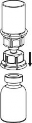Spis treści:
Ulotka dołączona do opakowania: informacja dla pacjenta
Berinin® P 1200, 1200 j.m.
Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań lub infuzji Ludzki IX czynnik krzepnięcia krwi
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki:
Co to jest lek Berinin P i w jakim celu się go stosuje
Informacje ważne przed zastosowaniem leku Berinin P Kiedy nie stosować leku Berinin P:
Jeśli pacjent ma uczulenie na ludzki IX czynnik krzepnięcia lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania Berinin P należy omówić to z lekarzem lub farmaceutą.
Nadwrażliwość
Podczas stosowania Berinin P możliwe jest wystąpienie reakcji nadwrażliwości typu alergicznego. W przypadku wystąpienia objawów nadwrażliwości, pacjent powinien natychmiast zaprzestać stosowania produktu i skontaktować się z lekarzem. Pacjenci powinni być poinformowani o wczesnych objawach reakcji nadwrażliwości, do których należy pokrzywka, uogólniona pokrzywka, ucisk w klatce piersiowej, świszczący oddech, spadek ciśnienia tętniczego krwi oraz anafilaksja. W przypadku wystąpienia wstrząsu należy zastosować odpowiednie postępowanie medyczne w terapii wstrząsu.
Inhibitory
Po wielokrotnym podawaniu produktów ludzkiego IX czynnika krzepnięcia, należy u pacjentów monitorować powstawanie przeciwciał neutralizujących (inhibitorów), które powinny być oznaczane w jednostkach Bethesda (BU, ang. Bethesda Units) za pomocą odpowiednich testów biologicznych.
W literaturze zgłaszano przypadki wskazujące na korelację pomiędzy pojawieniem się inhibitora czynnika IX, a wystąpieniem reakcji alergicznych. Z tego względu pacjentów, u których wystąpiły reakcje alergiczne należy kontrolować na obecność inhibitora. Należy
wziąć pod uwagę, iż u pacjentów, u których stwierdzono obecność inhibitorów czynnika IX może wystąpić zwiększone ryzyko reakcji anafilaktycznej po kolejnym podaniu czynnika IX.
Z powodu ryzyka wystąpienia reakcji alergicznych związanych z podawaniem koncentratu IX czynnika, rozpoczęcie jego podawania powinno zgodnie z oceną lekarza prowadzącego odbywać się pod kontrolą lekarską w warunkach, które umożliwiają zastosowanie odpowiedniego leczenia w przypadku pojawienia się reakcji alergicznych.
Choroba zakrzepowo-zatorowa
Ze względu na potencjalne ryzyko wystąpienia powikłań zakrzepowo-zatorowych, podając produkt pacjentom z chorobami wątroby, pacjentom po zabiegach chirurgicznych, noworodkom lub pacjentom z ryzykiem wystąpienia powikłań zakrzepowo-zatorowych lub DIC, należy rozpocząć odpowiednią obserwację kliniczną wystąpienia wczesnych objawów powikłań zakrzepowo-zatorowych i koagulopatii ze zużycia z zastosowaniem odpowiednich testów biologicznych. W każdej z tych sytuacji należy rozważyć korzyści płynące z terapii Berinin P wobec ryzyka wystąpienia wymienionych powikłań.
Zdarzenia sercowo-naczyniowe
U pacjentów, u których istnieją czynniki ryzyka wystąpienia zaburzeń sercowo-naczyniowych, terapia za pomocą czynnika IX może zwiększać to ryzyko.
Ryzyko występowania powikłań przy stosowaniu cewników
W przypadku konieczności użycia kaniuli do cewnikowania żył centralnych (ang. central venous access device, CVAD), należy rozważyć ryzyko związane z ich stosowaniem, takie jak miejscowe zakażenie, bakteriemia oraz zakrzepica w miejscu umieszczenia cewnika.
Bezpieczeństwo przeciwwirusowe
W przypadku leków wytwarzanych z ludzkiej krwi lub osocza, podejmowane są środki ostrożności mające na celu zapobieganie zakażeniu pacjentów. Należą do nich:
dokładny dobór dawców krwi i osocza, w celu zapewnienia, że dawcy obarczeni ryzykiem przeniesienia infekcji są wykluczeni,
badanie każdej donacji i pul osocza pod kątem obecności wirusów / zakażeń,
włączenie do procesu przetwarzania krwi lub osocza procedury, które mogą inaktywować lub usuwać wirusy.
Pomimo ich stosowania, przy podawaniu leków przygotowywanych z ludzkiej krwi lub osocza nie można całkowicie wykluczyć możliwości przeniesienia zakażenia. Dotyczy to również dotychczas nieznanych lub nowo poznanych wirusów i innych rodzajów zakażeń.
Zastosowane procedury są uznane za skuteczne wobec wirusów otoczkowych, takich jak wirus ludzkiego niedoboru odporności (HIV, wirus powodujący AIDS), wirus zapalenia wątroby typu B i wirus zapalenia wątroby typu C (stan zapalny wątroby) oraz wobec bezotoczkowego wirusa zapalenia wątroby typu A (stan zapalny wątroby).
Wobec wirusów bezotoczkowych, takich jak parwowirus B19 zastosowane procedury mogą mieć ograniczoną skuteczność.
Zakażenie parwowirusem B19 może być niebezpieczne dla kobiet w ciąży (ze względu na możliwość zakażenia płodu) oraz dla pacjentów z niedoborami odporności lub pewnymi rodzajami anemii (np. anemią sierpowatą lub hemolityczną).
Jeżeli pacjent regularnie/wielokrotnie przyjmuje produkty otrzymywane z ludzkiego osocza (np. czynnik IX), lekarz może zalecić szczepienie przeciw wirusowemu zapaleniu wątroby typu A i B.
Stanowczo zaleca się, aby przy każdym podaniu Berinin P odnotować nazwę i serię produktu, w celu umożliwienia prowadzenia dokumentacji dotyczącej użytych numerów serii produktu.
Dzieci i młodzież
Wymienione ostrzeżenia i środki ostrożności dotyczą zarówno dorosłych, jak i dzieci.
Lek Berinin P a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować.
Przypadki interakcji produktów ludzkiego IX czynnika krzepnięcia z innymi lekami nie są znane.
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, rozpuszczalnikami i rozcieńczalnikami, oprócz wymienionych w punkcie 6.
Ciąża, karmienie piersią i wpływ na płodność
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Nie przeprowadzono badań na zwierzętach dotyczących wpływu IX czynnika krzepnięcia krwi na płodność.
Ze względu na rzadkie występowanie hemofilii typu B u kobiet, dane dotyczące stosowania IX czynnika w czasie ciąży i podczas karmienia piersią nie są dostępne. Z tego względu produkty czynnika IX należy stosować w okresie ciąży i laktacji tylko w przypadkach uzasadnionych.
Dane dotyczące wpływu na płodność nie są dostępne.
Prowadzenie pojazdów i obsługiwanie maszyn
Berinin P nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn
Berinin zawiera sód i heparynę
Berinin P 1200 zawiera do 38,4 mg sodu na fiolkę. Należy wziąć to pod uwagę u pacjentów będących na kontrolowanej diecie niskosodowej.
Berinin P zawiera heparynę jako substancję pomocniczą. Może ona powodować reakcje alergiczne i obniżony poziom krwinek, przez co może wpływać na układ krzepnięcia krwi. Pacjenci, u których w wywiadzie występują reakcje alergiczne wywołane przez heparynę powinni unikać produktów leczniczych zawierających heparynę.
Jak stosować lek Berinin P
Roztwór powinien być przejrzysty lub lekko opalizujący, np. może połyskiwać, gdy jest obserwowany pod światło, ale nie może zawierać wyraźnych cząstek. Po przefiltrowaniu lub pobraniu (patrz poniżej), przed podaniem, produkt po rekonstytucji powinien być oceniony wizualnie w celu wykluczenia obecności cząsteczek i przebarwień. Nie używać roztworów mętnych lub zawierających pozostałości (osad/cząstki).
Proces rekonstytucji oraz pobierania produktu musi się odbywać w warunkach aseptycznych.
Możliwe działania niepożądane
Nagła reakcja alergiczna (taka jak pokrzywka, uogólniona pokrzywka),
Trudności w oddychaniu (ucisk w klatce piersiowej, świszczący oddech),
Spadek ciśnienia tętniczego krwi
Anafilaksja
Brak reakcji na leczenie (nieustające krwawienie).
Inne objawy niepożądane:
Nadwrażliwość lub reakcje alergiczne, do których zalicza się:
obrzęk naczynioruchowy
kłucie i pieczenie w miejscu infuzji
dreszcze
nagłe zaczerwienienie twarzy
uogólniona pokrzywka
ból głowy
pokrzywka
spadek ciśnienia tętniczego krwi,
uczucie zmęczenia (letarg)
nudności
niepokój
przyspieszenie bicia serca (tachykardia)
ucisk w klatce piersiowej
uczucie mrowienia
wymioty
świszczący oddech
Powyższe objawy obserwowano rzadko. W niektórych przypadkach wymienione objawy rozwijały się w ciężką anafilaksję (z wstrząsem włącznie) i były ściśle powiązane czasowo z powstawaniem inhibitorów IX czynnika
Zaobserwowano zespół nerczycowy po próbie indukcji tolerancji immunologicznej u pacjentów z hemofilią B z inhibitorami czynnika IX i reakcją alergiczną w wywiadzie.
Pacjenci z hemofilią typu B mogą wytwarzać przeciwciała neutralizujące (inhibitory) IX czynnika krzepnięcia. Jeżeli pojawią się tego typu inhibitory, stan taki będzie objawiał się niewystarczającą reakcją na leczenie. W takich przypadkach należy się skontaktować z wyspecjalizowanym ośrodkiem leczenia hemofilii.
Istnieje potencjalne ryzyko powikłań zakrzepowo-zatorowych po stosowaniu produktów zawierających IX czynnik, ze zwiększonym ryzykiem przy stosowaniu produktów niskooczyszczonych. Stosowanie produktów niskooczyszczonych IX czynnika jest związane z występowaniem zawału mięśnia sercowego, rozsianego wykrzepiania wewnątrznaczyniowego, zakrzepicy żylnej i zatorowości płucnej. Stosowanie produktów wysokooczyszczonych IX czynnika rzadko związane jest z takimi działaniami niepożądanymi.
Obserwowano występowanie gorączki.
Zgłaszano przypadki zmniejszenia wytwarzania płytek krwi związanego z podaniem heparyny (heparynozależnej trombocytopenii, HAT Typu II). Heparyna o działaniu hamującym na proces krzepnięcia krwi, stanowi składnik produktu Berinin P. U pacjentów, u których nadwrażliwość na heparynę dotychczas nie występowała, do spadku liczby płytek krwi dochodzi zazwyczaj po 6 do 14 dniach od rozpoczęcia leczenia. U pacjentów nadwrażliwych na heparynę do takiego spadku może dojść już w ciągu kilku godzin od jej podania. Do ciężkiej postaci trombocytopenii (obniżonej ilości płytek krwi) może dojść na skutek:
wzmożonego tworzenia zakrzepów krwi w tętnicach lub żyłach, (zakrzepy/zaburzenia zatorowo-zakrzepowo)
koagulopatii ze zużycia, której w niektórych przypadkach może towarzyszyć martwica skóry w miejscu iniekcji, wybroczyny, plamica i smolisty stolec
W takich przypadkach hamujące działanie heparyny na proces krzepnięcia może ulec zmniejszeniu (tolerancja heparyny).
U pacjentów, u których doszło do wystąpienia takich objawów podawanie produktu należy natychmiast przerwać i skontaktować się z lekarzem. W przyszłości nie wolno przyjmować żadnych leków zawierających heparynę.
Informacje dotyczące bezpieczeństwa przeciwwirusowego zawarte są w punkcie 2. Informacje ważne przed zastosowaniem leku Berinin P
Dodatkowe działania niepożądane u dzieci i młodzieży
Częstość, rodzaj i nasilenie reakcji niepożądanych u dzieci są porównywalne, jak u dorosłych
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak przechowywać lek Berinin P
Zawartość opakowania i inne informacje
Co to jest Berinin P
Berinin P składa się z proszku i rozpuszczalnika. Przygotowany roztwór służy do podawania dożylnego w postaci wstrzykiwań lub infuzji.
Berinin P jest wytwarzany z ludzkiego osocza (płynna część krwi) i zawiera ludzki IX czynnik krzepnięcia.
W jakim celu stosuje się Berinin P
Berinin P jest stosowany w leczeniu i profilaktyce krwawień u pacjentów z hemofilią B (wrodzony niedobór IX czynnika krzepnięcia).
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić się do lekarza.
Leczenie powinno być prowadzone pod nadzorem lekarza doświadczonego w leczeniu hemofilii.
Zalecana dawka
Dawkowanie oraz czas trwania leczenia zależą od kilku czynników, takich jak: stopień ciężkości niedoboru IX czynnika krzepnięcia krwi (nasilenie choroby), masa ciała, miejsce i intensywność krwawienia, konieczność zapobieżenia krwawieniu podczas zabiegu chirurgicznego lub badania.
Jeżeli zalecone zostało stosowanie leku Berinin P w domu, lekarz powinien poinformować pacjenta
o tym, w jaki sposób należy podawać lek i jaką jego dawkę stosować.
Należy dokładnie przestrzegać zaleceń otrzymanych od lekarza lub pielęgniarki z ośrodka leczenia hemofilii.
Zastosowanie większej niż zalecana dawki leku Berinin P
Nie odnotowano żadnych objawów przedawkowania ludzkiego IX czynnika krzepnięcia.
Rekonstytucja i sposób podawania
Informacje ogólne
Rekonstytucja:
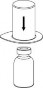
Doprowadzić rozpuszczalnik do temperatury pokojowej. Upewnić się, że nasadki z fiolek produktu leczniczego i rozpuszczalnika zostały usunięte, przetrzeć powierzchnię gumowych korków roztworem antyseptycznym i pozwolić by korki wyschły przed otwarciem opakowania Mix2Vial.
| 1. Otworzyć opakowanie zawierające Mix2Vial usuwając folię zabezpieczającą. Nie wyjmować Mix2Vial z opakowania blistrowego! |
| 2. Umieścić fiolkę z rozpuszczalnikiem na czystej i równej powierzchni i mocno przytrzymać. Nie wyjmując z opakowania blistrowego zestawu Mix2Vial nałożyć jego niebieską końcówkę z igłą na korek fiolki z rozpuszczalnikiem i naciskając pionowo w dół przebić korek fiolki z rozpuszczalnikiem. |
| 3. Przytrzymując krawędź zestawu Mix2Vial ostrożnie zdjąć opakowanie blistrowe pociągając go pionowo do góry. Należy zwrócić uwagę, aby zdjąć jedynie opakowanie blistrowe, a nie cały zestaw Mix2Vial. |
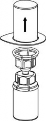
| 4. Umieścić fiolkę z produktem na czystej, równej i twardej powierzchni. Odwrócić do góry dnem fiolkę z rozpuszczalnikiem i dołączonym do niej zestawem Mix2Vial. Naciskając przezroczystą końcówkę z igłą pionowo w dół wbić w korek fiolki z proszkiem. Rozpuszczalnik samoczynnie zostanie przetransferowany do fiolki z proszkiem. |
| 5. Jedną ręką uchwycić fiolkę z produktem przyłączoną do zestawu Mix2Vial, drugą ręką uchwycić fiolkę po rozpuszczalniku także przyłączoną do zestawu Mix2Vial i ostrożnie rozkręcić zestaw na dwie części, przeciwnie do ruchu wskazówek zegara. Fiolkę po rozpuszczalniku wraz z niebieską końcówką zestawu Mix2Vial usunąć. |
6 | 6. Doprowadzić do pełnego rozpuszczenia produktu delikatnie poruszając ruchem obrotowym fiolkę z produktem z przyłączoną przezroczystą końcówką do zestawu Mix 2Vial. Nie wstrząsać. |
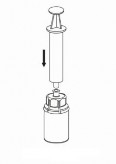
| 7. Nabrać powietrza do pustej, jałowej strzykawki. Trzymając fiolkę z produktem pionowo korkiem do góry, przyłączyć strzykawkę do połączenia Luer Lock zestawu Mix2Vial, przekręcając zgodnie z ruchem wskazówek zegara. Wstrzyknąć powietrze do fiolki z produktem. |
Pobieranie i podawanie:
| 8. Przytrzymując tłok strzykawki odwrócić fiolkę wraz ze strzykawką do góry dnem i nabrać roztwór do strzykawki, powoli odciągając tłok. |
| 9. Po napełnieniu strzykawki roztworem, mocno uchwycić cylinder strzykawki (utrzymując strzykawkę tłokiem do dołu) i odłączyć przezroczystą końcówkę zestawu Mix2Vial od strzykawki, przekręcając przeciwnie do ruchu wskazówek zegara. |
W celu wykonania wstrzyknięcia Berinin P należy używać plastikowych jednorazowych strzykawek, ponieważ roztwory tego typu mają tendencję do przylegania do powierzchni strzykawek wykonanych ze szkła.
Produkt po rekonstytucji, przed podaniem należy ogrzać do temperatury pokojowej lub temperatury ciała. Należy podawać powoli dożylnie w iniekcji lub infuzji, z szybkością komfortową dla pacjenta. Zwrócić uwagę, aby krew nie dostała się do strzykawki wypełnionej produktem. Szybkość iniekcji lub infuzji nie powinna przekraczać 2 ml na minutę.
Należy zwrócić uwagę na wystąpienie jakiejkolwiek natychmiastowej reakcji. W przypadku jakiejkolwiek reakcji mogącej mieć związek z podaniem produktu Berinin P, należy zmniejszyć szybkość infuzji lub ją wstrzymać, w zależności od stanu klinicznego pacjenta (patrz również punkt 2).
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się do lekarza lub farmaceuty.
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Jeżeli wystąpi którykolwiek z następujących objawów, należy natychmiast zaprzestać stosowania produktu leczniczego i powiadomić lekarza:
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie i pudełku. Nie przechowywać w temperaturze powyżej 25oC.
Nie zamrażać.
Przechowywać fiolki w opakowaniu zewnętrznym w celu ochrony przed światłem.
Po rekonstytucji stabilność fizykochemiczna utrzymuje się przez 16 godzin w temperaturze niższej lub równej 25oC . Z mikrobiologicznego punktu widzenia oraz z powodu, że Berinin P nie zawiera środków konserwujących, lek po rekonstytucji powinien być natychmiast wykorzystany. Jeżeli lek nie zostanie podany natychmiast, okres jego przechowywania nie powinien przekraczać 8 godzin w temperaturze niższej lub równej 25oC
Co zawiera lek Berinin P
1 fiolka Berinin P zawiera 1200 j.m. ludzkiego IX czynnika krzepnięcia krwi.
Produkt po rekonstytucji w 10 ml wody do wstrzykiwań zawiera około 120 j.m./ml ludzkiego IX czynnika krzepnięcia.
Aktywność produktu (j.m) jest określana przy użyciu jednostopniowego testu krzepnięcia zgodnego z Farmakopeą Europejską.
Aktywność swoista Berinin P osiąga minimum 50 j.m. IX czynnika na mg białka całkowitego.
Pozostałe składniki to:
Glicyna, antytrombina III, heparyna, wapnia chlorek, sodu chlorek, sodu cytrynian, kwas solny lub sodu wodorotlenek (w małych ilościach do ustalenia pH).
Rozpuszczalnik: woda do wstrzykiwań 10 ml
Jak wygląda lek Berinin P i co zawiera opakowanie
Berinin P ma postać białego proszku z dołączonym przezroczystym, bezbarwnym rozpuszczalnikiem (wodą do wstrzykiwań) do sporządzania roztworu do wstrzykiwań / infuzji.
Dostępne opakowania
1 fiolka z proszkiem
1 fiolka z wodą do wstrzykiwań po 10 ml 1 system transferowy z filtrem 20/20
Podmiot odpowiedzialny i wytwórca
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg Niemcy
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do przedstawiciela podmiotu odpowiedzialnego:
CSL Behring sp. z o.o.
Ul. Branickiego 17
02-972 Warszawa
Tel: 22 213 22 65
Data ostatniej aktualizacji ulotki:
-----------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Monitorowanie leczenia
Podczas leczenia zaleca się właściwe oznaczanie poziomu IX czynnika, w celu ustalenia wielkości podawanej dawki oraz częstotliwości powtarzania wlewów. U poszczególnych pacjentów mogą wystąpić różnice w odpowiedzi na podanie IX czynnika krzepnięcia, co odzwierciedlają różnice w okresie półtrwania oraz odzysku. Dawka ustalana na podstawie masy ciała może wymagać dostosowania u pacjentów z niedowagą lub nadwagą. Podczas dużych zabiegów chirurgicznych niezbędne jest precyzyjne monitorowanie terapii substytucyjnej poprzez kontrolę procesu krzepnięcia (poziomu aktywności IX czynnika krzepnięcia w osoczu).
Dawkowanie
Liczba jednostek podawanego IX czynnika krzepnięcia krwi jest wyrażona w jednostkach międzynarodowych (j.m.), które odnoszą się do aktualnych standardów WHO dla produktów
IX czynnika krzepnięcia. Aktywność IX czynnika krzepnięcia w osoczu jest wyrażana w procentach (w odniesieniu do normalnego osocza ludzkiego) lub w jednostkach międzynarodowych (w odniesieniu do międzynarodowych standardów zawartości IX czynnika krzepnięcia krwi w osoczu).
Jedna jednostka międzynarodowa (j.m.) aktywności IX czynnika jest równa ilości IX czynnika krzepnięcia zawartego w jednym ml normalnego osocza ludzkiego.
Leczenie na żądanie
Obliczenie wymaganej dawki czynnika IX opiera się na doświadczeniach empirycznych dowodzących, że l jednostka międzynarodowa (j.m.) czynnika IX na kg masy ciała podwyższa aktywność osoczowego czynnika IX o 1, 0% normalnej aktywności.
Wymagana dawka jest obliczana przy użyciu następującego wzoru:
Wymagana liczba jednostek = masa ciała [kg] x pożądany wzrost aktywności czynnika IX [% lub j.m./dl] x 1,0
Podawana dawka produktu, częstotliwość oraz czas trwania jego podawania powinny zawsze być indywidualnie dobrane w zależności od efektywności klinicznej u poszczególnych pacjentów.
W razie wystąpienia następujących przypadków krwawień, aktywność czynnika IX nie powinna zmniejszać się poniżej podanych poziomów aktywności w osoczu (w % normy lub j.m./dl) w danym okresie czasu. Schemat podany w poniższej tabeli może być stosowany w doborze dawkowania
w przypadkach krwawienia i zabiegów chirurgicznych:
Nasilenie krwawienia / rodzaj | Wymagany poziom czynnika | Częstotliwość dawkowania |
zabiegu chirurgicznego | IX (% lub j.m./dl) | (godziny)/czas trwania leczenia |
(dni) | ||
Krwotok | ||
Wczesne krwawienie do stawów, mięśni lub z jamy ustnej | 20-40 | Powtarzać infuzje, co 24 godziny. Co najmniej |
przez 1 dobę, aż do | ||
ustąpienia bólu | ||
spowodowanego przez | ||
krwawienie lub zagojenia | ||
rany. | ||
Bardziej nasilone krwawienie | 30-60 | Powtarzać infuzję, co 24 |
do stawów, mięśni lub krwiak | godziny przez 3-4 dni lub | |
dłużej aż do ustania bólu i | ||
powrotu sprawności. | ||
Krwawienia zagrażające | 60-100 | Powtarzać infuzję, co 8 do 24 |
życiu | godzin aż do ustąpienia | |
zagrożenia. | ||
Zabiegi chirurgiczne | ||
Małe włącznie z ekstrakcją | 30-60 | Co 24 godziny, co najmniej |
zęba | przez 1 dzień, aż do zagojenia | |
rany. | ||
Duże | 80-100 | Powtarzać infuzję, co 8 do 24 |
(przed- i pooperacyjne) | godzin aż do zagojenia się | |
rany, następnie kontynuować | ||
terapię, przez co najmniej 7 kolejnych dni w celu utrzymania aktywności czynnika IX na poziomie 30% do 60% (j.m./dl) | ||
Profilaktyka
W długotrwałej profilaktyce krwawień u pacjentów z ciężką hemofilią typu B, zwykle podawane są dawki czynnika IX wynoszące 20 do 40 j.m. na kg masy ciała w odstępach od 3 do 4 dni. U niektórych, zwłaszcza młodszych pacjentów, może być konieczne podanie produktu w krótszych odstępach czasu lub w większych dawkach.
Pacjenci powinni być monitorowani ze względu na możliwość pojawienia się inhibitorów IX czynnika krzepnięcia, patrz też punkt 2. Informacje ważne przed zastosowaniem leku Berinin P
Dzieci i młodzież
Nie istnieją dane z badań klinicznych pozwalające określić dawkowanie Berinin P u dzieci.