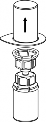Spis treści:
Ulotka dla Pacjenta
Beriplex P/N 500
Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Protrombiny ludzkiej zespół
Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać
Należy zwrócić się do lekarza lub farmaceuty w razie jakichkolwiek dalszych wątpliwości
Lek ten został przepisany ściśle określonej osobie. Nie należy go przekazywać innym.
Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie możliwe objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki:
Co to jest lek Beriplex P/N 500 i w jakim celu się go stosuje
Informacje ważne przed zastosowaniem leku Beriplex P/N 500
jeśli pacjent ma uczulenie na substancje czynne lub którykolwiek z pozostałych składników tego leku (wymienione w punkcie 6).
Należy poinformować lekarza o występowaniu alergii na jakiekolwiek leki lub pokarmy.
jeżeli występuje zwiększone ryzyko tworzenia się skrzeplin (pacjenci z grup ryzyka rozsianego wykrzepiania wewnątrznaczyniowego)
w przypadku występowania reakcji alergicznej na heparynę, powodującej obniżenie liczby płytek krwi (małopłytkowość zależna od heparyny typu II, HIT typ II).
Należy poinformować lekarza lub farmaceutę w przypadku występowania takiej choroby.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Beriplex należy omówić to z lekarzem lub farmaceutą.
W przypadku nabytego niedoboru zależnych od witaminy K czynników krzepnięcia. Może on być spowodowany przyjmowaniem leków blokujących działanie witaminy K. Beriplex P/N 500 może być stosowany tylko w razie konieczności szybkiego wyrównania poziomu czynników krzepnięcia kompleksu protrombiny, np. w przypadku dużych krwawień lub nagłych zabiegów chirurgicznych.
W przypadku występowania wrodzonego niedoboru któregokolwiek z zależnych od witaminy K czynników krzepnięcia należy, o ile to możliwe, stosować lek zawierający swoisty czynnik krzepnięcia.
W przypadku wystąpienia reakcji alergicznej lub anafilaktycznej (poważna reakcja alergiczna powodująca ciężkie zaburzenia oddychania lub zawroty głowy):
Podawanie leku Beriplex P/N 500 należy natychmiast zatrzymać (np. zaprzestać wstrzyknięcia).
Jeżeli istnieje ryzyko zwiększonego tworzenia się skrzeplin w naczyniach krwionośnych (zakrzepica), w szczególności w następujących przypadkach:
u pacjentów po ataku serca (z rozpoznaną chorobą wieńcową lub zawałem mięśnia sercowego)
u pacjentów z chorobami wątroby
u pacjentów bezpośrednio przed i po zabiegach operacyjnych
u noworodków
u pacjentów z podwyższonym ryzykiem powstawania skrzeplin (pacjenci z ryzykiem choroby zakrzepowo-zatorowej lub rozsianego wykrzepiania wewnątrznaczyniowego, lub samoistnym niedoborem inhibitorów krzepnięcia)
Jeżeli występuje podwyższone ryzyko wystąpienia zaburzeń krzepnięcia spowodowanych zwiększonym zużyciem płytek krwi lub czynników krzepnięcia. Leczenie lekiem Beriplex P/N 500 może być rozpoczęte po zakończeniu leczenia choroby podstawowej.
Zmniejszenie produkcji płytek krwi indukowane heparyną (małopłytkowość zależna od heparyny, HIT typ II). Heparyna, białko, którego efektem działania jest rozpuszczenie skrzepu krwi, jest składnikiem leku Beriplex. Znaczne obniżenie liczby płytek krwi może być związane z:
tworzeniem się skrzeplin w naczyniach żylnych kończyn dolnych,
zwiększeniem tendencji do powstawania skrzeplin,
w niektórych przypadkach z wysypką skórną w miejscu wstrzyknięcia,
wybroczynami oraz
pojawieniem się smolistego stolca.
W takich przypadkach działanie heparyny może być upośledzone (tolerancja heparyny). W przypadku wystąpienia tych objawów, należy natychmiast przerwać podawanie leku i skontaktować się z lekarzem. W przyszłości nie należy przyjmować leków zawierających heparynę.
Szczególna postać zapalenia nerek została zgłoszona po leczeniu pacjentów cierpiących na hemofilię B z inhibitorami czynnika IX. U tych pacjentów występowały reakcje alergiczne w wywiadzie.
Lekarz powinien rozważyć korzyści płynące z terapii Beriplex P/N 500 wobec ryzyka wystąpienia wymienionych powikłań.
Bezpieczeństwo przeciwwirusowe
W przypadku, kiedy leki otrzymywane są z ludzkiej krwi lub ludzkiego osocza, stosowane są różne metody mające na celu zapobieżenie przenoszenia czynników zakaźnych do pacjenta. Należą do nich:
właściwy dobór dawców krwi i osocza tak, aby wykluczyć możliwość przeniesienia czynników zakaźnych,
badanie indywidualnych dawców oraz puli osocza na obecność wirusów oraz innych zakażeń,
włączenie w procesie wytwarzania etapów mających na celu inaktywacje lub usunięcie wirusów.
Pomimo stosowania tych zabezpieczeń, przy zastosowaniu leków otrzymywanych z ludzkiej krwi lub osocza nie można całkowicie wykluczyć ryzyka wystąpienia chorób zakaźnych z powodu możliwości przeniesienia czynników zakaźnych. Odnosi się to również do nieznanych dotychczas patogenów
i innych rodzajów zakażeń.
Stosowane metody uważane są za skuteczne wobec takich wirusów otoczkowych jak wirus ludzkiego niedoboru odporności (HIV, wirus powodujący AIDS), wirus zapalenia wątroby typu B, wirus zapalenia wątroby typu C (wirusowe zapalenie wątroby) oraz bezotoczkowego wirusa zapalenia wątroby typu A (wirusowe zapalenie wątroby) i parwowirus B19.
Lekarz może zalecić odpowiednie szczepienie przeciw wirusowemu zapaleniu wątroby typu A i B, jeżeli regularnie/wielokrotnie przyjmowane są leki otrzymywane z ludzkiego osocza.
Zdecydowanie zalecane jest przy każdym podaniu leku Beriplex P/N 500 odnotowanie
w dokumentacji medycznej nazwy i serii leku w celu udokumentowania użytych serii leku.
Beriplex P/N 500 a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych obecnie lub ostatnio a także o lekach, które pacjent planuje przyjmować.
Beriplex P/N 500 może hamować działanie antagonistów witaminy K. Interakcje z innymi lekami nie są znane.
Leku Beriplex P/N 500 nie należy mieszać z innymi lekami, z wyjątkiem tych wymienionych w punkcie 6.
Ciąża, karmienie piersią i wpływ na płodność
W ciąży i w okresie karmienia piersią lub gdy istnieje podejrzenie, że kobieta jest w ciąży, lub gdy planuje ciążę, przed zastosowaniem tego leku należy poradzić się lekarza lub farmaceuty.
U kobiet w okresie ciąży lub karmienia piersią lek Beriplex P/N 500 należy stosować tylko w uzasadnionych przypadkach.
Brak dostępnych danych dotyczących wpływu na płodność.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie ma odpowiednich badań dokumentujących wpływ stosowania leku na prowadzenie pojazdów
i obsługiwanie maszyn.
Beriplex P/N 500 zawiera sód
Beriplex P/N 500 zawiera do 343mg sodu (około 15 milimoli) w 100 ml. Ilość tę należy uwzględnić w przypadku pacjentów będących na kontrolowanej diecie sodowej.
Jak stosować lek Beriplex P/N 500
Możliwe działania niepożądane
Ryzyko nasilenia procesu tworzenia się skrzeplin (patrz punkt 2)
Ból głowy
Wzrost temperatury ciała
Następujące działania niepożądane były obserwowane niezbyt często (u mniej niż 1 na 100 pacjentów):
Nadwrażliwość lub reakcje alergiczne (patrz punkt 2)
Częstość występowania następujących działań niepożądanych jest nieznana (nie może być określona na podstawie dostępnych danych):
Ciężkie krwawienia będące wynikiem nadmiernego wykrzepiania
Reakcje anafilaktyczne ze wstrząsem włącznie (patrz punkt 2)
Tworzenie krążących przeciwciał hamujących jeden lub więcej czynników krzepnięcia
Dzieci i młodzież
Brak danych dotyczących stosowania leku Beriplex u dzieci i młodzieży.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie . Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
tel.: +48 22 49 21 301
fax.: +48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak przechowywać lek Beriplex P/N 500
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować leku Beriplex P/N 500 po upływie terminu ważności zamieszczonego na etykiecie i pudełku.
Nie przechowywać w temperaturze powyżej 25oC.
Nie zamrażać.
Fiolkę przechowywać w opakowaniu zewnętrznym w celu ochrony przed światłem.
Beriplex P/N 500 nie zawiera środków konserwujących, rozpuszczony produkt należy zużyć natychmiast.
Zawartość opakowania i inne informacje Co zawiera Beriplex P/N 500
Co to jest Beriplex P/N 500
Beriplex P/N 500 jest dostępny jako proszek wraz z dołączonym rozpuszczalnikiem. Jest to biały lub lekko zabarwiony proszek lub krucha zestalona masa. Sporządzony roztwór przeznaczony jest do wstrzykiwań dożylnych.
Beriplex P/N 500 jest wytwarzany z osocza ludzkiego (płynna część krwi) i zawiera ludzkie czynniki krzepnięcia II, VII, IX i X. Koncentraty zawierające wyżej wymienione czynniki krzepnięcia są nazywane produktami zespołu protrombiny. Zależne od witaminy K - II, VII, IX i X czynniki krzepnięcia odgrywają ważną rolę w procesie krzepnięcia (koagulacji). Niedobór któregokolwiek
z wymienionych czynników krzepnięcia powoduje, że krew nie krzepnie tak szybko, jak powinna i ryzyko krwawienia jest większe. Uzupełnienie II, VII, IX i X czynnika krzepnięcia poprzez zastosowanie leku Beriplex P/N 500 doprowadzi do naprawienia mechanizmu krzepnięcia.
W jakim celu stosuje się Beriplex P/N 500
Beriplex P/N 500 jest używany w celu zapobiegania (podczas zabiegów chirurgicznych) i leczenia krwawień spowodowanych nabytym lub wrodzonym niedoborem we krwi zależnych od witaminy K czynników krzepnięcia II, VII, IX i X, kiedy lek zawierający oczyszczony, swoisty czynnik krzepnięcia nie jest dostępny.
W poniższym punkcie zawarte są informacje, z którymi pacjent i lekarz powinni zapoznać się przed zastosowaniem leku Beriplex P/N 500.
Kiedy NIE stosować leku Beriplex P/N 500 :
Leczenie powinno być rozpoczęte pod nadzorem lekarza doświadczonego w terapii tego rodzaju zaburzeń.
Dawkowanie
Zalecana dawka czynników II, VII, IX i X oraz czas trwania terapii zależy od kilku czynników, takich jak masa ciała, stopień zaawansowania i przebieg choroby, umiejscowienie i intensywność krwawienia oraz konieczność zapobiegnięcia krwawieniom podczas operacji lub prowadzenia diagnostyki chorego (patrz punkt. „Informacje przeznaczone wyłącznie dla fachowego personelu medycznego”).
W przypadku jakichkolwiek wątpliwości dotyczących stosowania leku, należy skontaktować się
z lekarzem lub farmaceutą.
Przedawkowanie
W czasie leczenia lekarz powinien regularnie kontrolować poziom parametrów krzepnięcia.
Podawanie dużych dawek koncentratu czynników krzepnięcia zespołu protrombiny miało związek
z wystąpieniem zawału serca, rozwojem rozsianego krzepnięcia śródnaczyniowego oraz tworzeniem się skrzeplin w naczyniach krwionośnych u pacjentów z grupy podwyższonego ryzyka występowania tych zaburzeń.
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią. Następujące działania niepożądane były obserwowane często (u mniej niż 1 na 10 pacjentów):
Beriplex P/N 500 zawiera 400-620 j.m. ludzkiego IX czynnika krzepnięcia krwi w fiolce.
Substancją czynną leku jest:
Koncentrat ludzkich czynników krzepnięcia II, VII, IX i X, białka C i S.
Pozostałe składniki to:
Ludzka antytrombina III, heparyna, albumina ludzka, sodu chlorek, sodu cytrynian, HCl lub NaOH (w niewielkich ilościach, do ustalenia pH).
Rozpuszczalnik: Woda do wstrzykiwań.
Jak wygląda lek Beriplex P/N 500 i co zawiera opakowanie
Beriplex P/N 500 jest białym lub lekko zabarwionym proszkiem i jest dostarczany wraz z dołączoną wodą do wstrzykiwań jako rozpuszczalnikiem. Proszek powinien być rozpuszczony w 20 ml wody do wstrzykiwań.
Sporządzony roztwór powinien być przezroczysty lub lekko opalizujący, co oznacza, że może połyskiwać oglądany pod światło, nie powinien zawierać żadnych stałych cząstek.
Dostępne opakowania
Opakowanie z lekiem w dawce 500 j.m. zawiera:
1 fiolkę z proszkiem
1 fiolkę z wodą do wstrzykiwań po 20 ml
1 system transferowy 20/20 z filtrem
Nazwa i adres podmiotu odpowiedzialnego oraz nazwa i adres wytwórcy:
CSL Behring GmbH Emil-von-Behring-Str. 76
35041 Marburg Niemcy
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru Gospodarczego pod następującymi nazwami
Austria
Beriplex P/N 500 I.E. Pulver und Lösungsmittel zur Herstellung einer
Injektionslösung
Belgia
Confidex 500 I.E., poeder en oplosmiddel voor oplossing voor injectie
Bułgaria Chorwacja
Czechy Dania
Beriplex P/N 500, 500 IU, Powder and solvent for solution for injection Beriplex P/N 500 IU prašak i otapalo za otopinu za injekciju
Beriplex 500 IU Confidex
Finlandia
Confidex 500 IU injektiokuiva-aine ja liuotin, liuosta varten
Francja
Confidex 500 UI, poudre et solvant pour solution injectable
Niemcy
Beriplex P/N 500
Grecja
Beriplex P/N
Κόνις και διαλύτης για ενέσιμο διάλυμα 500 IU/vial
Węgry
Irlandia
Beriplex P/N 500 por és oldószer oldatos injekcióhoz
Beriplex P/N 500 IU, powder and solvent for solution for injection
Włochy
Confidex 500
Luxemburg
Confidex 500 UI poudre et solvant pour solution injectable
Malta Holandia
Beriplex P/N 500, powder and solvent for solution for injection
Beriplex P/N 500 IE, poeder en oplosmiddel voor oplossing voor injectie
Norwegia
Polska
Confidex 500 IU pulver og væske til injeksjonsvæske, oppløsning
Beriplex P/N 500
Portugalia
Beriplex 500 UI pó e solvente para solução injectável
Rumunia Słowacja Słowenia Hiszpania
Beriplex P/N 500 UI pulbere și solvent pentru soluție injectabilă Beriplex 500 IU
Beriplex P/N 500 i.e. prašek in vehikel za raztopino za injiciranje
Beriplex 500 UI polvo y disolvente para solución inyectable
Szwecja
Confidex 500 IE, pulver och vätska till injektionsvätska, lösning
Wielka Brytania
Beriplex P/N 500 IU, powder and solvent for solution for injection
Data sporządzenia ulotki:
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego Skład ilościowy i jakościowy
Beriplex P/N 500 nominalnie zawiera następujące ilości j.m. ludzkich czynników krzepnięcia podane w tabeli poniżej:
Nazwa składnika
Zawartość po rekonstytucji (j.m./ml)
Zawartość w jednej fiolce Beriplex P/N 500 (j.m.)
Substancje czynne
Ludzki II czynnik krzepnięcia krwi
20 - 48
400 – 960
Ludzki VII czynnik krzepnięcia
krwi
10 – 25
200 -500
Ludzki IX czynnik krzepnięcia krwi
20 - 31
400 – 620
Ludzki X czynnik krzepnięcia
krwi
22 – 60
440 – 1200
Pozostałe substancje czynne
Białko C
15 – 45
300 – 900
Białko S
12 – 38
240 – 760
Zawartość białka całkowitego po rekonstytucji wynosi 6-14 mg/ml w roztworze. Aktywność swoista czynnika IX wynosi 2,5 j.m. na mg białka całkowitego.
Aktywność wszystkich czynników krzepnięcia jak również białka C i S (antygeny) była badana zgodnie z aktualnymi międzynarodowymi standardami WHO.
Dawkowanie i sposób podania
Dawkowanie
Poniżej podano tylko ogólne zasady dawkowania.
Wielkość dawki oraz częstość jej podawania powinny być obliczone dla każdego pacjenta indywidualnie. Odstępy między dawkami powinny być dostosowane do wartości okresu półtrwania poszczególnych czynników krzepnięcia należących do zespołu protrombiny. Dawkę indywidualną określa się w oparciu o regularne oznaczanie aktywności w osoczu poszczególnych czynników krzepnięcia, lub na podstawie wyników badań laboratoryjnych ogólnie określających działanie zespołu protrombiny (INR, wskaźnik Quicka) oraz poprzez ciągłe monitorowanie stanu klinicznego pacjenta.
W przypadku większych interwencji chirurgicznych konieczne jest dokładne monitorowanie leczenia substytucyjnego (testy dla poszczególnych czynników krzepnięcia jak i ogólne dla czynników krzepnięcia zespołu protrombiny).
Krwawienia i profilaktyka okołooperacyjna krwawień podczas leczenia antagonistami witaminy K::
Dawka leku zależy od wartości wskaźnika INR oznaczonego przed rozpoczęciem leczenia oraz od wartości wskaźnika INR, którą pacjent ma uzyskać. Wskaźnik INR przed leczeniem powinien być mierzony w najkrótszym możliwym czasie przed podaniem leku, aby umożliwić obliczenie odpowiedniej dawki produktu leczniczego Beriplex. Poniższa tabela określa przybliżone dawki (ml/kg masy ciała rekonstytuowanego produktu oraz j.m. czynnika IX/kg masy ciała), tak, aby uzyskać normalizację wskaźnika INR (tj.INR≤1.3) przy różnych wyjściowych wartościach wskaźnika INR.
Wartość INR przed leczeniem
2,0 – 3,.9
4,0 – 6,.0
>6,0
Przybliżona dawka w ml/kg masy ciała
1
1.4
2
Przybliżona dawka w j.m. (czynnik IX) na kilogram masy ciała
25
35
50
Dawkowanie jest ustalane w oparciu o masę ciała, gdy nie przekracza ona 100 kg. W przypadku pacjentów o masie ciała powyżej 100 kg maksymalna pojedyncza dawka (j.m. czynnika IX) nie powinna przekraczać 2500 j.m. dla wartości wskaźnika INR 2,0 -3,9; 3500 j.m. dla wartości wskaźnika INR 4,0 – 6,0 oraz 5000 j.m. dla wartości wskaźnika INR >6,0.
Normalizacja zaburzeń hemostazy spowodowanych stosowaniem antagonistów witaminy K jest zwykle osiągana po około 30 minutach po wstrzyknięciu .Równoczesne podawanie witaminy K powinno być rozważone u pacjentów otrzymujących Beriplex w celu pilnego odwrócenia działania antagonistów witaminy K, gdyż zazwyczaj efekt działania witaminy K jest osiągany po 4-6 godzinach.
Powtarzane dawkowanie Beriplexu u pacjentów wymagających pilnego odwrócenia działania antagonistów witaminy K nie jest wsparte badaniami klinicznymi i w związku z tym nie jest zalecane.
Zalecenia te podano w oparciu o badania kliniczne na ograniczonej liczbie osobników. Konieczne jest monitorowanie wartość wskaźnika INR podczas leczenia ponieważ skuteczność i czas działania mogą się różnić u poszczególnych pacjentów.
Krwawienia i profilaktyka okołooperacyjna u pacjentów we wrodzonych niedoborach któregokolwiek czynnika krzepnięcia zależnego od witaminy K, kiedy zastosowanie preparatu swoistego czynnika krzepnięcia nie jest możliwe
Wyliczenie wymaganej dawki koncentratu czynników krzepnięcia zespołu protrombiny ustalone w oparciu o badania kliniczne:
1 j.m. czynnika IX na kg masy ciała powoduje spodziewany wzrostu aktywności czynnika IX w osoczu o 1,3% (0,013 j.m./ml) w stosunku do normy,
1 j.m. czynnika VII na kg masy ciała powoduje wzrost aktywności czynnika VII w osoczu o 1,7% w stosunku do normy (0,017 j.m./ml),
1 j.m. czynnika II na kg masy ciała zwiększa aktywność czynnika II w osoczu o 1,9% w stosunku do normy (0,019 j.m./ml),
1 j.m. czynnika X na kg masy ciała zwiększa aktywność czynnika X w osoczu o 1,9% w stosunku do normy (0,019 j.m./ml).
Dawka poszczególnego czynnika krzepnięcia wyrażana jest w jednostkach międzynarodowych (j.m.), zgodnych z obowiązującym standardem dla każdego czynnika krzepnięcia zatwierdzonym przez Światową Organizację Zdrowia (WHO). Aktywność czynnika krzepnięcia w osoczu jest wyrażana procentowo (w stosunku do prawidłowego osocza ludzkiego) lub
w jednostkach międzynarodowych (zgodnie z międzynarodowym standardem dla konkretnego czynnika krzepnięcia w osoczu).
Jedna jednostka międzynarodowa (j.m.) aktywności czynnika krzepnięcia jest równa aktywności tego czynnika zawartego w 1 ml prawidłowego osocza ludzkiego.
Na przykład, obliczenie wymaganej dawki czynnika X opiera się na empirycznym stwierdzeniu, że 1 j.m. czynnika X na kg masy ciała zwiększa aktywność osoczowego czynnika X o 0,019 j.m./ml.
Wymagane dawkowanie obliczane jest przy użyciu następującego wzoru:
Wymagana liczba jednostek = masa ciała [kg] x pożądany wzrost aktywności czynnika X [j.m./ml] x 53,
gdzie 53 (ml/kg) jest odwrotnością szacowanej wartości odzysku.
Należy zauważyć, że obliczenia te są oparte na danych dotyczących pacjentów otrzymujących antagonistów witaminy K. Obliczenia oparte na danych dotyczących zdrowych osób dostarczyłyby niższej wartości wymaganej dawki.
Jeśli indywidualna wartość odzysku jest znana powinna być używana do obliczeń.
Dane dotyczące produktu są dostępne na podstawie badań klinicznych prowadzonych na zdrowych ochotnikach (N=15), w odwróceniu działania antagonistów witaminy K w leczeniu ostrych dużych krwawień lub profilaktyki krwawień okołooperacyjnych. (N=98, N=43)
Dzieci i młodzież
Bezpieczeństwo i skuteczność produktu leczniczego Beriplex P/N 500 u dzieci i młodzieży nie została do tej pory ustalona w kontrolowanych badaniach klinicznych.
Osoby starsze
Dawkowanie i sposób podawania u ludzi starszych (> 65 roku życia) są zgodne z ogólnymi
zaleceniami.
Sposób podawania
Instrukcje ogólne
Roztwór powinien być przezroczysty lub lekko opalizujący. Po przefiltrowaniu oraz pobraniu roztworu po rekonstytucji (patrz niżej), przed jego podaniem należy sprawdzić, czy nie zawiera on widocznych gołym okiem cząstek lub odbarwień. Nie należy stosować roztworów mętnych lub zawierających osad lub cząstki.
Rekonstytucję i pobieranie z fiolki należy przeprowadzić w warunkach aseptycznych.
Rekonstytucja
Doprowadzić rozpuszczalnik do temperatury pokojowej.
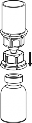

Upewnić się, czy wieczka fiolek z proszkiem i z rozpuszczalnikiem są usunięte, przetrzeć gumowe korki płynem aseptycznym oraz pozwolić by korki wyschły przed otwarciem opakowania Mix2Vial.
| 1. Otworzyć opakowanie zawierające Mix2Vial usuwając folię zabezpieczającą. Nie wyjmować Mix2Vial z blistra. |
2 | 2. Umieścić fiolkę z rozpuszczalnikiem na czystej i równej powierzchni i mocno przytrzymać. Nie wyjmując z blistra systemu Mix2Vial nałożyć jego niebieską końcówkę z igłą na korek fiolki rozpuszczalnika i naciskając pionowo w dół przebić korek fiolki rozpuszczalnika. |
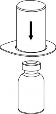
| 3. Przytrzymując krawędź systemu Mix2Vial ostrożnie zdjąć blister pociągając go pionowo do góry. Należy zwrócić uwagę aby zdjąć jedynie blister a nie cały zestaw Mix2Vial. |
4 | 4. Przytrzymując mocno fiolkę z produktem leczniczym na czystej i gładkiej powierzchni odwrócić fiolkę z rozpuszczalnikiem z systemem Mix2Vial i założyć przezroczystą część łącznika na korek fiolki z produktem. Naciskając pionowo w dół przebić korek fiolki z produktem. Rozpuszczalnik samoczynnie zostanie przeniesiony do fiolki z produktem leczniczym. |
5 | 5. Jedną ręką uchwycić fiolkę z produktem leczniczym przyłączoną do systemu Mix2Vial, drugą ręką uchwycić fiolkę z rozpuszczalnikiem także przyłączoną do systemu Mix2Vial i ruchem przeciwnym do wskazówek zegara ostrożnie rozkręcić zestaw na dwie części. Fiolkę po rozpuszczalniku wraz z niebieską końcówką systemu Mix2Vial usunąć. |
6 | 6. Doprowadzić do pełnego rozpuszczenia produktu delikatnie poruszając ruchem obrotowym fiolkę z produktem z przyłączoną przezroczystą końcówką systemu Mix 2Vial. Nie wstrząsać. |
7 | 7. Nabrać powietrza do pustej jałowej strzykawki. Trzymając fiolkę z produktem leczniczym pionowo korkiem do góry, przyłączyć strzykawkę do połączenia Luer Lock systemu Mix2Vial zgodnie z ruchem wskazówek zegara. Wstrzyknąć powietrze do fiolki z produktem. |

Pobieranie i podawanie
8 | 8. Przytrzymując tłok strzykawki odwrócić fiolkę wraz ze strzykawką do góry dnem i nabrać roztwór do strzykawki, powoli odciągając tłok. |
9 | 9. Po napełnieniu strzykawki roztworem, mocno uchwycić cylinder strzykawki (utrzymując strzykawkę tłokiem do dołu) i odłączyć system Mix2Vial od strzykawki ruchem przeciwnym do ruchu wskazówek zegara. |
Należy uważać, aby krew nie dostała się do strzykawki wypełnionej produktem. Może to spowodować reakcję czynników krzepnięcia znajdujących się w produkcie i powstania skrzepów fibryny, które mogą być podane pacjentowi.
W przypadku jeżeli wymagane jest podanie więcej niż jednej fiolki produktu Beriplex, istnieje możliwość połączenia kilku fiolek w celu podania jako pojedynczej infuzji przez dostępny na rynku zestaw do podawania.
Roztworu produktu leczniczego Beriplex nie wolno rozcieńczać.
Roztwór po rekonstytucji powinien być podany dożylnie (nie szybciej niż 8 ml/min*).
Wszelkie niewykorzystanego resztki produktu leczniczego lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania.
Nie ma dostępnych danych klinicznych dotyczących stosowania leku Beriplex P/N 500 w przypadku krwawień okołoporodowych z powodu niedoboru witaminy K u noworodków.
*W badaniach klinicznych Beriplexu pacjenci ważący poniżej 70 kg mieli zalecane dawkowanie z maksymalną szybkością infuzji wynoszącą 0.12 ml/kg/min (poniżej 8 ml/min).
Uwagi dotyczące kontroli liczby płytek krwi:
Należy ściśle monitorować liczbę płytek krwi.
Interakcje z innymi lekami i inne rodzaje interakcji
W przypadku wykonywania testów krzepnięcia wrażliwych na obecność heparyny, u pacjentów otrzymujących wysokie dawki czynników krzepnięcia zespołu protrombiny, w otrzymanych wynikach testów należy uwzględnić dawkę heparyny zawartą w produkcie.