Spis treści:
Ulotka dołączona do opakowania: informacja dla pacjenta
Cluvot 1250 j.m.
proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań / infuzji Ludzki XIII czynnik krzepnięcia krwi
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub farmaceuty.
Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Patrz punkt 4.
Spis treści ulotki
Co to jest Cluvot i w jakim celu się go stosuje
do profilaktycznego leczenia wrodzonego niedoboru czynnika XIII oraz
w postępowaniu okołooperacyjnym w celu leczenia krwawień podczas zabiegów chirurgicznych
u pacjentów z wrodzonym niedoborem czynnika XIII.
Informacje ważne przed zastosowaniem Cluvot
jeśli pacjent ma uczulenie na substancję czynną lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Należy poinformować lekarza jeśli występuje nadwrażliwość na jakikolwiek lek lub pokarm.
Ostrzeżenia i środki ostrożności:
jeśli po podaniu czynnika XIII krzepnięcia krwi występowały w przeszłości reakcje alergiczne. Profilaktycznie należy zastosować leki antyhistaminowe i kortykosteroidy jeżeli tak zdecyduje lekarz.
gdy pojawią się objawy alergiczne lub reakcje typu anafilaktycznego (ciężkie objawy alergiczne mogą spowodować znacznego stopnia utrudnienie oddychania lub zawroty głowy). Podawanie Cluvot musi być natychmiast wstrzymane (tj. przerwanie wstrzykiwania lub wlewu). W przypadku wstrząsu należy zastosować leczenie zgodne z obowiązującymi standardami medycznymi.
jeśli występowała świeża zakrzepica (skrzep krwi). Należy uważnie obserwować pacjenta z powodu stabilizującego fibrynę działania F XIII.
tworzenie się inhibitorów (przeciwciał neutralizujących) jest znane jako powikłanie leczenia i oznacza, że leczenie przestaje działać. Jeżeli krwawienie nie zostało opanowane za pomocą leku Cluvot, należy o tym natychmiast poinformować lekarza. Pacjent powinien być dokładnie monitorowany w kierunku rozwoju (pojawienia się) inhibitorów.
Lekarz powinien zawsze rozważyć korzyści wynikające z leczenia w stosunku do ryzyka wynikającego
z powikłań.
Bezpieczeństwo przeciwwirusowe
Gdy leki wytwarzane są z ludzkiej krwi lub osocza, podejmowane są różne czynności mające na celu zabezpieczenie pacjenta przed przeniesieniem czynników zakaźnych. Do metod tych należą:
odpowiedni dobór dawców krwi i osocza w celu wykluczenia ryzyka przeniesienia czynników zakaźnych
badanie każdej donacji i pul osocza na obecność markerów wirusów/ zakażeń.
wprowadzenie do procesu wytwarzania produktów z krwi lub osocza etapów, które mogą prowadzić do inaktywacji lub usunięcia wirusów.
Pomimo zastosowania wspomnianych wyżej metod, nie można całkowicie wykluczyć możliwości przeniesienia czynników zakaźnych po podaniu produktu leczniczego pochodzącego z krwi lub osocza ludzkiego. To ryzyko dotyczy również nieznanych lub nowo odkrytych wirusów i innych czynników zakaźnych.
Podjęte środki zabezpieczające są skuteczne w stosunku do otoczkowych wirusów takich jak ludzki wirus upośledzenia odporności (HIV, wirus powodujący AIDS), wirus zapalenia wątroby typu B (HBV, powodujący zapalenie wątroby typu B), wirus zapalenia wątroby typu C (HCV, powodujący zapalenie wątroby typu C) oraz wirusów bezotoczkowych, takich jak: wirus zapalenia wątroby typu A (HAV, powodujący zapalenie wątroby typu A) i parwowirus B 19.
U pacjentów wielokrotnie otrzymujących produkty pochodzące z ludzkiego osocza należy rozważyć zastosowanie szczepień przeciwko wirusowemu zapaleniu wątroby typu A i B.
Zaleca się każdorazowo, gdy podawany jest Cluvot, aby data podania, numer serii i przetoczona objętość zostały odnotowane w prowadzonej dokumentacji.
Cluvot a inne leki
Należy poinformować lekarza lub farmaceutę o przyjmowaniu innych leków, w tym tych, które
dostępne są bez recepty.
Nie jest znane wystąpienie interakcji koncentratu czynnika krzepnięcia krwi FXIII z innymi produktami leczniczymi.
Cluvot nie może być mieszany z innymi produktami leczniczymi, rozpuszczalnikami i rozcieńczalnikami, z wyjątkiem tych wymienionych w punkcie 6 i powinien być podawany za pomocą oddzielnych zestawów infuzyjnych.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Ograniczone dane dotyczące klinicznego stosowania Cluvot w ciąży nie wykazały żadnych negatywnych skutków związanych z ciążą oraz rozwojem embrionalnym i poporodowym. W przypadku konieczności może być rozważone zastosowanie Cluvot w czasie ciąży.
Nie jest znany stopień przenikania Cluvot do ludzkiego mleka, jednak zważywszy jego wysoką masę cząsteczkową prawdopodobieństwo wydzielania z mlekiem matki jest bardzo niskie i z powodu jego białkowego charakteru absorpcja nienaruszonych cząstek przez noworodka jest także mało prawdopodobna. W związku z tym Cluvot może być stosowany podczas karmienia piersią.
Brak danych dotyczących wpływu Cluvot na płodność.
Prowadzenia pojazdów i obsługiwanie maszyn
Nie prowadzono badań dotyczących wpływu na zdolność do prowadzenia pojazdów i obsługiwania maszyn.
Ważne informacje o niektórych składnikach Cluvot Cluvot zawiera sód.
Należy mieć na uwadze fakt, że Cluvot zawiera sód. Jest to ważne u pacjentów będących na kontrolowanej diecie niskosodowej. Cluvot zawiera od 124,4 do 195,4 mg (5,41 do 8,50 mmol) sodu na dawkę (40 j.m. /masę ciała - przy średniej masie ciała 70 kg), jeśli podano rekomendowaną dawkę (2800 j.m. = 44,8 ml)
Jak stosować Cluvot
Cluvot zazwyczaj jest podawany przez lekarza.
Cluvot jest przeznaczony wyłącznie do podawania dożylnego.
Dawkowanie
Lekarz powinien wyliczyć odpowiednią dawkę i zdecydować jak często Cluvot powinien być podawany pacjentowi, biorąc pod uwagę postępy w leczeniu.
Bardziej szczegółowe zalecenia patrz punkt: „Informacja przeznaczona wyłącznie dla personelu medycznego lub pracowników służby zdrowia”.
Przedawkowanie
Nie odnotowano przypadków przedawkowania i nie należy ich oczekiwać w przypadku podawania tego leku przez personel medyczny.
Możliwe działania niepożądane
Reakcje alergiczne takie jak uogólniona pokrzywka (swędzący obrzęk na skórze), wysypka, obniżenie ciśnienia krwi (które może powodować uczucie omdlenia lub skołowania), trudności w oddychaniu.
Wzrost temperatury ciała
Poniższe działania niepożądane były obserwowane bardzo rzadko (występowały u mniej niż 1 na 10 000 pacjentów):
Tworzenie się inhibitorów FXIII.
Jeżeli pojawią się reakcje alergiczne, podawanie leku Cluvot powinno być natychmiast wstrzymane i powinno zostać rozpoczęte odpowiednie leczenie. Powinny zostać zastosowane aktualne standardy medyczne do leczenia wstrząsu.
Działania niepożądane u dzieci i młodzieży
Oczekuje się, że działania niepożądane u dzieci są takie same jak u dorosłych.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak przechowywać Cluvot
Przechowywać w lodówce (2⁰C – 8⁰C).
Nie zamrażać.
Przechowywać w opakowaniu zewnętrznym w celu ochrony przed światłem.
Cluvot nie zawiera środków konserwujących. Lek powinien być zużyty natychmiast po re konstytucji. Jeżeli nie zostanie natychmiast zużyty, przechowywanie w temperaturze pokojowej nie powinno przekroczyć 4 godzin. Nie przechowywać w lodówce i nie zamrażać roztworu po rekonstytucji.
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować Cluvot po upływie terminu ważności zamieszczonego na etykiecie i opakowaniu zewnętrznym po skrócie EXP.
Numer serii produktu leczniczego jest umieszczony na opakowaniu zewnętrznym i etykiecie po skrócie: Lot.
Zawartość opakowania i inne informacje Co zawiera Cluvot
Co to jest Cluvot
Cluvot jest lekiem dostępnym w postaci białego proszku i rozpuszczalnika. Sporządzony roztwór powinien zostać podany we wstrzyknięciu dożylnym.
Cluvot jest ludzkim XIII czynnikiem krzepnięcia krwi (F XIII) wytworzonym z ludzkiego osocza (jest to płynna część krwi) i pełni ważną rolę w procesie hemostazy (zatrzymując krwawienie).
W jakim celu stosuje się Cluvot
Cluvot jest wskazany do stosowania u dorosłych, dzieci i młodzieży.
Ta część ulotki zawiera informacje, które należy wziąć pod uwagę, zanim rozpocznie się stosowanie leku Cluvot.
Kiedy nie stosować Cluvot:
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią. Poniższe działania niepożądane obserwowano rzadko (występowały u więcej niż 1 na 10 000 pacjentów
i mniej niż u 1 na 1 000)
Substancja czynna:
Koncentrat XIII czynnika krzepnięcia osocza ludzkiego(FXIII) zawierający 1250 j.m. na fiolkę.
Substancje pomocnicze:
Albumina ludzka, glukoza jednowodna, sodu chlorek, sodu wodorotlenek (w małych ilościach do ustalenia pH).
Rozpuszczalnik: Woda do wstrzykiwań
Jak wygląda Cluvot i co zawiera opakowanie
Cluvot występuje w postaci białego proszku i załączonego rozpuszczalnika, którym jest woda do wstrzykiwań. Przygotowany roztwór powinien być bezbarwny, klarowny do lekko opalizującego. Trzymany pod światło nie powinien być mętny ani zawierać pozostałości (kłaczki/cząstki).
Wielkości opakowań
Jedno opakowanie 1250 j.m. zawiera: 1 fiolkę z proszkiem
1 fiolkę z 20 ml wody do wstrzykiwań
1 system do transferu 20/20 z filtrem (Mix2Vial)
Zestaw do podawania (opakowanie wewnętrzne);
strzykawka jednorazowego użytku o pojemości 20 ml 1 zestaw do wkłucia
waciki nasączone alkoholem 1 niejałowy plaster
Podmiot odpowiedzialny i Wytwórca
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg Niemcy
Data ostatniej aktualizacji ulotki: sierpień 2021
----------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Dawkowanie
1 ml odpowiada w przybliżeniu 62.5 j.m., a 100 j.m. jest równoważne odpowiednio 1,6 ml. Ważne:
Ilość potrzebna do podania i częstość podawania powinny być zawsze dostosowane do skuteczności klinicznej
u poszczególnych pacjentów .
Dawkowanie
Dawkowanie powinno być indywidualnie dobrane w zależności od masy ciała, wyników badań laboratoryjnych oraz stanu klinicznego pacjenta.
Rutynowy schemat dawkowania w profilaktyce Dawka początkowa
40 jednostek międzynarodowych (j.m.) na kilogram masy ciała.
Szybkość infuzji nie powinna być większa niż 4 ml na minutę
Kolejne dawki
Dawkowanie powinno być określone w oparciu o bieżący poziom aktywności FXIII, dawki należy podawać w odstępach 28 dniowych (4 tygodnie) w celu utrzymania minimalnej aktywności F XIII na poziomie ok. 5 do 20%.
Zalecane dostosowanie dawkowania o +/- 5 j.m. na kg masy ciała należy obliczyć biorąc pod uwagę minimalny poziom aktywności F XIII jak pokazano w tabeli nr 1 oraz kliniczny stan pacjenta .
Dostosowywanie dawkowania powinno być prowadzone w oparciu o specyficzny, czuły test stosowany do oznaczania poziomu F XIII. Przykłady dostosowywania przy użyciu standardowego testu aktywności Berichrom zostały przedstawione w poniższej tabeli nr 1.
Tabela 1 : Dostosowanie dawkowania przy użyciu testu aktywności Berichrom
Minimalny poziom aktywności czynnika XIII(%)
Zmiana dawkowania
Jeden poziom minimalny < 5%
Zwiększenie o 5 jednostek na kg.
Poziom minimalny 5% do 20%
Brak zmian
Dwa poziomy minimalne > 20%
Zmniejszenie o 5 jednostek na kg.
Jeden poziom minimalny > 25%
Zmniejszenie o 5 jednostek na kg.
Aktywność wyrażona w jednostkach jest oznaczana przy użyciu testu aktywności Berichrom, odnoszącego się do aktualnego Międzynarodowego Standardu dla Osoczowego XIII Czynnika Krzepnięcia Krwi. W związku z tym jednostka odpowiada Jednostce Międzynarodowej.
Profilaktyka przedooperacyjna.
Po ostatniej dawce zastosowanej w rutynowej profilaktyce, w przypadku planowanego zabiegu operacyjnego:
Pomiędzy 21 a 28 dniem od ostatniej dawki - należy podać pacjentowi pełną dawkę bezpośrednio przed zabiegiem chirurgicznym, a kolejna dawka profilaktyczna powinna zostać podana 28 dni później.
Pomiędzy 8 a 21 dniem od ostatniej dawki - dodatkowa dawka (pełna lub częściowa) może zostać podana przed zabiegiem chirurgicznym. Dawka powinna być uzależniona od poziomu aktywności FXIII pacjenta , jego stanu klinicznego i powinna być dobrana zgodnie z okresem półtrwania produktu leczniczego Cluvot.
W ciągu 7 dni od ostatniej dawki – dodatkowe podanie może nie być potrzebne.
Dostosowanie dawkowania może być różne od dawkowania zalecanego i powinno być indywidualnie dobrane w oparciu o poziom aktywności F XIII i stan kliniczny pacjenta. Wszyscy pacjenci powinni być ściśle monitorowani podczas i po zabiegu chirurgicznym.
W związku z powyższym zaleca się monitorowanie wzrostu poziomu aktywności F XIII w oparciu o test czynnika XIII. W przypadku poważnych zabiegów chirurgicznych oraz dużych krwawień celem powinno być osiągnięcie zbliżonych do prawidłowych wartości (osoby zdrowe: 70%-140%).
Dzieci i młodzież
Dawkowanie i sposób podawania u dzieci i młodzieży jest oparte o masę ciała i w związku z tym ogólnie nie odbiega od wytycznych dla dorosłych. Dawkowanie i/lub częstość podawania dla każdego pacjenta powinna zawsze być dobrana w oparciu o skuteczność kliniczną i poziom aktywności FXIII.
Pacjenci w podeszłym wieku
Dawkowanie i sposób podawania u pacjentów w podeszłym wieku (> 65 lat) nie zostały udokumentowane w badaniach klinicznych.
Sposób podawania
Wskazówki ogólne
Roztwór powinien być klarowny lub lekko opalizujący. Po filtracji/pobraniu zawartości fiolki (patrz poniżej) produkt po rekonstytucji przed podaniem powinien być poddany wizualnej ocenie; należy sprawdzić czy nie pojawiły się żadne zanieczyszczenia i czy nie nastąpiła zmiana zabarwienia.
Nie stosować mętnych roztworów i takich, które zawierają płatki lub cząstki.
Rekonstytucja i pobieranie z fiolki muszą być przeprowadzone w warunkach aseptycznych.
Rekonstytucja
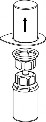
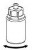
Doprowadzić rozpuszczalnik do temperatury pokojowej. Zdjąć z fiolek zawierających proszek i rozpuszczalnik plastikowe wieczka i przemyć korki aseptycznym roztworem. Po wyschnięciu otworzyć system zawierający łącznik Mix2Vial.
1. Otworzyć opakowanie zawierające Mix2Vial poprzez usunięcie wieczka. Nie wyjmować Mix2Vial z blistra. |
1 |
2 | 2. Umieścić fiolkę z rozpuszczalnikiem na równej, czystej powierzchni i mocno przytrzymać. Nie wyjmując z blistra systemu Mix2Vial nałożyć jego niebieską końcówkę z ostrzem na korek fiolki rozpuszczalnika i naciskając pionowo w dół przebić korek fiolki rozpuszczalnika.. |
3 | 3. Przytrzymując krawędź systemu Mix2Vial ostrożnie zdjąć blister pociągając go pionowo do góry. Należy zwrócić uwagę aby zdjąć jedynie blister a nie cały system Mix2Vial. |
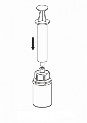
4 | 4. Umieścić fiolkę z proszkiem na równej i twardej powierzchni. Odwrócić do góry dnem fiolkę z rozpuszczalnikiem i dołączonym do niej systemem Mix2Vial i wbić w korek fiolki z proszkiem, ruchem pionowo w dół, ostrze przezroczystego końca. Rozpuszczalnik samoczynnie zostanie przeniesiony do fiolki z proszkiem. |
5 | 5. Jedną ręką chwycić część systemu Mix2Vial w fiolce zawierającej obecnie roztwór, drugą zaś ręką przytrzymać część łącznika od strony fiolki po rozpuszczalniku i ostrożnie odkręcając oddzielić od siebie obie części łącznika. Usunąć fiolkę po rozpuszczalniku z przyczepionym do niej niebieskim końcem systemu Mix2Vial. |
6 | 6. Fiolkę z doczepionym przezroczystym końcem systemu Mix2Vial, zawierającą roztwór, łagodnie mieszać ruchem wirowym do całkowitego rozpuszczenia leku. Nie wstrząsać. |
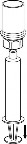
7 | 7. Nabrać powietrza do pustej, jałowej strzykawki. Trzymając fiolkę z produktem leczniczym pionowo korkiem do góry, przyłączyć strzykawkę do połączenia Luer Lock systemu Mix2Vial. Wstrzyknąć powietrze do fiolki z produktem. |

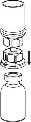
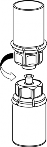
Pobieranie i sposób podawania
8 | 8. Przytrzymując tłok strzykawki odwrócić fiolkę wraz ze strzykawką do góry dnem i nabrać roztwór do strzykawki, powoli odciągając tłok. |
9 | 9. Po napełnieniu strzykawki roztworem, mocno uchwycić cylinder strzykawki (utrzymując strzykawkę tłokiem do dołu) odłączyć od niej przezroczysty koniec systemu Mix2Vial. |
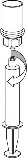
Należy zachować ostrożność, aby krew nie dostała się do strzykawki wypełnionej produktem leczniczym, gdyż istnieje ryzyko, że krew może ulec wykrzepianiu w strzykawce i skrzepliny fibryny mogłyby zostać podane pacjentowi.
Roztwór po rekonstytucji powinien być podany do oddzielnych zestawów do wstrzykiwań/ infuzji (dostarczonych z produktem), w powolnym wstrzyknięciu dożylnym, z szybkością nie przekraczającą 4 ml na minutę.
Wszelkie niezużyte produkty lecznicze oraz ich pozostałości powinny zostać usunięte zgodnie z lokalnymi wymaganiami.











