Spis treści:
Ulotka dołączona do opakowania: informacja dla użytkownika
Braltus, 10 mikrogramów/dawkę dostarczoną, proszek do inhalacji w kapsułce twardej
Tiotropium
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie możliwe objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
Co to jest lek Braltus i w jakim celu się go stosuje
Braltus zawiera substancję czynną tiotropium. Tiotropium ułatwia oddychanie ludziom chorym na przewlekłą obturacyjną chorobę płuc (POChP). POChP to przewlekła choroba płuc, która powoduje duszność i kaszel. Nazwa POChP jest związana z przewlekłym zapaleniem oskrzeli i rozedmą płuc. POChP jest chorobą przewlekłą, dlatego lek należy stosować codziennie, a nie tylko wtedy, gdy występują problemy z oddychaniem lub inne objawy POChP.
Braltus to lek rozszerzający oskrzela o długotrwałym działaniu, który pomaga rozszerzyć drogi oddechowe i ułatwia przedostawanie się powietrza do i z płuc. Regularne stosowanie tego leku może także pomóc w zmniejszeniu utrzymującej się duszności związanej z chorobą i pomoże zmniejszyć skutki choroby odczuwalne w życiu codziennym. Lek pomaga zachować aktywność dłużej. Codzienne stosowanie leku pomoże także zapobiec nagłemu, krótkotrwałemu nasileniu objawów POChP, które może trwać przez kilka dni. Działanie leku utrzymuje się przez 24 godziny, należy więc lek stosować tylko raz na dobę.
Leku nie należy stosować jako doraźnego leczenia w celu złagodzenia nagłego ucisku w klatce piersiowej, kaszlu, czy napadu duszności lub świszczącego oddechu. W takiej sytuacji należy zastosować szybko
działający lek wziewny łagodzący objawy do stosowania doraźnie, taki jak salbutamol. Zawsze należy mieć przy sobie szybko działający lek wziewny do stosowania doraźnie.
Informacje ważne przed zastosowaniem leku Braltus Kiedy nie stosować leku Braltus:
jeśli pacjent ma uczulenie (nadwrażliwość) na tiotropium lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6)
jeśli pacjent ma uczulenie (nadwrażliwość) na atropinę lub jej pochodne, jak ipratropium lub oksytropium
jeśli pacjent ma uczulenie (nadwrażliwość) na laktozę lub inne cukry
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Braltus należy omówić to z lekarzem, farmaceutą lub pielęgniarką, jeśli:
pacjent przyjmuje inne leki zawierające ipratropium lub oksytropium
u pacjenta występuje jaskra z wąskim kątem przesączania, problemy z prostatą lub trudności w oddawaniu moczu
u pacjenta występują jakiekolwiek problemy związane z nerkami
pacjent przebył w czasie ostatnich 6 miesięcy zawał serca, doświadczył zaburzeń pracy serca lub
zagrażającego życiu nieregularnego bicia serca, lub ciężkiej niewydolności serca w ciągu ostatniego roku.
Braltus jest wskazany w podtrzymującym leczeniu przewlekłej obturacyjnej choroby płuc. Nie należy stosować tego leku do leczenia nagłych napadów duszności lub świszczącego oddechu.
Podczas stosowania leku Braltus mogą wystąpić natychmiastowe reakcje nadwrażliwości, takie jak wysypka, obrzęk, świąd, świszczący oddech i duszność. W takich przypadkach należy natychmiast skontaktować się z lekarzem (patrz punkt 4).
Leki wziewne, takie jak Braltus mogą spowodować wystąpienie uczucia ucisku w klatce piersiowej, kaszel, świszczący oddech lub duszność (skurcz oskrzeli) bezpośrednio po zastosowaniu. W takich sytuacjach
należy natychmiast zastosować szybko działający doraźny lek wziewny np. salbutamol. W razie wystąpienia wymienionych objawów należy przerwać stosowanie leku Braltus i niezwłocznie skontaktować się z lekarzem.
Nie wolno dopuścić, aby proszek do inhalacji dostał się do oczu, ponieważ może to spowodować łzawienie oczu lub wystąpienie lub zaostrzenie objawów jaskry z wąskim kątem przesączania, która jest chorobą oczu.
Ból oka lub dyskomfort, niewyraźne widzenie, widzenie tęczowej obwódki wokół źródła światła lub
zmienione widzenie kolorów, jednocześnie z zaczerwienieniem oczu mogą być oznaką wystąpienia ostrej jaskry z wąskim kątem przesączania. Zaburzeniom dotyczącym oczu mogą towarzyszyć: ból głowy, nudności i wymioty. Jeżeli wystąpią objawy jaskry z wąskim kątem przesączania należy przerwać stosowanie tego leku i natychmiast skontaktować się z lekarzem, najlepiej okulistą.
Lek znajdujący się w inhalatorze może zmniejszyć ilość wydzieliny (śliny) w jamie ustnej i wywołać suchość w jamie ustnej. Po dłuższym czasie może to powodować próchnicę zębów. Dlatego należy pamiętać o utrzymaniu higieny jamy ustnej, płukać jamę ustną i myć zęby regularnie.
Jeśli pacjent przebył w czasie ostatnich 6 miesięcy zawał serca, doświadczył zaburzeń pracy serca lub
zagrażającego życiu nieregularnego bicia serca, lub ciężkiej niewydolności serca w ciągu ostatniego roku, należy zawiadomić o tym lekarza. Pozwoli to lekarzowi zadecydować, czy lek Braltus jest odpowiednim leczeniem dla pacjenta.
Leku nie należy stosować częściej niż raz na dobę (patrz punkt 3).
Dzieci i młodzież
Nie należy stosować leku Braltus u dzieci i młodzieży w wieku poniżej 18 lat.
Inne leki i lek Braltus
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach przyjmowanych obecnie lub ostatnio, w tym lekach wziewnych i lekach, które wydawane są bez recepty.
Należy poinformować lekarza lub farmaceutę o przyjmowaniu innych leków obecnie lub w przeszłości stosowanych w chorobie płuc, takich jak ipratropium czy oksytropium.
Nie zanotowano specyficznych działań niepożądanych podczas stosowania tego leku z innymi lekami stosowanymi w leczeniu POChP, takimi jak: leki wziewne stosowane doraźnie, np. salbutamol, metyloksantyny (np. teofilina) i (lub) doustne oraz wziewne steroidy, np. prednizolon.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku. Nie należy stosować tego leku, chyba że na wyraźne zalecenie lekarza.
Prowadzenie pojazdów i obsługiwanie maszyn
Zawroty głowy, niewyraźne widzenie lub ból głowy mogą wpływać na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Lek Braltus zawiera laktozę
Laktoza jest rodzajem cukru występującym w mleku. Jeśli u pacjenta stwierdzono wcześniej uczulenie na niektóre cukry, pacjent powinien skontaktować się z lekarzem przed przyjęciem tego leku. Laktoza może zawierać niewielkie ilości białek mleka, które mogą powodować reakcje alergiczne u osób z ciężką nadwrażliwością lub uczuleniem na białka mleka. Jeśli lek jest stosowany zgodnie z zaleconym dawkowaniem jednej kapsułki raz na dobę, każda dawka dostarcza do 18 mg laktozy jednowodnej.
Jak stosować lek Braltus
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić się do lekarza lub farmaceuty.
Zaleca się inhalację zawartości jednej kapsułki raz na dobę za pomocą inhalatora Zonda. Jedna kapsułka zapewnia wymaganą dzienną dawkę tiotropium (dostarczona dawka 10 mikrogramów tiotropium); nie należy stosować dawki większej niż zalecana.
Należy dążyć do tego, aby stosować lek o tej samej porze każdego dnia. Jest to ważne, ponieważ lek działa przez 24 godziny.
Kapsułki mogą być stosowane tylko wziewnie. Nie stosować doustnie. Kapsułek nie należy połykać.
Inhalator Zonda, do którego należy włożyć kapsułkę leku Braltus, przedziurawia kapsułkę i pozwala na zainhalowanie proszku.
Kapsułki należy podawać wyłącznie przy użyciu inhalatora Zonda. Nie należy stosować żadnych innych aparatów do podawania kapsułek leku Braltus.
Należy upewnić się, że pacjent potrafi prawidłowo używać inhalator Zonda. Instrukcja użycia aparatu do inhalacji Zonda znajduje się na drugiej stronie ulotki. Należy postępować dokładnie zgodnie z instrukcją. Zdjęcia prezentujące sposób prawidłowego umieszczenia kapsułki w inhalatorze znajdują się również na wewnętrznej stronie klapki pudełka. Aby uniknąć ryzyka zadławienia NIGDY nie należy wkładać kapsułki bezpośrednio do ustnika. W razie jakichkolwiek trudności z użyciem aparatu do inhalacji Zonda, należy poprosić lekarza, farmaceutę lub pielęgniarkę o pomoc.
W razie konieczności, można wytrzeć ustnik inhalatora Zonda suchym kawałkiem tkaniny lub chusteczką.
Nie należy wydychać powietrza do inhalatora Zonda. W czasie stosowania leku Braltus, należy uważać, aby proszek nie dostał się do oczu, ponieważ może to spowodować niewyraźne widzenie, ból oka i (lub)
zaczerwienie oczu; należy natychmiast przemyć oczy ciepłą wodą i niezwłocznie zgłosić się do lekarza po dalsze wskazówki.
W przypadku wrażenia, że trudności w oddychaniu nasilają się, należy tak szybko, jak to możliwe skontaktować się z lekarzem.
Stosowanie u dzieci i młodzieży
Lek Braltus nie jest zalecany do stosowania u dzieci i młodzieży w wieku poniżej 18 lat.
Zastosowanie większej niż zalecana dawki leku Braltus
W razie zainhalowania zawartości więcej niż 1 kapsułki leku Braltus na dobę, należy natychmiast skontaktować się z lekarzem. U pacjenta może zwiększyć się ryzyko wystąpienia działań niepożądanych, takich jak: suchość błony śluzowej jamy ustnej, zaparcia, trudności w oddawaniu moczu, przyspieszenie akcji serca lub niewyraźne widzenie.
Pominięcie zastosowania leku Braltus
Jeżeli pominięto dawkę leku, należy przyjąć ją tak szybko, jak to jest możliwe, ale nigdy nie należy przyjmować dwóch dawek jednocześnie lub w tym samym dniu. Następną dawkę należy przyjąć o zwykłej porze. Nie należy przyjmować podwójnej dawki, w celu uzupełnienia pominiętej dawki.
Przerwanie stosowania leku Braltus
Przed przerwaniem stosowania leku Braltus, należy poradzić się lekarza lub farmaceuty. Po przerwaniu stosowania leku mogą nasilić się objawy POChP.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
Możliwe działania niepożądane
suchość błony śluzowej jamy ustnej (zazwyczaj o łagodnym nasileniu)
Niezbyt często: mogą wystąpić u 1 na 100 osób
zawroty głowy
ból głowy
zaburzenia smaku
niewyraźne widzenie
nieregularne bicie serca (migotanie przedsionków)
zapalenie gardła
chrypka (dysfonia)
kaszel
choroba refluksowa przełyku, której objawem jest m.in. zgaga
zaparcie
zakażenia grzybicze w obrębie jamy ustnej i gardła (kandydoza jamy ustnej i gardła)
wysypka
trudności w oddawaniu moczu (zatrzymanie moczu)
bolesne lub utrudnione oddawanie moczu
5
Rzadko: mogą wystąpić 1 na 1000 osób
trudności w zasypianiu (bezsenność)
widzenie tęczowej obwódki wokół źródła światła lub zmienione widzenie kolorów, wraz z zaczerwienieniem oczu (jaskra)
zwiększone ciśnienie w oku
nieregularne bicie serca (częstoskurcz nadkomorowy)
przyspieszenie czynności serca (tachykardia)
kołatanie serca
ucisk w klatce piersiowej powiązany z kaszlem, świszczącym oddechem lub dusznością występującą natychmiast po zainhalowaniu leku (skurcz oskrzeli)
krwawienie z nosa
zapalenie krtani
zapalenie zatok
zaniknięcie światła jelita lub brak ruchów robaczkowych jelit (niedrożność jelit, w tym porażenna niedrożność jelit)
zapalenie dziąseł
zapalenie języka
utrudnione przełykanie (dysfagia)
zapalenie jamy ustnej
nudności
pokrzywka
świąd
zakażenie dróg moczowych
Częstość nie może być określona na podstawie dostępnych danych:
ubytek wody z organizmu (odwodnienie)
próchnica zębów
zakażenia lub owrzodzenie skóry
suchość skóry
obrzęk stawów
Jak przechowywać lek Braltus
Zawartość opakowania i inne informacje Co zawiera lek Braltus
Substancją czynną leku jest tiotropium. Każda kapsułka zawiera 13 mikrogramów substancji czynnej tiotropium (w postaci bromku). W czasie inhalacji, każda kapsułka dostarcza 10 mikrogramów tiotropium przez ustnik inhalatora Zonda, które są następnie wdychane przez pacjenta do płuc.
Pozostałe składniki to: laktoza jednowodna (zawartość kapsułki) i hypromeloza (otoczka kapsułki)
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Po zastosowaniu leku ciężkie reakcje alergiczne, takie jak obrzęk twarzy lub gardła (obrzęk naczynioruchowy) lub inne reakcje nadwrażliwości (takie jak nagłe obniżenie ciśnienia krwi lub zawroty głowy) lub świszczący oddech lub duszności mogą wystąpić samodzielnie lub jako część ciężkiej reakcji alergicznej (reakcji anafilaktycznej). Tak poważne działania niepożądane występują rzadko. Dodatkowo, podobnie jak w przypadku innych leków stosowanych wziewnie, bezpośrednio po inhalacji leku u niektórych pacjentów może wystąpić nagły ucisk w klatce piersiowej, kaszel, świszczący oddech lub duszność (tzw. skurcz oskrzeli).
W przypadku wystąpienia któregokolwiek z tych objawów, należy natychmiast skontaktować się z lekarzem.
Należy skonsultować się z lekarzem przed kolejnym zastosowaniem leku Braltus. W razie wystąpienia świszczącego oddechu lub duszności należy zastosować szybko działający wziewny lek rozszerzający oskrzela.
Inne działania niepożądane zgłaszane przez osoby stosujące ten lek zostały wymienione poniżej według częstości występowania.
Często: mogą wystąpić u 1 na 10 osób
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować leku po upływie terminu ważności zamieszczonego na tekturowym pudełku i na etykiecie butelki po EXP. Termin ważności oznacza ostatni dzień podanego miesiąca.
Nie przechowywać w lodówce ani nie zamrażać.
Przechowywać butelkę szczelnie zamkniętą. Przechowywać w oryginalnym opakowaniu, w celu ochrony przed wilgocią.
Okres ważności po pierwszym otwarciu butelki: 30 dni (butelki zawierające 15 kapsułek) lub 60 dni (butelki zawierające 30 kapsułek).
Inhalatora Zonda należy używać tylko z kapsułkami z butelki dostarczonej w tym samym opakowaniu, co inhalator, lub z kapsułkami z butelki dostarczonej w opakowaniu dołączonym do opakowania z inhalatorem. Nie należy ponownie używać inhalatora dla drugiej butelki z kapsułkami.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
Jak wygląda lek Braltus i co zawiera opakowanie
Braltus 10 mikrogramów/ dawkę dostarczoną, proszek do inhalacji w kapsułce twardej jest bezbarwną i przezroczystą, twardą kapsułką zawierającą biały proszek.
Lek jest dostarczany w butelce z nakrętką. Butelka razem z inhalatorem Zonda zapakowana jest w tekturowe pudełko. Inhalator Zonda ma zielony korpus oraz wieczko z białym przyciskiem.
Braltus jest dostępny w opakowaniach zawierających 15 lub 30 kapsułek i inhalator Zonda, oraz w opakowaniach zbiorczych zawierających 60 kapsułek (2 opakowania po 30) i 2 inhalatory Zonda, lub 90
kapsułek (3 opakowania po 30) i 3 inhalatory Zonda.
Pakiet: 30 kapsułek (butelka) w pudełku z 1 inhalatorem Zonda zapakowanym w osobne pudełko. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca:
Podmiot odpowiedzialny
Teva Pharmaceuticals Polska Sp. z o.o. ul. Emilii Plater 53,
00-113 Warszawa
tel.: (22) 345 93 00
Wytwórca:
Laboratorios LICONSA S.A
Avda. Miralcampo No 7, Polígono Industrial Miralcampo Azuqueca de Henares
19200, Guadalajara Hiszpania
Teva Pharma B.V. Swensweg 5
2031 GA Haarlem Holandia
Actavis Ltd
BLB015, BLB016, Bulebel Industrial Estate, Zejtun, ZTN3000,
Malta
Teva Operations Poland Sp. z.o.o. ul. Mogilska 80
31-546 Kraków Polska
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru Gospodarczego pod następującymi nazwami:
Austria - Braltus 10 Mikrogramm pro abgegebener Dosis Kapseln mit Inhalationspulver
Belgia - Braltus 10 micrograms Inhalatiepoeder in harde capsule/ Poudre pour inhalation en gélule/ Hartkapsel mit Pulver zur Inhalation
Bułgaria - Braltus 10 микрограма на доставена доза прах за инхалация, твърда капсула Chorwacja - Braltus 10 mikrograma po isporučenoj dozi, prašak inhalata, tvrde kapsule
Cypr - Braltus 10 μικρογραμμάρια ανά χορηγούμενη δόση, κόνις για εισπνοή, καψάκιο, σκληρό Republika
Czeska - Braltus 10 mikrogramů/dávka, prášek k inhalaci ve tvrdých tobolkách Dania - Braltus
Estonia - Braltus
Finlandia - Braltus 10 mikrog / vapautunut annos inhalaatiojauhe, kapseli, kova Niemcy - Braltus 10 Mikrogramm Hartkapseln mit Pulver zur Inhalation
Grecja - Braltus 10 μικρογραμμάρια ανά χορηγούμενη δόση, κόνις για εισπνοή, καψάκιο, σκληρό Węgry - Braltus 10 mikrogramm adagolt inhalációs por kemény kapszulában
Islandia - Braltus 10 míkrógramm í hverjum skammti, Innöndunarduft, hart hylki Irlandia - Braltus 10 microgram per delivered dose inhalation powder, hard capsule
Włochy - Tiotropio Teva Italia 10 microgrammi per dose erogata polvere per inalazione, capsula rigida Łotwa - Braltus 10 mikrogrami saņemtajā devā, inhalācijas pulveris cietās kapsulās
Litwa - Braltus 10 mikrogramų/dozėje įkvepiamieji milteliai (kietoji kapsulė) Luksemburg - Braltus 10 Mikrogramm pro abgegebener Dosis Kapsel mit Inhalationspulver Malta - Braltus 10 microgram per delivered dose inhalation powder, hard capsule Holandia - Braltus 10 microgram per afgegeven dosis inhalatiepoeder in harde capsules Norwegia - Braltus
Polska - Braltus Portugalia - Braltus
Rumunia - Braltus 10 micrograme pulbere de inhalat, capsula Słowacja - Braltus 10 mikrogramov
Słowenia - Braltus 10 mikrogramov na dovedeni odmerek, prašek za inhaliranje, trde kapsule Hiszpania - Braltus 10 microgramos/dosis liberada polvo para inhalación
Szwecja - Braltus
Wielka Brytania - Braltus 10 microgram per delivered dose inhalation powder, hard capsule
Data ostatniej aktualizacji ulotki: kwiecień 2021 r.
Druga strona ulotki:
Instrukcja użycia inhalatora Zonda
Drogi Pacjencie,
Inhalator Zonda umożliwia podanie leku zawartego w kapsułce Braltus, zaleconego przez lekarza na problemy z oddychaniem.
Należy dokładnie przestrzegać zaleceń lekarza podczas stosowania leku Braltus.
Inhalator Zonda jest dostosowany tylko do kapsułek leku Braltus; nie należy go używać do podawania innych leków. Kapsułki leku Braltus należy przyjmować tylko za pomocą inhalatora Zonda. Nie wolno
używać innego inhalatora do podawania kapsułek leku Braltus. Każda kapsułka zawiera niewielką ilość proszku. Nie należy otwierać kapsułki, ponieważ może to spowodować nieprawidłowe działanie inhalatora. Inhalatora Zonda należy używać tylko z kapsułkami z butelki dostarczonej w tym samym opakowaniu, co inhalator, lub z kapsułkami z butelki dostarczonej w opakowaniu dołączonym do opakowania z inhalatorem. Nie należy ponownie używać inhalatora dla drugiej butelki z kapsułkami. Inhalator Zonda należy wyrzucić po 15 użyciach (jeśli jest używany z butelką zawierającą 15 kapsułek) lub 30 użyciach (jeśli jest używany z butelką zawierającą 30 kapsułek).
Zonda
2
1
5
4
3

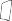








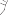







Aby uniknąć ryzyka zadławienia NIGDY nie wolno umieszczać kapsułki bezpośrednio w ustniku.
Zamknąć ustnik, aż do kliknięcia, a wieczko chroniące przed kurzem pozostawić otwarte.
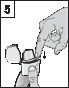
Trzymając inhalator z ustnikiem skierowanym ku górze, należy nacisnąć jeden raz do końca przycisk przekłuwający, a następnie go zwolnić. Kapsułka zostanie przekłuta, a lek będzie gotowy do zainhalowania przez pacjenta.







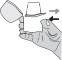





Wykonać głęboki wydech. Ważne jest, aby zrobić to z dala od ustnika. Nigdy nie należy wydychać powietrza przez ustnik.
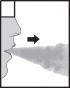
Umieścić ustnik inhalatora w ustach i trzymać głowę w pozycji pionowej. Objąć ustnik wargami
i wykonać powolny i głęboki wdech tak, aby słyszeć lub poczuć wibrację kapsułki wewnątrz komory centralnej. Następnie wstrzymać oddech tak długo jak można, jednocześnie wyjąć inhalator z ust. Powrócić do normalnego oddychania. W celu całkowitego opróżnienia kapsułki, należy powtórzyć czynności opisane w punktach 7 i 8.




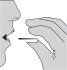
Po użyciu, ponownie otworzyć ustnik i usunąć zużytą kapsułkę. Zamknąć ustnik i wieczko chroniące przed kurzem i odłożyć aparat do inhalacji Zonda.
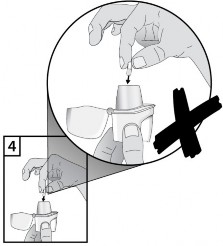
9







Inhalator Zonda jest wyrobem medycznym (CE) Wytwórca:
Laboratorios LICONSA S.A.
Avda. Miralcampo, No 7, Polígono Industrial Miralcampo 19200 Azuqueca de Henares, Guadalajara
Hiszpania











