Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
- DOZYMETRIA
- INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
1
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Znakowania zestawów do sporządzania radiofarmaceutyków opracowanych i zatwierdzonych do znakowania tym roztworem.
Scyntygrafii tarczycy: poprzez bezpośrednie obrazowanie oraz pomiar wychwytu związku przez tarczycę, pozwala ocenić położenie, rozmiar, strukturę tkanki gruczołowej oraz funkcję narządu w przypadku chorób tarczycy.
Scyntygrafii gruczołów ślinowych: rozpoznanie przewlekłego zapalenia ślinianki (np.: zespół Sjögrena), jak również oceny funkcji wydzielniczej tkanki gruczołowej oraz drożności przewodów wyprowadzających oraz kontrolowanie odpowiedzi na działania lecznicze (w szczególności terapia radiojodem).
Lokalizacji ektopowej błony śluzowej żołądka (uchyłek Meckela).
Scyntygrafii kanalików łzowych: ocena niedrożności kanalików łzowych oraz kontrolowanie odpowiedzi na działania lecznicze.
Dawkowanie i sposób podawania
Scyntygrafia tarczycy: 20-80 MBq.
Scyntygrafia gruczołów ślinowych: od 30 do 150 MBq dla obrazów statycznych i do 370 MBq dla obrazów dynamicznych.
Scyntygrafia uchyłka Meckela: 300-400 MBq.
Scyntygrafia kanalików łzowych: 2-4 MBq na jedno oko.
Niewydolność nerek
Należy zachować szczególną ostrożność przy dawkowaniu aktywności pacjentom z niewydolnością nerek, gdyż stanowią oni grupę zwiększonego narażenia na promieniowanie.
Dzieci i młodzież
Dawkowanie należy szczególnie ostrożnie rozważyć u dzieci i młodzieży, biorąc pod uwagę wskazania kliniczne i ocenę stosunku korzyści do ryzyka w tej grupie pacjentów.
Aktywność do podania u dzieci i młodzieży określa się zgodnie z zaleceniami podanymi w karcie dawkowania pediatrycznego Europejskiego Towarzystwa Medycyny Nuklearnej (ang. European Association of Nuclear Medicine, EANM). Aktywność do podania u dzieci i młodzieży określa się, mnożąc bazową aktywność (podaną na potrzeby obliczeń) przez podany w poniższej tabeli współczynnik zależności wagowej (patrz tabela 1).
A[MBq] Dawkowanie = aktywność bazowa × współczynnik
Scyntygrafia tarczycy:
Podana aktywność [MBq] = 5,6 MBq x współczynnik korygujący (tabela 1). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka:
Podana aktywność [MBq] = 10,5 MBq x współczynnik korygujący (tabela 1). Minimalna aktywność wymagana do uzyskania obrazu wystarczającej jakości wynosi 20 MBq.
Tabela 1: Współczynniki zależności wagowej stosowane przy dawkowaniu u dzieci i młodzieży (w scyntygrafii tarczycy i identyfikacji/lokalizacji ektopowej błony śluzowej żołądka) zgodnie z wytycznymi EANM - maj 2008 r.
Masa ciała
Współczynnik
Masa ciała
Współczynnik
Masa ciała
Współczynnik
3 kg
=
1
22 kg
=
5,29
42 kg
= 9,14
4 kg
=
1,14
24 kg
=
5,71
44 kg
= 9,57
6 kg
=
1,71
26 kg
=
6,14
46 kg
= 10,00
8 kg
=
2,14
28 kg
=
6,43
48 kg
= 10,29
10 kg
=
2,71
30 kg
=
6,86
50 kg
= 10,71
12 kg
=
3,14
32 kg
=
7,29
52-54 kg
= 11,29
14 kg
=
3,57
34 kg
=
7,72
56-58 kg
= 12,00
16 kg
=
4,00
36 kg
=
8,00
60-62 kg
= 12,71
18 kg
=
4,43
38 kg
=
8,43
64-66 kg
= 13,43
20 kg
=
4,86
40 kg
=
8,86
68 kg
= 14,00
Scyntygrafia gruczołów ślinowych:
Pediatryczna Grupa Robocza EANM (1990) zaleca wyliczenie dawki należnej na podstawie masy ciała dziecka zgodnie z tabelą podaną poniżej (patrz tabela 2). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Tabela 2: Współczynnik zależności wagowej stosowany przy dawkowaniu u dzieci i młodzieży (w scyntygrafii gruczołów ślinowych) zgodnie z zaleceniami EANM z roku 1990:
Masa ciała
Współczynnik
Masa ciała
Współczynnik
Masa ciała
Współczynnik
3 kg
=
0,1
22 kg
= 0,50
42 kg
= 0,78
4 kg
=
0,14
24 kg
= 0,53
44 kg
= 0,80
6 kg
=
0,19
26 kg
= 0,56
46 kg
= 0,82
8 kg
=
0,23
28 kg
= 0,58
48 kg
= 0,85
10 kg
=
0,27
30 kg
= 0,62
50 kg
= 0,88
12 kg
=
0,32
32 kg
= 0,65
52-54 kg
= 0,90
14 kg
=
0,36
34 kg
= 0,68
56-58 kg
= 0,92
16 kg
=
0,40
36 kg
= 0,71
60-62 kg
= 0,96
18 kg
=
0,44
38 kg
= 0,73
64-66 kg
= 0,98
20 kg
=
0,46
40 kg
= 0,76
68 kg
= 0,99
Scyntygrafia kanalików łzowych:
Zalecane aktywności dla dzieci i młodzieży są takie same jak dla dorosłych.
Sposób podawania
Podanie dożylne lub do oka. Do wielokrotnego użycia.
Instrukcje przygotowania produktu leczniczego przed podaniem, patrz punkt 12. Sposób przygotowania pacjenta, patrz punkt 4.4.
We wskazaniach: scyntygrafia tarczycy, scyntygrafia gruczołów ślinowych i identyfikacja/lokalizacja ektopowej błony śluzowej żołądka, sodu nadtechnecjan (99mTc) roztwór stosuje się we wstrzyknięciu dożylnym.
W scyntygrafii kanalików łzowych krople zakrapla się do worka spojówkowego (podanie do oka).
Obrazowanie
Scyntygrafia tarczycy: 20 minut po podaniu dożylnym.
Scyntygrafia gruczołów ślinowych: bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 15 minut.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka (uchyłek Meckela): bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 30 minut.
Scyntygrafia kanalików łzowych: w czasie 2 minut od wprowadzenia kropli do worka spojówkowego wykonuje się obrazy dynamiczne, a następnie statyczne, w odpowiednich odstępach czasu przez
20 minut.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
przeciwtarczycowe produkty lecznicze (np.: karbimazol lub inne pochodne imidazolu, takie jak propylotiouracyl), salicylany, steroidy, sodu nitroprusydek, sodu sulfobromoftaleina, nadchlorany. Ich podawanie powinno być wstrzymane na 1 tydzień przed scyntygrafią tarczycy,
podawanie fenylobutazonu i środków wykrztuśnych powinno być wstrzymane na 2 tygodnie,
podawanie produktów zawierających naturalne lub syntetyczne hormony tarczycy (np. sodu tyroksynę, sodu liotyroninę, wyciąg z tarczycy) powinno zostać wstrzymane na 2–3 tygodnie przed badaniem,
podawanie amiodaronu, benzodiazepin, litu powinno być wstrzymane na 4 tygodnie przed badaniem,
dożylne środki kontrastowe nie powinny być podawane na 1–2 miesiące przed badaniem.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Kolumna:
Glinu tlenek.
Roztwór do elucji:
Sodu chlorek, sodu azotan, woda do wstrzykiwań.
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
250 ml miękkiego worka z PP zawierającego roztwór do elucji (1), połączonego igłą ze stali nierdzewnej (2) z górną częścią kolumny chromatograficznej;
szklanej kolumny chromatograficznej (3) zamkniętej na obu końcach silikonowymi korkami i spiekami ze stali nierdzewnej (4). Kolumna zawiera glinu tlenek, na którym zaadsorbowany jest
99Mo.
igły wylotowej (5) połączonej z dolną częścią kolumny. Drugi koniec igły (6) może być podłączony do fiolki elucyjnej w celu elucji kolumny lub fiolki ochronnej (STE-ELU) w celu utrzymania sterylności między dwoma elucjami.
Kolumna z glinu tlenkiem oraz igła są chronione cylindryczno-stożkową osłoną ołowianą lub wolframową (7). Generatory do 25 GBq technetu (99mTc) są chronione ołowianą osłoną, a generatory 50 GBq są chronione osłoną wolframową.
Cały system jest umieszczony w plastikowej obudowie o kształcie równoległościanu (23 x 21 x 14 cm) (8-9).
Igła do elucji wystaje z górnej części plastikowej osłony, chronionej nasadką transportową lub fiolką ochronną (STE-ELU).
Obok igły do elucji znajduje się zawór bezpieczeństwa (10), zamykany na czas transportu.
Akcesoria w zestawie z generatorem:
worek zawierający 10 sterylnych, wolnych od pirogenów fiolek do elucji (TC-ELU-5) (11) umożliwiających elucję od 5 ml do 6 ml.
sterylna fiolka zabezpieczająca igłę do elucji (STE-ELU). Każda fiolka do elucji lub fiolka ochronna to 15 ml, bezbarwna fiolka ze szkła typu I, zamknięta gumowym korkiem i aluminiowym wieczkiem.
Pojemnik na elucję (12) jest dostarczany z pierwszą dostawą.
Inne dostępne akcesoria:
zestawy zawierające fiolki 10 x 15 ml:
fiolki umożliwiające elucję od 5 do 6 ml;
fiolki umożliwiające elucję od 9 do 11 ml;
fiolki umożliwiające elucję od 14 do 16 ml.
dodatkowe przesłony ołowiane dostosowany do generatora TEKCIS: PROTECT ELU.
Wielkość opakowań:
aktywność 99mTc (maksymalna teoretyczna aktywność elucyjna na dzień
kalibracji, godz. 12 CET)
2
4
6
8
10
12
16
20
25
50
GBq
aktywność 99Mo
(na dzień kalibracji, godz. 12 CET)
2,5
5
7
9,5
12
14,5
19
24
30
60
GBq
Schemat generatora TEKCIS w trybie elucji
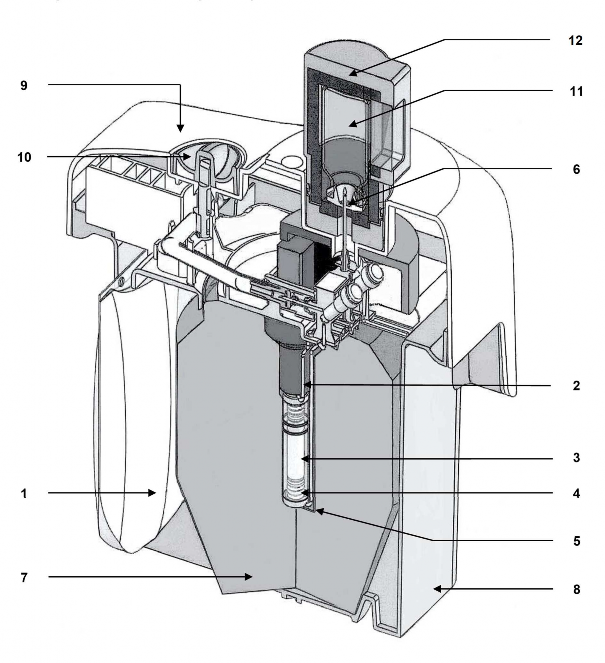
worek z roztworem do elucji ołowiane lub wolframowe cylindryczno- 7
stożkowe osłony
igła łącząca dolna plastikowa osłona 8
szklana kolumna chromatograficzna górna plastikowa osłona 9
korek silikonowy + spieki ze stali nierdzewnej
zawór bezpieczeństwa 10
igła wylotowa ze stali nierdzewnej fiolka elucyjna 11
igła elucyjna pojemnik elucyjny 12
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
DOZYMETRIA
Wartości dawek, gdy pacjent nie otrzymał produktu blokującego:
Narząd
Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq]
Dorośli
15 lat
10 lat
5 lat
1 rok
Nadnercza
0,0037
0,0047
0,0072
0,011
0,019
Ściana pęcherza
moczowego
0,018
0,023
0,030
0,033
0,060
Powierzchnia kości
0,0054
0,0066
0,0097
0,014
0,026
Mózg
0,0020
0,0025
0,0041
0,0066
0,012
Sutki
0,0018
0,0023
0,0034
0,0056
0,011
Pęcherzyk żółciowy
0,0074
0,0099
0,016
0,023
0,035
Przewód pokarmowy
- Ściana żołądka
0,026
0,034
0,048
0,078
0,16
- Jelito cienkie
0,016
0,020
0,031
0,047
0,082
- Okrężnica
0,042
0,054
0,088
0,14
0,27
- Ściana okrężnicy wstępującej
0,057
0,073
0,12
0,20
0,38
- Ściana okrężnicy zstępującej
0,021
0,028
0,045
0,072
0,13
Serce
0,0031
0,0040
0,0061
0,0092
0,017
Nerki
0,0050
0,0060
0,0087
0,013
0,021
Wątroba
0,0038
0,0048
0,0081
0,013
0,022
Płuca
0,0026
0,0034
0,0051
0,0079
0,014
Mięśnie
0,0032
0,0040
0,0060
0,0090
0,016
Przełyk
0,0024
0,0032
0,0047
0,0075
0,014
Jajniki
0,010
0,013
0,018
0,026
0,045
Trzustka
0,0056
0,0073
0,011
0,016
0,027
Szpik kostny
0,0036
0,0045
0,0066
0,0090
0,015
Ślinianki
0,0093
0,012
0,017
0,024
0,039
Skóra
0,0018
0,0022
0,0035
0,0056
0,010
Śledziona
0,0043
0,0054
0,0081
0,012
0,021
Jądra
0,0028
0,0037
0,0058
0,0087
0,016
Grasica
0,0024
0,0032
0,0047
0,0075
0,014
Tarczyca
0,022
0,036
0,055
0,12
0,22
Macica
0,0081
0,010
0,015
0,022
0,037
Pozostałe tkanki
0,0035
0,0043
0,0064
0,0096
0,017
Dawka skuteczna (mSv/MBq)
0,013
0,017
0,026
0,042
0,079
Wartości dawek, gdy pacjent otrzymał produkt blokujący:
INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
TEKCIS, 2-50 GBq, generator radionuklidu
Sodu nadtechnecjan (99mTc), roztwór do wstrzykiwań, otrzymywany jest z generatora (99Mo/99mTc). Technet (99mTc) rozpada się, emitując promieniowanie gamma o średniej energii 140 keV (jego okres półtrwania wynosi 6,01 h) do technetu (99Tc), który ze względu na długi okres półtrwania, wynoszący 2,13 x 105 lat, można uznać za quasi stabilny.
Generator radionuklidu zawierający izotop macierzysty 99Mo zaadsorbowany na kolumnie chromatograficznej dostarcza sodu nadtechnecjan (99mTc) do wstrzykiwań w postaci jałowego roztworu.
99Mo na kolumnie jest w stanie równowagi z wytworzonym izotopem pochodnym 99mTc. Generatory dostarczane są z określoną poniżej aktywnością 99Mo dla referencyjnego czasu aktywności, które dostarczają następujące ilości eluatu technetu (99mTc):
aktywność 99mTc (maksymalna teoretyczna aktywność elucyjna na dzień kalibracji, godz. 12 CET) | 2 | 4 | 6 | 8 | 10 | 12 | 16 | 20 | 25 | 50 | GBq |
aktywność 99Mo (na dzień kalibracji, godz. 12 CET) | 2,5 | 5 | 7 | 9,5 | 12 | 14,5 | 19 | 24 | 30 | 60 | GBq |
Ilość technetu (99mTc) otrzymywana podczas pojedynczej elucji zależy od rzeczywistej wydajności użytego generatora deklarowanej przez producenta i zatwierdzonej przez właściwy organ krajowy.
Substancja pomocnicza o znanym działaniu:
Każdy 1 ml roztworu sodu nadtechnecjanu (99mTc) zawiera 3,6 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Generator radionuklidu
Eluowany roztwór jest klarownym i bezbarwnym roztworem sodu nadtechnecjanu (99mTc) o pH między 4,5 a 7,5.
Produkt leczniczy przeznaczony wyłącznie do diagnostyki.
Eluat otrzymywany z generatora radionuklidu (sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań) jest wskazany do:
Dawkowanie
Jeśli sodu nadtechnecjan (99mTc) jest podawany dożylnie, stosowane dawki radioaktywności mogą się znacznie różnić w zależności od wymaganych informacji klinicznych oraz stosowanej aparatury.
Podanie aktywności powyżej diagnostycznego poziomu referencyjnego dawek określonego przez lokalne przepisy (DRL) powinno być uzasadnione wskazaniami.
Zalecane dawki aktywności wynoszą:
Dorośli (70 kg) i osoby w podeszłym wieku:
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Możliwość wystąpienia nadwrażliwości lub reakcji anafilaktycznych
Jeżeli wystąpią reakcje nadwrażliwości lub reakcje anafilaktyczne, należy natychmiast przerwać podawanie produktu leczniczego i, jeżeli jest to konieczne, rozpocząć leczenie dożylne. W celu podjęcia natychmiastowego leczenia należy zapewnić dostępność niezbędnych produktów leczniczych i sprzętu, takiego jak rurka intubacyjna i respirator.
Uzasadnienie indywidualnego stosunku korzyści do ryzyka
U każdego pacjenta narażenie na promieniowanie jonizujące musi być uzasadnione w oparciu o spodziewane korzyści kliniczne. Podana dawka radioaktywności powinna być w każdym przypadku możliwie jak najniższa, a jednocześnie wystarczająca do uzyskania założonej informacji diagnostycznej.
Niewydolność nerek
Ze względu na możliwy wzrost narażenia na promieniowanie należy uważnie ocenić stosunek korzyści do ryzyka w tej grupie pacjentów.
Dzieci i młodzież
Informacje dotyczące stosowania produktu leczniczego u dzieci i młodzieży, patrz punkt 4.2.
Zasadność stosowania produktu leczniczego w tej grupie pacjentów należy dokładnie rozważyć, gdyż dawka skuteczna w przeliczeniu na 1 MBq jest wyższa niż w przypadku dorosłych (patrz punkt 11). Blokowanie czynności tarczycy jest szczególnie istotne w grupie dzieci i młodzieży, z wyjątkiem scyntygrafii tarczycy.
Przygotowanie pacjenta
W niektórych wskazaniach może być konieczne wstępne podanie środków blokujących czynność tarczycy.
Pacjent powinien być dobrze nawodniony przed rozpoczęciem badania oraz poinformowany o konieczności jak najczęstszego oddawania moczu w ciągu pierwszych godzin po podaniu produktu leczniczego, w celu usunięcia z organizmu substancji promieniotwórczych.
W celu zmniejszenia prawdopodobieństwa wyników fałszywie dodatnich i zminimalizowania narażenia na promieniowanie poprzez obniżenie wychwytu nadtechnecjanu przez tarczycę i gruczoły ślinowe konieczne jest blokowanie czynności tarczycy. Stosuje się je przy scyntygrafii kanalików łzowych oraz scyntygrafii uchyłku Meckela. NIE WOLNO stosować środków blokujących czynność tarczycy przed badaniem scyntygraficznym tarczycy, przytarczyc i gruczołów ślinowych.
Przed podaniem roztworu sodu nadtechnecjanu (99mTc) w scyntygrafii uchyłku Meckela pacjent powinien być na czczo przez 3 do 4 godzin, aby zmniejszyć perystaltykę jelit.
Po znakowaniu erytrocytów w warunkach in vivo z wykorzystaniem redukcji jonami cyny, sodu nadtechnecjan (99mTc) wbudowuje się głównie w erytrocyty. Dlatego scyntygrafię uchyłku Meckela należy przeprowadzać przed tym badaniem lub kilka dni po wyznakowaniu erytrocytów w warunkach in vivo.
Po badaniu
Pacjent powinien unikać kontaktu z małymi dziećmi i kobietami w ciąży przez 12 godzin po badaniu. Specjalne ostrzeżenia
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań zawiera 3,6 mg sodu na 1 ml roztworu.
W zależności od czasu podania ilość sodu otrzymanego przez pacjenta może w niektórych przypadkach przekraczać 1 mmol (23 mg). Należy to wziąć pod uwagę w przypadku pacjentów stosujących dietę niskosodową.
W sytuacji wykorzystywania roztworu sodu nadtechnecjanu (99mTc) do znakowania zestawów, podczas określania całkowitej zawartości sodu należy uwzględnić sód otrzymany z eluatu i zestawu. Należy zapoznać się z treścią ulotki załączonej do zestawu.
W scyntygrafii gruczołów ślinowych należy spodziewać się niższej swoistości metody w porównaniu do sialografii MR.
Środki ostrożności w odniesieniu do zagrożenia dla środowiska naturalnego, patrz punkt 6.6.
Atropina, izoprenalina i leki przeciwbólowe mogą powodować opóźnienie opróżniania żołądka i spowalniać redystrybucję nadtechnecjanu (99mTc) w obrazowaniu jamy brzusznej.
Należy unikać podawania środków przeczyszczających, gdyż powodują one podrażnienie przewodu pokarmowego. Należy unikać wykonywania badań z użyciem środka kontrastowego (np. siarczanu baru) i badań górnego odcinka przewodu pokarmowego w okresie 48 godzin przed podaniem nadtechnecjanu (99mTc) na potrzeby badania scyntygraficznego uchyłka Meckela.
Wiele produktów leczniczych ma znany wpływ zmieniający właściwości wychwytu przez tarczycę.
Kobiety w wieku rozrodczym
Przed podaniem radiofarmaceutyku kobiecie w wieku rozrodczym należy upewnić się, że nie jest ona w ciąży. Każdą kobietę, u której nie wystąpiła regularna miesiączka, należy do wykluczenia ciąży traktować jako kobietę w ciąży. W razie wątpliwości dotyczących możliwej ciąży (jeśli u kobiety nie wystąpiła miesiączka, jeśli miesiączki są bardzo nieregularne itp.) należy zaproponować pacjentce inne metody diagnostyczne, bez użycia promieniowania jonizującego (jeśli takie istnieją).
Ciąża
Podanie sodu nadtechnecjanu (99mTc) kobiecie, która jest w ciąży, dopuszcza się wyłącznie w sytuacji, gdy jest uzasadnione medycznymi przesłankami a spodziewane korzyści przewyższają ryzyko na jakie narażona jest matka i płód. Należy rozważyć alternatywne metody diagnostyczne, bez użycia promieniowania jonizującego.
99mTc (w postaci wolnego nadtechnecjanu) przechodzi przez barierę łożyskową. Karmienie piersią
Przed podaniem radiofarmaceutyku kobiecie karmiącej piersią należy rozważyć możliwość odroczenia podania radionuklidu do chwili zakończenia przez matkę karmienia piersią i wybrać najkorzystniejszy radiofarmaceutyk pod względem przenikania aktywności do mleka. Jeśli podanie radiofarmaceutyku zostanie uznane za konieczne, karmienie piersią należy przerwać na 12 godzin po podaniu produktu leczniczego, a pokarm wydzielony w tym czasie usunąć.
Pacjentka powinna unikać bliskiego kontaktu z dzieckiem w tym czasie.
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Informacje na temat działań niepożądanych pochodzą ze spontanicznych zgłoszeń. Odnotowano następujące rodzaje reakcji: reakcje anafilaktoidalne, reakcje wegetatywne oraz różne reakcje w miejscu podania.
Sodu nadtechnecjan (99mTc) otrzymywany z generatora radionuklidu Tekcis jest stosowany do znakowania różnych związków. Związki te charakteryzuje większe prawdopodobieństwo wywołania działań niepożądanych niż w przypadku sodu nadtechnecjanu 99mTc. Dlatego odnotowane działania niepożądane są raczej związane ze stosowaniem wyznakowanych związków niż z 99mTc. Możliwe rodzaje interakcji, jakie mogą wystąpić po dożylnym podaniu produktu leczniczego wyznakowanego roztworem nadtechnecjanu (99mTc) sodu, mogą być różne w zależności od użytej substancji.
Informacje te można znaleźć w Charakterystyce Produktu Leczniczego dołączonej do zestawu do sporządzania radiofarmaceutyku.
Tabelaryczna lista działań niepożądanych:
Częstość występowania działań niepożądanych klasyfikuje się następująco: nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia układu immunologicznego
Częstość nieznana*: reakcje anafilaktoidalne (np. duszność, śpiączka, pokrzywka, rumień, wysypka,
świąd, obrzęk różnych miejsc ciała np. obrzęk twarzy);
Zaburzenia układu nerwowego
Częstość nieznana*: reakcje wazowagalne (np. omdlenie, częstoskurcz, rzadkoskurcz, zawroty głowy, bóle głowy, niewyraźne widzenie, zaczerwienienie);
Zaburzenia żołądka i jelit
Częstość nieznana*: wymioty, nudności, biegunka;
Zaburzenia ogólne i stany w miejscu podania
Częstość nieznana*: reakcje w miejscu wstrzyknięcia (np. zapalenie tkanki łącznej, ból, rumień i obrzęk)
* Działania niepożądane pochodzące ze spontanicznych zgłoszeń.
Narażenie na promieniowanie jonizujące jest związane z indukcją nowotworów oraz możliwością rozwoju wad wrodzonych. Ponieważ dawka skuteczna wynosi 5,2 mSv, w związku z podaniem maksymalnej zalecanej dawki aktywności wynoszącej 400 MBq istnieje małe prawdopodobieństwo wystąpienia tych działań niepożądanych.
Opis wybranych działań niepożądanych
Reakcje anafilaktyczne (np. duszność, śpiączka, pokrzywka, rumień, wysypka, świąd, obrzęk różnych miejsc ciała [np. obrzęk twarzy])
Obserwowano reakcje anafilaktyczne po podaniu dożylnym sodu nadtechnecjanu (99mTc), które dotyczyły różnych zmian skórnych lub problemów w oddychaniu, np. podrażnienie skóry, obrzęk lub duszność.
Reakcje wegetatywne (układu nerwowego i zaburzenia żołądkowo-jelitowe)
Odnotowano pojedyncze przypadki ciężkich reakcji wegetatywnych, jednak większość zgłaszanych reakcji wegetatywnych to reakcje ze strony przewodu pokarmowego, takie jak nudności lub wymioty. Inne to reakcje wazowagalne, takie jak ból lub zawroty głowy. Reakcje wegetatywne uważane są raczej za związane ze świadomością pacjenta, że jest poddawany badaniu, niż z samym zastosowaniem technetu (99mTc); dotyczy to szczególnie pacjentów odczuwających lęk.
Zaburzenia ogólne i stany w miejscu podania
Inne zgłoszenia opisują miejscowe reakcje w miejscu wstrzyknięcia. Reakcje w miejscu wstrzyknięcia są związane z wynaczynieniem roztworu radiofarmaceutyku podczas wstrzykiwania i mogą przybierać postać od lokalnego obrzęku do zapalenia tkanki łącznej. W zależności od podanej radioaktywności i znakowanego związku rozległe wynaczynienie może wymagać leczenia chirurgicznego.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem:
Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C
PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
W przypadku przedawkowania radioaktywności sodu nadtechnecjanu (99mTc) należy dążyć do obniżenia dawki pochłoniętej przez pacjenta poprzez przyspieszenie wydalania radionuklidu z organizmu poprzez częste wypróżnienia, wymuszoną diurezę i oddawanie moczu.
Wychwyt przez tarczycę, ślinianki i śluzówkę przewodu pokarmowego może być znacznie zmniejszony, gdy po przypadkowym podaniu wysokich dawek sodu nadtechnecjanu (99mTc) natychmiast poda się nadchloran sodu lub potasu.
Grupa farmakoterapeutyczna: Różne środki radiofarmaceutyczne stosowane w diagnostyce tarczycy, kod ATC: V09FX01.
W zakresie diagnostycznie stosowanych dawek nie zaobserwowano aktywności farmakologicznej.
Dystrybucja
Jon nadtechnecjanowy ma podobną dystrybucję biologiczną do jonu jodowego i nadchloranowego - gromadzi się przejściowo w śliniankach, splocie naczyniówkowym, śluzówce żołądka oraz tarczycy. Jest uwalniany z tych narządów w niezmienionej postaci. Jon nadtechnecjanowy gromadzi się w obszarach o bogatym unaczynieniu lub w miejscach, gdzie naczynia mają nieprawidłową przepuszczalność. Dzieje się tak szczególnie wtedy, gdy wcześniej podane pacjentowi środki blokują pobieranie produktu leczniczego przez struktury gruczołowe. Przy nienaruszonej barierze krew-mózg sodu nadtechnecjan (99mTc) nie przechodzi do tkanki mózgowej.
Wychwyt przez narządy
We krwi 70–80% wstrzykniętego dożylnie sodu nadtechnecjanu (99mTc) wiąże się z białkami, głównie w sposób niespecyficzny z albuminami. Wolne frakcje (20–30%) gromadzone są czasowo w tarczycy i gruczołach ślinowych, żołądku i błonie śluzowej nosa, a także w splocie naczyniówkowym.
W przeciwieństwie do jodu, sodu nadtechnecjanu (99mTc) nie jest wykorzystywany do syntezy hormonów tarczycy (organifikacja) ani nie wchłania się w jelicie cienkim. Maksymalny poziom akumulacji w tarczycy, w zależności od statusu czynnościowego i nasycenia jodem (w eutyreozie ok. 0,3–3%, w nadczynności tarczycy i zaburzeniach z niedoboru jodu do 25%) jest osiągany po ok.
20 minutach od wstrzyknięcia, a następnie szybko maleje. Dotyczy to również komórek przyściennych błony śluzowej żołądka oraz komórek groniastych ślinianek.
W przeciwieństwie do tarczycy, która uwalnia sodu nadtechnecjan (99mTc) do krwi, gruczoły ślinowe i
żołądek wydzielają sodu nadtechnecjan (99mTc) odpowiednio do śliny i soków żołądkowych. Akumulacja w gruczołach ślinowych jest na poziomie 0,5% podanej aktywności. Przy czym maksymalny poziom osiągnięty jest po około 20 minutach. Po godzinie od wstrzyknięcia stężenie w ślinie jest od około 10- do 30-krotnie większe niż w osoczu. Wydzielanie można przyspieszyć poprzez podanie soku z cytryny lub stymulację przywspółczulnego układu nerwowego.
Eliminacja
Okres półtrwania w osoczu wynosi około 3 godziny. Sodu nadtechnecjan (99mTc) nie jest metabolizowany w organizmie. Jedna frakcja jest wydalana przez nerki bardzo szybko, reszta wolniej z kałem, śliną i płynem łzowym. Przez pierwsze 24 godziny od podania związek jest wydalany głównie z moczem (około 25%), przez następne 48 godzin - z kałem. Około 50% dawki jest wydalane w czasie 50 godzin od podania. Jeśli podano wcześniej produkt blokujący wychwyt nadtechnecjanu (99mTc) przez narządy gruczołowe, wydalanie odbywa się w sposób opisany powyżej, klirens nerkowy jest jednak wyższy.
Powyższe dane nie dotyczą zastosowania sodu nadtechnecjanu (99mTc) do znakowania innych radiofarmaceutyków.
Brak danych dotyczących ostrej, podostrej oraz przewlekłej toksyczności po podaniu pojedynczej dawki oraz dawek wielokrotnych. Ilość sodu nadtechnecjanu (99mTc) podawanego podczas badań diagnostycznych jest bardzo mała. Nie obserwowano innych reakcji poza alergicznymi.
Produkt leczniczy nie jest przeznaczony do regularnego ani ciągłego stosowania.
Nie prowadzono badań mutagenności ani długoterminowych badań dotyczących działania rakotwórczego.
Toksyczność reprodukcyjna:
Stopień przechodzenia 99mTc z podanego dożylnie roztworu sodu nadtechnecjanu (99mTc) przez łożysko badano u myszy. Jeśli nie podano wcześniej nadchlorku, w ciężarnej macicy gromadziło się nawet 60% podanej dawki 99mTc. Badania prowadzone u myszy ciężarnych, w trakcie ciąży, w ciąży i karmiących oraz tylko karmiących wykazały zmiany u potomstwa, takie jak zmniejszenie masy ciała, brak owłosienia oraz bezpłodność.
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 12.
Generator: 21 dni od daty wytworzenia.
Data kalibracji i termin ważności są podane na etykiecie.
Eluat sodu nadtechnecjanu (99mTc): po elucji zużyć w ciągu 10 godzin do 10 pobrań Ten produktu leczniczy nie wymaga żadnych specjalnych warunków przechowywania. Fiolki do elucji: 24 miesiące.
Generator: Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. Eluat: warunki przechowywania produktu leczniczego po elucji patrz punkt 6.3.
Fiolki do elucji: Nie przechowywać w temperaturze powyżej 25°C.
Radiofarmaceutyki należy przechowywać zgodnie z obowiązującymi przepisami dotyczącymi materiałów radioaktywnych.
Generator TEKCIS jest dostarczany w pojemniku transportowym typu A. Składa się z:
Ogólne ostrzeżenia
Radiofarmaceutyk może być otrzymywany, używany i podawany chorym tylko przez osoby mające odpowiednie uprawnienia, w wyznaczonych do tego placówkach klinicznych. Otrzymywanie, magazynowanie, użycie, przenoszenie i utylizacja podlegają przepisom i (lub) odpowiednim licencjom właściwych organizacji.
Radiofarmaceutyki powinny być przygotowywane w sposób odpowiedni do wymagań dotyczących zarówno zasad bezpieczeństwa radiologicznego, jak i jakości farmaceutyków. Powinno zapewnić się odpowiednie warunki aseptyczne.
Nie należy stosować generatora lub fiolki z eluatem, jeżeli zauważy się jakiekolwiek ślady uszkodzenia.
Produkt leczniczy należy podawać w taki sposób, aby zminimalizować ryzyko zanieczyszczenia produktu leczniczego i napromieniowania osoby go podającej. Konieczne jest stosowanie odpowiednich osłon.
Podawanie chorym radioaktywnych produktów leczniczych stwarza niebezpieczeństwo skażenia dla osób postronnych, np. moczem lub wymiocinami pacjenta. Należy zatem przestrzegać zasad ochrony radiologicznej zgodnych z obowiązującymi przepisami krajowymi.
Przed utylizacją generatora należy określić jego pozostałą radioaktywność.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
CIS bio international Route Nationale 306
BP 32 SACLAY
F-91192 Gif-sur-Yvette Cedex Francja
Pozwolenie nr:
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:
Dane wymienione poniżej pochodzą z ICRP 80 i są obliczane według następujących założeń:
Narząd | Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq], gdy pacjent otrzymał produkt blokujący | ||||
Dorośli | 15 lat | 10 lat | 5 lat | 1 lat | |
Nadnercza | 0,0029 | 0,0037 | 0,0056 | 0,0086 | 0,016 |
Ściana pęcherza moczowego | 0,030 | 0,038 | 0,048 | 0,050 | 0,091 |
Powierzchnia kości | 0,0044 | 0,0054 | 0,0081 | 0,012 | 0,022 |
Mózg | 0,0020 | 0,0026 | 0,0042 | 0,0071 | 0,012 |
Sutki | 0,0017 | 0,0022 | 0,0032 | 0,0052 | 0,010 |
Pęcherzyk żółciowy | 0,0030 | 0,0042 | 0,0070 | 0,010 | 0,013 |
Przewód pokarmowy | |||||
- Ściana żołądka | 0,0027 | 0,0036 | 0,0059 | 0,0086 | 0,015 |
- Jelito cienkie | 0,0035 | 0,0044 | 0,0067 | 0,010 | 0,018 |
- Okrężnica | 0,0036 | 0,0048 | 0,0071 | 0,010 | 0,018 |
- Ściana okrężnicy wstępującej | 0,0032 | 0,0043 | 0,0064 | 0,010 | 0,017 |
- Ściana okrężnicy zstępującej | 0,0042 | 0,0054 | 0,0081 | 0,011 | 0,019 |
Serce | 0,0027 | 0,0034 | 0,0052 | 0,0081 | 0,014 |
Nerki | 0,0044 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Wątroba | 0,0026 | 0,0034 | 0,0053 | 0,0082 | 0,015 |
Płuca | 0,0023 | 0,0031 | 0,0046 | 0,0074 | 0,013 |
Mięśnie | 0,0025 | 0,0031 | 0,0047 | 0,0072 | 0,013 |
Przełyk | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Jajniki | 0,0043 | 0,0054 | 0,0078 | 0,011 | 0,019 |
Trzustka | 0,0030 | 0,0039 | 0,0059 | 0,0093 | 0,016 |
Szpik kostny | 0,0025 | 0,0032 | 0,0049 | 0,0072 | 0,013 |
Skóra | 0,0016 | 0,0020 | 0,0032 | 0,0052 | 0,0097 |
Śledziona | 0,0026 | 0,0034 | 0,0054 | 0,0083 | 0,015 |
Jądra | 0,0030 | 0,0040 | 0,0060 | 0,0087 | 0,016 |
Grasica | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Tarczyca | 0,0024 | 0,0031 | 0,0050 | 0,0084 | 0,015 |
Macica | 0,0060 | 0,0073 | 0,011 | 0,014 | 0,023 |
Pozostałe tkanki | 0,0025 | 0,0031 | 0,0048 | 0,0073 | 0,013 |
Dawka skuteczna (mSv/MBq) | 0,0042 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Dawka skuteczna po podaniu dożylnym 400 MBq sodu nadtechnecjanu (99mTc) dorosłemu pacjentowi o masie ciała 70 kg wynosi 5,2 mSv.
Po zastosowaniu produktu o właściwościach blokujących i podaniu 400 MBq sodu
nadtechnecjanu (99mTc) dorosłemu pacjentowi o masie ciała 70 kg dawka skuteczna wynosi 1,7 mSv.
Dawka promieniowania pochłonięta przez soczewkę oka po podaniu sodu nadtechnecjanu (99mTc) celem wykonania scyntygrafii kanałów łzowych jest szacowana na 0,038 mGy/MBq. Podanie aktywności wynoszącej 4 MBq powoduje pochłonięcie dawki skutecznej nieprzekraczającej 0,01 mSv.
Podane dawki promieniowania mają zastosowanie w przypadku, kiedy narządy pochłaniające sodu nadtechnecjan (99mTc) funkcjonują prawidłowo. Nadczynność/niedoczynność (np. tarczycy, błony śluzowej żołądka i nerek) oraz długotrwałe procesy z zaburzeniem bariery krew-mózg lub upośledzeniem eliminacji przez nerki mogą prowadzić do zmian w narażeniu na promieniowanie, prowadząc lokalnie do jego bardzo znacznego wzrostu.
Narażenie na promieniowanie zewnętrzne
Moc dawki 99Mo-99mTc na powierzchni generatora (μSv/h.GBq) | Moc dawki 99Mo-99mTc w odległości 1 m od generatora (μSv/h.GBq) | |
Osłona ołowiana 41 mm | 16 | 0,3 |
Dawki powierzchniowe i dawka skumulowana zależą od wielu czynników. Ogólnie rzecz biorąc, pomiar promieniowania w otoczeniu i podczas pracy ma kluczowe znaczenie i powinien być wykonywany.
Elucję generatora należy przeprowadzać w pomieszczeniach zgodnych z krajowymi przepisami dotyczącymi bezpieczeństwa użytkowania produktów radioaktywnych.
Eluat jest przezroczystym i bezbarwnym roztworem nadtechnecjanu sodu (99mTc) o pH między 4,5 a 7,5 i czystości radiochemicznej równej lub większej niż 95%.
Jeżeli roztwór sodu nadtechnecjanu (99mTc) jest zastosowany do znakowania zestawu, należy zapoznać się z ulotką dołączoną do opakowania tego zestawu.
Przygotowanie
Zdezynfekować korek fiolek do elucji przed każdą elucją. Uwaga:
Nie używać etanolu ani eteru etylowego do dezynfekcji korka fiolki do elucji, ponieważ może to zakłócać proces elucji.
Podczas transportu sterylność igły elucyjnej chroni nasadka.
Chronić igłę do elucji przed możliwym zanieczyszczeniem bakteryjnym, umieszczając fiolkę ochronną na igle między dwoma eluatami.
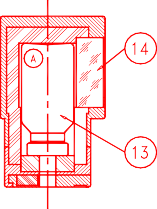
Przestrzegać następującej sekwencji, aby uzyskać zadowalające wyniki:
Pierwsza elucja:
Używając generatora po raz pierwszy, OTWORZYĆ zawór bezpieczeństwa (10) do pozycji ON PRZED podłączeniem fiolki do elucji. Nigdy nie zamykać zaworu bezpieczeństwa pomiędzy dwoma eluatami. Zawór bezpieczeństwa zamykać dopiero na czas utylizacji generatora.
Aby eluować generator, nałożyć nasadkę lub fiolkę ochronną na pojemnik do elucji (A) zawierający fiolkę próżniową do elucji (oznaczoną „TC-ELU”) odpowiadającą żądanej objętości elucji (13).
Elucję można obserwować przez okienko ze szkła ołowiowego (14) pojemnika (A). Odczekać dwie minuty do pełnej elucji.
Przed użyciem sprawdzić klarowność eluatu i wyrzucić, jeśli roztwór nie jest przejrzysty. Po elucji natychmiast założyć fiolkę ochronną na igłę, aby zachować jej sterylność.
Objętości elucji:
Tekcis to generator opracowany do elucji całej dostępnej aktywności technetu-99m w objętości 5 ml. Elucje frakcjonowane są zatem niepotrzebne. Można jednak przeprowadzić elucje do większych objętości: 10 ml lub 15 ml.
Możliwości zastosowania:
Aktywność podana na etykiecie generatora wyrażona jest w technecie-99m, dostępnym na dzień kalibracji (12:00 CET).
Dostępność technetu-99m zależy od:
aktywności molibdenu-99 w momencie elucji;
czasu od ostatniej elucji. Kontrola jakości
Radioaktywność oraz tzw. „przebicie” molibdenu (99Mo) muszą być sprawdzone przed użyciem.
Sprawdzenie „przebicia” molibdenu (99Mo) może być przeprowadzone zgodnie z Farmakopeą Europejską lub też każdą inną zwalidowaną metodą umożliwiającą określenie zawartości molibdenu (99Mo) poniżej 0,1% całkowitej radioaktywności na dzień i godzinę podania.
Masa technetu (99mTc + 99Tc) obecnego w eluacie:
Molibden-99 jest przekształcany w technet-99m (87,6% całego rozpadu molibdenu-99) i technet-99 (12,4% całego rozpadu molibdenu-99). Całkowitą masę technetu ((99mTc) + (99Tc)) wyrażoną w µg technetu obecnego w eluacie można obliczyć według następującego uproszczonego wzoru:
M(µg) = aktywność technetu-99m w eluacie x k
F
k = 5,161,10-3 (aktywność wyrażona w GBq)
F to stosunek liczby atomów technetu-99m (N99m) do całkowitej liczby atomów technetu (Nt): F = N99m
Nt
Wartości tego stosunku (F) w funkcji odstępu między dwoma elucjami przedstawia poniższa tabela:
Godziny
Dni
0
1
2
3
4
5
6
0
-
0,277
0,131
0,076
0,0498
0,0344
0,0246
3
0,727
0,248
0,121
0,072
0,0474
0,0329
0,0236
6
0,619
0,223
0,113
0,068
0,0452
0,0315
0,0227
9
0,531
0,202
0,105
0,064
0,0431
0,0302
0,0218
12
0,459
0,184
0,098
0,061
0,0411
0,0290
0,0210
15
0,400
0,168
0,092
0,058
0,0393
0,0278
0,0202
18
0,352
0,154
0,086
0,055
0,0375
0,0266
0,0194
21
0,311
0,141
0,081
0,052
0,0359
0,0256
0,0187
Przykłady:
Technet-99m z generatora jest eluowany do objętości 5 ml; zmierzona aktywność wynosi 10 GBq; poprzednią elucję przeprowadzono 27 godzin wcześniej.
Masa technetu wynosi:
M(µg) = 10 x 5,161,10-3 = 0,208 µg
0,248
tzn: 0,042 µg/mL
Technet-99m z generatora jest eluowany 4 dni po przygotowaniu (co odpowiada pierwszej elucji). Dla aktywności 10 GBq w 5 ml eluatu masa technetu wynosi:
M(µg) = 10 x 5,161,10-3 = 1,036 µg
0,0498
tzn: 0,207 µg/ml, czyli pięć razy więcej technetu niż w poprzednim przykładzie. Ta ilość technetu, mimo iż jest niewielka, może wpływać na wydajność znakowania niektórych związków.
Pierwszy eluat uzyskany z tego generatora może być normalnie używany, o ile nie określono inaczej. Eluaty eluowane nawet później niż 24 godziny od ostatniej elucji mogą być użyte do znakowania zestawu, o ile nie jest to wykluczone w ChPL odpowiedniego zestawu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
OZNAKOWANIE OPAKOWAŃ
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH
Generator
1. NAZWA PRODUKTU LECZNICZEGO
TEKCIS, 2-50 GBq, generator radionuklidu
natrii pertechnetatis (99mTc) fissione formati solutio iniectabilis
2. ZAWARTOŚĆ SUSBSTANCJI CZYNNEJ
Sodu nadtechnecjan (99mTc): aktywność generatora określona na dzień kalibracji. Aktywność 99mTc: GBq określona na dzień kalibracji (12:00 CET)
Aktywność 99mTc: GBq określona na dzień wytworzenia (12:00 CET)
3. WYKAZ SUBSTANCJI POMOCNICZYCH
Substancje pomocnicze: sodu chlorek, sodu azotan i woda do wstrzykiwań.
4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
Generator radionuklidu. Dawkowanie wielokrotne
3
6
6
1
5
4
1
1
0
0
4
0
5
Kod:
5. SPOSÓB I DROGI PODANIA
Podanie dożylne lub do oka.
Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
6.
OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI
7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
Produkt leczniczy radiofarmaceutyczny. Symbol radioaktywności
8. TERMIN WAŻNOŚCI
EXP {DD/MM/RRRR} (12:00 CET)
Po elucji zużyć w ciągu 10 godzin, maksymalnie do 10 pobrań.
9. SPECJALNE WARUNKI PRZECHOWYWANIA
10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI WŁAŚCIWE
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy przechowywać i usunąć zgodnie z lokalnymi przepisami.
11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
Podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu / Wytwórca
CIS bio international
F-91192 Gif-sur-Yvette Cedex
12. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr:
13. NUMER SERII
Nr serii (Lot):
14. OGÓLNA KATEGORIA DOSTĘPNOŚCI
Rpz - Lek wydawany na receptę.
15. INSTRUKCJA UŻYCIA
16. INFORMACJA PODANA SYSTEMEM BRAILLE’A
Zaakceptowano uzasadnienie braku informacji systemem Braille’a.
17. NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
Nie dotyczy.
18. NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
Nie dotyczy.
MINIMUM INFORMACJI ZAMIESZCZANYCH NA MAŁYCH OPAKOWANIACH BEZPOŚREDNICH
Sterylna szklana fiolka próżniowa
1. NAZWA PRODUKTU LECZNICZEGO I DROGA PODANIA
TC-ELU
2. SPOSÓB PODAWANIA
3. TERMIN WAŻNOŚCI
MM/RRRR
4. NUMER SERII<, KODY DONACJI I PRODUKTU>
LOT
5.
ZAWARTOŚĆ OPAKOWANIA Z PODANIEM MASY, OBJĘTOŚCI LUB LICZBY JEDNOSTEK
Poziom elucji w zależności od użytej fiolki: 5
6. INNE
STERILE
Cis bio international
ULOTKA DLA PACJENTA
Ulotka dołączona do opakowania: informacja dla pacjenta
TEKCIS, 2-50 GBq, generator radionuklidu
natrii pertechnetatis (99mTc) fissione formati solutio iniectabilis
Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza medycyny nuklearnej, który będzie nadzorował zabieg.
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi medycyny nuklearnej. Patrz punkt 4.
Spis treści ulotki
Co to jest lek TEKCIS i w jakim celu się go stosuje
gruczoł tarczycy
gruczoły ślinowe
tkanka żołądka pojawiająca się w nieprawidłowym miejscu (uchyłek Meckela)
kanaliki łzowe oczu.
Roztwór nadtechnecjanu sodu (99mTc) może być również stosowany w skojarzeniu z innym produktem do przygotowania innego leku radiofarmaceutycznego. W takiej sytuacji patrz odnośna ulotka dołączona do opakowania.
Lekarz medycyny nuklearnej wyjaśni pacjentowi charakter badania, które zostanie przeprowadzone z zastosowaniem tego produktu.
Stosowanie roztworu nadtechnecjanu sodu (99mTc) wiąże się z ekspozycją na niewielkie ilości radioaktywności. Lekarz prowadzący i lekarz medycyny nuklearnej uznali, że korzyści kliniczne, jakie pacjent odniesie z zabiegu z użyciem radiofarmaceutyku, przewyższają ryzyko związane z promieniowaniem.
Tekcis jest produktem radiofarmaceutycznym stosowanym wyłącznie do celów diagnostycznych.
Tekcis jest generatorem technetu (99mTc), co oznacza, że jest to urządzenie stosowane do uzyskania roztworu do wstrzykiwań nadtechnecjanu sodu (99mTc). Kiedy radioaktywny roztwór zostaje wstrzyknięty do organizmu, tymczasowo gromadzi się on w niektórych częściach ciała. Niewielką ilość podanych związków promieniotwórczych można wykryć spoza organizmu z użyciem specjalnych kamer. Lekarz medycyny nuklearnej następnie wykona zdjęcie (skan) danego narządu, co dostarczy mu cennych informacji na temat struktury i czynności tego narządu.
Po wstrzyknięciu roztwór nadtechnecjanu sodu (99mTc) służy do uzyskania obrazów różnych części ciała, takich jak:
Informacje ważne przed zastosowaniem roztworu nadtechnecjanu sodu (99mTc) uzyskanego z użyciem leku TEKCIS
Kiedy nie stosować roztworu nadtechnecjanu sodu (99mTc) uzyskanego z użyciem leku Tekcis
jeśli pacjent ma uczulenie na nadtechnecjan sodu (99mTc) lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Ostrzeżenia i środki ostrożności
Należy poinformować lekarza medycyny nuklearnej, jeśli:
pacjent ma uczulenia, ponieważ po podaniu roztworu nadtechnecjanu sodu (99mTc) zaobserwowano kilka przypadków reakcji alergicznych,
pacjent choruje na chorobę nerek,
pacjentka jest w ciąży lub przypuszcza, że może być w ciąży,
pacjentka karmi piersią.
Lekarz medycyny nuklearnej poinformuje pacjenta, czy konieczne jest podjęcie specjalnych środków ostrożności po zastosowaniu tego leku. W przypadku wątpliwości należy skonsultować się z lekarzem medycyny nuklearnej.
Przed podaniem roztworu nadtechnecjanu sodu (99mTc) pacjent powinien:
pić dużo wody przed rozpoczęciem badania, aby jak najczęściej oddawać mocz podczas pierwszych godzin po badaniu.
być na czczo przez 3 do 4 godzin przed scyntygrafią uchyłka Meckela, aby utrzymać
możliwie powolną pracę jelita cienkiego.
Dzieci i młodzież
Osoby w wieku poniżej 18 lat lub rodzice takich osób powinni porozumieć się z lekarzem medycyny nuklearnej.
Roztwór nadtechnecjanu sodu (99mTc) a inne leki
Należy powiedzieć lekarzowi medycyny nuklearnej o wszystkich lekach przyjmowanych przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować, ponieważ mogą one utrudniać interpretację zdjęć. W szczególności dotyczy to następujących leków:
atropina, używana np. do:
zmniejszenia skurczów żołądka, jelit lub pęcherzyka żółciowego,
zmniejszenia wydzieliny trzustki,
w okulistyce,
przed podaniem znieczulenia,
w leczeniu spowolnionego bicia serca lub
jako antidotum
izoprenalina, lek stosowany w leczeniu spowolnionego bicia serca
leki przeciwbólowe
środki przeczyszczające (nie należy ich stosować podczas tego zabiegu, gdyż podrażniają przewód pokarmowy)
jeśli pacjent przechodził badania z kontrastem (np. z użyciem środka kontrastowego z barem) lub badanie górnego odcinka przewodu pokarmowego (ponieważ należy ich unikać na 48 godzin przed scyntygrafią uchyłka Meckela)
leki przeciwtarczycowe (np. karbimazol lub inne pochodne imidazolu, takie jak
propylotiouracyl, salicylany, steroidy, nitroprusydek sodu, sulfobromoftaleina sodu, nadchloran) (nie należy ich przyjmować na 1 tydzień przed scyntygrafią)
fenylobutazon w leczeniu gorączki, bólu i stanów zapalnych w organizmie (nie należy go
przyjmować na 2 tygodnie przed scyntygrafią)
środki wykrztuśne (nie należy ich przyjmować na 2 tygodnie przed scyntygrafią)
preparaty zawierające naturalne lub syntetyczne hormony tarczycy (np. tyroksyna sodowa, liotyronina sodowa, ekstrakt z tarczycy) (nie należy ich przyjmować przez 2-3 tygodnie przed scyntygrafią)
amiodaron - lek przeciwarytmiczny (nie należy go przyjmować przez 4 tygodnie przed
scyntygrafią)
benzodiazepiny stosowane np. w sedacji lub jako leki przeciwlękowe, przeciwdrgawkowe lub zwiotczające mięśnie lub związki litu stosowane jako stabilizator nastroju w chorobie maniakalno-depresyjnej (ponieważ obu nie należy przyjmować na 4 tygodnie przed scyntygrafią)
jodkowe środki kontrastowe do badań radiologicznych organizmu (ponieważ nie powinny być
podawane na 1-2 miesiące przed scyntygrafią)
Przed zażyciem jakichkolwiek leków należy zapytać lekarza medycyny nuklearnej.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub gdy planuje mieć dziecko, powinna poradzić się lekarza medycyny nuklearnej przed otrzymaniem tego leku.
Pacjentka musi poinformować lekarza medycyny nuklearnej przed otrzymaniem roztworu nadtechnecjanu sodu (99mTc), jeśli istnieje możliwość, że jest w ciąży, jeśli opóźnia się jej miesiączka lub jeśli karmi piersią. W przypadku wątpliwości należy skonsultować się z lekarzem medycyny nuklearnej, który będzie nadzorował procedurę.
Jeśli pacjentka jest w ciąży, lekarz medycyny nuklearnej poda lek w czasie ciąży wyłącznie, jeśli oczekiwana korzyść z badania znacznie przewyższa ryzyko.
Jeśli pacjentka karmi piersią, powinna poinformować o tym lekarza medycyny nuklearnej, ponieważ zaleci on zaprzestanie karmienia do czasu wyeliminowania radioaktywności z organizmu. Trwa to około 12 godzin. Wydzielone w tym czasie mleko należy wyrzucić. Wznowienie karmienia piersią należy uzgodnić ze specjalistą medycyny nuklearnej, który będzie nadzorował badanie.
Prowadzenie pojazdów i obsługiwanie maszyn
Roztwór nadtechnecjanu sodu (99mTc) nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Roztwór nadtechnecjanu sodu zawiera sód
Roztwór nadtechnecjanu sodu zawiera 3,6 mg/ml sodu. W zależności od wstrzykniętej objętości może zostać przekroczony limit 1 mmol (23 mg) sodu na podaną dawkę. Należy to wziąć pod uwagę, jeśli pacjent jest na diecie o niskiej zawartości soli.
Jak stosuje się roztwór nadtechnecjanu sodu (99mTc) uzyskany z użyciem leku TEKCIS
Istnieją surowe przepisy dotyczące stosowania, obchodzenia się i usuwania produktów radiofarmaceutycznych. Tekcis będzie stosowany wyłącznie w specjalnych kontrolowanych obszarach. Produkt będą przygotowywały i podawały pacjentowi wyłącznie osoby, które są przeszkolone i wykwalifikowane do tego, by zrobić to w bezpieczny sposób. Osoby te dołożą wszelkich starań, by stosować produkt w bezpieczny sposób i by informować pacjenta o podejmowanych działaniach.
Lekarz medycyny nuklearnej nadzorujący procedurę zdecyduje o ilości roztworu nadtechnecjanu sodu (99mTc) do zastosowania w danym przypadku. Będzie to najmniejsza dawka niezbędna do uzyskania oczekiwanych informacji.
Ilość zwykle zalecana do podania osobom dorosłym w zależności od rodzaju wykonywanego badania wynosi od 2 do 400 MBq (megabekerel, jednostka używana do wyrażania radioaktywności).
Stosowanie u dzieci i młodzieży
U dzieci i młodzieży podawana ilość będzie dostosowana do masy ciała.
Podanie roztworu nadtechnecjanu sodu (99mTc) i przeprowadzenie badania
W zależności od celu badania produkt będzie podawany we wstrzyknięciu do żyły ramiennej lub może być wkroplony do oczu w postaci kropli.
Do przeprowadzenia badania potrzebnego lekarzowi wystarczy jedno podanie.
Czas trwania procedury
Lekarz medycyny nuklearnej poinformuje pacjenta o tym, jak długo zwykle trwa procedura.
Skany można wykonywać w dowolnym momencie, od momentu wstrzyknięcia i do 24 godzin po podaniu, w zależności od rodzaju badania.
Po podaniu roztworu nadtechnecjanu sodu (99mTc) pacjent powinien:
unikać bliskiego kontaktu z małymi dziećmi i kobietami w ciąży przez 12 godzin po wstrzyknięciu,
często oddawać mocz, aby usuwać produkt z organizmu,
po podaniu roztworu pacjent otrzyma napój i zostanie poproszony o oddanie moczu bezpośrednio przed badaniem.
Lekarz medycyny nuklearnej poinformuje pacjenta, czy konieczne jest podjęcie specjalnych środków ostrożności po otrzymaniu tego leku. W przypadku wszelkich pytań należy się skontaktować z lekarzem medycyny nuklearnej.
Zastosowanie większej niż zalecana dawki roztworu nadtechnecjanu sodu (99mTc) uzyskanego za pomocą leku Tekcis:
Przedawkowanie jest prawie niemożliwe, ponieważ pacjent otrzyma tylko pojedynczą dawkę roztworu nadtechnecjanu sodu (99mTc) dokładnie kontrolowaną przez lekarza medycyny nuklearnej nadzorującego procedurę. Jednak w przypadku przedawkowania pacjent otrzyma odpowiednie leczenie. W szczególności lekarz medycyny nuklearnej odpowiedzialny za zabieg może zalecić picie dużej ilości płynów w celu usunięcia śladów radioaktywności z organizmu.
W przypadku pytań dotyczących stosowania tego produktu należy zwrócić się do lekarza medycyny
nuklearnej, który nadzoruje procedurę.
Możliwe działania niepożądane
reakcje alergiczne z objawami, takimi jak
wysypka skórna, swędzenie
pokrzywka
obrzęki w różnych miejscach, m.in. twarzy
brak tchu (krótki, płytki oddech)
zaczerwienienie skóry
śpiączka
reakcje krążeniowe z objawami, takimi jak:
szybkie bicie serca, wolne bicie serca
omdlenie
nieostre widzenie
zawroty głowy
ból głowy
uderzenia gorąca z zaczerwienieniem skóry
zaburzenia ze strony przewodu pokarmowego z objawami, takimi jak
wymioty
nudności (mdłości)
biegunka
reakcje w miejscu wkłucia z objawami, takimi jak
stan zapalny skóry
ból
obrzęk (spuchnięcie)
zaczerwienienie.
Ten produkt radiofarmaceutyczny będzie dostarczał niewielkie ilości promieniowania jonizującego, co wiąże się z jak najmniejszym ryzykiem zachorowania na raka i wystąpienia dziedzicznych nieprawidłowości.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać bezpośrednio do:
Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Działania niepożądane o nieznanej częstości (na podstawie dostępnych danych nie można ustalić częstości):
Jak przechowywać lek TEKCIS
Pacjent nie będzie przechowywał tego produktu. Specjalista w danym zakładzie medycyny nuklearnej jest odpowiedzialny za jego przechowywanie. Przechowywanie produktów radiofarmaceutycznych będzie odbywało się zgodnie z krajowymi przepisami dotyczącymi przechowywania materiałów radioaktywnych.
Zawartość opakowania i inne informacje Co zawiera lek TEKCIS
Substancją czynną jest roztwór sodu nadtechnecjanu (99mTc).
Pozostałe składniki to: sodu chlorek, sodu azotan i woda do wstrzykiwań.
Jak wygląda lek TEKCIS i co zawiera opakowanie
Produktem jest roztwór sodu nadtechnecjanu (99mTc) otrzymywany z generatora radionuklidu. TEKCIS należy eluować, a otrzymany roztwór może być użyty sam lub do radioznakowania niektórych konkretnych zestawów do przygotowania radiofarmaceutyku.
Wielkość opakowań:
aktywność 99mTc
(maksymalna teoretyczna aktywność elucyjna na dzień
kalibracji, godz. 12 CET)
2
4
6
8
10
12
16
20
25
50
GBq
aktywność 99Mo
(na dzień kalibracji, godz. 12 CET)
2,5
5
7
9,5
12
14,5
19
24
30
60
GBq
Podmiot odpowiedzialny i wytwórca
CIS bio international Route Nationale306 BP 32 SACLAY
F-91192 Gif-sur-Yvette Cedex Francja
E-mail: drugsafety@curiumpharma.com, Tel: +33 1.69.85.76.76.
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru Gospodarczego pod następującymi nazwami:
Austria, Belgia, Bułgaria, Cypr, Chorwacja, Dania, Estonia, Finlandia, Francja, Niemcy, Grecja, Węgry, Irlandia, Włochy, Łotwa, Litwa, Luksemburg, Malta, Holandia, Norwegia, Polska, Portugalia, Rumunia, Słowacja, Słowenia, Hiszpania, Szwecja, Wielka Brytania: TEKCIS
Czechy: Technecistan-(99mTc) sodný CIS bio international
Data ostatniej aktualizacji ulotki:
Inne źródła informacji
Szczegółowe informacje o tym leku znajdują się na stronie internetowej Departament Rejestracji Produktów Leczniczych (https://rejestrymedyczne.ezdrowie.gov.pl/rpl/search/public)
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Kompletna ChPL produktu leczniczego Tekcis jest dostarczana jako osobny dokument w opakowaniu produktu w celu dostarczenia fachowemu personelowi medycznemu innych dodatkowych informacji naukowych i praktycznych na temat podawania i stosowania tego radiofarmaceutyku.
Proszę zapoznać się z ChPL (powinna znajdować się w opakowaniu).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
TEKCIS, 2-50 GBq, generator radionuklidu
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Sodu nadtechnecjan (99mTc), roztwór do wstrzykiwań, otrzymywany jest z generatora (99Mo/99mTc). Technet (99mTc) rozpada się, emitując promieniowanie gamma o średniej energii 140 keV (jego okres półtrwania wynosi 6,01 h) do technetu (99Tc), który ze względu na długi okres półtrwania, wynoszący 2,13 x 105 lat, można uznać za quasi stabilny.
Generator radionuklidu zawierający izotop macierzysty 99Mo zaadsorbowany na kolumnie chromatograficznej dostarcza sodu nadtechnecjan (99mTc) do wstrzykiwań w postaci jałowego roztworu.
99Mo na kolumnie jest w stanie równowagi z wytworzonym izotopem pochodnym 99mTc. Generatory dostarczane są z określoną poniżej aktywnością 99Mo dla referencyjnego czasu aktywności, które dostarczają następujące ilości eluatu technetu (99mTc):
aktywność 99mTc (maksymalna teoretyczna aktywność elucyjna na dzień kalibracji, godz. 12 CET) | 2 | 4 | 6 | 8 | 10 | 12 | 16 | 20 | 25 | 50 | GBq |
aktywność 99Mo (na dzień kalibracji, godz. 12 CET) | 2,5 | 5 | 7 | 9,5 | 12 | 14,5 | 19 | 24 | 30 | 60 | GBq |
Ilość technetu (99mTc) otrzymywana podczas pojedynczej elucji zależy od rzeczywistej wydajności użytego generatora deklarowanej przez producenta i zatwierdzonej przez właściwy organ krajowy.
Substancja pomocnicza o znanym działaniu:
Każdy 1 ml roztworu sodu nadtechnecjanu (99mTc) zawiera 3,6 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Generator radionuklidu
Eluowany roztwór jest klarownym i bezbarwnym roztworem sodu nadtechnecjanu (99mTc) o pH między 4,5 a 7,5.
Produkt leczniczy przeznaczony wyłącznie do diagnostyki.
Eluat otrzymywany z generatora radionuklidu (sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań) jest wskazany do:
Znakowania zestawów do sporządzania radiofarmaceutyków opracowanych i zatwierdzonych do znakowania tym roztworem.
Scyntygrafii tarczycy: poprzez bezpośrednie obrazowanie oraz pomiar wychwytu związku przez tarczycę, pozwala ocenić położenie, rozmiar, strukturę tkanki gruczołowej oraz funkcję narządu w przypadku chorób tarczycy.
Scyntygrafii gruczołów ślinowych: rozpoznanie przewlekłego zapalenia ślinianki (np.: zespół Sjögrena), jak również oceny funkcji wydzielniczej tkanki gruczołowej oraz drożności przewodów wyprowadzających oraz kontrolowanie odpowiedzi na działania lecznicze (w szczególności terapia radiojodem).
Lokalizacji ektopowej błony śluzowej żołądka (uchyłek Meckela).
Scyntygrafii kanalików łzowych: ocena niedrożności kanalików łzowych oraz kontrolowanie odpowiedzi na działania lecznicze.
Dawkowanie i sposób podawania
Scyntygrafia tarczycy: 20-80 MBq.
Scyntygrafia gruczołów ślinowych: od 30 do 150 MBq dla obrazów statycznych i do 370 MBq dla obrazów dynamicznych.
Scyntygrafia uchyłka Meckela: 300-400 MBq.
Scyntygrafia kanalików łzowych: 2-4 MBq na jedno oko.
Niewydolność nerek
Należy zachować szczególną ostrożność przy dawkowaniu aktywności pacjentom z niewydolnością nerek, gdyż stanowią oni grupę zwiększonego narażenia na promieniowanie.
Dzieci i młodzież
Dawkowanie należy szczególnie ostrożnie rozważyć u dzieci i młodzieży, biorąc pod uwagę wskazania kliniczne i ocenę stosunku korzyści do ryzyka w tej grupie pacjentów.
Aktywność do podania u dzieci i młodzieży określa się zgodnie z zaleceniami podanymi w karcie dawkowania pediatrycznego Europejskiego Towarzystwa Medycyny Nuklearnej (ang. European Association of Nuclear Medicine, EANM). Aktywność do podania u dzieci i młodzieży określa się, mnożąc bazową aktywność (podaną na potrzeby obliczeń) przez podany w poniższej tabeli współczynnik zależności wagowej (patrz tabela 1).
A[MBq] Dawkowanie = aktywność bazowa × współczynnik
Scyntygrafia tarczycy:
Podana aktywność [MBq] = 5,6 MBq x współczynnik korygujący (tabela 1). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka:
Podana aktywność [MBq] = 10,5 MBq x współczynnik korygujący (tabela 1). Minimalna aktywność wymagana do uzyskania obrazu wystarczającej jakości wynosi 20 MBq.
Tabela 1: Współczynniki zależności wagowej stosowane przy dawkowaniu u dzieci i młodzieży (w scyntygrafii tarczycy i identyfikacji/lokalizacji ektopowej błony śluzowej żołądka) zgodnie z wytycznymi EANM - maj 2008 r.
Masa ciała
Współczynnik
Masa ciała
Współczynnik
Masa ciała
Współczynnik
3 kg
=
1
22 kg
=
5,29
42 kg
= 9,14
4 kg
=
1,14
24 kg
=
5,71
44 kg
= 9,57
6 kg
=
1,71
26 kg
=
6,14
46 kg
= 10,00
8 kg
=
2,14
28 kg
=
6,43
48 kg
= 10,29
10 kg
=
2,71
30 kg
=
6,86
50 kg
= 10,71
12 kg
=
3,14
32 kg
=
7,29
52-54 kg
= 11,29
14 kg
=
3,57
34 kg
=
7,72
56-58 kg
= 12,00
16 kg
=
4,00
36 kg
=
8,00
60-62 kg
= 12,71
18 kg
=
4,43
38 kg
=
8,43
64-66 kg
= 13,43
20 kg
=
4,86
40 kg
=
8,86
68 kg
= 14,00
Scyntygrafia gruczołów ślinowych:
Pediatryczna Grupa Robocza EANM (1990) zaleca wyliczenie dawki należnej na podstawie masy ciała dziecka zgodnie z tabelą podaną poniżej (patrz tabela 2). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Tabela 2: Współczynnik zależności wagowej stosowany przy dawkowaniu u dzieci i młodzieży (w scyntygrafii gruczołów ślinowych) zgodnie z zaleceniami EANM z roku 1990:
Masa ciała
Współczynnik
Masa ciała
Współczynnik
Masa ciała
Współczynnik
3 kg
=
0,1
22 kg
= 0,50
42 kg
= 0,78
4 kg
=
0,14
24 kg
= 0,53
44 kg
= 0,80
6 kg
=
0,19
26 kg
= 0,56
46 kg
= 0,82
8 kg
=
0,23
28 kg
= 0,58
48 kg
= 0,85
10 kg
=
0,27
30 kg
= 0,62
50 kg
= 0,88
12 kg
=
0,32
32 kg
= 0,65
52-54 kg
= 0,90
14 kg
=
0,36
34 kg
= 0,68
56-58 kg
= 0,92
16 kg
=
0,40
36 kg
= 0,71
60-62 kg
= 0,96
18 kg
=
0,44
38 kg
= 0,73
64-66 kg
= 0,98
20 kg
=
0,46
40 kg
= 0,76
68 kg
= 0,99
Scyntygrafia kanalików łzowych:
Zalecane aktywności dla dzieci i młodzieży są takie same jak dla dorosłych.
Sposób podawania
Podanie dożylne lub do oka. Do wielokrotnego użycia.
Instrukcje przygotowania produktu leczniczego przed podaniem, patrz punkt 12. Sposób przygotowania pacjenta, patrz punkt 4.4.
We wskazaniach: scyntygrafia tarczycy, scyntygrafia gruczołów ślinowych i identyfikacja/lokalizacja ektopowej błony śluzowej żołądka, sodu nadtechnecjan (99mTc) roztwór stosuje się we wstrzyknięciu dożylnym.
W scyntygrafii kanalików łzowych krople zakrapla się do worka spojówkowego (podanie do oka).
Obrazowanie
Scyntygrafia tarczycy: 20 minut po podaniu dożylnym.
Scyntygrafia gruczołów ślinowych: bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 15 minut.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka (uchyłek Meckela): bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 30 minut.
Scyntygrafia kanalików łzowych: w czasie 2 minut od wprowadzenia kropli do worka spojówkowego wykonuje się obrazy dynamiczne, a następnie statyczne, w odpowiednich odstępach czasu przez
20 minut.
Dawkowanie
Jeśli sodu nadtechnecjan (99mTc) jest podawany dożylnie, stosowane dawki radioaktywności mogą się znacznie różnić w zależności od wymaganych informacji klinicznych oraz stosowanej aparatury.
Podanie aktywności powyżej diagnostycznego poziomu referencyjnego dawek określonego przez lokalne przepisy (DRL) powinno być uzasadnione wskazaniami.
Zalecane dawki aktywności wynoszą:
Dorośli (70 kg) i osoby w podeszłym wieku:
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Możliwość wystąpienia nadwrażliwości lub reakcji anafilaktycznych
Jeżeli wystąpią reakcje nadwrażliwości lub reakcje anafilaktyczne, należy natychmiast przerwać podawanie produktu leczniczego i, jeżeli jest to konieczne, rozpocząć leczenie dożylne. W celu podjęcia natychmiastowego leczenia należy zapewnić dostępność niezbędnych produktów leczniczych i sprzętu, takiego jak rurka intubacyjna i respirator.
Uzasadnienie indywidualnego stosunku korzyści do ryzyka
U każdego pacjenta narażenie na promieniowanie jonizujące musi być uzasadnione w oparciu o spodziewane korzyści kliniczne. Podana dawka radioaktywności powinna być w każdym przypadku możliwie jak najniższa, a jednocześnie wystarczająca do uzyskania założonej informacji diagnostycznej.
Niewydolność nerek
Ze względu na możliwy wzrost narażenia na promieniowanie należy uważnie ocenić stosunek korzyści do ryzyka w tej grupie pacjentów.
Dzieci i młodzież
Informacje dotyczące stosowania produktu leczniczego u dzieci i młodzieży, patrz punkt 4.2.
Zasadność stosowania produktu leczniczego w tej grupie pacjentów należy dokładnie rozważyć, gdyż dawka skuteczna w przeliczeniu na 1 MBq jest wyższa niż w przypadku dorosłych (patrz punkt 11). Blokowanie czynności tarczycy jest szczególnie istotne w grupie dzieci i młodzieży, z wyjątkiem scyntygrafii tarczycy.
Przygotowanie pacjenta
W niektórych wskazaniach może być konieczne wstępne podanie środków blokujących czynność tarczycy.
Pacjent powinien być dobrze nawodniony przed rozpoczęciem badania oraz poinformowany o konieczności jak najczęstszego oddawania moczu w ciągu pierwszych godzin po podaniu produktu leczniczego, w celu usunięcia z organizmu substancji promieniotwórczych.
W celu zmniejszenia prawdopodobieństwa wyników fałszywie dodatnich i zminimalizowania narażenia na promieniowanie poprzez obniżenie wychwytu nadtechnecjanu przez tarczycę i gruczoły ślinowe konieczne jest blokowanie czynności tarczycy. Stosuje się je przy scyntygrafii kanalików łzowych oraz scyntygrafii uchyłku Meckela. NIE WOLNO stosować środków blokujących czynność tarczycy przed badaniem scyntygraficznym tarczycy, przytarczyc i gruczołów ślinowych.
Przed podaniem roztworu sodu nadtechnecjanu (99mTc) w scyntygrafii uchyłku Meckela pacjent powinien być na czczo przez 3 do 4 godzin, aby zmniejszyć perystaltykę jelit.
Po znakowaniu erytrocytów w warunkach in vivo z wykorzystaniem redukcji jonami cyny, sodu nadtechnecjan (99mTc) wbudowuje się głównie w erytrocyty. Dlatego scyntygrafię uchyłku Meckela należy przeprowadzać przed tym badaniem lub kilka dni po wyznakowaniu erytrocytów w warunkach in vivo.
Po badaniu
Pacjent powinien unikać kontaktu z małymi dziećmi i kobietami w ciąży przez 12 godzin po badaniu. Specjalne ostrzeżenia
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań zawiera 3,6 mg sodu na 1 ml roztworu.
W zależności od czasu podania ilość sodu otrzymanego przez pacjenta może w niektórych przypadkach przekraczać 1 mmol (23 mg). Należy to wziąć pod uwagę w przypadku pacjentów stosujących dietę niskosodową.
W sytuacji wykorzystywania roztworu sodu nadtechnecjanu (99mTc) do znakowania zestawów, podczas określania całkowitej zawartości sodu należy uwzględnić sód otrzymany z eluatu i zestawu. Należy zapoznać się z treścią ulotki załączonej do zestawu.
W scyntygrafii gruczołów ślinowych należy spodziewać się niższej swoistości metody w porównaniu do sialografii MR.
Środki ostrożności w odniesieniu do zagrożenia dla środowiska naturalnego, patrz punkt 6.6.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Atropina, izoprenalina i leki przeciwbólowe mogą powodować opóźnienie opróżniania żołądka i spowalniać redystrybucję nadtechnecjanu (99mTc) w obrazowaniu jamy brzusznej.
Należy unikać podawania środków przeczyszczających, gdyż powodują one podrażnienie przewodu pokarmowego. Należy unikać wykonywania badań z użyciem środka kontrastowego (np. siarczanu baru) i badań górnego odcinka przewodu pokarmowego w okresie 48 godzin przed podaniem nadtechnecjanu (99mTc) na potrzeby badania scyntygraficznego uchyłka Meckela.
Wiele produktów leczniczych ma znany wpływ zmieniający właściwości wychwytu przez tarczycę.
przeciwtarczycowe produkty lecznicze (np.: karbimazol lub inne pochodne imidazolu, takie jak propylotiouracyl), salicylany, steroidy, sodu nitroprusydek, sodu sulfobromoftaleina, nadchlorany. Ich podawanie powinno być wstrzymane na 1 tydzień przed scyntygrafią tarczycy,
podawanie fenylobutazonu i środków wykrztuśnych powinno być wstrzymane na 2 tygodnie,
podawanie produktów zawierających naturalne lub syntetyczne hormony tarczycy (np. sodu tyroksynę, sodu liotyroninę, wyciąg z tarczycy) powinno zostać wstrzymane na 2–3 tygodnie przed badaniem,
podawanie amiodaronu, benzodiazepin, litu powinno być wstrzymane na 4 tygodnie przed badaniem,
dożylne środki kontrastowe nie powinny być podawane na 1–2 miesiące przed badaniem.
Wpływ na płodność, ciążę i laktację
Kobiety w wieku rozrodczym
Przed podaniem radiofarmaceutyku kobiecie w wieku rozrodczym należy upewnić się, że nie jest ona w ciąży. Każdą kobietę, u której nie wystąpiła regularna miesiączka, należy do wykluczenia ciąży traktować jako kobietę w ciąży. W razie wątpliwości dotyczących możliwej ciąży (jeśli u kobiety nie wystąpiła miesiączka, jeśli miesiączki są bardzo nieregularne itp.) należy zaproponować pacjentce inne metody diagnostyczne, bez użycia promieniowania jonizującego (jeśli takie istnieją).
Ciąża
Podanie sodu nadtechnecjanu (99mTc) kobiecie, która jest w ciąży, dopuszcza się wyłącznie w sytuacji, gdy jest uzasadnione medycznymi przesłankami a spodziewane korzyści przewyższają ryzyko na jakie narażona jest matka i płód. Należy rozważyć alternatywne metody diagnostyczne, bez użycia promieniowania jonizującego.
99mTc (w postaci wolnego nadtechnecjanu) przechodzi przez barierę łożyskową. Karmienie piersią
Przed podaniem radiofarmaceutyku kobiecie karmiącej piersią należy rozważyć możliwość odroczenia podania radionuklidu do chwili zakończenia przez matkę karmienia piersią i wybrać najkorzystniejszy radiofarmaceutyk pod względem przenikania aktywności do mleka. Jeśli podanie radiofarmaceutyku zostanie uznane za konieczne, karmienie piersią należy przerwać na 12 godzin po podaniu produktu leczniczego, a pokarm wydzielony w tym czasie usunąć.
Pacjentka powinna unikać bliskiego kontaktu z dzieckiem w tym czasie.
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Działania niepożądane
Podsumowanie profilu bezpieczeństwa
Informacje na temat działań niepożądanych pochodzą ze spontanicznych zgłoszeń. Odnotowano następujące rodzaje reakcji: reakcje anafilaktoidalne, reakcje wegetatywne oraz różne reakcje w miejscu podania.
Sodu nadtechnecjan (99mTc) otrzymywany z generatora radionuklidu Tekcis jest stosowany do znakowania różnych związków. Związki te charakteryzuje większe prawdopodobieństwo wywołania działań niepożądanych niż w przypadku sodu nadtechnecjanu 99mTc. Dlatego odnotowane działania niepożądane są raczej związane ze stosowaniem wyznakowanych związków niż z 99mTc. Możliwe rodzaje interakcji, jakie mogą wystąpić po dożylnym podaniu produktu leczniczego wyznakowanego roztworem nadtechnecjanu (99mTc) sodu, mogą być różne w zależności od użytej substancji.
Informacje te można znaleźć w Charakterystyce Produktu Leczniczego dołączonej do zestawu do sporządzania radiofarmaceutyku.
Tabelaryczna lista działań niepożądanych:
Częstość występowania działań niepożądanych klasyfikuje się następująco: nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia układu immunologicznego
Częstość nieznana*: reakcje anafilaktoidalne (np. duszność, śpiączka, pokrzywka, rumień, wysypka,
świąd, obrzęk różnych miejsc ciała np. obrzęk twarzy);
Zaburzenia układu nerwowego
Częstość nieznana*: reakcje wazowagalne (np. omdlenie, częstoskurcz, rzadkoskurcz, zawroty głowy, bóle głowy, niewyraźne widzenie, zaczerwienienie);
Zaburzenia żołądka i jelit
Częstość nieznana*: wymioty, nudności, biegunka;
Zaburzenia ogólne i stany w miejscu podania
Częstość nieznana*: reakcje w miejscu wstrzyknięcia (np. zapalenie tkanki łącznej, ból, rumień i obrzęk)
* Działania niepożądane pochodzące ze spontanicznych zgłoszeń.
Narażenie na promieniowanie jonizujące jest związane z indukcją nowotworów oraz możliwością rozwoju wad wrodzonych. Ponieważ dawka skuteczna wynosi 5,2 mSv, w związku z podaniem maksymalnej zalecanej dawki aktywności wynoszącej 400 MBq istnieje małe prawdopodobieństwo wystąpienia tych działań niepożądanych.
Opis wybranych działań niepożądanych
Reakcje anafilaktyczne (np. duszność, śpiączka, pokrzywka, rumień, wysypka, świąd, obrzęk różnych miejsc ciała [np. obrzęk twarzy])
Obserwowano reakcje anafilaktyczne po podaniu dożylnym sodu nadtechnecjanu (99mTc), które dotyczyły różnych zmian skórnych lub problemów w oddychaniu, np. podrażnienie skóry, obrzęk lub duszność.
Reakcje wegetatywne (układu nerwowego i zaburzenia żołądkowo-jelitowe)
Odnotowano pojedyncze przypadki ciężkich reakcji wegetatywnych, jednak większość zgłaszanych reakcji wegetatywnych to reakcje ze strony przewodu pokarmowego, takie jak nudności lub wymioty. Inne to reakcje wazowagalne, takie jak ból lub zawroty głowy. Reakcje wegetatywne uważane są raczej za związane ze świadomością pacjenta, że jest poddawany badaniu, niż z samym zastosowaniem technetu (99mTc); dotyczy to szczególnie pacjentów odczuwających lęk.
Zaburzenia ogólne i stany w miejscu podania
Inne zgłoszenia opisują miejscowe reakcje w miejscu wstrzyknięcia. Reakcje w miejscu wstrzyknięcia są związane z wynaczynieniem roztworu radiofarmaceutyku podczas wstrzykiwania i mogą przybierać postać od lokalnego obrzęku do zapalenia tkanki łącznej. W zależności od podanej radioaktywności i znakowanego związku rozległe wynaczynienie może wymagać leczenia chirurgicznego.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem:
Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C
PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
W przypadku przedawkowania radioaktywności sodu nadtechnecjanu (99mTc) należy dążyć do obniżenia dawki pochłoniętej przez pacjenta poprzez przyspieszenie wydalania radionuklidu z organizmu poprzez częste wypróżnienia, wymuszoną diurezę i oddawanie moczu.
Wychwyt przez tarczycę, ślinianki i śluzówkę przewodu pokarmowego może być znacznie zmniejszony, gdy po przypadkowym podaniu wysokich dawek sodu nadtechnecjanu (99mTc) natychmiast poda się nadchloran sodu lub potasu.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Grupa farmakoterapeutyczna: Różne środki radiofarmaceutyczne stosowane w diagnostyce tarczycy, kod ATC: V09FX01.
W zakresie diagnostycznie stosowanych dawek nie zaobserwowano aktywności farmakologicznej.
Dystrybucja
Jon nadtechnecjanowy ma podobną dystrybucję biologiczną do jonu jodowego i nadchloranowego - gromadzi się przejściowo w śliniankach, splocie naczyniówkowym, śluzówce żołądka oraz tarczycy. Jest uwalniany z tych narządów w niezmienionej postaci. Jon nadtechnecjanowy gromadzi się w obszarach o bogatym unaczynieniu lub w miejscach, gdzie naczynia mają nieprawidłową przepuszczalność. Dzieje się tak szczególnie wtedy, gdy wcześniej podane pacjentowi środki blokują pobieranie produktu leczniczego przez struktury gruczołowe. Przy nienaruszonej barierze krew-mózg sodu nadtechnecjan (99mTc) nie przechodzi do tkanki mózgowej.
Wychwyt przez narządy
We krwi 70–80% wstrzykniętego dożylnie sodu nadtechnecjanu (99mTc) wiąże się z białkami, głównie w sposób niespecyficzny z albuminami. Wolne frakcje (20–30%) gromadzone są czasowo w tarczycy i gruczołach ślinowych, żołądku i błonie śluzowej nosa, a także w splocie naczyniówkowym.
W przeciwieństwie do jodu, sodu nadtechnecjanu (99mTc) nie jest wykorzystywany do syntezy hormonów tarczycy (organifikacja) ani nie wchłania się w jelicie cienkim. Maksymalny poziom akumulacji w tarczycy, w zależności od statusu czynnościowego i nasycenia jodem (w eutyreozie ok. 0,3–3%, w nadczynności tarczycy i zaburzeniach z niedoboru jodu do 25%) jest osiągany po ok.
20 minutach od wstrzyknięcia, a następnie szybko maleje. Dotyczy to również komórek przyściennych błony śluzowej żołądka oraz komórek groniastych ślinianek.
W przeciwieństwie do tarczycy, która uwalnia sodu nadtechnecjan (99mTc) do krwi, gruczoły ślinowe i
żołądek wydzielają sodu nadtechnecjan (99mTc) odpowiednio do śliny i soków żołądkowych. Akumulacja w gruczołach ślinowych jest na poziomie 0,5% podanej aktywności. Przy czym maksymalny poziom osiągnięty jest po około 20 minutach. Po godzinie od wstrzyknięcia stężenie w ślinie jest od około 10- do 30-krotnie większe niż w osoczu. Wydzielanie można przyspieszyć poprzez podanie soku z cytryny lub stymulację przywspółczulnego układu nerwowego.
Eliminacja
Okres półtrwania w osoczu wynosi około 3 godziny. Sodu nadtechnecjan (99mTc) nie jest metabolizowany w organizmie. Jedna frakcja jest wydalana przez nerki bardzo szybko, reszta wolniej z kałem, śliną i płynem łzowym. Przez pierwsze 24 godziny od podania związek jest wydalany głównie z moczem (około 25%), przez następne 48 godzin - z kałem. Około 50% dawki jest wydalane w czasie 50 godzin od podania. Jeśli podano wcześniej produkt blokujący wychwyt nadtechnecjanu (99mTc) przez narządy gruczołowe, wydalanie odbywa się w sposób opisany powyżej, klirens nerkowy jest jednak wyższy.
Powyższe dane nie dotyczą zastosowania sodu nadtechnecjanu (99mTc) do znakowania innych radiofarmaceutyków.
Brak danych dotyczących ostrej, podostrej oraz przewlekłej toksyczności po podaniu pojedynczej dawki oraz dawek wielokrotnych. Ilość sodu nadtechnecjanu (99mTc) podawanego podczas badań diagnostycznych jest bardzo mała. Nie obserwowano innych reakcji poza alergicznymi.
Produkt leczniczy nie jest przeznaczony do regularnego ani ciągłego stosowania.
Nie prowadzono badań mutagenności ani długoterminowych badań dotyczących działania rakotwórczego.
Toksyczność reprodukcyjna:
Stopień przechodzenia 99mTc z podanego dożylnie roztworu sodu nadtechnecjanu (99mTc) przez łożysko badano u myszy. Jeśli nie podano wcześniej nadchlorku, w ciężarnej macicy gromadziło się nawet 60% podanej dawki 99mTc. Badania prowadzone u myszy ciężarnych, w trakcie ciąży, w ciąży i karmiących oraz tylko karmiących wykazały zmiany u potomstwa, takie jak zmniejszenie masy ciała, brak owłosienia oraz bezpłodność.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Kolumna:
Glinu tlenek.
Roztwór do elucji:
Sodu chlorek, sodu azotan, woda do wstrzykiwań.
Niezgodności farmaceutyczne
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 12.
Okres ważności
Generator: 21 dni od daty wytworzenia.
Data kalibracji i termin ważności są podane na etykiecie.
Eluat sodu nadtechnecjanu (99mTc): po elucji zużyć w ciągu 10 godzin do 10 pobrań Ten produktu leczniczy nie wymaga żadnych specjalnych warunków przechowywania. Fiolki do elucji: 24 miesiące.
Specjalne środki ostrożności podczas przechowywania
Generator: Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. Eluat: warunki przechowywania produktu leczniczego po elucji patrz punkt 6.3.
Fiolki do elucji: Nie przechowywać w temperaturze powyżej 25°C.
Radiofarmaceutyki należy przechowywać zgodnie z obowiązującymi przepisami dotyczącymi materiałów radioaktywnych.
Rodzaj i zawartość opakowania
Generator TEKCIS jest dostarczany w pojemniku transportowym typu A. Składa się z:
250 ml miękkiego worka z PP zawierającego roztwór do elucji (1), połączonego igłą ze stali nierdzewnej (2) z górną częścią kolumny chromatograficznej;
szklanej kolumny chromatograficznej (3) zamkniętej na obu końcach silikonowymi korkami i spiekami ze stali nierdzewnej (4). Kolumna zawiera glinu tlenek, na którym zaadsorbowany jest
99Mo.
igły wylotowej (5) połączonej z dolną częścią kolumny. Drugi koniec igły (6) może być podłączony do fiolki elucyjnej w celu elucji kolumny lub fiolki ochronnej (STE-ELU) w celu utrzymania sterylności między dwoma elucjami.
Kolumna z glinu tlenkiem oraz igła są chronione cylindryczno-stożkową osłoną ołowianą lub wolframową (7). Generatory do 25 GBq technetu (99mTc) są chronione ołowianą osłoną, a generatory 50 GBq są chronione osłoną wolframową.
Cały system jest umieszczony w plastikowej obudowie o kształcie równoległościanu (23 x 21 x 14 cm) (8-9).
Igła do elucji wystaje z górnej części plastikowej osłony, chronionej nasadką transportową lub fiolką ochronną (STE-ELU).
Obok igły do elucji znajduje się zawór bezpieczeństwa (10), zamykany na czas transportu.
Akcesoria w zestawie z generatorem:
worek zawierający 10 sterylnych, wolnych od pirogenów fiolek do elucji (TC-ELU-5) (11) umożliwiających elucję od 5 ml do 6 ml.
sterylna fiolka zabezpieczająca igłę do elucji (STE-ELU). Każda fiolka do elucji lub fiolka ochronna to 15 ml, bezbarwna fiolka ze szkła typu I, zamknięta gumowym korkiem i aluminiowym wieczkiem.
Pojemnik na elucję (12) jest dostarczany z pierwszą dostawą.
Inne dostępne akcesoria:
zestawy zawierające fiolki 10 x 15 ml:
fiolki umożliwiające elucję od 5 do 6 ml;
fiolki umożliwiające elucję od 9 do 11 ml;
fiolki umożliwiające elucję od 14 do 16 ml.
dodatkowe przesłony ołowiane dostosowany do generatora TEKCIS: PROTECT ELU.
Wielkość opakowań:
aktywność 99mTc (maksymalna teoretyczna aktywność elucyjna na dzień
kalibracji, godz. 12 CET)
2
4
6
8
10
12
16
20
25
50
GBq
aktywność 99Mo
(na dzień kalibracji, godz. 12 CET)
2,5
5
7
9,5
12
14,5
19
24
30
60
GBq
Schemat generatora TEKCIS w trybie elucji
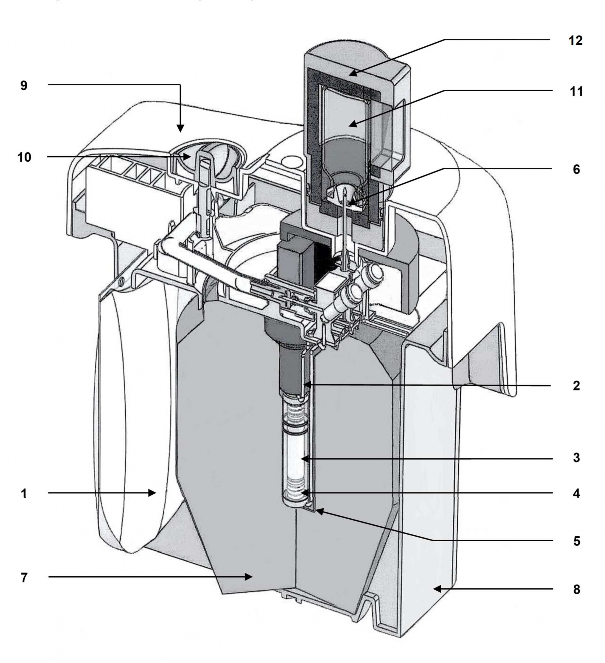
worek z roztworem do elucji ołowiane lub wolframowe cylindryczno- 7
stożkowe osłony
igła łącząca dolna plastikowa osłona 8
szklana kolumna chromatograficzna górna plastikowa osłona 9
korek silikonowy + spieki ze stali nierdzewnej
zawór bezpieczeństwa 10
igła wylotowa ze stali nierdzewnej fiolka elucyjna 11
igła elucyjna pojemnik elucyjny 12
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Ogólne ostrzeżenia
Radiofarmaceutyk może być otrzymywany, używany i podawany chorym tylko przez osoby mające odpowiednie uprawnienia, w wyznaczonych do tego placówkach klinicznych. Otrzymywanie, magazynowanie, użycie, przenoszenie i utylizacja podlegają przepisom i (lub) odpowiednim licencjom właściwych organizacji.
Radiofarmaceutyki powinny być przygotowywane w sposób odpowiedni do wymagań dotyczących zarówno zasad bezpieczeństwa radiologicznego, jak i jakości farmaceutyków. Powinno zapewnić się odpowiednie warunki aseptyczne.
Nie należy stosować generatora lub fiolki z eluatem, jeżeli zauważy się jakiekolwiek ślady uszkodzenia.
Produkt leczniczy należy podawać w taki sposób, aby zminimalizować ryzyko zanieczyszczenia produktu leczniczego i napromieniowania osoby go podającej. Konieczne jest stosowanie odpowiednich osłon.
Podawanie chorym radioaktywnych produktów leczniczych stwarza niebezpieczeństwo skażenia dla osób postronnych, np. moczem lub wymiocinami pacjenta. Należy zatem przestrzegać zasad ochrony radiologicznej zgodnych z obowiązującymi przepisami krajowymi.
Przed utylizacją generatora należy określić jego pozostałą radioaktywność.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
CIS bio international Route Nationale 306
BP 32 SACLAY
F-91192 Gif-sur-Yvette Cedex Francja
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr:
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
DOZYMETRIA
Dane wymienione poniżej pochodzą z ICRP 80 i są obliczane według następujących założeń:
Wartości dawek, gdy pacjent nie otrzymał produktu blokującego:
Narząd
Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq]
Dorośli
15 lat
10 lat
5 lat
1 rok
Nadnercza
0,0037
0,0047
0,0072
0,011
0,019
Ściana pęcherza
moczowego
0,018
0,023
0,030
0,033
0,060
Powierzchnia kości
0,0054
0,0066
0,0097
0,014
0,026
Mózg
0,0020
0,0025
0,0041
0,0066
0,012
Sutki
0,0018
0,0023
0,0034
0,0056
0,011
Pęcherzyk żółciowy
0,0074
0,0099
0,016
0,023
0,035
Przewód pokarmowy
- Ściana żołądka
0,026
0,034
0,048
0,078
0,16
- Jelito cienkie
0,016
0,020
0,031
0,047
0,082
- Okrężnica
0,042
0,054
0,088
0,14
0,27
- Ściana okrężnicy wstępującej
0,057
0,073
0,12
0,20
0,38
- Ściana okrężnicy zstępującej
0,021
0,028
0,045
0,072
0,13
Serce
0,0031
0,0040
0,0061
0,0092
0,017
Nerki
0,0050
0,0060
0,0087
0,013
0,021
Wątroba
0,0038
0,0048
0,0081
0,013
0,022
Płuca
0,0026
0,0034
0,0051
0,0079
0,014
Mięśnie
0,0032
0,0040
0,0060
0,0090
0,016
Przełyk
0,0024
0,0032
0,0047
0,0075
0,014
Jajniki
0,010
0,013
0,018
0,026
0,045
Trzustka
0,0056
0,0073
0,011
0,016
0,027
Szpik kostny
0,0036
0,0045
0,0066
0,0090
0,015
Ślinianki
0,0093
0,012
0,017
0,024
0,039
Skóra
0,0018
0,0022
0,0035
0,0056
0,010
Śledziona
0,0043
0,0054
0,0081
0,012
0,021
Jądra
0,0028
0,0037
0,0058
0,0087
0,016
Grasica
0,0024
0,0032
0,0047
0,0075
0,014
Tarczyca
0,022
0,036
0,055
0,12
0,22
Macica
0,0081
0,010
0,015
0,022
0,037
Pozostałe tkanki
0,0035
0,0043
0,0064
0,0096
0,017
Dawka skuteczna (mSv/MBq)
0,013
0,017
0,026
0,042
0,079
Wartości dawek, gdy pacjent otrzymał produkt blokujący:
Narząd | Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq], gdy pacjent otrzymał produkt blokujący | ||||
Dorośli | 15 lat | 10 lat | 5 lat | 1 lat | |
Nadnercza | 0,0029 | 0,0037 | 0,0056 | 0,0086 | 0,016 |
Ściana pęcherza moczowego | 0,030 | 0,038 | 0,048 | 0,050 | 0,091 |
Powierzchnia kości | 0,0044 | 0,0054 | 0,0081 | 0,012 | 0,022 |
Mózg | 0,0020 | 0,0026 | 0,0042 | 0,0071 | 0,012 |
Sutki | 0,0017 | 0,0022 | 0,0032 | 0,0052 | 0,010 |
Pęcherzyk żółciowy | 0,0030 | 0,0042 | 0,0070 | 0,010 | 0,013 |
Przewód pokarmowy | |||||
- Ściana żołądka | 0,0027 | 0,0036 | 0,0059 | 0,0086 | 0,015 |
- Jelito cienkie | 0,0035 | 0,0044 | 0,0067 | 0,010 | 0,018 |
- Okrężnica | 0,0036 | 0,0048 | 0,0071 | 0,010 | 0,018 |
- Ściana okrężnicy wstępującej | 0,0032 | 0,0043 | 0,0064 | 0,010 | 0,017 |
- Ściana okrężnicy zstępującej | 0,0042 | 0,0054 | 0,0081 | 0,011 | 0,019 |
Serce | 0,0027 | 0,0034 | 0,0052 | 0,0081 | 0,014 |
Nerki | 0,0044 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Wątroba | 0,0026 | 0,0034 | 0,0053 | 0,0082 | 0,015 |
Płuca | 0,0023 | 0,0031 | 0,0046 | 0,0074 | 0,013 |
Mięśnie | 0,0025 | 0,0031 | 0,0047 | 0,0072 | 0,013 |
Przełyk | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Jajniki | 0,0043 | 0,0054 | 0,0078 | 0,011 | 0,019 |
Trzustka | 0,0030 | 0,0039 | 0,0059 | 0,0093 | 0,016 |
Szpik kostny | 0,0025 | 0,0032 | 0,0049 | 0,0072 | 0,013 |
Skóra | 0,0016 | 0,0020 | 0,0032 | 0,0052 | 0,0097 |
Śledziona | 0,0026 | 0,0034 | 0,0054 | 0,0083 | 0,015 |
Jądra | 0,0030 | 0,0040 | 0,0060 | 0,0087 | 0,016 |
Grasica | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Tarczyca | 0,0024 | 0,0031 | 0,0050 | 0,0084 | 0,015 |
Macica | 0,0060 | 0,0073 | 0,011 | 0,014 | 0,023 |
Pozostałe tkanki | 0,0025 | 0,0031 | 0,0048 | 0,0073 | 0,013 |
Dawka skuteczna (mSv/MBq) | 0,0042 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Dawka skuteczna po podaniu dożylnym 400 MBq sodu nadtechnecjanu (99mTc) dorosłemu pacjentowi o masie ciała 70 kg wynosi 5,2 mSv.
Po zastosowaniu produktu o właściwościach blokujących i podaniu 400 MBq sodu
nadtechnecjanu (99mTc) dorosłemu pacjentowi o masie ciała 70 kg dawka skuteczna wynosi 1,7 mSv.
Dawka promieniowania pochłonięta przez soczewkę oka po podaniu sodu nadtechnecjanu (99mTc) celem wykonania scyntygrafii kanałów łzowych jest szacowana na 0,038 mGy/MBq. Podanie aktywności wynoszącej 4 MBq powoduje pochłonięcie dawki skutecznej nieprzekraczającej 0,01 mSv.
Podane dawki promieniowania mają zastosowanie w przypadku, kiedy narządy pochłaniające sodu nadtechnecjan (99mTc) funkcjonują prawidłowo. Nadczynność/niedoczynność (np. tarczycy, błony śluzowej żołądka i nerek) oraz długotrwałe procesy z zaburzeniem bariery krew-mózg lub upośledzeniem eliminacji przez nerki mogą prowadzić do zmian w narażeniu na promieniowanie, prowadząc lokalnie do jego bardzo znacznego wzrostu.
Narażenie na promieniowanie zewnętrzne
Moc dawki 99Mo-99mTc na powierzchni generatora (μSv/h.GBq) | Moc dawki 99Mo-99mTc w odległości 1 m od generatora (μSv/h.GBq) | |
Osłona ołowiana 41 mm | 16 | 0,3 |
Dawki powierzchniowe i dawka skumulowana zależą od wielu czynników. Ogólnie rzecz biorąc, pomiar promieniowania w otoczeniu i podczas pracy ma kluczowe znaczenie i powinien być wykonywany.
INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
Elucję generatora należy przeprowadzać w pomieszczeniach zgodnych z krajowymi przepisami dotyczącymi bezpieczeństwa użytkowania produktów radioaktywnych.
Eluat jest przezroczystym i bezbarwnym roztworem nadtechnecjanu sodu (99mTc) o pH między 4,5 a 7,5 i czystości radiochemicznej równej lub większej niż 95%.
Jeżeli roztwór sodu nadtechnecjanu (99mTc) jest zastosowany do znakowania zestawu, należy zapoznać się z ulotką dołączoną do opakowania tego zestawu.
Przygotowanie
Zdezynfekować korek fiolek do elucji przed każdą elucją. Uwaga:
Nie używać etanolu ani eteru etylowego do dezynfekcji korka fiolki do elucji, ponieważ może to zakłócać proces elucji.
Podczas transportu sterylność igły elucyjnej chroni nasadka.
Chronić igłę do elucji przed możliwym zanieczyszczeniem bakteryjnym, umieszczając fiolkę ochronną na igle między dwoma eluatami.
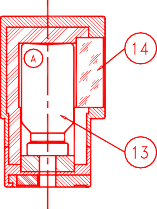
Przestrzegać następującej sekwencji, aby uzyskać zadowalające wyniki:
Pierwsza elucja:
Używając generatora po raz pierwszy, OTWORZYĆ zawór bezpieczeństwa (10) do pozycji ON PRZED podłączeniem fiolki do elucji. Nigdy nie zamykać zaworu bezpieczeństwa pomiędzy dwoma eluatami. Zawór bezpieczeństwa zamykać dopiero na czas utylizacji generatora.
Aby eluować generator, nałożyć nasadkę lub fiolkę ochronną na pojemnik do elucji (A) zawierający fiolkę próżniową do elucji (oznaczoną „TC-ELU”) odpowiadającą żądanej objętości elucji (13).
Elucję można obserwować przez okienko ze szkła ołowiowego (14) pojemnika (A). Odczekać dwie minuty do pełnej elucji.
Przed użyciem sprawdzić klarowność eluatu i wyrzucić, jeśli roztwór nie jest przejrzysty. Po elucji natychmiast założyć fiolkę ochronną na igłę, aby zachować jej sterylność.
Objętości elucji:
Tekcis to generator opracowany do elucji całej dostępnej aktywności technetu-99m w objętości 5 ml. Elucje frakcjonowane są zatem niepotrzebne. Można jednak przeprowadzić elucje do większych objętości: 10 ml lub 15 ml.
Możliwości zastosowania:
Aktywność podana na etykiecie generatora wyrażona jest w technecie-99m, dostępnym na dzień kalibracji (12:00 CET).
Dostępność technetu-99m zależy od:
aktywności molibdenu-99 w momencie elucji;
czasu od ostatniej elucji. Kontrola jakości
Radioaktywność oraz tzw. „przebicie” molibdenu (99Mo) muszą być sprawdzone przed użyciem.
Sprawdzenie „przebicia” molibdenu (99Mo) może być przeprowadzone zgodnie z Farmakopeą Europejską lub też każdą inną zwalidowaną metodą umożliwiającą określenie zawartości molibdenu (99Mo) poniżej 0,1% całkowitej radioaktywności na dzień i godzinę podania.
Masa technetu (99mTc + 99Tc) obecnego w eluacie:
Molibden-99 jest przekształcany w technet-99m (87,6% całego rozpadu molibdenu-99) i technet-99 (12,4% całego rozpadu molibdenu-99). Całkowitą masę technetu ((99mTc) + (99Tc)) wyrażoną w µg technetu obecnego w eluacie można obliczyć według następującego uproszczonego wzoru:
M(µg) = aktywność technetu-99m w eluacie x k
F
k = 5,161,10-3 (aktywność wyrażona w GBq)
F to stosunek liczby atomów technetu-99m (N99m) do całkowitej liczby atomów technetu (Nt): F = N99m
Nt
Wartości tego stosunku (F) w funkcji odstępu między dwoma elucjami przedstawia poniższa tabela:
Godziny | Dni | ||||||
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
0 | - | 0,277 | 0,131 | 0,076 | 0,0498 | 0,0344 | 0,0246 |
3 | 0,727 | 0,248 | 0,121 | 0,072 | 0,0474 | 0,0329 | 0,0236 |
6 | 0,619 | 0,223 | 0,113 | 0,068 | 0,0452 | 0,0315 | 0,0227 |
9 | 0,531 | 0,202 | 0,105 | 0,064 | 0,0431 | 0,0302 | 0,0218 |
12 | 0,459 | 0,184 | 0,098 | 0,061 | 0,0411 | 0,0290 | 0,0210 |
15 | 0,400 | 0,168 | 0,092 | 0,058 | 0,0393 | 0,0278 | 0,0202 |
18 | 0,352 | 0,154 | 0,086 | 0,055 | 0,0375 | 0,0266 | 0,0194 |
21 | 0,311 | 0,141 | 0,081 | 0,052 | 0,0359 | 0,0256 | 0,0187 |
Przykłady:
Technet-99m z generatora jest eluowany do objętości 5 ml; zmierzona aktywność wynosi 10 GBq; poprzednią elucję przeprowadzono 27 godzin wcześniej.
Masa technetu wynosi:
M(µg) = 10 x 5,161,10-3 = 0,208 µg
0,248
tzn: 0,042 µg/mL
Technet-99m z generatora jest eluowany 4 dni po przygotowaniu (co odpowiada pierwszej elucji). Dla aktywności 10 GBq w 5 ml eluatu masa technetu wynosi:
M(µg) = 10 x 5,161,10-3 = 1,036 µg
0,0498
tzn: 0,207 µg/ml, czyli pięć razy więcej technetu niż w poprzednim przykładzie. Ta ilość technetu, mimo iż jest niewielka, może wpływać na wydajność znakowania niektórych związków.
Pierwszy eluat uzyskany z tego generatora może być normalnie używany, o ile nie określono inaczej. Eluaty eluowane nawet później niż 24 godziny od ostatniej elucji mogą być użyte do znakowania zestawu, o ile nie jest to wykluczone w ChPL odpowiedniego zestawu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
OZNAKOWANIE OPAKOWAŃ
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH
Generator
1. NAZWA PRODUKTU LECZNICZEGO
TEKCIS, 2-50 GBq, generator radionuklidu
natrii pertechnetatis (99mTc) fissione formati solutio iniectabilis
2. ZAWARTOŚĆ SUSBSTANCJI CZYNNEJ
Sodu nadtechnecjan (99mTc): aktywność generatora określona na dzień kalibracji. Aktywność 99mTc: GBq określona na dzień kalibracji (12:00 CET)
Aktywność 99mTc: GBq określona na dzień wytworzenia (12:00 CET)
3. WYKAZ SUBSTANCJI POMOCNICZYCH
Substancje pomocnicze: sodu chlorek, sodu azotan i woda do wstrzykiwań.
4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
Generator radionuklidu. Dawkowanie wielokrotne
3 | 6 | 6 | 1 | 5 | 4 | 1 | 1 | 0 | 0 | 4 | 0 | 5 |
Kod:
5. SPOSÓB I DROGI PODANIA
Podanie dożylne lub do oka.
Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
6.
OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI
7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
Produkt leczniczy radiofarmaceutyczny. Symbol radioaktywności
8. TERMIN WAŻNOŚCI
EXP {DD/MM/RRRR} (12:00 CET)
Po elucji zużyć w ciągu 10 godzin, maksymalnie do 10 pobrań.
9. SPECJALNE WARUNKI PRZECHOWYWANIA
10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI WŁAŚCIWE
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy przechowywać i usunąć zgodnie z lokalnymi przepisami.
11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
Podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu / Wytwórca
CIS bio international
F-91192 Gif-sur-Yvette Cedex
12. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr:
13. NUMER SERII
Nr serii (Lot):
14. OGÓLNA KATEGORIA DOSTĘPNOŚCI
Rpz - Lek wydawany na receptę.
15. INSTRUKCJA UŻYCIA
16. INFORMACJA PODANA SYSTEMEM BRAILLE’A
Zaakceptowano uzasadnienie braku informacji systemem Braille’a.
17. NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
Nie dotyczy.
18. NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
Nie dotyczy.
MINIMUM INFORMACJI ZAMIESZCZANYCH NA MAŁYCH OPAKOWANIACH BEZPOŚREDNICH
Sterylna szklana fiolka próżniowa
1. NAZWA PRODUKTU LECZNICZEGO I DROGA PODANIA
TC-ELU
2. SPOSÓB PODAWANIA
3. TERMIN WAŻNOŚCI
MM/RRRR
4. NUMER SERII<, KODY DONACJI I PRODUKTU>
LOT
5.
ZAWARTOŚĆ OPAKOWANIA Z PODANIEM MASY, OBJĘTOŚCI LUB LICZBY JEDNOSTEK
Poziom elucji w zależności od użytej fiolki: 5
6. INNE
STERILE
Cis bio international
ULOTKA DLA PACJENTA
Ulotka dołączona do opakowania: informacja dla pacjenta
TEKCIS, 2-50 GBq, generator radionuklidu
natrii pertechnetatis (99mTc) fissione formati solutio iniectabilis
Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza medycyny nuklearnej, który będzie nadzorował zabieg.
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi medycyny nuklearnej. Patrz punkt 4.
Spis treści ulotki
Co to jest lek TEKCIS i w jakim celu się go stosuje
gruczoł tarczycy
gruczoły ślinowe
tkanka żołądka pojawiająca się w nieprawidłowym miejscu (uchyłek Meckela)
kanaliki łzowe oczu.
Roztwór nadtechnecjanu sodu (99mTc) może być również stosowany w skojarzeniu z innym produktem do przygotowania innego leku radiofarmaceutycznego. W takiej sytuacji patrz odnośna ulotka dołączona do opakowania.
Lekarz medycyny nuklearnej wyjaśni pacjentowi charakter badania, które zostanie przeprowadzone z zastosowaniem tego produktu.
Stosowanie roztworu nadtechnecjanu sodu (99mTc) wiąże się z ekspozycją na niewielkie ilości radioaktywności. Lekarz prowadzący i lekarz medycyny nuklearnej uznali, że korzyści kliniczne, jakie pacjent odniesie z zabiegu z użyciem radiofarmaceutyku, przewyższają ryzyko związane z promieniowaniem.
Tekcis jest produktem radiofarmaceutycznym stosowanym wyłącznie do celów diagnostycznych.
Tekcis jest generatorem technetu (99mTc), co oznacza, że jest to urządzenie stosowane do uzyskania roztworu do wstrzykiwań nadtechnecjanu sodu (99mTc). Kiedy radioaktywny roztwór zostaje wstrzyknięty do organizmu, tymczasowo gromadzi się on w niektórych częściach ciała. Niewielką ilość podanych związków promieniotwórczych można wykryć spoza organizmu z użyciem specjalnych kamer. Lekarz medycyny nuklearnej następnie wykona zdjęcie (skan) danego narządu, co dostarczy mu cennych informacji na temat struktury i czynności tego narządu.
Po wstrzyknięciu roztwór nadtechnecjanu sodu (99mTc) służy do uzyskania obrazów różnych części ciała, takich jak:
Informacje ważne przed zastosowaniem roztworu nadtechnecjanu sodu (99mTc) uzyskanego z użyciem leku TEKCIS
Kiedy nie stosować roztworu nadtechnecjanu sodu (99mTc) uzyskanego z użyciem leku Tekcis
jeśli pacjent ma uczulenie na nadtechnecjan sodu (99mTc) lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Ostrzeżenia i środki ostrożności
Należy poinformować lekarza medycyny nuklearnej, jeśli:
pacjent ma uczulenia, ponieważ po podaniu roztworu nadtechnecjanu sodu (99mTc) zaobserwowano kilka przypadków reakcji alergicznych,
pacjent choruje na chorobę nerek,
pacjentka jest w ciąży lub przypuszcza, że może być w ciąży,
pacjentka karmi piersią.
Lekarz medycyny nuklearnej poinformuje pacjenta, czy konieczne jest podjęcie specjalnych środków ostrożności po zastosowaniu tego leku. W przypadku wątpliwości należy skonsultować się z lekarzem medycyny nuklearnej.
Przed podaniem roztworu nadtechnecjanu sodu (99mTc) pacjent powinien:
pić dużo wody przed rozpoczęciem badania, aby jak najczęściej oddawać mocz podczas pierwszych godzin po badaniu.
być na czczo przez 3 do 4 godzin przed scyntygrafią uchyłka Meckela, aby utrzymać
możliwie powolną pracę jelita cienkiego.
Dzieci i młodzież
Osoby w wieku poniżej 18 lat lub rodzice takich osób powinni porozumieć się z lekarzem medycyny nuklearnej.
Roztwór nadtechnecjanu sodu (99mTc) a inne leki
Należy powiedzieć lekarzowi medycyny nuklearnej o wszystkich lekach przyjmowanych przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować, ponieważ mogą one utrudniać interpretację zdjęć. W szczególności dotyczy to następujących leków:
atropina, używana np. do:
zmniejszenia skurczów żołądka, jelit lub pęcherzyka żółciowego,
zmniejszenia wydzieliny trzustki,
w okulistyce,
przed podaniem znieczulenia,
w leczeniu spowolnionego bicia serca lub
jako antidotum
izoprenalina, lek stosowany w leczeniu spowolnionego bicia serca
leki przeciwbólowe
środki przeczyszczające (nie należy ich stosować podczas tego zabiegu, gdyż podrażniają przewód pokarmowy)
jeśli pacjent przechodził badania z kontrastem (np. z użyciem środka kontrastowego z barem) lub badanie górnego odcinka przewodu pokarmowego (ponieważ należy ich unikać na 48 godzin przed scyntygrafią uchyłka Meckela)
leki przeciwtarczycowe (np. karbimazol lub inne pochodne imidazolu, takie jak
propylotiouracyl, salicylany, steroidy, nitroprusydek sodu, sulfobromoftaleina sodu, nadchloran) (nie należy ich przyjmować na 1 tydzień przed scyntygrafią)
fenylobutazon w leczeniu gorączki, bólu i stanów zapalnych w organizmie (nie należy go
przyjmować na 2 tygodnie przed scyntygrafią)
środki wykrztuśne (nie należy ich przyjmować na 2 tygodnie przed scyntygrafią)
preparaty zawierające naturalne lub syntetyczne hormony tarczycy (np. tyroksyna sodowa, liotyronina sodowa, ekstrakt z tarczycy) (nie należy ich przyjmować przez 2-3 tygodnie przed scyntygrafią)
amiodaron - lek przeciwarytmiczny (nie należy go przyjmować przez 4 tygodnie przed
scyntygrafią)
benzodiazepiny stosowane np. w sedacji lub jako leki przeciwlękowe, przeciwdrgawkowe lub zwiotczające mięśnie lub związki litu stosowane jako stabilizator nastroju w chorobie maniakalno-depresyjnej (ponieważ obu nie należy przyjmować na 4 tygodnie przed scyntygrafią)
jodkowe środki kontrastowe do badań radiologicznych organizmu (ponieważ nie powinny być
podawane na 1-2 miesiące przed scyntygrafią)
Przed zażyciem jakichkolwiek leków należy zapytać lekarza medycyny nuklearnej.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub gdy planuje mieć dziecko, powinna poradzić się lekarza medycyny nuklearnej przed otrzymaniem tego leku.
Pacjentka musi poinformować lekarza medycyny nuklearnej przed otrzymaniem roztworu nadtechnecjanu sodu (99mTc), jeśli istnieje możliwość, że jest w ciąży, jeśli opóźnia się jej miesiączka lub jeśli karmi piersią. W przypadku wątpliwości należy skonsultować się z lekarzem medycyny nuklearnej, który będzie nadzorował procedurę.
Jeśli pacjentka jest w ciąży, lekarz medycyny nuklearnej poda lek w czasie ciąży wyłącznie, jeśli oczekiwana korzyść z badania znacznie przewyższa ryzyko.
Jeśli pacjentka karmi piersią, powinna poinformować o tym lekarza medycyny nuklearnej, ponieważ zaleci on zaprzestanie karmienia do czasu wyeliminowania radioaktywności z organizmu. Trwa to około 12 godzin. Wydzielone w tym czasie mleko należy wyrzucić. Wznowienie karmienia piersią należy uzgodnić ze specjalistą medycyny nuklearnej, który będzie nadzorował badanie.
Prowadzenie pojazdów i obsługiwanie maszyn
Roztwór nadtechnecjanu sodu (99mTc) nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Roztwór nadtechnecjanu sodu zawiera sód
Roztwór nadtechnecjanu sodu zawiera 3,6 mg/ml sodu. W zależności od wstrzykniętej objętości może zostać przekroczony limit 1 mmol (23 mg) sodu na podaną dawkę. Należy to wziąć pod uwagę, jeśli pacjent jest na diecie o niskiej zawartości soli.
Jak stosuje się roztwór nadtechnecjanu sodu (99mTc) uzyskany z użyciem leku TEKCIS
Istnieją surowe przepisy dotyczące stosowania, obchodzenia się i usuwania produktów radiofarmaceutycznych. Tekcis będzie stosowany wyłącznie w specjalnych kontrolowanych obszarach. Produkt będą przygotowywały i podawały pacjentowi wyłącznie osoby, które są przeszkolone i wykwalifikowane do tego, by zrobić to w bezpieczny sposób. Osoby te dołożą wszelkich starań, by stosować produkt w bezpieczny sposób i by informować pacjenta o podejmowanych działaniach.
Lekarz medycyny nuklearnej nadzorujący procedurę zdecyduje o ilości roztworu nadtechnecjanu sodu (99mTc) do zastosowania w danym przypadku. Będzie to najmniejsza dawka niezbędna do uzyskania oczekiwanych informacji.
Ilość zwykle zalecana do podania osobom dorosłym w zależności od rodzaju wykonywanego badania wynosi od 2 do 400 MBq (megabekerel, jednostka używana do wyrażania radioaktywności).
Stosowanie u dzieci i młodzieży
U dzieci i młodzieży podawana ilość będzie dostosowana do masy ciała.
Podanie roztworu nadtechnecjanu sodu (99mTc) i przeprowadzenie badania
W zależności od celu badania produkt będzie podawany we wstrzyknięciu do żyły ramiennej lub może być wkroplony do oczu w postaci kropli.
Do przeprowadzenia badania potrzebnego lekarzowi wystarczy jedno podanie.
Czas trwania procedury
Lekarz medycyny nuklearnej poinformuje pacjenta o tym, jak długo zwykle trwa procedura.
Skany można wykonywać w dowolnym momencie, od momentu wstrzyknięcia i do 24 godzin po podaniu, w zależności od rodzaju badania.
Po podaniu roztworu nadtechnecjanu sodu (99mTc) pacjent powinien:
unikać bliskiego kontaktu z małymi dziećmi i kobietami w ciąży przez 12 godzin po wstrzyknięciu,
często oddawać mocz, aby usuwać produkt z organizmu,
po podaniu roztworu pacjent otrzyma napój i zostanie poproszony o oddanie moczu bezpośrednio przed badaniem.
Lekarz medycyny nuklearnej poinformuje pacjenta, czy konieczne jest podjęcie specjalnych środków ostrożności po otrzymaniu tego leku. W przypadku wszelkich pytań należy się skontaktować z lekarzem medycyny nuklearnej.
Zastosowanie większej niż zalecana dawki roztworu nadtechnecjanu sodu (99mTc) uzyskanego za pomocą leku Tekcis:
Przedawkowanie jest prawie niemożliwe, ponieważ pacjent otrzyma tylko pojedynczą dawkę roztworu nadtechnecjanu sodu (99mTc) dokładnie kontrolowaną przez lekarza medycyny nuklearnej nadzorującego procedurę. Jednak w przypadku przedawkowania pacjent otrzyma odpowiednie leczenie. W szczególności lekarz medycyny nuklearnej odpowiedzialny za zabieg może zalecić picie dużej ilości płynów w celu usunięcia śladów radioaktywności z organizmu.
W przypadku pytań dotyczących stosowania tego produktu należy zwrócić się do lekarza medycyny
nuklearnej, który nadzoruje procedurę.
Możliwe działania niepożądane
reakcje alergiczne z objawami, takimi jak
wysypka skórna, swędzenie
pokrzywka
obrzęki w różnych miejscach, m.in. twarzy
brak tchu (krótki, płytki oddech)
zaczerwienienie skóry
śpiączka
reakcje krążeniowe z objawami, takimi jak:
szybkie bicie serca, wolne bicie serca
omdlenie
nieostre widzenie
zawroty głowy
ból głowy
uderzenia gorąca z zaczerwienieniem skóry
zaburzenia ze strony przewodu pokarmowego z objawami, takimi jak
wymioty
nudności (mdłości)
biegunka
reakcje w miejscu wkłucia z objawami, takimi jak
stan zapalny skóry
ból
obrzęk (spuchnięcie)
zaczerwienienie.
Ten produkt radiofarmaceutyczny będzie dostarczał niewielkie ilości promieniowania jonizującego, co wiąże się z jak najmniejszym ryzykiem zachorowania na raka i wystąpienia dziedzicznych nieprawidłowości.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać bezpośrednio do:
Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Działania niepożądane o nieznanej częstości (na podstawie dostępnych danych nie można ustalić częstości):
Jak przechowywać lek TEKCIS
Pacjent nie będzie przechowywał tego produktu. Specjalista w danym zakładzie medycyny nuklearnej jest odpowiedzialny za jego przechowywanie. Przechowywanie produktów radiofarmaceutycznych będzie odbywało się zgodnie z krajowymi przepisami dotyczącymi przechowywania materiałów radioaktywnych.
Zawartość opakowania i inne informacje Co zawiera lek TEKCIS
Substancją czynną jest roztwór sodu nadtechnecjanu (99mTc).
Pozostałe składniki to: sodu chlorek, sodu azotan i woda do wstrzykiwań.
Jak wygląda lek TEKCIS i co zawiera opakowanie
Produktem jest roztwór sodu nadtechnecjanu (99mTc) otrzymywany z generatora radionuklidu. TEKCIS należy eluować, a otrzymany roztwór może być użyty sam lub do radioznakowania niektórych konkretnych zestawów do przygotowania radiofarmaceutyku.
Wielkość opakowań:
aktywność 99mTc
(maksymalna teoretyczna aktywność elucyjna na dzień
kalibracji, godz. 12 CET)
2
4
6
8
10
12
16
20
25
50
GBq
aktywność 99Mo
(na dzień kalibracji, godz. 12 CET)
2,5
5
7
9,5
12
14,5
19
24
30
60
GBq
Podmiot odpowiedzialny i wytwórca
CIS bio international Route Nationale306 BP 32 SACLAY
F-91192 Gif-sur-Yvette Cedex Francja
E-mail: drugsafety@curiumpharma.com, Tel: +33 1.69.85.76.76.
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru Gospodarczego pod następującymi nazwami:
Austria, Belgia, Bułgaria, Cypr, Chorwacja, Dania, Estonia, Finlandia, Francja, Niemcy, Grecja, Węgry, Irlandia, Włochy, Łotwa, Litwa, Luksemburg, Malta, Holandia, Norwegia, Polska, Portugalia, Rumunia, Słowacja, Słowenia, Hiszpania, Szwecja, Wielka Brytania: TEKCIS
Czechy: Technecistan-(99mTc) sodný CIS bio international
Data ostatniej aktualizacji ulotki:
Inne źródła informacji
Szczegółowe informacje o tym leku znajdują się na stronie internetowej Departament Rejestracji Produktów Leczniczych (https://rejestrymedyczne.ezdrowie.gov.pl/rpl/search/public)
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Kompletna ChPL produktu leczniczego Tekcis jest dostarczana jako osobny dokument w opakowaniu produktu w celu dostarczenia fachowemu personelowi medycznemu innych dodatkowych informacji naukowych i praktycznych na temat podawania i stosowania tego radiofarmaceutyku.
Proszę zapoznać się z ChPL (powinna znajdować się w opakowaniu).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
TEKCIS, 2-50 GBq, generator radionuklidu
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Sodu nadtechnecjan (99mTc), roztwór do wstrzykiwań, otrzymywany jest z generatora (99Mo/99mTc). Technet (99mTc) rozpada się, emitując promieniowanie gamma o średniej energii 140 keV (jego okres półtrwania wynosi 6,01 h) do technetu (99Tc), który ze względu na długi okres półtrwania, wynoszący 2,13 x 105 lat, można uznać za quasi stabilny.
Generator radionuklidu zawierający izotop macierzysty 99Mo zaadsorbowany na kolumnie chromatograficznej dostarcza sodu nadtechnecjan (99mTc) do wstrzykiwań w postaci jałowego roztworu.
99Mo na kolumnie jest w stanie równowagi z wytworzonym izotopem pochodnym 99mTc. Generatory dostarczane są z określoną poniżej aktywnością 99Mo dla referencyjnego czasu aktywności, które dostarczają następujące ilości eluatu technetu (99mTc):
aktywność 99mTc (maksymalna teoretyczna aktywność elucyjna na dzień kalibracji, godz. 12 CET) | 2 | 4 | 6 | 8 | 10 | 12 | 16 | 20 | 25 | 50 | GBq |
aktywność 99Mo (na dzień kalibracji, godz. 12 CET) | 2,5 | 5 | 7 | 9,5 | 12 | 14,5 | 19 | 24 | 30 | 60 | GBq |
Ilość technetu (99mTc) otrzymywana podczas pojedynczej elucji zależy od rzeczywistej wydajności użytego generatora deklarowanej przez producenta i zatwierdzonej przez właściwy organ krajowy.
Substancja pomocnicza o znanym działaniu:
Każdy 1 ml roztworu sodu nadtechnecjanu (99mTc) zawiera 3,6 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Generator radionuklidu
Eluowany roztwór jest klarownym i bezbarwnym roztworem sodu nadtechnecjanu (99mTc) o pH między 4,5 a 7,5.
Produkt leczniczy przeznaczony wyłącznie do diagnostyki.
Eluat otrzymywany z generatora radionuklidu (sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań) jest wskazany do:
Znakowania zestawów do sporządzania radiofarmaceutyków opracowanych i zatwierdzonych do znakowania tym roztworem.
Scyntygrafii tarczycy: poprzez bezpośrednie obrazowanie oraz pomiar wychwytu związku przez tarczycę, pozwala ocenić położenie, rozmiar, strukturę tkanki gruczołowej oraz funkcję narządu w przypadku chorób tarczycy.
Scyntygrafii gruczołów ślinowych: rozpoznanie przewlekłego zapalenia ślinianki (np.: zespół Sjögrena), jak również oceny funkcji wydzielniczej tkanki gruczołowej oraz drożności przewodów wyprowadzających oraz kontrolowanie odpowiedzi na działania lecznicze (w szczególności terapia radiojodem).
Lokalizacji ektopowej błony śluzowej żołądka (uchyłek Meckela).
Scyntygrafii kanalików łzowych: ocena niedrożności kanalików łzowych oraz kontrolowanie odpowiedzi na działania lecznicze.
Dawkowanie i sposób podawania
Scyntygrafia tarczycy: 20-80 MBq.
Scyntygrafia gruczołów ślinowych: od 30 do 150 MBq dla obrazów statycznych i do 370 MBq dla obrazów dynamicznych.
Scyntygrafia uchyłka Meckela: 300-400 MBq.
Scyntygrafia kanalików łzowych: 2-4 MBq na jedno oko.
Niewydolność nerek
Należy zachować szczególną ostrożność przy dawkowaniu aktywności pacjentom z niewydolnością nerek, gdyż stanowią oni grupę zwiększonego narażenia na promieniowanie.
Dzieci i młodzież
Dawkowanie należy szczególnie ostrożnie rozważyć u dzieci i młodzieży, biorąc pod uwagę wskazania kliniczne i ocenę stosunku korzyści do ryzyka w tej grupie pacjentów.
Aktywność do podania u dzieci i młodzieży określa się zgodnie z zaleceniami podanymi w karcie dawkowania pediatrycznego Europejskiego Towarzystwa Medycyny Nuklearnej (ang. European Association of Nuclear Medicine, EANM). Aktywność do podania u dzieci i młodzieży określa się, mnożąc bazową aktywność (podaną na potrzeby obliczeń) przez podany w poniższej tabeli współczynnik zależności wagowej (patrz tabela 1).
A[MBq] Dawkowanie = aktywność bazowa × współczynnik
Scyntygrafia tarczycy:
Podana aktywność [MBq] = 5,6 MBq x współczynnik korygujący (tabela 1). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka:
Podana aktywność [MBq] = 10,5 MBq x współczynnik korygujący (tabela 1). Minimalna aktywność wymagana do uzyskania obrazu wystarczającej jakości wynosi 20 MBq.
Tabela 1: Współczynniki zależności wagowej stosowane przy dawkowaniu u dzieci i młodzieży (w scyntygrafii tarczycy i identyfikacji/lokalizacji ektopowej błony śluzowej żołądka) zgodnie z wytycznymi EANM - maj 2008 r.
Masa ciała
Współczynnik
Masa ciała
Współczynnik
Masa ciała
Współczynnik
3 kg
=
1
22 kg
=
5,29
42 kg
= 9,14
4 kg
=
1,14
24 kg
=
5,71
44 kg
= 9,57
6 kg
=
1,71
26 kg
=
6,14
46 kg
= 10,00
8 kg
=
2,14
28 kg
=
6,43
48 kg
= 10,29
10 kg
=
2,71
30 kg
=
6,86
50 kg
= 10,71
12 kg
=
3,14
32 kg
=
7,29
52-54 kg
= 11,29
14 kg
=
3,57
34 kg
=
7,72
56-58 kg
= 12,00
16 kg
=
4,00
36 kg
=
8,00
60-62 kg
= 12,71
18 kg
=
4,43
38 kg
=
8,43
64-66 kg
= 13,43
20 kg
=
4,86
40 kg
=
8,86
68 kg
= 14,00
Scyntygrafia gruczołów ślinowych:
Pediatryczna Grupa Robocza EANM (1990) zaleca wyliczenie dawki należnej na podstawie masy ciała dziecka zgodnie z tabelą podaną poniżej (patrz tabela 2). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Tabela 2: Współczynnik zależności wagowej stosowany przy dawkowaniu u dzieci i młodzieży (w scyntygrafii gruczołów ślinowych) zgodnie z zaleceniami EANM z roku 1990:
Masa ciała
Współczynnik
Masa ciała
Współczynnik
Masa ciała
Współczynnik
3 kg
=
0,1
22 kg
= 0,50
42 kg
= 0,78
4 kg
=
0,14
24 kg
= 0,53
44 kg
= 0,80
6 kg
=
0,19
26 kg
= 0,56
46 kg
= 0,82
8 kg
=
0,23
28 kg
= 0,58
48 kg
= 0,85
10 kg
=
0,27
30 kg
= 0,62
50 kg
= 0,88
12 kg
=
0,32
32 kg
= 0,65
52-54 kg
= 0,90
14 kg
=
0,36
34 kg
= 0,68
56-58 kg
= 0,92
16 kg
=
0,40
36 kg
= 0,71
60-62 kg
= 0,96
18 kg
=
0,44
38 kg
= 0,73
64-66 kg
= 0,98
20 kg
=
0,46
40 kg
= 0,76
68 kg
= 0,99
Scyntygrafia kanalików łzowych:
Zalecane aktywności dla dzieci i młodzieży są takie same jak dla dorosłych.
Sposób podawania
Podanie dożylne lub do oka. Do wielokrotnego użycia.
Instrukcje przygotowania produktu leczniczego przed podaniem, patrz punkt 12. Sposób przygotowania pacjenta, patrz punkt 4.4.
We wskazaniach: scyntygrafia tarczycy, scyntygrafia gruczołów ślinowych i identyfikacja/lokalizacja ektopowej błony śluzowej żołądka, sodu nadtechnecjan (99mTc) roztwór stosuje się we wstrzyknięciu dożylnym.
W scyntygrafii kanalików łzowych krople zakrapla się do worka spojówkowego (podanie do oka).
Obrazowanie
Scyntygrafia tarczycy: 20 minut po podaniu dożylnym.
Scyntygrafia gruczołów ślinowych: bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 15 minut.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka (uchyłek Meckela): bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 30 minut.
Scyntygrafia kanalików łzowych: w czasie 2 minut od wprowadzenia kropli do worka spojówkowego wykonuje się obrazy dynamiczne, a następnie statyczne, w odpowiednich odstępach czasu przez
20 minut.
Dawkowanie
Jeśli sodu nadtechnecjan (99mTc) jest podawany dożylnie, stosowane dawki radioaktywności mogą się znacznie różnić w zależności od wymaganych informacji klinicznych oraz stosowanej aparatury.
Podanie aktywności powyżej diagnostycznego poziomu referencyjnego dawek określonego przez lokalne przepisy (DRL) powinno być uzasadnione wskazaniami.
Zalecane dawki aktywności wynoszą:
Dorośli (70 kg) i osoby w podeszłym wieku:
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Możliwość wystąpienia nadwrażliwości lub reakcji anafilaktycznych
Jeżeli wystąpią reakcje nadwrażliwości lub reakcje anafilaktyczne, należy natychmiast przerwać podawanie produktu leczniczego i, jeżeli jest to konieczne, rozpocząć leczenie dożylne. W celu podjęcia natychmiastowego leczenia należy zapewnić dostępność niezbędnych produktów leczniczych i sprzętu, takiego jak rurka intubacyjna i respirator.
Uzasadnienie indywidualnego stosunku korzyści do ryzyka
U każdego pacjenta narażenie na promieniowanie jonizujące musi być uzasadnione w oparciu o spodziewane korzyści kliniczne. Podana dawka radioaktywności powinna być w każdym przypadku możliwie jak najniższa, a jednocześnie wystarczająca do uzyskania założonej informacji diagnostycznej.
Niewydolność nerek
Ze względu na możliwy wzrost narażenia na promieniowanie należy uważnie ocenić stosunek korzyści do ryzyka w tej grupie pacjentów.
Dzieci i młodzież
Informacje dotyczące stosowania produktu leczniczego u dzieci i młodzieży, patrz punkt 4.2.
Zasadność stosowania produktu leczniczego w tej grupie pacjentów należy dokładnie rozważyć, gdyż dawka skuteczna w przeliczeniu na 1 MBq jest wyższa niż w przypadku dorosłych (patrz punkt 11). Blokowanie czynności tarczycy jest szczególnie istotne w grupie dzieci i młodzieży, z wyjątkiem scyntygrafii tarczycy.
Przygotowanie pacjenta
W niektórych wskazaniach może być konieczne wstępne podanie środków blokujących czynność tarczycy.
Pacjent powinien być dobrze nawodniony przed rozpoczęciem badania oraz poinformowany o konieczności jak najczęstszego oddawania moczu w ciągu pierwszych godzin po podaniu produktu leczniczego, w celu usunięcia z organizmu substancji promieniotwórczych.
W celu zmniejszenia prawdopodobieństwa wyników fałszywie dodatnich i zminimalizowania narażenia na promieniowanie poprzez obniżenie wychwytu nadtechnecjanu przez tarczycę i gruczoły ślinowe konieczne jest blokowanie czynności tarczycy. Stosuje się je przy scyntygrafii kanalików łzowych oraz scyntygrafii uchyłku Meckela. NIE WOLNO stosować środków blokujących czynność tarczycy przed badaniem scyntygraficznym tarczycy, przytarczyc i gruczołów ślinowych.
Przed podaniem roztworu sodu nadtechnecjanu (99mTc) w scyntygrafii uchyłku Meckela pacjent powinien być na czczo przez 3 do 4 godzin, aby zmniejszyć perystaltykę jelit.
Po znakowaniu erytrocytów w warunkach in vivo z wykorzystaniem redukcji jonami cyny, sodu nadtechnecjan (99mTc) wbudowuje się głównie w erytrocyty. Dlatego scyntygrafię uchyłku Meckela należy przeprowadzać przed tym badaniem lub kilka dni po wyznakowaniu erytrocytów w warunkach in vivo.
Po badaniu
Pacjent powinien unikać kontaktu z małymi dziećmi i kobietami w ciąży przez 12 godzin po badaniu. Specjalne ostrzeżenia
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań zawiera 3,6 mg sodu na 1 ml roztworu.
W zależności od czasu podania ilość sodu otrzymanego przez pacjenta może w niektórych przypadkach przekraczać 1 mmol (23 mg). Należy to wziąć pod uwagę w przypadku pacjentów stosujących dietę niskosodową.
W sytuacji wykorzystywania roztworu sodu nadtechnecjanu (99mTc) do znakowania zestawów, podczas określania całkowitej zawartości sodu należy uwzględnić sód otrzymany z eluatu i zestawu. Należy zapoznać się z treścią ulotki załączonej do zestawu.
W scyntygrafii gruczołów ślinowych należy spodziewać się niższej swoistości metody w porównaniu do sialografii MR.
Środki ostrożności w odniesieniu do zagrożenia dla środowiska naturalnego, patrz punkt 6.6.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Atropina, izoprenalina i leki przeciwbólowe mogą powodować opóźnienie opróżniania żołądka i spowalniać redystrybucję nadtechnecjanu (99mTc) w obrazowaniu jamy brzusznej.
Należy unikać podawania środków przeczyszczających, gdyż powodują one podrażnienie przewodu pokarmowego. Należy unikać wykonywania badań z użyciem środka kontrastowego (np. siarczanu baru) i badań górnego odcinka przewodu pokarmowego w okresie 48 godzin przed podaniem nadtechnecjanu (99mTc) na potrzeby badania scyntygraficznego uchyłka Meckela.
Wiele produktów leczniczych ma znany wpływ zmieniający właściwości wychwytu przez tarczycę.
przeciwtarczycowe produkty lecznicze (np.: karbimazol lub inne pochodne imidazolu, takie jak propylotiouracyl), salicylany, steroidy, sodu nitroprusydek, sodu sulfobromoftaleina, nadchlorany. Ich podawanie powinno być wstrzymane na 1 tydzień przed scyntygrafią tarczycy,
podawanie fenylobutazonu i środków wykrztuśnych powinno być wstrzymane na 2 tygodnie,
podawanie produktów zawierających naturalne lub syntetyczne hormony tarczycy (np. sodu tyroksynę, sodu liotyroninę, wyciąg z tarczycy) powinno zostać wstrzymane na 2–3 tygodnie przed badaniem,
podawanie amiodaronu, benzodiazepin, litu powinno być wstrzymane na 4 tygodnie przed badaniem,
dożylne środki kontrastowe nie powinny być podawane na 1–2 miesiące przed badaniem.
Wpływ na płodność, ciążę i laktację
Kobiety w wieku rozrodczym
Przed podaniem radiofarmaceutyku kobiecie w wieku rozrodczym należy upewnić się, że nie jest ona w ciąży. Każdą kobietę, u której nie wystąpiła regularna miesiączka, należy do wykluczenia ciąży traktować jako kobietę w ciąży. W razie wątpliwości dotyczących możliwej ciąży (jeśli u kobiety nie wystąpiła miesiączka, jeśli miesiączki są bardzo nieregularne itp.) należy zaproponować pacjentce inne metody diagnostyczne, bez użycia promieniowania jonizującego (jeśli takie istnieją).
Ciąża
Podanie sodu nadtechnecjanu (99mTc) kobiecie, która jest w ciąży, dopuszcza się wyłącznie w sytuacji, gdy jest uzasadnione medycznymi przesłankami a spodziewane korzyści przewyższają ryzyko na jakie narażona jest matka i płód. Należy rozważyć alternatywne metody diagnostyczne, bez użycia promieniowania jonizującego.
99mTc (w postaci wolnego nadtechnecjanu) przechodzi przez barierę łożyskową. Karmienie piersią
Przed podaniem radiofarmaceutyku kobiecie karmiącej piersią należy rozważyć możliwość odroczenia podania radionuklidu do chwili zakończenia przez matkę karmienia piersią i wybrać najkorzystniejszy radiofarmaceutyk pod względem przenikania aktywności do mleka. Jeśli podanie radiofarmaceutyku zostanie uznane za konieczne, karmienie piersią należy przerwać na 12 godzin po podaniu produktu leczniczego, a pokarm wydzielony w tym czasie usunąć.
Pacjentka powinna unikać bliskiego kontaktu z dzieckiem w tym czasie.
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Działania niepożądane
Podsumowanie profilu bezpieczeństwa
Informacje na temat działań niepożądanych pochodzą ze spontanicznych zgłoszeń. Odnotowano następujące rodzaje reakcji: reakcje anafilaktoidalne, reakcje wegetatywne oraz różne reakcje w miejscu podania.
Sodu nadtechnecjan (99mTc) otrzymywany z generatora radionuklidu Tekcis jest stosowany do znakowania różnych związków. Związki te charakteryzuje większe prawdopodobieństwo wywołania działań niepożądanych niż w przypadku sodu nadtechnecjanu 99mTc. Dlatego odnotowane działania niepożądane są raczej związane ze stosowaniem wyznakowanych związków niż z 99mTc. Możliwe rodzaje interakcji, jakie mogą wystąpić po dożylnym podaniu produktu leczniczego wyznakowanego roztworem nadtechnecjanu (99mTc) sodu, mogą być różne w zależności od użytej substancji.
Informacje te można znaleźć w Charakterystyce Produktu Leczniczego dołączonej do zestawu do sporządzania radiofarmaceutyku.
Tabelaryczna lista działań niepożądanych:
Częstość występowania działań niepożądanych klasyfikuje się następująco: nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia układu immunologicznego
Częstość nieznana*: reakcje anafilaktoidalne (np. duszność, śpiączka, pokrzywka, rumień, wysypka,
świąd, obrzęk różnych miejsc ciała np. obrzęk twarzy);
Zaburzenia układu nerwowego
Częstość nieznana*: reakcje wazowagalne (np. omdlenie, częstoskurcz, rzadkoskurcz, zawroty głowy, bóle głowy, niewyraźne widzenie, zaczerwienienie);
Zaburzenia żołądka i jelit
Częstość nieznana*: wymioty, nudności, biegunka;
Zaburzenia ogólne i stany w miejscu podania
Częstość nieznana*: reakcje w miejscu wstrzyknięcia (np. zapalenie tkanki łącznej, ból, rumień i obrzęk)
* Działania niepożądane pochodzące ze spontanicznych zgłoszeń.
Narażenie na promieniowanie jonizujące jest związane z indukcją nowotworów oraz możliwością rozwoju wad wrodzonych. Ponieważ dawka skuteczna wynosi 5,2 mSv, w związku z podaniem maksymalnej zalecanej dawki aktywności wynoszącej 400 MBq istnieje małe prawdopodobieństwo wystąpienia tych działań niepożądanych.
Opis wybranych działań niepożądanych
Reakcje anafilaktyczne (np. duszność, śpiączka, pokrzywka, rumień, wysypka, świąd, obrzęk różnych miejsc ciała [np. obrzęk twarzy])
Obserwowano reakcje anafilaktyczne po podaniu dożylnym sodu nadtechnecjanu (99mTc), które dotyczyły różnych zmian skórnych lub problemów w oddychaniu, np. podrażnienie skóry, obrzęk lub duszność.
Reakcje wegetatywne (układu nerwowego i zaburzenia żołądkowo-jelitowe)
Odnotowano pojedyncze przypadki ciężkich reakcji wegetatywnych, jednak większość zgłaszanych reakcji wegetatywnych to reakcje ze strony przewodu pokarmowego, takie jak nudności lub wymioty. Inne to reakcje wazowagalne, takie jak ból lub zawroty głowy. Reakcje wegetatywne uważane są raczej za związane ze świadomością pacjenta, że jest poddawany badaniu, niż z samym zastosowaniem technetu (99mTc); dotyczy to szczególnie pacjentów odczuwających lęk.
Zaburzenia ogólne i stany w miejscu podania
Inne zgłoszenia opisują miejscowe reakcje w miejscu wstrzyknięcia. Reakcje w miejscu wstrzyknięcia są związane z wynaczynieniem roztworu radiofarmaceutyku podczas wstrzykiwania i mogą przybierać postać od lokalnego obrzęku do zapalenia tkanki łącznej. W zależności od podanej radioaktywności i znakowanego związku rozległe wynaczynienie może wymagać leczenia chirurgicznego.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem:
Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C
PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
W przypadku przedawkowania radioaktywności sodu nadtechnecjanu (99mTc) należy dążyć do obniżenia dawki pochłoniętej przez pacjenta poprzez przyspieszenie wydalania radionuklidu z organizmu poprzez częste wypróżnienia, wymuszoną diurezę i oddawanie moczu.
Wychwyt przez tarczycę, ślinianki i śluzówkę przewodu pokarmowego może być znacznie zmniejszony, gdy po przypadkowym podaniu wysokich dawek sodu nadtechnecjanu (99mTc) natychmiast poda się nadchloran sodu lub potasu.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Grupa farmakoterapeutyczna: Różne środki radiofarmaceutyczne stosowane w diagnostyce tarczycy, kod ATC: V09FX01.
W zakresie diagnostycznie stosowanych dawek nie zaobserwowano aktywności farmakologicznej.
Dystrybucja
Jon nadtechnecjanowy ma podobną dystrybucję biologiczną do jonu jodowego i nadchloranowego - gromadzi się przejściowo w śliniankach, splocie naczyniówkowym, śluzówce żołądka oraz tarczycy. Jest uwalniany z tych narządów w niezmienionej postaci. Jon nadtechnecjanowy gromadzi się w obszarach o bogatym unaczynieniu lub w miejscach, gdzie naczynia mają nieprawidłową przepuszczalność. Dzieje się tak szczególnie wtedy, gdy wcześniej podane pacjentowi środki blokują pobieranie produktu leczniczego przez struktury gruczołowe. Przy nienaruszonej barierze krew-mózg sodu nadtechnecjan (99mTc) nie przechodzi do tkanki mózgowej.
Wychwyt przez narządy
We krwi 70–80% wstrzykniętego dożylnie sodu nadtechnecjanu (99mTc) wiąże się z białkami, głównie w sposób niespecyficzny z albuminami. Wolne frakcje (20–30%) gromadzone są czasowo w tarczycy i gruczołach ślinowych, żołądku i błonie śluzowej nosa, a także w splocie naczyniówkowym.
W przeciwieństwie do jodu, sodu nadtechnecjanu (99mTc) nie jest wykorzystywany do syntezy hormonów tarczycy (organifikacja) ani nie wchłania się w jelicie cienkim. Maksymalny poziom akumulacji w tarczycy, w zależności od statusu czynnościowego i nasycenia jodem (w eutyreozie ok. 0,3–3%, w nadczynności tarczycy i zaburzeniach z niedoboru jodu do 25%) jest osiągany po ok.
20 minutach od wstrzyknięcia, a następnie szybko maleje. Dotyczy to również komórek przyściennych błony śluzowej żołądka oraz komórek groniastych ślinianek.
W przeciwieństwie do tarczycy, która uwalnia sodu nadtechnecjan (99mTc) do krwi, gruczoły ślinowe i
żołądek wydzielają sodu nadtechnecjan (99mTc) odpowiednio do śliny i soków żołądkowych. Akumulacja w gruczołach ślinowych jest na poziomie 0,5% podanej aktywności. Przy czym maksymalny poziom osiągnięty jest po około 20 minutach. Po godzinie od wstrzyknięcia stężenie w ślinie jest od około 10- do 30-krotnie większe niż w osoczu. Wydzielanie można przyspieszyć poprzez podanie soku z cytryny lub stymulację przywspółczulnego układu nerwowego.
Eliminacja
Okres półtrwania w osoczu wynosi około 3 godziny. Sodu nadtechnecjan (99mTc) nie jest metabolizowany w organizmie. Jedna frakcja jest wydalana przez nerki bardzo szybko, reszta wolniej z kałem, śliną i płynem łzowym. Przez pierwsze 24 godziny od podania związek jest wydalany głównie z moczem (około 25%), przez następne 48 godzin - z kałem. Około 50% dawki jest wydalane w czasie 50 godzin od podania. Jeśli podano wcześniej produkt blokujący wychwyt nadtechnecjanu (99mTc) przez narządy gruczołowe, wydalanie odbywa się w sposób opisany powyżej, klirens nerkowy jest jednak wyższy.
Powyższe dane nie dotyczą zastosowania sodu nadtechnecjanu (99mTc) do znakowania innych radiofarmaceutyków.
Brak danych dotyczących ostrej, podostrej oraz przewlekłej toksyczności po podaniu pojedynczej dawki oraz dawek wielokrotnych. Ilość sodu nadtechnecjanu (99mTc) podawanego podczas badań diagnostycznych jest bardzo mała. Nie obserwowano innych reakcji poza alergicznymi.
Produkt leczniczy nie jest przeznaczony do regularnego ani ciągłego stosowania.
Nie prowadzono badań mutagenności ani długoterminowych badań dotyczących działania rakotwórczego.
Toksyczność reprodukcyjna:
Stopień przechodzenia 99mTc z podanego dożylnie roztworu sodu nadtechnecjanu (99mTc) przez łożysko badano u myszy. Jeśli nie podano wcześniej nadchlorku, w ciężarnej macicy gromadziło się nawet 60% podanej dawki 99mTc. Badania prowadzone u myszy ciężarnych, w trakcie ciąży, w ciąży i karmiących oraz tylko karmiących wykazały zmiany u potomstwa, takie jak zmniejszenie masy ciała, brak owłosienia oraz bezpłodność.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Kolumna:
Glinu tlenek.
Roztwór do elucji:
Sodu chlorek, sodu azotan, woda do wstrzykiwań.
Niezgodności farmaceutyczne
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 12.
Okres ważności
Generator: 21 dni od daty wytworzenia.
Data kalibracji i termin ważności są podane na etykiecie.
Eluat sodu nadtechnecjanu (99mTc): po elucji zużyć w ciągu 10 godzin do 10 pobrań Ten produktu leczniczy nie wymaga żadnych specjalnych warunków przechowywania. Fiolki do elucji: 24 miesiące.
Specjalne środki ostrożności podczas przechowywania
Generator: Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. Eluat: warunki przechowywania produktu leczniczego po elucji patrz punkt 6.3.
Fiolki do elucji: Nie przechowywać w temperaturze powyżej 25°C.
Radiofarmaceutyki należy przechowywać zgodnie z obowiązującymi przepisami dotyczącymi materiałów radioaktywnych.
Rodzaj i zawartość opakowania
Generator TEKCIS jest dostarczany w pojemniku transportowym typu A. Składa się z:
250 ml miękkiego worka z PP zawierającego roztwór do elucji (1), połączonego igłą ze stali nierdzewnej (2) z górną częścią kolumny chromatograficznej;
szklanej kolumny chromatograficznej (3) zamkniętej na obu końcach silikonowymi korkami i spiekami ze stali nierdzewnej (4). Kolumna zawiera glinu tlenek, na którym zaadsorbowany jest
99Mo.
igły wylotowej (5) połączonej z dolną częścią kolumny. Drugi koniec igły (6) może być podłączony do fiolki elucyjnej w celu elucji kolumny lub fiolki ochronnej (STE-ELU) w celu utrzymania sterylności między dwoma elucjami.
Kolumna z glinu tlenkiem oraz igła są chronione cylindryczno-stożkową osłoną ołowianą lub wolframową (7). Generatory do 25 GBq technetu (99mTc) są chronione ołowianą osłoną, a generatory 50 GBq są chronione osłoną wolframową.
Cały system jest umieszczony w plastikowej obudowie o kształcie równoległościanu (23 x 21 x 14 cm) (8-9).
Igła do elucji wystaje z górnej części plastikowej osłony, chronionej nasadką transportową lub fiolką ochronną (STE-ELU).
Obok igły do elucji znajduje się zawór bezpieczeństwa (10), zamykany na czas transportu.
Akcesoria w zestawie z generatorem:
worek zawierający 10 sterylnych, wolnych od pirogenów fiolek do elucji (TC-ELU-5) (11) umożliwiających elucję od 5 ml do 6 ml.
sterylna fiolka zabezpieczająca igłę do elucji (STE-ELU). Każda fiolka do elucji lub fiolka ochronna to 15 ml, bezbarwna fiolka ze szkła typu I, zamknięta gumowym korkiem i aluminiowym wieczkiem.
Pojemnik na elucję (12) jest dostarczany z pierwszą dostawą.
Inne dostępne akcesoria:
zestawy zawierające fiolki 10 x 15 ml:
fiolki umożliwiające elucję od 5 do 6 ml;
fiolki umożliwiające elucję od 9 do 11 ml;
fiolki umożliwiające elucję od 14 do 16 ml.
dodatkowe przesłony ołowiane dostosowany do generatora TEKCIS: PROTECT ELU.
Wielkość opakowań:
aktywność 99mTc (maksymalna teoretyczna aktywność elucyjna na dzień
kalibracji, godz. 12 CET)
2
4
6
8
10
12
16
20
25
50
GBq
aktywność 99Mo
(na dzień kalibracji, godz. 12 CET)
2,5
5
7
9,5
12
14,5
19
24
30
60
GBq
Schemat generatora TEKCIS w trybie elucji
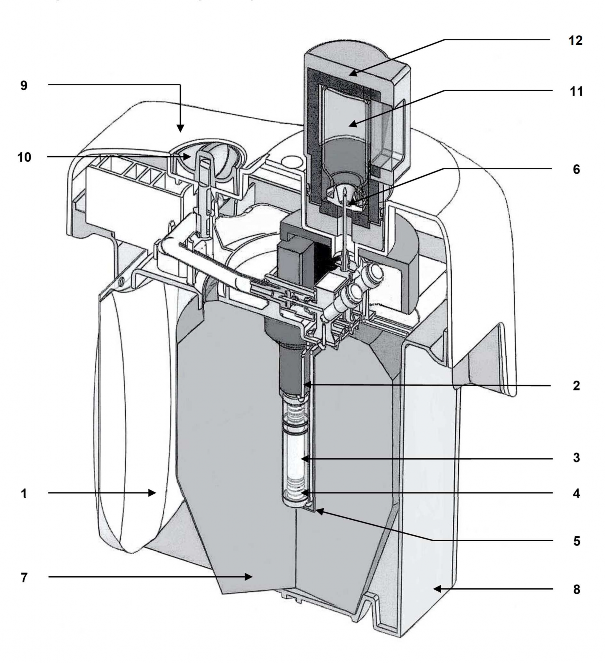
worek z roztworem do elucji ołowiane lub wolframowe cylindryczno- 7
stożkowe osłony
igła łącząca dolna plastikowa osłona 8
szklana kolumna chromatograficzna górna plastikowa osłona 9
korek silikonowy + spieki ze stali nierdzewnej
zawór bezpieczeństwa 10
igła wylotowa ze stali nierdzewnej fiolka elucyjna 11
igła elucyjna pojemnik elucyjny 12
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Ogólne ostrzeżenia
Radiofarmaceutyk może być otrzymywany, używany i podawany chorym tylko przez osoby mające odpowiednie uprawnienia, w wyznaczonych do tego placówkach klinicznych. Otrzymywanie, magazynowanie, użycie, przenoszenie i utylizacja podlegają przepisom i (lub) odpowiednim licencjom właściwych organizacji.
Radiofarmaceutyki powinny być przygotowywane w sposób odpowiedni do wymagań dotyczących zarówno zasad bezpieczeństwa radiologicznego, jak i jakości farmaceutyków. Powinno zapewnić się odpowiednie warunki aseptyczne.
Nie należy stosować generatora lub fiolki z eluatem, jeżeli zauważy się jakiekolwiek ślady uszkodzenia.
Produkt leczniczy należy podawać w taki sposób, aby zminimalizować ryzyko zanieczyszczenia produktu leczniczego i napromieniowania osoby go podającej. Konieczne jest stosowanie odpowiednich osłon.
Podawanie chorym radioaktywnych produktów leczniczych stwarza niebezpieczeństwo skażenia dla osób postronnych, np. moczem lub wymiocinami pacjenta. Należy zatem przestrzegać zasad ochrony radiologicznej zgodnych z obowiązującymi przepisami krajowymi.
Przed utylizacją generatora należy określić jego pozostałą radioaktywność.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
CIS bio international Route Nationale 306
BP 32 SACLAY
F-91192 Gif-sur-Yvette Cedex Francja
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr:
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
DOZYMETRIA
Dane wymienione poniżej pochodzą z ICRP 80 i są obliczane według następujących założeń:
Wartości dawek, gdy pacjent nie otrzymał produktu blokującego:
Narząd
Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq]
Dorośli
15 lat
10 lat
5 lat
1 rok
Nadnercza
0,0037
0,0047
0,0072
0,011
0,019
Ściana pęcherza
moczowego
0,018
0,023
0,030
0,033
0,060
Powierzchnia kości
0,0054
0,0066
0,0097
0,014
0,026
Mózg
0,0020
0,0025
0,0041
0,0066
0,012
Sutki
0,0018
0,0023
0,0034
0,0056
0,011
Pęcherzyk żółciowy
0,0074
0,0099
0,016
0,023
0,035
Przewód pokarmowy
- Ściana żołądka
0,026
0,034
0,048
0,078
0,16
- Jelito cienkie
0,016
0,020
0,031
0,047
0,082
- Okrężnica
0,042
0,054
0,088
0,14
0,27
- Ściana okrężnicy wstępującej
0,057
0,073
0,12
0,20
0,38
- Ściana okrężnicy zstępującej
0,021
0,028
0,045
0,072
0,13
Serce
0,0031
0,0040
0,0061
0,0092
0,017
Nerki
0,0050
0,0060
0,0087
0,013
0,021
Wątroba
0,0038
0,0048
0,0081
0,013
0,022
Płuca
0,0026
0,0034
0,0051
0,0079
0,014
Mięśnie
0,0032
0,0040
0,0060
0,0090
0,016
Przełyk
0,0024
0,0032
0,0047
0,0075
0,014
Jajniki
0,010
0,013
0,018
0,026
0,045
Trzustka
0,0056
0,0073
0,011
0,016
0,027
Szpik kostny
0,0036
0,0045
0,0066
0,0090
0,015
Ślinianki
0,0093
0,012
0,017
0,024
0,039
Skóra
0,0018
0,0022
0,0035
0,0056
0,010
Śledziona
0,0043
0,0054
0,0081
0,012
0,021
Jądra
0,0028
0,0037
0,0058
0,0087
0,016
Grasica
0,0024
0,0032
0,0047
0,0075
0,014
Tarczyca
0,022
0,036
0,055
0,12
0,22
Macica
0,0081
0,010
0,015
0,022
0,037
Pozostałe tkanki
0,0035
0,0043
0,0064
0,0096
0,017
Dawka skuteczna (mSv/MBq)
0,013
0,017
0,026
0,042
0,079
Wartości dawek, gdy pacjent otrzymał produkt blokujący:
Narząd | Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq], gdy pacjent otrzymał produkt blokujący | ||||
Dorośli | 15 lat | 10 lat | 5 lat | 1 lat | |
Nadnercza | 0,0029 | 0,0037 | 0,0056 | 0,0086 | 0,016 |
Ściana pęcherza moczowego | 0,030 | 0,038 | 0,048 | 0,050 | 0,091 |
Powierzchnia kości | 0,0044 | 0,0054 | 0,0081 | 0,012 | 0,022 |
Mózg | 0,0020 | 0,0026 | 0,0042 | 0,0071 | 0,012 |
Sutki | 0,0017 | 0,0022 | 0,0032 | 0,0052 | 0,010 |
Pęcherzyk żółciowy | 0,0030 | 0,0042 | 0,0070 | 0,010 | 0,013 |
Przewód pokarmowy | |||||
- Ściana żołądka | 0,0027 | 0,0036 | 0,0059 | 0,0086 | 0,015 |
- Jelito cienkie | 0,0035 | 0,0044 | 0,0067 | 0,010 | 0,018 |
- Okrężnica | 0,0036 | 0,0048 | 0,0071 | 0,010 | 0,018 |
- Ściana okrężnicy wstępującej | 0,0032 | 0,0043 | 0,0064 | 0,010 | 0,017 |
- Ściana okrężnicy zstępującej | 0,0042 | 0,0054 | 0,0081 | 0,011 | 0,019 |
Serce | 0,0027 | 0,0034 | 0,0052 | 0,0081 | 0,014 |
Nerki | 0,0044 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Wątroba | 0,0026 | 0,0034 | 0,0053 | 0,0082 | 0,015 |
Płuca | 0,0023 | 0,0031 | 0,0046 | 0,0074 | 0,013 |
Mięśnie | 0,0025 | 0,0031 | 0,0047 | 0,0072 | 0,013 |
Przełyk | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Jajniki | 0,0043 | 0,0054 | 0,0078 | 0,011 | 0,019 |
Trzustka | 0,0030 | 0,0039 | 0,0059 | 0,0093 | 0,016 |
Szpik kostny | 0,0025 | 0,0032 | 0,0049 | 0,0072 | 0,013 |
Skóra | 0,0016 | 0,0020 | 0,0032 | 0,0052 | 0,0097 |
Śledziona | 0,0026 | 0,0034 | 0,0054 | 0,0083 | 0,015 |
Jądra | 0,0030 | 0,0040 | 0,0060 | 0,0087 | 0,016 |
Grasica | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Tarczyca | 0,0024 | 0,0031 | 0,0050 | 0,0084 | 0,015 |
Macica | 0,0060 | 0,0073 | 0,011 | 0,014 | 0,023 |
Pozostałe tkanki | 0,0025 | 0,0031 | 0,0048 | 0,0073 | 0,013 |
Dawka skuteczna (mSv/MBq) | 0,0042 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Dawka skuteczna po podaniu dożylnym 400 MBq sodu nadtechnecjanu (99mTc) dorosłemu pacjentowi o masie ciała 70 kg wynosi 5,2 mSv.
Po zastosowaniu produktu o właściwościach blokujących i podaniu 400 MBq sodu
nadtechnecjanu (99mTc) dorosłemu pacjentowi o masie ciała 70 kg dawka skuteczna wynosi 1,7 mSv.
Dawka promieniowania pochłonięta przez soczewkę oka po podaniu sodu nadtechnecjanu (99mTc) celem wykonania scyntygrafii kanałów łzowych jest szacowana na 0,038 mGy/MBq. Podanie aktywności wynoszącej 4 MBq powoduje pochłonięcie dawki skutecznej nieprzekraczającej 0,01 mSv.
Podane dawki promieniowania mają zastosowanie w przypadku, kiedy narządy pochłaniające sodu nadtechnecjan (99mTc) funkcjonują prawidłowo. Nadczynność/niedoczynność (np. tarczycy, błony śluzowej żołądka i nerek) oraz długotrwałe procesy z zaburzeniem bariery krew-mózg lub upośledzeniem eliminacji przez nerki mogą prowadzić do zmian w narażeniu na promieniowanie, prowadząc lokalnie do jego bardzo znacznego wzrostu.
Narażenie na promieniowanie zewnętrzne
Moc dawki 99Mo-99mTc na powierzchni generatora (μSv/h.GBq) | Moc dawki 99Mo-99mTc w odległości 1 m od generatora (μSv/h.GBq) | |
Osłona ołowiana 41 mm | 16 | 0,3 |
Dawki powierzchniowe i dawka skumulowana zależą od wielu czynników. Ogólnie rzecz biorąc, pomiar promieniowania w otoczeniu i podczas pracy ma kluczowe znaczenie i powinien być wykonywany.
INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
Elucję generatora należy przeprowadzać w pomieszczeniach zgodnych z krajowymi przepisami dotyczącymi bezpieczeństwa użytkowania produktów radioaktywnych.
Eluat jest przezroczystym i bezbarwnym roztworem nadtechnecjanu sodu (99mTc) o pH między 4,5 a 7,5 i czystości radiochemicznej równej lub większej niż 95%.
Jeżeli roztwór sodu nadtechnecjanu (99mTc) jest zastosowany do znakowania zestawu, należy zapoznać się z ulotką dołączoną do opakowania tego zestawu.
Przygotowanie
Zdezynfekować korek fiolek do elucji przed każdą elucją. Uwaga:
Nie używać etanolu ani eteru etylowego do dezynfekcji korka fiolki do elucji, ponieważ może to zakłócać proces elucji.
Podczas transportu sterylność igły elucyjnej chroni nasadka.
Chronić igłę do elucji przed możliwym zanieczyszczeniem bakteryjnym, umieszczając fiolkę ochronną na igle między dwoma eluatami.
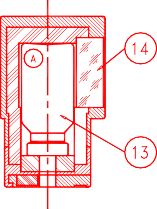
Przestrzegać następującej sekwencji, aby uzyskać zadowalające wyniki:
Pierwsza elucja:
Używając generatora po raz pierwszy, OTWORZYĆ zawór bezpieczeństwa (10) do pozycji ON PRZED podłączeniem fiolki do elucji. Nigdy nie zamykać zaworu bezpieczeństwa pomiędzy dwoma eluatami. Zawór bezpieczeństwa zamykać dopiero na czas utylizacji generatora.
Aby eluować generator, nałożyć nasadkę lub fiolkę ochronną na pojemnik do elucji (A) zawierający fiolkę próżniową do elucji (oznaczoną „TC-ELU”) odpowiadającą żądanej objętości elucji (13).
Elucję można obserwować przez okienko ze szkła ołowiowego (14) pojemnika (A). Odczekać dwie minuty do pełnej elucji.
Przed użyciem sprawdzić klarowność eluatu i wyrzucić, jeśli roztwór nie jest przejrzysty. Po elucji natychmiast założyć fiolkę ochronną na igłę, aby zachować jej sterylność.
Objętości elucji:
Tekcis to generator opracowany do elucji całej dostępnej aktywności technetu-99m w objętości 5 ml. Elucje frakcjonowane są zatem niepotrzebne. Można jednak przeprowadzić elucje do większych objętości: 10 ml lub 15 ml.
Możliwości zastosowania:
Aktywność podana na etykiecie generatora wyrażona jest w technecie-99m, dostępnym na dzień kalibracji (12:00 CET).
Dostępność technetu-99m zależy od:
aktywności molibdenu-99 w momencie elucji;
czasu od ostatniej elucji. Kontrola jakości
Radioaktywność oraz tzw. „przebicie” molibdenu (99Mo) muszą być sprawdzone przed użyciem.
Sprawdzenie „przebicia” molibdenu (99Mo) może być przeprowadzone zgodnie z Farmakopeą Europejską lub też każdą inną zwalidowaną metodą umożliwiającą określenie zawartości molibdenu (99Mo) poniżej 0,1% całkowitej radioaktywności na dzień i godzinę podania.
Masa technetu (99mTc + 99Tc) obecnego w eluacie:
Molibden-99 jest przekształcany w technet-99m (87,6% całego rozpadu molibdenu-99) i technet-99 (12,4% całego rozpadu molibdenu-99). Całkowitą masę technetu ((99mTc) + (99Tc)) wyrażoną w µg technetu obecnego w eluacie można obliczyć według następującego uproszczonego wzoru:
M(µg) = aktywność technetu-99m w eluacie x k
F
k = 5,161,10-3 (aktywność wyrażona w GBq)
F to stosunek liczby atomów technetu-99m (N99m) do całkowitej liczby atomów technetu (Nt): F = N99m
Nt
Wartości tego stosunku (F) w funkcji odstępu między dwoma elucjami przedstawia poniższa tabela:
Godziny | Dni | ||||||
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
0 | - | 0,277 | 0,131 | 0,076 | 0,0498 | 0,0344 | 0,0246 |
3 | 0,727 | 0,248 | 0,121 | 0,072 | 0,0474 | 0,0329 | 0,0236 |
6 | 0,619 | 0,223 | 0,113 | 0,068 | 0,0452 | 0,0315 | 0,0227 |
9 | 0,531 | 0,202 | 0,105 | 0,064 | 0,0431 | 0,0302 | 0,0218 |
12 | 0,459 | 0,184 | 0,098 | 0,061 | 0,0411 | 0,0290 | 0,0210 |
15 | 0,400 | 0,168 | 0,092 | 0,058 | 0,0393 | 0,0278 | 0,0202 |
18 | 0,352 | 0,154 | 0,086 | 0,055 | 0,0375 | 0,0266 | 0,0194 |
21 | 0,311 | 0,141 | 0,081 | 0,052 | 0,0359 | 0,0256 | 0,0187 |
Przykłady:
Technet-99m z generatora jest eluowany do objętości 5 ml; zmierzona aktywność wynosi 10 GBq; poprzednią elucję przeprowadzono 27 godzin wcześniej.
Masa technetu wynosi:
M(µg) = 10 x 5,161,10-3 = 0,208 µg
0,248
tzn: 0,042 µg/mL
Technet-99m z generatora jest eluowany 4 dni po przygotowaniu (co odpowiada pierwszej elucji). Dla aktywności 10 GBq w 5 ml eluatu masa technetu wynosi:
M(µg) = 10 x 5,161,10-3 = 1,036 µg
0,0498
tzn: 0,207 µg/ml, czyli pięć razy więcej technetu niż w poprzednim przykładzie. Ta ilość technetu, mimo iż jest niewielka, może wpływać na wydajność znakowania niektórych związków.
Pierwszy eluat uzyskany z tego generatora może być normalnie używany, o ile nie określono inaczej. Eluaty eluowane nawet później niż 24 godziny od ostatniej elucji mogą być użyte do znakowania zestawu, o ile nie jest to wykluczone w ChPL odpowiedniego zestawu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
OZNAKOWANIE OPAKOWAŃ
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH
Generator
1. NAZWA PRODUKTU LECZNICZEGO
TEKCIS, 2-50 GBq, generator radionuklidu
natrii pertechnetatis (99mTc) fissione formati solutio iniectabilis
2. ZAWARTOŚĆ SUSBSTANCJI CZYNNEJ
Sodu nadtechnecjan (99mTc): aktywność generatora określona na dzień kalibracji. Aktywność 99mTc: GBq określona na dzień kalibracji (12:00 CET)
Aktywność 99mTc: GBq określona na dzień wytworzenia (12:00 CET)
3. WYKAZ SUBSTANCJI POMOCNICZYCH
Substancje pomocnicze: sodu chlorek, sodu azotan i woda do wstrzykiwań.
4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
Generator radionuklidu. Dawkowanie wielokrotne
3 | 6 | 6 | 1 | 5 | 4 | 1 | 1 | 0 | 0 | 4 | 0 | 5 |
Kod:
5. SPOSÓB I DROGI PODANIA
Podanie dożylne lub do oka.
Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
6.
OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI
7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
Produkt leczniczy radiofarmaceutyczny. Symbol radioaktywności
8. TERMIN WAŻNOŚCI
EXP {DD/MM/RRRR} (12:00 CET)
Po elucji zużyć w ciągu 10 godzin, maksymalnie do 10 pobrań.
9. SPECJALNE WARUNKI PRZECHOWYWANIA
10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI WŁAŚCIWE
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy przechowywać i usunąć zgodnie z lokalnymi przepisami.
11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
Podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu / Wytwórca
CIS bio international
F-91192 Gif-sur-Yvette Cedex
12. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr:
13. NUMER SERII
Nr serii (Lot):
14. OGÓLNA KATEGORIA DOSTĘPNOŚCI
Rpz - Lek wydawany na receptę.
15. INSTRUKCJA UŻYCIA
16. INFORMACJA PODANA SYSTEMEM BRAILLE’A
Zaakceptowano uzasadnienie braku informacji systemem Braille’a.
17. NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
Nie dotyczy.
18. NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
Nie dotyczy.
MINIMUM INFORMACJI ZAMIESZCZANYCH NA MAŁYCH OPAKOWANIACH BEZPOŚREDNICH
Sterylna szklana fiolka próżniowa
1. NAZWA PRODUKTU LECZNICZEGO I DROGA PODANIA
TC-ELU
2. SPOSÓB PODAWANIA
3. TERMIN WAŻNOŚCI
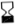
MM/RRRR
4. NUMER SERII<, KODY DONACJI I PRODUKTU>
LOT
5.
ZAWARTOŚĆ OPAKOWANIA Z PODANIEM MASY, OBJĘTOŚCI LUB LICZBY JEDNOSTEK
Poziom elucji w zależności od użytej fiolki: 5
6. INNE
STERILE
Cis bio international
ULOTKA DLA PACJENTA
Ulotka dołączona do opakowania: informacja dla pacjenta
TEKCIS, 2-50 GBq, generator radionuklidu
natrii pertechnetatis (99mTc) fissione formati solutio iniectabilis
Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza medycyny nuklearnej, który będzie nadzorował zabieg.
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi medycyny nuklearnej. Patrz punkt 4.
Spis treści ulotki
Co to jest lek TEKCIS i w jakim celu się go stosuje
gruczoł tarczycy
gruczoły ślinowe
tkanka żołądka pojawiająca się w nieprawidłowym miejscu (uchyłek Meckela)
kanaliki łzowe oczu.
Roztwór nadtechnecjanu sodu (99mTc) może być również stosowany w skojarzeniu z innym produktem do przygotowania innego leku radiofarmaceutycznego. W takiej sytuacji patrz odnośna ulotka dołączona do opakowania.
Lekarz medycyny nuklearnej wyjaśni pacjentowi charakter badania, które zostanie przeprowadzone z zastosowaniem tego produktu.
Stosowanie roztworu nadtechnecjanu sodu (99mTc) wiąże się z ekspozycją na niewielkie ilości radioaktywności. Lekarz prowadzący i lekarz medycyny nuklearnej uznali, że korzyści kliniczne, jakie pacjent odniesie z zabiegu z użyciem radiofarmaceutyku, przewyższają ryzyko związane z promieniowaniem.
Tekcis jest produktem radiofarmaceutycznym stosowanym wyłącznie do celów diagnostycznych.
Tekcis jest generatorem technetu (99mTc), co oznacza, że jest to urządzenie stosowane do uzyskania roztworu do wstrzykiwań nadtechnecjanu sodu (99mTc). Kiedy radioaktywny roztwór zostaje wstrzyknięty do organizmu, tymczasowo gromadzi się on w niektórych częściach ciała. Niewielką ilość podanych związków promieniotwórczych można wykryć spoza organizmu z użyciem specjalnych kamer. Lekarz medycyny nuklearnej następnie wykona zdjęcie (skan) danego narządu, co dostarczy mu cennych informacji na temat struktury i czynności tego narządu.
Po wstrzyknięciu roztwór nadtechnecjanu sodu (99mTc) służy do uzyskania obrazów różnych części ciała, takich jak:
Informacje ważne przed zastosowaniem roztworu nadtechnecjanu sodu (99mTc) uzyskanego z użyciem leku TEKCIS
Kiedy nie stosować roztworu nadtechnecjanu sodu (99mTc) uzyskanego z użyciem leku Tekcis
jeśli pacjent ma uczulenie na nadtechnecjan sodu (99mTc) lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Ostrzeżenia i środki ostrożności
Należy poinformować lekarza medycyny nuklearnej, jeśli:
pacjent ma uczulenia, ponieważ po podaniu roztworu nadtechnecjanu sodu (99mTc) zaobserwowano kilka przypadków reakcji alergicznych,
pacjent choruje na chorobę nerek,
pacjentka jest w ciąży lub przypuszcza, że może być w ciąży,
pacjentka karmi piersią.
Lekarz medycyny nuklearnej poinformuje pacjenta, czy konieczne jest podjęcie specjalnych środków ostrożności po zastosowaniu tego leku. W przypadku wątpliwości należy skonsultować się z lekarzem medycyny nuklearnej.
Przed podaniem roztworu nadtechnecjanu sodu (99mTc) pacjent powinien:
pić dużo wody przed rozpoczęciem badania, aby jak najczęściej oddawać mocz podczas pierwszych godzin po badaniu.
być na czczo przez 3 do 4 godzin przed scyntygrafią uchyłka Meckela, aby utrzymać
możliwie powolną pracę jelita cienkiego.
Dzieci i młodzież
Osoby w wieku poniżej 18 lat lub rodzice takich osób powinni porozumieć się z lekarzem medycyny nuklearnej.
Roztwór nadtechnecjanu sodu (99mTc) a inne leki
Należy powiedzieć lekarzowi medycyny nuklearnej o wszystkich lekach przyjmowanych przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować, ponieważ mogą one utrudniać interpretację zdjęć. W szczególności dotyczy to następujących leków:
atropina, używana np. do:
zmniejszenia skurczów żołądka, jelit lub pęcherzyka żółciowego,
zmniejszenia wydzieliny trzustki,
w okulistyce,
przed podaniem znieczulenia,
w leczeniu spowolnionego bicia serca lub
jako antidotum
izoprenalina, lek stosowany w leczeniu spowolnionego bicia serca
leki przeciwbólowe
środki przeczyszczające (nie należy ich stosować podczas tego zabiegu, gdyż podrażniają przewód pokarmowy)
jeśli pacjent przechodził badania z kontrastem (np. z użyciem środka kontrastowego z barem) lub badanie górnego odcinka przewodu pokarmowego (ponieważ należy ich unikać na 48 godzin przed scyntygrafią uchyłka Meckela)
leki przeciwtarczycowe (np. karbimazol lub inne pochodne imidazolu, takie jak
propylotiouracyl, salicylany, steroidy, nitroprusydek sodu, sulfobromoftaleina sodu, nadchloran) (nie należy ich przyjmować na 1 tydzień przed scyntygrafią)
fenylobutazon w leczeniu gorączki, bólu i stanów zapalnych w organizmie (nie należy go
przyjmować na 2 tygodnie przed scyntygrafią)
środki wykrztuśne (nie należy ich przyjmować na 2 tygodnie przed scyntygrafią)
preparaty zawierające naturalne lub syntetyczne hormony tarczycy (np. tyroksyna sodowa, liotyronina sodowa, ekstrakt z tarczycy) (nie należy ich przyjmować przez 2-3 tygodnie przed scyntygrafią)
amiodaron - lek przeciwarytmiczny (nie należy go przyjmować przez 4 tygodnie przed
scyntygrafią)
benzodiazepiny stosowane np. w sedacji lub jako leki przeciwlękowe, przeciwdrgawkowe lub zwiotczające mięśnie lub związki litu stosowane jako stabilizator nastroju w chorobie maniakalno-depresyjnej (ponieważ obu nie należy przyjmować na 4 tygodnie przed scyntygrafią)
jodkowe środki kontrastowe do badań radiologicznych organizmu (ponieważ nie powinny być
podawane na 1-2 miesiące przed scyntygrafią)
Przed zażyciem jakichkolwiek leków należy zapytać lekarza medycyny nuklearnej.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub gdy planuje mieć dziecko, powinna poradzić się lekarza medycyny nuklearnej przed otrzymaniem tego leku.
Pacjentka musi poinformować lekarza medycyny nuklearnej przed otrzymaniem roztworu nadtechnecjanu sodu (99mTc), jeśli istnieje możliwość, że jest w ciąży, jeśli opóźnia się jej miesiączka lub jeśli karmi piersią. W przypadku wątpliwości należy skonsultować się z lekarzem medycyny nuklearnej, który będzie nadzorował procedurę.
Jeśli pacjentka jest w ciąży, lekarz medycyny nuklearnej poda lek w czasie ciąży wyłącznie, jeśli oczekiwana korzyść z badania znacznie przewyższa ryzyko.
Jeśli pacjentka karmi piersią, powinna poinformować o tym lekarza medycyny nuklearnej, ponieważ zaleci on zaprzestanie karmienia do czasu wyeliminowania radioaktywności z organizmu. Trwa to około 12 godzin. Wydzielone w tym czasie mleko należy wyrzucić. Wznowienie karmienia piersią należy uzgodnić ze specjalistą medycyny nuklearnej, który będzie nadzorował badanie.
Prowadzenie pojazdów i obsługiwanie maszyn
Roztwór nadtechnecjanu sodu (99mTc) nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Roztwór nadtechnecjanu sodu zawiera sód
Roztwór nadtechnecjanu sodu zawiera 3,6 mg/ml sodu. W zależności od wstrzykniętej objętości może zostać przekroczony limit 1 mmol (23 mg) sodu na podaną dawkę. Należy to wziąć pod uwagę, jeśli pacjent jest na diecie o niskiej zawartości soli.
Jak stosuje się roztwór nadtechnecjanu sodu (99mTc) uzyskany z użyciem leku TEKCIS
Istnieją surowe przepisy dotyczące stosowania, obchodzenia się i usuwania produktów radiofarmaceutycznych. Tekcis będzie stosowany wyłącznie w specjalnych kontrolowanych obszarach. Produkt będą przygotowywały i podawały pacjentowi wyłącznie osoby, które są przeszkolone i wykwalifikowane do tego, by zrobić to w bezpieczny sposób. Osoby te dołożą wszelkich starań, by stosować produkt w bezpieczny sposób i by informować pacjenta o podejmowanych działaniach.
Lekarz medycyny nuklearnej nadzorujący procedurę zdecyduje o ilości roztworu nadtechnecjanu sodu (99mTc) do zastosowania w danym przypadku. Będzie to najmniejsza dawka niezbędna do uzyskania oczekiwanych informacji.
Ilość zwykle zalecana do podania osobom dorosłym w zależności od rodzaju wykonywanego badania wynosi od 2 do 400 MBq (megabekerel, jednostka używana do wyrażania radioaktywności).
Stosowanie u dzieci i młodzieży
U dzieci i młodzieży podawana ilość będzie dostosowana do masy ciała.
Podanie roztworu nadtechnecjanu sodu (99mTc) i przeprowadzenie badania
W zależności od celu badania produkt będzie podawany we wstrzyknięciu do żyły ramiennej lub może być wkroplony do oczu w postaci kropli.
Do przeprowadzenia badania potrzebnego lekarzowi wystarczy jedno podanie.
Czas trwania procedury
Lekarz medycyny nuklearnej poinformuje pacjenta o tym, jak długo zwykle trwa procedura.
Skany można wykonywać w dowolnym momencie, od momentu wstrzyknięcia i do 24 godzin po podaniu, w zależności od rodzaju badania.
Po podaniu roztworu nadtechnecjanu sodu (99mTc) pacjent powinien:
unikać bliskiego kontaktu z małymi dziećmi i kobietami w ciąży przez 12 godzin po wstrzyknięciu,
często oddawać mocz, aby usuwać produkt z organizmu,
po podaniu roztworu pacjent otrzyma napój i zostanie poproszony o oddanie moczu bezpośrednio przed badaniem.
Lekarz medycyny nuklearnej poinformuje pacjenta, czy konieczne jest podjęcie specjalnych środków ostrożności po otrzymaniu tego leku. W przypadku wszelkich pytań należy się skontaktować z lekarzem medycyny nuklearnej.
Zastosowanie większej niż zalecana dawki roztworu nadtechnecjanu sodu (99mTc) uzyskanego za pomocą leku Tekcis:
Przedawkowanie jest prawie niemożliwe, ponieważ pacjent otrzyma tylko pojedynczą dawkę roztworu nadtechnecjanu sodu (99mTc) dokładnie kontrolowaną przez lekarza medycyny nuklearnej nadzorującego procedurę. Jednak w przypadku przedawkowania pacjent otrzyma odpowiednie leczenie. W szczególności lekarz medycyny nuklearnej odpowiedzialny za zabieg może zalecić picie dużej ilości płynów w celu usunięcia śladów radioaktywności z organizmu.
W przypadku pytań dotyczących stosowania tego produktu należy zwrócić się do lekarza medycyny
nuklearnej, który nadzoruje procedurę.
Możliwe działania niepożądane
reakcje alergiczne z objawami, takimi jak
wysypka skórna, swędzenie
pokrzywka
obrzęki w różnych miejscach, m.in. twarzy
brak tchu (krótki, płytki oddech)
zaczerwienienie skóry
śpiączka
reakcje krążeniowe z objawami, takimi jak:
szybkie bicie serca, wolne bicie serca
omdlenie
nieostre widzenie
zawroty głowy
ból głowy
uderzenia gorąca z zaczerwienieniem skóry
zaburzenia ze strony przewodu pokarmowego z objawami, takimi jak
wymioty
nudności (mdłości)
biegunka
reakcje w miejscu wkłucia z objawami, takimi jak
stan zapalny skóry
ból
obrzęk (spuchnięcie)
zaczerwienienie.
Ten produkt radiofarmaceutyczny będzie dostarczał niewielkie ilości promieniowania jonizującego, co wiąże się z jak najmniejszym ryzykiem zachorowania na raka i wystąpienia dziedzicznych nieprawidłowości.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać bezpośrednio do:
Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Działania niepożądane o nieznanej częstości (na podstawie dostępnych danych nie można ustalić częstości):
Jak przechowywać lek TEKCIS
Pacjent nie będzie przechowywał tego produktu. Specjalista w danym zakładzie medycyny nuklearnej jest odpowiedzialny za jego przechowywanie. Przechowywanie produktów radiofarmaceutycznych będzie odbywało się zgodnie z krajowymi przepisami dotyczącymi przechowywania materiałów radioaktywnych.
Zawartość opakowania i inne informacje Co zawiera lek TEKCIS
Substancją czynną jest roztwór sodu nadtechnecjanu (99mTc).
Pozostałe składniki to: sodu chlorek, sodu azotan i woda do wstrzykiwań.
Jak wygląda lek TEKCIS i co zawiera opakowanie
Produktem jest roztwór sodu nadtechnecjanu (99mTc) otrzymywany z generatora radionuklidu. TEKCIS należy eluować, a otrzymany roztwór może być użyty sam lub do radioznakowania niektórych konkretnych zestawów do przygotowania radiofarmaceutyku.
Wielkość opakowań:
aktywność 99mTc
(maksymalna teoretyczna aktywność elucyjna na dzień
kalibracji, godz. 12 CET)
2
4
6
8
10
12
16
20
25
50
GBq
aktywność 99Mo
(na dzień kalibracji, godz. 12 CET)
2,5
5
7
9,5
12
14,5
19
24
30
60
GBq
Podmiot odpowiedzialny i wytwórca
CIS bio international Route Nationale306 BP 32 SACLAY
F-91192 Gif-sur-Yvette Cedex Francja
E-mail: drugsafety@curiumpharma.com, Tel: +33 1.69.85.76.76.
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru Gospodarczego pod następującymi nazwami:
Austria, Belgia, Bułgaria, Cypr, Chorwacja, Dania, Estonia, Finlandia, Francja, Niemcy, Grecja, Węgry, Irlandia, Włochy, Łotwa, Litwa, Luksemburg, Malta, Holandia, Norwegia, Polska, Portugalia, Rumunia, Słowacja, Słowenia, Hiszpania, Szwecja, Wielka Brytania: TEKCIS
Czechy: Technecistan-(99mTc) sodný CIS bio international
Data ostatniej aktualizacji ulotki:
Inne źródła informacji
Szczegółowe informacje o tym leku znajdują się na stronie internetowej Departament Rejestracji Produktów Leczniczych (https://rejestrymedyczne.ezdrowie.gov.pl/rpl/search/public)
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Kompletna ChPL produktu leczniczego Tekcis jest dostarczana jako osobny dokument w opakowaniu produktu w celu dostarczenia fachowemu personelowi medycznemu innych dodatkowych informacji naukowych i praktycznych na temat podawania i stosowania tego radiofarmaceutyku.
Proszę zapoznać się z ChPL (powinna znajdować się w opakowaniu).
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
TEKCIS, 2-50 GBq, generator radionuklidu
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Sodu nadtechnecjan (99mTc), roztwór do wstrzykiwań, otrzymywany jest z generatora (99Mo/99mTc). Technet (99mTc) rozpada się, emitując promieniowanie gamma o średniej energii 140 keV (jego okres półtrwania wynosi 6,01 h) do technetu (99Tc), który ze względu na długi okres półtrwania, wynoszący 2,13 x 105 lat, można uznać za quasi stabilny.
Generator radionuklidu zawierający izotop macierzysty 99Mo zaadsorbowany na kolumnie chromatograficznej dostarcza sodu nadtechnecjan (99mTc) do wstrzykiwań w postaci jałowego roztworu.
99Mo na kolumnie jest w stanie równowagi z wytworzonym izotopem pochodnym 99mTc. Generatory dostarczane są z określoną poniżej aktywnością 99Mo dla referencyjnego czasu aktywności, które dostarczają następujące ilości eluatu technetu (99mTc):
aktywność 99mTc (maksymalna teoretyczna aktywność elucyjna na dzień kalibracji, godz. 12 CET) | 2 | 4 | 6 | 8 | 10 | 12 | 16 | 20 | 25 | 50 | GBq |
aktywność 99Mo (na dzień kalibracji, godz. 12 CET) | 2,5 | 5 | 7 | 9,5 | 12 | 14,5 | 19 | 24 | 30 | 60 | GBq |
Ilość technetu (99mTc) otrzymywana podczas pojedynczej elucji zależy od rzeczywistej wydajności użytego generatora deklarowanej przez producenta i zatwierdzonej przez właściwy organ krajowy.
Substancja pomocnicza o znanym działaniu:
Każdy 1 ml roztworu sodu nadtechnecjanu (99mTc) zawiera 3,6 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Generator radionuklidu
Eluowany roztwór jest klarownym i bezbarwnym roztworem sodu nadtechnecjanu (99mTc) o pH między 4,5 a 7,5.
Produkt leczniczy przeznaczony wyłącznie do diagnostyki.
Eluat otrzymywany z generatora radionuklidu (sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań) jest wskazany do:
Znakowania zestawów do sporządzania radiofarmaceutyków opracowanych i zatwierdzonych do znakowania tym roztworem.
Scyntygrafii tarczycy: poprzez bezpośrednie obrazowanie oraz pomiar wychwytu związku przez tarczycę, pozwala ocenić położenie, rozmiar, strukturę tkanki gruczołowej oraz funkcję narządu w przypadku chorób tarczycy.
Scyntygrafii gruczołów ślinowych: rozpoznanie przewlekłego zapalenia ślinianki (np.: zespół Sjögrena), jak również oceny funkcji wydzielniczej tkanki gruczołowej oraz drożności przewodów wyprowadzających oraz kontrolowanie odpowiedzi na działania lecznicze (w szczególności terapia radiojodem).
Lokalizacji ektopowej błony śluzowej żołądka (uchyłek Meckela).
Scyntygrafii kanalików łzowych: ocena niedrożności kanalików łzowych oraz kontrolowanie odpowiedzi na działania lecznicze.
Dawkowanie i sposób podawania
Scyntygrafia tarczycy: 20-80 MBq.
Scyntygrafia gruczołów ślinowych: od 30 do 150 MBq dla obrazów statycznych i do 370 MBq dla obrazów dynamicznych.
Scyntygrafia uchyłka Meckela: 300-400 MBq.
Scyntygrafia kanalików łzowych: 2-4 MBq na jedno oko.
Niewydolność nerek
Należy zachować szczególną ostrożność przy dawkowaniu aktywności pacjentom z niewydolnością nerek, gdyż stanowią oni grupę zwiększonego narażenia na promieniowanie.
Dzieci i młodzież
Dawkowanie należy szczególnie ostrożnie rozważyć u dzieci i młodzieży, biorąc pod uwagę wskazania kliniczne i ocenę stosunku korzyści do ryzyka w tej grupie pacjentów.
Aktywność do podania u dzieci i młodzieży określa się zgodnie z zaleceniami podanymi w karcie dawkowania pediatrycznego Europejskiego Towarzystwa Medycyny Nuklearnej (ang. European Association of Nuclear Medicine, EANM). Aktywność do podania u dzieci i młodzieży określa się, mnożąc bazową aktywność (podaną na potrzeby obliczeń) przez podany w poniższej tabeli współczynnik zależności wagowej (patrz tabela 1).
A[MBq] Dawkowanie = aktywność bazowa × współczynnik
Scyntygrafia tarczycy:
Podana aktywność [MBq] = 5,6 MBq x współczynnik korygujący (tabela 1). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka:
Podana aktywność [MBq] = 10,5 MBq x współczynnik korygujący (tabela 1). Minimalna aktywność wymagana do uzyskania obrazu wystarczającej jakości wynosi 20 MBq.
Tabela 1: Współczynniki zależności wagowej stosowane przy dawkowaniu u dzieci i młodzieży (w scyntygrafii tarczycy i identyfikacji/lokalizacji ektopowej błony śluzowej żołądka) zgodnie z wytycznymi EANM - maj 2008 r.
Masa ciała
Współczynnik
Masa ciała
Współczynnik
Masa ciała
Współczynnik
3 kg
=
1
22 kg
=
5,29
42 kg
= 9,14
4 kg
=
1,14
24 kg
=
5,71
44 kg
= 9,57
6 kg
=
1,71
26 kg
=
6,14
46 kg
= 10,00
8 kg
=
2,14
28 kg
=
6,43
48 kg
= 10,29
10 kg
=
2,71
30 kg
=
6,86
50 kg
= 10,71
12 kg
=
3,14
32 kg
=
7,29
52-54 kg
= 11,29
14 kg
=
3,57
34 kg
=
7,72
56-58 kg
= 12,00
16 kg
=
4,00
36 kg
=
8,00
60-62 kg
= 12,71
18 kg
=
4,43
38 kg
=
8,43
64-66 kg
= 13,43
20 kg
=
4,86
40 kg
=
8,86
68 kg
= 14,00
Scyntygrafia gruczołów ślinowych:
Pediatryczna Grupa Robocza EANM (1990) zaleca wyliczenie dawki należnej na podstawie masy ciała dziecka zgodnie z tabelą podaną poniżej (patrz tabela 2). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Tabela 2: Współczynnik zależności wagowej stosowany przy dawkowaniu u dzieci i młodzieży (w scyntygrafii gruczołów ślinowych) zgodnie z zaleceniami EANM z roku 1990:
Masa ciała
Współczynnik
Masa ciała
Współczynnik
Masa ciała
Współczynnik
3 kg
=
0,1
22 kg
= 0,50
42 kg
= 0,78
4 kg
=
0,14
24 kg
= 0,53
44 kg
= 0,80
6 kg
=
0,19
26 kg
= 0,56
46 kg
= 0,82
8 kg
=
0,23
28 kg
= 0,58
48 kg
= 0,85
10 kg
=
0,27
30 kg
= 0,62
50 kg
= 0,88
12 kg
=
0,32
32 kg
= 0,65
52-54 kg
= 0,90
14 kg
=
0,36
34 kg
= 0,68
56-58 kg
= 0,92
16 kg
=
0,40
36 kg
= 0,71
60-62 kg
= 0,96
18 kg
=
0,44
38 kg
= 0,73
64-66 kg
= 0,98
20 kg
=
0,46
40 kg
= 0,76
68 kg
= 0,99
Scyntygrafia kanalików łzowych:
Zalecane aktywności dla dzieci i młodzieży są takie same jak dla dorosłych.
Sposób podawania
Podanie dożylne lub do oka. Do wielokrotnego użycia.
Instrukcje przygotowania produktu leczniczego przed podaniem, patrz punkt 12. Sposób przygotowania pacjenta, patrz punkt 4.4.
We wskazaniach: scyntygrafia tarczycy, scyntygrafia gruczołów ślinowych i identyfikacja/lokalizacja ektopowej błony śluzowej żołądka, sodu nadtechnecjan (99mTc) roztwór stosuje się we wstrzyknięciu dożylnym.
W scyntygrafii kanalików łzowych krople zakrapla się do worka spojówkowego (podanie do oka).
Obrazowanie
Scyntygrafia tarczycy: 20 minut po podaniu dożylnym.
Scyntygrafia gruczołów ślinowych: bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 15 minut.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka (uchyłek Meckela): bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 30 minut.
Scyntygrafia kanalików łzowych: w czasie 2 minut od wprowadzenia kropli do worka spojówkowego wykonuje się obrazy dynamiczne, a następnie statyczne, w odpowiednich odstępach czasu przez
20 minut.
Dawkowanie
Jeśli sodu nadtechnecjan (99mTc) jest podawany dożylnie, stosowane dawki radioaktywności mogą się znacznie różnić w zależności od wymaganych informacji klinicznych oraz stosowanej aparatury.
Podanie aktywności powyżej diagnostycznego poziomu referencyjnego dawek określonego przez lokalne przepisy (DRL) powinno być uzasadnione wskazaniami.
Zalecane dawki aktywności wynoszą:
Dorośli (70 kg) i osoby w podeszłym wieku:
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Możliwość wystąpienia nadwrażliwości lub reakcji anafilaktycznych
Jeżeli wystąpią reakcje nadwrażliwości lub reakcje anafilaktyczne, należy natychmiast przerwać podawanie produktu leczniczego i, jeżeli jest to konieczne, rozpocząć leczenie dożylne. W celu podjęcia natychmiastowego leczenia należy zapewnić dostępność niezbędnych produktów leczniczych i sprzętu, takiego jak rurka intubacyjna i respirator.
Uzasadnienie indywidualnego stosunku korzyści do ryzyka
U każdego pacjenta narażenie na promieniowanie jonizujące musi być uzasadnione w oparciu o spodziewane korzyści kliniczne. Podana dawka radioaktywności powinna być w każdym przypadku możliwie jak najniższa, a jednocześnie wystarczająca do uzyskania założonej informacji diagnostycznej.
Niewydolność nerek
Ze względu na możliwy wzrost narażenia na promieniowanie należy uważnie ocenić stosunek korzyści do ryzyka w tej grupie pacjentów.
Dzieci i młodzież
Informacje dotyczące stosowania produktu leczniczego u dzieci i młodzieży, patrz punkt 4.2.
Zasadność stosowania produktu leczniczego w tej grupie pacjentów należy dokładnie rozważyć, gdyż dawka skuteczna w przeliczeniu na 1 MBq jest wyższa niż w przypadku dorosłych (patrz punkt 11). Blokowanie czynności tarczycy jest szczególnie istotne w grupie dzieci i młodzieży, z wyjątkiem scyntygrafii tarczycy.
Przygotowanie pacjenta
W niektórych wskazaniach może być konieczne wstępne podanie środków blokujących czynność tarczycy.
Pacjent powinien być dobrze nawodniony przed rozpoczęciem badania oraz poinformowany o konieczności jak najczęstszego oddawania moczu w ciągu pierwszych godzin po podaniu produktu leczniczego, w celu usunięcia z organizmu substancji promieniotwórczych.
W celu zmniejszenia prawdopodobieństwa wyników fałszywie dodatnich i zminimalizowania narażenia na promieniowanie poprzez obniżenie wychwytu nadtechnecjanu przez tarczycę i gruczoły ślinowe konieczne jest blokowanie czynności tarczycy. Stosuje się je przy scyntygrafii kanalików łzowych oraz scyntygrafii uchyłku Meckela. NIE WOLNO stosować środków blokujących czynność tarczycy przed badaniem scyntygraficznym tarczycy, przytarczyc i gruczołów ślinowych.
Przed podaniem roztworu sodu nadtechnecjanu (99mTc) w scyntygrafii uchyłku Meckela pacjent powinien być na czczo przez 3 do 4 godzin, aby zmniejszyć perystaltykę jelit.
Po znakowaniu erytrocytów w warunkach in vivo z wykorzystaniem redukcji jonami cyny, sodu nadtechnecjan (99mTc) wbudowuje się głównie w erytrocyty. Dlatego scyntygrafię uchyłku Meckela należy przeprowadzać przed tym badaniem lub kilka dni po wyznakowaniu erytrocytów w warunkach in vivo.
Po badaniu
Pacjent powinien unikać kontaktu z małymi dziećmi i kobietami w ciąży przez 12 godzin po badaniu. Specjalne ostrzeżenia
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań zawiera 3,6 mg sodu na 1 ml roztworu.
W zależności od czasu podania ilość sodu otrzymanego przez pacjenta może w niektórych przypadkach przekraczać 1 mmol (23 mg). Należy to wziąć pod uwagę w przypadku pacjentów stosujących dietę niskosodową.
W sytuacji wykorzystywania roztworu sodu nadtechnecjanu (99mTc) do znakowania zestawów, podczas określania całkowitej zawartości sodu należy uwzględnić sód otrzymany z eluatu i zestawu. Należy zapoznać się z treścią ulotki załączonej do zestawu.
W scyntygrafii gruczołów ślinowych należy spodziewać się niższej swoistości metody w porównaniu do sialografii MR.
Środki ostrożności w odniesieniu do zagrożenia dla środowiska naturalnego, patrz punkt 6.6.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Atropina, izoprenalina i leki przeciwbólowe mogą powodować opóźnienie opróżniania żołądka i spowalniać redystrybucję nadtechnecjanu (99mTc) w obrazowaniu jamy brzusznej.
Należy unikać podawania środków przeczyszczających, gdyż powodują one podrażnienie przewodu pokarmowego. Należy unikać wykonywania badań z użyciem środka kontrastowego (np. siarczanu baru) i badań górnego odcinka przewodu pokarmowego w okresie 48 godzin przed podaniem nadtechnecjanu (99mTc) na potrzeby badania scyntygraficznego uchyłka Meckela.
Wiele produktów leczniczych ma znany wpływ zmieniający właściwości wychwytu przez tarczycę.
przeciwtarczycowe produkty lecznicze (np.: karbimazol lub inne pochodne imidazolu, takie jak propylotiouracyl), salicylany, steroidy, sodu nitroprusydek, sodu sulfobromoftaleina, nadchlorany. Ich podawanie powinno być wstrzymane na 1 tydzień przed scyntygrafią tarczycy,
podawanie fenylobutazonu i środków wykrztuśnych powinno być wstrzymane na 2 tygodnie,
podawanie produktów zawierających naturalne lub syntetyczne hormony tarczycy (np. sodu tyroksynę, sodu liotyroninę, wyciąg z tarczycy) powinno zostać wstrzymane na 2–3 tygodnie przed badaniem,
podawanie amiodaronu, benzodiazepin, litu powinno być wstrzymane na 4 tygodnie przed badaniem,
dożylne środki kontrastowe nie powinny być podawane na 1–2 miesiące przed badaniem.
Wpływ na płodność, ciążę i laktację
Kobiety w wieku rozrodczym
Przed podaniem radiofarmaceutyku kobiecie w wieku rozrodczym należy upewnić się, że nie jest ona w ciąży. Każdą kobietę, u której nie wystąpiła regularna miesiączka, należy do wykluczenia ciąży traktować jako kobietę w ciąży. W razie wątpliwości dotyczących możliwej ciąży (jeśli u kobiety nie wystąpiła miesiączka, jeśli miesiączki są bardzo nieregularne itp.) należy zaproponować pacjentce inne metody diagnostyczne, bez użycia promieniowania jonizującego (jeśli takie istnieją).
Ciąża
Podanie sodu nadtechnecjanu (99mTc) kobiecie, która jest w ciąży, dopuszcza się wyłącznie w sytuacji, gdy jest uzasadnione medycznymi przesłankami a spodziewane korzyści przewyższają ryzyko na jakie narażona jest matka i płód. Należy rozważyć alternatywne metody diagnostyczne, bez użycia promieniowania jonizującego.
99mTc (w postaci wolnego nadtechnecjanu) przechodzi przez barierę łożyskową. Karmienie piersią
Przed podaniem radiofarmaceutyku kobiecie karmiącej piersią należy rozważyć możliwość odroczenia podania radionuklidu do chwili zakończenia przez matkę karmienia piersią i wybrać najkorzystniejszy radiofarmaceutyk pod względem przenikania aktywności do mleka. Jeśli podanie radiofarmaceutyku zostanie uznane za konieczne, karmienie piersią należy przerwać na 12 godzin po podaniu produktu leczniczego, a pokarm wydzielony w tym czasie usunąć.
Pacjentka powinna unikać bliskiego kontaktu z dzieckiem w tym czasie.
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Działania niepożądane
Podsumowanie profilu bezpieczeństwa
Informacje na temat działań niepożądanych pochodzą ze spontanicznych zgłoszeń. Odnotowano następujące rodzaje reakcji: reakcje anafilaktoidalne, reakcje wegetatywne oraz różne reakcje w miejscu podania.
Sodu nadtechnecjan (99mTc) otrzymywany z generatora radionuklidu Tekcis jest stosowany do znakowania różnych związków. Związki te charakteryzuje większe prawdopodobieństwo wywołania działań niepożądanych niż w przypadku sodu nadtechnecjanu 99mTc. Dlatego odnotowane działania niepożądane są raczej związane ze stosowaniem wyznakowanych związków niż z 99mTc. Możliwe rodzaje interakcji, jakie mogą wystąpić po dożylnym podaniu produktu leczniczego wyznakowanego roztworem nadtechnecjanu (99mTc) sodu, mogą być różne w zależności od użytej substancji.
Informacje te można znaleźć w Charakterystyce Produktu Leczniczego dołączonej do zestawu do sporządzania radiofarmaceutyku.
Tabelaryczna lista działań niepożądanych:
Częstość występowania działań niepożądanych klasyfikuje się następująco: nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia układu immunologicznego
Częstość nieznana*: reakcje anafilaktoidalne (np. duszność, śpiączka, pokrzywka, rumień, wysypka,
świąd, obrzęk różnych miejsc ciała np. obrzęk twarzy);
Zaburzenia układu nerwowego
Częstość nieznana*: reakcje wazowagalne (np. omdlenie, częstoskurcz, rzadkoskurcz, zawroty głowy, bóle głowy, niewyraźne widzenie, zaczerwienienie);
Zaburzenia żołądka i jelit
Częstość nieznana*: wymioty, nudności, biegunka;
Zaburzenia ogólne i stany w miejscu podania
Częstość nieznana*: reakcje w miejscu wstrzyknięcia (np. zapalenie tkanki łącznej, ból, rumień i obrzęk)
* Działania niepożądane pochodzące ze spontanicznych zgłoszeń.
Narażenie na promieniowanie jonizujące jest związane z indukcją nowotworów oraz możliwością rozwoju wad wrodzonych. Ponieważ dawka skuteczna wynosi 5,2 mSv, w związku z podaniem maksymalnej zalecanej dawki aktywności wynoszącej 400 MBq istnieje małe prawdopodobieństwo wystąpienia tych działań niepożądanych.
Opis wybranych działań niepożądanych
Reakcje anafilaktyczne (np. duszność, śpiączka, pokrzywka, rumień, wysypka, świąd, obrzęk różnych miejsc ciała [np. obrzęk twarzy])
Obserwowano reakcje anafilaktyczne po podaniu dożylnym sodu nadtechnecjanu (99mTc), które dotyczyły różnych zmian skórnych lub problemów w oddychaniu, np. podrażnienie skóry, obrzęk lub duszność.
Reakcje wegetatywne (układu nerwowego i zaburzenia żołądkowo-jelitowe)
Odnotowano pojedyncze przypadki ciężkich reakcji wegetatywnych, jednak większość zgłaszanych reakcji wegetatywnych to reakcje ze strony przewodu pokarmowego, takie jak nudności lub wymioty. Inne to reakcje wazowagalne, takie jak ból lub zawroty głowy. Reakcje wegetatywne uważane są raczej za związane ze świadomością pacjenta, że jest poddawany badaniu, niż z samym zastosowaniem technetu (99mTc); dotyczy to szczególnie pacjentów odczuwających lęk.
Zaburzenia ogólne i stany w miejscu podania
Inne zgłoszenia opisują miejscowe reakcje w miejscu wstrzyknięcia. Reakcje w miejscu wstrzyknięcia są związane z wynaczynieniem roztworu radiofarmaceutyku podczas wstrzykiwania i mogą przybierać postać od lokalnego obrzęku do zapalenia tkanki łącznej. W zależności od podanej radioaktywności i znakowanego związku rozległe wynaczynienie może wymagać leczenia chirurgicznego.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem:
Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C
PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
W przypadku przedawkowania radioaktywności sodu nadtechnecjanu (99mTc) należy dążyć do obniżenia dawki pochłoniętej przez pacjenta poprzez przyspieszenie wydalania radionuklidu z organizmu poprzez częste wypróżnienia, wymuszoną diurezę i oddawanie moczu.
Wychwyt przez tarczycę, ślinianki i śluzówkę przewodu pokarmowego może być znacznie zmniejszony, gdy po przypadkowym podaniu wysokich dawek sodu nadtechnecjanu (99mTc) natychmiast poda się nadchloran sodu lub potasu.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Grupa farmakoterapeutyczna: Różne środki radiofarmaceutyczne stosowane w diagnostyce tarczycy, kod ATC: V09FX01.
W zakresie diagnostycznie stosowanych dawek nie zaobserwowano aktywności farmakologicznej.
Dystrybucja
Jon nadtechnecjanowy ma podobną dystrybucję biologiczną do jonu jodowego i nadchloranowego - gromadzi się przejściowo w śliniankach, splocie naczyniówkowym, śluzówce żołądka oraz tarczycy. Jest uwalniany z tych narządów w niezmienionej postaci. Jon nadtechnecjanowy gromadzi się w obszarach o bogatym unaczynieniu lub w miejscach, gdzie naczynia mają nieprawidłową przepuszczalność. Dzieje się tak szczególnie wtedy, gdy wcześniej podane pacjentowi środki blokują pobieranie produktu leczniczego przez struktury gruczołowe. Przy nienaruszonej barierze krew-mózg sodu nadtechnecjan (99mTc) nie przechodzi do tkanki mózgowej.
Wychwyt przez narządy
We krwi 70–80% wstrzykniętego dożylnie sodu nadtechnecjanu (99mTc) wiąże się z białkami, głównie w sposób niespecyficzny z albuminami. Wolne frakcje (20–30%) gromadzone są czasowo w tarczycy i gruczołach ślinowych, żołądku i błonie śluzowej nosa, a także w splocie naczyniówkowym.
W przeciwieństwie do jodu, sodu nadtechnecjanu (99mTc) nie jest wykorzystywany do syntezy hormonów tarczycy (organifikacja) ani nie wchłania się w jelicie cienkim. Maksymalny poziom akumulacji w tarczycy, w zależności od statusu czynnościowego i nasycenia jodem (w eutyreozie ok. 0,3–3%, w nadczynności tarczycy i zaburzeniach z niedoboru jodu do 25%) jest osiągany po ok.
20 minutach od wstrzyknięcia, a następnie szybko maleje. Dotyczy to również komórek przyściennych błony śluzowej żołądka oraz komórek groniastych ślinianek.
W przeciwieństwie do tarczycy, która uwalnia sodu nadtechnecjan (99mTc) do krwi, gruczoły ślinowe i
żołądek wydzielają sodu nadtechnecjan (99mTc) odpowiednio do śliny i soków żołądkowych. Akumulacja w gruczołach ślinowych jest na poziomie 0,5% podanej aktywności. Przy czym maksymalny poziom osiągnięty jest po około 20 minutach. Po godzinie od wstrzyknięcia stężenie w ślinie jest od około 10- do 30-krotnie większe niż w osoczu. Wydzielanie można przyspieszyć poprzez podanie soku z cytryny lub stymulację przywspółczulnego układu nerwowego.
Eliminacja
Okres półtrwania w osoczu wynosi około 3 godziny. Sodu nadtechnecjan (99mTc) nie jest metabolizowany w organizmie. Jedna frakcja jest wydalana przez nerki bardzo szybko, reszta wolniej z kałem, śliną i płynem łzowym. Przez pierwsze 24 godziny od podania związek jest wydalany głównie z moczem (około 25%), przez następne 48 godzin - z kałem. Około 50% dawki jest wydalane w czasie 50 godzin od podania. Jeśli podano wcześniej produkt blokujący wychwyt nadtechnecjanu (99mTc) przez narządy gruczołowe, wydalanie odbywa się w sposób opisany powyżej, klirens nerkowy jest jednak wyższy.
Powyższe dane nie dotyczą zastosowania sodu nadtechnecjanu (99mTc) do znakowania innych radiofarmaceutyków.
Brak danych dotyczących ostrej, podostrej oraz przewlekłej toksyczności po podaniu pojedynczej dawki oraz dawek wielokrotnych. Ilość sodu nadtechnecjanu (99mTc) podawanego podczas badań diagnostycznych jest bardzo mała. Nie obserwowano innych reakcji poza alergicznymi.
Produkt leczniczy nie jest przeznaczony do regularnego ani ciągłego stosowania.
Nie prowadzono badań mutagenności ani długoterminowych badań dotyczących działania rakotwórczego.
Toksyczność reprodukcyjna:
Stopień przechodzenia 99mTc z podanego dożylnie roztworu sodu nadtechnecjanu (99mTc) przez łożysko badano u myszy. Jeśli nie podano wcześniej nadchlorku, w ciężarnej macicy gromadziło się nawet 60% podanej dawki 99mTc. Badania prowadzone u myszy ciężarnych, w trakcie ciąży, w ciąży i karmiących oraz tylko karmiących wykazały zmiany u potomstwa, takie jak zmniejszenie masy ciała, brak owłosienia oraz bezpłodność.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Kolumna:
Glinu tlenek.
Roztwór do elucji:
Sodu chlorek, sodu azotan, woda do wstrzykiwań.
Niezgodności farmaceutyczne
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 12.
Okres ważności
Generator: 21 dni od daty wytworzenia.
Data kalibracji i termin ważności są podane na etykiecie.
Eluat sodu nadtechnecjanu (99mTc): po elucji zużyć w ciągu 10 godzin do 10 pobrań Ten produktu leczniczy nie wymaga żadnych specjalnych warunków przechowywania. Fiolki do elucji: 24 miesiące.
Specjalne środki ostrożności podczas przechowywania
Generator: Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. Eluat: warunki przechowywania produktu leczniczego po elucji patrz punkt 6.3.
Fiolki do elucji: Nie przechowywać w temperaturze powyżej 25°C.
Radiofarmaceutyki należy przechowywać zgodnie z obowiązującymi przepisami dotyczącymi materiałów radioaktywnych.
Rodzaj i zawartość opakowania
Generator TEKCIS jest dostarczany w pojemniku transportowym typu A. Składa się z:
250 ml miękkiego worka z PP zawierającego roztwór do elucji (1), połączonego igłą ze stali nierdzewnej (2) z górną częścią kolumny chromatograficznej;
szklanej kolumny chromatograficznej (3) zamkniętej na obu końcach silikonowymi korkami i spiekami ze stali nierdzewnej (4). Kolumna zawiera glinu tlenek, na którym zaadsorbowany jest
99Mo.
igły wylotowej (5) połączonej z dolną częścią kolumny. Drugi koniec igły (6) może być podłączony do fiolki elucyjnej w celu elucji kolumny lub fiolki ochronnej (STE-ELU) w celu utrzymania sterylności między dwoma elucjami.
Kolumna z glinu tlenkiem oraz igła są chronione cylindryczno-stożkową osłoną ołowianą lub wolframową (7). Generatory do 25 GBq technetu (99mTc) są chronione ołowianą osłoną, a generatory 50 GBq są chronione osłoną wolframową.
Cały system jest umieszczony w plastikowej obudowie o kształcie równoległościanu (23 x 21 x 14 cm) (8-9).
Igła do elucji wystaje z górnej części plastikowej osłony, chronionej nasadką transportową lub fiolką ochronną (STE-ELU).
Obok igły do elucji znajduje się zawór bezpieczeństwa (10), zamykany na czas transportu.
Akcesoria w zestawie z generatorem:
worek zawierający 10 sterylnych, wolnych od pirogenów fiolek do elucji (TC-ELU-5) (11) umożliwiających elucję od 5 ml do 6 ml.
sterylna fiolka zabezpieczająca igłę do elucji (STE-ELU). Każda fiolka do elucji lub fiolka ochronna to 15 ml, bezbarwna fiolka ze szkła typu I, zamknięta gumowym korkiem i aluminiowym wieczkiem.
Pojemnik na elucję (12) jest dostarczany z pierwszą dostawą.
Inne dostępne akcesoria:
zestawy zawierające fiolki 10 x 15 ml:
fiolki umożliwiające elucję od 5 do 6 ml;
fiolki umożliwiające elucję od 9 do 11 ml;
fiolki umożliwiające elucję od 14 do 16 ml.
dodatkowe przesłony ołowiane dostosowany do generatora TEKCIS: PROTECT ELU.
Wielkość opakowań:
aktywność 99mTc (maksymalna teoretyczna aktywność elucyjna na dzień kalibracji, godz. 12 CET) | 2 | 4 | 6 | 8 | 10 | 12 | 16 | 20 | 25 | 50 | GBq |
aktywność 99Mo (na dzień kalibracji, godz. 12 CET) | 2,5 | 5 | 7 | 9,5 | 12 | 14,5 | 19 | 24 | 30 | 60 | GBq |
Schemat generatora TEKCIS w trybie elucji
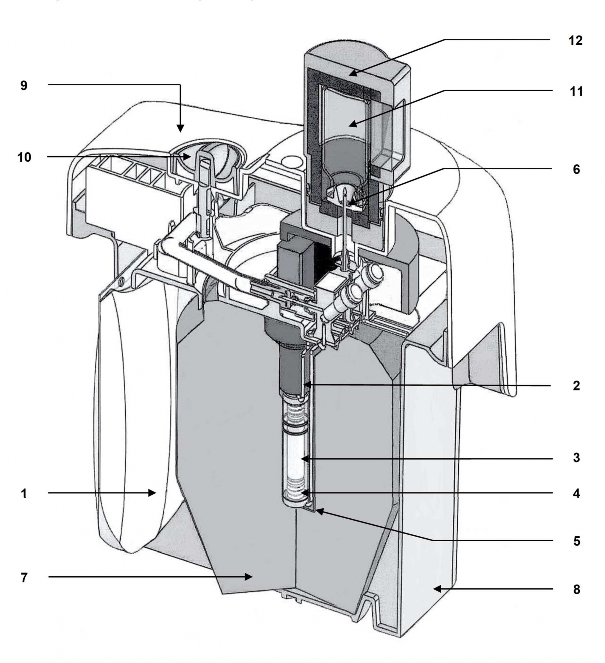
worek z roztworem do elucji ołowiane lub wolframowe cylindryczno- 7
stożkowe osłony
igła łącząca dolna plastikowa osłona 8
szklana kolumna chromatograficzna górna plastikowa osłona 9
korek silikonowy + spieki ze stali nierdzewnej
zawór bezpieczeństwa 10
igła wylotowa ze stali nierdzewnej fiolka elucyjna 11
igła elucyjna pojemnik elucyjny 12
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Ogólne ostrzeżenia
Radiofarmaceutyk może być otrzymywany, używany i podawany chorym tylko przez osoby mające odpowiednie uprawnienia, w wyznaczonych do tego placówkach klinicznych. Otrzymywanie, magazynowanie, użycie, przenoszenie i utylizacja podlegają przepisom i (lub) odpowiednim licencjom właściwych organizacji.
Radiofarmaceutyki powinny być przygotowywane w sposób odpowiedni do wymagań dotyczących zarówno zasad bezpieczeństwa radiologicznego, jak i jakości farmaceutyków. Powinno zapewnić się odpowiednie warunki aseptyczne.
Nie należy stosować generatora lub fiolki z eluatem, jeżeli zauważy się jakiekolwiek ślady uszkodzenia.
Produkt leczniczy należy podawać w taki sposób, aby zminimalizować ryzyko zanieczyszczenia produktu leczniczego i napromieniowania osoby go podającej. Konieczne jest stosowanie odpowiednich osłon.
Podawanie chorym radioaktywnych produktów leczniczych stwarza niebezpieczeństwo skażenia dla osób postronnych, np. moczem lub wymiocinami pacjenta. Należy zatem przestrzegać zasad ochrony radiologicznej zgodnych z obowiązującymi przepisami krajowymi.
Przed utylizacją generatora należy określić jego pozostałą radioaktywność.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
CIS bio international Route Nationale 306
BP 32 SACLAY
F-91192 Gif-sur-Yvette Cedex Francja
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr:
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
DOZYMETRIA
Dane wymienione poniżej pochodzą z ICRP 80 i są obliczane według następujących założeń:
Wartości dawek, gdy pacjent nie otrzymał produktu blokującego:
Narząd
Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq]
Dorośli
15 lat
10 lat
5 lat
1 rok
Nadnercza
0,0037
0,0047
0,0072
0,011
0,019
Ściana pęcherza
moczowego
0,018
0,023
0,030
0,033
0,060
Powierzchnia kości
0,0054
0,0066
0,0097
0,014
0,026
Mózg
0,0020
0,0025
0,0041
0,0066
0,012
Sutki
0,0018
0,0023
0,0034
0,0056
0,011
Pęcherzyk żółciowy
0,0074
0,0099
0,016
0,023
0,035
Przewód pokarmowy
- Ściana żołądka
0,026
0,034
0,048
0,078
0,16
- Jelito cienkie
0,016
0,020
0,031
0,047
0,082
- Okrężnica
0,042
0,054
0,088
0,14
0,27
- Ściana okrężnicy wstępującej
0,057
0,073
0,12
0,20
0,38
- Ściana okrężnicy zstępującej
0,021
0,028
0,045
0,072
0,13
Serce
0,0031
0,0040
0,0061
0,0092
0,017
Nerki
0,0050
0,0060
0,0087
0,013
0,021
Wątroba
0,0038
0,0048
0,0081
0,013
0,022
Płuca
0,0026
0,0034
0,0051
0,0079
0,014
Mięśnie
0,0032
0,0040
0,0060
0,0090
0,016
Przełyk
0,0024
0,0032
0,0047
0,0075
0,014
Jajniki
0,010
0,013
0,018
0,026
0,045
Trzustka
0,0056
0,0073
0,011
0,016
0,027
Szpik kostny
0,0036
0,0045
0,0066
0,0090
0,015
Ślinianki
0,0093
0,012
0,017
0,024
0,039
Skóra
0,0018
0,0022
0,0035
0,0056
0,010
Śledziona
0,0043
0,0054
0,0081
0,012
0,021
Jądra
0,0028
0,0037
0,0058
0,0087
0,016
Grasica
0,0024
0,0032
0,0047
0,0075
0,014
Tarczyca
0,022
0,036
0,055
0,12
0,22
Macica
0,0081
0,010
0,015
0,022
0,037
Pozostałe tkanki
0,0035
0,0043
0,0064
0,0096
0,017
Dawka skuteczna (mSv/MBq)
0,013
0,017
0,026
0,042
0,079
Wartości dawek, gdy pacjent otrzymał produkt blokujący:
Narząd | Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq], gdy pacjent otrzymał produkt blokujący | ||||
Dorośli | 15 lat | 10 lat | 5 lat | 1 lat | |
Nadnercza | 0,0029 | 0,0037 | 0,0056 | 0,0086 | 0,016 |
Ściana pęcherza moczowego | 0,030 | 0,038 | 0,048 | 0,050 | 0,091 |
Powierzchnia kości | 0,0044 | 0,0054 | 0,0081 | 0,012 | 0,022 |
Mózg | 0,0020 | 0,0026 | 0,0042 | 0,0071 | 0,012 |
Sutki | 0,0017 | 0,0022 | 0,0032 | 0,0052 | 0,010 |
Pęcherzyk żółciowy | 0,0030 | 0,0042 | 0,0070 | 0,010 | 0,013 |
Przewód pokarmowy | |||||
- Ściana żołądka | 0,0027 | 0,0036 | 0,0059 | 0,0086 | 0,015 |
- Jelito cienkie | 0,0035 | 0,0044 | 0,0067 | 0,010 | 0,018 |
- Okrężnica | 0,0036 | 0,0048 | 0,0071 | 0,010 | 0,018 |
- Ściana okrężnicy wstępującej | 0,0032 | 0,0043 | 0,0064 | 0,010 | 0,017 |
- Ściana okrężnicy zstępującej | 0,0042 | 0,0054 | 0,0081 | 0,011 | 0,019 |
Serce | 0,0027 | 0,0034 | 0,0052 | 0,0081 | 0,014 |
Nerki | 0,0044 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Wątroba | 0,0026 | 0,0034 | 0,0053 | 0,0082 | 0,015 |
Płuca | 0,0023 | 0,0031 | 0,0046 | 0,0074 | 0,013 |
Mięśnie | 0,0025 | 0,0031 | 0,0047 | 0,0072 | 0,013 |
Przełyk | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Jajniki | 0,0043 | 0,0054 | 0,0078 | 0,011 | 0,019 |
Trzustka | 0,0030 | 0,0039 | 0,0059 | 0,0093 | 0,016 |
Szpik kostny | 0,0025 | 0,0032 | 0,0049 | 0,0072 | 0,013 |
Skóra | 0,0016 | 0,0020 | 0,0032 | 0,0052 | 0,0097 |
Śledziona | 0,0026 | 0,0034 | 0,0054 | 0,0083 | 0,015 |
Jądra | 0,0030 | 0,0040 | 0,0060 | 0,0087 | 0,016 |
Grasica | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Tarczyca | 0,0024 | 0,0031 | 0,0050 | 0,0084 | 0,015 |
Macica | 0,0060 | 0,0073 | 0,011 | 0,014 | 0,023 |
Pozostałe tkanki | 0,0025 | 0,0031 | 0,0048 | 0,0073 | 0,013 |
Dawka skuteczna (mSv/MBq) | 0,0042 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Dawka skuteczna po podaniu dożylnym 400 MBq sodu nadtechnecjanu (99mTc) dorosłemu pacjentowi o masie ciała 70 kg wynosi 5,2 mSv.
Po zastosowaniu produktu o właściwościach blokujących i podaniu 400 MBq sodu
nadtechnecjanu (99mTc) dorosłemu pacjentowi o masie ciała 70 kg dawka skuteczna wynosi 1,7 mSv.
Dawka promieniowania pochłonięta przez soczewkę oka po podaniu sodu nadtechnecjanu (99mTc) celem wykonania scyntygrafii kanałów łzowych jest szacowana na 0,038 mGy/MBq. Podanie aktywności wynoszącej 4 MBq powoduje pochłonięcie dawki skutecznej nieprzekraczającej 0,01 mSv.
Podane dawki promieniowania mają zastosowanie w przypadku, kiedy narządy pochłaniające sodu nadtechnecjan (99mTc) funkcjonują prawidłowo. Nadczynność/niedoczynność (np. tarczycy, błony śluzowej żołądka i nerek) oraz długotrwałe procesy z zaburzeniem bariery krew-mózg lub upośledzeniem eliminacji przez nerki mogą prowadzić do zmian w narażeniu na promieniowanie, prowadząc lokalnie do jego bardzo znacznego wzrostu.
Narażenie na promieniowanie zewnętrzne
Moc dawki 99Mo-99mTc na powierzchni generatora (μSv/h.GBq) | Moc dawki 99Mo-99mTc w odległości 1 m od generatora (μSv/h.GBq) | |
Osłona ołowiana 41 mm | 16 | 0,3 |
Dawki powierzchniowe i dawka skumulowana zależą od wielu czynników. Ogólnie rzecz biorąc, pomiar promieniowania w otoczeniu i podczas pracy ma kluczowe znaczenie i powinien być wykonywany.
INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
Elucję generatora należy przeprowadzać w pomieszczeniach zgodnych z krajowymi przepisami dotyczącymi bezpieczeństwa użytkowania produktów radioaktywnych.
Eluat jest przezroczystym i bezbarwnym roztworem nadtechnecjanu sodu (99mTc) o pH między 4,5 a 7,5 i czystości radiochemicznej równej lub większej niż 95%.
Jeżeli roztwór sodu nadtechnecjanu (99mTc) jest zastosowany do znakowania zestawu, należy zapoznać się z ulotką dołączoną do opakowania tego zestawu.
Przygotowanie
Zdezynfekować korek fiolek do elucji przed każdą elucją. Uwaga:
Nie używać etanolu ani eteru etylowego do dezynfekcji korka fiolki do elucji, ponieważ może to zakłócać proces elucji.
Podczas transportu sterylność igły elucyjnej chroni nasadka.
Chronić igłę do elucji przed możliwym zanieczyszczeniem bakteryjnym, umieszczając fiolkę ochronną na igle między dwoma eluatami.
Przestrzegać następującej sekwencji, aby uzyskać zadowalające wyniki:
Pierwsza elucja:
Używając generatora po raz pierwszy, OTWORZYĆ zawór bezpieczeństwa (10) do pozycji ON PRZED podłączeniem fiolki do elucji. Nigdy nie zamykać zaworu bezpieczeństwa pomiędzy dwoma eluatami. Zawór bezpieczeństwa zamykać dopiero na czas utylizacji generatora.
Aby eluować generator, nałożyć nasadkę lub fiolkę ochronną na pojemnik do elucji (A) zawierający fiolkę próżniową do elucji (oznaczoną „TC-ELU”) odpowiadającą żądanej objętości elucji (13).
Elucję można obserwować przez okienko ze szkła ołowiowego (14) pojemnika (A). Odczekać dwie minuty do pełnej elucji.
Przed użyciem sprawdzić klarowność eluatu i wyrzucić, jeśli roztwór nie jest przejrzysty. Po elucji natychmiast założyć fiolkę ochronną na igłę, aby zachować jej sterylność.
Objętości elucji:
Tekcis to generator opracowany do elucji całej dostępnej aktywności technetu-99m w objętości 5 ml. Elucje frakcjonowane są zatem niepotrzebne. Można jednak przeprowadzić elucje do większych objętości: 10 ml lub 15 ml.
Możliwości zastosowania:
Aktywność podana na etykiecie generatora wyrażona jest w technecie-99m, dostępnym na dzień kalibracji (12:00 CET).
Dostępność technetu-99m zależy od:
aktywności molibdenu-99 w momencie elucji;
czasu od ostatniej elucji. Kontrola jakości
Radioaktywność oraz tzw. „przebicie” molibdenu (99Mo) muszą być sprawdzone przed użyciem.
Sprawdzenie „przebicia” molibdenu (99Mo) może być przeprowadzone zgodnie z Farmakopeą Europejską lub też każdą inną zwalidowaną metodą umożliwiającą określenie zawartości molibdenu (99Mo) poniżej 0,1% całkowitej radioaktywności na dzień i godzinę podania.
Masa technetu (99mTc + 99Tc) obecnego w eluacie:
Molibden-99 jest przekształcany w technet-99m (87,6% całego rozpadu molibdenu-99) i technet-99 (12,4% całego rozpadu molibdenu-99). Całkowitą masę technetu ((99mTc) + (99Tc)) wyrażoną w µg technetu obecnego w eluacie można obliczyć według następującego uproszczonego wzoru:
M(µg) = aktywność technetu-99m w eluacie x k
F
k = 5,161,10-3 (aktywność wyrażona w GBq)
F to stosunek liczby atomów technetu-99m (N99m) do całkowitej liczby atomów technetu (Nt): F = N99m
Nt
Wartości tego stosunku (F) w funkcji odstępu między dwoma elucjami przedstawia poniższa tabela:
Godziny | Dni | ||||||
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
0 | - | 0,277 | 0,131 | 0,076 | 0,0498 | 0,0344 | 0,0246 |
3 | 0,727 | 0,248 | 0,121 | 0,072 | 0,0474 | 0,0329 | 0,0236 |
6 | 0,619 | 0,223 | 0,113 | 0,068 | 0,0452 | 0,0315 | 0,0227 |
9 | 0,531 | 0,202 | 0,105 | 0,064 | 0,0431 | 0,0302 | 0,0218 |
12 | 0,459 | 0,184 | 0,098 | 0,061 | 0,0411 | 0,0290 | 0,0210 |
15 | 0,400 | 0,168 | 0,092 | 0,058 | 0,0393 | 0,0278 | 0,0202 |
18 | 0,352 | 0,154 | 0,086 | 0,055 | 0,0375 | 0,0266 | 0,0194 |
21 | 0,311 | 0,141 | 0,081 | 0,052 | 0,0359 | 0,0256 | 0,0187 |
Przykłady:
Technet-99m z generatora jest eluowany do objętości 5 ml; zmierzona aktywność wynosi 10 GBq; poprzednią elucję przeprowadzono 27 godzin wcześniej.
Masa technetu wynosi:
M(µg) = 10 x 5,161,10-3 = 0,208 µg
0,248
tzn: 0,042 µg/mL
Technet-99m z generatora jest eluowany 4 dni po przygotowaniu (co odpowiada pierwszej elucji). Dla aktywności 10 GBq w 5 ml eluatu masa technetu wynosi:
M(µg) = 10 x 5,161,10-3 = 1,036 µg
0,0498
tzn: 0,207 µg/ml, czyli pięć razy więcej technetu niż w poprzednim przykładzie. Ta ilość technetu, mimo iż jest niewielka, może wpływać na wydajność znakowania niektórych związków.
Pierwszy eluat uzyskany z tego generatora może być normalnie używany, o ile nie określono inaczej. Eluaty eluowane nawet później niż 24 godziny od ostatniej elucji mogą być użyte do znakowania zestawu, o ile nie jest to wykluczone w ChPL odpowiedniego zestawu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
OZNAKOWANIE OPAKOWAŃ
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH
Generator
1. NAZWA PRODUKTU LECZNICZEGO
TEKCIS, 2-50 GBq, generator radionuklidu
natrii pertechnetatis (99mTc) fissione formati solutio iniectabilis
2. ZAWARTOŚĆ SUSBSTANCJI CZYNNEJ
Sodu nadtechnecjan (99mTc): aktywność generatora określona na dzień kalibracji. Aktywność 99mTc: GBq określona na dzień kalibracji (12:00 CET)
Aktywność 99mTc: GBq określona na dzień wytworzenia (12:00 CET)
3. WYKAZ SUBSTANCJI POMOCNICZYCH
Substancje pomocnicze: sodu chlorek, sodu azotan i woda do wstrzykiwań.
4. POSTAĆ FARMACEUTYCZNA I ZAWARTOŚĆ OPAKOWANIA
Generator radionuklidu. Dawkowanie wielokrotne
3 | 6 | 6 | 1 | 5 | 4 | 1 | 1 | 0 | 0 | 4 | 0 | 5 |
Kod:
5. SPOSÓB I DROGI PODANIA
Podanie dożylne lub do oka.
Należy zapoznać się z treścią ulotki przed zastosowaniem leku.
6.
OSTRZEŻENIE DOTYCZĄCE PRZECHOWYWANIA PRODUKTU LECZNICZEGO W MIEJSCU NIEWIDOCZNYM I NIEDOSTĘPNYM DLA DZIECI
7. INNE OSTRZEŻENIA SPECJALNE, JEŚLI KONIECZNE
Produkt leczniczy radiofarmaceutyczny. Symbol radioaktywności
8. TERMIN WAŻNOŚCI
EXP {DD/MM/RRRR} (12:00 CET)
Po elucji zużyć w ciągu 10 godzin, maksymalnie do 10 pobrań.
9. SPECJALNE WARUNKI PRZECHOWYWANIA
10. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI WŁAŚCIWE
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy przechowywać i usunąć zgodnie z lokalnymi przepisami.
11. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
Podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu / Wytwórca
CIS bio international
F-91192 Gif-sur-Yvette Cedex
12. NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr:
13. NUMER SERII
Nr serii (Lot):
14. OGÓLNA KATEGORIA DOSTĘPNOŚCI
Rpz - Lek wydawany na receptę.
15. INSTRUKCJA UŻYCIA
16. INFORMACJA PODANA SYSTEMEM BRAILLE’A
Zaakceptowano uzasadnienie braku informacji systemem Braille’a.
17. NIEPOWTARZALNY IDENTYFIKATOR – KOD 2D
Nie dotyczy.
18. NIEPOWTARZALNY IDENTYFIKATOR – DANE CZYTELNE DLA CZŁOWIEKA
Nie dotyczy.
MINIMUM INFORMACJI ZAMIESZCZANYCH NA MAŁYCH OPAKOWANIACH BEZPOŚREDNICH
Sterylna szklana fiolka próżniowa
1. NAZWA PRODUKTU LECZNICZEGO I DROGA PODANIA
TC-ELU
2. SPOSÓB PODAWANIA
3. TERMIN WAŻNOŚCI
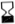
MM/RRRR
4. NUMER SERII<, KODY DONACJI I PRODUKTU>
LOT
5.
ZAWARTOŚĆ OPAKOWANIA Z PODANIEM MASY, OBJĘTOŚCI LUB LICZBY JEDNOSTEK
Poziom elucji w zależności od użytej fiolki: 5
6. INNE
STERILE
Cis bio international
ULOTKA DLA PACJENTA
Ulotka dołączona do opakowania: informacja dla pacjenta
TEKCIS, 2-50 GBq, generator radionuklidu
natrii pertechnetatis (99mTc) fissione formati solutio iniectabilis
Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza medycyny nuklearnej, który będzie nadzorował zabieg.
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi medycyny nuklearnej. Patrz punkt 4.
Spis treści ulotki
Co to jest lek TEKCIS i w jakim celu się go stosuje
gruczoł tarczycy
gruczoły ślinowe
tkanka żołądka pojawiająca się w nieprawidłowym miejscu (uchyłek Meckela)
kanaliki łzowe oczu.
Roztwór nadtechnecjanu sodu (99mTc) może być również stosowany w skojarzeniu z innym produktem do przygotowania innego leku radiofarmaceutycznego. W takiej sytuacji patrz odnośna ulotka dołączona do opakowania.
Lekarz medycyny nuklearnej wyjaśni pacjentowi charakter badania, które zostanie przeprowadzone z zastosowaniem tego produktu.
Stosowanie roztworu nadtechnecjanu sodu (99mTc) wiąże się z ekspozycją na niewielkie ilości radioaktywności. Lekarz prowadzący i lekarz medycyny nuklearnej uznali, że korzyści kliniczne, jakie pacjent odniesie z zabiegu z użyciem radiofarmaceutyku, przewyższają ryzyko związane z promieniowaniem.
Tekcis jest produktem radiofarmaceutycznym stosowanym wyłącznie do celów diagnostycznych.
Tekcis jest generatorem technetu (99mTc), co oznacza, że jest to urządzenie stosowane do uzyskania roztworu do wstrzykiwań nadtechnecjanu sodu (99mTc). Kiedy radioaktywny roztwór zostaje wstrzyknięty do organizmu, tymczasowo gromadzi się on w niektórych częściach ciała. Niewielką ilość podanych związków promieniotwórczych można wykryć spoza organizmu z użyciem specjalnych kamer. Lekarz medycyny nuklearnej następnie wykona zdjęcie (skan) danego narządu, co dostarczy mu cennych informacji na temat struktury i czynności tego narządu.
Po wstrzyknięciu roztwór nadtechnecjanu sodu (99mTc) służy do uzyskania obrazów różnych części ciała, takich jak:
Informacje ważne przed zastosowaniem roztworu nadtechnecjanu sodu (99mTc) uzyskanego z użyciem leku TEKCIS
Kiedy nie stosować roztworu nadtechnecjanu sodu (99mTc) uzyskanego z użyciem leku Tekcis
jeśli pacjent ma uczulenie na nadtechnecjan sodu (99mTc) lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Ostrzeżenia i środki ostrożności
Należy poinformować lekarza medycyny nuklearnej, jeśli:
pacjent ma uczulenia, ponieważ po podaniu roztworu nadtechnecjanu sodu (99mTc) zaobserwowano kilka przypadków reakcji alergicznych,
pacjent choruje na chorobę nerek,
pacjentka jest w ciąży lub przypuszcza, że może być w ciąży,
pacjentka karmi piersią.
Lekarz medycyny nuklearnej poinformuje pacjenta, czy konieczne jest podjęcie specjalnych środków ostrożności po zastosowaniu tego leku. W przypadku wątpliwości należy skonsultować się z lekarzem medycyny nuklearnej.
Przed podaniem roztworu nadtechnecjanu sodu (99mTc) pacjent powinien:
pić dużo wody przed rozpoczęciem badania, aby jak najczęściej oddawać mocz podczas pierwszych godzin po badaniu.
być na czczo przez 3 do 4 godzin przed scyntygrafią uchyłka Meckela, aby utrzymać
możliwie powolną pracę jelita cienkiego.
Dzieci i młodzież
Osoby w wieku poniżej 18 lat lub rodzice takich osób powinni porozumieć się z lekarzem medycyny nuklearnej.
Roztwór nadtechnecjanu sodu (99mTc) a inne leki
Należy powiedzieć lekarzowi medycyny nuklearnej o wszystkich lekach przyjmowanych przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje przyjmować, ponieważ mogą one utrudniać interpretację zdjęć. W szczególności dotyczy to następujących leków:
atropina, używana np. do:
zmniejszenia skurczów żołądka, jelit lub pęcherzyka żółciowego,
zmniejszenia wydzieliny trzustki,
w okulistyce,
przed podaniem znieczulenia,
w leczeniu spowolnionego bicia serca lub
jako antidotum
izoprenalina, lek stosowany w leczeniu spowolnionego bicia serca
leki przeciwbólowe
środki przeczyszczające (nie należy ich stosować podczas tego zabiegu, gdyż podrażniają przewód pokarmowy)
jeśli pacjent przechodził badania z kontrastem (np. z użyciem środka kontrastowego z barem) lub badanie górnego odcinka przewodu pokarmowego (ponieważ należy ich unikać na 48 godzin przed scyntygrafią uchyłka Meckela)
leki przeciwtarczycowe (np. karbimazol lub inne pochodne imidazolu, takie jak
propylotiouracyl, salicylany, steroidy, nitroprusydek sodu, sulfobromoftaleina sodu, nadchloran) (nie należy ich przyjmować na 1 tydzień przed scyntygrafią)
fenylobutazon w leczeniu gorączki, bólu i stanów zapalnych w organizmie (nie należy go
przyjmować na 2 tygodnie przed scyntygrafią)
środki wykrztuśne (nie należy ich przyjmować na 2 tygodnie przed scyntygrafią)
preparaty zawierające naturalne lub syntetyczne hormony tarczycy (np. tyroksyna sodowa, liotyronina sodowa, ekstrakt z tarczycy) (nie należy ich przyjmować przez 2-3 tygodnie przed scyntygrafią)
amiodaron - lek przeciwarytmiczny (nie należy go przyjmować przez 4 tygodnie przed
scyntygrafią)
benzodiazepiny stosowane np. w sedacji lub jako leki przeciwlękowe, przeciwdrgawkowe lub zwiotczające mięśnie lub związki litu stosowane jako stabilizator nastroju w chorobie maniakalno-depresyjnej (ponieważ obu nie należy przyjmować na 4 tygodnie przed scyntygrafią)
jodkowe środki kontrastowe do badań radiologicznych organizmu (ponieważ nie powinny być
podawane na 1-2 miesiące przed scyntygrafią)
Przed zażyciem jakichkolwiek leków należy zapytać lekarza medycyny nuklearnej.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub gdy planuje mieć dziecko, powinna poradzić się lekarza medycyny nuklearnej przed otrzymaniem tego leku.
Pacjentka musi poinformować lekarza medycyny nuklearnej przed otrzymaniem roztworu nadtechnecjanu sodu (99mTc), jeśli istnieje możliwość, że jest w ciąży, jeśli opóźnia się jej miesiączka lub jeśli karmi piersią. W przypadku wątpliwości należy skonsultować się z lekarzem medycyny nuklearnej, który będzie nadzorował procedurę.
Jeśli pacjentka jest w ciąży, lekarz medycyny nuklearnej poda lek w czasie ciąży wyłącznie, jeśli oczekiwana korzyść z badania znacznie przewyższa ryzyko.
Jeśli pacjentka karmi piersią, powinna poinformować o tym lekarza medycyny nuklearnej, ponieważ zaleci on zaprzestanie karmienia do czasu wyeliminowania radioaktywności z organizmu. Trwa to około 12 godzin. Wydzielone w tym czasie mleko należy wyrzucić. Wznowienie karmienia piersią należy uzgodnić ze specjalistą medycyny nuklearnej, który będzie nadzorował badanie.
Prowadzenie pojazdów i obsługiwanie maszyn
Roztwór nadtechnecjanu sodu (99mTc) nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Roztwór nadtechnecjanu sodu zawiera sód
Roztwór nadtechnecjanu sodu zawiera 3,6 mg/ml sodu. W zależności od wstrzykniętej objętości może zostać przekroczony limit 1 mmol (23 mg) sodu na podaną dawkę. Należy to wziąć pod uwagę, jeśli pacjent jest na diecie o niskiej zawartości soli.
Jak stosuje się roztwór nadtechnecjanu sodu (99mTc) uzyskany z użyciem leku TEKCIS
Istnieją surowe przepisy dotyczące stosowania, obchodzenia się i usuwania produktów radiofarmaceutycznych. Tekcis będzie stosowany wyłącznie w specjalnych kontrolowanych obszarach. Produkt będą przygotowywały i podawały pacjentowi wyłącznie osoby, które są przeszkolone i wykwalifikowane do tego, by zrobić to w bezpieczny sposób. Osoby te dołożą wszelkich starań, by stosować produkt w bezpieczny sposób i by informować pacjenta o podejmowanych działaniach.
Lekarz medycyny nuklearnej nadzorujący procedurę zdecyduje o ilości roztworu nadtechnecjanu sodu (99mTc) do zastosowania w danym przypadku. Będzie to najmniejsza dawka niezbędna do uzyskania oczekiwanych informacji.
Ilość zwykle zalecana do podania osobom dorosłym w zależności od rodzaju wykonywanego badania wynosi od 2 do 400 MBq (megabekerel, jednostka używana do wyrażania radioaktywności).
Stosowanie u dzieci i młodzieży
U dzieci i młodzieży podawana ilość będzie dostosowana do masy ciała.
Podanie roztworu nadtechnecjanu sodu (99mTc) i przeprowadzenie badania
W zależności od celu badania produkt będzie podawany we wstrzyknięciu do żyły ramiennej lub może być wkroplony do oczu w postaci kropli.
Do przeprowadzenia badania potrzebnego lekarzowi wystarczy jedno podanie.
Czas trwania procedury
Lekarz medycyny nuklearnej poinformuje pacjenta o tym, jak długo zwykle trwa procedura.
Skany można wykonywać w dowolnym momencie, od momentu wstrzyknięcia i do 24 godzin po podaniu, w zależności od rodzaju badania.
Po podaniu roztworu nadtechnecjanu sodu (99mTc) pacjent powinien:
unikać bliskiego kontaktu z małymi dziećmi i kobietami w ciąży przez 12 godzin po wstrzyknięciu,
często oddawać mocz, aby usuwać produkt z organizmu,
po podaniu roztworu pacjent otrzyma napój i zostanie poproszony o oddanie moczu bezpośrednio przed badaniem.
Lekarz medycyny nuklearnej poinformuje pacjenta, czy konieczne jest podjęcie specjalnych środków ostrożności po otrzymaniu tego leku. W przypadku wszelkich pytań należy się skontaktować z lekarzem medycyny nuklearnej.
Zastosowanie większej niż zalecana dawki roztworu nadtechnecjanu sodu (99mTc) uzyskanego za pomocą leku Tekcis:
Przedawkowanie jest prawie niemożliwe, ponieważ pacjent otrzyma tylko pojedynczą dawkę roztworu nadtechnecjanu sodu (99mTc) dokładnie kontrolowaną przez lekarza medycyny nuklearnej nadzorującego procedurę. Jednak w przypadku przedawkowania pacjent otrzyma odpowiednie leczenie. W szczególności lekarz medycyny nuklearnej odpowiedzialny za zabieg może zalecić picie dużej ilości płynów w celu usunięcia śladów radioaktywności z organizmu.
W przypadku pytań dotyczących stosowania tego produktu należy zwrócić się do lekarza medycyny
nuklearnej, który nadzoruje procedurę.
Możliwe działania niepożądane
reakcje alergiczne z objawami, takimi jak
wysypka skórna, swędzenie
pokrzywka
obrzęki w różnych miejscach, m.in. twarzy
brak tchu (krótki, płytki oddech)
zaczerwienienie skóry
śpiączka
reakcje krążeniowe z objawami, takimi jak:
szybkie bicie serca, wolne bicie serca
omdlenie
nieostre widzenie
zawroty głowy
ból głowy
uderzenia gorąca z zaczerwienieniem skóry
zaburzenia ze strony przewodu pokarmowego z objawami, takimi jak
wymioty
nudności (mdłości)
biegunka
reakcje w miejscu wkłucia z objawami, takimi jak
stan zapalny skóry
ból
obrzęk (spuchnięcie)
zaczerwienienie.
Ten produkt radiofarmaceutyczny będzie dostarczał niewielkie ilości promieniowania jonizującego, co wiąże się z jak najmniejszym ryzykiem zachorowania na raka i wystąpienia dziedzicznych nieprawidłowości.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać bezpośrednio do:
Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak przechowywać lek TEKCIS
Zawartość opakowania i inne informacje Co zawiera lek TEKCIS
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Działania niepożądane o nieznanej częstości (na podstawie dostępnych danych nie można ustalić częstości):
Pacjent nie będzie przechowywał tego produktu. Specjalista w danym zakładzie medycyny nuklearnej jest odpowiedzialny za jego przechowywanie. Przechowywanie produktów radiofarmaceutycznych będzie odbywało się zgodnie z krajowymi przepisami dotyczącymi przechowywania materiałów radioaktywnych.
Substancją czynną jest roztwór sodu nadtechnecjanu (99mTc).
Pozostałe składniki to: sodu chlorek, sodu azotan i woda do wstrzykiwań.
Jak wygląda lek TEKCIS i co zawiera opakowanie
Produktem jest roztwór sodu nadtechnecjanu (99mTc) otrzymywany z generatora radionuklidu. TEKCIS należy eluować, a otrzymany roztwór może być użyty sam lub do radioznakowania niektórych konkretnych zestawów do przygotowania radiofarmaceutyku.
Wielkość opakowań:
aktywność 99mTc (maksymalna teoretyczna aktywność elucyjna na dzień kalibracji, godz. 12 CET) | 2 | 4 | 6 | 8 | 10 | 12 | 16 | 20 | 25 | 50 | GBq |
aktywność 99Mo (na dzień kalibracji, godz. 12 CET) | 2,5 | 5 | 7 | 9,5 | 12 | 14,5 | 19 | 24 | 30 | 60 | GBq |
Podmiot odpowiedzialny i wytwórca
CIS bio international Route Nationale306 BP 32 SACLAY
F-91192 Gif-sur-Yvette Cedex Francja
E-mail: drugsafety@curiumpharma.com, Tel: +33 1.69.85.76.76.
Ten lek jest dopuszczony do obrotu w krajach członkowskich Europejskiego Obszaru Gospodarczego pod następującymi nazwami:
Austria, Belgia, Bułgaria, Cypr, Chorwacja, Dania, Estonia, Finlandia, Francja, Niemcy, Grecja, Węgry, Irlandia, Włochy, Łotwa, Litwa, Luksemburg, Malta, Holandia, Norwegia, Polska, Portugalia, Rumunia, Słowacja, Słowenia, Hiszpania, Szwecja, Wielka Brytania: TEKCIS
Czechy: Technecistan-(99mTc) sodný CIS bio international
Data ostatniej aktualizacji ulotki:
Inne źródła informacji
Szczegółowe informacje o tym leku znajdują się na stronie internetowej Departament Rejestracji Produktów Leczniczych (https://rejestrymedyczne.ezdrowie.gov.pl/rpl/search/public)
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Kompletna ChPL produktu leczniczego Tekcis jest dostarczana jako osobny dokument w opakowaniu produktu w celu dostarczenia fachowemu personelowi medycznemu innych dodatkowych informacji naukowych i praktycznych na temat podawania i stosowania tego radiofarmaceutyku.
Proszę zapoznać się z ChPL (powinna znajdować się w opakowaniu).











