Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania Dawkowanie
Podanie domięśniowe
Sposób rozpuszczania: Patrz punkt 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania.
Należy uwzględnić całkowitą ilość witamin pochodzących ze wszystkich źródeł, takich jak inne formy żywienia, podawanie innych witamin lub leków zawierających witaminy jako składniki nieaktywne (patrz punkt 4.5).
Stan kliniczny pacjenta i stężenia witamin powinny być kontrolowane w celu utrzymania ich odpowiedniego poziomu.
Należy wziąć pod uwagę, że niektóre witaminy, zwłaszcza A, B2 i B6 są wrażliwe na działanie światła ultrafioletowego (np.: bezpośrednie i pośrednie światło słoneczne). Dodatkowo, duża zawartość tlenu w roztworze może zwiększać utratę witamin A, B1, C i E. Należy rozważyć te czynniki, jeżeli właściwe stężenia witamin nie są osiągnięte.
Przeciwwskazania
w nadwrażliwości na którąkolwiek substancję czynną, zwłaszcza na witaminę B1 lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, w tym na białko soi i produkty sojowe (lecytyna w mieszankach miceli pochodzi z soi), lub na białko orzeszków ziemnych i produkty je zawierające,
u noworodków, niemowląt i dzieci poniżej 11 lat,
w hiperwitaminozie którejkolwiek z witamin zawartych w tym produkcie.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ostrzeżenia
Dla preparatu CERNEVIT, innych produktów wielowitaminowych oraz pojedynczych witamin (zwłaszcza B1, B2, B12 i kwasu foliowego) były zgłaszane ciężkie ogólnoustrojowe reakcje nadwrażliwości. Dla preparatu CERNEVIT i innych produktów witaminowych podawanych pozajelitowo zgłaszano reakcje zakończone zgonem (Patrz punkt 4.8).
Obserwowano występowanie alergii krzyżowych pomiędzy białkami soi i orzeszków ziemnych.
W niektórych przypadkach, wystąpienie reakcji nadwrażliwości po dożylnym podaniu produktów wielowitaminowych może być związane z szybkością podania. W przypadku podania we wlewie dożylnym, preparat CERNEVIT należy podawać powoli. W przypadku podania we wstrzyknięciu dożylnym, należy podawać powoli (wstrzyknięcie powinno trwać co najmniej 10 minut).
Jeżeli wystąpią objawy przedmiotowe lub podmiotowe reakcji nadwrażliwości, wlew lub wstrzyknięcie musi być natychmiast przerwane.
Toksyczność witamin
Stan kliniczny pacjenta i stężenie witamin we krwi powinny być monitorowane w celu uniknięcia przedawkowania i działania toksycznego, zwłaszcza witamin A, D i E, a w szczególności u pacjentów, którzy dodatkowo otrzymują witaminy z innych źródeł lub stosują inne czynniki zwiększające ryzyko toksycznego wpływu witamin.
Monitorowanie jest szczególnie ważne u pacjentów długotrwale otrzymujących suplementację.
Hiperwitaminoza A
Ryzyko hiperwitaminozy A i toksycznego wpływu witaminy A (np.: nieprawidłowości skóry i kości, podwójne widzenie, marskość wątroby) jest zwiększone, na przykład:
u pacjentów z niedoborem białka
u pacjentów z niewydolnością nerek (nawet w przypadku braku suplementacji witaminy A)
u pacjentów z niewydolnością wątroby
u pacjentów z małą masą ciała (np.: pacjenci pediatryczni)
i u pacjentów leczonych przewlekle.
Ostre schorzenia wątroby u pacjentów z dużymi zapasami witaminy A w wątrobie mogą prowadzić do wystąpienia objawów toksycznego wpływu witaminy A.
Zespół ponownego odżywiania u pacjentów otrzymujących żywienie pozajelitowe
Uzupełnianie substancji odżywczych u pacjentów ciężko niedożywionych może wywołać zespół objawów z tym związanych, który charakteryzuje się przeniesieniem potasu, fosforu i magnezu do przestrzeni wewnątrzkomórkowej, gdyż u pacjenta zaczynają przeważać przemiany anaboliczne. Może także dojść do powstania niedoboru tiaminy i zatrzymania płynów w organizmie. Dokładna kontrola i powolne zwiększanie podaży substancji odżywczych, unikając przekarmienia, może zapobiec tym powikłaniom. W razie wystąpienia niedoborów żywieniowych może być uzasadniona odpowiednia suplementacja.
Osady u pacjentów otrzymujących żywienie pozajelitowe
U pacjentów żywionych pozajelitowo zgłaszano wytrącanie się osadu w naczyniach płucnych. Niektóre przypadki zakończyły się zgonem. Nadmierny dodatek wapnia i fosforanu zwiększa ryzyko powstawania osadu fosforanu wapnia. Wystąpienie osadów było zgłaszane nawet przy nieobecności soli fosforanowych w roztworze. Zgłaszano również pojawienie się osadu oddalonego od filtra umieszczonego na linii wlewu i podejrzenie formowania się osadu w krwioobiegu.
Oprócz kontroli roztworu, należy również okresowo sprawdzać zestaw do infuzji i cewnik w kierunku obecności osadów.
W przypadku wystąpienia objawów przedmiotowych zaburzenia funkcji płuc, należy przerwać wlew i rozpocząć ocenę kliniczną pacjenta.
Sprawdzić, czy pojemnik nie jest uszkodzony. Pracować w warunkach aseptycznych.
Nie należy przechowywać częściowo zużytych fiolek; nie używać, jeżeli barwa produktu po rozpuszczeniu jest niewłaściwa.
Specjalne środki ostrożności przy stosowaniu
Wpływ na wątrobę
U pacjentów otrzymujących CERNEVIT zaleca się monitorowanie parametrów czynności wątroby. Szczególna kontrola zalecana jest u pacjentów z żółtaczką pochodzenia wątrobowego lub innymi objawami cholestazy.
U pacjentów otrzymujących CERNEVIT zgłaszano przypadki wzrostu aktywności enzymów wątrobowych, w tym izolowanego wzrostu aktywności aminotransferazy alaninowej (ALT) u osób z chorobami zapalnymi jelit (patrz punkt 4.8).
Dodatkowo, u pacjentów otrzymujących CERNEVIT obserwowano wzrost stężenia kwasów żółciowych (wszystkich jak i poszczególnych kwasów żółciowych, w tym kwasu glikocholowego).
U niektórych pacjentów otrzymujących żywienie pozajelitowe (włączając żywienie pozajelitowe z suplementacją witaminami) dochodzi do wystąpienia zaburzeń wątroby i dróg żółciowych, w tym cholestazy, stłuszczenia, zwłóknienia i marskości wątroby, prowadzących prawdopodobnie do niewydolności wątroby, a także zapalenia woreczka żółciowego i kamicy żółciowej. Uważa się, że etiologia tych schorzeń jest wieloczynnikowa i może być różna u poszczególnych pacjentów. Pacjenci, u których wystąpią nieprawidłowości w wynikach badań laboratoryjnych lub inne oznaki zaburzeń wątroby i dróg żółciowych, powinni zostać jak najwcześniej poddani badaniu przez lekarza posiadającego wiedzę z zakresu chorób wątroby w celu identyfikacji możliwych czynników przyczynowych i sprzyjających oraz podjęcia możliwych środków terapeutycznych i profilaktycznych.
Stosowanie u pacjentów z zaburzeniami funkcji wątroby
Pacjenci z zaburzeniami funkcji wątroby mogą wymagać indywidualnego uzupełniania witamin. Należy zwrócić szczególną uwagę, aby zapobiec toksyczności witaminy A, ponieważ występowanie choroby wątroby wiąże się ze zwiększoną podatnością na toksyczne działanie witaminy A, w szczególności w połączeniu z przewlekłym nadmiernym spożyciem alkoholu (patrz też powyżej
„Hiperwitaminoza A” i „Wpływ na wątrobę”).
Stosowanie u pacjentów z upośledzoną funkcją nerek
Pacjenci z zaburzoną funkcją nerek mogą wymagać indywidualnego uzupełniania witamin, w zależności od stopnia uszkodzenia nerek i występowania chorób współistniejących. U pacjentów z ciężką niewydolnością nerek, należy zwrócić szczególną uwagę na utrzymanie właściwego stężenia witaminy D oraz na zapobieganie toksycznemu wpływowi witaminy A, który może się pojawić u takich pacjentów nawet przy suplementacji małymi dawkami witaminy A lub nawet przy braku suplementacji.
Hiperwitaminoza i toksyczność (obwodowa neuropatia, ruchy mimowolne) pirydoksyny (witaminy B6) były zgłaszane u pacjentów przewlekle hemodializowanych, którzy otrzymywali dożylnie produkty wielowitaminowe zawierające 4 mg pirydoksyny podawane trzy razy w tygodniu.
Ogólne monitorowanie
U pacjentów otrzymujących przez dłuższy czas dożylnie produkty wielowitaminowe jako jedyne źródło witamin, należy monitorować stan kliniczny oraz stężenie witamin. Jest to szczególnie ważne, w celu właściwej suplementacji, np.:
witaminy A u pacjentów z odleżynami, ranami, oparzeniami, zespołem krótkiego jelita czy mukowiscydozą,
witaminy B1 u pacjentów dializowanych,
witaminy B2 u pacjentów z chorobą nowotworową,
witaminy B6 u pacjentów z niewydolnością nerek,
poszczególnych witamin, których wymaganie może być zwiększone z uwagi na interakcje z innymi produktami leczniczymi (patrz punkt 4.5).
Niedobory jednej lub kilku witamin należy korygować poprzez specyficzną suplementację. CERNEVIT nie zawiera witaminy K, którą w razie potrzeby należy podawać osobno.
Stosowanie u pacjentów z niedoborem witaminy B12
Przed rozpoczęciem suplementacji produktem CERNEVIT u pacjentów z grupy ryzyka niedoboru witaminy B12 i (lub) kiedy planuje się podawanie produktu CERNEVIT przez kilka tygodni, zaleca się ocenę stanu witaminy B12.
Po kilku dniach podawania, zarówno stężenie cyjanokobalaminy (witaminy B12) jak i kwasu foliowego w produkcie CERNEVIT może być wystarczające, by spowodować wzrost ilości czerwonych krwinek, retikulocytów oraz hemoglobiny u niektórych pacjentów z niedoborem witaminy B12 z towarzyszącą anemią megaloblastyczną. Może to maskować niedobór witaminy B12. Skuteczne leczenie niedoboru witaminy B12 wymaga wyższych dawek cyjanokobalaminy niż jest dostarczana w produkcie CERNEVIT.
Suplementacja kwasu foliowego u pacjentów z niedoborem witaminy B12, którzy również nie otrzymują witaminy B12, nie zapobiega rozwojowi ani postępowi zmian neurologicznych związanych z niedoborem witaminy B12. Sugeruje się nawet możliwość pogorszenia stanu neurologicznego.
Podczas interpretacji poziomu witaminy B12 należy wziąć pod uwagę, że niedawne przyjmowanie witaminy B12 może powodować prawidłowy poziom pomimo niedoboru w tkankach.
Zaburzenia testów laboratoryjnych
Biotyna może wpływać na badania laboratoryjne oparte na interakcji biotyny i streptawidyny, prowadząc do fałszywie obniżonych lub fałszywie podwyższonych wyników badań, w zależności od próby. Ryzyko interferencji jest większe u dzieci i pacjentów z zaburzeniami czynności nerek i wzrasta w przypadku większych dawek. Interpretując wyniki badań laboratoryjnych należy wziąć pod uwagę możliwą interferencję biotyny, zwłaszcza jeżeli obserwuje się brak zgodności z prezentacją kliniczną (np. wyniki badania tarczycy imitujące wyniki wskazujące na chorobę Gravesa-Basedowa u przyjmujących biotynę pacjentów bez objawów tej choroby lub fałszywie negatywne wyniki testów troponinowych u pacjentów z zawałem mięśnia sercowego przyjmujących biotynę). W przypadkach, w których podejrzewa się wystąpienie interferencji, należy wykonać alternatywne, niepodatne na interferencję z biotyną, badania, jeżeli są one dostępne. Jeśli zleca się badania laboratoryjne u pacjentów przyjmujących biotynę, należy skonsultować się z personelem laboratorium.
W zależności od stosowanych odczynników, obecność kwasu askorbinowego w surowicy krwi i moczu może powodować fałszywie wysokie lub niskie odczyty stężenia glukozy w niektórych systemach badania poziomu glukozy we krwi i moczu, w tym przenośnych paskach testowych i przenośnych glukometrach. Należy zapoznać się z danymi technicznym dla każdego testu laboratoryjnego w celu określenia potencjalnych zaburzeń wywołanych witaminami.
Równoczesne stosowanie z lekami przeciwpadaczkowymi:
Ze względu na obecność kwasu foliowego, łączne podawanie preparatu CERNEVIT z lekami przeciwpadaczkowymi zawierającymi fenobarbital, fenytoinę lub prymidon wymaga zachowania szczególnej ostrożności (patrz „Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji”).
Równoczesne stosowanie z lewodopą:
Ze względu na obecność pirydoksyny w produkcie CERNEVIT, równoczesne stosowanie z lewodopą wymaga zachowania środków ostrożności, gdyż może to zmniejszać skuteczność L-dopy (patrz
„Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji”).
Stosowanie u dzieci i młodzieży
CERNEVIT jest wskazany u dzieci i młodzieży w wieku powyżej 11 lat (patrz również punkt 4.4: Hiperwitaminoza A).
Stosowanie u pacjentów w podeszłym wieku
Zazwyczaj, należy rozważyć dostosowanie dawkowania u pacjentów w podeszłym wieku (zmniejszenie dawki i (lub) wydłużenie odstępów pomiędzy kolejnymi dawkami) uwzględniając większą częstotliwość pogorszenia czynności wątroby, nerek lub serca oraz występowanie chorób współistniejących lub terapii lekowej.
Zawartość sodu
CERNEVIT zawiera 24 mg sodu (1 mmol) na fiolkę. Należy wziąć to pod uwagę, jeżeli pacjenci są na diecie kontrolującej ilość sodu.
Należy sprawdzić zgodność produktu przed zmieszaniem z innymi roztworami do wlewów, zwłaszcza, gdy CERNEVIT jest dodawany do worków zawierających podwójne mieszaniny do żywienia pozajelitowego, łączące glukozę, elektrolity i roztwór aminokwasów, jak również potrójne mieszaniny łączące glukozę, elektrolity i roztwór aminokwasów oraz tłuszcze (patrz również punkt 6.2
„Niezgodności farmaceutyczne”).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
czynniki mogące powodować wystąpienie pseudoguza mózgu (w tym pewne tetracykliny): ryzyko wystąpienia pseudoguza mózgu wzrasta przy jednoczesnym podawaniu witaminy A,
alkohol (przewlekłe nadużywanie): podnosi ryzyko hepatotoksycznego wpływu witaminy A,
leki przeciwdrgawkowe: kwas foliowy może zwiększyć metabolizm niektórych leków przeciwpadaczkowych, np.: fenobarbitalu, fenytoiny, fosfenytoiny i prymidonu, co zwiększa ryzyko wystąpienia napadu padaczkowego. Powinno się monitorować stężenie leków przeciwdrgawkowych w surowicy krwi przy równoczesnym stosowaniu folianów oraz po zakończeniu terapii nimi,
leki przeciwpłytkowe (np.: aspiryna): witamina E może nasilać wpływ hamujący na czynność płytek,
aspiryna (terapia dużymi dawkami): może redukować poziom kwasu foliowego przez zwiększenie wydalania moczu,
niektóre leki przeciwdrgawkowe (np.: fenytoina, karbamazepina, fenobarbital, walproinian): mogą powodować niedobór folianów, pirydoksyny i witaminy D,
niektóre leki antyretrowirusowe: obniżone poziomy witaminy D są związane np. z efavirenzem czy zydowudyną. Zmniejszone tworzenie aktywnych metabolitów witaminy D jest związane z inhibitorami proteaz,
chloramfenikol: może hamować odpowiedź hematologiczną na leczenie witaminą B12,
deferoksamina: zwiększa ryzyko niewydolności serca indukowanej żelazem z powodu zwiększonej mobilizacji żelaza przez większą niż fizjologiczna suplementację witaminy C. W celu zapoznania się ze specyficznymi środkami ostrożności, patrz informacja o produkcie deferoksaminy,
etionamid: może powodować niedobór pirydoksyny,
fluoropirymidyny (5-fluorouracyl, kapecytabina, tegafur): zwiększona cytotoksyczność w połączeniu z kwasem foliowym,
antagoniści folianów, np.: metotreksat, sulfasalazyna, pirymetamina, triamteren, trimetoprim oraz wysokie stężenia katechin zawartych w herbacie: blokują przemianę folianów do ich aktywnych metabolitów i zmniejszają skuteczność suplementacji,
antymetabolity folianów (metotreksat, raltitreksed): suplementacja kwasem foliowym może obniżyć skuteczność działania antymetabolicznego,
lewodopa: witamina B6 może zmniejszać skuteczność lewodopy, ponieważ dekarboksylacja lewodopy wymaga enzymu zależnego od witaminy B6. Aby zapobiec tej interakcji, można dodać inhibitor dopa-dekarboksylazy, np. karbidopę.
antagoniści pirydoksyny, w tym cykloseryna, hydralazyna, izoniazyd, penicylamina, fenelzyna: mogą powodować niedobór pirydoksyny,
retinoidy, w tym beksaroten: wzrasta ryzyko ich toksyczności, jeżeli są podawane wraz z witaminą A (patrz punkt 4.4: Hiperwitaminoza A),
teofilina: może powodować niedobór pirydoksyny,
roztwór doustny tipranawiru: zawiera 116 j.m/ml witaminy E, co przekracza zalecaną podaż dobową,
antagoniści witaminy K (np.: warfaryna): nasilają przeciwkrzepliwe działanie witaminy E.
Produkty lecznicze łączące się z kwaśną alfa-1-glikoproteiną (AAG):
W badaniu in vitro z użyciem ludzkiej surowicy, około 4-krotnie wyższe stężenie kwasu glikocholowego niż stężenie kwasu glikocholowego w surowicy, które mogło być rezultatem wstrzyknięcia w bolusie osobie dorosłej produktu CERNEVIT, zwiększało o 50-80% frakcję wybranych produktów leczniczych wiążących się z kwaśną alfa-1-glikoproteiną (AAG).
Nie wiadomo, czy efekt ten jest istotny klinicznie, jeżeli ilość kwasu glikocholowego zawarta w standardowej dawce CERNEVIT (jako składnik zmieszanych miceli) jest podawana w powolnej iniekcji dożylnej, powolnej iniekcji domięśniowej lub w infuzji przez dłuższy czas.
Pacjenci otrzymujący CERNEVIT oraz produkty lecznicze wiążące się z AAG powinni być ściśle monitorowani pod kątem zwiększonego działania tych leków. Należą do nich propranolol, prazosyna i wiele innych.
Interakcje związane z suplementacją innych witamin:
Niektóre produkty lecznicze mogą wchodzić w interakcje z niektórymi witaminami w dawkach znacznie przekraczających dawki zawarte w produkcie CERNEVIT. Należy wziąć to pod uwagę u pacjentów przyjmujących witaminy z wielu źródeł, a gdy ma to miejsce, należy monitorować pacjentów pod kątem tych interakcji i odpowiednio postępować.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
zaburzenia żołądkowo-jelitowe, ból głowy, wzrost ciśnienia wewnątrzczaszkowego, obrzęk tarczy nerwu wzrokowego, zaburzenia psychiczne, nadmierna pobudliwość a nawet drgawki. Jako późny objaw reakcji organizmu na przedawkowanie obserwowano uogólnione łuszczenie się skóry.
Objawy kliniczne toksyczności witaminy A przy przedawkowaniu przewlekłym (długotrwałe podawanie wyższych niż fizjologiczne dawek witaminy A u pacjentów niewymagających uzupełniania niedoboru)
wzrost ciśnienia wewnątrzczaszkowego, nadmierny wzrost warstwy korowej kości długich oraz przedwczesne kostnienie części nasadowych kości. Rozpoznanie jest oparte na obecności tkliwych uciskowo lub bolesnych podskórnych obrzęków w obrębie kończyn. W obrazie rentgenowskim występują zgrubienia okostnej trzonu kości łokciowej, strzałkowej, obojczyków oraz żeber.
Leczenie przedawkowania witamin zazwyczaj polega na zaprzestaniu suplementacji witamin i innych działaniach zgodnie ze wskazaniami klinicznymi (jak ograniczenie podaży wapnia, zwiększenie diurezy i nawodnienie).
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
występuje w postaci wolnej lub jako koenzym A w osoczu i w erytrocytach, wydalana w moczu;
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Dodatki mogą być niezgodne z żywieniem pozajelitowym zawierającym CERNEVIT.
Nie należy dodawać innych produktów leczniczych lub substancji bez uprzedniego potwierdzenia ich zgodności i stabilności powstałego preparatu.
W przypadku konieczności równoczesnego podawania leków, które wykazują niezgodność w miejscu łącznika Y należy podawać je za pomocą oddzielnych linii dożylnych.
Witamina A i tiamina zawarte w produkcie CERNEVIT mogą reagować z wodorosiarczynami zawartymi w roztworach do żywienia pozajelitowego (np. w wyniku dodatku), co może prowadzić do degradacji witaminy A i tiaminy.
Zwiększenie pH roztworu może nasilać degradację niektórych witamin. Należy to uwzględnić podczas dodawania roztworów alkalicznych do mieszaniny zawierającej CERNEVIT.
Stabilność kwasu foliowego może być zmniejszona z powodu zwiększonego stężenia wapnia w mieszaninie.
Opisanych zostało jeszcze wiele innych niezgodności między witaminami a innymi produktami leczniczymi, w tym z niektórymi antybiotykami i pierwiastkami śladowymi.
Jeśli potrzeba, należy odnieść się do odpowiednich referencji dotyczących zgodności oraz wytycznych. Tego produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi, chyba że wykazano ich zgodność i stabilność; w celu uzyskania dalszych informacji patrz punkt 6.6.
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
CERNEVIT, proszek do sporządzania roztworu do wstrzykiwań i infuzji
1 fiolka proszku (5 ml) zawiera:
Co odpowiada | |||
retynolu palmitynian | 3500 j.m | witamina A | 3500 j.m. |
Cholekalcyferol | 220 j.m | witamina D3 | 220 j.m. |
DL--tokoferol | 10,20 mg | witamina E | 11,20 j.m. |
kwas askorbowy | 125 mg | witamina C | 125 mg |
kokarboksylaza czterowodna | 5,80 mg | witamina B1 (tiamina) | 3,51 mg |
sól sodowa fosforanu ryboflawiny | 5,67 mg | witamina B2 (ryboflawina) | 4,14 mg |
pirydoksyny chlorowodorek | 5,50 mg | witamina B6 (pirydoksyna) | 4,53 mg |
Cyjanokobalamina | 6 g | witamina B12 | 6 g |
kwas foliowy | 414 µg | kwas foliowy | 414 g |
Dekspantenol | 16,15 mg | kwas pantotenowy | 17,25 mg |
Biotyna | 69 g | Biotyna | 69 g |
Nikotynamid | 46 mg | witamina PP | 46 mg |
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek do sporządzenia roztworu do wstrzykiwań i infuzji.
Dostarczanie witamin pacjentom żywionym pozajelitowo. Tylko dla dorosłych i dzieci w wieku powyżej 11 lat.
Podawać wstrzykując powoli domięśniowo lub dożylnie, lub dożylnie w postaci wlewów, 1 fiolkę dziennie.
Sposób podawania
- Podanie dożylne
Sposób rozpuszczania: Patrz punkt 6.6 Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania.
Po rozpuszczeniu: Wstrzykiwać powoli (co najmniej 10 min.; patrz punkt 4.4) dożylnie lub w postaci wlewu dożylnego w roztworze soli fizjologicznej lub glukozy 5%.
Podawanie może być kontynuowane przez cały okres żywienia pozajelitowego. W celu spełnienia potrzeb żywieniowych i zapobieganiu niedoborom oraz ewentualnym powikłaniom z nich wynikających CERNEVIT może być dodawany do mieszanin odżywczych zawierających węglowodany, tłuszcze, aminokwasy i elektrolity, pod warunkiem wcześniejszego stwierdzenia zgodności i stabilności w stosunku do każdego preparatu wchodzącego w skład mieszaniny odżywczej.
Produktu CERNEVIT nie wolno stosować:
Reakcje nadwrażliwości
Należy odpowiednio uwzględnić interakcje pomiędzy poszczególnymi witaminami w produkcie CERNEVIT i innymi czynnikami.
Interakcje te obejmują:
Przed przepisaniem produktu CERNEVIT, lekarze powinni dokładnie rozważyć potencjalne ryzyko i korzyści dla każdego pacjenta.
Ciąża
Brak danych odnośnie bezpieczeństwa podawania preparatu CERNEVIT w okresie ciąży i karmienia piersią. Jeżeli jest to konieczne, preparat może być przepisany kobiecie w ciąży, pod warunkiem ścisłego przestrzegania wskazań i dawkowania, aby uniknąć przedawkowania witamin.
Laktacja
Ze względu na niebezpieczeństwo przedawkowania witaminy A u noworodka, podawanie preparatu podczas karmienia piersią jest niewskazane.
Płodność
Brak wystarczających danych ze stosowania produktu CERNEVIT odnośnie płodności mężczyzn lub kobiet.
Nie dotyczy.
Działania niepożądane produktów leczniczych, które wystąpiły po podaniu CERNEVIT są przedstawiane z ich względną częstotliwością; obejmują one działania niepożądane udokumentowane w badaniach klinicznych oraz pochodzące ze zgłoszeń po wprowadzeniu leku do obrotu. CERNEVIT podawano w 3 badaniach klinicznych u 267 dorosłych pacjentów wymagających pozajelitowego uzupełniania witamin.
Częstotliwości działań niepożądanych są zgłaszane, zgodnie z następującą konwencją: bardzo często (≥ 1/10); często (≥ 1/100 do <1/10); niezbyt często (≥ 1/1000 do <1/100); rzadko (≥ 1/10000 do
<1/1000); bardzo rzadko (<1/10000); i nieznana (nie może być określona na podstawie dostępnych danych).
Działania niepożądane zgłaszane w badaniach klinicznych i po wprowadzeniu do obrotu produktu CERNEVIT:
Klasyfikacja układów i narządów | Preferowane terminy wg MedDRA | Częstotliwość |
Zaburzenia układu immunologicznego | Ogólnoustrojowe reakcje nadwrażliwości z objawami, takimi jak zaburzenia oddychania, dyskomfort w klatce piersiowej, obrzęk krtani, pokrzywka, wysypka, zaczerwienienia, dyskomfort w nadbrzuszu, jak również zatrzymanie akcji serca ze skutkiem śmiertelnym | Nieznana |
Zaburzenia metabolizmu i odżywiania | Wzrost stężenia witaminy Aa,b Wzrost stężenia białek wiążących retynolb | Nieznanac Nieznanac |
Zaburzenia układu nerwowego | Zaburzenia smaku (metaliczny posmak) | Nieznana |
Zaburzenia serca | Tachykardia | Nieznana |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Przyspieszony oddech | Nieznana |
Zaburzenia żołądka i jelit | Mdłości Wymioty | Rzadko Rzadko |
Biegunka | Nieznana | |
Zaburzenia wątroby i dróg żółciowych | Wzrost aktywności transaminaz Izolowany wzrost aktywności aminotransferazy alaninowejd Wzrost aktywności dehydrogenazy glutaminianowej Wzrost aktywności fosfatazy zasadowej we krwi Wzrost stężenia kwasów żółciowyche Wzrost aktywności gamma glutamylotransferazy | Nieznanac Nieznanac Nieznanac Nieznanac Nieznanac Nieznana |
Zaburzenia skóry i tkanki podskórnej | Świąd | Nieznana |
Zaburzenia ogólne i stany w miejscu podania | Ból w miejscu wkłucia/wlewu | Często |
Gorączka Ból uogólniony | Nieznana Nieznana |
Reakcje w miejscu infuzji, tj. uczucie pieczenia, wysypka | Nieznana |
a Nie odnotowano objawów hiperwitaminozy A.
b Podwyższone stężenie witaminy A w osoczu zgłaszano u 8 z 20 pacjentów otrzymujących CERNEVIT w żywieniu pozajelitowym w 45 dniu podawania. Od 45 do 90 dnia podawania produktu wysokie wartości witaminy A utrzymywały się na stałym poziomie (maksymalne obserwowane wartości 3,6 µmol/l w 90 dniu; normalne wartości: 1 do 2,6 µmol/l). Ponadto, zaobserwowano również średni wzrost białka wiążącego retynol (RBP). Odnotowane maksymalne wartość RBP to 60 mg/l w 90 dniu (normalne wartości: 30 do 50 mg/l)
b
c Częstotliwość nie może być ustalona lub całkowita liczba pacjentów w poszczególnych badaniach jest zbyt mała, aby umożliwić prawidłowe oszacowanie częstotliwości.
c
d Izolowany wzrost aktywności aminotransferazy alaninowej odnotowano w chorobach zapalnych jelit. CERNEVIT podawano drogą iniekcji dożylnej bez dodatkowego żywienia pozajelitowego.
e zgłaszano przypadki wzrostu całkowitego stężenia i poszczególnych kwasów żółciowych, w tym kwasu glikocholowego na początku podawania żywienia pozajelitowego u pacjentów otrzymujących CERNEVIT.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C PL 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Ostre lub przewlekłe przedawkowanie witamin (w szczególności A, B6, D i E) może powodować objawowe hiperwitaminozy.
Ryzyko przedawkowania jest szczególnie wysokie, jeżeli pacjent otrzymuje witaminy z wielu źródeł, a ogólna suplementacja witaminy nie odpowiada indywidualnym potrzebom pacjenta oraz u pacjentów ze zwiększoną podatnością na hiperwitaminozy (patrz punkt 4.4).
Objawy przedawkowania preparatu CERNEVIT wynikają głównie z podania zbyt dużych dawek witaminy A.
Objawy kliniczne ostrego przedawkowania witaminy A (dawki przekraczające 150 000 j.m.)
Grupa farmakoterapeutyczna: dodatki do roztworów do podawania dożylnego; witaminy. Kod ATC: B05XC
CERNEVIT to zbilansowany zestaw witamin rozpuszczalnych w wodzie i witamin rozpuszczalnych w tłuszczach, który pokrywa dzienne zapotrzebowanie w trakcie żywienia pozajelitowego.
Właściwości farmakodynamiczne preparatu CERNEVIT wynikają z właściwości 12 witamin wchodzących w skład preparatu.
Podstawowe właściwości:
witamina A uczestniczy we wzroście i różnicowaniu komórek oraz w procesie fizjologicznym widzenia;
witamina D reguluje metabolizm wapnia i fosforu w nerkach i kościach;
witamina E ma właściwości antyoksydacyjne, zapobiega tworzeniu toksycznych produktów utleniania i chroni struktury komórkowe;
witamina B1 (tiamina) po połączeniu z ATP jest koenzymem działającym w
metabolizmie węglowodanów;
witamina B2 (ryboflawina) działa jako koenzym w metabolizmie energetycznym
komórki, systemach oddechowych tkanek i metabolizmie makroskładników odżywczych;
witamina B3 (PP) działa jako składnik koenzymów NAD i NADP w procesach
utleniania i redukcji niezbędnych w metabolizmie makroskładników odżywczych i oddychaniu tkankowym;
witamina B5 (kwas pantotenowy)
prekursor koenzymu A, związanego z metabolizmem węglowodanów, glukoneogenezą, syntezą kwasów tłuszczowych, steroli, hormonów steroidowych i porfiryn;
witamina B6 (pirydoksyna) działa jako koenzym w metabolizmie białek, węglowodanów i
tłuszczów;
witamina B12 ze źródeł egzogennych - potrzebna do syntezy białek jądrowych i mieliny, reprodukcji komórek, prawidłowego wzrostu i utrzymania prawidłowej erytropoezy;
witamina C ma właściwości antyoksydacyjne, jest niezbędna w tworzeniu i ochronie substancji międzykomórkowej i kolagenu, biosyntezie katecholamin, syntezie karnityny i steroidów, metabolizmie kwasu foliowego i tyrozyny;
kwas foliowy ze źródeł egzogennych - potrzebny do syntezy białek jądrowych i utrzymania prawidłowej erytropoezy;
Biotyna w połączeniu z co najmniej czterema enzymami, uczestniczy w metabolizmie energetycznym, w tym glukoneogenezie.
U pacjentów przyjmujących CERNEVIT, stężenia witamin A, D i E w osoczu powracają do normy i utrzymują się w zakresie prawidłowych wartości w czasie długotrwałego żywienia pozajelitowego.
Właściwości farmakokinetyczne preparatu CERNEVIT wynikają z właściwości 12 witamin wchodzących w skład preparatu.
Podstawowe właściwości:
witamina A - prawidłowe stężenia w surowicy wynoszą 80-300 j.m./ml, związana z białkami, wydalana głównie z żółcią, a także w moczu;
witamina D - aktywna po hydroksylacji w wątrobie i nerkach, związana z białkami, wydalana głównie z żółcią, a także w moczu;
witamina E - przenoszona we krwi przez lipoproteiny, przekształcana w lakton w wątrobie i wydalana głównie w moczu;
witamina B1 (tiamina) - w 90% przenoszona przez erytrocyty, w osoczu związana z
albuminami, wydalana głównie w moczu;
witamina B2 (ryboflawina) - związana z białkami w osoczu, stężenia w osoczu bardzo
zróżnicowane, wydalana głównie w moczu w postaci wolnej lub jako metabolity;
witamina B3 (PP) - w osoczu występuje w postaci kwasu i amidu, wydalana w
moczu w postaci wolnej lub jako metabolity;
witamina B5 (kwas pantotenowy)
witamina B6 (pirydoksyna) - metabolizowana w wątrobie, wydalana w moczu; witamina B12 - prawidłowe stężenia w surowicy wynoszą 200-900 pg/ml,
związana z białkami, magazynowana w wątrobie, przenika do mleka, 50-90% dawki wydalane w moczu;
witamina C - przy stężeniach prawidłowych (8 – 14 mg/l) zachodzi całkowite wchłanianie zwrotne w kanalikach nerkowych; powyżej tych stężeń - nadmiar wydalany jest w moczu;
kwas foliowy - prawidłowe stężenia w surowicy wynoszą 0,005 – 0,015
g/ml, dystrybuowany do wszystkich tkanek, metabolizowany i magazynowany w wątrobie; przy dużych dawkach przekroczony zostaje próg wchłaniania zwrotnego w nerkach i dochodzi do wydalania w moczu;
Biotyna - występuje w postaci wolnej lub związanej z białkami w osoczu, głównie magazynowana w wątrobie, wydalana głównie w formie niezmienionej w moczu.
Nie przeprowadzono specyficznych badań przedklinicznych preparatu CERNEVIT.
Przedkliniczne badania bezpieczeństwa przeprowadzone dla każdego ze składników preparatu nie wykazały żadnego ryzyka użycia u ludzi.
Glicyna, kwas glikocholowy, lecytyna sojowa, sodu wodorotlenek, kwas solny
2 lata
Przechowywać w temperaturze pokojowej, tj. od 15°C do 25°C, chronić od światła. Przechowywać w opakowaniu zewnętrznym.
Po rozpuszczeniu preparat zachowuje stabilność chemiczną i fizyczną przez 24 godziny w temperaturze 25°C.
Z mikrobiologicznego punktu widzenia, produkt powinien zostać zużyty natychmiast po rozpuszczeniu. W przeciwnym razie, za czas i warunki przechowywania do momentu użycia odpowiada osoba podająca preparat, a przechowywanie nie powinno trwać dłużej niż 24 godziny w temperaturze 2-8°C, chyba że rozpuszczanie odbywało się w kontrolowanych i zwalidowanych warunkach aseptycznych.
Fiolki z oranżowego szkła zawierające po 750 mg proszku, w tekturowym pudełku. Opakowania 10 i 20 fiolek.
Fiolki z oranżowego szkła zawierające po 750 mg proszku, z systemem BIO-SET, w tekturowym pudełku. Opakowania 10 i 20 fiolek.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podczas przygotowywania roztworu i dodawania składnika do mieszaniny do żywienia pozajelitowego, należy przestrzegać warunków aseptycznych.
Delikatnie wymieszać, aby rozpuścić liofilizowany proszek.
CERNEVIT musi być całkowicie rozpuszczony zanim zostanie przeniesiony z fiolki.
Nie używać produktu, jeżeli przygotowany roztwór nie jest klarowny a oryginalne zamknięcie jest naruszone.
Po dodaniu CERNEVIT do roztworu do żywienia pozajelitowego, należy sprawdzić czy nie występuje nieprawidłowa zmiana koloru i (lub) czy nie są obecne osady nierozpuszczalnych kompleksów lub kryształów.
Należy dokładnie wymieszać końcowy roztwór, jeżeli CERNEVIT jest stosowany jako składnik mieszaniny do żywienia pozajelitowego.
Niewykorzystany rozpuszczony produkt CERNEVIT należy wyrzucić i nie należy przechowywać go do późniejszego użycia.
Produkty lecznicze do podawania pozajelitowego przed podaniem należy ocenić wizualnie pod kątem obecności cząstek stałych i nieprawidłowej zmiany zabarwienia roztworu, gdy roztwór oraz opakowanie na to pozwala.
Podczas podawania wszystkich rodzajów żywienia pozajelitowego zaleca się stosowanie filtra na końcu linii.
Tego produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi z wyjątkiem sytuacji, gdy wykazano zgodność i trwałość takiej mieszaniny (patrz punkt 4.2). W celu uzyskania dalszych informacji należy skontaktować się z podmiotem odpowiedzialnym.
Należy sprawdzić zgodność roztworów podawanych jednocześnie przez tą samą linię (patrz punkt 6.2).
CERNEVIT (fiolki bez BIO-SET)
Podanie dożylne
Przy użyciu strzykawki wstrzyknąć 5 ml wody do wstrzykiwań lub roztworu glukozy 5% lub 0,9% roztworu chlorku sodu do fiolki.
Delikatnie wymieszać, aż do rozpuszczenia proszku. Otrzymany roztwór ma kolor żółto-pomarańczowy.
Podanie domięśniowe
Rozpuścić proszek w 2,5 ml wody do wstrzykiwań w sposób opisany powyżej.
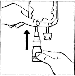
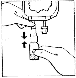
CERNEVIT BIO-SET
CERNEVIT z systemem BIO-SET umożliwia bezpośrednie rozpuszczenie preparatu w workach (jedno i wielokomorowych) z wejściem iniekcyjnym.
Worek jednokomorowy:

PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Baxter Polska Sp. z o.o. ul. Kruczkowskiego 8
00-380 Warszawa
R/6576
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 05.03.1996 Data ostatniego przedłużenia pozwolenia: 02.03.2011
26.03.2019











