Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJACY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
zaburzenia rytmu w przebiegu zespołu Wolffa-Parkinsona-White’a
migotanie i trzepotanie przedsionków, napadowe tachyarytmie nadkomorowe: częstoskurcz nadkomorowy i węzłowy, gdy inne leki nie mogą być zastosowane
komorowe zaburzenia rytmu (częstoskurcz komorowy, migotanie komór), gdy inne leki przeciwarytmiczne są nieskuteczne.
Dawkowanie i sposób podawania
Przeciwwskazania
bradykardia zatokowa, blok zatokowo-przedsionkowy i zespół chorego węzła zatokowego, z wyjątkiem osób z wszczepionym stymulatorem serca (ryzyko zahamowania czynności węzła);
blok przedsionkowo-komorowy II lub III stopnia, z wyjątkiem osób z wszczepionym stymulatorem,
blok dwu–lub trójwiązkowy, z wyjątkiem osób z wszczepionym stymulatorem serca lub założonym tymczasowym układem stymulacyjnym;
jednoczesne stosowanie z innymi lekami, które mogą powodować zaburzenia rytmu serca typu
torsade de pointes (patrz punkt 4.5);
choroby tarczycy;
okres karmienia piersią;
zapaść krążeniowa, ciężkie niedociśnienie tętnicze;
dożylne podanie leku jest przeciwwskazane w przypadku niedociśnienia, ciężkiej niewydolności układu oddechowego, kardiomiopatii zastoinowej lub niewydolności serca (możliwe zaostrzenie).
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Interakcje farmakodynamiczne
Leki wywołujące zaburzenia rytmu serca typu torsade de pointes lub wydłużające odstęp QT
Leki wywołujące zaburzenia rytmu serca typu torsade de pointes
Stosowanie amiodaronu wraz z innymi lekami mogącymi spowodować zaburzenia rytmu serca typu torsade de pointes jest przeciwwskazane (patrz punkt 4.3); do tych leków należą:
leki przeciwarytmiczne klasy IA (np.: chinidyna, dyzopiramid, prokainamid), sotalol, bretylium, beprydyl,
podawana dożylnie erytromycyna, kotrimoksazol lub pentamidyna (podana pozajelitowo),
leki przeciwpsychotyczne, takie jak: chloropromazyna, tiorydazyna, flufenazyna, pimozyd, haloperydol, amisulpiryd, sertindol,
preparaty litu i trójpierścieniowe leki przeciwdepresyjne, np. doksepina, amitryptylina,
niektóre leki przeciwhistaminowe: terfenadyna, astemizol, mizolastyna,
leki przeciwmalaryczne: chinina, chlorochina, meflochina, halofantryna,winkamina,
cyzapryd, niektóre leki neuroleptyczne.
Leki wydłużające odstęp QT
Jednoczesne podawanie amiodaronu z lekami o znanym działaniu wydłużającym odstęp QT musi być oparte na szczegółowej ocenie ryzyka i korzyści dla każdego pacjenta, ponieważ może wzrosnąć ryzyko zaburzeń rytmu serca typu torsade de pointes (patrz punkt 4.4) i pacjenta należy monitorować pod kątem wydłużenia odstępu QT.
Należy unikać podawania fluorochinolonów u pacjentów otrzymujących amiodaron.
Leki zwalniające rytm pracy serca lub wywołujące zaburzenia automatyzmu, lub przewodzenia serca
Nie zaleca się jednoczesnego stosowania amiodaronu z tymi lekami.
Leki beta-adrenolityczne oraz leki z grupy antagonistów kanałów wapniowych spowalniających rytm serca (werapamil, diltiazem), mogą spowodować zaburzenia automatyzmu węzła (znaczna bradykardia) i zaburzenia przewodzenia.
Interakcje innych leków z amiodaronem (patrz punkt 4.4)
Nie zaleca się jednoczesnego stosowania amiodaronu z sofosbuwirem w skojarzeniu z innymi lekami przeciwwirusowymi o działaniu bezpośrednim (takimi jak daklataswir, symeprewir czy ledipaswir). Jednoczesne stosowanie amiodaronu ze schematami zawierającymi sofosbuwir może prowadzić do wystąpienia ciężkiej, objawowej bradykardii. Jeśli nie można uniknąć jednoczesnego stosowania amiodaronu ze schematami zawierającymi sofosbuwir, po ich podaniu zaleca się monitorowanie pracy serca pacjenta (patrz punkt 4.4).
Leki mogące wywołać hipokaliemię
Nie zaleca się jednoczesnego stosowania z następującymi lekami.
drażniącymi lekami przeczyszczającymi wywołującymi hipokaliemię, co zwiększa ryzyko wystąpienia zaburzeń rytmu serca typu torsade de pointes, należy stosować inne grupy leków przeczyszczających.
Należy zachować ostrożność podczas stosowania następujących leków w połączeniu z amiodaronem:
leki mogące wywołać hipokaliemię i (lub) hipomagnezemię: leki moczopędne, kortykosteroidy (gliko-, mineralo-) stosowane ogólnoustrojowo, tetrakozaktyd, amfoterycyna B podawana dożylnie.
Należy zapobiegać wystąpieniu hipokaliemii, a w przypadku jej stwierdzenia, należy uzupełnić niedobór potasu; należy monitorować odstęp QT oraz w przypadku wystąpienia zaburzeń rytmu typu typu torsade de pointes nie należy stosować leków przeciwarytmicznych (należy wdrożyć stymulację komorową, można stosować dożylne infuzje magnezu).
Znieczulenie ogólne (patrz punkty 4.4 oraz 4.8)
Obserwowano potencjalnie ciężkie powikłania u pacjentów poddawanych znieczuleniu ogólnemu: bradykardia (nie odpowiadająca na atropinę), niedociśnienie, zaburzenia przewodzenia, zmniejszenie pojemności minutowej serca.
Zgłaszano kilka bardzo rzadkich przypadków ciężkich powikłań oddechowych czasami prowadzących do zgonu, występujących zwykle bezpośrednio po zakończeniu zabiegu chirurgicznego (zespół ostrej niewydolności oddechowej dorosłych). Może być to związane z interakcją z tlenem podawanym w dużym stężeniu. Przed zabiegiem chirurgicznym należy poinformować anestezjologa o stosowaniu amiodaronu.
Wpływ Cordarone na inne produkty lecznicze
Amiodaron i (lub) jego metabolit, deetyloamiodaron hamują CYP1A1, CYP1A2, CYP3A4, CYP2C9, CYP2D6 i glikoproteinę P i mogą zwiększać ekspozycję na ich substraty.
Z powodu długiego okresu półtrwania amiodaronu, interakcje mogą być obserwowane nawet po kilku miesiącach od zakończenia leczenia amiodaronem.
Substraty glikoproteiny P
Amiodaron jest inhibitorem glikoproteiny P. Przypuszcza się, że jednoczesne stosowanie amiodaronu z substratami glikoproteiny P wiąże się ze zwiększeniem narażenia organizmu na te substraty.
Glikozydy naparstnicy:
Stosowanie amiodaronu u pacjentów leczonych długotrwale digoksyną może spowodować zwiększenie stężenia digoksyny we krwi i wywołać objawy jej przedawkowania - zaburzenia czynności węzła zatokowego, zaburzenia automatyzmu (nadmierna bradykardia) oraz zwolnienie przewodzenia przedsionkowo-komorowego (działanie synergiczne): dodatkowo możliwy jest wzrost stężenia digoksyny w osoczu ze względu na zmniejszenie klirensu digoksyny.
Należy monitorować EKG oraz stężenie digoksyny w osoczu. Pacjenta należy obserwować pod kątem klinicznych objawów toksyczności glikozydów naparstnicy. Może być konieczne dostosowanie dawki glikozydów naparstnicy.
Dabigatran
Należy zachować ostrożność podczas jednoczesnego stosowania amiodaronu z dabigatranem
ze względu na ryzyko krwawienia. Może być konieczne dostosowanie dawki dabigatranu zgodnie z jego wskazaniami.
Substraty CYP2C9
Amiodaron zwiększa stężenie substratów izoenzymu CYP2C9 w osoczu, takich jak warfaryna lub fenytoina, przez hamowanie izoenzymu 2C9 cytochromu P450.
Warfaryna
Skojarzenie warfaryny i amiodaronu może nasilać działanie doustnego leku przeciwzakrzepowego, stąd ryzyko krwawienia. Konieczne jest ścisłe monitorowanie czasu protrombinowego (międzynarodowy współczynnik znormalizowany - INR), aby dostosować doustne dawki leków przeciwzakrzepowych, zarówno podczas leczenia amiodaronem, jak i po zakończeniu leczenia amiodaronem.
Fenytoina
Skojarzenie fenytoiny i amiodaronu może prowadzić do przedawkowania fenytoiny, wywołując objawy neurologiczne. Należy prowadzić ścisłe monitorowanie stanu klinicznego pacjenta i natychmiast po wystąpieniu pierwszych objawów przedawkowania zmniejszyć dawkę fenytoiny oraz oznaczyć stężenie fenytoiny w osoczu.
Substraty CYP2D6
Flekainid
Jednoczesne stosowanie amiodaronu i flekainidu powoduje zwiększenie stężenia flekainidu w osoczu na skutek hamowania izoenzymu 2D6 cytochromu P450. Dlatego należy dostosować dawkowanie flekainidu.
Substraty CYP3A4
Jednoczesne stosowanie leków metabolizowanych przez cytochrom CYP3A4 i amiodaronu, inhibitora CYP3A4, może powodować zwiększenie stężenia tych leków w osoczu
i wystąpienie ich toksyczności.
Cyklosporyna
Jednoczesne stosowanie z amiodaronem może powodować zwiększenie stężenia cyklosporyny w osoczu. Należy dostosować dawkę cyklosporyny.
Fentanyl
Jednoczesne stosowanie z amiodaronem może nasilać działanie fentanylu i zwiększać ryzyko jego toksycznego działania.
Statyny
Podczas jednoczesnego stosowaniu amiodaronu ze statynami metabolizowanymi przez CYP3A4, takimi jak symwastatyna, atorwastatyna i lowastatyna występuje zwiększone ryzyko toksycznego wpływu na układ mięśniowy (np. rabdomioliza). Zaleca się stosowanie statyn nie metabolizowanych przez CYP3A4 podczas leczenia amiodaronem.
Inne leki metabolizowane przez CYP3A4:
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
dawka nasycająca: 5 mg/kg m.c. podana w czasie od 20 minut do 2 godzin,
dawka podtrzymująca: 10 do 15 mg/kg m.c./dobę podana w infuzji ciągłej trwającej od kilku godzin do kilku dni.
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu lecznicznego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJACY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CORDARONE; 50 mg/ml, roztwór do wstrzykiwań
Jeden ml roztworu do wstrzykiwań zawiera 50 mg amiodaronu chlorowodorku (Amiodaroni hydrochloridum).
Jedna ampułka (3 ml) zawiera 150 mg amiodaronu chlorowodorku.
Substancja pomocnicza o znanym działaniu: alkohol benzylowy. Jedna ampułka (3 ml) zawiera 60 mg alkoholu benzylowego (patrz punkt 4.4).
Pełny wykaz substancji pomocniczych patrz punkt 6.1.
Roztwór do wstrzykiwań
Amiodaron podaje się dożylnie w sytuacjach, gdy konieczne jest uzyskanie szybkiego działania leku lub gdy podawanie doustne leku nie jest możliwe.
Leczenie groźnych dla życia zaburzeń rytmu serca:
Cordarone, roztwór do wstrzykiwań należy stosować wyłącznie w ośrodkach intensywnej opieki dysponujących możliwością monitorowania kardiologicznego, defibrylacji i stymulacji serca. Lek należy stosować w infuzji dożylnej. W przypadku infuzji ciągłej lub powtarzanej amiodaron należy podawać przez centralny dostęp żylny, aby uniknąć niepożądanych reakcji w miejscu podania (patrz punkt 4.8).
Ze względu na ryzyko wystąpienia ciężkiego niedociśnienia tętniczego i zapaści krążeniowej amiodaron we wstrzyknięciu dożylnym można podawać tylko w nagłych sytuacjach, gdy inne leki są nieskuteczne, wyłącznie na oddziale intensywnej terapii, prowadząc ciągłe monitorowanie elektrokardiograficzne. Stosowana dawka wynosi około 5 mg/kg masy ciała. Za wyjątkiem przypadków resuscytacji krążeniowo-oddechowej pacjentów z migotaniem komór, gdy defibrylacja nie jest skuteczna, wstrzyknięcie dawki amiodaronu powinno trwać minimum 3 minuty.
Produkt leczniczy Cordarone, roztwór do wstrzykiwań, wykazuje niezgodność z fizjologicznym roztworem chlorku sodu i może być stosowany wyłącznie z 5% roztworem glukozy. Roztwór amiodaronu o stężeniu mniejszym niż 300 mg (2 ampułki) w 500 ml 5% roztworu glukozy nie jest stabilny i nie należy go stosować.
Infuzja dożylna
Dawka nasycająca: zwykle dawka nasycająca wynosi 5 mg/kg mc. podana w 250 ml 5% roztworu glukozy w infuzji trwającej od 20 minut do 2 godzin. Infuzję można powtarzać 2 do 3 razy na dobę. Szybkość infuzji należy ustalić w oparciu o uzyskany efekt działania leku.
Efekt terapeutyczny pojawia się w ciągu kilku pierwszych minut i następnie stopniowo słabnie, dlatego w celu jego przedłużenia należy kontynuować podawanie leku w infuzji.
Dawka podtrzymująca: 10-20 mg/kg mc./dobę (zazwyczaj 600 do 800 mg/24 godziny
do dawki 1200 mg/24 godziny) w infuzji w 250 ml 5% roztworu glukozy przez kilka dni. W każdym przypadku należy dążyć do podawania minimalnej skutecznej dawki.
Przejście z podawania dożylnego na doustne: gdy tylko zostanie uzyskany pożądany efekt terapeutyczny należy rozpocząć jednoczesne podawanie doustne amiodaronu w zwykłej dawce nasycającej (3 x 200 mg na dobę). Dawkę podawaną dożylnie należy zmniejszać stopniowo.
Dawkowanie w nagłych sytuacjach: stosuje się 150-300 mg amiodaronu w 10-20 ml 5% roztworu glukozy w powolnym, trwającym co najmniej 3 minuty wstrzyknięciu.
Następne wstrzyknięcie można powtórzyć nie wcześniej niż po 15 minutach, nawet jeżeli w pierwszym wstrzyknięciu podano tylko roztwór z jednej ampułki (150 mg) ze względu na ryzyko wystąpienia zapaści krążeniowej. Jeżeli konieczne jest podanie następnych dawek amiodaronu, należy je podawać w infuzji dożylnej.
Resuscytacja krążeniowo-oddechowa
W szczególnym przypadku resuscytacji krążeniowo-oddechowej pacjenta z migotaniem komór opornym na defibrylację, pierwszą dawkę 300 mg (lub 5 mg/kg) amiodaronu, rozcieńczając odpowiednią objętość roztworu produktu Cordarone w 20 ml 5% roztworu glukozy, podaje się w formie bolusu dożylnego. W przypadku utrzymywania się migotania komór można rozważyć podanie dodatkowej dożylnej dawki amiodaronu w wysokości 150 mg (lub 2,5 mg/kg).
Nie należy mieszać innych leków z amiodaronem w tej samej strzykawce. Nie należy wstrzykiwać innych leków w ten sam dostęp żylny.
Stosowanie u pacjentów w podeszłym wieku
Nie ma szczegółowych danych dotyczących dawkowania u osób w podeszłym wieku.
Jednak u pacjentów w podeszłym wieku należy zachować szczególne środki ostrożności ze względu na możliwość wystąpienia ciężkiej bradykardii lub zaburzeń przewodzenia.
Dzieci i młodzież
Nie ustalono bezpieczeństwa stosowania i skuteczności amiodaronu u dzieci. Dostępne obecnie dane są opisane w punktach 5.1. i 5.2.
Ze względu na obecność alkoholu benzylowego, należy zachować ostrożność podczas podawania dożylnie amiodaronu noworodkom, niemowlętom i dzieciom w wieku do 3 lat (patrz punkt 4.4). Niezgodności farmaceutyczne – patrz punkt 6.2; sposób otwarcia ampułki – patrz pkt 6.6.
- nadwrażliwość na jod, amiodaron lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1;
- ciąża;
Powyższe przeciwwskazania nie mają zastosowania jeśli amiodaron jest stosowany na oddziale intensywnej terapii w resuscytacji krążeniowo-oddechowej nagłego zatrzymania krążenia w przebiegu migotania komór, gdy defibrylacja nie jest skuteczna.
Amiodaron może być podawany dożylnie wyłącznie na oddziale intensywnej terapii, gdzie stan kliniczny pacjenta jest stale monitorowany (zapis EKG, wartości ciśnienia tętniczego).
W przypadku gdy tylko jest to możliwe, amiodaron w postaci dożylnej powinien być podawany poprzez centralny dostęp żylny, aby uniknąć reakcji niepożądanych w miejscu podania (patrz punkt 4.8).
Należy zwrócić uwagę na wszelkie objawy niedociśnienia, ciężkiej niewydolności oddechowej, niewyrównanej lub ciężkiej niewydolności serca.
Szczegółowe informacje dotyczące wstrzyknięć dożylnych
Ze względu na ryzyko zaburzeń hemodynamicznych (ciężkie niedociśnienie, zapaść krążeniowa) wstrzyknięcie dożylne nie jest zalecane rutynowo. W sytuacjach gdy tylko jest to możliwe preferowana jest infuzja dożylna.
Amiodaron może być podawany we wstrzyknięciu dożylnym tylko w nagłych sytuacjach, gdy inne leki są nieskuteczne, wyłącznie na oddziale intensywnej terapii, gdzie pacjent jest ciągle monitorowany (zapis EKG, wartości ciśnienia tętniczego).
Dawka wynosi około 5 mg/kg masy ciała. Amiodaron powinien być podawany
we wstrzyknięciu dożylnym trwającym co najmniej 3 minuty z wyjątkiem przypadków resuscytacji krążeniowo-oddechowej związanej z migotaniem komór, gdy defibrylacja nie jest skuteczna. Następne wstrzyknięcie można powtórzyć nie wcześniej niż po 15 minutach, nawet jeżeli w pierwszym wstrzyknięciu podano tylko roztwór z jednej ampułki (150 mg) ze względu na ryzyko wystąpienia nieodwracalnej zapaści krążeniowej.
Jeżeli konieczne jest podanie następnych dawek amiodaronu, należy je podawać w formie infuzji dożylnej. Nie należy mieszać innych leków z amiodaronem w tej samej strzykawce. Nie należy wstrzykiwać innych leków w ten sam dostęp żylny.
Zaburzenia czynności serca (patrz punkt 4.8)
Działanie farmakologiczne amiodaronu powoduje zmiany w badaniu EKG: wydłużenie odstępu QT (związane z wydłużeniem okresu repolaryzacji) z możliwym powstaniem fali U. Jednak te zmiany nie świadczą o zatruciu amiodaronem.
Donoszono o wystąpieniu nowego typu zaburzeń rytmu serca lub pogorszeniu leczonych zaburzeń rytmu serca, czasami prowadzących do zgonu. Ważne jest, ale trudne do rozróżnienia czy wynika to z braku skuteczności leku, który wykazuje działanie proarytmiczne, czy jest to związane z nasileniem zaburzeń rytmu serca. Rzadziej donoszono o działaniu proarytmicznym amiodaronu niż innych leków przeciwarytmicznych. Działanie proarytmiczne amiodaronu występuje zwłaszcza jako rezultat interakcji z lekami wydłużającymi odstęp QT i (lub) w przypadku zaburzeń elektrolitowych (patrz punkty 4.5 i 4.8). Niezależnie od wydłużenia odstępu QT, amiodaron wykazuje niską aktywność wywoływania zaburzeń rytmu serca typu torsade de pointes.
Ciężka bradykardia i blok serca
Podczas stosowania schematów zawierających sofosbuwir jednocześnie z amiodaronem zaobserwowano zagrażające życiu przypadki bradykardii i bloku serca.
Bradykardia występowała zwykle w ciągu kilku godzin do dni, ale obserwowano także przypadki, w których ten czas był dłuższy, najczęściej do 2 tygodni od rozpoczęcia leczenia HCV.
Pacjentom przyjmującym schemat zawierający sofosbuwir należy podawać amiodaron wyłącznie wtedy, gdy stosowanie innych alternatywnych leków przeciwarytmicznych jest przeciwwskazane lub nie są one tolerowane.
Jeśli jednoczesne stosowanie amiodaronu jest konieczne, zaleca się monitorowanie czynności serca u pacjentów w warunkach szpitalnych przez pierwsze 48 godzin od rozpoczęcia jednoczesnego podawania; a następnie częstość pracy serca powinna być monitorowana w warunkach ambulatoryjnych lub samodzielnie przez pacjenta, codziennie przez co najmniej pierwsze 2 tygodnie leczenia.
Ze względu na długi okres półtrwania amiodaronu należy również monitorować czynność serca w sposób opisany powyżej u pacjentów, którzy przerwali stosowanie amiodaronu w ciągu ostatnich kilku miesięcy i mają rozpocząć przyjmowanie schematu zawierającego sofosbuwir.
Należy powiadomić wszystkich pacjentów przyjmujących amiodaron w skojarzeniu ze schematem zawierającym sofosbuwir o ryzyku wystąpienia objawów bradykardii i bloku serca oraz o konieczności niezwłocznego zwrócenia się o pomoc lekarską w przypadku ich wystąpienia.
Zaburzenia układu oddechowego (patrz punkt 4.8)
Wystąpienie duszności oraz nieproduktywnego kaszlu może być związane z toksycznym działaniem na płuca, takim jak wystąpienie śródmiąższowego zapalenia płuc. Bardzo rzadko zgłaszano przypadki śródmiąższowego zapalenia płuc po zastosowaniu amiodaronu w postaci dożylnej. W przypadku podejrzenia takiego rozpoznania u pacjenta, u którego wystąpiła duszność wysiłkowa zarówno jako jedyny objaw, jak i związana z pogorszeniem ogólnego stanu pacjenta (zmęczenie, utrata masy ciała, gorączka), należy wykonać badanie radiologiczne klatki piersiowej. W takim przypadku należy ponownie ocenić zasadność dalszego leczenia amiodaronem, ponieważ śródmiąższowe zapalenie płuc jest zazwyczaj odwracalne po wczesnym odstawieniu amiodaronu (objawy kliniczne ustępują zazwyczaj po upływie 3 do 4 tygodni, z następową stopniową poprawą wyników badań radiologicznych oraz badań czynnościowych płuc, w okresie kilku miesięcy). Należy rozważyć także wprowadzenie leczenia z zastosowaniem kortykosteroidów.
Zgłaszano kilka bardzo rzadkich przypadków ciężkich powikłań oddechowych, czasami prowadzących do zgonu, występujących zwykle bezpośrednio po zabiegu chirurgicznym (zespół ostrej niewydolności oddechowej dorosłych). Może być to związane z interakcją tlenu podawanego w dużym stężeniu (patrz poniżej i punkty 4.5 oraz 4.8).
Znieczulenie (patrz punkty 4.5 i 4.8)
Przed zabiegiem chirurgicznym należy poinformować anestezjologa o stosowaniu przez pacjenta amiodaronu.
Zaburzenia czynności wątroby (patrz punkt 4.8)
Zaleca się regularne, ścisłe monitorowanie czynności wątroby (oznaczenie aktywności aminotransferaz) podczas leczenia amiodaronem począwszy od momentu rozpoczęcia leczenia. Dawkowanie amiodaronu należy zmniejszyć lub zakończyć leczenie w przypadku zwiększenia aktywności aminotransferaz 3-krotnie powyżej górnej granicy normy, co może świadczyć o wystąpieniu ostrych, ciężkich zaburzeń czynności wątroby (w tym ciężkiej niewydolności komórek wątrobowych lub niewydolności wątroby, czasami prowadzących do zgonu) lub przewlekłych zaburzeń czynności wątroby. Mogą one wystąpić podczas stosowania zarówno w postaci doustnej produktu, jak i dożylnej oraz w ciągu 24 godzin od dożylnego podania amiodaronu . Kliniczne i biologiczne objawy przewlekłych zaburzeń czynności wątroby mogą być o niewielkim nasileniu (możliwe powiększenie wątroby, zwiększenie aktywności aminotransferaz 1,5 do 5 razy powyżej górnej granicy normy). Te nieprawidłowości zwykle ustępują po odstawieniu leczenia amiodaronem. Zgłaszano jednak przypadki zakończone zgonem.
Ciężkie reakcje skórne
Należy natychmiast przerwać leczenie amiodaronem, jeśli podczas jego stosowania pojawią się reakcje skórne mogące wskazywać na wystąpienie zespołu Stevensa-Johnsona (ang. SJS- Stevens- Johnson syndrome) (postępująca wysypka z pęcherzami lub zmiany na błonach śluzowych, gorączka i bóle stawowe) lub toksycznego martwiczego oddzielania się naskórka (ang. TEN- Toxic Epidermal Necrolysis) (ciężka gwałtownie przebiegająca choroba objawiająca się pękającymi olbrzymimi
pęcherzami podnaskórkowymi, rozległymi nadżerkami na skórze, spełzaniem dużych płatów naskórka oraz gorączką) pęcherzowe zapalenie skóry i reakcja polekowa z eozynofilią i objawami uogólnionymi (DRESS). Objawy te mogą zagrażać życiu pacjenta, a nawet prowadzić do zgonu.
Zaburzenia oka (patrz punkt 4.8)
W przypadku wystąpienia niewyraźnego widzenia lub pogorszenia widzenia należy niezwłocznie przeprowadzić kompletne badanie okulistyczne, w tym badanie dna oka oftalmoskopem. Stwierdzenie neuropatii nerwu wzrokowego i (lub) zapalenia nerwu wzrokowego wymaga odstawienia leczenia amiodaronem ze względu na możliwość progresji do utraty wzroku.
Oddziaływanie z innymi lekami (patrz punkt 4.5)
Nie jest zalecane jednoczesne stosowanie amiodaronu z następującymi lekami: leki beta- adrenolityczne, antagoniści kanałów wapniowych zwalniający rytm serca (werapamil, diltiazem), drażniące leki przeczyszczające, które mogą powodować hipokaliemię.
Dzieci i młodzież
Nie ustalono bezpieczeństwa stosowania i skuteczności amiodaronu u dzieci. Dostępne obecnie dane są opisane w punktach 5.1 i 5.2.
Produkt Cordarone w postaci roztworu do wstrzykiwań zawiera alkohol benzylowy w stężeniu 20 mg/ml (patrz punkt 6.1). Alkohol benzylowy u noworodków, niemowląt i dzieci w wieku do 3 lat może powodować reakcje toksyczne i alergiczne. Po podaniu dożylnym roztworów zawierających ten konserwant donoszono o występowaniu „zespołu śmiertelnych zaburzeń oddechowych” (ang.
„gasping syndrome”), ze skutkiem śmiertelnym u noworodków (dzieci przed ukończeniem pierwszego miesiąca życia). Objawy obejmują nagłe wystąpienie „zespołu śmiertelnych zaburzeń oddechowych” (ang. „gasping syndrome”), niedociśnienia tętniczego, bradykardii i zapaści sercowo-krążeniowej.
Więcej specjalnych ostrzeżeń dotyczących długotrwałego stosowania amiodaronu dostępnych jest w Charakterystyce Produktu Leczniczego Cordarone, tabletki, 200 mg.
Przeszczep serca
W badaniach retrospektywnych stosowanie amiodaronu przed przeszczepem serca u biorcy przeszczepu, wykazało zwiększone ryzyko wystąpienia pierwotnej dysfunkcji przeszczepu (PGD, ang. Primary Graft Dysfunction).
Pierwotna dysfunkcja przeszczepu (PGD) jest zagrażającym życiu powikłaniem przeszczepu serca, które charakteryzuje się zaburzeniami lewej komory, prawej komory lub zaburzeniami
dwukomorowymi i występuje w ciągu pierwszych 24 godzin po przeszczepie, dla której nie ma możliwej do zidentyfikowania wtórnej przyczyny (patrz punkt 4.8). Ciężka postać PGD może być nieodwracalna.
U pacjentów znajdujących się na liście oczekujących na przeszczep serca należy jak najwcześniej przed przeszczepem rozważyć zastosowanie alternatywnego leku przeciwarytmicznego.
Alkohol benzylowy
Produkt leczniczy Cordarone zawiera 60 mg alkoholu benzylowego w jednej ampułce (3 ml) co odpowiada 20 mg/ml.
Alkohol benzylowy może powodować reakcje alergiczne.
Dożylne podawanie alkoholu benzylowego noworodkom wiąże się z ryzykiem ciężkich działań niepożądanych i śmierci (tzw. ”gasping syndrome”). Minimalna ilość alkoholu benzylowego, przy której mogą wystąpić objawy toksyczności jest nieznana, a u małych dzieci istnieje zwiększone ryzyko z powodu kumulacji.
Duże objętości alkoholu benzylowego należy podawać z ostrożnością i tylko w razie konieczności, zwłaszcza u pacjentów z zaburzeniami czynności nerek lub wątroby z powodu ryzyka kumulacji i toksyczności (kwasica metaboliczna).
Wpływ na ciążę i karmienie piersią, patrz punkt 4.6.
lidokaina, syrolimus, takrolimus, syldenafil, midazolam, triazolam, dihydroergotamina, ergotamina, kolchicyna.
Wpływ innych produktów leczniczych na Cordarone
Inhibitory CYP3A4 oraz CYP2C8 mogą potencjalnie hamować metabolizm amiodaronu i zwiększać ekspozycję na niego.
Zaleca się unikanie inhibitorów CYP3A4 (np. soku z grejpfruta oraz pewnych leków) podczas leczenia amiodaronem.
Ciąża
Ze względu na wpływ amiodaronu na tarczycę płodu, stosowanie leku w okresie ciąży jest przeciwwskazane.
Karmienie piersią
Amiodaron przenika do mleka kobiecego w znaczących ilościach, dlatego stosowanie leku w okresie karmienia piersią jest przeciwwskazane.
Kobiety w ciąży lub karmiące piersią powinny skontaktować się z lekarzem lub farmaceutą przed zastosowaniem leku, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną).
Płodność:
Brak danych dotyczących wpływu amiodaronu na płodność u ludzi.
Na podstawie danych dotyczących bezpieczeństwa stosowania amiodaronu lek nie powoduje ograniczenia zdolności prowadzenia pojazdów i obsługiwania maszyn.
Następujące działania niepożądane są wymienione na podstawie klasyfikacji układów i narządów i przy użyciu następującej konwencji: bardzo często ≥1/10, często ≥1/100 do <1/10, niezbyt często
≥1/1 000 do <1/100, rzadko ≥1/10 000 do <1/1 000, bardzo rzadko <1/10 000, nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia krwi i układu chłonnego:
Częstość nieznana:
neutropenia, agranulocytoza
Zaburzenia serca:
Często:
bradykardia, zazwyczaj umiarkowana
Bardzo rzadko:
znaczna bradykardia, zatrzymanie czynności węzła zatokowego wymagające zakończenia leczenia amiodaronem, zwłaszcza u pacjentów z zaburzeniem czynności węzła zatokowego i (lub) u pacjentów w podeszłym wieku, wystąpienie nowego typu zaburzeń rytmu serca lub pogorszenie istniejących zaburzeń rytmu serca, czasami z zatrzymaniem akcji serca (patrz punkty 4.4 i 4.5)
Częstość nieznana:
torsade de pointes (patrz punkt 4.4 oraz 4.5)
Zaburzenia żołądka i jelit:
Bardzo rzadko:
nudności
Częstość nieznana:
zapalenie trzustki lub ostre zapalenie trzustki
Zaburzenia ogólne i stany w miejscu podania:
Często:
reakcje niepożądane w miejscu podania leku, takie, jak: ból, rumień, obrzęk, martwica, wynaczynienie krwi, naciek, stan zapalny, stwardnienie, zakrzepowe zapalenie żył, zapalenie żył, zapalenie tkanki łącznej, zakażenie, zmiany zabarwienia skóry
Zaburzenia wątroby i dróg żółciowych (patrz punkt 4.4):
Bardzo rzadko:
izolowane zwiększenie aktywności aminotransaferaz w surowicy, które jest zwykle umiarkowanie nasilone (1,5 do 3 razy powyżej górnej granicy normy), występujące na początku leczenia.
Te nieprawidłowości mogą powrócić do wartości prawidłowych po zmniejszeniu dawki leku lub samoistnie;
ostre zaburzenia czynności wątroby z dużą aktywnością aminotransferaz w surowicy i (lub) żółtaczką, w tym niewydolność wątroby, czasami ze skutkiem śmiertelnym (patrz punkt 4.4).
Zaburzenia układu immunologicznego:
Bardzo rzadko:
wstrząs anafilaktyczny
Częstość nieznana:
obrzęk naczynioruchowy (obrzęk Quinckego).
Zaburzenia endokrynologiczne (patrz punkt 4.4):
Bardzo rzadko:
zespół nieadekwatnego wydzielania hormonu antydiuretycznego (ang. Syndrome of inappropriate antidiuretic hormone secretion, SIADH)
Częstość nieznana:
nadczynność tarczycy
Zaburzenia układu nerwowego:
Bardzo rzadko:
nieznaczne nadciśnienie wewnątrzczaszkowe (rzekomy guz mózgu), bóle głowy
Zaburzenia układu mięśniowo-szkieletowego
Częstość nieznana:
bóle odcinka lędźwiowo-krzyżowego kręgosłupa
Zaburzenia oddechowe, klatki piersiowej i śródpiersia:
Bardzo rzadko:
śródmiąższowe zapalenie płuc lub zwłóknienie płuc czasami prowadzące do zgonu (patrz punkt 4.4), ciężkie powikłania oddechowe (zespół ostrej niewydolności oddechowej dorosłych), czasami
z zejściem śmiertelnym (patrz punkt 4.4 i 4.5),
skurcz oskrzeli i (lub) bezdech w przypadku ciężkiej niewydolności oddechowej i zwłaszcza u pacjentów z astmą oskrzelową
Zaburzenia skóry i tkanki podskórnej:
Często:
wyprysk
Bardzo rzadko:
pocenie się
Częstość nieznana:
pokrzywka, ciężkie reakcje skórne, jak toksyczne martwicze oddzielanie się naskórka (TEN)
lub zespół Stevensa-Johnsona (SJS), pęcherzowe zapalenie skóry i reakcja polekowa z eozynofilią i objawami uogólnionymi (DRESS)
Zaburzenia naczyń:
Często:
obniżenie ciśnienia tętniczego krwi, zwykle umiarkowane i przemijające; donoszono o przypadkach ciężkiego niedociśnienia tętniczego lub zapaści krążeniowej w następstwie przedawkowania leku lub zbyt szybkiego podania
Bardzo rzadko:
nagłe zaczerwienienie twarzy
Zaburzenia oka:
Częstość nieznana:
neuropatia i (lub) zapalenie nerwu wzrokowego, które może prowadzić do utraty wzroku (patrz punkt 4.4)
Zaburzenia psychiczne:
Często:
zmniejszone libido
Częstość nieznana:
majaczenie (w tym splątanie), omamy
Zaburzenia układu rozrodczego i piersi:
Częstość nieznana:
zmniejszenie libido
Urazy, zatrucia i powikłania po zabiegach
Częstość nieznana:
pierwotna dysfunkcja przeszczepu po przeszczepie serca (patrz punkt 4.4)
Szczegółowe informacje dotyczące działań niepożądanych w przypadku przedawkowania amiodaronu podawanego doustnie zawarte są w Charakterystyce Produktu Leczniczego amiodaronu w tabletkach 200 mg (Cordarone, tabletki 200 mg).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa,
tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce.
Nie ma dostępnych danych dotyczących przedawkowania amiodaronu podawanego drogą dożylną. Istnieje niewiele doniesień dotyczących przedawkowania amiodaronu podawanego drogą doustną.
Może wystąpić bradykardia zatokowa, blok przedsionkowo – komorowy, częstoskurcz komorowy, zaburzenia rytmu serca typu torsade de pointes, niewydolność krążenia, a także obniżenie ciśnienia i uszkodzenie wątroby.
Zarówno amiodaron jak i jego metabolity nie są usuwane podczas dializy. Przedawkowanie leku wymaga fachowej pomocy lekarskiej; leczenie jest objawowe.
Grupa farmakoterapeutyczna: leki przeciwarytmiczne, preparaty należące do klasy III kod ATC; C 01 BD 01
Właściwości przeciwarytmiczne:
Wydłużenie fazy 3 potencjału czynnościowego komórek mięśnia sercowego powodujące zwolnienie przepływu jonów potasu (vaugham Williams klasa III).
Zwolnienie czynności serca na skutek obniżenia automatyzmu węzła zatokowego, działanie to nie jest znoszone przez atropinę.
Działanie antyadrenergiczne na receptory alfa i beta.
Zwolnienie przewodzenia na poziomie węzła zatokowo-przedsionkowego, przedsionków i węzła przedsionkowo-komorowego - im szybszy rytm serca tym działanie bardziej nasilone; brak wpływu na przewodzenie śródkomorowe.
Wydłużenie okresu refrakcji i zmniejszenie pobudliwości komórek mięśnia sercowego na poziomie przedsionków, węzła przedsionkowo-komorowego i komór.
Zwolnienie przewodzenia i wydłużenie okresu refrakcji w dodatkowych szlakach przedsionkowo- komorowych.
Brak ujemnego działania inotropowego.
Nie przeprowadzono kontrolowanych badań u dzieci.
W opublikowanych badaniach, bezpieczeństwo stosowania amiodaronu oceniono u 1118 dzieci z różnymi zaburzeniami rytmu serca.
Następujące dawki leku zostały zastosowane w klinicznych badaniach pediatrycznych:
Podanie dożylne:
W razie konieczności, można rozpocząć jednoczesne leczenie amiodaronem podawanym doustnie.
Stosowanie amiodaronu w resuscytacji krążeniowo-oddechowej.
Bezpieczeństwo i skuteczność stosowania amiodaronu w formie dożylnej u pacjentów z zatrzymaniem krążenia w warunkach pozaszpitalnych w mechanizmie migotania komór, gdy defibrylacja nie jest skuteczna, oceniano w dwóch badaniach przeprowadzonych z zastosowaniem podwójnie ślepej próby: w badaniu ARREST (porównanie amiodaronu z placebo), oraz badaniu ALIVE (porównanie amiodaronu z lidokainą). Pierwszorzędowym punktem końcowym w obu badaniach było przeżycie do momentu przyjęcia do szpitala. W badaniu ARREST 504 pacjentów z zatrzymaniem krążenia w warunkach pozaszpitalnych w mechanizmie migotania komór lub komorowej częstoskurczu komorowego bez tętna, opornych na trzykrotną lub większą liczbę defibrylacji i adrenalinę, poddano randomizacji do zastosowania amiodaronu w dawce 300 mg, rozpuszczonego w 20 ml 5% glukozy, podanego w szybkim wstrzyknięciu do żyły obwodowej (246 pacjentów), lub placebo
(258 pacjentów). Wśród 197 chorych (39%), którzy przeżyli do momentu przyjęcia do szpitala, zastosowanie amiodaronu w istotny sposób zwiększało szansę na skuteczną resuscytację i przyjęcie do szpitala: 44% chorych w grupie, w której zastosowano amiodaron w porównaniu do 34% w grupie, w której stosowano placebo [p=0,03]. Po dokonaniu korekty względem innych niezależnych czynników rokowniczych, skorygowana wartość ilorazu szans dla przeżycia do momentu przyjęcia do szpitala wyniosła 1,6 dla amiodaronu w porównaniu z grupą placebo (95% przedział ufności, 1,1 do 2,4; p=0,02).
W grupie, w której stosowano amiodaron odnotowano częstsze występowanie niedociśnienia (59% wobec 25%, p=0,04) i bradykardii (41% wobec 25%, p=0,004) niż w grupie placebo.
W badaniu ALIVE 347 pacjentów z migotaniem komór opornym na trzykrotną defibrylację, podanie adrenaliny z następową, kolejną defibrylacją, lub z nawrotem migotania komór po początkowej, skutecznej defibrylacji, zostało poddanych randomizacji do grup, w których stosowano amiodaron (5 mg / kg szacowanej masy ciała, rozpuszczone w 30 ml 5% glukozy) z placebo odpowiadającym lidokainie, lub lidokainę (1,5 mg / kg w stężeniu 10 mg/ml) z placebo odpowiadającym amiodaronowi, zwierającym ten sam rozpuszczalnik (polisorbat 80). Spośród 347 pacjentów włączonych do badania, w przypadku podania amiodaronu uzyskano istotny wzrost szans na skuteczną resuscytację i przyjęcie do szpitala: 22,8% chorych w grupie, w której stosowano
amiodaron (41 spośród 180 pacjentów) i 12% w grupie, w której stosowano lidokainę (20 spośród 167 pacjentów) [p=0,009]. Po dokonaniu korekty względem innych czynników, mogących wpływać na prawdopodobieństwo przeżycia, skorygowana wartość ilorazu szans na przeżycie do momentu przyjęcia do szpitala u chorych otrzymujących amidaron, w porównaniu z pacjentami otrzymującymi lidokainę, wyniosła 2,49 (95% przedział ufności, 1,28 do 4,85; p=0,007). Nie stwierdzono różnic
pomiędzy grupami w zakresie odsetka pacjentów, którzy wymagali leczenia bradykardii z zastosowaniem atropiny lub leczenia presyjnego z zastosowaniem dopaminy, lub w zakresie odsetka chorych, którzy otrzymali dodatkowo lidokainę w otwartego próbie otwartej.
Amiodaron jest głównie metabolizowany przez CYP3A4, a także przez CYP2C8.
Amiodaron i jego metabolit, deetyloamiodaron, wykazuje in vitro potencjał hamowania CYP1A1,
CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4, CYP2A6, CYP2B6 oraz 2C8. Amiodaron
i deetyloamiodaron mają również potencjał hamowania niektórych transporterów takich jak glikoproteina P i organiczne transportery kationowe (OCT2) [jedno badanie wykazało 11% wzrostu poziomu kreatyniny (substratu OCT2) w surowicy].
Dane in vitro opisują interakcje amiodaronu z substratami CYP3A4, CYP2C9, CYP2D6 oraz glikoproteiny P.
Stężenie amiodaronu podawanego dożylnie bardzo szybko zmniejsza się we krwi, przy czym wysycenie tkanek jest duże. Maksymalne działanie we krwi występuje po około 15 minutach i utrzymuje się przez okres około 4 godzin.
Złożona farmakokinetyka amiodaronu nie została całkowicie wyjaśniona. Głównym metabolitem jest deetyloamiodaron. Amiodaron silnie wiąże się z białkami osocza (> 95%). Wydalany jest głównie z kałem przy nieznacznej eliminacji przez nerki. Badanie przeprowadzone zarówno na zdrowych ochotnikach, jak i osobach chorych, którym dożylnie podano amiodaron wykazało, że wyliczone objętości dystrybucji oraz całkowity klirens krwi przy wykorzystaniu modelu dwukompartmentowego były podobne w obu grupach. Eliminacja amiodaronu po dożylnym podaniu okazała się zgodna z rozkładem dwuwykładniczym z fazą dystrybucji trwającą około 4 godzin. Bardzo duża objętość dystrybucji w połączeniu ze stosunkowo niewielką pozorną objętością w kompartmencie centralnym sugeruje znaczne rozmieszczenie tkankowe. Okres półtrwania po podaniu 400 mg amiodaronu w szybkim wstrzyknięciu dożylnym (bolusie) wyniósł w przybliżeniu 11 godzin.
Nie przeprowadzono kontrolowanych badań z udziałem dzieci i młodzieży.
W nielicznie opublikowanych, dostępnych danych dotyczących stosowania amiodaronu u dzieci, nie stwierdzono różnic w porównaniu z dorosłymi.
W 2-letnim badaniu rakotwórczości u szczurów, zaobserwowano u obu płci istotny klinicznie wpływ amiodaronu na wzrost guzów pęcherzykowych tarczycy [gruczolaki i (lub) raki]. Ponieważ nie stwierdzono mutagennego działania amiodaronu, przypuszcza się, że do indukcji tego typu nowotworu dochodzi raczej w wyniku mechanizmu epigenetycznego (dziedzicznych zmian w ekspresji genów nie wynikających ze zmian w sekwencji DNA) niż działania genotoksycznego. U myszy nie zaobserwowano raka, jednak pojawił się zależny od dawki pęcherzykowy rozrost tarczycy.
Wystąpienie tych objawów w tarczycach szczurów i myszy najprawdopodobniej wiązało się z wpływem amiodaronu na syntezę i (lub) uwalnianie hormonów tarczycy. Znaczenie tych wyników w odniesieniu do ludzi jest małe.
Alkohol benzylowy Polisorbat 80
Woda do wstrzykiwań
Stosowanie materiałów medycznych z plastiku zawierających DEHP (2-dwuetyloheksyloftalan), w obecności roztworu amiodaronu do podawania dożylnego, może prowadzić do uwalniania DEHP. W celu minimalizowania ekspozycji pacjenta na DEHP zaleca się wykonanie końcowego rozcieńczenia amiodaronu przed infuzją i podawanie leku stosując zestawy niezawierające DEHP.
Produkt leczniczy Cordarone podawany dożylnie wykazuje także niezgodność z fizjologicznym roztworem chlorku sodu i może być stosowany wyłącznie z 5% roztworem glukozy. Roztwór amiodaronu o stężeniu mniejszym niż 300 mg (2 ampułki) w 500 ml roztworu glukozy 5% nie jest stabilny i nie należy go stosować.
2 lata
Przechowywać w temperaturze poniżej 250C.
6 ampułek z bezbarwnego szkła po 3 ml w tekturowym pudełku.
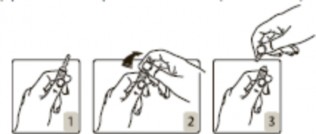
Sposób otwarcia ampułki:
Ampułkę należy przytrzymać w taki sposób, aby kolorowy punkt był skierowany w stronę osoby trzymającej (rys. 1). Górną część ampułki należy umieścić między kciukiem a palcem wskazującym (kciuk należy umieścić na kolorowym punkcie), a następnie należy nacisnąć ampułkę z tyłu (rys. 2 i 3).
Sanofi-Aventis France 82, Avenue Raspail
Gentilly, 94250 Francja
R/1636
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 30 sierpnia 1979
Data ostatniego przedłużenia pozwolenia: 13 stycznia 2014
12/2021











