Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTUCHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Zalecana dawka haloperydolu dekanonianu powinna być 10-15 razy większa od wcześniej stosowanej dawki haloperydolu w postaci doustnej.
Na podstawie tego przelicznika dla większości pacjentów dawka początkowa haloperydolu dekanonianu będzie wynosiła od 25 do 150 mg.
Zaleca się dostosowywać dawkę haloperydolu dekanonianu, zwiększając ją o 50 mg co 4 tygodnie (w zależności od indywidualnej odpowiedzi pacjenta na leczenia), aż do uzyskania optymalnego efektu terapeutycznego.
Można oczekiwać, że najbardziej skuteczna będzie dawka z zakresu od 50 do 200 mg.
Rozważając stosowanie dawki powyżej 200 mg co 4 tygodnie, zaleca się dokonać indywidualnej oceny stosunku korzyści do ryzyka.
Nie wolno przekraczać dawki maksymalnej wynoszącej 300 mg raz na 4 tygodnie, ponieważ ryzyko przewyższy kliniczne korzyści z leczenia.
Wstrzyknięcia zazwyczaj wykonuje się w odstępie 4 tygodni.
Może być konieczne dostosowanie odstępu pomiędzy dawkowaniem (w zależności od indywidualnej odpowiedzi pacjenta na leczenie).
Uzupełniające podawanie haloperydolu w postaci innej niż dekanonian można rozważyć w trakcie przestawiania na produkt Decaldol, podczas dostosowywania dawkowania lub w epizodach
Całkowita dawka haloperydolu dostarczana w obydwóch postaciach leku nie może przekraczać dawki odpowiadającej maksymalnej dawce podawanej doustnie, wynoszącej 20 mg/dobę.
Zaleca się stosowanie niskiej dawki haloperydolu dekanonianu w zakresie od 12,5 do 25 mg.
Dostosowywanie dawki haloperydolu dekanonianu zaleca się tylko wtedy, gdy jest to konieczne (w zależności od indywidualnej odpowiedzi pacjenta na leczenia), aż do uzyskania optymalnego efektu terapeutycznego.
Można oczekiwać, że najbardziej skuteczna będzie dawka w zakresie od 25 do 75 mg.
Stosowanie dawek przekraczających 75 mg raz na 4 tygodnie można rozważyć tylko u pacjentów, którzy tolerowali wyższe dawki i po przeprowadzeniu indywidualnej oceny stosunku korzyści do ryzyka.
Wstrzyknięcia zazwyczaj wykonuje się w odstępie 4 tygodni.
Może być konieczne dostosowanie odstępu pomiędzy dawkowaniem (w zależności od indywidualnej odpowiedzi pacjenta na leczenie).
Uzupełniające podawanie haloperydolu w postaci innej niż dekanonian można rozważyć w trakcie przestawiania na produkt Decaldol, podczas dostosowywania dawkowania lub w epizodach
Całkowita dawka haloperydolu dostarczana w obydwóch postaciach leku nie może przekraczać dawki odpowiadającej maksymalnej dawce podawanej doustnie, wynoszącej 5 mg/dobę, lub
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
leki przeciwarytmiczne klasy 1A (np. dyzopiramid, chinidyna),
leki przeciwarytmiczne klasy III (np. amiodaron, dofetylid, dronedaron, ibutylid, sotalol),
niektóre leki przeciwdepresyjne (np. cytalopram, escytalopram),
niektóre antybiotyki (np. azytromycyna, klarytromycyna, erytromycyna, lewofloksacyna, moksyfloksacyna, telitromycyna),
inne leki przeciwpsychotyczne (np. pochodne fenotiazyny, sertyndol, pimozyd, zyprazydon),
niektóre leki przeciwgrzybicze (np. pentamidyna),
niektóre leki przeciwmalaryczne (np. halofantryna),
niektóre leki stosowane w zaburzeniach żołądkowo-jelitowych (np. dolasetron),
niektóre produkty lecznicze stosowane w onkologii (np. toremifen, wandetanib),
inne produkty lecznicze (np. beprydyl, metadon). Powyższa lista nie jest kompletna.
Należy zachować ostrożność stosując produkt Decaldol w skojarzeniu z produktami leczniczymi,
o których wiadomo, że wpływają na równowagę elektrolitową (patrz punkt 4.4).
Produkty lecznicze mogące zwiększać stężenie haloperydolu w osoczu
Metabolizm haloperydolu przebiega kilkoma szlakami (patrz punkt 5.2). Główne szlaki metaboliczne obejmują glukuronidację i redukcję grupy ketonowej. Uczestniczy w nim również układ enzymatyczny cytochromu P450, szczególnie CYP3A4 oraz, w mniejszym stopniu, CYP2D6.
Hamowanie tych szlaków metabolizmu przez inne produkty lecznicze lub poprzez zmniejszenie
aktywności enzymów CYP2D6 może spowodować zwiększenie stężenia haloperydolu. Hamowanie CYP3A4 oraz zmniejszenie aktywności CYP2D6 może dawać efekt addytywny (patrz punkt 5.2). Na podstawie ograniczonych i niekiedy sprzecznych informacji, stężenie haloperydolu w osoczu, w przypadku jednoczesnego podawania z inhibitorem CYP3A4 i (lub) CYP2D6, może się zwiększyć od 20 do 40%, chociaż w niektórych przypadkach zgłaszano wzrost stężenia nawet o 100%.
Przykładowe produkty lecznicze, które mogą zwiększać stężenie haloperydolu w osoczu (na podstawie doświadczenia klinicznego lub mechanizmu interakcji z lekami), to:
inhibitory CYP3A4 – alprazolam, fluwoksamina, indynawir, itrakonazol, ketokonazol, nefazodon, posakonazol, sakwinawir, werapamil, worykonazol.
inhibitory CYP2D6 – bupropion, chloropromazyna, duloksetyna, paroksetyna, prometazyna, sertralina, wenlafaksyna.
inhibitory jednocześnie CYP3A4 i CYP2D6: fluoksetyna, rytonawir.
bez potwierdzonego mechanizmu – buspiron. Powyższa lista nie jest kompletna.
Podwyższone stężenie haloperydolu w osoczu może prowadzić do zwiększenia ryzyka zdarzeń niepożądanych, włącznie z wydłużeniem odstępu QTc (patrz punkt 4.4). Wydłużenie odstępu QTc obserwowano podczas jednoczesnego podawania z inhibitorami metabolicznymi - ketokonazolem (400 mg/dobę) i paroksetyną (20 mg/dobę).
Zaleca się, aby pacjentów przyjmujących haloperydol jednocześnie z tego typu produktami
leczniczymi monitorować pod kątem wystąpienia objawów przedmiotowych i podmiotowych nasilonego lub wydłużonego działania farmakologicznego haloperydolu, a w razie potrzeby zaleca się zmniejszenie dawki produktu Decaldol.
Produkty lecznicze mogące zmniejszać stężenie haloperydolu w osoczu
Jednoczesne stosowanie haloperydolu z lekami silnie indukującymi CYP3A4 może stopniowo
zmniejszać stężenie haloperydolu w osoczu do tego stopnia, że jego skuteczność zostanie obniżona. Przykładowe substancje to:
karbamazepina, fenobarbital, fenytoina, ryfampicyna, ziele dziurawca zwyczajnego (Hypericum perforatum).
Powyższa lista nie jest kompletna.
Po kilku dniach leczenia można zaobserwować indukcję enzymów. Najsilniejszą indukcję enzymów stwierdza się zwykle po około 2 tygodniach, co może następnie utrzymywać się przez taki sam okres po przerwaniu stosowania produktu leczniczego. Zaleca się, aby w trakcie skojarzonego leczenia
z induktorami CYP3A4 monitorować stan pacjentów, a w razie potrzeby zwiększyć dawkę produktu Decaldol. Po odstawieniu leku indukującego CYP3A4, stężenie haloperydolu może stopniowo
wzrastać i dlatego może być konieczne zmniejszenie dawki produktu Decaldol.
Wiadomo, że walproinian sodu hamuje glukuronidację, ale nie wpływa na stężenie haloperydolu w osoczu.
Wpływ haloperydolu na inne produkty lecznicze
Haloperydol może nasilać depresję ośrodkowego układu nerwowego (OUN), jaką wywołuje alkohol lub produkty lecznicze hamujące OUN, w tym leki nasenne, uspokajające lub silne leki
przeciwbólowe. Donoszono również o nasilonym wpływie na OUN podczas jednoczesnego stosowania z metyldopą.
Haloperydol może działać przeciwstawnie do adrenaliny i innych produktów sympatykomimetycznych (np. substancji pobudzających, takich jak pochodne amfetaminy) oraz odwracać działanie hipotensyjne produktów leczniczych blokujących receptory adrenergiczne, takich jak guanetydyna.
Haloperydol może zmniejszać działanie lewodopy i innych agonistów dopaminy.
Haloperydol jest inhibitorem CYP2D6. Hamuje metabolizm trójpierścieniowych leków przeciwdepresyjnych (np. imipraminy, dezypraminy), zwiększając tym samym ich stężenie w osoczu.
Inne rodzaje interakcji
W rzadkich przypadkach, po jednoczesnym zastosowaniu litu i haloperydolu zgłaszano wystąpienie następujących objawów: encefalopatia, zespół objawów pozapiramidowych, dyskinezy późne, złośliwy zespół neuroleptyczny, ostry zespół mózgowy oraz śpiączka. Większość z tych objawów miała charakter przemijający. Dotychczas pozostaje niejasne, czy stanowią one osobną jednostkę kliniczną.
Niemniej, zaleca się, aby u pacjentów otrzymujących jednocześnie lit i produkt Decaldol natychmiast przerwać leczenie w razie wystąpienia tego typu objawów.
Odnotowano działanie antagonistyczne haloperydolu wobec leku przeciwzakrzepowego fenindionu.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Zgłaszane w badaniach klinicznych haloperydolu dekanonianu.
Zgłaszane w badaniach klinicznych haloperydolu (w postaci innej niż dekanonian) i dotyczących substancji czynnej.
Zgłaszane po wprowadzeniu do obrotu haloperydolu dekanonianu oraz haloperydolu.
Częstość występowania działań niepożądanych ustalono w oparciu (lub oszacowano na podstawie) badań klinicznych lub badań epidemiologicznych haloperydolu dekanonianu, i opisano
z zastosowaniem następującej konwencji:
Bardzo często: ≥1/10 Często: ≥1/100 do <1/10
Niezbyt często: ≥1/1 000 do <1/100 Rzadko: ≥1/10 000 do <1/1 000 Bardzo rzadko: <1/10 000
Nieznana: częstość nie może być określona na podstawie dostępnych danych.
Działania niepożądane wymieniono zgodnie z klasyfikacją układów i narządów, w kolejności od najcięższych w obrębie danej kategorii częstości.
Tabela 3: Działania niepożądane
Klasyfikacja układów
i narządów
Działania niepożądane
Częstość występowania
Bardzo często
Często
Niezbyt często
Rzadko
Nieznana
Zaburzenia krwi i układu chłonnego
Pancytopenia Agranulocytoza Trombocytopenia Leukopenia
Neutropenia
Zaburzenia układu immunologi-
cznego
Reakcja anafilaktyczna Nadwrażliwość
Zaburzenia endokryno- logiczne
Zespół
nieprawidłowego wydzielania hormonu antydiuretyczne- go
Hiperprolakty- nemia
Zaburzenia
metabolizmu i odżywiania
Hipoglikemia
Zaburzenia psychiczne
Depresja Bezsenność
Zaburzenia psychotyczne Pobudzenie Stan splątania Utrata libido
Obniżone libido Niepokój
Zaburzenia układu nerwowego
Objawy zespołu
pozapirami- dowego
Akatyzja Parkinso- nizm Twarz maskowata Drżenie mięśni Nadmierna senność Nadmierne
uspokojenie
Bezruch Dyskinezy Dystonia Skokowa sztywność mięśniowa Wzmożone napięcie mięśniowe Ból głowy
Złośliwy zespół neuroleptyczny Dyskinezy późne Drgawki Bradykinezja Hiperkinezja Hipokinezja Zawroty głowy Mimowolne skurcze mięśni Zaburzenia funkcji motorycznej
Oczopląs
Zaburzenia oka
Napadowe przymusowe patrzenie w górę
Niewyraźne widzenie
Zaburzenia
widzenia
Zaburzenia serca
Częstoskurcz
Migotanie komór Torsade de pointes
Częstoskurcz komorowy
Skurcze dodatkowe
Zaburzenia naczyniowe
Niedociśnienie tętnicze
Niedociśnienie tętnicze ortostatyczne
Zaburzenia układu oddechowego klatki piersiowej
i śródpiersia
Obrzęk krtani Skurcz oskrzeli Skurcz krtani Duszność
Zaburzenia żołądka i jelit
Zaparcia Suchość w jamie ustnej Nadmierne wydzielanie
śliny
Wymioty Nudności
Zaburzenia wątroby
Ostra
niewydolność wątroby Zapalenie
wątroby Cholestaza Żółtaczka
Nieprawidłowe wyniki testów czynnościowych
wątroby
Zaburzenia skóry i tkanki podskórnej
Obrzęk naczynioruchowy Złuszczające się zapalenie skóry Leukocytoklasty- czne zapalenie naczyń
Nadwrażliwość na światło Pokrzywka Świąd Wysypka Nadmierne
pocenie się
Zaburzenia mięśniowo-
szkieletowe i tkanki
Sztywność mięśniowa
Rabdomioliza Kręcz szyi Szczękościsk
Skurcze mięśni
łącznej
Drżenie pęczkowe mięśni Zesztywnienie mięśniowo-
szkieletowe
Zaburzenia nerek i dróg
moczowych
Zatrzymanie moczu
Ciąża, połóg i okres
okołoporodo- wy
Zespół objawów odstawienia u noworodka (patrz
punkt 4.6)
Zaburzenia układu rozrodczego i piersi
Zaburzenia seksualne
Priapizm
Brak miesiączki Mlekotok
Bóle menstruacyjne Obfite
miesiączkowanie Zaburzenia erekcji Ginekomastia Zaburzenia
miesiączkowania Ból piersi Tkliwość piersi
Zaburzenia ogólne i stany w miejscu podania
Reakcja
w miejscu wstrzyknię- cia
Nagły zgon Obrzęk twarzy Obrzęk
Wysoka gorączka Hipotermia Zaburzenia chodu
Ropień w miejscu wstrzyknięcia
Badania diagnosty- czne
Zwiększenie masy ciała
Wydłużenie QT w EKG
Zmniejszenie
masy ciała
W trakcie stosowania haloperydolu zgłaszano przypadki wydłużenia QT w EKG, komorowych
zaburzeń rytmu (migotanie komór, częstoskurcz komorowy), torsade de pointes oraz nagłego zgonu.
Wpływ leków przeciwpsychotycznych, jako klasy terapeutycznej
Odnotowano przypadki zatrzymania akcji serca w trakcie stosowania leków przeciwpsychotycznych.
W trakcie stosowania leków przeciwpsychotycznych odnotowano przypadki żylnej choroby zakrzepowo-zatorowej, w tym przypadki zatoru tętnicy płucnej oraz zakrzepicy żył głębokich. Częstość występowania tych zaburzeń nie jest znana.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
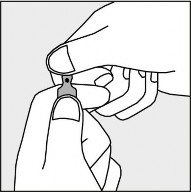
Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki.
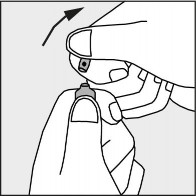
Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTUCHARAKTERYSTYKI PRODUKTU LECZNICZEGO
DECALDOL, 50 mg/ml, roztwór do wstrzykiwań
Każdy ml roztworu zawiera 50 mg haloperydolu w postaci haloperydolu dekanonianu (Haloperidoli decanoas).
Substancje pomocnicze o znanym działaniu: olej arachidowy oczyszczony, alkohol benzylowy. Każdy ml roztworu zawiera 15 mg alkoholu benzylowego.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań
Przezroczysty oleisty płyn, żółty lub brunatny, o różnej intensywności zabarwienia.
Decaldol wskazany jest w leczeniu podtrzymującym schizofrenii oraz zaburzeń schizoafektywnych u dorosłych pacjentów aktualnie skutecznie leczonych haloperydolem podawanym doustnie (patrz punkt 5.1).
Leczenie należy rozpoczynać a dawkowanie dostosowywać pod ścisłym nadzorem medycznym. Dawkowanie
Wielkość dawki zależy zarówno od nasilenia objawów jak i stosowanej aktualnie dawki haloperydolu w postaci doustnej. Pacjent musi zawsze kontynuować leczenie stosując najmniejszą skuteczną dawkę.
Początkowa dawka haloperydolu dekanonianu wywodzi się z wielokrotności dawki dobowej haloperydolu doustnego, dlatego nie można określić szczegółowych zaleceń dotyczących zmiany leczenia z innych leków przeciwpsychotycznych (patrz punkt 5.1).
Dorośli w wieku 18 lat i starsi
Tabela 1: Zalecenia dotyczące dawki haloperydolu dekanonianu u dorosłych w wieku 18 lat lub starszych
Zmiana leczenia z haloperydolu w postaci doustnej |
Kontynuacja leczenia |
Odstępy pomiędzy dawkowaniem |
Uzupełniające podawanie haloperydolu w postaci innej niż dekanonian zaostrzenia objawów psychotycznych (w zależności od indywidualnej odpowiedzi pacjenta na leczenie). |
Szczególne grupy pacjentów Osoby w podeszłym wieku
Tabela 2: Zalecenia dotyczące dawki haloperydolu dekanonianu u pacjentów w podeszłym wieku
Zmiana leczenia z haloperydolu w postaci doustnej |
Kontynuacja leczenia |
Odstępy pomiędzy dawkowaniem |
Uzupełniające podawanie haloperydolu w postaci innej niż dekanonian zaostrzenia objawów psychotycznych (w zależności od indywidualnej odpowiedzi pacjenta na leczenie). wcześniej podawanej doustnej dawki haloperydolu u pacjentów, którzy przez długi czas przyjmowali doustny haloperydol. |
Zaburzenia czynności nerek
Nie oceniano wpływu zaburzeń czynności nerek na parametry farmakokinetyczne haloperydolu. Nie ma potrzeby zmiany dawki podczas stosowania produktu u pacjentów z zaburzeniami czynności nerek, należy jednak zachować ostrożność. Pacjenci z ciężkimi zaburzeniami czynności nerek mogą
jednak wymagać zastosowania mniejszej dawki początkowej, a następnie łagodniejszego zwiększania dawkowania, w dłuższych odstępach czasu niż u pacjentów z prawidłową czynnością nerek (patrz punkt 5.2).
Zaburzenia czynności wątroby
Nie oceniano wpływu zaburzeń czynności wątroby na parametry farmakokinetyczne haloperydolu. Ponieważ haloperydol podlega intensywnemu metabolizmowi w wątrobie, zaleca się stosowanie połowy dawki początkowej, a następnie łagodniejsze zwiększanie dawkowania, w dłuższych odstępach czasu, niż u pacjentów z prawidłową czynnością wątroby (patrz punkt 4.4 i 5.2).
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Decaldol u dzieci i młodzieży w wieku poniżej 18 lat. Brak dostępnych danych.
Sposób podawania
Produkt leczniczy Decaldol jest przeznaczony wyłącznie do stosowania domięśniowego i nie wolno go podawać dożylnie. Podawany jest jako głębokie wstrzyknięcie domięśniowe w okolicy pośladkowej. Zaleca się podawanie produktu na zmianę w obydwa mięśnie pośladkowe. Nie zaleca się wstrzykiwania roztworu o większej objętości niż 3 ml, ponieważ może to wywołać dyskomfort
u pacjenta. Instrukcja dotycząca przygotowania produktu Decaldol, patrz punkt 6.6.
Nadwrażliwość na substancję czynną lub na olej arachidowy, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Stan śpiączki.
Depresja ośrodkowego układu nerwowego (OUN). Choroba Parkinsona.
Otępienie z ciałami Lewy’go. Postępujące porażenie nadjądrowe.
Stwierdzone wydłużenie odstępu QTc lub wrodzony zespół wydłużonego QT. Niedawno przebyty ostry zawał mięśnia sercowego.
Niewyrównana niewydolność serca.
Zaburzenia rytmu komorowego lub torsade de pointes w wywiadzie. Niewyrównana hipokaliemia.
Stosowanie produktów leczniczych wydłużających odstęp QT (patrz punkt 4.5).
Zwiększona śmiertelność wśród osób w podeszłym wieku z otępieniem
Odnotowano rzadkie przypadki nagłych zgonów pacjentów z zaburzeniami psychicznymi, którzy otrzymywali leki przeciwpsychotyczne, w tym haloperydol (patrz punkt 4.8).
Pacjenci w podeszłym wieku z psychozą związaną z otępieniem, otrzymujący leki przeciwpsychotyczne są narażeni na zwiększone ryzyko zgonu. Analizy siedemnastu badań kontrolowanych placebo (średni czas trwania 10 tygodni), głównie z udziałem pacjentów przyjmujących atypowe leki przeciwpsychotyczne, wykazały, że ryzyko zgonu u pacjentów otrzymujących lek było 1,6 do 1,7 razy większe niż ryzyko zgonu u pacjentów otrzymujących
placebo. Podczas typowego 10 tygodniowego badania z grupą kontrolną, odsetek zgonów u pacjentów otrzymujących leki przeciwpsychotyczne wynosił 4,5%, w porównaniu do około 2,6% w grupie
placebo. Chociaż przyczyny zgonu były różne, większość wiązała się albo z zaburzeniami sercowo- naczyniowymi (np. niewydolność serca, nagły zgon), albo z zakażeniami (np. zapalenie płuc).
Badania obserwacyjne wskazują, że leczeniu haloperydolem pacjentów w podeszłym wieku towarzyszy zwiększona umieralność. Ten związek może być silniejszy dla haloperydolu, niż dla atypowych leków przeciwpsychotycznych, jest bardziej zauważalny w pierwszych 30 dniach od rozpoczęcia leczenia i utrzymuje się przez co najmniej 6 miesięcy. Nie ustalono jeszcze, w jakim zakresie zwiększenie umieralności w badaniach obserwacyjnych można przypisać lekowi
przeciwpsychotycznemu, a w jakim niektórym indywidualnym cechom pacjenta.
Decaldol nie jest wskazany w leczeniu zaburzeń behawioralnych w przebiegu otępienia. Wpływ na układ sercowo-naczyniowy
Donoszono o przypadkach wydłużenia odstępu QTc i (lub) komorowych zaburzeń rytmu,
towarzyszących rzadkim przypadkom nagłych zgonów po haloperydolu (patrz punkty 4.3 i 4.8). Ryzyko takich zdarzeń zwiększa się po zastosowaniu dużych dawek, przy dużym stężeniu w osoczu oraz u predysponowanych pacjentów, lub po podaniu pozajelitowym, a zwłaszcza dożylnym.
Nie wolno podawać produktu Decaldol dożylnie.
Należy zachować ostrożność u pacjentów z rzadkoskurczem, chorobą serca, wydłużeniem odstępu QTc w wywiadzie rodzinnym lub nadużywających kiedykolwiek w przeszłości lub aktualnie alkoholu. Należy również zachować ostrożność u pacjentów, u których stężenia haloperydolu w osoczu mogą osiągać wysokie wartości (patrz punkt 4.4 Osoby wolno metabolizujące przy udziale CYP2D6).
Przed rozpoczęciem leczenia zaleca się przeprowadzenie badania EKG. W trakcie leczenia, u każdego pacjenta należy rozważyć potrzebę przeprowadzenia badań EKG, w celu wykrycia wydłużenia odstępu QTc lub komorowych zaburzeń rytmu. Jeżeli w trakcie leczenia odstęp QT się wydłuży,
zaleca się zmniejszenie dawki, ale gdy odstęp QTc będzie dłuższy niż 500 ms, haloperydol należy odstawić.
Zaburzenia elektrolitowe, takie jak hipokaliemia i hipomagnezemia zwiększają ryzyko komorowych zaburzeń rytmu i należy je skorygować przed rozpoczęciem leczenia haloperydolem. Dlatego zaleca się wykonanie badania stężenia elektrolitów przed rozpoczęciem leczenia i okresowe monitorowanie w trakcie leczenia.
Zgłaszano również przypadki częstoskurczu i niedociśnienia (w tym niedociśnienia ortostatycznego) (patrz punkt 4.8). Zaleca się zachowanie ostrożności w przypadku podawania haloperydolu pacjentom z objawami niedociśnienia lub niedociśnienia ortostatycznego.
Zdarzenia naczyniowo-mózgowe
W randomizowanych badaniach klinicznych z kontrolą placebo, przeprowadzonych wśród pacjentów z otępieniem, odnotowano około 3-krotny wzrost ryzyka naczyniowo-mózgowych zdarzeń
niepożądanych podczas stosowania niektórych atypowych leków przeciwpsychotycznych.
Badania obserwacyjne porównujące odsetek udarów u pacjentów w podeszłym wieku otrzymujących jakiekolwiek leki przeciwpsychotyczne wobec odsetka udarów u pacjentów, którzy nie otrzymywali tego typu produktów leczniczych, wykazały podwyższony odsetek udarów u pacjentów
otrzymujących leczenie. Wzrost ten może być większy w przypadku stosowania każdej z pochodnych butyrofenonu, w tym haloperydolu. Mechanizm prowadzący do tego wzrostu częstości udarów nie
został poznany. Nie można wykluczyć zwiększonego ryzyka w innych grupach pacjentów. Należy zachować ostrożność stosując produkt Decaldol u pacjentów z czynnikami ryzyka udaru.
Złośliwy zespół neuroleptyczny
Stosowanie haloperydolu wiązało się z występowaniem złośliwego zespołu neuroleptycznego, rzadko występującą odpowiedzią osobniczą, charakteryzującą się wysoką gorączką, uogólnioną sztywnością mięśniową, dysfunkcją układu autonomicznego, zaburzeniami świadomości oraz podwyższonym poziomem fosfokinazy kreatyninowej w osoczu. Hipertermia jest często wczesnym objawem tego
zespołu. Należy niezwłocznie przerwać podawanie leku przeciwpsychotycznego i wdrożyć odpowiednie leczenie objawowe oraz uważnie obserwować stan pacjenta.
Dyskinezy późne
U niektórych pacjentów po długotrwałym leczeniu lub po zakończeniu stosowania produktu leczniczego mogą wystąpić dyskinezy późne. Charakteryzują je przede wszystkim rytmiczne, mimowolne ruchy języka, twarzy, ust lub żuchwy. U niektórych pacjentów objawy te mogą
utrzymywać się stale. Objawy te mogą nie ujawniać się podczas wznawiania leczenia, zwiększania dawki lub zamiany na inny lek przeciwpsychotyczny. Jeśli wystąpią objawy przedmiotowe lub podmiotowe dyskinez późnych, należy rozważyć przerwanie stosowania każdego z leków przeciwpsychotycznych, w tym produktu Decaldol.
Objawy zespołu pozapiramidowego
Mogą wystąpić objawy zespołu pozapiramidowego (np. drżenie, sztywność mięśniowa, nadmierne wydzielanie śliny, spowolnienie ruchów, akatyzja, ostra dystonia). Stosowanie haloperydolu wiązało się z wystąpieniem akatyzji, charakteryzującej się subiektywnym uczuciem nieprzyjemnego niepokoju i rozdrażnienia oraz potrzebą poruszania się, czemu często towarzyszy niemożność pozostania nieruchomo w pozycji siedzącej lub stojącej. Z większym prawdopodobieństwem objawy te mogą wystąpić w ciągu pierwszych kilku tygodni leczenia. U pacjentów z tego typu objawami zwiększanie dawki może prowadzić do ich nasilenia.
Ostra dystonia może wystąpić w pierwszych dniach leczenia haloperydolem, lecz stwierdzano ją także później lub po zwiększeniu dawki. Do objawów dystonii należą m.in.: kręcz szyi, grymasy twarzy, szczękościsk, protruzja języka oraz nietypowe ruchy gałek ocznych, w tym napadowe przymusowe patrzenie z rotacją gałek ocznych. Większe ryzyko tego typu reakcji występuje u mężczyzn oraz
w grupach osób w młodszym wieku. Ostra dystonia może wymagać przerwania stosowania produktu leczniczego.
Leki stosowane w parkinsonizmie o działaniu cholinolitycznym mogą być stosowane, jeżeli wymaga tego opanowanie objawów zespołu pozapiramidowego, lecz nie zaleca się rutynowego ich przepisywania, jako środka zapobiegawczego. Jeśli zachodzi konieczność jednoczesnego podawania leku przeciw parkinsonizmowi, można kontynuować jego stosowanie po odstawieniu produktu Decaldol, jeżeli wydalanie leku przeciw parkinsonizmowi przebiega szybciej niż haloperydolu, aby uniknąć wystąpienia lub nasilenia objawów zespołu pozapiramidowego. Należy pamiętać o możliwości zwiększenia ciśnienia wewnątrzgałkowego w razie jednoczesnego stosowania cholinolitycznych produktów leczniczych, w tym leków stosowanych w parkinsonizmie, z produktem leczniczym Decaldol.
Napady drgawkowe/Drgawki
Odnotowano, że haloperydol może wywołać napady drgawkowe. Należy zachować ostrożność u pacjentów z padaczką oraz u osób predysponowanych do wystąpienia drgawek (np. pacjenci odstawiający alkohol oraz pacjenci z uszkodzeniem mózgu).
Objawy ze strony wątroby i dróg żółciowych
Haloperydol metabolizowany jest w wątrobie, dlatego zaleca się dostosowanie dawki i zachowanie ostrożności stosując lek u pacjentów z zaburzeniami czynności wątroby (patrz punkty 4.2 i 5.2).
Odnotowano pojedyncze przypadki zaburzenia czynności wątroby lub zapalenia wątroby, najczęściej z zastojem żółci (patrz punkt 4.8).
Objawy ze strony układu dokrewnego
Tyroksyna może nasilać działanie toksyczne haloperydolu. U osób z nadczynnością tarczycy leki przeciwpsychotyczne można podawać tylko z zachowaniem ostrożności, jednocześnie zawsze stosując leczenie w celu utrzymania prawidłowej czynności tarczycy.
Wpływ leków neuroleptycznych na gospodarkę hormonalną obejmuje hiperprolaktynemię, która może wywołać mlekotok, ginekomastię, skąpe miesiączkowanie lub brak miesiączki (patrz punkt 4.8).
Badania z zastosowaniem ludzkich hodowli tkankowych wskazują, że prolaktyna może stymulować wzrost komórek nowotworów piersi. Chociaż w badaniach klinicznych oraz epidemiologicznych nie wykazano wyraźnego związku pomiędzy podawaniem leków przeciwpsychotycznych a nowotworami piersi u ludzi, należy zachować ostrożność u pacjentek z nowotworem piersi w wywiadzie. Należy
zachować ostrożność stosując produkt Decaldol u pacjentów ze stwierdzoną hiperprolaktynemią oraz u pacjentów z nowotworami prolaktyno-zależnymi (patrz punkt 5.3).
Odnotowano przypadki hipoglikemii oraz zespołu nieprawidłowego wydzielania hormonu antydiuretycznego, związane ze stosowaniem haloperydolu (patrz punkt 4.8).
Żylna choroba zakrzepowo-zatorowa
Odnotowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE, ang.: Venous Thromboembolism) związane ze stosowaniem leków przeciwpsychotycznych. Z uwagi na to, że
u pacjentów leczonych lekami przeciwpsychotycznymi często istnieją nabyte czynniki ryzyka żylnej choroby zakrzepowo-zatorowej, przed rozpoczęciem oraz podczas leczenia produktem Decaldol należy rozpoznać wszystkie możliwe czynniki ryzyka VTE oraz podjąć odpowiednie działania prewencyjne.
Rozpoczęcie leczenia
Pacjenci, u których rozważa się zastosowanie produktu Decaldol, muszą początkowo otrzymywać haloperydol w postaci doustnej, aby wykluczyć możliwość niespodziewanych reakcji nadwrażliwości na haloperydol.
Pacjenci z depresją
Jeżeli depresja jest objawem dominującym, zaleca się, aby produkt Decaldol nie był stosowany w monoterapii. Haloperydol może być stosowany z lekami przeciwdepresyjnymi w stanach, gdy współistnieją depresja i psychozy (patrz punkt 4.5).
Osoby z wolnym metabolizmem przy udziale cytochromu CYP2D6
Decaldol należy stosować z ostrożnością u pacjentów wolno metabolizujących przy udziale cytochromu P450 2D6 i którzy jednocześnie otrzymują inhibitor CYP3A4.
Substancje pomocnicze produktu Decaldol
Produkt Decaldol zawiera olej arachidowy (z orzeszków ziemnych). Jeżeli u pacjenta występuje uczulenie na orzeszki ziemne lub soję, stosowanie tego produktu jest przeciwwskazane.
Produkt Decaldol zawiera 15 mg alkoholu benzylowego w każdym ml roztworu. Alkohol benzylowy może powodować reakcje alergiczne.
Kobiety w ciąży lub karmiące piersią oraz pacjenci z chorobami wątroby lub nerek powinni
skontaktować się z lekarzem przed zastosowaniem leku, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną).
Badania dotyczące interakcji przeprowadzono jedynie u osób dorosłych. Wpływ na układ sercowo-naczyniowy
Jednoczesne stosowanie produktu Decaldol oraz produktów leczniczych wydłużających odstęp QTc
jest przeciwskazane (patrz punkt 4.3). Przykłady tego typu produktów leczniczych:
Ciąża
Umiarkowana liczba danych dotyczących stosowania u kobiet w ciąży (ponad 400 zakończonych ciąż) nie wykazuje wad rozwojowych ani toksycznego wpływu haloperydolu na płód/noworodka. Istnieją
jednak pojedyncze zgłoszenia przypadków uszkodzenia płodu po zastosowaniu haloperydolu
jednocześnie z innymi produktami leczniczymi. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Jako środek ostrożności, pożądane jest unikanie stosowania produktu Decaldol w okresie ciąży.
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym haloperydolu) w trzecim trymestrze ciąży są zagrożone wystąpieniem działań niepożądanych, w tym objawów pozapiramidowych i (lub) objawów odstawienia, których nasilenie i czas trwania po urodzeniu bywają różne. Zgłaszano przypadki pobudzenia, wzmożonego lub obniżonego napięcia mięśniowego, drżenia, senności, niewydolności oddechowej, a także zaburzeń karmienia. Dlatego zaleca się, aby uważnie monitorować stan noworodka.
Karmienie piersią
Haloperydol przenika do mleka ludzkiego.
Niewielkie ilości haloperydolu wykryto w osoczu i w moczu noworodków karmionych piersią przez kobiety, które przyjmowały haloperydol. Dane dotyczące wpływu haloperydolu na dzieci karmione piersią nie są wystarczające. Należy podjąć decyzję czy przerwać karmienie piersią, czy przerwać stosowanie produktu Decaldol, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki.
Płodność
Haloperydol zwiększa poziom prolaktyny. Hiperprolaktynemia może hamować wydzielanie gonadoliberyny przez podwzgórze, czego skutkiem może być zmniejszone wydzielanie gonadotropin przez przysadkę. Może to spowodować zahamowanie aktywności reprodukcyjnej, poprzez
upośledzenie procesu steroidogenezy w gonadach, zarówno u kobiet, jak i u mężczyzn (patrz punkt 4.4).
Decaldol wywiera umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Może wystąpić senność lub zaburzenia koncentracji, szczególnie po zastosowaniu dużych dawek oraz na początku leczenia. Alkohol może nasilać te objawy. Pacjentom należy zalecić, aby nie prowadzili pojazdów i nie obsługiwali maszyn w trakcie leczenia, dopóki nie upewnią się, jak reagują na leczenie.
Bezpieczeństwo stosowania haloperydolu dekanonianu oceniano u 410 pacjentów, uczestniczących w 3 badaniach porównawczych (jedno porównujące haloperydolu dekanonian z flufenazyną i dwa porównujące haloperydolu dekanonian z postacią doustną), w 9 badaniach otwartych i w jednym badaniu analizującym reakcję na dawkę.
W oparciu o połączone dane dotyczące bezpieczeństwa, uzyskane w powyższych badaniach,
najczęściej zgłaszanymi działaniami niepożądanymi były: zaburzenia pozapiramidowe (14%), drżenie (8%), parkinsonizm (7%), sztywność mięśniowa (6%) oraz nadmierna senność (5%).
Dodatkowo, bezpieczeństwo haloperydolu oceniano u 284 pacjentów biorących udział w 3 badaniach kontrolowanych placebo oraz u 1295 pacjentów otrzymujących haloperydol w 16 badaniach
klinicznych, z podwójnie ślepą próbą, z lekiem porównawczym w grupie kontrolnej.
W Tabeli 3 uwzględniono następujące działania niepożądane:
Przedawkowanie jest mniej prawdopodobne w przypadku podania pozajelitowego niż podawania doustnego, dlatego poniższe informacje podano na podstawie danych dotyczących postaci doustnej haloperydolu, z uwzględnieniem wydłużonego czasu działania produktu Decaldol.
Objawy przedmiotowe i podmiotowe
Przedawkowanie haloperydolu manifestuje się nasileniem znanego działania farmakologicznego haloperydolu oraz jego działań niepożądanych. Najważniejsze objawy to ciężkie objawy
pozapiramidowe, niedociśnienie oraz sedacja. Objawami reakcji pozapiramidowej są wzmożone napięcie mięśni oraz uogólnione lub miejscowe drżenie mięśni. Bardziej prawdopodobne jest wystąpienie nadciśnienia niż niedociśnienia tętniczego.
W skrajnych przypadkach, pacjent może zapaść w stan śpiączki z depresją oddechową
i niedociśnieniem, które mogą być na tyle poważne, że mogą prowadzić do stanu podobnego do wstrząsu. Należy uwzględnić ryzyko komorowych zaburzeń rytmu, związane prawdopodobnie z wydłużeniem odstępu QTc.
Leczenie
Brak swoistego antidotum. Stosuje się leczenie podtrzymujące. Nie określono skuteczności
zastosowania węgla aktywnego (w przypadku doustnego przedawkowania haloperydolu). Nie zaleca się poddawania pacjenta dializie w ramach leczenia przedawkowania, ponieważ usuwa ona jedynie bardzo niewielką ilość haloperydolu (patrz punkt 5.2).
U pacjentów w stanie śpiączki należy zapewnić drożność dróg oddechowych za pomocą rurki ustno- gardłowej lub dotchawicznej rurki intubacyjnej. W razie depresji oddechowej może być konieczne zastosowanie mechanicznej wentylacji.
Zaleca się monitorowanie czynności serca za pomocą elektrokardiografu (EKG) oraz parametrów
życiowych, prowadzone do czasu normalizacji EKG. W leczeniu ciężkich zaburzeń rytmu zaleca się stosować odpowiednie środki przeciwarytmiczne.
Niedociśnieniu tętniczemu oraz zapaści naczyniowo-sercowej można przeciwdziałać, podając dożylnie płyny, osocze lub koncentrat albuminowy oraz leki wazopresyjne, takie jak dopamina lub noradrenalina. Adrenaliny nie wolno podawać, ponieważ w połączeniu z haloperydolem może wywołać gwałtowny spadek ciśnienia.
W przypadku ciężkich objawów pozapiramidowych, należy podać produkty lecznicze stosowane w parkinsonizmie, a leczenie należy kontynuować przez kilka tygodni. Leki stosowane w chorobie Parkinsona należy odstawiać bardzo ostrożnie, ponieważ mogą wystąpić objawy pozapiramidowe.
Grupa farmakoterapeutyczna: Leki psycholeptyczne. Leki przeciwpsychotyczne. Pochodne butyrofenonu, kod ATC: N05AD01
Mechanizm działania
Haloperydolu dekanonian jest estrem haloperydolu i kwasu dekanowego i, jako taki, jest
neuroleptykiem o przedłużonym działaniu należącym do grupy pochodnych butyrofenonu. Po podaniu domięśniowym haloperydolu dekanonian jest stopniowo uwalniany z tkanki mięśniowej i ulega powolnej hydrolizie do wolnego haloperydolu, który dostaje się do krążenia ogólnego.
Haloperydol jest ośrodkowo działającym, silnym antagonistą receptora dopaminowego typu 2,
i w zalecanych dawkach wykazuje niskie powinowactwo do receptorów adrenergicznych α1, oraz nie wykazuje aktywności przeciwhistaminowej ani przeciwcholinergicznej.
Działanie farmakodynamiczne
Haloperydol zmniejsza nasilenie omamów i urojeń, co stanowi bezpośrednią konsekwencję blokowania sygnałów dopaminergicznych w mezolimbicznym szlaku dopaminergicznym. Efekt ośrodkowego blokowania dopaminy występuje w jądrach podstawnych (szlaku nigrostriatalnym). Haloperydol wywołuje skuteczną sedację psychomotoryczną, co wyjaśnia jego korzystne działanie w manii oraz zespołach przebiegających z pobudzeniem.
Oddziaływanie na jądra podstawne prawdopodobnie leży u podstawy niepożądanego wpływu na motorykę pozapiramidową (dystonia, akatyzja, parkinsonizm).
Działanie przeciwdopaminergiczne haloperydolu na laktotrofy w przedniej części przysadki wyjaśnia hiperprolaktynemię wywołaną przez osłabienie dopamino-zależnego mechanizmu stałej inhibicji wydzielania prolaktyny.
Badania kliniczne
W badaniach klinicznych pacjenci w większości najpierw otrzymywali haloperydol w postaci doustnej, a następnie leczenie zmieniano na haloperydolu dekanonian. W niektórych przypadkach pacjenci wcześniej otrzymywali doustnie inne przeciwpsychotyczne produkty lecznicze.
Wchłanianie
W wyniku podania dekanonianu haloperydolu w postaci iniekcji domięśniowej o przedłużonym uwalnianiu, powoli i długotrwale uwalniany jest wolny haloperydol. Stężenie w osoczu wzrasta stopniowo, osiągając maksimum zazwyczaj w ciągu 3 do 9 dni od podania iniekcji.
Stężenie w osoczu w stanie równowagi osiągane jest w ciągu 2 do 4 miesięcy u pacjentów otrzymujących iniekcje raz na miesiąc.
Dystrybucja
U dorosłych średnio około 88 do 92% haloperydolu wiąże się z białkami osocza. Wiązanie z białkami osocza podlega dużej zmienności osobniczej. Haloperydol jest szybko dystrybuowany do różnych
tkanek i narządów, na co wskazuje duża objętość dystrybucji (średnia wartość 8 do 21 l/kg po podaniu dożylnym). Haloperydol z łatwością przenika barierę krew-mózg. Przenika również przez łożysko
i wydzielany jest do mleka ludzkiego.
Metabolizm
Haloperydol jest intensywnie metabolizowany w wątrobie. Do głównych szlaków metabolicznych haloperydolu u człowieka należą glukuronidacja, redukcja grupy ketonowej, oksydacyjna N- dealkilacja i tworzenie metabolitów pirydynowych. Wydaje się, że metabolity haloperydolu nie przyczyniają się w istotny sposób do jego aktywności, jednak szlak redukcyjny odpowiada za około 23% biotransformacji, i nie można wykluczyć wstecznej konwersji zredukowanych metabolitów haloperydolu do haloperydolu. W metabolizmie haloperydolu uczestniczą enzymy CYP3A4
i CYP2D6. Hamowanie lub indukcja CYP3A4 lub CYP2D6 może wpływać na metabolizm haloperydolu. Hamowanie aktywności enzymów CYP2D6 może spowodować wzrost stężenia haloperydolu.
Eliminacja
Okres półtrwania haloperydolu w fazie eliminacji, po podaniu domięśniowym haloperydolu dekanonianu wynosi około 3 tygodni. Jest on dłuższy niż dla postaci innych niż dekanonian, dla których okres półtrwania haloperydolu w fazie eliminacji wynosi średnio 24 godziny po podaniu doustnym i 21 godzin po podaniu domięśniowym.
Pozorny klirens haloperydolu po podaniu pozanaczyniowym waha się od 0,9 do 1,5 l/h/kg, a u osób wolno metabolizujących z udziałem CYP2D6 jego wartość jest niższa. Obniżona aktywność enzymów CYP2D6 może spowodować wzrost stężenia haloperydolu. Zmienność osobnicza (współczynnik zmiany, %) w zakresie klirensu haloperydolu oszacowano na 44%, na podstawie analizy populacyjnej parametrów farmakokinetycznych u pacjentów ze schizofrenią. Po podaniu dożylnym haloperydolu, 21% dawki zostało wydalone z kałem, a 33% w moczu. Mniej niż 3% dawki wydalane jest z moczem w postaci niezmienionej.
Liniowość/nieliniowość
Farmakokinetyka haloperydolu po podaniu domięśniowym haloperydolu dekanonianu jest zależna od dawki. Zależność wielkości dawki od stężeniem haloperydolu w osoczu jest w przybliżeniu liniowa dla dawek do 450 mg.
Szczególne grupy pacjentów
Osoby w podeszłym wieku
Stężenie haloperydolu w osoczu u pacjentów w podeszłym wieku było wyższe niż u młodszych osób dorosłych, które otrzymały taką samą dawkę. Wyniki niewielkich badań klinicznych wskazują na niższy klirens i dłuższy okres półtrwania w fazie eliminacji haloperydolu u osób w podeszłym wieku.
Wyniki mieszczą się w zakresie obserwowanej zmienności parametrów farmakokinetycznych haloperydolu. U pacjentów w podeszłym wieku zaleca się odpowiednie dostosowanie dawki (patrz punkt 4.2)
Zaburzenia czynności nerek
Nie oceniano wpływu zaburzeń czynności nerek na parametry farmakokinetyczne haloperydolu. Około jednej trzeciej dawki haloperydolu wydalane jest z moczem, głównie w postaci metabolitów. Mniej niż 3% podanej dawki haloperydolu wydalane jest z moczem w postaci niezmienionej. Wydaje się, że metabolity haloperydolu nie przyczyniają się w istotny sposób do jego aktywności, jednak nie można wykluczyć wstecznej konwersji zredukowanego metabolitu haloperydolu do haloperydolu.
Chociaż nie wydaje się, aby upośledzenie czynności nerek wpływało na eliminacje haloperydolu w klinicznie istotnym zakresie, należy zachować ostrożność u pacjentów z zaburzeniami czynności
nerek, a w szczególności u pacjentów z ciężkimi zaburzeniami czynności nerek z powodu długiego okresu półtrwania haloperydolu i jego zredukowanego metabolitu i możliwości kumulacji (patrz punkt 4.2).
Ze względu na dużą objętość dystrybucji haloperydolu oraz wiązanie w dużym stopniu z białkami osocza, tylko bardzo niewielka ilość usuwana jest za pomocą dializy.
Zaburzenia czynności wątroby
Nie oceniano wpływu zaburzeń czynności wątroby na parametry farmakokinetyczne haloperydolu. Ponieważ jednak haloperydol jest intensywnie metabolizowany w wątrobie, zaburzenia czynności wątroby mogą znacząco wpływać na jego farmakokinetykę. Dlatego zaleca się dostosować dawkę i zachować ostrożność u pacjentów z zaburzeniami czynności wątroby (patrz punkty 4.2 i 4.4).
Zależności farmakokinetyczno - farmakodynamiczne
Stężenie terapeutyczne
Jak wynika z opublikowanych danych z wielu badań klinicznych, odpowiedź terapeutyczną
u większości pacjentów z ostrą lub przewlekłą schizofrenią, uzyskiwano przy stężeniu w osoczu wynoszącym od 1 do 10 ng/ml. Część pacjentów może wymagać większych stężeń, jako wynik dużej zmienności osobniczej parametrów farmakokinetycznych haloperydolu.
U pacjentów z pierwszym epizodem schizofrenii leczonych krótko działającymi postaciami haloperydolu, odpowiedź terapeutyczną można uzyskać już przy stężeniu od 0,6 do 3,2 ng/ml, jak oszacowano na podstawie pomiarów wysycenia receptorów D2 oraz zakładając, że wysycenie
receptorów D2 rzędu 60 - 80% jest najbardziej właściwe do uzyskania odpowiedzi terapeutycznej i zahamowania objawów pozapiramidowych. Przeciętnie, stężenie w tym zakresie osiągane jest po zastosowaniu dawek dobowych wynoszących od 1 do 4 mg.
Ze względu na dużą zmienność osobniczą parametrów farmakokinetycznych haloperydolu oraz mając na uwadze korelację pomiędzy stężeniem a uzyskanym efektem, zaleca się, aby dostosować indywidualną dawkę haloperydolu dekanonianu na podstawie uzyskanej odpowiedzi na leczenie, biorąc pod uwagę dane, które wskazują na 5-dniowe opóźnienie do uzyskania połowy maksymalnej odpowiedzi na leczenie. Należy także uwzględnić czas od zmiany dawki do osiągnięcia nowego stanu równowagi stężenia w osoczu i dodatkowy czas na uzyskanie odpowiedzi terapeutycznej.
W indywidualnych przypadkach można rozważyć zbadanie stężeń haloperydolu we krwi.
Wpływ na układ sercowo-naczyniowy
Ryzyko wydłużenia odstępu QTc wzrasta wraz z dawką haloperydolu oraz jego stężeniem w osoczu.
Objawy zespołu pozapiramidowego
Objawy zespołu pozapiramidowego mogą wystąpić w zakresie dawek terapeutycznych, chociaż ich częstość jest większa przy dawkowaniu, którego skutkiem jest stężenie wyższe niż terapeutyczne.
Dane niekliniczne wynikające z konwencjonalnych badań toksyczności po podaniu wielokrotnym oraz genotoksyczności, nie ujawniają szczególnego zagrożenia dla człowieka. Podawanie haloperydolu
u gryzoni powodowało obniżenie płodności, teratogenność w ograniczonym stopniu, jak również działanie embriotoksyczne.
W badaniach działania rakotwórczego haloperydolu u samic myszy obserwowano zależny od dawki wzrost częstości występowania gruczolaków przysadki mózgowej oraz nowotworów gruczołów sutkowych. Nowotwory te mogą być spowodowane długotrwałym blokowaniem receptorów dopaminowych D2 i hiperprolaktynemią. Znaczenie tych obserwacji dotyczących nowotworów
u gryzoni, w kontekście ryzyka dla człowieka, nie jest znane.
W kilku badaniach in vitro obserwowano blokowanie przez haloperydol kanału potasowego hERG w sercu. W wielu badaniach in vivo, dożylne podanie haloperydolu w niektórych modelach
zwierzęcych powodowało znaczne wydłużenie odstępu QTc przy dawkowaniu na poziomie
0,3 mg/kg, i maksymalnym stężeniu w osoczu Cmax co najmniej 7 do 14 razy wyższym niż stężenia terapeutyczne wynoszące od 1 do 10 ng/ml, które były skuteczne u większości pacjentów w badaniach klinicznych. Te dawki podawane dożylnie, powodujące wydłużenie odstępu QTc, nie powodowały
zaburzeń rytmu serca. W niektórych badaniach przeprowadzanych na zwierzętach, większe dawki podawanego dożylnie haloperydolu wynoszące 1 mg/kg lub więcej, powodowały wydłużenie odstępu QTc i (lub) komorowe zaburzenia rytmu przy wartości Cmax co najmniej 38 do 137 razy większej niż stężenia w osoczu po zastosowaniu dawek terapeutycznych, które były skuteczne u większości
pacjentów w badaniach klinicznych.
Alkohol benzylowy
Olej arachidowy oczyszczony
Nie są znane.
3 lata
Przechowywać ampułki w opakowaniu zewnętrznym w celu ochrony przed światłem, w temperaturze poniżej 25°C. Nie zamrażać.
Ampułki ze szkła oranżowego w tekturowym pudełku. 5 ampułek po 1 ml
Instrukcja otwierania ampułki
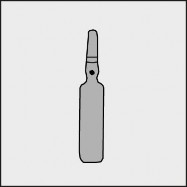
Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu. Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej miejsca nacięcia.
Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy usunąć zgodnie z obowiązującymi przepisami.
Rysunek 1.
Rysunek 2.
Rysunek 3.
Warszawskie Zakłady Farmaceutyczne Polfa S.A. ul. Karolkowa 22/24; 01-207 Warszawa
Pozwolenie nr R/0773
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 12.10.1993 r. Data ostatniego przedłużenia pozwolenia: 19.06.2012 r.











