Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
pacjenci, którzy powtórnie stosowali glikokortykosteroidy, szczególnie w okresie dłuższym niż 3 tygodnie,
pacjenci, którym przepisano leczenie krótkotrwałe w ciągu roku od zakończenia leczenia długotrwałego (miesiące lub lata),
pacjenci, u których występuje niewydolność kory nadnerczy z przyczyn innych niż terapia glikokortykosteroidami,
pacjenci otrzymujący deksametazon w dawce większej niż 6 mg na dobę,
pacjenci przyjmujący drugą dawkę leku po południu.
Choroby współistniejące, uraz lub zabieg operacyjny w przypadku długotrwałego leczenia mogą wymagać czasowego zwiększenia dawki.
Jeśli przerwanie stosowania glikokortykosteroidów nastąpi w czasie ich długotrwałego stosowania może być konieczne okresowe wznowienie leczenia.
W celu zmniejszenia ryzyka związanego ze stosowaniem glikokortykosteroidów pacjenci powinni otrzymać specjalną kartę zawierającą zalecenia lekarza, nazwę stosowanego leku oraz informacje o sposobie jego stosowania i okresie leczenia.
Nie należy przerywać podawania ogólnoustrojowych kortykosteroidów u pacjentów, którzy są już leczeni ogólnoustrojowymi (doustnymi) kortykosteroidami z innych powodów (np. pacjenci z
przewlekłą obturacyjną chorobą płuc (POChP)), ale nie wymagają suplementacji tlenem.
Deksametazonu nie należy podawać w chorobie COVID-19 u pacjentów, którzy nie wymagają podawania tlenu lub wentylacji mechanicznej, ze względu na brak korzyści terapeutycznych i ryzyko pogorszenia stanu zdrowia w tej grupie pacjentów.
Działanie przeciwzapalne/ immunosupresyjne, infekcje
Podczas stosowania kortykosteroidów może wystąpić zmniejszona oporność i trudności z lokalizacją infekcji. Kortykosteroidy mogą maskować pewne objawy zapalenia lub infekcji, często objawy mogą być nietypowe, a ciężkie zakażenia jak posocznica i gruźlica mogą osiągnąć poważny stopień
zaawansowania zanim zostaną zdiagnozowane.
Stosowanie glikokortykosteroidów łącznie z leczeniem infekcji jest możliwe tylko w przypadkach koniecznych np.: gruźlica, wirusowe i grzybicze zakażenia oczu.
Pacjenci leczeni lekami immunosupresyjnymi są bardziej podatni na infekcje niż osoby zdrowe. Ospa wietrzna i odra mogą mieć znacznie poważniejszy przebieg, a nawet prowadzić do zgonu u pacjentów z zaburzoną odpornością leczonych kortykosteroidami.
Unikać narażenia powinni szczególnie pacjenci, którzy nie przebyli tych chorób wcześniej. Ryzyko rozwoju zakażenia uogólnionego różni się u różnych osób i może być związane z dawką, drogą
i czasem podawania kortykosteroidów oraz chorobą podstawową. Pacjentom stosującym glikokortykosteroidy w chwili narażenia lub pacjentom, którzy stosowali je w czasie ostatnich 3 miesięcy, w ciągu 10 dni po narażeniu na ospę wietrzną, należy profilaktycznie podać
immunoglobulinę varicella zooster (VZIG). Jeśli dojdzie do rozwoju ospy wietrznej, pacjent wymaga odpowiedniego leczenia specjalistycznego. Nie należy przerywać leczenia glikokortykosteroidami, ale może zaistnieć konieczność zwiększenia stosowanej dotychczas dawki.
Po narażeniu na odrę, wskazane jest profilaktyczne podawanie immunoglibuliny (IG).
Szczególną ostrożność należy zachować rozważając zastosowanie glikokortykosteroidów u pacjentów, u których występują następujące schorzenia:
osteoporoza (szczególne ryzyko u kobiet w okresie pomenopauzalnym),
nadciśnienie lub zastoinowa niewydolność serca,
ciężkie choroby psychiczne (szczególnie posteroidowe) obecnie lub w wywiadzie,
cukrzyca (lub występowanie cukrzycy w rodzinie),
gruźlica w wywiadzie,
jaskra (lub występowanie jaskry w rodzinie),
miopatia wywołana przez kortykosteroidy w wywiadzie,
niewydolność wątroby,
niewydolność nerek,
niedoczynność tarczycy,
epilepsja,
owrzodzenie żołądka,
migrena,
niektóre robaczyce, szczególnie ameboza.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Pabi-Dexamethason, 500 mikrogramów (μg), tabletki Pabi-Dexamethason, 1 mg, tabletki
1 tabletka zawiera 500 μg lub 1 mg deksametazonu (Dexamethasonum) oraz substancję pomocniczą biologicznie czynną laktozę odpowiednio 82 mg i 92 mg.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka
Tabletki koloru białego, z odcieniem słabo żółtawym, okrągłe, obustronnie płaskie, obustronnie grawerowane; po jednej stronie „Dx”, a po drugiej stronie linia podziału.
Choroby reagujące na leczenie glikokortykosteroidami. Pomocniczo w kontroli obrzęku mózgu.
Pabi-Dexamethason jest wskazany w leczeniu COVID-19 u pacjentów dorosłych i młodzieży
(w wieku 12 lat i starszych o masie ciała wynoszącej co najmniej 40 kg), wymagających tlenoterapii.”
Dawkowanie
Dawki ustala się indywidualnie zależnie od ciężkości choroby i reakcji pacjenta na leczenie.
W szczególnych przypadkach, jak na przykład stres i zmiana obrazu klinicznego pacjenta może wystąpić konieczność podania większej dawki deksametazonu. Jeżeli w ciągu kilku dni nie wystąpi pozytywna reakcja na leczenie należy przerwać stosowanie glikokortykosteroidów.
Dorośli: zwykle od 0,5 mg do 10 mg na dobę zależnie od rodzaju choroby.
W przypadku niektórych pacjentów może zaistnieć konieczność czasowego zwiększenia dawki. Po uzyskaniu pożądanego efektu leczniczego należy stopniowo zmniejszać dawkę do najmniejszej skutecznej dawki i kontynuować obserwację pacjenta (patrz punkt 4.4).
W krótkim teście supresji deksametazonem stosuje się 1 mg deksametazonu o godzinie 23.00
i oznacza stężenie kortyzolu w osoczu krwi pobranej następnego dnia rano. Pacjentów, u których nie zaobserwowano wzrostu stężenia kortyzolu można poddać testowi dłuższemu. Pacjentowi podaje się wówczas 0,5 mg co 6 godzin przez 2 doby. W następnych 2 kolejnych dniach podaje się co 6 godzin po 2 mg deksametazonu. Oznacza się dobowe wydalanie 17- hydroksysteroidów z moczem w dobie poprzedzającej próbę oraz w 2 i 4 dobie testu.
Dzieci i młodzież
Dzieci: od 0,01 mg do 0,1 mg/ kg masy ciała.
Dawki glikokortykosteroidów ustala się na podstawie indywidualnej reakcji pacjenta na leczenie.
Stosowanie w leczeniu Covid-19
W leczeniu choroby COVID-19 należy stosować dawkę 6 mg raz na dobę doustnie, przez okres do 10 dni.
Populacja pediatryczna: W populacji pediatrycznej (młodzież w wieku od 12 lat) zaleca się przyjmowanie dawki 6 mg doustnie raz na dobę przez okres do 10 dni.
Czas trwania leczenia należy dostosować do odpowiedzi klinicznej i indywidualnych wymagań pacjenta.
Pacjenci w podeszłym wieku, pacjenci z zaburzeniami czynności wątroby i nerek
Nie ma konieczności dostosowania dawki.
Nadwrażliwość na deksametazon lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Układowe zakażenia, o ile nie jest stosowane leczenie przeciwzakażeniowe.
Szczepienia żywymi szczepionkami u pacjentów leczonych dawkami immunosupresyjnymi.
Pacjentów i (lub) ich opiekunów należy uprzedzić o możliwości wystąpienia psychiatrycznych działań niepożądanych (patrz punkt 4.8). Objawy występują zwykle w ciągu kilku dni lub tygodni od
rozpoczęcia leczenia. Ryzyko ich wystąpienia zwiększa się wraz ze zwiększeniem dawki i długością leczenia (patrz punkt 4.5), jednak wielkość dawki nie pozwala przewidzieć ciężkości i długości
trwania reakcji. Większość objawów ustępuje po zmniejszeniu dawki lub odstawieniu deksametazonu, może być jednak konieczne zastosowanie specyficznego leczenia. Należy zachęcić pacjentów i (lub) ich opiekunów do korzystania z porady lekarskiej gdy nastąpi pogorszenie objawów
psychologicznych, szczególnie w przypadku obniżenia nastroju i wystąpienia myśli samobójczych. Pacjentów i (lub) ich opiekunów należy także poinformować o możliwości wystąpienia zaburzeń psychicznych w trakcie lub zaraz po odstawieniu deksametazonu, mimo iż takie reakcje opisywane są niezbyt często. Należy zachować szczególną uwagę rozważając zastosowanie glikokortykosteroidów u pacjentów z aktywnymi postaciami chorób psychicznych z kręgu cyklofrenii, uwzględniając choroby depresyjne, maniakalno-depresyjne i psychozy steroidowe.
Działania niepożądane można zminimalizować poprzez stosowanie najmniejszej skutecznej dawki przez najkrótszy okres czasu i przez stosowanie wymaganej dawki dobowej jako pojedynczej dawki podawanej rano lub jeśli to możliwe co drugi dzień. Aby dobrać odpowiednią dawkę konieczne jest częste monitorowanie stanu klinicznego pacjenta.
Zaburzenia widzenia
Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (ang. Central Serous Chorioretinopathy, CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
Przełom guza chromochłonnego
Po podaniu kortykosteroidów układowych zgłaszano przypadki wystąpienia przełomu guza
chromochłonnego (Pheochromocytoma crisis), który może być śmiertelny. Kortykosteroidy należy podawać pacjentom z podejrzewaniem lub rozpoznaniem guza chromochłonnego wyłącznie po starannej ocenie korzyści i ryzyka.
Spodziewane jest, że jednoczesne podawanie inhibitorów CYP3A, w tym produktów zawierających kobicystat, zwiększy ryzyko ogólnoustrojowych działań niepożądanych. Należy unikać łączenia
leków, chyba że korzyść przewyższa zwiększone ryzyko ogólnoustrojowych działań niepożądanych związanych ze stosowaniem glikortykosteroidów; w takim przypadku pacjenta należy obserwować w celu wykrycia ogólnoustrojowych działań glikortykosteroidów.
Odstawienie deksametazonu
W trakcie długotrwałego stosowania glikokortykosteroidów rozwija się niewydolność kory nadnerczy, która może utrzymywać się przez rok po zakończeniu leczenia.
Po długotrwałym leczeniu odstawienie glikokortykosteroidów zawsze musi przebiegać stopniowo, aby uniknąć ostrej niewydolności kory nadnerczy. Dawkę należy zmniejszać stopniowo w ciągu tygodni lub miesięcy zależnie od stosowanej dawki i okresu leczenia.
Pacjent, który otrzymywał dawkę większą niż fizjologiczna (około 1 mg deksametazonu) w okresie dłuższym niż 3 tygodnie nie powinien nagle odstawić leku. Sposób zmniejszania dawki glikokortykosteroidów należy uzależnić, w dużej mierze, od prawdopodobieństwa nawrotu choroby. W trakcie odstawienia konieczna jest kliniczna ocena stanu pacjenta. Jeśli prawdopodobieństwo nawrotu choroby jest małe, ale istnieją wątpliwości dotyczące supresji osi podwgórze-przysadka- nadnercza stosowana dawka może być od razu zmniejszona do dawki fizjologicznej, dalsze
zmniejszanie dawki powinno przebiegać wolniej.
Nagłe przerwanie leczenia w przypadku stosowania deksametazonu w dawce dobowej większej niż 6 mg przez 3 tygodnie, u większości pacjentów, prawdopodobnie nie doprowadzi do klinicznie istotnego zahamowania osi podwzgórze-przysadka-nadnercza.
Stopniowe odstawienie glikokortykosteroidów należy rozważyć w przypadku niżej wymienionych grup pacjentów, nawet jeśli deksametazon stosowano krócej niż 3 tygodnie:
Doniesienia piśmiennictwa sugerują istnienie związku pomiędzy stosowaniem kortykosteroidów i pęknięcia wolnej ściany lewego przedsionka po świeżym zawale mięśnia sercowego; u tych pacjentów kortykosteroidy należy stosować bardzo ostrożnie.
Po podaniu glikokortykosteroidów mogą wystąpić ciężkie reakcje anafilaktoidalne, takie jak obrzęk głośni, pokrzywka, skurcz oskrzeli, szczególnie u pacjentów z alergią w wywiadzie.
W przypadku wystąpienia reakcji anafilaktoidalnych zaleca się następujące postępowanie: natychmiastowa powolna iniekcja dożylna 0,1-0,5 ml adrenaliny (roztwór 1:1 000: 0,1-0,5 mg adrenaliny zależnie od masy ciała), dożylne podanie aminofiliny i sztuczne oddychanie, jeśli konieczne.
Pabi-Dexamethason zawiera laktozę i nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy typu Lapp lub zespołem złego wchłaniania glukozy-galaktozy.
Dzieci i młodzież
Deksametazon należy stosować ostrożnie u dzieci ze względu na możliwy wpływ na wzrost i rozwój.
Glikokortykosteroidy wywołują zależne od dawki zahamowanie wzrostu u niemowląt, dzieci i młodzieży. Wpływ ten może być nieodwracalny.
Wcześniaki: Dostępne dane wskazują na występowanie długotrwałych niepożądanych zdarzeń wpływających na rozwój neurologiczny wcześniaków z przewlekłą chorobą płuc po rozpoczęciu wczesnego leczenia (<96 godzin) w dawce początkowej 0,25 mg/kg mc. dwa razy na dobę.
Stosowanie u osób w wieku podeszłym
Działania niepożądane występujące po zastosowaniu glikokortykosteroidów mogą mieć cięższy
przebieg u osób starszych, szczególnie dotyczy to osteoporozy, nadciśnienia, hipokaliemii, cukrzycy, wrażliwości na infekcje i scieńczania skóry. Aby uniknąć reakcji zagrażających życiu należy otoczyć takich pacjentów szczególną opieką.
Ryfampicyna, ryfabutin, karbamazepina, fenobarbital, fenytoina, prymidon i aminoglutetimid mogą zwiększać metabolizm kortykosteroidów, co powoduje zmniejszenie skuteczności ich działania.
Efedryna także zwiększa metabolizm deksametazonu.
Kortykosteroidy wykazują antagonistyczne działanie w stosunku do leków hipoglikemicznych (w tym insuliny), leków przeciwnadciśnieniowych i moczopędnych, zwiększają natomiast działanie hipokalemiczne acetazolamidu, diuretyków pętlowych i tiazydowych oraz karbenoksolonu.
U pacjentów otrzymujących kortykosteroidy i kumarynowe środki przeciwkrzepliwe należy często kontrolować czas protrombinowy, gdyż kortykosteroidy mogą zwiększać ich działanie.
Doustne środki antykoncepcyjne (estrogeny i progestageny) zwiększają stężenie kortykosteroidów
w surowicy krwi, podobne działanie wobec deksametazonu wykazuje lek przeciwwirusowy rytonawir.
Deksametazon zmniejsza stężenie leków przeciwwirusowych indynawiru i sakwinawiru w osoczu krwi.
Kortykosteroidy zwiększają klirens nerkowy salicylanów, dlatego odstawienie sterydów może spowodować zatrucie salicylanami.
Pacjenci stosujący niesteroidowe leki przeciwzapalne przyjmujący równocześnie glikokortykosteroidy powinni być uważnie obserwowani ze względu na możliwość wystąpienia i (lub) pogorszenia
objawów owrzodzenia żołądka i dwunastnicy.
U pacjentów stosujących jednocześnie metotreksat i deksametazon występuje zwiększone ryzyko toksycznego wpływu na układ krwionośny.
Środki zobojętniające, szczególnie te, które zawierają krzemian magnezu zaburzają wchłanianie glikokortykosteroidów z przewodu pokarmowego.
Ciąża
Kortykosteroidy w różnym stopniu przenikają przez łożysko. Deksametazon łatwo przenika przez łożysko. Podanie kortykosteroidów ciężarnym zwierzętom może być przyczyną nieprawidłowości rozwoju płodu, w tym rozszczepów podniebienia, opóźnienia wzrostu płodu oraz wpływa na rozwój mózgu i zahamowanie rozwoju płodu. Brak danych na temat wpływu kortykosteroidów na
zwiększenie ilości wad rozwojowych takich jak rozszczepy podniebienia i (lub) warg u ludzi. Jednakże długotrwałe lub częste podawanie kortykosteroidów podczas ciąży może zwiększyć ryzyko opóźnienia rozwoju płodu. U dzieci matek leczonych kortykosteroidami w czasie ciąży teoretycznie może wystąpić niedoczynność kory nadnerczy, która zwykle ustępuje po urodzeniu i rzadko ma
znaczenie kliniczne. U kobiet w ciąży lek może być stosowany jedynie w przypadku, gdy w opinii lekarza korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu.
Karmienie piersią
Kortykosteroidy przenikają do mleka kobiet karmiących piersią, choć brak jest danych na temat deksametazonu. U dzieci matek przyjmujących duże dawki kortykosteroidów przez długi okres czasu może wystąpić zahamowanie czynności kory nadnerczy.
Brak danych na temat wpływu deksametazonu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Przewidywane działania niepożądane zależne od hamowania osi podwzgórze-przysadka-nadnercza są związane z siłą działania leku, dawką, porą dnia i czasem trwania leczenia.
Częstość występowania działań niepożądanych została określona w następujący sposób: Bardzo często: (> 1/10)
Często: (> 1/100, < 1/10)
Niezbyt często: (> 1/1 000, < 1/100) Rzadko: (> 1/10 000, < 1/1 000)
Bardzo rzadko: (< 1/10 000) w tym pojedyncze przypadki
Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych)
Klasyfikacja układów i narządów MedDRA | Częstość | Działania niepożądane |
Zaburzenia układu immunologicznego | Nieznana | Zwiększenie podatności i ciężkości infekcji z zahamowaniem ich klinicznych objawów, oporne infekcje, nawroty nieczynnej gruźlicy, zmniejszenie odpowiedzi na szczepionki i testy skórne, reakcje nadwrażliwości, w tym anafilaksja, alergiczne zapalenie skóry, pokrzywka, obrzęk naczynioruchowy. |
Zaburzenia endokrynologiczne | Nieznana | Zahamowanie osi podwzgórze-przysadka- nadnercza, zahamowanie wzrostu u niemowląt, dzieci i młodzieży, zaburzenia miesiączkowania, brak miesiączki, zespół Cushinga, hirsutyzm, zmniejszona tolerancja węglowodanów, zwiększenie zapotrzebowania na insulinę i leki przeciwcukrzycowe, przedwczesne kostnienie. |
Zaburzenia metabolizmu i odżywiania | Nieznana | Zwiększenie masy ciała, ujemny bilans azotowy i wapniowy, zwiększenie apetytu, zatrzymanie sodu i wody, utrata potasu, zasadowica z niedoboru potasu. |
Zaburzenia psychiczne | Nieznana | Choroby afektywne (drażliwość, euforia, depresja i zmiany nastroju, myśli samobójcze), reakcje psychiczne (mania, omamy, urojenia, pogorszenie schizofrenii), zaburzenia zachowania, nerwowość, lęk, zaburzenia snu, zaburzenia funkcji poznawczych (dezorientacja, zaniki pamięci). |
Zaburzenia układu nerwowego | Nieznana | Drgawki, pogorszenie padaczki, wzrost ciśnienia śródczaszkowego i obrzęk opuszki (pseudo guz mózgu), zawroty głowy, bóle głowy, uzależnienie psychologiczne. |
Zaburzenia oka | Nieznana | Nieostre widzenie (patrz także punkt 4.4). |
Nieznana | Zaćma podtorebkowa tylna, zwiększone ciśnienia śródgałkowe, jaskra, tarcza zastoinowa, wytrzeszcz, scieńczenie rogówki i twardówki, zaostrzenie choroby wirusowej i grzybiczej oka. | |
Zaburzenia serca | Nieznana | Zakrzep z zatorami, pęknięcie ściany mięśnia sercowego po świeżym zawale mięśnia sercowego, nadciśnienie. |
Zaburzenia żołądka i jelit | Nieznana | Niestrawność, wrzód trawienny z możliwą perforacją i krwawieniem, ostre zapalenie trzustki, zakażenie grzybicze, wrzodziejące zapalenie przełyku, wzdęcia, wymioty, nudności. |
Zaburzenia skóry i tkanki podskórnej | Nieznana | Zaburzone gojenie ran, sińce, scieńczenia skóry, wybroczyny i wylewy krwawe, rumień, rozstępy, trądzik, zwiększona potliwość. |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Nieznana | Osteoporoza, złamania kręgów i kości długich, martwica kości, zerwanie ścięgien, osłabienie siły działania mięśni. |
Zaburzenia ogólne i stany w miejscu podania | Nieznana | Leukocytoza, czkawka, złe samopoczucie. |
Przerwanie leczenia po długotrwałym stosowaniu kortykosteroidów może wywołać ostrą niewydolność kory nadnerczy, niedociśnienie, zgon (patrz punkt 4.4). Może wystąpić zespół odstawienia, w tym gorączka, katar, zapalenie spojówek, bolesne swędzące guzki na skórze, zmniejszenie masy ciała, bóle mięśni i stawów, złe samopoczucie.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: +48 22 40 21 301, fax: +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie może objawiać się działaniami niepożądanymi. Leczenie jest objawowe i podtrzymujące.
Grupa farmakoterapeutyczna: glikokortykosteroidy, kod ATC: H 02 AB 02
Deksametazon to syntetyczny hormon kory nadnerczy z grupy glikokortykosteroidów do stosowania doustnego o długotrwałym i bardzo silnym działaniu przeciwzapalnym, działaniu przeciwalergicznym, przeciwgorączkowym i immunosupresyjnym. Efekt przeciwzapalny jest około 7,5 razy silniejszy, natomiast wpływ na przemianę węglowodanową jest 5 razy, a na gospodarkę wodno-elektrolitową
10 razy słabszy od prednizonu. Prawie nie zatrzymuje sodu i wody w ustroju, nieznacznie zwiększa wydalanie potasu. W małych i średnich dawkach nie wywołuje nadciśnienia tętniczego. Obniża
ciśnienie śródczaszkowe. Powoduje ubożenie organizmu w wapń. Znacznie silniej niż inne hormony kory nadnerczy hamuje wydzielanie kortykotropiny z przysadki mózgowej i wtórnie zmniejsza
stężenie kortyzolu we krwi.
Badanie RECOVERY (ang. - Randomised Evaluation of COVid-19 thERapY)
To inicjowane przez badacza, randomizowane kontrolowane, otwarte, adaptacyjne badanie platformowe, mające na celu ocenę skutków potencjalnego leczenia u pacjentów hospitalizowanych z powodu COVID-19.
Badanie zostało przeprowadzone w 176 szpitalach w Wielkiej Brytanii.
6425 pacjentów zakwalifikowano losowo do grupy otrzymującej deksametazon (2104 pacjentów) lub opiekę standardową (4321 pacjentów). 89% pacjentów miało potwierdzoną laboratoryjnie infekcję SARS-CoV-2.
Podczas randomizacji 16% pacjentów poddawano inwazyjnej wentylacji mechanicznej lub pozaustrojowej oksygenacji membranowej, 60% otrzymywało tylko tlen (z lub bez wentylacji nieinwazyjnej), a 24% nie otrzymywało tlenoterapii ani wentylacji mechanicznej.
Średni wiek pacjentów wynosił 66,1 ± 15,7 lat. 36% pacjentów stanowiły kobiety. U 24% pacjentów stwierdzono w wywiadzie cukrzycę, u 27% choroby serca i u 21% przewlekłą chorobę płuc.
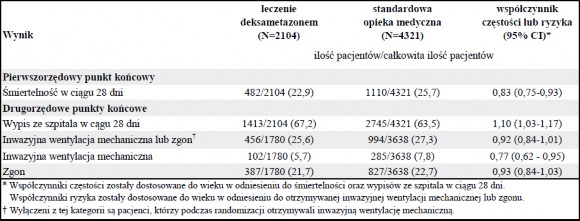
Pierwszorzędowy punkt końcowy
Śmiertelność po 28 dniach była istotnie niższa w grupie leczonej deksametazonem niż w grupie podlegającej standardowej opiece medycznej, odnotowano odpowiednio 482 zgony w grupie 2104 pacjentów (22,9%) i 1110 zgonów w grupie 4321 pacjentów (25,7%) (współczynnik częstości 0,83;
95% przedział ufności [CI], 0,75 do 0,93; P<0,001).
W grupie otrzymującej deksametazon, częstość zgonów była niższa niż w grupie otrzymującej
standardową opiekę medyczną wśród pacjentów poddawanych inwazyjnej wentylacji mechanicznej (29,3% vs. 41,4%; współczynnik częstości 0,64; 95% CI, 0,51 do 0,81) oraz otrzymujących tlen bez
inwazyjnej wentylacji mechanicznej (23,3% vs. 26,2%; współczynnik częstości 0,82; 95% CI, 0,72 do
0,94).
Nie stwierdzono wyraźnego wpływu deksametazonu wśród pacjentów, którzy nie otrzymywali
żadnego wspomagania oddychania w trakcie randomizacji (17,8% vs. 14,0%; współczynnik częstości 1,19; 95% CI, 0,91 do 1,55).
Drugorzędowe punkty końcowe
Pacjenci leczeni deksametazonem mieli krótszy czas hospitalizacji niż pacjenci podlegający standardowej opiece medycznej (12 dni vs. 13 dni) i większe prawdopodobieństwo wypisu ze szpitala w ciągu 28 dni (współczynnik częstości 1,10; 95% CI, 1,03 do 1,17).
Zgodnie z pierwszorzędowym punktem końcowym, największy wpływ na wzrost
prawdopodobieństwa wypisu ze szpitala w ciągu 28 dni obserwowano wśród pacjentów poddawanych inwazyjnej wentylacji mechanicznej (współczynnik częstości 1,48; 95% CI, 1,16 do 1,90), następnie otrzymujących tylko tlen (współczynnik częstości 1,15; 95% CI, 1,06 do1,24) bez korzystnego wpływu u pacjentów nieotrzymujących tlenu (współczynnik częstości 0,96; 95% CI 0,85 do 1,08).
Bezpieczeństwo
Podczas leczenia wystąpiły cztery ciężkie zdarzenia niepożądane: dwa przypadki hiperglikemii, psychoza wywołana steroidami oraz krwawienie z górnego odcinka przewodu pokarmowego. Wszystkie zdarzenia niepożądane ustąpiły.
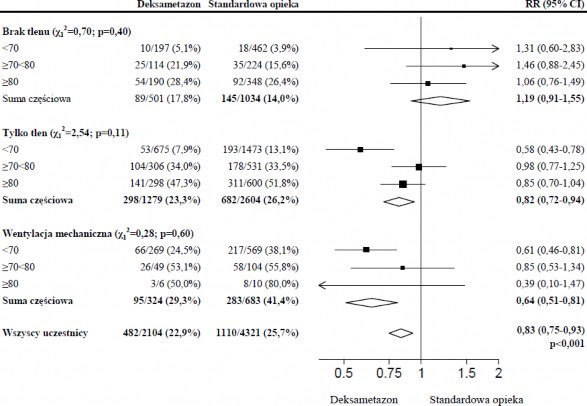
Analiza podgrup
Wpływ deksametazonu na śmiertelność z uwzględnieniem wieku i wspomagania oddychania otrzymanego podczas randomizacji w ciągu 28 dni obserwacji
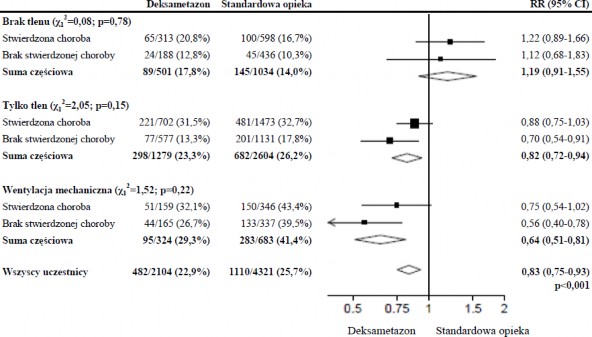
Wpływ deksametazonu na śmiertelność z uwzględnieniem otrzymanego wspomagania oddychania i stwierdzonej w wywiadzie jakiejkolwiek choroby przewlekłej podczas randomizacji w ciągu 28 dni obserwacji
Deksametazon po podaniu doustnym wchłania się szybko z przewodu pokarmowego. Szybko przenika do tkanek. Maksymalne stężenie leku we krwi występuje między 1 a 2 godziną po zażyciu.
Deksametazon rozmieszcza się w płynach ustrojowych, w 77% wiąże się z białkami osocza. W około 97% jest metabolizowany w wątrobie, a produkty przemiany są wydalane głównie z moczem i w
niewielkiej ilości przez przewód pokarmowy. Biologiczny okres półtrwania wynosi od 36 do 54 godzin. Hemodializa nie ma istotnego wpływu na stężenie deksametazonu we krwi.
W badaniach na zwierzętach rozszczepienie podniebienia obserwowano u szczurów, myszy,
chomików, królików, psów i naczelnych, ale nie u koni i owiec. W niektórych przypadkach te wady rozwojowe połączone były z wadami ośrodkowego układu nerwowego i serca. U naczelnych wpływ na mózg widoczny był po narażeniu. Ponadto może nastąpić opóźnienie wzrostu płodu wewnątrz macicy. Wszystkie wymienione skutki obserwowano po zastosowaniu dużych dawek.
Pabi-Dexamethason, 500 μg Laktoza jednowodna Skrobia ziemniaczana
Żelatyna
Magnezu stearynian
Pabi-Dexamethason, 1 mg Laktoza jednowodna Skrobia ziemniaczana
Żelatyna
Magnezu stearynian
Nie dotyczy.
4 lata
Przechowywać w temperaturze poniżej 25°C, chronić przed światłem.
Pabi-Dexamethason, tabletki 500 μg
Blistry z folii PVC/Aluminium lub fiolka szklana oranżowa z korkiem z polietylenu (LDPE), w tekturowym pudełku.
20 tabletek w blistrze. 20 tabletek w fiolce.
Pabi-Dexamethason, tabletki 1 mg
Blistry z folii PVC/Aluminium lub fiolka szklana oranżowa z korkiem z polietylenu (LDPE), w tekturowym pudełku.
20 tabletek w blistrze. 20 tabletek w fiolce.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Adamed Pharma S.A.
Pieńków, ul. M. Adamkiewicza 6A 05-152 Czosnów
Pabi-Dexamethason, 500 μg Pozwolenie nr R/1704
Pabi-Dexamethason 1 mg Pozwolenie nr R/1705
Pabi-Dexamethason, 500 μg
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 20.12.1972 r. Data ostatniego przedłużenia pozwolenia: 02.02.2015 r.
Pabi-Dexamethason 1 mg
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 20.12.1972 r. Data ostatniego przedłużenia pozwolenia: 02.02.2015 r.











