Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD ILOŚCIOWY I JAKOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD ILOŚCIOWY I JAKOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
dla mężczyzn:
Ccr =
140 − wiek
stężenie kreatyniny (mg/100ml)
Uwaga: jeśli kreatynina jest oznaczana w mikromolach/l, to można zamienić na mg/100 ml (mg%) w następujący sposób:
stężenie kreatyniny (mg/100 ml) =
stężenie kreatyniny (mikromol/l) × 113,12 10 000
stężenie kreatyniny (mikromol/l)
=
Gdzie 113,12 jest masą cząsteczkową kreatyniny.
88,4
dla kobiet - uzyskany wynik należy pomnożyć przez 0,85.
Uwaga: powyższe wzory nie nadają się do obliczenia klirensu kreatyniny u dzieci.
W praktyce oznacza to, że dla większości pacjentów dawka podtrzymująca wynosi od 125 do 250 μg digoksyny na dobę. U pacjentów podatnych, u których występują nasilone działania niepożądane, zaleca się stosowanie mniejszych dawek, tj. wystarczająca może być dawka 62,5 μg na dobę lub mniejsza.
Niektórzy pacjenci wymagają jednak zastosowania większych dawek.
Dzieci
Noworodki, niemowlęta i dzieci do 10 lat
Jeśli glikozydy nasercowe podawano w ciągu dwóch tygodni poprzedzających rozpoczęcie leczenia digoksyną, należy spodziewać się, że optymalne dawki nasycające digoksyny będą mniejsze niż zalecane poniżej.
U noworodków, szczególnie wcześniaków, klirens nerkowy jest mniejszy, dlatego należy zmniejszyć dawki produktu, wykraczając poza ogólne zalecenia dotyczące dawkowania.
Poza okresem noworodkowym, dzieci zasadniczo wymagają proporcjonalnie większych dawek digoksyny niż pacjenci dorośli, w przeliczeniu na masę lub powierzchnię ciała, jak podano
w schemacie poniżej. U dzieci powyżej 10 lat stosuje się dawki jak u osób dorosłych, biorąc pod uwagę masę ciała.
Parenteralna dawka nasycająca
Dożylna dawka nasycająca powinna być podana według schematu:
Wcześniaki o masie ciała <1,5 kg: 20 mikrogramów/kg mc. na dobę Wcześniaki o masie ciała od 1,5 kg do 2,5 kg: 30 mikrogramów/kg mc. na dobę Noworodki oraz dzieci do 2 lat: 35 mikrogramów/kg mc. na dobę
Dzieci od 2 do 5 lat: 35 mikrogramów/kg mc. na dobę
Dzieci od 5 do 10 lat: 25 mikrogramów/kg mc. na dobę Dawka nasycająca powinna być podawana w dawkach podzielonych - przy czym pierwsza dawka powinna stanowić połowę całkowitej dawki leku, a następne powinny być podawane co 4 do 8 godzin, oceniając efekt kliniczny przed podaniem kolejnej dawki.
Każda dawka powinna być podawana w infuzji dożylnej przez 10 do 20 minut.
Leczenie podtrzymujące:
Dawkę podtrzymującą należy podawać według poniższego schematu:
Wcześniaki: dawka dobowa = 20% dawki 24-godzinnej nasycającej. Noworodki urodzone o czasie i dzieci do 10 lat: dawka dobowa = 25% 24-godzinnej dawki nasycającej.
Powyższy schemat należy traktować jako ogólną wskazówkę, w tych grupach dzieci i młodzieży jako podstawę do dostosowania dawkowania należy stosować obserwację kliniczną i kontrolę stężeń digoksyny w surowicy (patrz punkt 4.4).
Pacjenci w podeszłym wieku
W przypadku pacjentów w podeszłym wieku należy wziąć pod uwagę możliwość pogorszenia czynności nerek i zmniejszenia beztłuszczowej masy ciała. W razie konieczności dawkę należy zmniejszyć i dostosować do zmienionej farmakokinetyki, aby zapobiec zwiększeniu stężenia digoksyny w surowicy i ryzyku toksyczności. Należy regularnie kontrolować stężenie digoksyny w surowicy i unikać hipokaliemii.
Zaburzenia czynności nerek
Zalecenia dotyczące dawkowania należy ponownie rozważyć, jeśli pacjenci są w podeszłym wieku lub istnieją inne przyczyny zmniejszenia klirensu nerkowego digoksyny. Należy rozważyć zmniejszenie dawki początkowej i podtrzymującej (patrz punkt 4.4).
Rozcieńczanie:
Produkt może być podawany bez rozcieńczenia lub po rozcieńczeniu w czterokrotnej albo większej objętości roztworu do infuzji. Rozcieńczenie w mniejszej niż zalecana objętości może prowadzić do wytrącania się digoksyny.
Do rozcieńczania można zastosować następujące roztwory do infuzji:
0,9% roztwór NaCl,
0,18% roztwór NaCl i 4% roztwór glukozy,
5% roztwór glukozy.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
tygodnia. Poza okresem bezpośrednio po urodzeniu, dzieci generalnie wymagają podawania dawek proporcjonalnie większych niż dorośli w przeliczeniu na masę i powierzchnię ciała.
Zaburzenia czynności nerek
Okres półtrwania digoksyny w końcowej fazie eliminacji jest wydłużony u pacjentów z zaburzeniami czynności nerek, u pacjentów z bezmoczem może wynosić około 100 godzin.
Zaburzenia czynności wątroby
Zaburzenia czynności wątroby mają niewielki wpływ na klirens digoksyny.
Pacjenci w podeszłym wieku
Związane z wiekiem zaburzenia czynności nerek u pacjentów w podeszłym wieku mogą skutkować niższym klirensem digoksyny niż u młodszych osób, przy czym zgłoszony klirens digoksyny u osób starszych wynosi 53 ml/min/1,73 m2.
Płeć
Klirens digoksyny jest o 12%-14% mniejszy u kobiet niż u mężczyzn, co może wymagać uwzględnienia w obliczeniach dawkowania.
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania
0,9% roztwór NaCl,
0,18% roztwór NaCl i 4% roztwór glukozy,
5% roztwór glukozy.
Roztwór do infuzji dożylnej przygotować bezpośrednio przed podaniem. Jeżeli zachodzi konieczność, sporządzony roztwór można przechowywać, na odpowiedzialność użytkownika, maksymalnie przez 24 godziny w temperaturze od 2°C do 8°C, pod warunkiem, że rozcieńczenie przygotowuje się
w kontrolowanych i walidowanych aseptycznych warunkach. Niewykorzystany w ciągu 24 godzin roztwór należy wyrzucić.
Instrukcja otwierania ampułki
Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu.
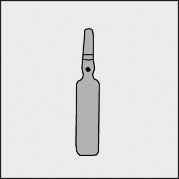
Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia.
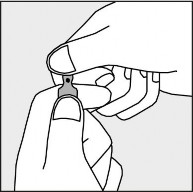
Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki.
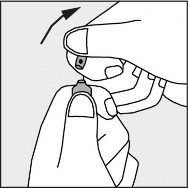
Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3.
Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
Rysunek 1.
Rysunek 2.
Rysunek 3.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
DIGOXIN WZF, 0,25 mg/ml, roztwór do wstrzykiwań
Każdy ml roztworu zawiera 0,25 mg digoksyny (Digoxinum). Każda ampułka (2 ml) zawiera 0,5 mg digoksyny (Digoxinum).
Substancje pomocnicze o znanym działaniu: etanol 96%, glikol propylenowy (E 1520) i sód. Każdy ml zawiera 101,25 mg etanolu 96%, 414,8 mg glikolu propylenowego i 0,58 mg sodu. Każda ampułka (2 ml) zawiera 202,5 mg etanolu 96%, 829,6 mg glikolu propylenowego, 1,16 mg sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań Bezbarwny, przezroczysty płyn
Niewydolność serca
Digoksyna jest wskazana w leczeniu przewlekłej niewydolności serca, w której dominującym problemem jest dysfunkcja skurczowa. Korzyść terapeutyczna jest największa u pacjentów
z rozszerzeniem komór.
Digoksyna jest szczególnie wskazana, gdy niewydolności serca towarzyszy migotanie przedsionków.
Nadkomorowe zaburzenia rytmu
Digoksyna jest wskazana w leczeniu niektórych nadkomorowych zaburzeń rytmu serca, zwłaszcza przewlekłego trzepotania i migotania przedsionków.
Dawkowanie
Dawki produktu należy ustalać indywidualnie, w zależności od wieku, masy ciała oraz czynności nerek pacjenta.
Podane poniżej dawki mają charakter orientacyjny.
W przypadkach, w których glikozydy nasercowe były przyjmowane w ciągu ostatnich dwóch tygodni, należy ponownie rozważyć zalecenia dotyczące początkowego dawkowania u pacjenta - zalecane jest zmniejszenie dawki.
Z uwagi na różnice w biodostępności postaci doustnej i dożylnej digoksyny, podczas zmiany
z tabletek na roztwór do wstrzykiwań dożylnych, dawkowanie powinno być zmniejszone o 33%.
Dorośli i dzieci w wieku powyżej 10 lat:
Parenteralne nasycenie
Parenteralne nasycenie można stosować jedynie u pacjentów, którzy nie otrzymywali glikozydów nasercowych w ciągu ostatnich 2 tygodni:
Całkowita parenteralna dawka nasycająca: 0,5 mg do 1 mg (2 ml do 4 ml) w zależności od wieku pacjenta, masy ciała i czynności nerek.
Całkowita dawka nasycająca powinna być podawana w dawkach podzielonych - przy czym pierwsza dawka powinna stanowić połowę całkowitej dawki leku, a następne powinny być podawane co 4 do 8 godzin, oceniając efekt kliniczny przed podaniem kolejnej dawki.
Każda dawka powinna być podawana w infuzji dożylnej przez 10 do 20 minut - patrz poniżej „Sposób podawania”.
Dawka podtrzymująca
Dawkę podtrzymującą można wyliczyć korzystając z wzoru:
Gdzie:
Dawka podtrzymująca =
Dawka nasycająca × % eliminowany na dobę 100
dawka nasycająca - dawka ustalona indywidualnie dla pacjenta
% eliminowany na dobę = 14 + Ccr /5
Ccr - jest klirensem kreatyniny, korygowanym na 70 kg masy ciała lub 1,73 m2 powierzchni ciała.
Jeżeli znane jest tylko stężenie kreatyniny w osoczu, Ccr można obliczyć stosownie do wieku w przybliżeniu:
Roztwór do infuzji dożylnej przygotować bezpośrednio przed podaniem.
Jeżeli zachodzi konieczność, sporządzony roztwór można przechowywać, na odpowiedzialność użytkownika, maksymalnie przez 24 godziny w temperaturze od 2°C do 8°C, pod warunkiem, że rozcieńczenie przygotowuje się w kontrolowanych i walidowanych aseptycznych warunkach.
Niewykorzystany w ciągu 24 godzin roztwór należy wyrzucić.
Sposób podawania Podanie dożylne.
Każdą dawkę należy podawać dożylnie. Infuzję podawać przez 10 do 20 minut.
Całkowitą dawkę nasycającą należy podawać w dawkach podzielonych, przy czym około połowę dawki całkowitej należy podawać jako pierwszą dawkę, a kolejne części dawki całkowitej należy podawać w odstępach od czterech do ośmiu godzin. Przed podaniem każdej dodatkowej dawki należy przeprowadzić ocenę odpowiedzi klinicznej.
Podanie domięśniowe jest bolesne i może spowodować martwicę mięśni. Nie zaleca się podawania domięśniowego.
Szybkie wstrzyknięcie dożylne może powodować zwężenie naczyń krwionośnych, powodując wysokie ciśnienie krwi i (lub) zmniejszenie przepływu przez naczynia wieńcowe. Powolne tempo wstrzykiwania jest zatem ważne w niewydolności serca z nadciśnieniem tętniczym i w ostrym zawale mięśnia sercowego.
Nadwrażliwość na substancję czynną, inne glikozydy nasercowe lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Okresowo występujący całkowity blok serca lub blok przedsionkowo-komorowy II stopnia, zwłaszcza z napadami Stokesa-Adamsa w wywiadzie.
Niemiarowości wywołane zatruciem glikozydami nasercowymi.
Niemiarowości nadkomorowe z dodatkową drogą przewodzenia przedsionkowo-komorowego, takie jak zespół Wolffa-Parkinsona-White'a, chyba że oceniono elektrofizjologiczne właściwości dodatkowej drogi przewodzenia i jakikolwiek szkodliwy wpływ digoksyny na te cechy. Jeśli wiadomo lub podejrzewa się, że dodatkowa droga jest obecna, a nie ma nadkomorowych zaburzeń rytmu serca w wywiadzie, digoksyna jest również przeciwwskazana.
Częstoskurcz komorowy lub migotanie komór.
Kardiomiopatia przerostowa ze zwężeniem drogi odpływu komory lewej, chyba że występują migotanie przedsionków i niewydolność serca, ale nawet wtedy digoksynę należy stosować ostrożnie.
Monitorowanie
U pacjentów otrzymujących digoksynę należy okresowo oceniać stężenie elektrolitów w surowicy
i czynność nerek (stężenie kreatyniny w surowicy); częstość ocen będzie zależeć od stanu klinicznego.
Wyniki badań określających stężenie digoksyny w osoczu mogą być wyrażone w nanogramach/ml (ng/ml) lub jednostkach układu SI nanomolach/l (nmol/l). Aby dokonać przeliczenia ng/ml na nmol/l, należy pomnożyć ng/ml przez 1,28.
Stężenie digoksyny w osoczu może być oznaczane metodami radioimmunologicznymi.
Krew przeznaczoną do badania należy pobrać po upływie 6 lub więcej godzin od przyjęcia ostatniej dawki digoksyny.
Nie ma sztywnych wytycznych co do zakresu stężeń w surowicy, które są najskuteczniejsze.
Analizy wykonywane post hoc u pacjentów z niewydolnością serca biorących udział w badaniach Digitalis Investigation Group wykazały, że optymalne stężenie digoksyny w osoczu wynosi od 0,5 ng/ml (0,64 nmoli/l) do 1,0 ng/ml (1,28 nmoli/l).
Objawy toksyczności digoksyny występują częściej, gdy stężenie digoksyny w osoczu jest większe niż 2 ng/ml, mogą jednak pojawić się przy niższych stężeniach w osoczu. Jednak stężenie digoksyny
w surowicy należy interpretować biorąc pod uwagę ogólny stan kliniczny.
Toksyczność może wystąpić przy mniejszych stężeniach digoksyny w surowicy. Przy podejmowaniu decyzji, czy objawy pacjenta są spowodowane stosowaniem digoksyny, ważnymi czynnikami są stan kliniczny, stężenie potasu w surowicy oraz czynność tarczycy (patrz punkt 4.9).
Oznaczenie stężenia digoksyny w surowicy może być bardzo pomocne w podjęciu decyzji o dalszym leczeniu digoksyną, ale inne glikozydy i substancje endogenne podobne do digoksyny, w tym metabolity digoksyny, mogą zaburzać wyniki badań i należy zawsze uważać na wartości, które nie wydają się współmierne do stanu klinicznego pacjenta. Bardziej odpowiednie mogą być obserwacje podczas tymczasowego wstrzymania stosowania digoksyny.
Zaburzenia rytmu
Toksyczne działania digoksyny mogą wywołać zaburzenia rytmu, z których niektóre mogą także przypominać niemiarowości będące wskazaniem do zastosowania tego leku. Przykładowo, częstoskurcz przedsionkowy ze zmiennym blokiem przedsionkowo-komorowym wymaga zachowania szczególnej ostrożności, gdyż klinicznie rytm ten przypomina migotanie przedsionków.
Korzystny wpływ digoksyny na zaburzenia rytmu serca wynika ze stopnia blokady przewodzenia przedsionkowo-komorowego. Jednakże, gdy istnieje już niepełny blok przedsionkowo-komorowy, należy spodziewać się szybkiego pogłębienia bloku serca. W całkowitym bloku serca, zastępczy rytm serca (idiowentrykularny) może być stłumiony.
Zaburzenia zatokowo-przedsionkowe
W niektórych przypadkach zatokowo-przedsionkowych zaburzeń przewodnictwa (tj. zespół chorego węzła) digoksyna może wywoływać lub nasilać bradykardię zatokową bądź powodować blok zatokowo-przedsionkowy.
Jeżeli pacjent stosował glikozydy nasercowe w okresie ostatnich dwóch tygodni, należy ponownie rozważyć zalecenia dotyczące dawek nasycających i zastosować mniejszą dawkę.
U pacjentów w podeszłym wieku lub ze zmniejszonym klirensem nerkowym należy rozważyć zmniejszenie dawek, zarówno nasycających, jak i podtrzymujących.
Hipokaliemia
Hipokaliemia uwrażliwia mięsień sercowy na działanie glikozydów nasercowych.
Hipoksja, hipomagnezemia i hiperkalcemia
Hipoksja, hipomagnezemia i znacznego stopnia hiperkalcemia zwiększają wrażliwość mięśnia sercowego na glikozydy nasercowe.
Choroba tarczycy
Podawanie digoksyny pacjentom z chorobą tarczycy wymaga zachowania ostrożności.
W niedoczynności tarczycy dawki nasycające i podtrzymujące digoksyny powinny być zmniejszone. W nadczynności tarczycy powstaje względna oporność na digoksynę i należy wtedy zwiększyć dawkę; w miarę uzyskiwania kontroli nadczynności tarczycy, dawkowanie digoksyny należy zmniejszać.
Zespół złego wchłaniania
Pacjenci z zespołem złego wchłaniania lub po zabiegach rekonstrukcyjnych na przewodzie pokarmowym mogą wymagać większych dawek digoksyny.
Kardiowersja elektryczna
W przypadku toksycznego działania digoksyny znacznie zwiększa się ryzyko wywołania niebezpiecznych zaburzeń rytmu podczas wykonywania kardiowersji prądem stałym i jest ono proporcjonalne do zastosowanej w kardiowersji energii.
Jeśli u pacjenta stosującego digoksynę planowana jest kardiowersja elektryczna, produkt należy odstawić minimum 24 godziny przed zabiegiem. W stanach nagłych, takich jak zatrzymanie krążenia, gdy ma być zastosowana kardiowersja, należy użyć najmniejszej skutecznej energii. Nie należy stosować kardiowersji elektrycznej u pacjentów z niemiarowościami, które pojawiły się po zastosowaniu glikozydów nasercowych.
Zawał mięśnia sercowego
Podawanie digoksyny w okresie bezpośrednio po zawale serca nie jest przeciwwskazane. Jednak stosowanie leków inotropowych u niektórych pacjentów w takich sytuacjach może skutkować niepożądanym zwiększeniem zapotrzebowania mięśnia sercowego na tlen oraz niedokrwieniem, a wyniki niektórych retrospektywnych badań sugerują, że podanie digoksyny może wiązać się ze zwiększonym ryzykiem zgonu. Stwierdzono, że u pacjentów z hipokaliemią po zawale mięśnia sercowego i niestabilnych hemodynamicznie istnieje ryzyko wystąpienia niemiarowości. Należy
również pamiętać o ograniczeniach nałożonych następnie na stosowanie kardiowersji prądem stałym.
Skrobiawica serca
Zasadniczo należy unikać leczenia digoksyną pacjentów z niewydolnością serca ze współistniejącą skrobiawicą serca. Jeżeli jednak zastosowanie innego alternatywnego leczenia nie jest możliwe, digoksynę należy stosować ostrożnie, kontrolując rytm komorowy u pacjentów ze skrobiawicą serca i migotaniem przedsionków.
Zapalenie mięśnia sercowego
Digoksyna może rzadko wywołać skurcz naczyń i dlatego należy unikać jej stosowania u pacjentów z zapaleniem mięśnia sercowego.
Choroba Beri-beri
Pacjenci z chorobą Beri-beri serca mogą nie wykazywać właściwej odpowiedzi na digoksynę, dopóki niedobór tiaminy nie zostanie jednocześnie leczony.
Zaciskające zapalenie osierdzia
Digoksyny nie należy stosować w przypadku zaciskającego zapalenia osierdzia, chyba że jest stosowana w celu uzyskania kontroli rytmu komorowego w migotaniu przedsionków lub poprawy zaburzeń skurczowych serca.
Tolerancja wysiłkowa
Digoksyna poprawia tolerancję wysiłkową u pacjentów z zaburzeniami czynności skurczowej lewej komory i prawidłowym rytmem zatokowym. Może to być związane, ale nie musi, z poprawą profilu hemodynamicznego. Stwierdzono, że korzyści dla pacjentów z niemiarowościami nadkomorowymi są bardziej znaczące w spoczynku niż po wysiłku.
Odstawienie digoksyny
U pacjentów stosujących leki moczopędne i inhibitory konwertazy angiotensyny lub tylko leki moczopędne, odstawienie digoksyny powoduje pogorszenie stanu klinicznego.
Elektrokardiogram
Zastosowanie dawek terapeutycznych digoksyny może powodować wydłużenie odstępu PR i obniżenie odcinka ST w elektrokardiogramie.
Digoksyna może powodować fałszywie dodatnie zmiany w zespołach ST - T na obrazie EKG podczas przeprowadzania testów wysiłkowych. Zmiany te odzwierciedlają spodziewane działanie produktu
i nie wskazują na jego toksyczność.
Przewlekła zastoinowa niewydolność serca
Pomimo że u wielu pacjentów z przewlekłą zastoinową niewydolnością serca doraźne zastosowanie digoksyny przynosi korzyści, u wielu z tych pacjentów nie obserwuje się stałej, znamiennej lub trwałej poprawy hemodynamicznej. Dlatego też istotna jest ocena indywidualnej reakcji każdego pacjenta przy długookresowej terapii digoksyną.
Ciężka choroba układu oddechowego
Pacjenci z ciężką niewydolnością oddechową mogą wykazywać zwiększoną wrażliwość mięśnia sercowego na glikozydy naparstnicy.
Ostrzeżenia dotyczące substancji pomocniczych
Ten produkt leczniczy zawiera 202,5 mg alkoholu (etanolu 96%) w każdej ampułce (2 ml). Ilość alkoholu w ampułce (2 ml) tego produktu jest równoważna mniej niż 5 ml piwa lub 2 ml wina. Mała ilość alkoholu w tym produkcie nie będzie powodowała zauważalnych skutków.
Produkt zawiera 414,8 mg glikolu propylenowego w każdym ml co odpowiada 829,6 mg glikolu propylenowego w każdej ampułce (2 ml). Jednoczesne podawanie produktu z innymi substratami dehydrogenazy alkoholowej, takimi jak etanol może powodować ciężkie działania niepożądane
u noworodków oraz działania niepożądane u dzieci w wieku poniżej 5 lat.
Dzieci z zaburzeniami czynności nerek lub wątroby powinny pozostawać pod kontrolą lekarza
z powodu różnych działań niepożądanych przypisywanych glikolowi propylenowemu, takich jak zaburzenia czynności nerek (ostra martwica kanalików nerkowych), ostra niewydolność nerek
i zaburzenia czynności wątroby.
Produkt zawiera 1,16 mg sodu na ampułkę (2 ml) co odpowiada 0,06% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
Produkt może być rozcieńczany - patrz punkt 6.6. Zawartość sodu pochodzącego z rozcieńczalnika powinna być brana pod uwagę w obliczeniu całkowitej zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu
w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika.
Wystąpienie interakcji zależy od stopnia wydalania leku przez nerki, wiązania przez tkanki, wiązania z białkami osocza, dystrybucji w organizmie, stopnia wchłaniania digoksyny i wrażliwości na tę substancję. Należy wziąć pod uwagę możliwość wystąpienia interakcji podczas stosowania terapii złożonych, a w przypadkach jakichkolwiek wątpliwości należy określić stężenie digoksyny.
Digoksyna jest substratem glikoproteiny P. Zatem inhibitory glikoproteiny P mogą zwiększać stężenie digoksyny we krwi poprzez nasilanie jej wchłaniania i (lub) zmniejszanie klirensu nerkowego (patrz punkt 5.2.). Indukcja glikoproteiny P może powodować zmniejszenie stężenia digoksyny w osoczu.
Połączenia, których należy unikać
Leki, które przy jednoczesnym podawaniu z digoksyną mogą nasilać działanie digoksyny:
Digoksyna w skojarzeniu z lekami blokującymi receptory beta-adrenergiczne może powodować wydłużenie czasu przewodzenia przedsionkowo-komorowego.
Leki powodujące hipokaliemię lub wewnątrzkomórkowy niedobór potasu mogą powodować zwiększoną wrażliwość na digoksynę; należą do nich niektóre leki moczopędne, sole litu, kortykosteroidy oraz karbenoksolon. Podczas jednoczesnego podawania digoksyny z pętlowymi lekami moczopędnymi lub hydrochlorotiazydem należy ściśle monitorować stężenie elektrolitów w surowicy i czynność nerek.
Wapń, zwłaszcza szybko wstrzyknięty dożylnie może wywołać ciężką niemiarowość u pacjentów stosujących digoksynę.
Leki sympatykomimetyczne mają bezpośrednie działanie chronotropowe dodatnie, które może sprzyjać arytmiom serca, a także może prowadzić do hipokaliemii, która może prowadzić do arytmii serca lub nasilić arytmię serca. Jednoczesne stosowanie digoksyny i sympatykomimetyków może zwiększać ryzyko zaburzeń rytmu serca.
Skojarzenia leków wymagające zachowania ostrożności
Leki, które przy jednoczesnym podawaniu z digoksyną mogą nasilać działanie digoksyny:
Amiodaron, kanagliflozyna, daklataswir, flibanseryna, flekainid, gentamycyna, indometacyna, itrakonazol, prazosyna, propafenon, chinidyna, chinina, spironolakton, antybiotyki makrolidowe (np. erytromycyna i klarytromycyna), tetracyklina (i prawdopodobnie inne antybiotyki), izawukonazol, iwakaftor, trimetoprim, alprazolam, propantelin, mirabegron, nefazodon, atorwastatyna, cyklosporyna, epoprostenol (przemijająco), antagoniści receptora wazopresyny (tolwaptan i koniwaptan), karwedylol, rytonawir/rytonawir w skojarzeniach, taleprewir, dronedaron, ranolazyna, symeprewir, telmisartan, lapatynib, tikagrelor, wandetanib, welpataswir, wenetoklaks i wemurafenib.
Należy zachować ostrożność, gdy którykolwiek z powyższych produktów leczniczych jest stosowany w skojarzeniu z digoksyną. Należy kontrolować stężenie digoksyny w surowicy i wykorzystywać do dostosowania dawek digoksyny.
Jednoczesne stosowanie digoksyny i sennozydów może wiązać się z umiarkowanym zwiększeniem ryzyka toksyczności digoksyny u pacjentów z niewydolnością serca.
Pacjenci otrzymujący digoksynę są bardziej podatni na skutki hiperkaliemii nasilonej przez suksametonium.
Jednoczesne podawanie lapatynibu i doustnie digoksyny powodowało zwiększenie AUC digoksyny. Należy zachować ostrożność podając digoksynę jednocześnie z lapatynibem.
Leki modyfikujące napięcie mięśniowe tętniczek aferentnych (doprowadzających) i eferentnych (odprowadzających) mogą wpływać na filtrację kłębuszkową. Inhibitory konwertazy angiotensyny (ACEI) i antagoniści receptora angiotensyny (ARB) zmniejszają skurcz tętniczek odprowadzających, w którym pośredniczy angiotensyna II, podczas gdy niesteroidowe leki przeciwzapalne (NLPZ)
i inhibitory enzymu cyklooksygenazy-2 (COX-2) zmniejszają wazodylatację tętniczek aferentnych, w której pośredniczy prostaglandyna. ARB, ACEI, NLPZ i inhibitory COX-2 nie zmieniały znacząco farmakokinetyki digoksyny, ani nie zmieniały parametrów farmakokinetycznych w spójny sposób.
Jednak leki te mogą modyfikować czynność nerek u niektórych pacjentów, powodując wtórne zwiększenie stężenia digoksyny.
Antagoniści kanału wapniowego mogą zwiększać lub nie zmieniać stężenia digoksyny w osoczu. Werapamil, felodypina i tiapamil zwiększają stężenie digoksyny w osoczu. Nifedypina i diltiazem mogą zwiększać lub nie wpływać na stężenie digoksyny w osoczu. Isradypina nie zmienia stężenia digoksyny w osoczu. Wiadomo również, że antagoniści kanału wapniowego, zwłaszcza diltiazem
i werapamil, wywierają depresyjny wpływ na przewodzenie w węzłach zatokowo-przedsionkowych i przedsionkowo-komorowych.
Inhibitory pompy protonowej (PPI) są w stanie zwiększyć stężenie digoksyny w osoczu poprzez hamowanie jej wypływu. Omeprazol hamuje metabolizm digoksyny w przewodzie pokarmowym, co powoduje zwiększenie stężenia digoksyny w osoczu. Podobne działanie zgłaszano w mniejszym stopniu w przypadku pantoprazolu i rabeprazolu.
Skojarzenia leków, które podczas jednoczesnego podawania mogą zmniejszać działanie digoksyny:
Leki zobojętniające sok żołądkowy, niektóre środki przeczyszczające, kaolin-pektyna, akarboza, neomycyna, penicylamina, ryfampicyna, niektóre cytostatyki, metoklopramid, sulfasalazyna, adrenalina, salbutamol, cholestyramina, fenytoina, ziele dziurawca zwyczajnego (Hypericum perforatum).
Bupropion i jego główny metabolit, z digoksyną i bez digoksyny, pobudzały transport digoksyny, w którym pośredniczy OATP4C1. Digoksyna została zidentyfikowana jako substrat dla aOATP4C1 po stronie podstawno-bocznej proksymalnych kanalików nerkowych. Wiązanie bupropionu i jego metabolitów z OATP4C1 prawdopodobnie może zwiększyć transport digoksyny, a tym samym zwiększyć wydalanie digoksyny przez nerki.
Inne interakcje
Milrinon nie wpływa na stężenie digoksyny w surowicy w stanie stacjonarnym.
Ciąża
Stosowanie digoksyny w ciąży nie jest przeciwwskazane, jednak dawkowanie i kontrola mogą być mniej przewidywalne u kobiet w ciąży niż u kobiet nie będących w ciąży, przy czym niektóre pacjentki mogą wymagać stosowania większych dawek w okresie ciąży. Stosowanie digoksyny
u kobiet w ciąży jest dopuszczalne tylko w przypadku, jeśli w opinii lekarza korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu.
Pomimo dużego narażenia na produkty naparstnicy przed urodzeniem, nie zaobserwowano znamiennych działań niepożądanych u płodu lub noworodka, gdy stężenia digoksyny w osoczu utrzymywane są w zakresie normy. Przypuszcza się, że digoksyna poprzez bezpośredni wpływ na błonę mięśniową macicy, może być przyczyną wcześniactwa i małej masy urodzeniowej dzieci. Digoksyna podawana matce może być stosowana do leczenia częstoskurczu u płodu oraz zastoinowej niewydolności serca.
Odnotowano działania niepożądane u płodów, w przypadkach gdy u ich matek stwierdzano zatrucie digoksyną.
Karmienie piersią
Digoksyna przenika do mleka kobiecego w minimalnych ilościach, dlatego karmienie piersią nie jest przeciwwskazane.
Płodność
Nie ma danych dotyczących wpływu na płodność digoksyny. Nie ma danych na temat działania teratogennego digoksyny.
Obserwowano zaburzenia ze strony ośrodkowego układu nerwowego i zaburzenia widzenia u pacjentów przyjmujących digoksynę, dlatego powinni oni zachować ostrożność podczas prowadzenia pojazdów i obsługiwania maszyn i wykonywania niebezpiecznych czynności.
Podsumowanie profilu bezpieczeństwa
Zasadniczo działania niepożądane digoksyny są zależne od dawki i występują po dawkach większych niż wymagane do uzyskania działania terapeutycznego.
W związku z tym działania niepożądane występują rzadziej, gdy digoksyna jest stosowana
w zalecanym zakresie dawek lub stężeniach terapeutycznych w surowicy, a także gdy bierze się pod uwagę stosowane jednocześnie leki i stan pacjenta.
Tabelaryczny wykaz działań niepożądanych
Poniżej wymienione działania niepożądane pogrupowano, biorąc pod uwagę podział na układy oraz częstość występowania.
Częstość występowania zdefiniowano w następujący sposób: bardzo często (≥1/10), często (≥1/100 do
<1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko
(<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych). Częstość określana jako bardzo często, często i niezbyt często była zasadniczo podana na podstawie badań klinicznych. Wzięto również pod uwagę przypadki po podaniu placebo. Działania niepożądane występujące z częstością rzadko i bardzo rzadko, a także pojedyncze przypadki, zamieszczono
w oparciu o raporty otrzymane w ramach nadzoru nad bezpieczeństwem farmakoterapii.
Klasyfikacja układów i narządów | Częstość | Działania niepożądane |
Zaburzenia krwi i układu chłonnego | Bardzo rzadko | Małopłytkowość |
Zaburzenia metabolizmu i odżywiania | Bardzo rzadko | Anoreksja |
Zaburzenia psychiczne | Niezbyt często Bardzo rzadko | Depresja Psychoza, apatia, splątanie |
Zaburzenia układu nerwowego | Często Bardzo rzadko | Zaburzenia ośrodkowego układu nerwowego, zawroty głowy Ból głowy |
Zaburzenia oka | Często | Zaburzenia widzenia (niewyraźne widzenie lub widzenie w żółtym kolorze). |
Zaburzenia serca | Często Bardzo rzadko | Arytmia, zaburzenia przewodzenia, bigeminia, trigeminia, wydłużenie odstępu PR, bradykardia zatokowa. Tachyarytmia nadkomorowa, częstoskurcze przedsionkowe (z blokiem lub bez bloku serca), częstoskurcz nadkomorowy (tachykardia węzłowa), arytmia komorowa, przedwczesne skurcze komorowe, obniżenie odcinka ST. |
Zaburzenia żołądka i jelit | Często Bardzo rzadko | Nudności i wymioty, biegunka. Niedokrwienie jelit, martwica jelit |
Zaburzenia skóry i tkanki podskórnej | Często | Wysypka skórna* |
Zaburzenia układu rozrodczego i piersi | Bardzo rzadko | Ginekomastia* |
Zaburzenia ogólne i stany w miejscu podania | Bardzo rzadko | Osłabienie, zmęczenie, złe samopoczucie |
* Patrz „Opis wybranych działań niepożądanych” Opis wybranych działań niepożądanych
Zaburzenia skóry i tkanki podskórnej
Wysypka skórna w postaci pokrzywki lub przypominająca płonicę; może im towarzyszyć znacznego stopnia eozynofilia.
Zaburzenia układu rozrodczego i piersi
Po długotrwałym podawaniu może wystąpić ginekomastia.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy toksyczności są zasadniczo podobne do zamieszczonych w punkcie 4.8. - Działania niepożądane, ale mogą występować częściej i o większym nasileniu.
Objawy toksyczności digoksyny występują częściej w przypadku stężenia powyżej
2,0 nanogramów/ml (2,56 nanomol/l), aczkolwiek mogą wystąpić indywidualne różnice. Jednak
w przypadku podjęcia decyzji, czy objawy występujące u pacjenta wywołane zostały przez digoksynę, należy ocenić ważne czynniki, takie jak stan kliniczny, stężenie elektrolitów w osoczu oraz czynność tarczycy (patrz punkt 4.2). U pacjentów poddawanych hemodializie stosowanie digoksyny wiąże się ze zwiększoną śmiertelnością. Najbardziej narażeni są pacjenci z małymi stężeniami potasu przed dializą.
Dorośli
Według klinicznych obserwacji, przedawkowanie digoksyny w ilości 10 do 15 mg u dorosłych bez współistniejącej choroby serca było śmiertelne dla połowy pacjentów.
W przypadku zastosowania ponad 25 mg digoksyny przez osobę dorosłą, bez choroby serca, obserwuje się zgon lub postępujące objawy toksyczne reagujące tylko na leczenie przeciwciałami Fab skierowanymi przeciw digoksynie.
Objawy ze strony serca
Objawy ze strony serca to najczęściej występujące ciężkie objawy, zarówno po zatruciu ostrym, jak
i przewlekłym. Największe nasilenie objawów ze strony serca występuje zwykle po 3 do 6 godzinach po przedawkowaniu i objawy te mogą utrzymywać się przez 24 godziny lub dłużej. Toksyczne działanie digoksyny może powodować wystąpienie różnego rodzaju niemiarowości. U niektórych pacjentów często występują jednocześnie różnego rodzaju zaburzenia rytmu serca. Mogą wystąpić napadowe częstoskurcze przedsionkowe z blokiem przedsionkowo-komorowym, przyspieszenie rytmu węzłowego, spowolnione migotanie przedsionków (z niewielkimi zmianami rytmu komór) oraz dwukierunkowa komorowa tachykardia.
Przedwczesne skurcze komorowe są zazwyczaj najwcześniej i najczęściej występującymi zaburzeniami rytmu serca. Często występują również bigeminia i trigeminia.
Bradykardia zatokowa i inne bradyarytmie występują często.
Bloki serca stopnia I, II i III i rozkojarzenie przedsionkowo-komorowe również występują często. Wczesna toksyczność może przejawiać się tylko wydłużeniem odstępu PR.
Tachykardia komorowa może być również objawem toksyczności.
Zatrzymanie serca w wyniku asystolii lub migotania przedsionków skutek zatrucia digoksyną ma zazwyczaj złe rokowanie.
Po ostrym masywnym przedawkowaniu digoksyny może wystąpić hiperkaliemia w wyniku hamowania pompy sodowo-potasowej. Hipokaliemia może przyczynić się do wystąpienia toksyczności.
Zaburzenia żołądkowo-jelitowe występują często, zarówno po przedawkowaniu ostrym, jak i przewlekłym. Według danych literaturowych objawy ze strony serca dotyczą około połowy pacjentów. Anoreksja, nudności i wymioty odnotowano u prawie 80%. Objawy te występują najczęściej we wczesnym okresie po przedawkowaniu.
Objawy neurologiczne i zaburzenia widzenia występują zarówno po zatruciu ostrym, jak
i przewlekłym. Zawroty głowy, różnego rodzaju zaburzenia ośrodkowego układu nerwowego, zmęczenie, złe samopoczucie występują bardzo często. Najczęstszym zaburzeniem widzenia jest zaburzenie widzenia barw (dominuje widzenie w żółtym kolorze). Objawy neurologiczne i zaburzenia widzenia mogą utrzymywać się nawet po ustąpieniu innych objawów zatrucia.
Po zatruciu przewlekłym mogą dominować objawy niespecyficzne, inne niż ze strony serca, takie jak złe samopoczucie i osłabienie.
Dzieci
W przypadku dzieci w wieku od 1 do 3 lat bez współistniejącej choroby serca po przedawkowaniu digoksyny w ilości od 6 do 10 mg odnotowano zgon u połowy pacjentów.
W przypadku przyjęcia digoksyny w dawce powyżej 10 mg u dzieci w wieku od 1 do 3 lat bez stwierdzonej choroby serca, zaniechanie podania przeciwciał Fab może zakończyć się zgonem dziecka.
Większość objawów toksyczności po podaniu digoksyny u dzieci występuje krótko po fazie nasycającej.
Zaburzenia serca
Niemiarowości lub mieszane rodzaje niemiarowości, które występują u dorosłych, mogą wystąpić u dzieci. Zatokowa tachykardia, nadkomorowa tachykardia oraz szybkie migotanie przedsionków występuje rzadziej u dzieci w porównaniu z dorosłymi.
U dzieci bardziej prawdopodobne jest wystąpienie zaburzeń przewodzenia przedsionkowo- komorowego lub zatokowej bradykardii.
Ektopia komorowa występuje rzadziej, jednak w przypadku masywnego przedawkowania, odnotowywano ektopię komorową, przyspieszenie czynności komór i migotanie przedsionków.
U noworodków częstymi objawami toksyczności są bradykardia zatokowa lub zatrzymanie zatokowe i (lub) wydłużenie odstępu PR. Bradykardia zatokowa częściej występuje u niemowląt i małych dzieci. U starszych dzieci bloki AV są najczęstszymi zaburzeniami przewodzenia.
Każdą arytmię lub zmiany przewodzenia w sercu, które rozwijają się u dziecka przyjmującego digoksynę należy przypisywać digoksynie do momentu wyjaśnienia przyczyn.
Inne objawy, niezwiązane z sercem
Częstość innych działań niepożądanych niż ze strony serca jest podobna do obserwowanych
u dorosłych: zaburzenia żołądkowo-jelitowe, ośrodkowego układu nerwowego, zaburzenia widzenia. Nudności i wymioty nie występują często u niemowląt i małych dzieci.
Działania niepożądane obserwowane po stosowaniu zalecanych dawek - zmniejszenie masy ciała
u starszych dzieci i brak prawidłowego rozwoju i wzrostu u niemowląt i małych dzieci, bóle brzucha związane z niedokrwieniem tętnicy krezkowej, senność i zaburzenia zachowania, w tym zaburzenia psychotyczne odnotowywano po przedawkowaniu.
Leczenie
Po połknięciu, przypadkowym lub samobójczym digoksyny należy przeprowadzić płukanie żołądka, aby zapobiec dalszemu wchłanianiu.
Płukanie żołądka zwiększa napięcie nerwu błędnego i może wywołać lub nasilić arytmię. Jeśli wykonuje się płukanie żołądka, należy rozważyć wstępne leczenie atropiną. Leczenie przeciwciałami Fab zwykle powoduje, że płukanie żołądka nie jest konieczne. W rzadkich przypadkach, w których wskazane jest płukanie żołądka, powinno być ono wykonywane wyłącznie przez osoby
z odpowiednim przeszkoleniem i wiedzą specjalistyczną.
Pacjenci po połknięciu dużej ilości digoksyny powinni otrzymać dużą dawkę węgla aktywnego, aby zapobiec wiązaniu się i wchłanianiu digoksyny w jelitach podczas krążenia jelitowo-jelitowego.
Jeśli występuje hipokaliemia, należy ją wyrównać, podając doustnie lub dożylnie potas, w zależności od pilności sytuacji. W przypadkach połknięcia znacznych ilości digoksyny może pojawić się hiperkaliemia w wyniku uwalniania potasu z mięśni szkieletowych. Dlatego też przed podaniem potasu w przypadku przedawkowania digoksyny, należy określić stężenie potasu w osoczu.
W przypadku wystąpienia bradyarytmii można podać atropinę, ale konieczne może okazać się przeprowadzenie stymulacji serca. Niemiarowości komorowe mogą reagować na podawanie lidokainy lub fenytoiny.
Dializa nie jest skuteczną metodą usuwania digoksyny z organizmu.
Przeciwciała Fab skierowane przeciw digoksynie są swoistym leczeniem toksyczności digoksyny i są bardzo skuteczne. Po podaniu dożylnym przeciwciał specyficznych dla digoksyny (owczych) (Fab) następuje szybkie odwrócenie powikłań związanych z poważnym zatruciem digoksyną, digitoksyną
i pokrewnymi glikozydami. Szczegółowe informacje można znaleźć w drukach informacyjnych dołączonych do opakowania przeciwciał Fab.
Grupa farmakoterapeutyczna: leki stosowane w chorobach serca, glikozydy nasercowe, kod ATC: C01AA05
Digoksyna zwiększa kurczliwość mięśnia sercowego. Działanie to jest proporcjonalne do dawki w dolnym jej zakresie, dlatego już przy stosowaniu małych dawek osiągany jest pewien efekt;
obserwowany jest on nawet w zdrowym mięśniu sercowym, chociaż nie przynosi on wtedy żadnych korzyści fizjologicznych. Główne działanie digoksyny polega na swoistym blokowaniu trifosfatazy adenozynowej, a przez to wymiany jonów sodowych i potasowych (Na+/K+), w wyniku czego zmieniona dystrybucja jonów po obu stronach błony komórkowej powoduje zwiększenie napływu jonów wapnia i zwiększenie stężenia wapnia w czasie sprzężenia pobudzenie-skurcz. Siła działania digoksyny zwiększa się przy małym stężeniu jonów potasu zewnątrzkomórkowego, natomiast hiperkaliemia wywiera przeciwne działanie.
Digoksyna hamuje mechanizm wymiany jonów Na+/K+ w komórkach autonomicznego układu nerwowego, co prowadzi do pośredniego wpływu na czynność serca. W wyniku nasilenia bodźców eferentnych z nerwu błędnego zmniejsza się napięcie układu współczulnego i zwalnia się przewodzenie bodźców w przedsionkach i węźle przedsionkowo-komorowym. Stąd główne korzystne działanie digoksyny polega na zwolnieniu pracy komór.
Dożylne podanie dawki nasycającej powoduje znaczące działanie farmakologiczne w ciągu 5 do
30 minut, podczas gdy po podaniu doustnym początek działania występuje w ciągu 0,5 do 2 godzin.
Badanie PROVED zaprojektowano w celu określenia skuteczności digoksyny u 88 pacjentów
z przewlekłą, stabilną łagodną do umiarkowanej niewydolnością serca. Odstawienie digoksyny lub kontynuację jej podawania przeprowadzono w prospektywnym, randomizowanym, podwójnie zaślepionym, wieloośrodkowym badaniu kontrolowanym placebo z udziałem pacjentów z przewlekłą, stabilną łagodną lub umiarkowaną niewydolnością serca, wtórną do dysfunkcji skurczowej lewej komory, którzy mieli prawidłowy rytm zatokowy i otrzymywali przez długi czas doraźne leczenie lekami moczopędnymi i digoksyną. Pacjenci wykluczeni z leczenia digoksyną wykazywali pogorszenie maksymalnej zdolności wysiłkowej (p=0,003), zwiększoną częstość niepowodzeń leczenia (p=0,039) oraz skrócenie czasu niepowodzenia leczenia (p=0,037). Pacjenci, którzy nadal otrzymywali digoksynę, mieli mniejszą masę ciała (p=0,044) i częstość akcji serca (p=0,003) oraz wyższą frakcję wyrzutową lewej komory (p=0,016). Całkowity odsetek uczestników, u których wystąpiło jedno lub więcej zdarzeń niepożądanych, był podobny w obu grupach: 59% w grupie placebo i 69% w grupie digoksyny. Rodzaje zdarzeń niepożądanych były nieokreślone.
W badaniu RADIANCE zbadano skutki odstawienia digoksyny u stabilnych pacjentów w klasie II i III wg NYHA, którzy otrzymywali leki moczopędne i inhibitory ACE. Początkowo ustabilizowano
178 pacjentów za pomocą skojarzenia kaptoprylu lub enalaprylu, leków moczopędnych i digoksyny, a następnie przydzielono losowo do kontynuacji leczenia digoksyną lub zamiany na placebo.
Względne ryzyko pogorszenia choroby w grupie placebo wynosiło 5,9 w porównaniu z grupą digoksyny. Odstawieniu digoksyny towarzyszyły nasilenie objawów, zmniejszona tolerancja wysiłku oraz pogorszenie jakości życia, co wskazuje, że u pacjentów z niewydolnością serca ryzyko związane z odstawieniem leku było znaczne pomimo kontynuacji terapii lekami moczopędnymi i inhibitorami ACE. U około 56% w grupie placebo i 49% w grupie digoksyny wystąpiły nieokreślone działania niepożądane.
W badaniu DIG 6 800 pacjentów z niewydolnością serca zostało losowo przydzielonych do grupy otrzymującej digoksynę lub placebo. Nie stwierdzono różnic w śmiertelności z jakiejkolwiek
przyczyny między pacjentami leczonymi digoksyną a pacjentami, którym podawano placebo.
W grupie digoksyny zaobserwowano tendencję w kierunku zmniejszenia ryzyka zgonu związanego
z pogorszeniem niewydolności serca (współczynnik ryzyka 0,88; 95% przedział ufności, 0,77 do 1,01; p=0,06). Jednak pacjenci, którzy otrzymywali digoksynę, mieli istotnie (p<0,001) mniej przyjęć do szpitala, gdy lek był podawany z lekami moczopędnymi i inhibitorami ACE. Leczenie digoksyną była najbardziej korzystne u pacjentów z frakcją wyrzutową ≤25%, pacjentów z powiększonym sercem (współczynnik sercowo-piersiowy >0,55) oraz pacjentów w III lub IV klasie funkcjonalnej NYHA.
W badaniu DIG u 11,9% pacjentów w ramieniu digoksyny i 7,9% pacjentów w ramieniu placebo podejrzewano toksyczność digoksyny, przy czym najczęstszymi objawami były nowe epizody migotania komór, arytmia nadkomorowa, tachykardia lub zaawansowany blok przedsionkowo- komorowy.
W badaniu AFFIRM wzięło udział w sumie 4 060 pacjentów zrekrutowanych do randomizowanego, wieloośrodkowego porównania dwóch strategii leczenia u pacjentów z migotaniem przedsionków
i wysokim ryzykiem udaru lub zgonu. Pierwszorzędowym punktem końcowym była śmiertelność ogólna. Wśród pacjentów przydzielonych do terapii kontrolującej rytm (amiodaron, dizopiramid, flekainid, morycyzyna, prokainamid, propafenon, chinidyna, sotalol i połączenia tych leków) odnotowano 356 zgonów, a 310 zgonów wśród pacjentów przypisanych do kontroli częstości rytmu [β-adenolityki, antagoniści kanału wapniowego (werapamil i diltiazem), digoksyna i połączenia tych leków) (śmiertelność w ciągu pięciu lat, odpowiednio 23,8% i 21,3%; współczynnik ryzyka 1,15 [95% przedział ufności, 0,99 do 1,34]; p=0,08). Więcej pacjentów w grupie z kontrolą rytmu niż w grupie
z kontrolą częstości było hospitalizowanych, a także w grupie z kontrolą rytmu wystąpiło więcej działań niepożądanych.
Pośrednie zmiany kurczliwości mięśnia sercowego wynikają także z modyfikacji podatności żył spowodowanej przez zmienioną aktywność układu wegetatywnego oraz bezpośrednią stymulację układu żylnego. Pełna odpowiedź układu krążenia na digoksynę jest wypadkową między wymienionymi działaniami bezpośrednimi i pośrednimi i może różnić się u poszczególnych pacjentów. W obecności niektórych niemiarowości nadkomorowych, największe znaczenie ma neurogenne zwolnienie przewodzenia przedsionkowo-komorowego.
Stopień aktywacji neurohormonalnej występującej u pacjentów z niewydolnością serca związany jest z pogorszeniem klinicznym i zwiększonym ryzykiem zgonu.
Digoksyna zmniejsza aktywację zarówno układu współczulnego, jak i układu renina-angiotensyna, niezależnie od działania inotropowego i w ten sposób może zwiększać szansę przeżycia pacjenta. Nie jest jasne, czy działanie takie jest związane z bezpośrednim hamującym wpływem na układ współczulny, czy też ze zwiększeniem wrażliwości odruchu z baroreceptorów.
Wchłanianie
Po dożylnym podaniu dawki nasycającej widoczne działanie farmakologiczne pojawia się w ciągu 5 do 30 minut i osiąga maksimum w czasie 1 do 5 godzin.
Dystrybucja
Początkowa dystrybucja digoksyny z kompartmentu centralnego do obwodowego trwa zazwyczaj 6 do 8 godzin. Mogą wystąpić wahania stężenia digoksyny w osoczu, zależnie od stopnia eliminacji digoksyny z organizmu. Objętość dystrybucji jest duża (Vd = 510 litrów u zdrowych ochotników), co wskazuje na silne wiązanie digoksyny przez tkanki. Największe stężenia digoksyny występują
w sercu, wątrobie i nerkach, przy czym stężenie w sercu osiąga wartości 30-krotnie większe od stężenia we krwi obwodowej. Pomimo, że stężenie digoksyny w mięśniach szkieletowych jest znacznie mniejsze, należy pamiętać, że są one ważnym rezerwuarem produktu, gdyż stanowią 40% całkowitej masy ciała. Z niewielkiej części digoksyny krążącej w osoczu, około 25% jest związane z białkami.
Eliminacja
Digoksyna jest wydalana głównie w moczu w postaci niezmienionej.
Digoksyna jest substratem dla glikoproteiny P. Jako białko wypływające na zewnętrzną błonę enterocytów, glikoproteina P może ograniczać wchłanianie digoksyny. Glikoproteina P w kanalikach nerkowych wydaje się być ważnym czynnikiem w wydalaniu digoksyny przez nerki (patrz punkt 4.5.).
Po podaniu dożylnym digoksyny zdrowym ochotnikom, 60% do 75% dawki leku jest wydalane z moczem w czasie 6 dni. Wykazano, że całkowity klirens digoksyny jest wprost proporcjonalnie związany z czynnością nerek, a procentowa utrata dobowa odzwierciedla klirens kreatyniny.
Całkowity i nerkowy klirens digoksyny wynosi odpowiednio 193±25 ml/min i 152±24 ml/min w zdrowej populacji kontrolnej.
Okres półtrwania digoksyny w fazie końcowej eliminacji u pacjentów z prawidłową czynnością nerek wynosi 30 do 40 godzin.
Ponieważ większość digoksyny związana jest w tkankach poza krwią, nie można jej skutecznie usunąć z organizmu podczas krążenia pozaustrojowego. Tylko 3% dawki digoksyny jest usuwane
z organizmu podczas pięciu godzin hemodializy.
Dzieci i młodzież
W okresie noworodkowym klirens nerkowy digoksyny jest mniejszy, dlatego należy dokonywać korekty dawkowania. Szczególnie dotyczy to wcześniaków, gdyż klirens nerkowy odzwierciedla stopień dojrzałości nerek. Klirens digoksyny wynosi 65,6 ± 30 ml/min/1,73 m2 powierzchni ciała w wieku 3 miesięcy, w porównaniu do zaledwie 32±7 ml/min/1,73 m2 powierzchni ciała w wieku
Digoksyna nie wykazała potencjału genotoksycznego w badaniach in vitro (test Amesa i na komórkach chłoniaka myszy).
Nie ma danych dotyczących działania mutagennego lub rakotwórczego digoksyny.
Etanol 96%
Glikol propylenowy (E 1520) Disodu fosforan dwunastowodny Kwas cytrynowy jednowodny
Woda do wstrzykiwań
Nie dotyczy.
Przechowywać w temperaturze nie wyższej niż 25°C. Chronić od światła. Nie zamrażać.
Ampułki ze szkła bezbarwnego w tekturowym pudełku. 5 ampułek po 2 ml
Produkt może być podawany bez rozcieńczenia lub po rozcieńczeniu w czterokrotnej albo większej objętości roztworu do infuzji. Rozcieńczenie w mniejszej niż zalecana objętości może prowadzić do wytrącania się digoksyny.
Do rozcieńczania można zastosować następujące roztwory do infuzji:
Warszawskie Zakłady Farmaceutyczne Polfa S.A. ul. Karolkowa 22/24, 01-207 Warszawa
Pozwolenie nr R/3208
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 09.08.1969 r. Data ostatniego przedłużenia pozwolenia: 06.05. 2013 r.











