Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ml roztworu zawiera disodu fosforan dwunastowodny (Dinatrii phosphas dodecahydricus), w przeliczeniu na substancję bezwodną 32,2 mg i sodu diwodorofosforan jednowodny (Natrii dihydrogenophosphas monohydricus, w przeliczeniu na substancję bezwodną 139 mg.
Substancja pomocnicza o znanym działaniu: metylu parahydroksybenzoesan 0,5 mg Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
z zaburzeniami czynności nerek (u tych pacjentów preparat można stosować jeśli spodziewane korzyści kliniczne przewyższają ryzyko hiperfosfatemii),
otrzymujących leki moczopędne lub leki mogące spowodować zaburzenia wodno-jonowe,
ze sztucznym odbytem,
u których występują zaburzenia równowagi jonów w organizmie (w szczególności hiperfosfatemia)
– u tych pacjentów preparat należy stosować z dużą ostrożnością i zaleca się kontrolowanie stężenia jonów przed podaniem i po podaniu wlewu,
u dzieci powyżej 3 lat produkt leczniczy stosować tylko po przepisaniu przez lekarza i pod jego nadzorem, a w wieku do lat 5 stosować szczególnie ostrożnie,
u pacjentów z wodobrzuszem, zmianami błony śluzowej odbytnicy (owrzodzenia, pęknięcia),
u pacjentów osłabionych lub w podeszłym wieku.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata.
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
ENEMA, (32,2 mg + 139 mg)/ml, roztwór doodbytniczy
Dinatrii phosphas dodecahydricus + Natrii dihydrogenophosphas monohydricus
Roztwór doodbytniczy
Wskazaniami do stosowania produktu leczniczego są: zaparcia, oczyszczanie jelita grubego przed badaniami diagnostycznymi, przed i po zabiegach operacyjnych, oczyszczanie jelita ze złogów środka kontrastowego po badaniu radiologicznym oraz oczyszczanie jelita przed i po porodzie.
Roztwór należy podawać tylko w postaci wlewu doodbytniczego. Dorośli: 120 – 150 ml.
Dzieci:
o masie ciała poniżej 14 kg – 30 ml
o masie ciała od 14 do 27 kg – 60 ml
o masie ciała od 28 do 40 kg – 90 ml.
U osób odwodnionych objętość wlewu należy zmniejszyć ponieważ hipertoniczny roztwór ENEMA może spowodować dalsze odwodnienie.
Unikać powtarzania wlewów w krótkich odstępach czasu.
Nie należy stosować produktu leczniczego częściej niż raz na dobę. Stosować zgodnie z ulotką lub według zalecenia lekarza.
Produkt leczniczy podaje się doodbytniczo (per rectum) wciskając odpowiednią objętość roztworu wieczorem w dniu poprzedzającym wykonanie badania lub zabiegu operacyjnego oraz w dniu operacji. Wlew doodbytniczy w dniu poprzedzającym operację można powtórzyć w przypadku nie uzyskania pełnego oczyszczenia. Roztwór wprowadzany do odbytnicy powinien mieć temperaturę pokojową.
Po zastosowaniu produktu leczniczego należy podać pacjentowi doustnie dodatkową porcję płynów. Środków przeczyszczających nie należy stosować dłużej niż jeden tydzień.
W celu wykonania wlewu produktu leczniczego należy zmienić zakrętkę na zakrętkę z aplikatorem, która znajduje się w kartoniku jednostkowym (nie dotyczy preparatu przeznaczonego do lecznictwa zamkniętego). Zdjąć zabezpieczający kapturek i wprowadzić specjalną końcówkę do odbytnicy
kierując ją w stronę pępka. Powoli naciskać butelkę, aż do wprowadzenia jej zawartości do odbytnicy. Opakowanie zawiera nadmiar roztworu, dlatego nie trzeba całkowicie opróżniać butelki. Po dokonaniu wlewu odczekać w obranej pozycji, aż do wystąpienia uczucia parcia (2-5 minut) i dokonać
wypróżnienia.
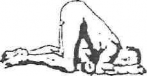
Istnieją trzy pozycje umożliwiające wykonanie wlewu produktu leczniczego ENEMA, przedstawione na rysunku poniżej. Pozycja pierwsza (Sima) i druga (kolankowo-łokciowa) wymagają pomocy drugiej osoby. Pozycja 3 umożliwia samodzielne wykonanie wlewu.


Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1
Niedrożność jelit, zarośnięcie odbytu, wrzodziejące zapalenie jelita grubego, krwawienie z jelita grubego
Choroby serca Nadciśnienie Choroby nerek
Zapalenie lub objawy zapalenia wyrostka robaczkowego Bóle brzucha, nudności, wymioty
Dzieci w wieku do 3 lat Pacjenci odwodnieni
Przed zabiegiem operacyjnym zaleca się wykonanie badania stężenia elektrolitów we krwi.
Jeśli w ciągu 5 minut od podania nie nastąpi wypróżnienie, należy skontaktować się z lekarzem, ponieważ zatrzymanie roztworu doodbytniczego może spowodować odwodnienie.
Pojawiające się krwawienia z odbytu, nasilone skurcze jelit mogą świadczyć o istotnym zaburzeniu stanu zdrowia. W takich przypadkach zaleca się przerwanie leczenia i zgłoszenie się do lekarza.
U pacjentów nieprzytomnych, o ograniczonej świadomości oraz z chorobami serca produkt leczniczy może być podawany tylko w obecności wykwalifikowanego personelu.
Ze względu na ryzyko wystąpienia zaburzeń gospodarki wodno - elektrolitowej i kwasowo – zasadowej takich jak hipernatremia, hiperfosfatemia, hipokalcemia, hipokaliemia i kwasica należy zachować specjalne środki ostrożności stosując produkt leczniczy u pacjentów:
W przypadku podejrzenia zaburzeń elektrolitowych oraz u pacjentów, u których może wystąpić hiperfosfatemia, poziom elektrolitów powinien być monitorowany przed zastosowaniem i po zastosowaniu produktu leczniczego ENEMA.
Należy poinformować pacjenta, aby po zastosowaniu wlewu oczekiwał płynnych stolców oraz
o konieczności przyjmowania dużej ilości płynów, w celu uniknięcia odwodnienia.
Powtarzające się i długotrwałe stosowanie produktu leczniczego ENEMA może doprowadzić do przyzwyczajenia.
U pacjentów stosujących leki blokujące kanały wapniowe, leki moczopędne, preparaty litu, lub inne leki mogące wpływać na zmiany stężenia elektrolitów we krwi może wystąpić hiperfosfatemia, hipokalcemia, hipokaliemia, odwodnienie z towarzyszącą hipernatremią lub kwasicą.
Ze względu na istniejący związek pomiędzy występowaniem hipernatremii, a obniżonym poziomem litu w surowicy krwi, jednoczesne stosowanie produktu leczniczego ENEMA i preparatów litu może skutkować obniżeniem poziomu litu w surowicy krwi, a tym samym obniżeniem skuteczności
preparatów litowych.
Badania na zwierzętach dotyczące wpływu na przebieg ciąży, rozwój zarodka/płodu, przebieg porodu i (lub) rozwój pourodzeniowy (patrz 5.3) są niewystarczające. Potencjalne zagrożenie dla człowieka nie jest znane. Ze względu na ryzyko wystąpienia zaburzeń elektrolitowych nie zaleca się stosowania produktu leczniczego ENEMA w czasie ciąży oraz w okresie karmienia piersią. Wyjątek stanowi pojedyncza aplikacja leku kobietom przed i po porodzie.
Ze względu na możliwość przenikania fosforanów sodowych do mleka matki zaleca się odrzucenie odciągniętego pokarmu do 24 godzin po zastosowaniu wlewu.
Produkt leczniczy ENEMA nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Działania niepożądane zostały wymienione poniżej zgodnie z klasyfikacją układów i narządów i konwencją klasyfikowania częstości występowania przyjętymi w słowniku MedDRA:
bardzo często: (≥1/10)
często: (≥1/100 do <1/10)
niezbyt często: (≥1/1 000 do <1/100)
rzadko: (≥1/10 000 do <1/1 000)
bardzo rzadko: (<1/10 000)
częstość nieznana: (częstość nie może być określona na podstawie dostępnych danych).
Częstość nieznana:
Zaburzenia metabolizmu i odżywiania
Hiperfosfatemia, hipokaliemia oraz kwasica metaboliczna. Przemijająca hipokalcemia i hipernatremia, a w konsekwencji odwodnienie. Produkt leczniczy ma jednak obniżoną zawartość fosforanów, co
zmniejsza ryzyko wystąpienia zaburzeń elektrolitowych. Ponadto, ENEMA jest produktem leczniczym aplikowanym sporadycznie, a ewentualnie pojawiające się zaburzenia gospodarki wodno- elektrolitowej mają zazwyczaj charakter przejściowy.
Zaburzenia ogólne i stany w miejscu podania
Podrażnienie błony śluzowej odbytu, dreszcze, pęcherze, kłucie, świąd odbytu, ból.
Zaburzenia żołądka i jelit
Nudności, wymioty, bóle brzucha, wzdęcia, biegunka.
Częste stosowanie może prowadzić do zaburzeń czynności jelita grubego.
Zaburzenia układu immunologicznego
Reakcje nadwrażliwości np. pokrzywka, świąd.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C,
02-222 Warszawa,
tel.: + 48 22 49 21 301,
faks: + 48 22 49 21 309,
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Produkt leczniczy dostępny jest w jednorazowym opakowaniu, co wyklucza możliwość
przedawkowania. Jednakże u pacjentów, u których występują bezwzględne przeciwwskazania oraz u pacjentów szczególnie wrażliwych może dochodzić do zaburzenia stężenia elektrolitów, kwasicy metabolicznej oraz odwodnienia. Mogą pojawić się również zaburzenia czynności układu krążenia oraz układu oddechowego. W przypadku wystąpienia powyższych objawów należy zastosować leczenie objawowe i doprowadzić do normalizacji stężenia elektrolitów.
Zanotowano przypadki śmiertelne związane z zaburzeniami wodno-elektrolitowymi w wyniku zastosowania tego typu produktów w nadmiernych dawkach, podania dzieciom lub pacjentom z zaparciem.
Grupa farmakoterapeutyczna: przewód pokarmowy i metabolizm; leki przeczyszczające; wlewki doodbytnicze; fosforany sodu; kod ATC: A06AG01
Produkt leczniczy o działaniu oczyszczającym jelito grube. ENEMA jest hipertonicznym roztworem disodu fosforanu dwunastowodnego i sodu diwodorofosforanu jednowodnego podawanym drogą
doodbytniczą. Poprzez działanie osmotyczne w świetle jelita grubego zapobiega wchłanianiu wody powodując zmiękczenie mas kałowych. Zwiększenie objętości i zmiękczenie mas kałowych prowadzi do natychmiastowego pobudzenia odruchu defekacji.
Po podaniu doodbytniczym niewielkie ilości substancji czynnych produktu leczniczego mogą ulegać wchłanianiu do krążenia ogólnego. Wchłonięte do krwi jony fosforanowe przedostają się do
przestrzeni pozanaczyniowej i śródkomórkowej, a następnie są wydalane z moczem i w mniejszym stopniu z kałem.
Brak przedklinicznych danych istotnych dla lekarza przepisującego produkt leczniczy, które nie byłyby wymienione w innych punktach Charakterystyki Produktu Leczniczego.
Brak danych wskazujących na toksyczny wpływ zastosowania substancji czynnych produktu leczniczego ENEMA w dawkach leczniczych na rozród u zwierząt.
Metylu parahydroksybenzoesan Woda oczyszczona
Nie dotyczy.
Przechowywać w temperaturze poniżej 25°C.
Butelka z zakrętką zawierająca 150 ml płynu oraz wymienna zakrętka z aplikatorem umożliwiającym łatwe wyciśnięcie zawartości, umieszczone w tekturowym pudełku.
Dla potrzeb lecznictwa zamkniętego:
Butelka zawierająca 150 ml płynu zakręcona zakrętką, w którą wmontowany jest aplikator umożliwiający łatwe wyciśnięcie zawartości – pakowane po 50 szt. w karton zbiorczy.
Brak specjalnych wymagań.
Laboratorium Galenowe Olsztyn Sp. z o.o. ul. Spółdzielcza 25A
11-001 Dywity
Pozwolenie nr R/2987
/ DATA PRZEDŁUŻENIA POZWOLENIA
30.06.1999 r./12.08.2004 r./10.06.2005 r./ 03.12.2008r./ 09.05.2014 r.











