Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Leczenie hipokaliemii.
Leczenie zatrucia glikozydami naparstnicy.
Jako dodatek elektrolitowy do płynów infuzyjnych nawadniających lub służących żywieniu pozajelitowemu.
Produkt Kalium chloratum WZF 15% przeznaczony jest dla pacjentów, u których nie jest możliwe zastosowanie doustnych preparatów potasu.
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie Objawy przedawkowania
Eliminacja z diety produktów bogatych w potas, odstawienie leków zawierających potas i sprzyjających hiperkaliemii (patrz punkt 4.5).
Stabilizacja miokardium: dożylnie podać 20 ml 10% glukonianu wapnia lub 10 ml 10%
chlorku wapnia w ciągu 2-5 minut. Wapń działa antagonistycznie do potasu i poprawia zapis EKG w ciągu kilku minut (nie obniża kaliemii). Podczas podawania leku pacjenta należy monitorować. Dawkę leku można powtórzyć, jeżeli zmiany w EKG nie ustępują. Metoda ta zabezpiecza pacjenta tymczasowo – należy następnie zastosować metody eliminacyjne. Jeżeli pacjent otrzymywał glikozydy naparstnicy, dożylne podanie wapnia jest bezwzględnie przeciwwskazane.
Transport potasu do wnętrza komórek (jest to również tymczasowa ochrona przed hiperkaliemią – po niej należy zastosować metody eliminacji potasu z ustroju):
Podać dożylnie 300 do 500 ml/godz. 10% roztworu glukozy zawierającego
10 do 20 j.m. insuliny/1000 ml. Kaliemia obniża się w ciągu kilkunastu minut.
Jeżeli u pacjenta występuje kwasica metaboliczna należy podać dożylnie wodorowęglan sodu w dawce 0,5 mmol/kg mc., a następnie w razie potrzeby w ciągłej infuzji dożylnej, nie przekraczając łącznej dawki 50-100 mmol. W trakcie podawania należy monitorować pH krwi, aby uniknąć alkalozy.
Można również podać agonistę receptorów β2-adrenergicznych w nebulizacji lub w infuzji dożylnej (salbutamol, fenoterol i inne).
Eliminacja potasu z ustroju:
U osób oddających mocz można (przy braku przeciwwskazań) podać roztwór soli fizjologicznej lub glukozy dożylnie oraz 20-40 mg furosemidu dożylnie (leczenie można powtórzyć).
Żywice jonowymienne (sulfonian polistyrenu: Resonium A, Calcium Resonium, Kayexalate) – wiążą potas w świetle jelita grubego. Preparaty te podaje się doustnie z laktulozą lub doodbytniczo (wlewka doodbytnicza) w dawce 25-50 g. Lek działa w ciągu paru godzin. Dawkę można powtarzać. Wiązanie potasu prowadzi do
uwalniania i zwiększenia ogólnoustrojowej puli wapnia lub sodu (w zależności od zastosowanego preparatu), co może ograniczać zastosowanie leku w specyficznych sytuacjach.
W przypadku hiperkaliemii opornej na wymienione powyżej metody leczenia lub
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
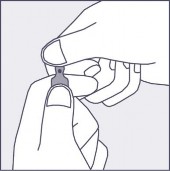
Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki.
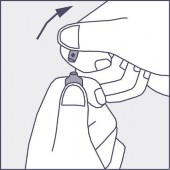
Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
KALIUM CHLORATUM WZF 15%, 150 mg/ml, koncentrat do sporządzania roztworu do infuzji
Każdy ml koncentratu zawiera 150 mg potasu chlorku (Kalii chloridum).
Każda ampułka 10 ml zawiera 1,5 g potasu chlorku, co odpowiada 20 mmol (20 mEq) potasu. Każda fiolka 20 ml zawiera 3,0 g potasu chlorku, co odpowiada 40 mmol (40 mEq) potasu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Koncentrat do sporządzania roztworu do infuzji
Produkt Kalium chloratum WZF 15% koncentrat do sporządzania roztworu do infuzji jest przeznaczony wyłącznie do podawania dożylnego w infuzji i musi być rozcieńczony przed podaniem w dużej objętości roztworu do infuzji.
Po pobraniu pierwszej dawki koncentratu z fiolki, można pozostałość przechowywać do 24 godzin w temperaturze poniżej 25°C.
Kalium chloratum WZF 15% koncentrat do sporządzania roztworu do infuzji można rozcieńczać: 5% roztworem glukozy, 0,9% roztworem chlorku sodu, płynem Ringera, płynem Ringera z mleczanem sodu lub płynem Hartmanna.
10 ml koncentratu zawierającego 20 mmol potasu (zawartość ampułki) należy rozcieńczyć do 500 ml roztworem do infuzji.
20 ml koncentratu zawierającego 40 mmol potasu (zawartość fiolki) należy rozcieńczyć do 1000 ml roztworem do infuzji.
Otrzymany roztwór należy dokładnie wymieszać. Stężenie potasu w uzyskanym w ten sposób roztworze wynosi 40 mmol/l.
Produkt Kalium chloratum WZF 15% i roztwory do infuzji używane do rozcieńczenia koncentratu nie zawierają środków konserwujących. Dlatego roztwór do infuzji należy przygotowywać bezpośrednio przed podaniem i zużyć w ciągu 6 godzin. Niewykorzystany roztwór należy zniszczyć.
Dawka oraz szybkość infuzji zależy od stanu pacjenta. Nawet przy dużej hipokaliemii produkt nie może być podawany bez rozcieńczenia.
W uproszczeniu można przyjąć, że 10 mmol potasu chlorku prowadzi do zwiększenia stężenia potasu w surowicy o 0,1 mmol/l. Rzeczywisty efekt podanej dawki na kaliemię zależy od wielu czynników takich jak: wolemia, stan gospodarki kwasowo-zasadowej, równowaga hormonalna, wydolność nerek, współistniejące choroby, przyjmowane leki. Zapotrzebowanie na potas u danego pacjenta może być określone tylko empirycznie na podstawie powtarzanych pomiarów stężenia potasu w surowicy.
Stężenie potasu w infuzji dożylnej nie powinno być większe niż 40 mmol/l, a szybkość infuzji nie powinna przekraczać 20 mmol/godzinę. Dawka zależy od indywidualnego stanu pacjenta, zwykle dawka dobowa nie powinna przekraczać 200 mmol potasu.
W specyficznych warunkach stężenie potasu w surowicy może nie odzwierciedlać rzeczywistych zasobów potasu w ustroju. Wynika to z redystrybucji jonów potasu pomiędzy przestrzeniami
wewnątrz- i zewnątrzkomórkową. Typowym przykładem jest hiperkaliemia u pacjenta
z niewyrównaną cukrzycą i kwasicą metaboliczną. Pacjent taki ma ogólnoustrojowy niedobór potasu z uwagi na jego utratę w wyniku diurezy osmotycznej. Kwasica powoduje ucieczkę potasu z komórek do przestrzeni pozakomórkowej i hiperkaliemię. Należy pamiętać o suplementacji potasu w miarę nawadniania i korekcji kwasicy metabolicznej.
Miejscowe objawy (ból) mogą uniemożliwić infuzję i w takich przypadkach należy podawać infuzję do dwóch żył lub do dużej żyły, np. żyły udowej.
Roztworu potasu chlorku nie należy podawać zbyt szybko przez cewnik centralny (wprowadzony do żyły podobojczykowej, szyjnej lub udowej), ponieważ grozi to zatrzymaniem krążenia (patrz punkt 4.4).
Podczas infuzji dożylnej (szczególnie przy szybkiej podaży potasu) należy monitorować EKG oraz stężenie potasu i innych elektrolitów we krwi. Pacjentom odwodnionym przed podaniem płynów
zawierających potas należy podać 1000 ml płynu bez potasu, chyba że występuje hipokaliemia. Niedoborowi potasu często towarzyszy niedobór magnezu; niedobór ten powinien być równolegle uzupełniany.
Dorośli
W przypadku pacjentów, u których stężenie potasu w surowicy jest większe niż 3 mmol/l, nie należy przekraczać szybkości infuzji 10 mmol/godzinę. Stężenie potasu w płynie infuzyjnym nie powinno być wyższe niż 40 mmol/l. Nie należy przekraczać dawki 200 mmol na dobę.
Jeżeli stężenie potasu w surowicy jest mniejsze niż 3 mmol/l, szczególnie gdy stwierdza się zmiany obrazu EKG lub niedowład mięśni, należy podawać potas w infuzji z szybkością 20 mmol/godzinę (a w uzasadnionych przypadkach 40 mmol/godzinę). Stężenie potasu w płynie infuzyjnym nie powinno przekraczać 40 mmol/l. Tylko w uzasadnionych przypadkach dawka dobowa może
przekraczać 200 mmol.
Dzieci
Dawka zalecana to 0,25-0,5 mmol/kg masy ciała. Szybkość infuzji nie powinna przekraczać 10 mmol/godzinę. Nie należy przekraczać dawki 1 mmol/kg mc./godzinę.
Należy szczególnie uważnie monitorować EKG pacjenta i powtarzać pomiary stężeń potasu i innych elektrolitów w surowicy.
Nadwrażliwość na substancję czynną Hiperkaliemia
Produkt Kalium chloratum WZF 15% koncentrat do sporządzania roztworu do infuzji jest przeznaczony wyłącznie do podawania dożylnego i musi być rozcieńczony przed podaniem.
Podczas infuzji roztworów potasu chlorku należy obserwować pacjenta oraz okresowo wykonywać oznaczenia stężeń elektrolitów w surowicy i równowagi kwasowo-zasadowej.
W celu oceny skuteczności leczenia i zapobiegania przedawkowaniu potasu należy okresowo przeprowadzać badania EKG, szczególnie u osób otrzymujących preparaty naparstnicy. Stężenie potasu w surowicy nie zawsze odzwierciedla zawartość tego jonu w tkankach (patrz punkt 4.2).
Infuzja roztworów zawierających potasu chlorek nie może być szybka, ponieważ może wystąpić ból i podrażnienie żyły w miejscu wstrzyknięcia, a nawet ostra hiperkaliemia, do zatrzymania krążenia włącznie. Należy unikać podawania potasu chlorku przez wkłucie centralne.
Nie należy podawać dożylnie potasu chlorku pacjentom z prawidłowym lub nieznacznie obniżonym stężeniem potasu, jeżeli u tych osób występuje niewydolność nerek lub inny stan sprzyjający retencji potasu i grożący rozwojem hiperkaliemii.
Potasu chlorek nie powinien być stosowany w niewydolności nerek, w stanach przebiegających ze skąpomoczem lub bezmoczem, w chorobach nerek z upośledzoną funkcją cewek dystalnych (anemia sierpowatokrwinkowa, toczeń rumieniowaty układowy), w migotaniu komór, przy bloku przedsionkowo-komorowym, blokach przewodzenia wewnątrzkomorowych, w chorobie Addisona, w zespole nadnerczowo-płciowym, w stanach niedoboru aldosteronu.
Należy zachować szczególną ostrożność przy suplementacji potasu chlorku w stanach przebiegających z ostrym odwodnieniem, rozległym mechanicznym uszkodzeniem tkanek (ze względu na możliwość rabdomiolizy z hiperkaliemią), przy rozległych oparzeniach, przy współistniejącym krwawieniu
wewnętrznym, po przetoczeniu znacznej objętości koncentratu krwinek czerwonych, u osób otrzymujących chemioterapię (możliwość lizy guza), w rzadkich zespołach neurologicznych (rodzinny okresowy paraliż hiperkaliemiczny).
Hiperkaliemii (w wyniku przenikania potasu z komórek do przestrzeni pozakomórkowej) sprzyjają: niedobór insuliny, kwasica, nieselektywne blokery kanałów adrenergicznych beta, a rzadkim powikłaniem leczenia statynami może być uszkodzenie komórek z następową hiperkaliemią.
Produkt można rozcieńczać: roztworem glukozy 5%, roztworem chlorku sodu 0,9%, płynem Ringera, płynem Ringera z mleczanem sodu lub płynem Hartmanna.
Zawartość sodu pochodzącego z rozcieńczalnika powinna być brana pod uwagę w obliczeniu
całkowitej zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika.
Niektóre leki mogą w specyficznych warunkach (stany opisane w punkcie 4.4) doprowadzić do hiperkaliemii, szczególnie jeżeli są stosowane łącznie z potasem. Do leków tych należą: inhibitory konwertazy angiotensyny, antagoniści receptorów dla angiotensyny II, niesteroidowe leki przeciwzapalne, heparyna, takrolimus (hamowanie produkcji aldosteronu), spironolakton (blokowanie receptora dla aldosteronu w cewce zbiorczej nerki), amiloryd, triamteren, trimetoprim, pentamidyna (blokowanie kanału sodowego w cewce dystalnej), cyklosporyna, digoksyna, a szczególnie jej przedawkowanie (blokowanie ATP-azy sodowo-potasowej), propranolol, nadolol, tymolol
(blokowanie receptora β2).
Insulina, wodorowęglany i leki β2-adrenergiczne obniżają stężenie potasu w surowicy. Potas osłabia działanie glikozydów naparstnicy. Sole wapnia podane dożylnie normalizują zaburzenia EKG typowe dla hiperkaliemii.
Ciąża
Nie przeprowadzono badań dotyczących wpływu leku na płód ludzki lub na zdolności reprodukcyjne kobiet. Produkt może być stosowany w ciąży jedynie w przypadkach, gdy w opinii lekarza
spodziewane korzyści dla matki przeważają nad potencjalnym zagrożeniem dla płodu.
Zarówno hipo- jak i hiperkaliemia są szkodliwe dla matki i płodu.
Karmienie piersią
Potas przenika do mleka kobiecego, dlatego należy zachować ostrożność podczas jego stosowania u kobiet karmiących piersią. Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Produkt nie wywiera wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn, jeżeli jest stosowany zgodnie z zaleceniami i nie dochodzi do jego przedawkowania.
Ze względu na postać i drogę podania produktu mogą wystąpić następujące reakcje: gorączka, infekcja w miejscu wykonywania infuzji, zakrzepica żylna lub zapalenie żyły w miejscu wkłucia, wynaczynienie, hiperwolemia i hiperkaliemia.
Podczas zbyt szybkiego podania dożylnego może wystąpić ból w miejscu wstrzyknięcia, a rzadziej podrażnienie lub zapalenie żył. Infuzja potasu chlorku przez wkłucie centralne (szczególnie zbyt szybka lub w dużym stężeniu) może prowadzić do zatrzymania krążenia i zgonu.
Podczas stosowania roztworów zawierających potas w infuzji dożylnej mogą wystąpić nudności, wymioty, bóle brzucha, biegunka.
Działania niepożądane wynikające z przedawkowania potasu - patrz punkt 4.9.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
W przypadku zaburzenia mechanizmów wydalania lub zbyt szybkiego dożylnego podania potasu może wystąpić hiperkaliemia, która potencjalnie może spowodować zgon. Nieznaczna (5-6 mmol/l) lub umiarkowana (6-7 mmol/l) hiperkaliemia jest bezobjawowa; stwierdzić można zwiększone
stężenie potasu w surowicy i charakterystyczne zmiany w obrazie EKG. Przy znacznej hiperkaliemii (ponad 7-8 mmol/l) może dochodzić do osłabienia, parestezji, bradyarytmii, zaburzeń przewodzenia, hipotonii, spastycznego porażenia mięśni szkieletowych i oddechowych, arefleksji, zaburzeń świadomości, zatrzymania krążenia i zgonu.
Zazwyczaj pierwszymi elektrokardiograficznymi objawami hiperkaliemii są: wysokie załamki T, skrócenie odstępu QT, ewentualnie obniżenie odcinka ST. Następnie pojawiają się bloki odnóg, wydłużenie odcinka PR i obniżenie załamka P. W dalszym etapie załamki P zanikają, a zespoły QRS poszerzają się do momentu, w którym krzywa EKG ma charakter sinusoidalny. Może wystąpić migotanie komór lub asystolia.
W przypadku wystąpienia objawów przedawkowania należy przerwać infuzję roztworu i zastosować właściwe leczenie.
Leczenie hiperkaliemii jest następujące:
u pacjentów z niewydolnością nerek, należy przeprowadzić jak najszybciej hemodializę.
Zbyt szybkie obniżenie stężenia potasu u pacjentów przyjmujących glikozydy naparstnicy, może spowodować wystąpienie objawów toksycznych.
Stany sprzyjające przedawkowaniu potasu - patrz punkt 4.5.
Grupa farmakoterapeutyczna: dodatki do roztworów dożylnych, roztwory elektrolitów kod ATC: B05XA01
Potas jest jednym z głównych kationów płynu komórkowego i jednym z najważniejszych pierwiastków wchodzących w skład płynów ustrojowych. Bierze udział w wielu reakcjach
enzymatycznych i procesach fizjologicznych, m.in. w prawidłowym działaniu układu nerwowego
i mięśniowego. Odgrywa rolę w utrzymaniu równowagi wodno-elektrolitowej, kwasowo-zasadowej i prawidłowej osmolarności płynów ustrojowych. Na mięsień sercowy działa antagonistycznie
w stosunku do wapnia.
Do stanów niedoboru potasu w organizmie może dojść w wyniku niedostatecznego spożycia (ciężkie niedożywienie, alkoholizm), zwiększonej utraty przez przewód pokarmowy (uporczywe wymioty, biegunka, przetoki jelitowe), utraty przez nerki (diuretyki tiazydowe i pętlowe, diureza osmotyczna,
w tym niewyrównana cukrzyca, pierwotny lub wtórny aldosteronizm (np. nadciśnienie tętnicze naczyniowo-nerkowe, guzy wydzielające reninę, marskość wątroby), choroby nerek z utratą potasu, w tym kwasice cewkowe dystalna lub proksymalna, zespół Liddle’a, zespół Bartter’a, zespół
Gitelmana, leczenie kortykosteroidami. Hipokaliemia może też być wyrazem wzmożonego transportu potasu do wnętrza komórki (leczenie insuliną, zasadowica, wyrzut katecholamin w stresie, rodzinny okresowy paraliż hipokaliemiczny).
Objawami niedoboru potasu mogą być: niepokój, osłabienie, tachyarytmia, niedrożność porażenna
jelit, zatrzymanie moczu, niedowład mięśni szkieletowych, zanik lub osłabienie odruchów, parestezje, porażenie mięśni oddechowych (rzadko), wielomocz (nefropatia hipokaliemiczna – moczówka nerkowa), wzmożone pragnienie, niekiedy tężyczka i śpiączka. Zmiany w zapisie EKG obejmują: spłaszczenie załamków T, wysoką falę U, obniżenie odcinka ST-T, w końcu - migotanie komór.
Prawidłowe stężenie potasu w surowicy (kaliemia) wynosi 3,5-5,0 mmol/l (wewnątrz komórki - 140 mmol/l). Całkowita zawartość potasu w organizmie to 3500 mmol, z czego 98% występuje
w komórkach, głównie w mięśniach i wątrobie, a 2% zewnątrzkomórkowo (to jest około 70 mmol).
Podaż potasu z dietą to około 100-150 mmol na dobę. Tyle też musi zostać wydalone, aby została zachowana równowaga.
Stężenie potasu w surowicy zależy od: podaży i wchłaniania, transportu do i z komórki (trwa minuty) oraz wydalania (trwa godziny) przez nerki (90-95%) i jelita (5-10%). Najistotniejsze jest wydalanie potasu w cewce zbiorczej, które zależy od: stężenia potasu w surowicy, aktywności aldosteronu, tempa przepływu cewkowego, dystalnego dowozu sodu, pH krwi, przezcewkowego gradientu
elektrochemicznego oraz wolemii. Wydalanie potasu przez przewód pokarmowy występuje w jelicie cienkim i grubym i jest również stymulowane przez aldosteron. W przewlekłej niewydolności nerek dochodzi do 3-4 krotnego wzrostu wydalania jelitowego potasu.
Nerki nie mają dużej zdolności zatrzymywania potasu, w związku z czym łatwo może dojść do jego niedoboru podczas głodówki lub niedostatecznej podaży tego jonu w pożywieniu.
Nie ma innych danych niż przedstawione w pozostałych punktach Charakterystyki Produktu
Leczniczego. Zarówno jony potasu, jak i chlorkowe są składnikiem komórek i płynów organizmu ludzkiego.
Woda do wstrzykiwań
Kalium chloratum WZF 15% można rozcieńczać: 5% roztworem glukozy, 0,9% roztworem chlorku sodu, płynem Ringera, płynem Ringera z mleczanem sodu lub płynem Hartmanna.
Nie należy łączyć produktu z roztworami: mannitolu, amikacyny, amfoterycyny B, amoksycyliny, benzylopenicyliny, diazepamu, dobutaminy, ergotaminy, metyloprednizolonu, fenytoiny, prometazyny, streptomycyny, nitroprusydku sodu, etopozydu z cisplatyną i mannitolem, gdyż mogą wystąpić niezgodności farmaceutyczne.
Lista leków, które mogą wykazywać niezgodności farmaceutyczne z produktem Kalium chloratum WZF 15% może być niekompletna, dlatego jeśli istnieje konieczność podania produktu z innymi lekami w jednej infuzji, przed zmieszaniem należy w każdym przypadku sprawdzić, czy występuje zgodność farmaceutyczna.
Przed zmieszaniem produktu Kalium chloratum WZF 15% z płynami do żywienia pozajelitowego należy w każdym przypadku sprawdzić, czy występuje zgodność farmaceutyczna.
3 lata
Przechowywać w temperaturze poniżej 25C. Nie zamrażać.
Ampułki lub fiolki szklane, w tekturowym pudełku. 50 ampułek po 10 ml
10 fiolek po 20 ml
Produkt Kalium chloratum WZF 15% koncentrat do sporządzania roztworu do infuzji jest przeznaczony wyłącznie do podawania dożylnego w infuzji i musi być rozcieńczony przed podaniem w dużej objętości roztworu do infuzji.
Po pobraniu pierwszej dawki koncentratu z fiolki, można pozostałość przechowywać do 24 godzin w temperaturze poniżej 25°C.
Kalium chloratum WZF 15% można rozcieńczać: 5% roztworem glukozy, 0,9% roztworem chlorku sodu, płynem Ringera, płynem Ringera z mleczanem sodu lub płynem Hartmanna.
Kalium chloratum WZF 15% i roztwory do infuzji używane do rozcieńczenia koncentratu nie zawierają środków konserwujących. Dlatego roztwór do infuzji należy przygotowywać bezpośrednio przed podaniem i zużyć w ciągu 6 godzin. Niewykorzystany roztwór należy zniszczyć.
Roztwór do infuzji należy przygotować w następujący sposób:
10 ml koncentratu zawierającego 20 mmol potasu (zawartość ampułki) należy rozcieńczyć do 500 ml roztworem do infuzji.
20 ml koncentratu zawierającego 40 mmol potasu (zawartość fiolki) należy rozcieńczyć do 1000 ml roztworem do infuzji.
Otrzymany roztwór należy dokładnie wymieszać. Stężenie potasu w uzyskanym w ten sposób roztworze wynosi 40 mmol/l.
Szczegółowe dane dotyczące szybkości infuzji oraz dawkowania podano w punkcie 4.2.
Instrukcja otwierania ampułki
Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu.
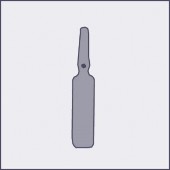
Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia.
Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
Rysunek 1 Rysunek 2 Rysunek 3
Warszawskie Zakłady Farmaceutyczne Polfa S.A. ul. Karolkowa 22/24
01-207 Warszawa
Pozwolenie nr R/2435
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 27.05.1975 r. Data ostatniego przedłużenia pozwolenia: 05.09.2013 r.











