Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
przewodu pokarmowego - kolka żółciowa, stany skurczowe dróg żółciowych, kolka jelitowa;
dróg moczowych - kolka nerkowa, bolesne parcie na mocz.
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
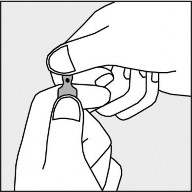
Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki.
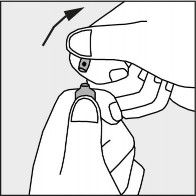
Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
PAPAVERINUM HYDROCHLORICUM WZF, 20 mg/ml, roztwór do wstrzykiwań
Każdy ml roztworu zawiera 20 mg papaweryny chlorowodorku (Papaverini hydrochloridum). Substancja pomocnicza o znanym działaniu: alkohol benzylowy
Każdy ml roztworu zawiera 10 mg alkoholu benzylowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Rozwór do wstrzykiwań
Przezroczysty, bezbarwny lub lekko żółtawy płyn.
Stany spastyczne mięśni gładkich:
Dawkowanie
Dorośli
Podawać domięśniowo lub podskórnie, bez rozcieńczenia: od 40 mg do 120 mg (od 2 ml do 6 ml). W razie konieczności dawka może być powtórzona po 3 godzinach, maksymalnie 4 razy na dobę.
Dzieci
Z uwagi na brak odpowiednich danych klinicznych, produktu Papaverinum hydrochloricum WZF nie należy stosować u dzieci.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Zaburzenia przewodnictwa w mięśniu sercowym.
Szczególną ostrożność należy zachować u pacjentów z jaskrą, zaburzeniami czynności wątroby, dławicą piersiową, po niedawno przebytym zawale mięśnia sercowego.
Dzieci
Z uwagi na brak odpowiednich danych klinicznych, produktu Papaverinum hydrochloricum WZF nie należy stosować u dzieci.
Produkt leczniczy zawiera 10 mg alkoholu benzylowego w każdym ml roztworu.
Produkt leczniczy zawiera 20 mg alkoholu benzylowego w każdej ampułce (2 ml roztworu).
Alkohol benzylowy może powodować reakcje alergiczne.
Dożylne podawanie alkoholu benzylowego noworodkom wiąże się z ryzykiem ciężkich działań niepożądanych i śmierci (tzw. „gasping syndrome”). Minimalna ilość alkoholu benzylowego, przy
której mogą wystąpić objawy toksyczności jest nieznana. U małych dzieci istnieje zwiększone ryzyko z powodu kumulacji. Produktu Papaverinum hydrochloricum WZF nie należy stosować u dzieci (patrz punkt 4.2).
Duże objętości alkoholu benzylowego należy podawać z ostrożnością i tylko w razie konieczności, zwłaszcza u pacjentów z zaburzeniami czynności nerek lub wątroby oraz u kobiet w ciąży lub karmiących piersią, z powodu ryzyka kumulacji i toksyczności (kwasica metaboliczna).
Produkt zawiera mniej niż 1 mmol (23 mg) sodu na ampułkę (2 ml), to znaczy produkt uznaje się za
„wolny od sodu”.
Papaweryna osłabia działanie lewodopy.
Ciąża
Papaweryna może być stosowana w ciąży jedynie w przypadkach, gdy w opinii lekarza korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu.
Karmienie piersią
Z powodu braku danych o przenikaniu leku do mleka kobiecego, podczas stosowania papaweryny w okresie karmienia piersią konieczne jest zachowanie ostrożności.
Produkt zawiera alkohol benzylowy - patrz punkt 4.4.
Należy zachować ostrożność podczas prowadzenia pojazdów i obsługiwania maszyn, gdyż produkt może powodować zawroty głowy lub senność.
Rumień twarzy, ból głowy, zawroty głowy, dyskomfort w jamie brzusznej, zaparcia, biegunka, złe samopoczucie, brak łaknienia, nudności, wymioty, nadmierna potliwość, senność, niedociśnienie tętnicze, zaburzenia oddychania. Ból w miejscu wstrzyknięcia.
Jeśli wystąpi nadwrażliwość ze strony wątroby, objawiająca się żółtaczką, eozynofilią, podwyższeniem wartości testów wątrobowych, produkt należy odstawić.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Wyjątkowo może wystąpić nadmierne obniżenie ciśnienia tętniczego, niewyraźne, podwójne widzenie, zaburzenia rytmu serca.
Stosuje się leczenie objawowe. Papawerynę można usunąć z krwi metodą hemodializy.
Grupa farmakoterapeutyczna: spazmolityki, leki przeciwcholinergiczne lub pobudzające perystaltykę; papaweryna i jej pochodne, kod ATC: A03AD01
Papaweryna należy do izochinolinowych alkaloidów opium. W przeciwieństwie do pochodnych
fenantrenowych nie działa przeciwbólowo i nie prowadzi do rozwoju uzależnienia. Rozkurcza mięśnie gładkie poprzez bezpośredni wpływ na komórki mięśniowe. Jej działanie spazmolityczne
wykorzystywane jest w celu likwidowania stanów spastycznych mięśni gładkich w obrębie jamy brzusznej. W bardziej nasilonych stanach skurczowych stosowana jest razem z lekami o działaniu cholinolitycznym i lekami przeciwbólowymi.
Papaweryna w surowicy wiąże się z białkami w około 90%. Po przemianach zachodzących w wątrobie jest wydalana przez nerki w postaci nieczynnych metabolitów. Okres półtrwania wynosi 0,5-2 h
(średnio 1,6 h).
Badania na zwierzętach wskazują na istnienie zagrożenia dla płodu. Odpowiednich badań u człowieka nie wykonano.
Disodu edetynian Alkohol benzylowy Woda do wstrzykiwań
Papaweryny chlorowodorek wytrąca się z mleczanowym roztworem Ringera do wstrzykiwań.
3 lata
Przechowywać w temperaturze poniżej 25°C. Przechowywać ampułki w opakowaniu zewnętrznym w celu ochrony przed światłem. Nie zamrażać.
10 ampułek ze szła bezbarwnego o pojemności 2 ml w tekturowym pudełku.
Roztwór podaje się we wstrzyknięciach, bez rozcieńczenia.
Instrukcja otwierania ampułki
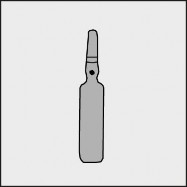
Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu. Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia.
Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
Rysunek 1.
Rysunek 2.
Rysunek 3.
Warszawskie Zakłady Farmaceutyczne Polfa S.A. ul. Karolkowa 22/24; 01-207 Warszawa
Pozwolenie nr R/2438
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 11.12.1970 r. Data ostatniego przedłużenia pozwolenia: 19.11.2014 r.











