Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
mg podzielonej na dawki mniejsze, przyjmowane w ciągu całego dnia.
Przerwanie leczenia
Ponieważ leczenie ma charakter objawowy, po jego przerwaniu objawy choroby mogą nawrócić. Dawkę leku należy zmniejszać stopniowo, aby uniknąć wystąpienia objawów zespołu odstawienia.
Informacje dotyczące stosowania produktu leczniczego Xanax 2 mg Jeśli trzeba, tabletki te można dzielić na połówki lub ćwiartki.
W tym celu tabletkę należy położyć na twardej powierzchni wgłębieniem do dołu. Po przyciśnięciu kciukiem, tabletka przełamie się na dwie równe części zawierające po 1 mg alprazolamu.

Jeśli trzeba, otrzymane części można dalej podzielić. W tym celu należy je ponownie umieścić na twardej powierzchni wgłębieniem do dołu i ponownie nacisnąć kciukiem. W ten sposób z każdej połówki otrzyma się dwie ćwiartki zawierające po 0,5 mg alprazolamu.

W ten sposób otrzymuje się następujące części tabletek Xanax:
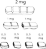
Dzieci i młodzież
Produktu Xanax nie należy stosować u dzieci i młodzieży poniżej 18 lat.
Stosowanie u pacjentów w podeszłym wieku lub osłabionych
Zalecana dawka początkowa wynosi 0,25 mg dwa lub trzy razy na dobę.
Dawkę w razie konieczności można stopniowo zwiększać, zależnie od tolerancji na lek.
W razie wystąpienia działań niepożądanych dawkę początkową należy zmniejszyć.
Stosowanie u pacjentów z niewydolnością wątroby
Stosowanie u pacjentów z ciężką niewydolnością wątroby jest przeciwwskazane.
Przeciwwskazania
nadwrażliwości na alprazolam i inne benzodiazepiny, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1
nużliwości mięśni (myasthenia gravis)
ciężkiej niewydolności oddechowej
zespołu bezdechu śródsennego
ciężkiej niewydolności wątroby
Nie należy stosować u dzieci i młodzieży poniżej 18 lat.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Każda tabletka tego leku o mocy 0,25 mg, 0,5 mg i 1 mg zawiera 0,11 mg sodu benzoesanu.
Każda tabletka tego leku o mocy 2 mg zawiera 0,23 mg sodu benzoesanu.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Nie zaleca się jednoczesnego stosowania alprazolamu z ketokonazolem, itrakonazolem, pozakonazolem, worykonazolem ani innymi lekami przeciwgrzybiczymi z grupy azoli.
Jednoczesne podawanie z nefazodonem lub fluwoksaminą około dwukrotnie zwiększa obszar AUC dla alprazolamu. W razie jednoczesnego stosowania alprazolamu z nefazodonem, fluwoksaminą lub cymetydyną zaleca się zachowanie szczególnej ostrożności i ewentualnie zmniejszenie dawki.
W razie jednoczesnego stosowania alprazolamu z fluoksetyną, propoksyfenem, doustnymi środkami antykoncepcyjnymi, sertraliną, diltiazemem lub antybiotykami makrolidowymi, takimi jak erytromycyna, klarytromycyna czy troleandomycyna, zaleca się zachowanie szczególnej ostrożności.
Induktory CYP3A4
Alprazolam jest metabolizowany przez CYP3A4, dlatego induktory tego enzymu mogą nasilać
metabolizm alprazolamu.
Interakcje pomiędzy inhibitorami proteazy ludzkiego wirusa niedoboru odporności (HIV)
(np. rytonawirem) a alprazolamem są złożone i zależą od czasu trwania leczenia. Krótkotrwałe podawanie małych dawek rytonawiru prowadziło do znacznego obniżenia klirensu alprazolamu, wydłużenia okresu półtrwania i nasilenia jego działania klinicznego. Jednak w przypadku długotrwałego stosowania rytonawiru ten efekt hamujący jest znoszony wskutek indukcji CYP3A. Ten rodzaj interakcji wymaga modyfikacji dawki bądź przerwania leczenia alprazolamem.
Podczas podawania alprazolamu stwierdzono podwyższone stężenia digoksyny, zwłaszcza u osób w podeszłym wieku (wiek >65 lat). Dlatego pacjentów otrzymujących jednocześnie alprazolam
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
zależność psychiczna i fizyczna;
objawy odstawienia. Patrz punkt 4.4.
Po wytworzeniu się zależności fizycznej nagłe przerwanie leczenia może prowadzić do pojawienia się
objawów odstawienia – od bólu głowy, mięśni, bardzo nasilonego lęku, uczucia napięcia, pobudzenia
psychoruchowego, dezorientacji, drażliwości do derealizacji, depersonalizacji, upośledzenia słuchu, sztywności i mrowienia kończyn, nadwrażliwości na światło, hałas i dotyk, omamów czy napadów padaczkowych.
Stosowanie benzodiazepin (nawet w dawkach terapeutycznych) może prowadzić do rozwinięcia się zależności fizycznej: przerwanie terapii może prowadzić do pojawienia się objawów odstawienia (np. „z odbicia”). W tych okolicznościach wystąpić mogą ponadto zmiany nastroju, lęk, zaburzenia snu i pobudzenie psychoruchowe.
Może wystąpić zależność psychiczna. Opisywano przypadki nadużywania benzodiazepin (patrz punkt 4.4).
Nasilone objawy odstawienia obserwuje się szczególnie często u pacjentów długotrwale leczonych dużymi dawkami. Objawy odstawienia stwierdzano również wtedy, gdy leczenie wycofywano szybko lub przerywano nagle (patrz punkt 4.2).
Podczas leczenia dużymi dawkami leku częściej niż w grupie placebo stwierdzano następujące działania niepożądane: nadmierne uspokojenie, senność, zmęczenie, ataksję, upośledzoną koordynację, zaburzenia mowy. Rzadziej natomiast stwierdzano: zmiany nastroju, objawy ze strony układu pokarmowego, zapalenie skóry, zaburzenia pamięci, zaburzenia czynności płciowych, zaburzenia poznawcze i dezorientację.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C
02-222 Warszawa,
tel.: + 48 22 49 21 301
faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego.
Przedawkowanie
stosowania trójpierścieniowych leków przeciwdepresyjnych
jednoczesnego podawania leków obniżających próg drgawkowy
zaburzeń w EKG pod postacią wydłużenia odcinka QRS lub QT (wskazującego jednocześnie na
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
mg/kg mc./dobę, czyli 25-krotnie większej od maksymalnej zalecanej dawki dobowej u człowieka, wynoszącej 10 mg na dobę.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Xanax, 0,25 mg, tabletki Xanax, 0,5 mg, tabletki Xanax, 1 mg, tabletki Xanax, 2 mg, tabletki
Każda tabletka zawiera odpowiednio 0,25 mg lub 0,5 mg, lub 1 mg, lub 2 mg alprazolamu
(Alprazolamum).
Substancje pomocnicze o znanym działaniu:
- W każdej tabletce o mocy 0,25 mg, 0,5 mg i 1 mg znajduje się 0,11 mg sodu benzoesanu (E 211) i 96 mg laktozy jednowodnej.
- W każdej tabletce o mocy 2 mg znajduje się 0,23 mg sodu benzoesanu (E 211) i 192 mg laktozy jednowodnej.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka.
Xanax, 0,25 mg: białe, eliptyczno-owalne tabletki podzielne oznaczone napisem „Upjohn 29” po jednej stronie i z linią podziału po drugiej stronie tabletki.
Xanax, 0,5 mg: różowe, eliptyczno-owalne tabletki podzielne oznaczone napisem „Upjohn 55” po jednej stronie i z linią podziału po drugiej stronie tabletki.
Xanax, 1 mg: lawendowe, eliptyczno-owalne tabletki podzielne oznaczone napisem „Upjohn 90” po jednej stronie i z linią podziału po drugiej stronie tabletki.
Xanax, 2 mg: białe, podłużne tabletki podzielne oznaczone napisem „U 94” po jednej stronie i z potrójną linią podziału po obu stronach tabletki.
Xanax jest wskazany w krótkotrwałym leczeniu objawowym stanów lękowych u osób dorosłych.
Xanax jest wskazany wyłącznie w przypadku ciężkich zaburzeń, w których objawy są nasilone, uniemożliwiają pacjentowi prawidłowe funkcjonowanie lub są dla niego bardzo uciążliwe.
Dawkowanie
Czas trwania leczenia: Xanax należy stosować w najmniejszej możliwej skutecznej dawce, przez
możliwie najkrótszy czas i maksymalnie przez 2-4 tygodnie. Należy często oceniać stan pacjenta
i potrzebę przedłużania leczenia, szczególnie jeśli nasilenie objawów występujących u pacjenta zmniejsza się lub objawy ustąpią. Nie zaleca się długotrwałego leczenia. Ryzyko uzależnienia może wzrastać wraz z dawką i czasem trwania leczenia (patrz punkt 4.4).
W niektórych przypadkach może być konieczne przedłużenie okresu stosowania produktu leczniczego. Nie należy tego jednak czynić bez wcześniejszej oceny stanu pacjenta przez specjalistę. W razie stosowania przewlekłego istnieje ryzyko rozwinięcia zależności lekowej (niekorzystny stosunek korzyści do zagrożeń).
Optymalne dawkowanie produktu leczniczego Xanax powinno być ustalane indywidualnie na podstawie nasilenia objawów i indywidualnej reakcji pacjenta na leczenie. W razie wystąpienia nasilonych działań niepożądanych po podaniu dawki początkowej konieczne jest zmniejszenie dawki. U nielicznych pacjentów, którzy wymagać będą podawania większych dawek niż początkowo zalecane, dawkowanie należy zwiększać stopniowo, większą dawkę podając wieczorem, by uniknąć działań niepożądanych. Pacjenci, którzy wcześniej nie przyjmowali leków psychotropowych, wymagają podawania mniejszych dawek aniżeli pacjenci uprzednio przyjmujący leki uspokajające, przeciwdepresyjne lub nasenne oraz osoby uzależnione od alkoholu.
Aby nie dopuścić do ataksji lub nadmiernego uspokojenia, należy stosować najmniejszą skuteczną dawkę. Jest to szczególnie istotne w przypadku osób w podeszłym wieku i (lub) osłabionych.
Leczenie objawowe stanów lękowych
Zalecana dawka początkowa wynosi 0,25 mg lub 0,5 mg trzy razy na dobę.
Dawkę można zwiększać, zależnie od potrzeb pacjenta do maksymalnej dawki dobowej wynoszącej
Stosowanie produktu leczniczego Xanax jest przeciwwskazane w przypadku:
Czas trwania leczenia
Czas trwania leczenia powinien być jak najkrótszy i nie dłuższy niż 2-4 tygodnie (patrz punkt 4.2).
Nie można wydłużyć czasu leczenia poza ten okres bez ponownej oceny stanu pacjenta.
W momencie rozpoczęcia leczenia, należy poinformować pacjenta o konieczności ograniczenia czasu trwania terapii i stopniowego zmniejszania dawki podczas odstawiania. Ponadto ważne, aby pacjent był świadomy możliwości wystąpienia objawów odstawienia, co pozwoli zmniejszyć jego lęk, gdy ewentualnie wystąpią w trakcie odstawiania produktu leczniczego. Istnieją oznaki wskazujące, że
w przypadku benzodiazepin o krótkim czasie działania objawy odstawienia mogą wystąpić w przerwie między dawkami, szczególnie, jeśli pacjent otrzymuje duże dawki leku. W razie stosowania benzodiazepin o długim czasie działania ważne jest uprzedzenie pacjenta przed zmianą na benzodiazepiny o krótkim czasie działania, ponieważ mogą rozwinąć się objawy odstawienia.
Zwykle benzodiazepiny podaje się doraźnie lub krótkotrwale. Działanie na organizm jest zatem
krótkie. W innych przypadkach stan zdrowia pacjenta wymaga przedłużenia okresu leczenia.
W przypadku długotrwałego stosowania benzodiazepin konieczność kontynuowania leczenia powinna być okresowo weryfikowana przez lekarza prowadzącego pacjenta. Długotrwałe stosowanie leku prowadzi do rozwoju zależności psychicznej.
Ryzyko związane z jednoczesnym stosowaniem z opioidami
W przypadku jednoczesnego stosowania benzodiazepin z opioidami może dochodzić do znacznego uspokojenia, depresji oddechowej, śpiączki oraz zgonu. Ze względu na te zagrożenia, jednoczesne przepisywanie leków uspokajających, takich jak benzodiazepiny, lub podobnych leków, takich jak produkt leczniczy Xanax, z opioidami powinno ograniczać się tylko do pacjentów, u których alternatywne sposoby leczenia są niewystarczające. Jeśli zostanie podjęta decyzja o przepisaniu produktu leczniczego Xanax jednocześnie z opioidami wymagane jest ograniczenie dawek i czasu trwania leczenia do minimum.
Tolerancja leku
Tolerancja lub konieczność zwiększania dawki w przypadku stosowania alprazolamu ma miejsce rzadko, choć jest możliwa. Zjawisko tolerancji wykazano dla działania uspokajającego alprazolamu, lecz nie przeciwlękowego.
Po wielokrotnym stosowaniu produktu przez kilka tygodni może wystąpić zmniejszenie skuteczności nasennego działania benzodiazepin.
Uzależnienie
W trakcie stosowania benzodiazepin, w tym alprazolamu, może dojść do rozwoju uzależnienia oraz zależności emocjonalnej lub fizycznej. Ryzyko uzależnienia zwiększa się wraz z dawką oraz czasem trwania leczenia. Szczególną ostrożność należy zachować w przypadku zapisywania benzodiazepin pacjentom skłonnym do nadużywania leków (w tym narkotyków) i alkoholu, gdyż ci pacjenci są szczególnie predysponowani do rozwoju uzależnienia. Uzależnienie lekowe może wystąpić podczas stosowania dawek terapeutycznych i (lub) u pacjentów bez czynników ryzyka. Ryzyko uzależnienia zwiększa się w trakcie jednoczesnego stosowania kilku benzodiazepin, niezależnie od wskazań przeciwlękowych czy nasennych. Znanym ryzykiem dotyczącym alprazolamu i innych benzodiazepin jest ich nadużywanie, dlatego pacjentów leczonych alprazolamem należy odpowiednio monitorować. Występuje ryzyko, że alprazolam zostanie przekazany osobie, której nie został przepisany. Zgłaszano przypadki zgonów związanych z przedawkowaniem, gdy alprazolam był nadużywany z innymi lekami działającymi depresyjnie na ośrodkowy układ nerwowy (OUN), w tym opioidami, innymi benzodiazepinami i alkoholem. Ryzyko to należy wziąć pod uwagę podczas przepisywania lub wydawania alprazolamu. Aby zmniejszyć te zagrożenia, pacjentom należy przepisywać jak najmniejszą ilość tego produktu leczniczego. Pacjentów należy także poinformować o właściwym przechowywaniu oraz pozbywaniu się niewykorzystanego leku (patrz punkty 4.2, 4.8 i 4.9).
W przypadku zależności psychicznej, nagłe przerwanie leczenia jest związane z wystąpieniem objawów odstawienia. Mogą one obejmować: ból głowy, bóle mięśni, skrajny lęk, napięcie, niepokój, dezorientację, drażliwość. W niektórych przypadkach mogą pojawić się: derealizacja, depersonalizacja, nadwrażliwość słuchowa, drętwienie i swędzenie kończyn, nadwrażliwość na światło, hałas i dotyk, omamy lub napady padaczki.
Objawy powyższe stwierdzano jednak również po nagłym odstawieniu benzodiazepin podawanych w dawkach leczniczych. Kiedy u pacjentów w stanach lękowych bądź podobnymi zaburzeniami leczenie przerywa się, nawracające wtedy objawy choroby bardzo przypominają objawy odstawienia. Mogą im towarzyszyć inne objawy, takie jak zmienny nastrój, lęk lub zaburzenia snu i niepokój.
Nagłe odstawienie benzodiazepin zwiększa ryzyko pojawienia się takich działań, jak zjawisko „z odbicia” czy objawy odstawienia (patrz punkt 4.8). Dawka powinna być zatem zmniejszana stopniowo (patrz punkt 4.2).
Zwiększone ryzyko samobójstw i zachowań samobójczych
W przypadku pacjentów z depresją ze skłonnościami samobójczymi należy zastosować odpowiednie środki ostrożności, a lek zapisywać w wyliczonej ilości. Stwierdzono związek pomiędzy stanami lękowymi oraz podobnymi zaburzeniami a dużą pierwotną lub wtórną depresją oraz zwiększoną liczbą samobójstw u pacjentów nieleczonych.
W związku z tym w przypadku stosowania dużych dawek produktu Xanax u pacjentów w stanach lękowych konieczne jest zastosowanie tych samych środków ostrożności, co u pacjentów z depresją stosujących leki psychotropowe lub u pacjentów, u których podejrzewa się występowanie myśli samobójczych z lub bez tendencji do realizacji.
Dzieci i młodzież
Bezpieczeństwo oraz skuteczność alprazolamu nie zostały potwierdzone u dzieci i młodzieży poniżej 18 roku życia. Dlatego też nie zaleca się stosowania alprazolamu w tej grupie pacjentów.
Reakcje psychiczne i paradoksalne
Podczas stosowania benzodiazepin może wystąpić reakcja paradoksalna: niepokój ruchowy,
pobudzenie psychoruchowe, drażliwość, agresja, urojenia, gniew, koszmary senne, omamy, psychozy, niewłaściwe zachowanie bądź inne zaburzenia zachowania (patrz punkt 4.8). W wypadku pojawienia się wymienionych objawów stosowanie leku należy przerwać.
W przypadku pacjentów z ostrą jaskrą zamkniętego kąta przesączania, należy zastosować odpowiednie środki ostrożności.
U pacjentów w podeszłym wieku lub osłabionych zaleca się stosowanie najmniejszej skutecznej
dawki, w celu zapobieżenia wystąpieniu ataksji lub nadmiernego uspokojenia.
Benzodiazepiny i podobnie działające substancje powinny być stosowane ostrożnie u osób
w podeszłym wieku, ze względu na ryzyko sedacji i (lub) osłabienia układu mięśniowo-szkieletowego, które mogą prowadzić do upadków, często z poważnymi skutkami w tej grupie pacjentów.
Mniejsza dawka jest zalecana również u pacjentów z przewlekłą niewydolnością oddechową ze względu na możliwość depresji oddechowej.
U pacjentów z zaburzeniami czynności nerek albo z łagodną, lub umiarkowaną niewydolnością wątroby zaleca się zachowanie ostrożności.
Benzodiazepiny nie są wskazane do leczenia podstawowego psychoz.
Pacjentom nie należy przepisywać benzodiazepin ani pochodnych benzodiazepin w monoterapii depresji, ponieważ może to wywołać lub zwiększać ryzyko prób samobójczych. Stosowanie produktu Xanax u pacjentów z objawami przedmiotowymi i podmiotowymi depresji lub u pacjentów o skłonnościach samobójczych wymaga szczególnej uwagi i kontroli ilości przepisywanego leku.
Zgłaszano epizody hipomanii i manii w związku ze stosowaniem alprazolamu u pacjentów z depresją.
Należy zachować szczególną ostrożność, stosując benzodiazepiny u pacjentów nadużywających
w przeszłości alkoholu lub leków (patrz punkt 4.5).
Interakcje
W przypadku jednoczesnego stosowania produktu leczniczego Xanax z innymi lekami nasennymi lub uspokajającymi, bądź spożywania alkoholu, należy pamiętać o możliwości addytywnego działania tych substancji (patrz punkt 4.5).
Laktoza
Produkt nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
Sód
Produkt zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy lek uznaje się za „wolny od
sodu”.
Sodu benzoesan (E 211)
Lek Xanax zawiera sodu benzoesan:
Benzodiazepiny charakteryzują się addytywnym działaniem depresyjnym na OUN, włączając depresję oddechową, kiedy stosowane są jednocześnie z opioidami, alkoholem lub innymi lekami działającymi
depresyjnie na OUN (patrz punkt 4.4).
Nie wolno spożywać alkoholu w okresie leczenia produktem Xanax.
Należy zachować ostrożność podczas stosowania alprazolamu z produktami działającymi depresyjnie na układ oddechowy, np. opioidami (leki przeciwbólowe, przeciwkaszlowe, stosowane w leczeniu uzależnień), szczególnie u pacjentów w podeszłym wieku.
W przypadku jednoczesnego stosowania alprazolamu z produktami działającymi depresyjnie na OUN, należy zachować ostrożność. W przypadku jednoczesnego stosowania produktu z lekami przeciwpsychotycznymi (neuroleptykami), lekami nasennymi, lekami przeciwlękowymi
i uspokajającymi, lekami przeciwdepresyjnymi, narkotycznymi lekami przeciwbólowymi, lekami przeciwdrgawkowymi środkami znieczulającymi i lekami przeciwhistaminowymi wykazującymi działanie sedacyjne może dochodzić do nasilenia depresyjnego wpływu na OUN. Ponadto,
w przypadku narkotycznych leków przeciwbólowych może dochodzić do nasilenia euforii, co może prowadzić do zwiększenia zależności psychicznej.
Do interakcji farmakokinetycznych może dochodzić, kiedy alprazolam stosowany jest w skojarzeniu z lekami wpływającymi na jego metabolizm.
Inhibitory CYP3A
Leki hamujące niektóre enzymy wątrobowe (w szczególności układ enzymatyczny cytochromu P450 3A4) mogą zwiększać stężenie alprazolamu i nasilać jego działanie. Dane dotyczące alprazolamu uzyskane z badań klinicznych, badań in vitro alprazolamu, badań klinicznych dotyczących produktów metabolizowanych w podobny sposób jak alprazolam, wskazują na różne stopnie interakcji i możliwe interakcje alprazolamu z innymi lekami.
Wymienione niżej zalecenia oparto na wynikach kilku badań naukowych:
i digoksynę należy ściśle monitorować w kierunku przedmiotowych i podmiotowych objawów
związanych z toksycznością digoksyny.
W przypadku jednoczesnego stosowania produktu leczniczego Xanax w dobowych dawkach dochodzących do 4 mg z imipraminą i dezypraminą, odnotowywano w stanie stacjonarnym średnie zwiększenie stężenia w osoczu imipraminy (o 31%) i dezypraminy (o 20%). Nie ustalono jeszcze znaczenia klinicznego tych zmian.
Nie dokonywano oceny interakcji alprazolamu z izoniazydem ani ryfampicyną. Nie stwierdzono żadnych zmian w zakresie kinetyki alprazolamu podczas jednoczesnego stosowania tego leku
z propranololem czy disulfiramem. Alprazolam nie wpływa na stężenie fenytoiny w osoczu, natomiast
wpływu fenytoiny na stężenie alprazolamu w osoczu nie badano.
Choć w przypadku jednoczesnego stosowania benzodiazepin z kwasem walproinowym istnieje ryzyko
rozwoju psychozy, w przypadku alprazolamu tego rodzaju powikłań jak na razie nie opisywano. Działanie benzodiazepin antagonizuje teofilina.
Nie stwierdzono wpływu alprazolamu na czas protrombinowy czy stężenie warfaryny w osoczu.
Ciąża
Dane dotyczące działania teratogennego oraz wpływu na rozwój i zachowanie w okresie poporodowym po stosowaniu benzodiazepin są sprzeczne. Liczne dane z badań kohortowych wskazują, że ekspozycja na benzodiazepiny w pierwszym trymestrze nie wiąże się ze wzrostem częstości istotnych wad rozwojowych. Niektóre wczesne kliniczno-kontrolne badania epidemiologiczne wykazały jednak dwukrotny wzrost ryzyka rozszczepów wargi i podniebienia.
Leczenie benzodiazepinami w dużych dawkach w drugim i (lub) trzecim trymestrze ciąży powodowało ograniczenie aktywnych ruchów płodu oraz zmienny rytm serca płodu.
Jeśli ze względów medycznych alprazolam musi być podawany, nawet w małych dawkach,
w ostatnim etapie ciąży, może wystąpić tzw. zespół dziecka wiotkiego, np. hipotonia osiowa czy trudności ze ssaniem prowadzące do słabego przyrostu masy ciała. Takie objawy są odwracalne, ale mogą trwać od 1 do 3 tygodni, w zależności od okresu półtrwania produktu. Dla wysokich dawek
u noworodków może wystąpić depresja oddechowa lub bezdech oraz hipotermia. Ponadto, po kilku dniach od urodzenia mogą wystąpić objawy odstawienia - nadpobudliwość, pobudzenie i drżenie, nawet jeśli nie obserwuje się zespołu dziecka wiotkiego. Pojawienie się objawów z odstawienia po urodzeniu zależy od okresu półtrwania substancji czynnej.
Alprazolam nie jest zalecany do stosowania w okresie ciąży lub w okresie, kiedy pacjentka planuje
ciążę.
Jeśli alprazolam jest stosowany w trakcie ciąży lub jeśli pacjentka zajdzie w ciążę podczas stosowania
alprazolamu, należy oszacować zagrożenie dla płodu.
Jeśli konieczne jest podawanie alprazolamu w ostatnim okresie ciąży, należy unikać dużych dawek oraz prowadzić obserwację noworodka w kierunku objawów odstawienia i (lub) zespołu dziecka wiotkiego.
Karmienie piersią
Alprazolam przenika do mleka ludzkiego w małych stężeniach. Nie należy jednak stosować alprazolamu podczas karmienia piersią.
Xanax wywiera znaczny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Sedacja, amnezja, upośledzona koncentracja i upośledzona czynność mięśni mogą mieć niekorzystny wpływ na zdolność do prowadzenia pojazdów i obsługiwania maszyn. W przypadku niedostatecznej ilości snu, prawdopodobieństwo zaburzenia czujności może być zwiększone.
Podobnie jak w przypadku innych substancji działających na ośrodkowy układ nerwowy, pacjenci leczeni produktem Xanax powinni być ostrzeżeni, aby nie prowadzili pojazdów ani nie obsługiwali maszyn. Należy zapoznać się z aktualnymi, lokalnymi przepisami w zakresie prawa ruchu drogowego. Z tego samego powodu pacjentów należy ostrzec, by w trakcie leczenia produktem Xanax nie
spożywali alkoholu ani nie przyjmowali leków wywierających działanie depresyjne na ośrodkowy układ nerwowy.
Najbardziej uciążliwe działania niepożądane są wynikiem nadmiernego działania farmakologicznego
alprazolamu.
Wystąpienie niektórych działań niepożądanych całkowicie zależy od osobniczej podatności pacjenta oraz podanej dawki leku. Działania niepożądane zwykle obserwuje się na początku terapii. Ustępują one w miarę kontynuowania leczenia lub kiedy zmniejszy się dawkę.
Działania niepożądane związane ze stosowaniem alprazolamu u pacjentów uczestniczących
w kontrolowanych badaniach klinicznych i po wprowadzeniu produktu do obrotu to:
Klasyfikacja układów i narządów | Bardzo często ≥1/10 | Często ≥1/100 do <1/10 | Niezbyt często ≥1/1000 do <1/100 | Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) |
Zaburzenia endokrynologi- czne | Hiperprolakty- nemia* | |||
Zaburzenia metabolizmu i odżywiania | Zmniejszenie apetytu | |||
Zaburzenia psychiczne | Depresja | Stan splątania, dezorientacja, zmniejszenie libido, lęk, bezsenność, nerwowość, zwiększenie libido* | Mania* (patrz punkt 4.4), omamy*, gniew*, pobudzenie*, uzależnienie | Hipomania*, agresywne zachowanie*, wrogie zachowanie*, zaburzenia myślenia*, zwiększona aktywność psychoruchowa*, nadużywanie leku* |
Zaburzenia układu nerwowego | Uspokojenie, senność, ataksja, zaburzenia pamięci, zaburzenia mowy, zawroty głowy, ból głowy | Zaburzenia równowagi, nieprawidłowa koordynacja, zaburzenia koncentracji uwagi, nadmierna potrzeba snu, letarg, drżenie | Niepamięć | Zaburzenia układu nerwowego autonomiczne- go*, dystonia* |
Zaburzenia oka | Nieostre widzenie | |||
Zaburzenia żołądka i jelit | Zaparcia, suchość w jamie ustnej | Nudności | Zaburzenia żołądkowo- jelitowe* | |
Zaburzenia | Zapalenie |
Klasyfikacja układów i narządów | Bardzo często ≥1/10 | Często ≥1/100 do <1/10 | Niezbyt często ≥1/1000 do <1/100 | Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) |
wątroby i dróg żółciowych | wątroby*, czynnościowe zaburzenia wątroby*, żółtaczka* | |||
Zaburzenia skóry i tkanki podskórnej | Zapalenie skóry* | Obrzęk naczyniorucho- wy*, reakcje nadwrażliwości na światło* | ||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Osłabienie siły mięśniowej | |||
Zaburzenia nerek i dróg moczowych | Nietrzymanie moczu* | Zatrzymanie moczu* | ||
Zaburzenia układu rozrodczego i piersi | Zaburzenia czynności płciowych* | Nieregularne miesiączkowa- nie* | ||
Zaburzenia ogólne i stany w miejscu podania | Zmęczenie, drażliwość | Zespół odstawienia leku* | Obrzęki obwodowe* | |
Badania diagnostyczne | Zmniejszenie masy ciała, zwiększenie masy ciała | Zwiększenie ciśnienia wewnątrzgałko- wego* |
*Działanie niepożądane stwierdzone po wprowadzeniu produktu do obrotu
W wielu przypadkach pacjenci wykazujący wymienione objawy przyjmowali też inne leki o działaniu ośrodkowym i (lub) występowały u nich zaburzenia psychiczne. W jednym przypadku wysunięto hipotezę, że ryzyko wystąpienia powyższych działań niepożądanych może być większe u pacjentów
z zaburzeniami osobowości typu „borderline”, z zachowaniami agresywnymi w wywiadzie,
nadużywających alkoholu lub leków oraz u pacjentów cierpiących na zespół stresu pourazowego.
Następujące działania niepożądane benzodiazepin obserwowano rzadko lub bardzo rzadko: zaburzenia motoryki, padaczkę, objawy paranoi, depersonalizację, agranulocytozę, reakcje alergiczne oraz anafilaksję.
Inne działania niepożądane związane ze stosowaniem benzodiazepin:
Choć przedawkowanie benzodiazepin rzadko bywa stanem zagrożenia życia, nigdy nie wolno zapominać o tym, że pacjent mógł wraz z lekiem spożyć inne środki działające depresyjnie na OUN lub alkohol.
W przypadku przedawkowania jakiegokolwiek produktu leczniczego należy pamiętać o tym, że
pacjent mógł przyjąć wiele różnych substancji.
Należy też uwzględnić występujące u pacjenta inne choroby. Leczenie należy odpowiednio dostosować. Leczenie przedawkowania polega przede wszystkim na podtrzymywaniu oddechu
i krążenia. W przypadku śpiączki leczenie jest zasadniczo objawowe, uwzględniające zapobieganie takim powikłaniom, jak asfiksja w wyniku zapadnięcia się języka lub zachłyśnięcia treścią żołądkową. Aby nie dopuścić do odwodnienia konieczne jest dożylne podawanie płynów. W razie jednoczesnego przyjęcia przez pacjenta innych leków uspokajających, kluczowe znaczenie ma podtrzymywanie czynności życiowych.
Po przedawkowaniu doustnych benzodiazepin należy wywołać wymioty (w ciągu jednej godziny) - jeśli pacjent jest przytomny, bądź wykonać płukanie żołądka z równoczesną ochroną dróg oddechowych - jeśli pacjent jest nieprzytomny. Jeśli opróżnienie żołądka nie przyniesie skutku, należy podać węgiel aktywny w celu zmniejszenia absorpcji leku. Następnie można podać osmotyczny środek przeczyszczający. Ogólnie wiadomo, że po zażyciu bardzo dużych dawek leku efekty jego działania mogą utrzymywać się przez długi czas. Diureza wymuszona i hemodializa nie mają tu
zastosowania.
Objawy przedawkowania produktu leczniczego Xanax wynikają z jego działania farmakologicznego. Przedawkowanie benzodiazepin przejawia się zwykle różnym stopniem depresji ośrodkowego układu nerwowego: od senności do śpiączki. W łagodnych przypadkach objawy obejmują uczucie senności, splątania psychicznego i zmęczenia (apatii), w poważniejszych - ataksję, hipotonię, niedociśnienie, depresję oddechową, rzadko - śpiączkę, a bardzo rzadko - zgon.
Jako odtrutkę można dożylnie podawać flumazenil.
Stosowanie flumazenilu, jako odtrutki, przeciwwskazane jest w przypadku:
stosowanie trójpierścieniowych leków przeciwdepresyjnych).
Grupa farmakoterapeutyczna: pochodne benzodiazepin, kod ATC: N 05 BA 12
Xanax zawiera substancję czynną alprazolam - triazolobenzodiazepinę. Wszystkie benzodiazepiny wykazują jakościowo podobne właściwości – anksjolityczne, uspokajająco-nasenne, miorelaksacyjne i przeciwdrgawkowe. Występują jednak różnice pod względem farmakokinetyki determinujące różne ich zastosowanie w lecznictwie.
Przyjmuje się, że działanie benzodiazepin oparte jest na nasileniu hamowania neuronalnego
pośredniczonego przez kwas gamma-aminomasłowy.
Wchłanianie
Maksymalne stężenie produktu leczniczego Xanax w osoczu po podaniu doustnym osiągane jest
po 1-2 godzinach.
Dystrybucja
Okres półtrwania alprazolamu wynosi 12–15 godzin, a u osób w podeszłym wieku wynosi średnio 16
godzin. W warunkach in vitro alprazolam wiąże się z białkami surowicy w 80%.
Metabolizm
Alprazolam ulega przede wszystkim oksydacji. Głównymi metabolitami alprazolamu są
alfa-hydroksyalprazolam i pochodna benzofenonu. Stężenie w osoczu tych metabolitów jest bardzo małe. Aktywność biologiczna alfa-hydroksyalprazolamu jest około połowę mniejsza niż aktywność samego alprazolamu. Okresy półtrwania metabolitów alprazolamu są tego samego rzędu wielkości co alprazolamu.
Pochodna benzofenonu prawie nie wykazuje aktywności biologicznej.
Eliminacja
Eliminacja alprazolamu i jego metabolitów odbywa się głównie przez nerki.
Mutageneza
W teście Amesa in vitro nie stwierdzono mutagenności alprazolamu. Alprazolam nie wywoływał aberracji chromosomowych w teście mikrojąder in vitro u szczurów, aż do największej zbadanej dawki 100 mg/kg mc., czyli 500-krotnie przewyższającej maksymalną dawkę zalecaną u ludzi, wynoszącą 10 mg na dobę.
Rakotwórczość
Nie znaleziono dowodów na działanie rakotwórcze alprazolamu w trwających 2 lata badaniach biologicznych przeprowadzonych na szczurach w dawkach do 30 mg/kg mc./dobę (150-krotnie przewyższających maksymalną dawkę zalecaną u ludzi, wynoszącą 10 mg na dobę) oraz na myszach w dawkach do 10 mg/kg mc./dobę (50-krotnie przewyższających maksymalną dawkę zalecaną u ludzi, wynoszącą 10 mg na dobę).
Wpływ na płodność
Alprazolam nie zmniejszał płodności u szczurów, aż do największej zbadanej dawki
Wpływ na narząd wzroku
W badaniach na szczurach wykazano po podawaniu doustnym alprazolamu przez dwa lata w dawkach wynoszących 3, 10 i 30 mg/kg mc./dobę (15 do 150 razy przewyższających maksymalne dawki zalecane u ludzi wynoszące 10 mg na dobę) prowadzi do zależnego od dawki wzrostu częstości występowania zaćmy (samice) i wrastania naczyń w rogówkę (samce). Zmiany te występowały dopiero po 11 miesiącach leczenia.
W badaniach toksyczności przewlekłej prowadzonych przez 12 miesięcy na psach obserwowano napady drgawek (czasem zakończone zgonem) po dawkach wynoszących 3 mg/kg mc./dobę
(15-krotnie przewyższającej maksymalną dawkę zalecaną u ludzi). Czas trwania i częstość występowania napadów drgawek wykazywała zależność od dawki. Nie wiadomo, czy dane te można odnosić do stosowania leku u ludzi.
Laktoza jednowodna Celuloza mikrokrystaliczna
Sodu dwuoktylosulfobursztynian (85%) + sodu benzoesan (15%) (E 211) Krzemu dwutlenek koloidalny
Magnezu stearynian Skrobia kukurydziana
Ponadto tabletki Xanax 0,5 mg zawierają lak sodowo-glinowy z erytrozyną, a tabletki Xanax 1 mg lak sodowo-glinowy z erytrozyną i lak glinowy F.D. i C. Blue Nr 2.
Nie dotyczy.
3 lata.
Przechowywać w temperaturze poniżej 25°C. Przechowywać w normalnych warunkach wilgotności.
Xanax 0,25 mg, Xanax 0,5 mg, Xanax 1 mg: blistry PVC/Aluminium w tekturowym pudełku zawierające 30, 50 lub 100 tabletek.
Xanax 2 mg: butelka z oranżowego szkła w tekturowym pudełku zawierająca 30, 50 lub 100 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie
z lokalnymi przepisami.
DOPUSZCZENIE DO OBROTU
Upjohn EESV Rivium Westlaan 142
2909 LD Capelle aan den IJssel Holandia
Xanax 0,25 mg: Pozwolenie nr: R/0364 Xanax 0,5 mg: Pozwolenie nr: R/0365 Xanax 1 mg: Pozwolenie nr: R/0366 Xanax 2 mg: Pozwolenie nr: R/0367
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 21.10.1993
Data ostatniego przedłużenia pozwolenia: 11.05.2009
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
08.10.2021











