Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
w ostrym bólu zwykle
10 mg do 15 mg (0,1 do 0,15 mg/kg mc.) podskórnie lub domięśniowo, albo
2 mg do 8 mg dożylnie (z szybkością 2 mg/min).
W razie potrzeby dawki można powtarzać co 4 godziny.
w bólu przewlekłym 5 mg do 20 mg doustnie, podskórnie lub domięśniowo co 4 godziny. Pacjentom w podeszłym wieku zazwyczaj podaje się połowę dawki przeznaczonej dla młodszych osób dorosłych.
Dzieci i młodzież:
Nie zaleca się podawania morfiny doustnie.
W przypadku stosowania morfiny u noworodków i małych dzieci, ze względu na ich małą masę ciała, należy zachować ostrożność, ponieważ te grupy pacjentów mogą być bardziej wrażliwe na opioidy.
W przypadku stosowania produktu u noworodków lub niemowląt zaleca się stałą obserwację.
Podanie podskórne, domięśniowe
zwykle stosuje się podskórnie lub domięśniowo 0,1 do 0,2 mg/kg mc. (100 do
200 mikrogramów/kg mc.), w razie potrzeby co 4 godziny; nie należy przekraczać 15 mg na dawkę;
u noworodków zalecana dawka to 0,1 mg/kg mc. (100 mikrogramów/kg mc.) podskórnie, w razie potrzeby co 4 do 6 godzin.
Podanie dożylne
Ze względu na większe ryzyko występowania depresji oddechowej podczas zastosowania morfiny w postaci dożylnych infuzji ciągłych u dzieci zaleca się monitorowanie częstości tętna, oddechu
i saturacji krwi.
Noworodki przedwcześnie urodzone:
0,025 mg/kg mc. (25 mikrogramów/kg mc.) dożylnie w powolnej 30-minutowej infuzji. Kolejne dawki mogą być podawane w odstępach 8-godzinnych.
U dzieci ze skrajnym wcześniactwem dawkę można powtarzać co 12 godzin, proponowana infuzja ciągła 0,01-0,02 mg/kg mc./godzinę (10-20 mikrogramów/kg mc./godzinę).
Noworodki donoszone:
0,025-0,05 mg/kg mc. (25-50 mikrogramów/kg mc.) dożylnie co 6 godzin lub infuzja ciągła 0,01-0,03 mg/kg mc./godzinę (10-30 mikrogramów/kg mc./godzinę).
Niemowlęta w wieku do 6 miesiąca życia:
0,05 mg/kg mc. (50 mikrogramów/kg mc.) dożylnie co 4-6 godzin lub infuzja ciągła 0,01-0,03 mg/kg mc./godzinę (10-30 mikrogramów/kg mc./godzinę).
Niemowlęta w wieku powyżej 6 miesiąca życia do 12 miesiąca życia:
0,05-0,1 mg/kg mc. (50-100 mikrogramów/kg mc.) co 4 godziny lub infuzja ciągła 0,01-0,04 mg/kg mc./godzinę (10-40 mikrogramów/kg mc./godzinę).
Dzieci w wieku powyżej 1 roku życia oraz młodzież w wieku do 18 lat:
0,05-0,1 mg/kg mc. (50-100 mikrogramów/kg mc.) dożylnie co 2-4 godzin lub infuzja ciągła 0,01-0,04 mg/kg mc./godzinę (10-40 mikrogramów/kg mc./godzinę).
Leczenie bólu kontrolowane przez pacjenta (Patient-controlled analgesia, PCA) można stosować
u dzieci w wieku od 6 lat: wstrzyknięcia dożylne (bolusy) wynoszą od 0,015-0,02 mg/kg mc. (15 do 20 mikrogramów/kg mc.), po czym następuje okres bez możliwości wstrzyknięcia - czas blokady pompy wynosi od 10 do 15 minut. Można podawać wlew dożylny od 0,005-0,02 mg/kg mc./godzinę (5 do 20 mikrogramów/kg mc./godzinę).
Zaburzenia czynności wątroby
Patrz punkt 4.4
Zaburzenia czynności nerek
Zmniejszona dawka podtrzymująca może być konieczna w przypadku umiarkowanych do ciężkich zaburzeń czynności nerek. U dzieci stosować 75% dawki, jeśli klirens kreatyniny wynosi
10 - 50 ml/min/1,73 m2 i 50%, jeśli wynosi <10 ml/min/1,73 m2.
Ponieważ dawka podawana dziecku w wieku poniżej 12 lat jest często oparta na jego masie ciała,
zamieszczono poniższą tabelę, aby umożliwić sprawdzenie obliczonej dawki. W tabeli wykorzystano dane dotyczące wieku w oparciu o średnie wartości masy ciała.
UWAGA: Wyliczone dane dotyczą mocy 10 mg/ml; podczas użycia mocy 20 mg/ml należy dokonać przeliczenia.
Tabela 1.
Dawka
(w miligramach/kg mc.) oraz
(w mikrogramach/kg mc.)
Wiek (w
przybliżeniu)
Masa ciała pacjenta (w
kilogramach)
Dawka
w miligramach (mg)
Dawka Objętość
w mililitrach (ml)
0,05-0,1 mg/kg mc.
(50-100 mikrogramów/kg mc.)
1 rok
10
0,5-1 mg
0,05-0,1 ml
3 lata
15
0,75-1,5 mg
0,075-0,15 ml
5 lat
18
0,9-1,8 mg
0,09-0,18 ml
7 lat
23
1,15-2,3 mg
0,115-0,23 ml
10 lat
30
1,5-3 mg
0,15-0,3 ml
12 lat
39
1,95-3,9 mg
0,195-0,39 ml
Dawki i objętości dla dzieci muszą być obliczane, mierzone i dokładnie sprawdzane przez kompetentny personel medyczny, aby uniknąć błędów. Szczególną ostrożność należy zachować podczas pomiaru bardzo małych objętości.
Po obliczeniu, dane zawarte w powyższych tabelach należy wykorzystać do sprawdzenia, czy dawka i objętość są odpowiednie dla konkretnego wieku i wagi dziecka.
Produkt należy stosować systematycznie. Jeśli zachodzi taka potrzeba, lekarz może dokonać zmian w dawkowaniu.
Przerwanie leczenia
Wystąpienie zespołu abstynencyjnego może zostać przyspieszone, jeśli nagle zaprzestanie się podawania leku opioidowego. Dlatego przed planowanym odstawieniem leku, jego dawkę należy zmniejszać stopniowo.
Sposób podawania
Produkt podaje się podskórnie, domięśniowo lub dożylnie.
Dorosłym pacjentom lekarz może zalecić rozcieńczenie zawartości ampułki wodą i zażycie doustne.
Morphini sulfas WZF 10 mg/ml i Morphini sulfas WZF 20 mg/ml można rozcieńczać – sposób rozcieńczania podano w punkcie 6.6.
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Upośledzenie oddychania lub choroba obturacyjna górnych dróg oddechowych
Kolka wątrobowa
Ostre zatrucie alkoholem
Stosowanie inhibitorów monoaminooksydazy i okres 2 tygodni po ich odstawieniu
Stany chorobowe przebiegające z drgawkami
Urazy głowy
Zespół ostrego brzucha
Guz chromochłonny nadnerczy
Podwyższone ciśnienie wewnątrzczaszkowe
Śpiączka
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
niewydolność układu oddechowego może prowadzić do śmierci, niedociśnienia z niewydolnością serca, obniżenia temperatury ciała, drgawek (szczególnie u niemowląt i dzieci), rozpadu mięśni poprzecznie prążkowanych prowadzącego do niewydolności nerek.
Może wystąpić zachłystowe zapalenie płuc.
Postępowanie w przypadku przedawkowania: przywrócenie drożności dróg oddechowych i wentylacji płuc, poprzez wdrożenie tlenoterapii. Równocześnie należy podać dożylnie nalokson w dawce
5 g/kg mc. oraz w razie potrzeby inne leki działające objawowo. Wstrzyknięcia naloksonu można
w miarę potrzeby powtarzać co 2-3 minuty. Brak poprawy po naloksonie wskazuje na inną przyczynę zatrucia i śpiączki.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania Ampułki szklane w tekturowym pudełku. 10 ampułek po 1 ml
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
w 0,9% roztworze NaCl do wstrzykiwań
w wodzie do wstrzykiwań w stosunku 1:10.
Stężenie siarczanu morfiny w roztworze otrzymanym po rozcieńczeniu wynosi odpowiednio: 1 mg/ml (Morphini sulfas WZF, 10 mg/ml);
2 mg/ml (Morphini sulfas WZF, 20 mg/ml).
Okres ważności rozcieńczonego produktu Morphini sulfas WZF, 10 mg/ml i Morphini sulfas WZF, 20 mg/ml – patrz punkt 6.3.
Mieszanie Morphini sulfas WZF 20 mg/ml z midazolamem (produktem Midanium 5 mg/ml) (patrz ostrzeżenie w punkcie 4.5):
Wykazano, że produkt Morphini sulfas WZF 20 mg/ml można mieszać z produktem Midanium 5 mg/ml w zakresie podanych niżej proporcji substancji czynnych:
10 mg morfiny siarczanu z midazolamem w dawce od 1,66 mg do 10 mg.
W celu uzyskania mieszaniny 10 mg morfiny siarczanu : 1,66 mg midazolamu należy zmieszać 2,1 ml produktu Morphini sulfas WZF 20 mg/ml z 1,4 ml produktu Midanium 5 mg/ml.
W celu uzyskania mieszaniny 10 mg morfiny siarczanu : 10 mg midazolamu należy zmieszać 1,0 ml produktu Morphini sulfas WZF 20 mg/ml z 4,0 ml produktu Midanium 5 mg/ml.
Okres ważności mieszaniny – patrz punkt 6.3.
Instrukcja otwierania ampułki
Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu.
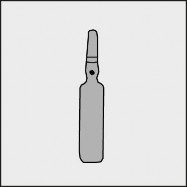
Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia.
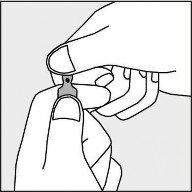
Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki.
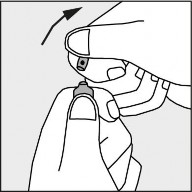
Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
MORPHINI SULFAS WZF, 10 mg/ml, roztwór do wstrzykiwań MORPHINI SULFAS WZF, 20 mg/ml, roztwór do wstrzykiwań
Morphini Sulfas WZF, 10 mg/ml, roztwór do wstrzykiwań
Każdy ml roztworu zawiera 10,0 mg morfiny siarczanu (Morphini sulfas).
Substancje pomocnicze o znanym działaniu: sodu pirosiarczyn (E 223) oraz sód. Każdy ml roztworu zawiera 1,0 mg sodu pirosiarczynu oraz 0,148 mmol (3,40 mg) sodu.
Morphini Sulfas WZF, 20 mg/ml, roztwór do wstrzykiwań
Każdy ml roztworu zawiera 20,0 mg morfiny siarczanu (Morphini sulfas).
Substancje pomocnicze o znanym działaniu: sodu pirosiarczyn (E 223) oraz sód. Każdy ml roztworu zawiera 1,0 mg sodu pirosiarczynu oraz 0,130 mmol (2,99 mg) sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań
Bezbarwny lub jasnożółty przezroczysty płyn
Morfina jest wskazana w bólu ostrym i przewlekłym o nasileniu od umiarkowanego do silnego, który nie ustępuje po zastosowaniu leków przeciwbólowych innych niż opioidowe. Morfina jest stosowana we wszystkich rodzajach bólu, w tym pooperacyjnych i przewlekłych, najczęściej pochodzenia nowotworowego, z wyjątkiem bólu spowodowanego skurczem mięśni gładkich, np. dróg żółciowych.
Dawkowanie
Dawkowanie należy ustalać indywidualnie dla każdego pacjenta. Dawkowanie zwykle stosowane:
Dorośli:
Produktu nie należy podawać podpajęczynówkowo i nadtwardówkowo.
Podanie podskórne produktu nie jest wskazane dla pacjentów ze złym stanem miejscowym skóry (uszkodzenie skóry, miejscowy stan zapalny, obrzęk limfatyczny) ze względu na ryzyko wystąpienia infekcji i zaburzone wchłanianie leku.
Opioidowe leki przeciwbólowe należy podawać ostrożnie lub w zmniejszonych dawkach pacjentom z niedoczynnością tarczycy, astmą, zmniejszoną rezerwą oddechową, przerostem gruczołu
krokowego, niedociśnieniem, wstrząsem, chorobami zapalnymi lub upośledzeniem drożności jelit, miastenią, a także pacjentom nadużywającym leków.
Niewydolność nadnerczy:
Opioidowe leki przeciwbólowe mogą spowodować nieodwracalną niewydolność nadnerczy
i konieczność obserwowania pacjenta oraz zastosowania terapii zastępczej glikokortykosteroidami. Objawy niewydolności nadnerczy mogą obejmować np. nudności, wymioty, utratę apetytu,
zmęczenie, osłabienie, zawroty głowy lub niskie ciśnienie krwi.
Zmniejszone wydzielanie hormonów płciowych i zwiększone wydzielanie prolaktyny:
Długotrwałe stosowanie opioidowych leków przeciwbólowych może wiązać się ze zmniejszeniem wydzielania hormonów płciowych i zwiększeniem wydzielania prolaktyny. Objawy obejmują
zmniejszenie popędu seksualnego, impotencję lub brak miesiączki.
Morfina może powodować wzrost ciśnienia w drogach żółciowych, co wynika z wpływu na zwieracz Oddiego. Dlatego u pacjentów z kolką wątrobową lub innymi zaburzeniami dróg żółciowych morfina może nasilić dolegliwości bólowe. Morfina podawana pacjentom po zabiegu usunięcia pęcherzyka
żółciowego, powodowała wystąpienie bólu.
Podczas podawania morfiny pacjentom z zaburzeniem czynności wątroby zaleca się ostrożność, ponieważ metabolizm morfiny przebiega w wątrobie.
U osób z zaburzeniem czynności nerek, po podaniu morfiny, stwierdzano długotrwałe zahamowanie czynności oddechowej o ciężkim przebiegu.
U pacjentów w podeszłym wieku oraz osłabionych należy zmniejszyć dawki morfiny.
Potencjał nadużycia morfiny jest podobny jak w przypadku innych silnych leków opioidowych, dlatego morfinę należy stosować ze szczególną ostrożnością u pacjentów, którzy w przeszłości nadużywali alkoholu lub leków.
Uzależnienie i zespół odstawienny (abstynencyjny):
Stosowanie opioidowych leków przeciwbólowych może prowadzić do rozwoju fizycznego i (lub) psychicznego uzależnienia bądź tolerancji. Związane z tym ryzyko wzrasta w miarę stosowania leku oraz podczas stosowania w większych dawkach. Objawy można ograniczyć poprzez dostosowanie dawki lub postaci leku oraz stopniowe odstawianie morfiny. U chorych otrzymujących morfinę ze wskazań medycznych uzależnienie występuje rzadko. Informacje na temat poszczególnych objawów - patrz punkt 4.8.
W trakcie leczenia, zwłaszcza podczas stosowania w dużych dawkach, może wystąpić hiperalgezja, która nie reaguje na dalsze zwiększenie dawki morfiny. Może być konieczne zmniejszenie dawki morfiny lub zmiana leku opioidowego.
Ostry zespół klatki piersiowej (ang. acute chest syndrome, ACS) u pacjentów z niedokrwistością sierpowatokrwinkową:
Ze względu na możliwe powiązanie między ostrym zespołem klatki piersiowej a podawaniem morfiny pacjentom z niedokrwistością sierpowatokrwinkową otrzymującym morfinę w czasie kryzysu naczyniowo-okluzyjnego, należy uważnie obserwować, czy nie występują u nich objawy ostrego
zespołu klatki piersiowej.
Ryzyko związane z jednoczesnym stosowaniem leków uspokajających, np. benzodiazepin lub leków pochodnych:
Jednoczesne stosowanie leku Morphini sulfas WZF i leków uspokajających, np. benzodiazepin lub leków pochodnych, może prowadzić do wystąpienia nadmiernego uspokojenia, depresji oddechowej, śpiączki lub śmierci. Z tego względu leczenie skojarzone z takimi lekami uspokajającymi należy stosować wyłącznie u pacjentów, u których nie są dostępne alternatywne metody leczenia. Jeśli
zostanie podjęta decyzja o stosowaniu leku Morphini sulfas WZF w skojarzeniu z lekami uspokajającymi, należy podać najmniejszą skuteczną dawkę, a czas leczenia powinien być możliwie jak najkrótszy.
Należy uważnie obserwować, czy u pacjenta nie występują objawy związane z depresją oddechową
i nadmierne uspokojenie. W tym kontekście zdecydowanie zaleca się poinformowanie pacjentów i ich opiekunów o możliwości wystąpienia takich objawów (patrz punkt 4.5).
Ryfampicyna może zmniejszać stężenie morfiny w osoczu. Należy obserwować działanie przeciwbólowe morfiny oraz odpowiednio dostosować dawkowanie morfiny w trakcie i po zakończeniu leczenia ryfampicyną.
Doustna terapia przeciwpłytkowa inhibitorem P2Y12
W pierwszym dniu leczenia skojarzonego inhibitorem P2Y12 i morfiną obserwowano zmniejszenie skuteczności leczenia inhibitorem P2Y12 (patrz punkt 4.5).
Produkt zawiera sodu pirosiarczyn (E 223) - rzadko może powodować ciężkie reakcje nadwrażliwości i skurcz oskrzeli.
Morphini sulfas WZF 10 mg/ml zawiera 0,148 mmol/ml (3,40 mg/ml) sodu, czyli mniej niż 1 mmol (23 mg) sodu w 1 ml roztworu, to znaczy produkt uznaje się za „wolny od sodu”.
Morphini sulfas WZF 20 mg/ml zawiera 0,130 mmol/ml (2,99 mg/ml) sodu, czyli mniej niż 1 mmol (23 mg) sodu w 1 ml roztworu, to znaczy produkt uznaje się za „wolny od sodu”.
Produkt może być rozcieńczany w: 0,9% roztworze NaCl lub w wodzie do wstrzykiwań. Zawartość sodu pochodzącego z rozcieńczalnika, powinna być brana pod uwagę w obliczeniu całkowitej
zawartości sodu w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika.
Leki uspokajające, np. benzodiazepiny lub leki pochodne:
Jednoczesne stosowanie leków opioidowych i leków uspokajających, np. benzodiazepin lub leków pochodnych, zwiększa ryzyko wystąpienia nadmiernego uspokojenia, depresji oddechowej, śpiączki lub śmierci na skutek addytywnego działania depresyjnego na OUN. Należy ograniczyć dawkę leku i czas trwania leczenia skojarzonego (patrz punkt 4.4).
W przypadku stosowania midazolamu i opioidów zwiększa się ryzyko wystąpienia depresji oddechowej, dlatego takie przypadki wymagają obserwacji.
Działanie uspokajające morfiny (także innych opioidowych leków przeciwbólowych) nasilają substancje działające na ośrodkowy układ nerwowy, takie jak alkohol, leki znieczulające, nasenne, uspokajające, przeciwlękowe, trójpierścieniowe leki przeciwdepresyjne oraz pochodne fenotiazyny.
Morfina nasila działanie hipotensyjne leków uspokajających, leków przeciwpsychotycznych i innych leków obniżających ciśnienie tętnicze. Nasila również działanie alkoholu.
Leki cholinolityczne, takie jak atropina, mogą jedynie częściowo odwrócić skurcz dróg żółciowych, lecz wywierają wpływ na przewód pokarmowy i drogi moczowe, w wyniku czego mogą wystąpić
ciężkie zaparcia i zatrzymanie moczu.
Opioidowe leki przeciwbólowe zmniejszają stężenie cyprofloksacyny w osoczu. Nie zaleca się stosowania opioidowych leków przeciwbólowych w premedykacji, jeśli stosowana jest cyprofloksacyna.
Podczas stosowania z morfiną może wystąpić hamowanie działania na układ pokarmowy cyzaprydu, metoklopramidu i domperydonu.
Stwierdzano wysoką temperaturę ciała oraz działanie toksyczne na ośrodkowy układ nerwowy podczas stosowania morfiny i leków dopaminergicznych, także selegiliny.
Morfina opóźnia wchłanianie meksyletyny.
Cymetydyna (antagonista receptora H2) może hamować metabolizm opioidowych leków przeciwbólowych, szczególnie petydyny (zwiększa się stężenie w osoczu).
U pacjentów z ostrym zespołem wieńcowym leczonych morfiną obserwowano opóźnioną
i zmniejszoną ekspozycję na doustną terapię przeciwpłytkową inhibitorem P2Y12. Interakcja ta, może być związana ze zmniejszoną ruchliwością przewodu pokarmowego i dotyczyć innych opioidów.
Znaczenie kliniczne nie jest znane, jednak dane wskazują na możliwość zmniejszenia skuteczności inhibitora P2Y12 u pacjentów otrzymujących jednocześnie morfinę i inhibitor P2Y12 (patrz punkt 4.4). U pacjentów z ostrym zespołem wieńcowym, u których nie można wstrzymać podawania morfiny, a szybkie hamowanie P2Y12 uznaje się za kluczowe, można rozważyć zastosowanie pozajelitowego inhibitora P2Y12.
Ciąża
Stosowanie produktu u kobiet w ciąży wymaga zachowania szczególnej ostrożności. Morfina może być stosowana u kobiet w ciąży wyłącznie w przypadku zdecydowanej konieczności.
Nie zaleca się stosowania morfiny w czasie porodu, niezależnie od drogi podania.
Należy obserwować, czy u noworodków, których matki przyjmowały w trakcie ciąży opioidowe leki przeciwbólowe, nie występują objawy noworodkowego zespołu odstawiennego (abstynencyjnego). Leczenie może obejmować zastosowanie leków opioidowych oraz leczenie objawowe.
U noworodków urodzonych przez matki przyjmujące długotrwale morfinę mogą wystąpić objawy zespołu odstawiennego, w tym nadpobudliwość, zaburzenia czynności żołądka i jelit, ciężkie
zaburzenia oddychania, ziewanie, kichanie, osutka plamista, podwyższona temperatura ciała.
Karmienie piersią
Morfina przenika do mleka kobiecego. Nie ustalono, jaki ma to wpływ na niemowlę karmione piersią. Należy zachować ostrożność podczas stosowania produktu u kobiet karmiących piersią.
Płodność
W badaniach na zwierzętach wykazano, że morfina może powodować zmniejszenie płodności (patrz punkt 5.3 Przedkliniczne dane dotyczące bezpieczeństwa stosowania).
Morfina zmniejsza sprawność psychofizyczną. Podczas stosowania produktu nie należy prowadzić pojazdów i obsługiwać maszyn.
Działania niepożądane podano według klasyfikacji układ/narząd i częstości: rzadko (≥1/10 000 do <1/1 000), nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia układu immunologicznego
Rzadko: reakcje anafilaktyczne po dożylnym podaniu morfiny Częstość nieznana: reakcje anafilaktoidalne
Zaburzenia psychiczne
Częstość nieznana: niepokój, nastrój dysforyczny, omamy, uzależnienie
Morfina stosowana długotrwale może prowadzić do uzależnienia psychicznego i fizycznego, a przy nagłym przerwaniu długotrwałego leczenia, do wystąpienia zespołu abstynencyjnego.
Zaburzenia układu nerwowego
Częstość nieznana: senność, stan splątania, podwyższone ciśnienie wewnątrzczaszkowe, zawroty głowy, allodynia, hiperalgezja (patrz punkt 4.4), nadmierna potliwość
Zaburzenia oka
Częstość nieznana: zwężenie źrenic
Zaburzenia serca
Częstość nieznana: bradykardia, kołatanie serca
Zaburzenia naczyniowe
Częstość nieznana: niedociśnienie tętnicze, niedociśnienie ortostatyczne
Zaburzenia żołądka i jelit
Częstość nieznana: suchość w ustach, zaparcia, nudności, wymioty
Zaburzenia wątroby i dróg żółciowych
Częstość nieznana: skurcz dróg żółciowych
Zaburzenia skóry i tkanki podskórnej Częstość nieznana: pokrzywka, świąd
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Częstość nieznana: sztywność mięśniowa
Zaburzenia nerek i dróg moczowych
Częstość nieznana: trudności w oddawaniu moczu, skurcz moczowodów, działanie antydiuretyczne
Zaburzenia ogólne i stany w miejscu podania
Częstość nieznana: zaczerwienienie twarzy, potliwość, kontaktowe zapalenie skóry, ból i podrażnienie w miejscu wstrzyknięcia, zespół odstawienny (abstynencyjny)
Uzależnienie od leku i zespół odstawienny (abstynencyjny)
Stosowanie opioidowych leków przeciwbólowych może prowadzić do rozwoju fizycznego i (lub) psychicznego uzależnienia bądź tolerancji. Wystąpienie zespołu abstynencyjnego może zostać
przyspieszone, jeśli nagle zaprzestanie się podawania leku opioidowego lub antagonistów receptorów opioidowych, a czasami może do niego dojść między kolejnymi dawkami. Informacje dotyczące postępowania - patrz punkt 4.4.
Fizjologiczne objawy odstawienia obejmują: bóle ciała, drgawki, zespół niespokojnych nóg, biegunka, kolka brzuszna, nudności, objawy grypopodobne, tachykardia i rozszerzenie źrenic. Do objawów psychicznych należą: nastrój dysforyczny, niepokój i drażliwość. U osób uzależnionych od leków
często występuje „głód lekowy”.
Tolerancja na produkt rozwija się przy dłuższym stosowaniu. Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Oznakami przedawkowania są: bardzo silne zwężenie źrenic („szpilkowate źrenice”), śpiączka, płytki oddech, sinica, chłodna skóra, wiotkość kończyn. Może dojść do zahamowania czynności oddechowej
Grupa farmakoterapeutyczna: naturalne alkaloidy opium; morfina, kod ATC: N02AA01
Morfina jest alkaloidem opium. Jest silnym opioidowym lekiem przeciwbólowym, skutecznym
w leczeniu bólów pochodzenia nocyceptywnego. Działa poprzez receptory opioidowe rozmieszczone w ośrodkowym układzie nerwowym. Szczególne powinowactwo wykazuje do receptorów μ.
Morfina działa przeciwbólowo poprzez ośrodkowy układ nerwowy. Wywołuje także senność, zmiany nastroju, obniżenie temperatury ciała, zależne od dawki zahamowanie czynności oddechowej.
Działanie przeciwbólowe powodowane jest również przez modyfikację uwalniania substancji neuroprzekaźnikowych z włókien nerwowych aferentnych. Do migracji i zwiększonej koncentracji receptorów opioidowych dochodzi w tkankach zmienionych zapalnie, co wpływa na obwodowe działanie przeciwbólowe morfiny.
Morfina wywiera również działania obwodowe: rozszerza naczynia krwionośne, początkowo zwiększa, a następnie obniża napięcie mięśniówki gładkiej przewodu pokarmowego i dróg moczowych, przy zachowanym skurczu zwieraczy. Działanie to może powodować opóźnienie
opróżniania żołądka i przedłużenie przebywania w nim treści pokarmowej, zahamowanie perystaltyki jelit, zaparcia, zwiększenie ciśnienia w drogach żółciowych, zaburzenia oddawania moczu. Morfina hamuje czynność wydzielniczą kory nadnerczy pod wpływem czynników stresowych. Morfina
zmniejsza duszność w niewydolności lewej komory serca i obrzęku płuc. Morfina nie wpływa na odruchy ścięgniste (np. rzepkowy oraz ze ścięgna Achillesa) oraz autonomiczne.
Opioidowe leki przeciwbólowe mogą powodować uwalnianie histaminy, co u pacjentów z astmą może wywołać skurcz oskrzeli.
Wchłanianie
Wchłanianie jest zmienne po podaniu doustnym; szybkie po podaniu podskórnym lub domięśniowym.
Stężenie we krwi
Po podaniu doustnym dawki 10 mg morfiny w postaci siarczanu, maksymalne stężenie we krwi występuje w czasie 15 do 60 minut.
Po podaniu domięśniowym dawki 10 mg, maksymalne stężenie w surowicy obserwowano po 10 do 20 min.
Po podaniu dożylnym dawki 10 mg, maksymalne stężenie w surowicy wynoszące 60 ng/ml występuje w czasie 15 minut i zmniejsza się o połowę po 30 minutach; po 3 godzinach wynosi 10 ng/ml.
Po podaniu podskórnym stężenia po 15 minutach podobne są do stężeń uzyskiwanych po podaniu domięśniowym, lecz pozostają większe w czasie następnych 3 godzin.
Stężenia morfiny w surowicy zmierzone wkrótce po podaniu wykazują ścisły związek z wiekiem pacjenta i są większe u osób w podeszłym wieku.
Okres półtrwania
Okres półtrwania morfiny po podaniu domięśniowym lub dożylnym wynosi 1,5 do 4,5 godziny.
U noworodków, w tym przedwcześnie urodzonych, ze względu na znaczną niedojrzałość enzymatyczną wątroby i związaną z tym mniejszą aktywność transferazy glukuronowej
odpowiedzialnej za metabolizm morfiny (procesu jej sprzęgania z kwasem glukuronowym), a także niedojrzałość nerek odpowiedzialnych za wydalanie jej aktywnych metabolitów, okres jej półtrwania jest wyraźnie wydłużony i wynosi w grupie wcześniaków dla pojedynczej dawki podanej dożylnie około 9 godzin, a u noworodków donoszonych około 6 godzin. U niemowląt i małych dzieci okres półtrwania wynosi około 2 godziny. U noworodków stężenie białek osoczowych jest niskie, a więc frakcja wolna czyli aktywna tego leku osiąga wysokie stężenia, wyższe niż u dzieci starszych.
Dystrybucja
Morfina jest rozmieszczana w całym organizmie, głównie w nerkach, wątrobie, tkance płucnej
i śledzionie. Mniejsze stężenia stwierdzane są w tkance mózgowej i mięśniowej. Morfina przenika przez barierę łożyska, a jej śladowe ilości wydzielane są w pocie i mleku.
W terapeutycznym zakresie stężeń morfina wiąże się w 35% z białkami - albuminami i immunoglobulinami.
Metabolizm
Polega głównie na sprzęganiu z kwasem glukuronowym (z wytworzeniem 3- i 6-glukuronidów) oraz z siarczanami. Procesy N-demetylacji, O-metylacji i tworzenia N-tlenków glukuronidów zachodzą
w błonie śluzowej jelit i w wątrobie, przy czym N-demetylacja zachodzi w większym stopniu po podaniu doustnym niż pozajelitowym.
Eliminacja
Po podaniu doustnym, około 60% produktu ulega wydaleniu z moczem w ciągu 24 godzin; około 3% ulega wydaleniu jako wolna morfina w ciągu 48 godzin.
Po podaniu pozajelitowym, około 90% ulega wydaleniu w ciągu 24 godzin, przy czym około 10%
w postaci wolnej morfiny, 65 do 70% w postaci sprzężonej, 1% jako normorfina i 3% jako glukuronid normorfiny.
Morfina jest wydalana z moczem - wraz ze wzrostem kwasowości moczu więcej morfiny ulega wydaleniu w postaci wolnej, zaś wraz ze wzrostem zasadowości moczu więcej morfiny ulega wydaleniu w postaci sprzężonej z glukuronidem. Około 10% dawki może być wydalone z żółcią.
Nie przeprowadzono badań na zwierzętach, dotyczących działania rakotwórczego i mutagennego morfiny.
U samców szczurów stwierdzono zmniejszenie płodności i uszkodzenia chromosomów w gametach.
Sodu chlorek
Sodu pirosiarczyn (E 223) Disodu edetynian
Woda do wstrzykiwań
Wykazano niezgodność fizykochemiczną (powstawanie osadów) między roztworami siarczanu morfiny i 5-fluorouracylu.
Morfina tworzy nierozpuszczalne połączenia z heparyną. Nie należy mieszać roztworów morfiny i heparyny w jednej strzykawce.
4 lata
Okres ważności po pierwszym otwarciu ampułki Zużyć natychmiast po otwarciu.
Okres ważności rozcieńczonego produktu Morphini sulfas WZF o mocach 10 mg/ml i 20 mg/ml po rozcieńczeniu (przygotowanie rozcieńczeń - patrz punkt 6.6)
Wykazano chemiczną i fizyczną stabilność przez 24 godziny w 25°C. Roztwór należy przygotować bezpośrednio przed podaniem.
Z mikrobiologicznego punktu widzenia, rozcieńczony produkt należy zużyć natychmiast. Jeżeli nie zostanie zużyty natychmiast, za warunki i czas przechowywania odpowiedzialność ponosi użytkownik. Jeżeli zachodzi konieczność, sporządzony roztwór można przechowywać maksymalnie przez 24 godziny w temperaturze 25○C, pod warunkiem, że rozcieńczenie przygotowuje się w kontrolowanych i walidowanych aseptycznych warunkach. Niewykorzystany w ciągu 24 godzin roztwór należy wyrzucić.
Okres ważności mieszaniny produktu Morphini sulfas WZF 20 mg/ml z produktem Midanium 5 mg/ml - 24 godziny (przygotowanie mieszaniny – patrz punkt 6.6).
Wykazano chemiczną i fizyczną stabilność przez 24 godziny w 25°C. Mieszaninę należy przygotować bezpośrednio przed podaniem.
Z mikrobiologicznego punktu widzenia, przygotowaną mieszaninę należy zużyć natychmiast. Jeżeli nie zostanie zużyta natychmiast, za warunki i czas przechowywania odpowiedzialność ponosi użytkownik. Jeżeli zachodzi konieczność, sporządzoną mieszaninę można przechowywać maksymalnie przez 24 godziny w temperaturze 25°C, pod warunkiem, że mieszaninę przygotowuje się
w kontrolowanych i walidowanych aseptycznych warunkach. Niewykorzystaną w ciągu 24 godzin mieszaninę należy wyrzucić. Przygotowana mieszanina nie wymaga ochrony przed światłem.
Przechowywać w temperaturze poniżej 25°C. Chronić od światła. Nie zamrażać.
Warunki przechowywania po pierwszym otwarciu i po rozcieńczeniu produktu oraz po zmieszaniu Morphini sulfas WZF 20 mg/ml z midazolamem (produktem Midanium 5 mg/ml) - patrz punkt 6.3.
Rozcieńczanie:
Produkt Morphini sulfas WZF, 10 mg/ml i Morphini sulfas WZF, 20 mg/ml może być podawany bez rozcieńczenia lub po rozcieńczeniu:
Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
Rysunek 1.
Rysunek 2.
Rysunek 3.
Warszawskie Zakłady Farmaceutyczne Polfa S.A. ul. Karolkowa 22/24; 01-207 Warszawa
10 mg/ml – Pozwolenie nr 4049
20 mg/ml – Pozwolenie nr 4050
10 mg/ml:
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 08.03.1998 r. Data ostatniego przedłużenia pozwolenia: 06.07.2012 r.
20 mg/ml:
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 08.03.1998 r. Data ostatniego przedłużenia pozwolenia: 06.07.2012 r.











