Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
dawka (0,5 ml) po rekonstytucji zawiera:
Wirus ospy wietrznej1, szczep Oka (żywy, atenuowany)
nie mniej niż 103,3 PFU2
1 namnażany w ludzkich komórkach diploidalnych linii MRC-5
2 PFU – (od ang. Plaque forming unit) - jednostka tworząca łysinkę
Szczepionka zawiera śladowe ilości neomycyny (patrz punkt 4.3). Substancje pomocnicze o znanym działaniu:
Szczepionka zawiera 6 mg sorbitolu na dawkę.
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
osób zdrowych w wieku od ukończenia 9. miesiąca życia do 11 miesięcy włącznie (patrz punkt 5.1), w szczególnych okolicznościach;
osób zdrowych w wieku od ukończenia 12. miesiąca życia (patrz punkt 5.1);
w ramach profilaktyki poekspozycyjnej osób zdrowych, podatnych na ospę wietrzną, stosowanej w ciągu 72 godzin od kontaktu z osobą zakażoną (patrz punkty 4.4 i 5.1);
osób zagrożonych ciężkim przebiegiem ospy wietrznej (patrz punkty 4.3, 4.4 i 5.1).
Stosowanie szczepionki Varilrix powinno być zgodne z oficjalnymi zaleceniami.
Dawkowanie i sposób podawania
Jedna dawka szczepionki Varilrix może zostać podana osobom, które już wcześniej otrzymały jedną dawkę innej szczepionki zawierającej wirus ospy wietrznej.
Po podaniu jednej dawki szczepionki Varilrix może zostać podana jedna dawka innej szczepionki zawierającej wirus ospy wietrznej.
Szczepionka Varilrix powinna być wstrzyknięta podskórnie (sc.) lub domięśniowo (im.), w okolicę mięśnia naramiennego lub w przednio-boczną część uda.
U osób z zaburzeniami krzepnięcia krwi (np. z małopłytkowością lub innymi zaburzeniami krzepnięcia), szczepionka Varilrix powinna być podawana podskórnie.
Informacje dotyczące przygotowania produktu leczniczego do podania, patrz punkt 6.6.
Przeciwwskazania
osoby z niedoborem odporności z całkowitą liczbą limfocytów poniżej 1200 na mm3;
osoby wykazujące inne objawy braku odporności komórkowej (np. pacjenci z białaczką, chłoniakiem, dyskrazją krwi, klinicznymi objawami zakażenia wirusem HIV);
osoby otrzymujące leczenie immunosupresyjne, w tym duże dawki kortykosteroidów;
ciężki, złożony niedobór odporności;
agammaglobulinemia;
AIDS lub objawowe zakażenie wirusem HIV lub odsetek limfocytów T CD4+, zależnie od wieku, u dzieci w wieku poniżej 12 miesięcy: CD4+ <25%; u dzieci w wieku między 12 a 35 miesięcy: CD4+ <20%; u dzieci w wieku między 36 a 59 miesięcy: CD4+ <15%.
Varilrix jest przeciwwskazany u osób, u których wcześniej wystąpiły objawy nadwrażliwości po podaniu szczepionki przeciw ospie wietrznej.
Ciąża. Ponadto, należy unikać zajścia w ciążę przez miesiąc po zaszczepieniu (patrz punkt 4.6).
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
osoby z obniżoną odpornością (patrz punkt 4.3 i 4.4);
kobiety w ciąży, u których nie stwierdzono w wywiadzie wcześniejszego zachorowania na ospę
wietrzną ani nie potwierdzono laboratoryjnie wcześniejszej infekcji;
noworodki od matek, u których nie stwierdzono w wywiadzie wcześniejszego zachorowania na ospę wietrzną ani nie potwierdzono laboratoryjnie wcześniejszej infekcji.
Pojawiająca się u zdrowych osób, kontaktujących się z zaszczepionymi, łagodna wysypka dowodzi, iż wirus pozostaje w postaci atenuowanej po pasażu przez organizm człowieka.
Pacjenci z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej
Dostępne są jedynie ograniczone dane z badań klinicznych dla szczepionki Varilrix (formulacja +4°C) u osób z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej.
Można rozważyć szczepienie u pacjentów z wybranymi rodzajami niedoborów odporności
w przypadku, gdy korzyści przewyższają ryzyko (np. pacjenci z bezobjawowym zakażeniem HIV, niedobór podklas IgG, wrodzona neutropenia, przewlekła choroba ziarniniakowa oraz choroby przebiegające z niedoborem dopełniacza).
Pacjenci z niedoborami odporności, u których nie stwierdza się przeciwwskazań do szczepienia (patrz punkt 4.3), mogą odpowiedzieć na szczepienie słabiej niż pacjenci z prawidłową czynnością układu immunologicznego; dlatego w przypadku kontaktu z wirusem ospy wietrznej niektóre z tych osób mogą zachorować na ospę wietrzną pomimo prawidłowego podania szczepionki. Tych pacjentów należy starannie monitorować pod kątem występowania objawów ospy wietrznej.
W przypadku rozważania zaszczepienia osób z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej, zaleca się, aby:
wstrzymać chemioterapię podtrzymującą na tydzień przed szczepieniem i tydzień po szczepieniu w przypadku pacjentów w ostrej fazie białaczki. Pacjenci poddawani radioterapii zwykle nie powinni być szczepieni w fazie leczenia. Zwykle pacjenci są szczepieni, gdy są w całkowitej remisji hematologicznej po chorobie.
całkowita liczba limfocytów wynosiła co najmniej 1200 na mm3 lub nie występowały symptomy braku odporności komórkowej.
szczepienie było przeprowadzone na kilka tygodni przed podaniem leczenia immunosupresyjnego w przypadku pacjentów przed przeszczepieniem narządów (np. przeszczep nerki).
Istnieją bardzo nieliczne doniesienia o wystąpieniu rozsianej ospy wietrznej z zajęciem narządów wewnętrznych po podaniu szczepionki zawierającej wirusa ospy wietrznej szczepu Oka, głównie u pacjentów z niedoborami odporności.
Szczepionki Varilrix w żadnym wypadku nie wolno podawać donaczyniowo ani śródskórnie. Zawartość fenyloalaniny
Szczepionka zawiera 331 mikrogramów fenyloalaniny na dawkę. Fenyloalanina może być szkodliwa
dla osób z fenyloketonurią (PKU).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata.
Specjalne środki ostrożności podczas przechowywania Przechowywać i przewozić w stanie schłodzonym (2˚C – 8˚C). Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Rodzaj i zawartość opakowania
1 fiolka z proszkiem + 1 ampułko-strzykawka z rozpuszczalnikiem + 1 igła dołączona
do opakowania
10 fiolek z proszkiem + 10 ampułko-strzykawek z rozpuszczalnikiem + 10 igieł dołączonych
do opakowania
1 fiolka z proszkiem + 1 ampułko-strzykawka z rozpuszczalnikiem + 2 igły dołączone
do opakowania
10 fiolek z proszkiem + 10 ampułko-strzykawek z rozpuszczalnikiem + 20 igieł dołączonych
do opakowania
1 fiolka z proszkiem + 1 ampułko-strzykawka bez igły z rozpuszczalnikiem
10 fiolek z proszkiem + 10 ampułko-strzykawek bez igły z rozpuszczalnikiem
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do
VARILRIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułko- strzykawce
Szczepionka przeciw ospie wietrznej, żywa
Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułko-strzykawce.
Przed rekonstytucją, proszek ma kolor lekko kremowy do żółtawego lub różowawy, a rozpuszczalnik
jest klarownym i bezbarwnym płynem.
Szczepionka Varilrix jest wskazana do czynnego uodparniania przeciw ospie wietrznej:
Schematy szczepień szczepionką Varilrix powinny być zgodne z oficialnymi zaleceniami.
Niemowlęta w wieku od ukończenia 9. miesiąca życia do 11 miesięcy (włącznie)
1
Niemowlęta w wieku od ukończenia 9. do 11 miesięcy (włącznie) powinny otrzymać 2 dawki szczepionki Varilrix w celu osiągnięcia optymalnej ochrony przed ospą wietrzną (patrz punkt 5.1). Drugą dawkę szczepionki Varilrix należy podać po upływie co najmniej 3 miesięcy.
Dzieci w wieku od ukończenia 12. miesiąca życia, młodzież i dorośli
Dzieci w wieku od ukończenia 12. miesiąca życia, a także młodzież i dorośli powinni otrzymać 2 dawki szczepionki Varilrix w celu osiągnięcia optymalnej ochrony przed ospą wietrzną (patrz punkt 5.1). Drugą dawkę szczepionki Varilrix należy podać po co najmniej 6 tygodniach od podania pierwszej dawki szczepionki. W żadnym wypadku odstęp pomiędzy dawkami nie powinien być krótszy niż 4 tygodnie.
Pacjenci z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej
U pacjentów z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej korzystne może być podanie dodatkowych dawek szczepionki po zastosowaniu 2-dawkowego schematu szczepień (patrz punkt 5.1). W celu zidentyfikowania pacjentów, którzy mogą odnieść korzyści
z podania dodatkowych dawek szczepionki, wskazane może być cykliczne oznaczanie poziomu przeciwciał przeciwko ospie wietrznej po szczepieniu. W żadnym wypadku odstęp pomiędzy dawkami nie powinien być krótszy niż 4 tygodnie.
Pozostała populacja pediatryczna
Bezpieczeństwo i skuteczność szczepionki Varilrix u niemowląt w wieku poniżej ukończonego 9.
miesiąca życia nie zostały jeszcze ustalone. Brak dostępnych danych.
Wymienne stosowanie szczepionek
Szczepionka Varilrix jest przeciwskazana u osób z ciężkim humoralnym lub komórkowym (pierwotnym lub nabytym) niedoborem odporności, takich jak (patrz także punkt 4.4):
Identyfikowalność
W celu poprawienia identyfikowalności biologicznych produktów leczniczych należy czytelnie zapisać nazwę i numer serii podawanego produktu.
Tak jak w przypadku innych szczepionek, podanie szczepionki Varilrix należy odroczyć u osób z ostrą i ciężką chorobą przebiegającą z gorączką. Jednakże obecność łagodnej infekcji, takiej jak przeziębienie, nie powinno być powodem odraczania szczepienia.
Utrata przytomności (omdlenie) może wystąpić po podaniu lub nawet przed podaniem szczepionki, szczególnie u nastolatków, jako reakcja psychogenna na ukłucie igłą. Mogą temu towarzyszyć objawy neurologiczne, takie jak przemijające zaburzenia widzenia, parestezje oraz toniczno-kloniczne ruchy kończyn podczas odzyskiwania przytomności. Ważne jest zachowanie odpowiednich procedur, aby uniknąć urazów podczas omdleń.
Tak jak w przypadku wszystkich szczepionek podawanych we wstrzyknięciach, należy zapewnić możliwość fachowej opieki medycznej i leczenia na wypadek rzadko występujących po szczepieniu reakcji anafilaktycznych.
Przed podaniem szczepionki należy poczekać aż alkohol lub inne środki dezynfekujące wyparują ze skóry, gdyż mogą one spowodować inaktywację atenuowanych wirusów zawartych w szczepionce.
Możliwe jest uzyskanie ograniczonej odporności po zastosowaniu szczepionki w ciągu 72 godzin od chwili kontaktu z osobą chorą na ospę wietrzną (patrz punkt 5.1).
Tak jak w przypadku innych szczepionek, możliwe jest, że nie wszyscy zaszczepieni uzyskają ochronną odpowiedź immunologiczną.
Podobnie jak w przypadku innych szczepionek przeciwko ospie wietrznej, stwierdzano przypadki wystąpienia ospy wietrznej u osób, którym wcześniej podano szczepionkę Varilrix. Przypadki te charakteryzował zwykle łagodny przebieg choroby, z mniejszą liczbą zmian oraz niższą gorączką niż w przypadku choroby u osób niezaszczepionych.
Przeniesienie wirusa
Przeniesienie zawartego w szczepionce wirusa ospy wietrznej szczepu Oka z osób zaszczepionych, u których rozwinęła się wysypka, na pozostające w kontakcie z nimi osoby nieuodpornione występowało niezwykle rzadko. Nie można wykluczyć możliwości przeniesienia wirusa ospy wietrznej szczepu Oka z osoby zaszczepionej, u której nie rozwinęła się wysypka, na pozostające w kontakcie z nią osoby nieuodpornione.
W porównaniu ze zdrowymi zaszczepionymi osobami, pacjenci z białaczką są bardziej narażeni na wystąpienie wysypki grudkowo-pęcherzykowej (patrz także punkt 4.8). Również w takich przypadkach, przebieg choroby u osób po kontakcie był łagodny.
Osoby zaszczepione, również te, u których nie rozwinęła się wysypka podobna do występującej w przebiegu ospy wietrznej, powinny starać się unikać kontaktu z osobami z grup wysokiego ryzyka, podatnymi na zarażenie ospą wietrzną, do 6 tygodni po szczepieniu. W przypadku gdy kontakt z osobą z grupy wysokiego ryzyka, podatną na zarażenie ospą wietrzną, jest nieunikniony, należy dokonać oceny ryzyka potencjalnego przeniesienia wirusa zawartego w szczepionce w porównaniu z ryzykiem zakażenia i przeniesienia dzikiego typu wirusa ospy wietrznej.
Grupa osób wysokiego ryzyka podatnych na zachorowanie na ospę wietrzną obejmuje:
Jeśli planowane jest przeprowadzenie u pacjenta próby tuberkulinowej, to należy ją wykonać przed lub równocześnie z podaniem szczepionki, ponieważ zaobserwowano, że szczepionki zawierające żywe wirusy mogą powodować czasowe zmniejszenie wrażliwości skóry na tuberkulinę. To działanie może się utrzymywać maksymalnie do 6 tygodni, dlatego w celu uniknięcia fałszywie ujemnego wyniku nie zaleca się przeprowadzania próby tuberkulinowej w tym czasie.
U osób, które otrzymały immunoglobulinę lub u których przetoczono krew, szczepienie należy odroczyć na okres co najmniej 3 miesięcy, ponieważ mogą one nie uzyskać odporności z powodu obecności biernie nabytych przeciwciał przeciwko wirusowi ospy wietrznej.
Przez 6 tygodni po szczepieniu przeciwko ospie wietrznej należy unikać podawania pochodnych kwasu salicylowego, ponieważ istnieją doniesienia o występowaniu zespołu Reye’a po zastosowaniu pochodnych kwasu salicylowego podczas naturalnego zakażenia wirusem ospy wietrznej.
Stosowanie z innymi szczepionkami
Badania kliniczne z wykorzystaniem szczepionek zawierających wirusa ospy wietrznej wykazują, że szczepionka Varilrix może być podawana jednocześnie z którąkolwiek z następujących monowalentnych lub skojarzonych szczepionek: szczepionką przeciw odrze, śwince i różyczce (MMR), szczepionką przeciw błonicy, tężcowi i krztuścowi, bezkomórkową (DTPa), szczepionką przeciwko błonicy, tężcowi i krztuścowi (bezkomórkową), o zmniejszonej zawartości antygenów (dTpa), szczepionką przeciw Haemophilus influenzae typu b (Hib), inaktywowaną szczepionką przeciwko polio (IPV), szczepionką przeciw wirusowemu zapaleniu wątroby typu B (HBV), szczepionką sześciowalentną (DTPa-HBV-IPV / Hib), szczepionką przeciw wirusowemu zapaleniu wątroby typu A (HAV), szczepionką przeciwko meningokokom grupy B (Bexsero), szczepionką skoniugowaną przeciwko meningokokom grupy C (MenC), szczepionką skoniugowaną przeciw meningokokom grup A, C, W oraz Y (Men ACWY) oraz skoniugowaną szczepionką przeciw pneumokokom (PCV).
Różne szczepionki podawane w postaci wstrzyknięć powinny być zawsze podawane w różne miejsca ciała.
Jeżeli szczepionka zawierająca wirus odry nie może być podana jednocześnie ze szczepionką Varilrix, zaleca się zachowanie przerwy co najmniej jednego miesiąca pomiędzy podawaniem tych szczepionek, ponieważ szczepienie przeciwko odrze może spowodować krótkotrwałe obniżenie komórkowej odpowiedzi immunologicznej.
Pacjenci z grup wysokiego ryzyka ciężkiego przebiegu ospy wietrznej
Szczepionka Varilrix nie powinna być podawana jednocześnie z innymi żywymi, atenuowanymi szczepionkami. Jeśli nie występują inne dodatkowe przeciwwskazania, inaktywowane szczepionki i szczepionka Varilrix mogą być stosowane w dowolnej relacji czasowej. Jednakże, różne szczepionki w formie wstrzyknięć powinny być zawsze podawane w różne miejsca ciała.
Kobiety w ciąży nie powinny być szczepione szczepionką Varilrix.
Nie udokumentowano jednak przypadków uszkodzenia płodu po podaniu szczepionki przeciwko ospie wietrznej kobietom w okresie ciąży.
Kobiety w wieku rozrodczym
Należy unikać zajścia w ciążę przez miesiąc od zaszczepienia. Kobiety, które planują ciążę powinny zostać pouczone o konieczności opóźnienia tej decyzji.
Nie ma danych dotyczących stosowania szczepionki u kobiet karmiących piersią.
Ze względu na teoretyczne ryzyko przeniesienia szczepu wirusa zawartego w szczepionce z matki na niemowlę, zasadniczo nie zaleca się stosowania szczepionki Varilrix u matek karmiących piersią (patrz także punkt 4.4). Możliwość zaszczepienia kobiet narażonych na zakażenie ospą wietrzną bez historii przebycia choroby w wywiadzie lub o których wiadomo, że są seronegatywne wobec ospy wietrznej, należy oceniać indywidualnie.
Nie ma dostępnych danych dotyczących wpływu na płodność.
Nie przeprowadzono badań dotyczących wpływu szczepionki Varilrix na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Szczepionka Varilrix nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednakże, niektóre z działań niepożądanych wymienionych w punkcie 4.8 „Działania niepożądane” mogą krótkotrwale wpływać na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Ponad 7 900 osób uczestniczyło w badaniach klinicznych, w których oceniano reaktogenność
szczepionki Varilrix podawanej podskórnie, oddzielnie lub w tym samym czasie co inne szczepionki.
Profil bezpieczeństwa w oparciu o dane otrzymane po zastosowaniu 5 369 dawek tylko szczepionki Varilrix u niemowląt, dzieci, młodzieży i dorosłych przedstawiono w tabeli poniżej:
Częstości występowania określono następująco:
Bardzo często: 1/10
Często: 1/100 do < 1/10
Niezbyt często: 1/1 000 do < 1/100 Rzadko: 1/10 000 do < 1/1 000 Bardzo rzadko: < 1/10 000
W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione
zgodnie ze zmniejszającym się nasileniem.
Klasyfikacja układów i narządów* | Częstość | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Niezbyt często | zakażenie górnych dróg oddechowych, zapalenie gardła |
Zaburzenia krwi i układu chłonnego | Niezbyt często | uogólnione powiększenie węzłów chłonnych |
Zaburzenia psychiczne | Niezbyt często | rozdrażnienie |
Zaburzenia układu nerwowego | Niezbyt często | ból głowy, senność |
Zaburzenia oka | Rzadko | zapalenie spojówek |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Niezbyt często | kaszel, nieżyt nosa |
Zaburzenia żołądka i jelit | Niezbyt często | wymioty, nudności |
Rzadko | biegunka, ból brzucha | |
Zaburzenia skóry i tkanki podskórnej | Często | wysypka |
Niezbyt często | wirusowa wysypka, świąd | |
Rzadko | pokrzywka | |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Niezbyt często | ból stawów, ból mięśni |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | ból, rumień |
Często | gorączka (mierzona pod pachą lub w jamie ustnej 37,5°C, mierzona w odbycie 38°C) †, obrzęk w miejscu wstrzyknięcia† | |
Niezbyt często | gorączka (mierzona pod pachą lub w jamie ustnej > 39°C, mierzona w odbycie > 39,5°C), zmęczenie, złe samopoczucie |
* Zgodnie z terminologią MedDRA (ang. Medical Dictionary for Regulatory Activities)
† Obrzęk w miejscu wstrzyknięcia oraz gorączka były zgłaszane bardzo często w badaniach u młodzieży i dorosłych. Obrzęk w miejscu wstrzyknięcia był również zgłaszany bardzo często po podaniu drugiej dawki u dzieci w wieku poniżej 13 lat.
Obserwowano tendencję do częstszego występowania bólu, rumienia i obrzęku w miejscu wstrzyknięcia po podaniu drugiej dawki w porównaniu z pierwszą dawką.
Nie odnotowano różnic w profilu reaktogenności u osób, które przed szczepieniem były seropozytywne w porównaniu z osobami seronegatywnymi.
W badaniu klinicznym 328 dzieci w wieku od 11 do 21 miesięcy otrzymało skojarzoną szczepionkę przeciw odrze, śwince, różyczce i ospie wietrznej firmy GlaxoSmithKline (GSK) (zawierającą ten sam szczep wirusa ospy wietrznej co szczepionka Varilrix) podskórnie lub domięśniowo. Zaobserwowano porównywalny profil bezpieczeństwa dla obydwu dróg podania.
Pacjenci należący do grup wysokiego ryzyka
Dane z badań klinicznych, które dotyczą pacjentów z grup wysokiego ryzyka są bardzo ograniczone. Jednakże, u tych pacjentów, działania niepożądane związane ze szczepieniem (głównie wykwity grudkowo-pęcherzykowe i gorączka) miały zwykle charakter łagodny. Podobnie jak u osób zdrowych, rumień, obrzęk i ból w miejscu podania były łagodne i ustępowały samoistnie.
Monitorowanie działań niepożądanych po wprowadzeniu do obrotu
Poniższe działania niepożądane odnotowywano sporadycznie w ramach monitorowania po
wprowadzeniu do obrotu.
Ponieważ te działania niepożądane były zgłaszane dobrowolnie i dotyczyły populacji o nieokreślonej wielkości, nie jest możliwe określenie częstości ich występowania.
Klasyfikacja układów i narządów* | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Półpasiec |
Zaburzenia krwi i układu chłonnego | Małopłytkowość (trombocytopenia) |
Zaburzenia układu immunologicznego | Reakcje anafilaktyczne, nadwrażliwość |
Zaburzenia układu nerwowego | Zapalenie mózgu, incydent naczyniowo – mózgowy, napady drgawkowe, zapalenie móżdżku, objawy przypominające zapalenie móżdżku (w tym przejściowe zaburzenia chodu i przejściowa ataksja) |
Zaburzenia naczyniowe | Zapalenie naczyń (w tym plamica Schönleina - Henocha i zespół Kawasaki) |
Zaburzenia skóry i tkanki podskórnej | Rumień wielopostaciowy |
* Zgodnie z terminologią MedDRA (ang. Medical Dictionary for Regulatory Activities)
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: 22 49 21 301
Faks: 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Zgłaszano przypadki nieumyślnego podania większej dawki szczepionki niż zalecana. W części tych przypadków jako działanie niepożądane zgłaszano letarg i drgawki. W innych przypadkach zgłoszonych jako przedawkowanie, nie odnotowano żadnych działań niepożądanych związanych ze szczepieniem.
Grupa farmakoterapeutyczna: Szczepionki przeciwwirusowe, szczepionki przeciw ospie wietrznej, kod ATC J07BK01.
Mechanizm działania
U osób nieuodpornionych, podanie szczepionki Varilrix powoduje klinicznie bezobjawową postać ospy wietrznej. Obecność przeciwciał jest uznawana jako dowód występowania odporności, jednak nie ma ustalonego poziomu ochronnego przeciwciał chroniącego przed zakażeniem wirusem ospy wietrznej.
Efekty farmakodynamiczne
Skuteczność szczepionek przeciwko ospie wietrznej, zawierającej szczep Oka, firmy GlaxoSmithKline (GSK) w zapobieganiu ospie wietrznej, potwierdzonej metodą PCR (od ang. polymerase chain reaction, łańcuchowa reakcja polimerazy) lub epidemiologicznie, była oceniana w dużym, randomizowanym, międzynarodowym badaniu klinicznym, w którym jako aktywną kontrolę zastosowano skojarzoną szczepionkę GSK przeciwko odrze, śwince i różyczce (Priorix). Badanie kliniczne zostało przeprowadzone w Europie w czasie, gdy powszechne szczepienia dzieci przeciwko ospie wietrznej nie były prowadzone. Dzieci w wieku od 12 do 22 miesięcy otrzymały jedną dawkę szczepionki Varilrix albo dwie dawki skojarzonej szczepionki GSK przeciw odrze, śwince, różyczce i ospie wietrznej (Priorix-Tetra) w odstępie 6 tygodni. Wykazano skuteczność szczepionki w zapobieganiu potwierdzonej ospie wietrznej o jakimkolwiek nasileniu oraz potwierdzonej ospie wietrznej o umiarkowanym lub ciężkim stopniu nasilenia, obserwowaną po 2 letnim pierwszorzędowym okresie obserwacji (mediana okresu obserwacji: 3,2 roku). Utrzymywanie się skuteczności było obserwowane w trakcie tego samego badania klinicznego podczas długoterminowej obserwacji: 6-letniej (mediana okresu obserwacji: 6,4 roku) oraz 10-letniej (mediana okresu obserwacji: 9,8 roku).
Dostępne dane znajdują się w tabeli poniżej.
Grupa | Okres obserwacji | Skuteczność przeciw potwierdzonej ospie wietrznej o jakimkolwiek nasileniu | Skuteczność szczepionki przeciw potwierdzonej ospie wietrznej o umiarkowanym lub ciężkim nasileniu |
Monowalentna | 2 lata | 65,4% | 90,7% |
szczepionka GSK | (97,5% CI: 57,2; 72,1) | (97,5% CI: 85,9; 93,9) | |
przeciwko ospie wietrzej (Oka) (Varilrix) | |||
6 lat(1) | 67,0% (95% CI: 61,8; 71,4) | 90,3% (95% CI: 86,9; 92,8) | |
1 dawka | 10 lat(1) | 67,2% | 89,5% |
N = 2 487 | (95% CI: 62,3; 71,5) | (95% CI: 86,1; 92,1) | |
Szczepionka GSK | 2 lata | 94,9% | 99,5% |
skojarzona przeciw | (97,5% CI: 92,4; 96,6) | (97,5% CI: 97,5; 99,9) | |
odrze, śwince, różyczce i ospie wietrznej (Oka) (Priorix-Tetra) | |||
6 lat(1) | 95,0% (95% CI: 93,6; 96,2) | 99,0% (95% CI: 97,7; 99,6) | |
2 dawki | 10 lat(1) | 95,4% | 99,1% |
N = 2 489 | (95% CI: 94,0; 96,4) | (95% CI: 97,9; 99,6) |
N = liczba osób włączonych do badania i poddanych szczepieniu
(1) analiza opisowa
W badaniach klinicznych, większość zaszczepionych osób, które zostały później narażone na działanie dzikiego wirusa ospy wietrznej, była albo całkowicie chroniona przed kliniczną postacią ospy wietrznej, albo rozwinęła łagodniejszą postać tej choroby (tj. mała liczba pęcherzyków, brak gorączki).
Dane dotyczące skuteczności, pochodzące z obserwacji w różnych okolicznościach (ogniska epidemiczne, badania kliniczno-kontrolne, badania obserwacyjne, analiza informacji z baz danych,
modele) wskazują na wyższy poziom ochrony i zmniejszenie częstości występowania ospy wietrznej po podaniu dwóch dawek szczepionki w porównaniu z podaniem jednej dawki.
Wpływ jednej dawki szczepionki Varilrix na zmniejszenie liczby hospitalizacji związanych z zachorowaniem na ospę wietrzną i zmniejszenie liczby wizyt ambulatoryjnych wśród dzieci wynosił odpowiednio 81 i 87%.
Profilaktyka poekspozycyjna
Dostępne dane dotyczące zapobiegania ospie wietrznej po ekspozycji na wirusa ospy wietrznej są
ograniczone.
W randomizowanym, podwójnie ślepym, kontrolowanym placebo badaniu klinicznym, z udziałem 42 dzieci w wieku od 12 miesięcy do 13 lat, 22 dzieci otrzymało jedną dawkę szczepionki Varilrix, a 20 dzieci otrzymało jedną dawkę placebo w przeciągu 3 dni po ekspozycji. U podobnego odsetka (odpowiednio 41% i 45%) dzieci rozwinęła się ospa wietrzna, ale ryzyko rozwoju postaci choroby umiarkowanej do ciężkiej było 8-krotnie wyższe w grupie, która otrzymała placebo w porównaniu z grupą zaszczepioną (ryzyko względne = 8,0; 95% CI: 1,2; 51,5; P=0,003).
W kontrolowanym badaniu klinicznym z udziałem 33 dzieci w wieku od 12 miesięcy do 12 lat, 15 dzieci otrzymało szczepionkę przeciw ospie wietrznej (13 osób otrzymało szczepionkę przeciw ospie wietrznej Varilrix, a 2 osoby otrzymały inną szczepionkę przeciw ospie wietrznej, zawierającą szczep Oka) do 5 dni po ekspozycji, a 18 osób nie zostało zaszczepionych. Dla grupy 12 dzieci zaszczepionych w ciągu 3 dni po ekspozycji, skuteczność szczepionki wyniosła 44% (95% CI: -1; 69) w zapobieganiu jakiejkolwiek postaci ospy wietrznej i 77% (95% CI: 14; 94) w zapobieganiu umiarkowanej lub ciężkiej postaci ospy wietrznej.
W prospektywnym badaniu kohortowym (z historycznymi współczynnikami zapadalności jako kontrolą) 67 dzieci, nastolatków lub dorosłych otrzymało szczepionkę przeciwko ospie wietrznej (55 osób otrzymało szczepionkę przeciw ospie wietrznej Varilrix, a 12 osób otrzymało inną szczepionkę przeciw ospie wietrznej, zawierającej szczep Oka) w ciągu 5 dni po ekspozycji. Skuteczność szczepionki wyniosła 62,3% (95% CI: 47,8; 74,9) w zapobieganiu którejkolwiek postaci ospy wietrznej i 79,4% (95% CI: 66,4; 88,9) w zapobieganiu umiarkowanej lub ciężkiej postaci ospy wietrznej.
Pacjenci należący do grup wysokiego ryzyka ciężkiego przebiegu ospy wietrznej
Odpowiedź immunologiczna po podaniu podskórnym
U dzieci w wieku od 11 do 21 miesięcy wskaźnik odpowiedzi serologicznej, mierzony metodą ELISA 6 tygodni po szczepieniu, wyniósł 89,6% po jednej dawce szczepionki i 100% po drugiej dawce szczepionki.
U dzieci zaszczepionych w wieku od 9 miesięcy do 12 lat, serokonwersję (przeciwciała oznaczane metodą immunofluorescencji - IFA) po 6 tygodniach po szczepieniu jedną dawką szczepionki stwierdzono u > 98% zaszczepionych.
U dzieci zaszczepionych w wieku 9 miesięcy do 6 lat, serokonwersję (przeciwciała oznaczane metodą IFA) po 6 tygodniach po podaniu drugiej dawki stwierdzono u 100% zaszczepionych. Po drugiej dawce obserwowano istotny wzrost miana przeciwciał (5-26 krotny wzrost średniej geometrycznej miana przeciwciał).
U osób szczepionych w wieku 13 lat i starszych, serokonwersję (przeciwciała oznaczane metodą IFA) po 6 tygodniach po podaniu drugiej dawki stwierdzono u 100% zaszczepionych. Po roku od szczepienia u wszystkich badanych stwierdzano obecność przeciwciał.
Pacjenci należący do grup wysokiego ryzyka ciężkiego przebiegu ospy wietrznej
Ograniczone dane z badań klinicznych wykazały immunogenność u osób z wysokim ryzykiem ciężkiego przebiegu ospy wietrznej.
Odpowiedź immunologiczna po podaniu domięśniowym
Immunogenność szczepionki Varilrix podawanej domięśniowo oszacowana jest w oparciu o badanie porównawcze, w którym 283 zdrowych dzieci w wieku od 11 do 21 miesięcy otrzymało skojarzoną szczepionkę GSK przeciwko odrze, śwince, różyczce i ospie wietrznej (zawierającą ten sam szczep wirusa ospy wietrznej co Varilrix) podaną podskórnie lub domięśniowo. Wykazano porównywalną immunogenność dla obydwu dróg podawania.
Ocena właściwości farmakokinetycznych nie jest wymagana dla szczepionek.
Niekliniczne dane o bezpieczeństwie uzyskane w badaniach przeprowadzonych na zwierzętach nie wykazują szczególnego zagrożenia dla ludzi.
Proszek:
Aminokwasy (w tym fenyloalanina) Laktoza bezwodna
Sorbitol (E 420)
Mannitol (E 421) Rozpuszczalnik:
Woda do wstrzykiwań
Szczepionkę należy podać niezwłocznie po rekonstytucji.
Wykazano jednak, że szczepionkę po rekonstytucji można przechowywać do 90 minut w temperaturze pokojowej (25°C) lub do 8 godzin w lodówce (w temperaturze 2°C – 8°C). Jeśli szczepionka po rekonstytucji nie została zużyta w zalecanym czasie lub nie była przechowywana w zalecanych warunkach, należy ją wyrzucić.
Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt 6.3.
Proszek w jednodawkowej fiolce ze szkła (typ I) z korkiem (z gumy bromobutylowej). 0,5 ml rozpuszczalnika w ampułko-strzykawce ze szkła (typ I) z zatyczką tłoka (z gumy
bromobutylowej) z igłami dołączonymi do opakowania lub bez igieł w następujących wielkościach opakowań:
stosowania
Rozpuszczalnik oraz szczepionkę po rekonstytucji należy obejrzeć przed podaniem pod kątem obecności obcych cząstek i (lub) zmian fizycznych. W przypadku stwierdzenia nieprawidłowości w wyglądzie, nie należy podawać szczepionki.
Szczepionkę należy poddać rekonstytucji poprzez dodanie całego rozpuszczalnika z ampułko- strzykawki do fiolki z proszkiem.
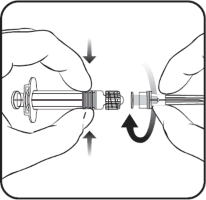
Aby dołączyć igłę do ampułko-strzykawki należy uważnie zapoznać się z instrukcją przedstawioną pod rysunkami 1 i 2. Ampułko-strzykawka dostarczana ze szczepionką Varilrix może jednak różnić się nieznacznie od przedstawionej na rysunku (może nie mieć gwintu do przykręcania igły). W takim przypadku igła powinna być zamocowana bez przykręcenia.
Igła
Nasadka igły
Adapter Luer Lock
a
Korpus strzykawki
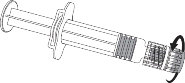
Osłonka igły

Ampułko-strzykawk
Tłok strzykawki
Rysunek 1.
Nasadka na ampułko-strzykawkę
Rysunek 2.
Należy zawsze trzymać ampułko-strzykawkę za jej korpus, nie za tłok ani za adapter Luer Lock (ang. Luer Lock Adaptor, LLA), a igłę należy utrzymywać w osi ampułko-strzykawki (jak przedstawiono na rysunku 2.). Niezastosowanie się do tych zaleceń może spowodować przekrzywienie adaptera LLA i w następstwie wyciek z ampułko-strzykawki.
Jeśli podczas przyłączania igły do ampułko-strzykawki dojdzie do odłączenia się adaptera LLA, należy użyć nowej dawki szczepionki (nowej ampułko-strzykawki i fiolki).
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
GlaxoSmithKline Biologicals S.A. rue de l’Institut 89
1330 Rixensart, Belgia
4690
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
dawka (0,5 ml) po rekonstytucji zawiera:
Wirus ospy wietrznej1, szczep Oka (żywy, atenuowany)
nie mniej niż 103,3 PFU2
1 namnażany w ludzkich komórkach diploidalnych linii MRC-5
2 PFU – (od ang. Plaque forming unit) – jednostka tworząca łysinkę
Szczepionka zawiera śladowe ilości neomycyny (patrz punkt 4.3). Substancje pomocnicze o znanym działaniu:
Szczepionka zawiera 6 mg sorbitolu na dawkę.
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
osób zdrowych w wieku od ukończenia 9. miesiąca życia do 11 miesięcy włącznie (patrz punkt 5.1), w szczególnych okolicznościach;
osób zdrowych w wieku od ukończenia 12. miesiąca życia (patrz punkt 5.1);
w ramach profilaktyki poekspozycyjnej osób zdrowych, podatnych na ospę wietrzną, stosowanej w ciągu 72 godzin od kontaktu z osobą zakażoną (patrz punkty 4.4 i 5.1);
osób zagrożonych ciężkim przebiegiem ospy wietrznej (patrz punkty 4.3, 4.4 i 5.1).
Stosowanie szczepionki Varilrix powinno być zgodne z oficjalnymi zaleceniami.
Dawkowanie i sposób podawania
Jedna dawka szczepionki Varilrix może zostać podana osobom, które już wcześniej otrzymały jedną dawkę innej szczepionki zawierającej wirus ospy wietrznej.
Po podaniu jednej dawki szczepionki Varilrix może zostać podana jedna dawka innej szczepionki zawierającej wirus ospy wietrznej.
Szczepionka Varilrix powinna być wstrzyknięta podskórnie (sc.) lub domięśniowo (im.), w okolicę mięśnia naramiennego lub w przednio-boczną część uda.
U osób z zaburzeniami krzepnięcia krwi (np. z małopłytkowością lub innymi zaburzeniami krzepnięcia), szczepionka Varilrix powinna być podawana podskórnie.
Informacje dotyczące przygotowania produktu leczniczego do podania, patrz punkt 6.6.
Przeciwwskazania
osoby z niedoborem odporności z całkowitą liczbą limfocytów poniżej 1200 na mm3;
osoby wykazujące inne objawy braku odporności komórkowej (np. pacjenci z białaczką, chłoniakiem, dyskrazją krwi, klinicznymi objawami zakażenia wirusem HIV);
osoby otrzymujące leczenie immunosupresyjne, w tym duże dawki kortykosteroidów;
ciężki, złożony niedobór odporności;
agammaglobulinemia;
AIDS lub objawowe zakażenie wirusem HIV lub odsetek limfocytów T CD4+, zależnie od wieku, u dzieci w wieku poniżej 12 miesięcy: CD4+ <25%; u dzieci w wieku między 12 a 35 miesięcy: CD4+ <20%; u dzieci w wieku między 36 a 59 miesięcy: CD4+ <15%.
Varilrix jest przeciwwskazany u osób, u których wcześniej wystąpiły objawy nadwrażliwości po podaniu szczepionki przeciw ospie wietrznej.
Ciąża. Ponadto, należy unikać zajścia w ciążę przez miesiąc po zaszczepieniu (patrz punkt 4.6).
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
osoby z obniżoną odpornością (patrz punkt 4.3 i 4.4);
kobiety w ciąży, u których nie stwierdzono w wywiadzie wcześniejszego zachorowania na ospę
wietrzną ani nie potwierdzono laboratoryjnie wcześniejszej infekcji;
noworodki od matek, u których nie stwierdzono w wywiadzie wcześniejszego zachorowania na ospę wietrzną ani nie potwierdzono laboratoryjnie wcześniejszej infekcji.
Pojawiająca się u zdrowych osób, kontaktujących się z zaszczepionymi, łagodna wysypka dowodzi, iż wirus pozostaje w postaci atenuowanej po pasażu przez organizm człowieka.
Pacjenci z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej
Dostępne są jedynie ograniczone dane z badań klinicznych dla szczepionki Varilrix (formulacja +4°C) u osób z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej.
Można rozważyć szczepienie u pacjentów z wybranymi rodzajami niedoborów odporności
w przypadku, gdy korzyści przewyższają ryzyko (np. pacjenci z bezobjawowym zakażeniem HIV, niedobór podklas IgG, wrodzona neutropenia, przewlekła choroba ziarniniakowa oraz choroby przebiegające z niedoborem dopełniacza).
Pacjenci z niedoborami odporności, u których nie stwierdza się przeciwwskazań do szczepienia (patrz punkt 4.3), mogą odpowiedzieć na szczepienie słabiej niż pacjenci z prawidłową czynnością układu immunologicznego; dlatego w przypadku kontaktu z wirusem ospy wietrznej niektóre z tych osób mogą zachorować na ospę wietrzną pomimo prawidłowego podania szczepionki. Tych pacjentów należy starannie monitorować pod kątem występowania objawów ospy wietrznej.
W przypadku rozważania zaszczepienia osób z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej, zaleca się, aby:
wstrzymać chemioterapię podtrzymującą na tydzień przed szczepieniem i tydzień po szczepieniu w przypadku pacjentów w ostrej fazie białaczki. Pacjenci poddawani radioterapii zwykle nie powinni być szczepieni w fazie leczenia. Zwykle pacjenci są szczepieni, gdy są w całkowitej remisji hematologicznej po chorobie.
całkowita liczba limfocytów wynosiła co najmniej 1200 na mm3 lub nie występowały symptomy braku odporności komórkowej.
szczepienie było przeprowadzone na kilka tygodni przed podaniem leczenia immunosupresyjnego w przypadku pacjentów przed przeszczepieniem narządów (np. przeszczep nerki).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata.
Specjalne środki ostrożności podczas przechowywania Przechowywać i przewozić w stanie schłodzonym (2˚C – 8˚C). Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
VARILRIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw ospie wietrznej, żywa
Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań.
Przed rekonstytucją, proszek ma kolor lekko kremowy do żółtawego lub różowawy, a rozpuszczalnik jest klarownym i bezbarwnym płynem.
Szczepionka Varilrix jest wskazana do czynnego uodparniania przeciw ospie wietrznej:
Schematy szczepień szczepionką Varilrix powinny być zgodne z oficialnymi zaleceniami.
Niemowlęta w wieku od ukończenia 9. miesiąca życia do 11 miesięcy (włącznie)
Niemowlęta w wieku od ukończenia 9. do 11 miesięcy (włącznie) powinny otrzymać 2 dawki szczepionki Varilrix w celu osiągnięcia optymalnej ochrony przed ospą wietrzną (patrz punkt 5.1). Drugą dawkę szczepionki Varilrix należy podać po upływie co najmniej 3 miesięcy.
Dzieci w wieku od ukończenia 12. miesiąca życia, młodzież i dorośli
Dzieci w wieku od ukończenia 12. miesiąca życia, a także młodzież i dorośli powinni otrzymać 2 dawki szczepionki Varilrix w celu osiągnięcia optymalnej ochrony przed ospą wietrzną (patrz punkt 5.1). Drugą dawkę szczepionki Varilrix należy podać po co najmniej 6 tygodniach od podania pierwszej dawki szczepionki. W żadnym wypadku odstęp pomiędzy dawkami nie powinien być krótszy niż 4 tygodnie.
Pacjenci z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej
U pacjentów z grup wysokiego ryzyka wystąpienia ciężkiego przebiegu ospy wietrznej korzystne może być podanie dodatkowych dawek szczepionki po zastosowaniu 2-dawkowego schematu szczepień (patrz punkt 5.1). W celu zidentyfikowania pacjentów, którzy mogą odnieść korzyści
z podania dodatkowych dawek szczepionki, wskazane może być cykliczne oznaczanie poziomu przeciwciał przeciwko ospie wietrznej po szczepieniu. W żadnym wypadku odstęp pomiędzy dawkami nie powinien być krótszy niż 4 tygodnie.
Pozostała populacja pediatryczna
Bezpieczeństwo i skuteczność szczepionki Varilrix u niemowląt w wieku poniżej ukończonego 9.
miesiąca życia nie zostały jeszcze ustalone. Brak dostępnych danych.
Wymienne stosowanie szczepionek
Szczepionka Varilrix jest przeciwskazana u osób z ciężkim humoralnym lub komórkowym (pierwotnym lub nabytym) niedoborem odporności, takich jak (patrz także punkt 4.4):
Identyfikowalność
W celu poprawienia identyfikowalności biologicznych produktów leczniczych należy czytelnie zapisać nazwę i numer serii podawanego produktu.
Tak jak w przypadku innych szczepionek, podanie szczepionki Varilrix należy odroczyć u osób z ostrą i ciężką chorobą przebiegającą z gorączką. Jednakże obecność łagodnej infekcji, takiej jak przeziębienie, nie powinno być powodem odraczania szczepienia.
Utrata przytomności (omdlenie) może wystąpić po podaniu lub nawet przed podaniem szczepionki, szczególnie u nastolatków, jako reakcja psychogenna na ukłucie igłą. Mogą temu towarzyszyć objawy neurologiczne, takie jak przemijające zaburzenia widzenia, parestezje oraz toniczno-kloniczne ruchy kończyn podczas odzyskiwania przytomności. Ważne jest zachowanie odpowiednich procedur, aby uniknąć urazów podczas omdleń.
Tak jak w przypadku wszystkich szczepionek podawanych we wstrzyknięciach, należy zapewnić możliwość fachowej opieki medycznej i leczenia na wypadek rzadko występujących po szczepieniu reakcji anafilaktycznych.
Przed podaniem szczepionki należy poczekać aż alkohol lub inne środki dezynfekujące wyparują ze skóry, gdyż mogą one spowodować inaktywację atenuowanych wirusów zawartych w szczepionce.
Możliwe jest uzyskanie ograniczonej odporności po zastosowaniu szczepionki w ciągu 72 godzin od chwili kontaktu z osobą chorą na ospę wietrzną (patrz punkt 5.1).
Tak jak w przypadku innych szczepionek, możliwe jest, że nie wszyscy zaszczepieni uzyskają
ochronną odpowiedź immunologiczną.
Podobnie jak w przypadku innych szczepionek przeciwko ospie wietrznej, stwierdzano przypadki wystąpienia ospy wietrznej u osób, którym wcześniej podano szczepionkę Varilrix. Przypadki te charakteryzował zwykle łagodny przebieg choroby, z mniejszą liczbą zmian oraz niższą gorączką niż w przypadku choroby u osób niezaszczepionych.
Przeniesienie wirusa
Przeniesienie zawartego w szczepionce wirusa ospy wietrznej szczepu Oka z osób zaszczepionych, u których rozwinęła się wysypka, na pozostające w kontakcie z nimi osoby nieuodpornione występowało niezwykle rzadko. Nie można wykluczyć możliwości przeniesienia wirusa ospy wietrznej szczepu Oka z osoby zaszczepionej, u której nie rozwinęła się wysypka, na pozostające w kontakcie z nią osoby nieuodpornione.
W porównaniu ze zdrowymi zaszczepionymi osobami, pacjenci z białaczką są bardziej narażeni na wystąpienie wysypki grudkowo-pęcherzykowej (patrz także punkt 4.8). Również w takich przypadkach, przebieg choroby u osób po kontakcie był łagodny.
Osoby zaszczepione, również te, u których nie rozwinęła się wysypka podobna do występującej w przebiegu ospy wietrznej, powinny starać się unikać kontaktu z osobami z grup wysokiego ryzyka, podatnymi na zarażenie ospą wietrzną, do 6 tygodni po szczepieniu. W przypadku gdy kontakt z osobą z grupy wysokiego ryzyka, podatną na zarażenie ospą wietrzną, jest nieunikniony, należy dokonać oceny ryzyka potencjalnego przeniesienia wirusa zawartego w szczepionce w porównaniu z ryzykiem zakażenia i przeniesienia dzikiego typu wirusa ospy wietrznej.
Grupa osób wysokiego ryzyka podatnych na zachorowanie na ospę wietrzną obejmuje:
Istnieją bardzo nieliczne doniesienia o wystąpieniu rozsianej ospy wietrznej z zajęciem narządów wewnętrznych po podaniu szczepionki zawierającej wirusa ospy wietrznej szczepu Oka, głównie u pacjentów z niedoborami odporności.
Szczepionki Varilrix w żadnym wypadku nie wolno podawać donaczyniowo ani śródskórnie. Zawartość fenyloalaniny
Szczepionka zawiera 331 mikrogramów fenyloalaniny na dawkę. Fenyloalanina może być szkodliwa
dla osób z fenyloketonurią (PKU).
Jeśli planowane jest przeprowadzenie u pacjenta próby tuberkulinowej, to należy ją wykonać przed lub równocześnie z podaniem szczepionki, ponieważ zaobserwowano, że szczepionki zawierające żywe wirusy mogą powodować czasowe zmniejszenie wrażliwości skóry na tuberkulinę. To działanie może się utrzymywać maksymalnie do 6 tygodni, dlatego w celu uniknięcia fałszywie ujemnego wyniku nie zaleca się przeprowadzania próby tuberkulinowej w tym czasie.
U osób, które otrzymały immunoglobulinę lub u których przetoczono krew, szczepienie należy odroczyć na okres co najmniej 3 miesięcy, ponieważ mogą one nie uzyskać odporności z powodu obecności biernie nabytych przeciwciał przeciwko wirusowi ospy wietrznej.
Przez 6 tygodni po szczepieniu przeciwko ospie wietrznej należy unikać podawania pochodnych kwasu salicylowego, ponieważ istnieją doniesienia o występowaniu zespołu Reye’a po zastosowaniu pochodnych kwasu salicylowego podczas naturalnego zakażenia wirusem ospy wietrznej.
Stosowanie z innymi szczepionkami
Badania kliniczne z wykorzystaniem szczepionek zawierających wirusa ospy wietrznej wykazują, że szczepionka Varilrix może być podawana jednocześnie z którąkolwiek z następujących monowalentnych lub skojarzonych szczepionek: szczepionką przeciw odrze, śwince i różyczce (MMR), szczepionką przeciw błonicy, tężcowi i krztuścowi, bezkomórkową (DTPa), szczepionką przeciwko błonicy, tężcowi i krztuścowi (bezkomórkową), o zmniejszonej zawartości antygenów (dTpa), szczepionką przeciw Haemophilus influenzae typu b (Hib), inaktywowaną szczepionką przeciwko polio (IPV), szczepionką przeciw wirusowemu zapaleniu wątroby typu B (HBV), szczepionką sześciowalentną (DTPa-HBV-IPV / Hib), szczepionką przeciw wirusowemu zapaleniu wątroby typu A (HAV), szczepionką przeciwko meningokokom grupy B (Bexsero), szczepionką skoniugowaną przeciwko meningokokom grupy C (MenC), szczepionką skoniugowaną przeciw meningokokom grup A, C, W oraz Y (Men ACWY) oraz skoniugowaną szczepionką przeciw pneumokokom (PCV).
Różne szczepionki podawane w postaci wstrzyknięć powinny być zawsze podawane w różne miejsca ciała.
Jeżeli szczepionka zawierająca wirus odry nie może być podana jednocześnie ze szczepionką Varilrix, zaleca się zachowanie przerwy co najmniej jednego miesiąca pomiędzy podawaniem tych szczepionek, ponieważ szczepienie przeciwko odrze może spowodować krótkotrwałe obniżenie komórkowej odpowiedzi immunologicznej.
Pacjenci z grup wysokiego ryzyka ciężkiego przebiegu ospy wietrznej
Szczepionka Varilrix nie powinna być podawana jednocześnie z innymi żywymi, atenuowanymi szczepionkami. Jeśli nie występują inne dodatkowe przeciwwskazania, inaktywowane szczepionki i szczepionka Varilrix mogą być stosowane w dowolnej relacji czasowej. Jednakże, różne szczepionki w formie wstrzyknięć powinny być zawsze podawane w różne miejsca ciała.
Kobiety w ciąży nie powinny być szczepione szczepionką Varilrix.
Nie udokumentowano jednak przypadków uszkodzenia płodu po podaniu szczepionki przeciwko ospie wietrznej kobietom w okresie ciąży.
Kobiety w wieku rozrodczym
Należy unikać zajścia w ciążę przez miesiąc od zaszczepienia. Kobiety, które planują ciążę powinny zostać pouczone o konieczności opóźnienia tej decyzji.
Nie ma danych dotyczących stosowania szczepionki u kobiet karmiących piersią.
Ze względu na teoretyczne ryzyko przeniesienia szczepu wirusa zawartego w szczepionce z matki na niemowlę, zasadniczo nie zaleca się stosowania szczepionki Varilrix u matek karmiących piersią (patrz także punkt 4.4). Możliwość zaszczepienia kobiet narażonych na zakażenie ospą wietrzną bez historii przebycia choroby w wywiadzie lub o których wiadomo, że są seronegatywne wobec ospy wietrznej, należy oceniać indywidualnie.
Nie ma dostępnych danych dotyczących wpływu na płodność.
Nie przeprowadzono badań dotyczących wpływu szczepionki Varilrix na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Szczepionka Varilrix nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednakże, niektóre z działań niepożądanych wymienionych w punkcie 4.8 „Działania niepożądane” mogą krótkotrwale wpływać na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Ponad 7 900 osób uczestniczyło w badaniach klinicznych, w których oceniano reaktogenność szczepionki Varilrix podawanej podskórnie, oddzielnie lub w tym samym czasie co inne szczepionki.
Profil bezpieczeństwa w oparciu o dane otrzymane po zastosowaniu 5 369 dawek tylko szczepionki Varilrix u niemowląt, dzieci, młodzieży i dorosłych przedstawiono w tabeli poniżej:
Częstości występowania określono następująco:
Bardzo często: 1/10
Często: 1/100 do < 1/10
Niezbyt często: 1/1 000 do < 1/100 Rzadko: 1/10 000 do < 1/1 000 Bardzo rzadko: < 1/10 000
W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Klasyfikacja układów i narządów* | Częstość | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Niezbyt często | zakażenie górnych dróg oddechowych, zapalenie gardła |
Zaburzenia krwi i układu chłonnego | Niezbyt często | uogólnione powiększenie węzłów chłonnych |
Zaburzenia psychiczne | Niezbyt często | rozdrażnienie |
Zaburzenia układu nerwowego | Niezbyt często | ból głowy, senność |
Zaburzenia oka | Rzadko | zapalenie spojówek |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Niezbyt często | kaszel, nieżyt nosa |
Zaburzenia żołądka i jelit | Niezbyt często | wymioty, nudności |
Rzadko | biegunka, ból brzucha | |
Zaburzenia skóry i tkanki podskórnej | Często | wysypka |
Niezbyt często | wirusowa wysypka, świąd | |
Rzadko | pokrzywka | |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Niezbyt często | ból stawów, ból mięśni |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | ból, rumień |
Często | gorączka (mierzona pod pachą lub w jamie ustnej 37,5°C, mierzona w odbycie 38°C) †, obrzęk w miejscu wstrzyknięcia† | |
Niezbyt często | gorączka (mierzona pod pachą lub w jamie ustnej > 39°C, mierzona w odbycie > 39,5°C), zmęczenie, złe samopoczucie |
* Zgodnie z terminologią MedDRA (ang. Medical Dictionary for Regulatory Activities)
† Obrzęk w miejscu wstrzyknięcia oraz gorączka były zgłaszane bardzo często w badaniach u młodzieży i dorosłych. Obrzęk w miejscu wstrzyknięcia był również zgłaszany bardzo często po podaniu drugiej dawki u dzieci w wieku poniżej 13 lat.
Obserwowano tendencję do częstszego występowania bólu, rumienia i obrzęku w miejscu wstrzyknięcia po podaniu drugiej dawki w porównaniu z pierwszą dawką.
Nie odnotowano różnic w profilu reaktogenności u osób, które przed szczepieniem były seropozytywne w porównaniu z osobami seronegatywnymi.
W badaniu klinicznym 328 dzieci w wieku od 11 do 21 miesięcy otrzymało skojarzoną szczepionkę przeciw odrze, śwince, różyczce i ospie wietrznej firmy GlaxoSmithKline (GSK) (zawierającą ten sam szczep wirusa ospy wietrznej co szczepionka Varilrix) podskórnie lub domięśniowo. Zaobserwowano porównywalny profil bezpieczeństwa dla obydwu dróg podania.
Pacjenci należący do grup wysokiego ryzyka
Dane z badań klinicznych, które dotyczą pacjentów z grup wysokiego ryzyka są bardzo ograniczone. Jednakże, u tych pacjentów, działania niepożądane związane ze szczepieniem (głównie wykwity grudkowo-pęcherzykowe i gorączka) miały zwykle charakter łagodny. Podobnie jak u osób zdrowych, rumień, obrzęk i ból w miejscu podania były łagodne i ustępowały samoistnie.
Monitorowanie działań niepożądanych po wprowadzeniu do obrotu
Poniższe działania niepożądane odnotowywano sporadycznie w ramach monitorowania po
wprowadzeniu do obrotu.
Ponieważ te działania niepożądane były zgłaszane dobrowolnie i dotyczyły populacji o nieokreślonej wielkości, nie jest możliwe określenie częstości ich występowania.
Klasyfikacja układów i narządów* | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Półpasiec |
Zaburzenia krwi i układu chłonnego | Małopłytkowość (trombocytopenia) |
Zaburzenia układu immunologicznego | Reakcje anafilaktyczne, nadwrażliwość |
Zaburzenia układu nerwowego | Zapalenie mózgu, incydent naczyniowo – mózgowy, napady drgawkowe, zapalenie móżdżku, objawy przypominające zapalenie móżdżku (w tym przejściowe zaburzenia chodu i przejściowa ataksja) |
Zaburzenia naczyniowe | Zapalenie naczyń (w tym plamica Schönleina - Henocha i zespół Kawasaki) |
Zaburzenia skóry i tkanki podskórnej | Rumień wielopostaciowy |
* Zgodnie z terminologią MedDRA (ang. Medical Dictionary for Regulatory Activities)
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: 22 49 21 301
Faks: 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Zgłaszano przypadki nieumyślnego podania większej dawki szczepionki niż zalecana. W części tych przypadków jako działanie niepożądane zgłaszano letarg i drgawki. W innych przypadkach zgłoszonych jako przedawkowanie, nie odnotowano żadnych działań niepożądanych związanych ze szczepieniem.
Grupa farmakoterapeutyczna: Szczepionki przeciwwirusowe, szczepionki przeciw ospie wietrznej, kod ATC J07BK01.
Mechanizm działania
U osób nieuodpornionych, podanie szczepionki Varilrix powoduje klinicznie bezobjawową postać ospy wietrznej. Obecność przeciwciał jest uznawana jako dowód występowania odporności, jednak nie ma ustalonego poziomu ochronnego przeciwciał chroniącego przed zakażeniem wirusem ospy wietrznej.
Efekty farmakodynamiczne
Skuteczność szczepionek przeciwko ospie wietrznej, zawierającej szczep Oka, firmy GlaxoSmithKline (GSK) w zapobieganiu ospie wietrznej, potwierdzonej metodą PCR (od ang. polymerase chain reaction, łańcuchowa reakcja polimerazy) lub epidemiologicznie, była oceniana w dużym, randomizowanym, międzynarodowym badaniu klinicznym, w którym jako aktywną kontrolę zastosowano skojarzoną szczepionkę GSK przeciwko odrze, śwince i różyczce (Priorix). Badanie kliniczne zostało przeprowadzone w Europie w czasie, gdy powszechne szczepienia dzieci przeciwko ospie wietrznej nie były prowadzone. Dzieci w wieku od 12 do 22 miesięcy otrzymały jedną dawkę szczepionki Varilrix albo dwie dawki skojarzonej szczepionki GSK przeciw odrze, śwince, różyczce i ospie wietrznej (Priorix-Tetra) w odstępie 6 tygodni. Wykazano skuteczność szczepionki w zapobieganiu potwierdzonej ospie wietrznej o jakimkolwiek nasileniu oraz potwierdzonej ospie wietrznej o umiarkowanym lub ciężkim stopniu nasilenia, obserwowaną po 2 letnim pierwszorzędowym okresie obserwacji (mediana okresu obserwacji: 3,2 roku). Utrzymywanie się skuteczności było obserwowane w trakcie tego samego badania klinicznego podczas długoterminowej obserwacji: 6-letniej (mediana okresu obserwacji: 6,4 roku) oraz 10-letniej (mediana okresu obserwacji: 9,8 roku).
Dostępne dane znajdują się w tabeli poniżej.
Grupa | Okres obserwacji | Skuteczność przeciw potwierdzonej ospie wietrznej o jakimkolwiek nasileniu | Skuteczność szczepionki przeciw potwierdzonej ospie wietrznej o umiarkowanym lub ciężkim nasileniu |
Monowalentna | 2 lata | 65,4% | 90,7% |
szczepionka GSK | (97,5% CI: 57,2; 72,1) | (97,5% CI: 85,9; 93,9) | |
przeciwko ospie wietrzej (Oka) (Varilrix) | |||
6 lat(1) | 67,0% (95% CI: 61,8; 71,4) | 90,3% (95% CI: 86,9; 92,8) | |
1 dawka | 10 lat(1) | 67,2% | 89,5% |
N = 2 487 | (95% CI: 62,3; 71,5) | (95% CI: 86,1; 92,1) | |
Szczepionka GSK | 2 lata | 94,9% | 99,5% |
skojarzona przeciw | (97,5% CI: 92,4; 96,6) | (97,5% CI: 97,5; 99,9) | |
odrze, śwince, różyczce i ospie wietrznej (Oka) (Priorix-Tetra) | |||
6 lat(1) | 95,0% (95% CI: 93,6; 96,2) | 99,0% (95% CI: 97,7; 99,6) | |
2 dawki | 10 lat(1) | 95,4% | 99,1% |
N = 2 489 | (95% CI: 94,0; 96,4) | (95% CI: 97,9; 99,6) |
N = liczba osób włączonych do badania i poddanych szczepieniu
(1) analiza opisowa
W badaniach klinicznych, większość zaszczepionych osób, które zostały później narażone na działanie dzikiego wirusa ospy wietrznej, była albo całkowicie chroniona przed kliniczną postacią ospy wietrznej, albo rozwinęła łagodniejszą postać tej choroby (tj. mała liczba pęcherzyków, brak gorączki).
Dane dotyczące skuteczności, pochodzące z obserwacji w różnych okolicznościach (ogniska epidemiczne, badania kliniczno-kontrolne, badania obserwacyjne, analiza informacji z baz danych,
modele) wskazują na wyższy poziom ochrony i zmniejszenie częstości występowania ospy wietrznej po podaniu dwóch dawek szczepionki w porównaniu z podaniem jednej dawki.
Wpływ jednej dawki szczepionki Varilrix na zmniejszenie liczby hospitalizacji związanych z zachorowaniem na ospę wietrzną i zmniejszenie liczby wizyt ambulatoryjnych wśród dzieci wynosił odpowiednio 81 i 87%.
Profilaktyka poekspozycyjna
Dostępne dane dotyczące zapobiegania ospie wietrznej po ekspozycji na wirusa ospy wietrznej są
ograniczone.
W randomizowanym, podwójnie ślepym, kontrolowanym placebo badaniu klinicznym, z udziałem 42 dzieci w wieku od 12 miesięcy do 13 lat, 22 dzieci otrzymało jedną dawkę szczepionki Varilrix, a 20 dzieci otrzymało jedną dawkę placebo w przeciągu 3 dni po ekspozycji. U podobnego odsetka (odpowiednio 41% i 45%) dzieci rozwinęła się ospa wietrzna, ale ryzyko rozwoju postaci choroby umiarkowanej do ciężkiej było 8-krotnie wyższe w grupie, która otrzymała placebo w porównaniu z grupą zaszczepioną (ryzyko względne = 8,0; 95% CI: 1,2; 51,5; P=0,003).
W kontrolowanym badaniu klinicznym z udziałem 33 dzieci w wieku od 12 miesięcy do 12 lat, 15 dzieci otrzymało szczepionkę przeciw ospie wietrznej (13 osób otrzymało szczepionkę przeciw ospie wietrznej Varilrix, a 2 osoby otrzymały inną szczepionkę przeciw ospie wietrznej, zawierającą szczep Oka) do 5 dni po ekspozycji, a 18 osób nie zostało zaszczepionych. Dla grupy 12 dzieci zaszczepionych w ciągu 3 dni po ekspozycji, skuteczność szczepionki wyniosła 44% (95% CI: -1; 69) w zapobieganiu jakiejkolwiek postaci ospy wietrznej i 77% (95% CI: 14; 94) w zapobieganiu umiarkowanej lub ciężkiej postaci ospy wietrznej.
W prospektywnym badaniu kohortowym (z historycznymi współczynnikami zapadalności jako kontrolą) 67 dzieci, nastolatków lub dorosłych otrzymało szczepionkę przeciwko ospie wietrznej (55 osób otrzymało szczepionkę przeciw ospie wietrznej Varilrix, a 12 osób otrzymało inną szczepionkę przeciw ospie wietrznej, zawierającej szczep Oka) w ciągu 5 dni po ekspozycji. Skuteczność szczepionki wyniosła 62,3% (95% CI: 47,8; 74,9) w zapobieganiu którejkolwiek postaci ospy wietrznej i 79,4% (95% CI: 66,4; 88,9) w zapobieganiu umiarkowanej lub ciężkiej postaci ospy wietrznej.
Pacjenci należący do grup wysokiego ryzyka ciężkiego przebiegu ospy wietrznej
Odpowiedź immunologiczna po podaniu podskórnym
U dzieci w wieku od 11 do 21 miesięcy wskaźnik odpowiedzi serologicznej, mierzony metodą ELISA 6 tygodni po szczepieniu, wyniósł 89,6% po jednej dawce szczepionki i 100% po drugiej dawce szczepionki.
U dzieci zaszczepionych w wieku od 9 miesięcy do 12 lat, serokonwersję (przeciwciała oznaczane metodą immunofluorescencji - IFA) po 6 tygodniach po szczepieniu jedną dawką szczepionki stwierdzono u > 98% zaszczepionych.
U dzieci zaszczepionych w wieku 9 miesięcy do 6 lat, serokonwersję (przeciwciała oznaczane metodą IFA) po 6 tygodniach po podaniu drugiej dawki stwierdzono u 100% zaszczepionych. Po drugiej dawce obserwowano istotny wzrost miana przeciwciał (5-26 krotny wzrost średniej geometrycznej miana przeciwciał).
U osób szczepionych w wieku 13 lat i starszych, serokonwersję (przeciwciała oznaczane metodą IFA) po 6 tygodniach po podaniu drugiej dawki stwierdzono u 100% zaszczepionych. Po roku od szczepienia u wszystkich badanych stwierdzano obecność przeciwciał.
Pacjenci należący do grup wysokiego ryzyka ciężkiego przebiegu ospy wietrznej
Ograniczone dane z badań klinicznych wykazały immunogenność u osób z wysokim ryzykiem ciężkiego przebiegu ospy wietrznej.
Odpowiedź immunologiczna po podaniu domięśniowym
Immunogenność szczepionki Varilrix podawanej domięśniowo oszacowana jest w oparciu o badanie porównawcze, w którym 283 zdrowych dzieci w wieku od 11 do 21 miesięcy otrzymało skojarzoną szczepionkę GSK przeciwko odrze, śwince, różyczce i ospie wietrznej (zawierającą ten sam szczep wirusa ospy wietrznej co Varilrix) podaną podskórnie lub domięśniowo. Wykazano porównywalną immunogenność dla obydwu dróg podawania.
Ocena właściwości farmakokinetycznych nie jest wymagana dla szczepionek.
Niekliniczne dane o bezpieczeństwie uzyskane w badaniach przeprowadzonych na zwierzętach nie wykazują szczególnego zagrożenia dla ludzi.
Proszek:
Aminokwasy (w tym fenyloalanina) Laktoza bezwodna
Sorbitol (E 420)
Mannitol (E 421)
Rozpuszczalnik:
Woda do wstrzykiwań
Szczepionkę należy podać niezwłocznie po rekonstytucji.
Wykazano jednak, że szczepionkę po rekonstytucji można przechowywać do 90 minut w temperaturze pokojowej (25°C) lub do 8 godzin w lodówce (w temperaturze 2°C – 8°C). Jeśli szczepionka po rekonstytucji nie została zużyta w zalecanym czasie lub nie była przechowywana w zalecanych warunkach, należy ją wyrzucić.
Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt 6.3.
Proszek w jednodawkowej fiolce ze szkła (typ I) z korkiem (z gumy bromobutylowej). 0,5 ml rozpuszczalnika w ampułce ze szkła (typ I).
Wielkość opakowania: po 10 sztuk.
stosowania
Rozpuszczalnik oraz szczepionkę po rekonstytucji należy obejrzeć przed podaniem pod kątem obecności obcych cząstek i (lub) zmian fizycznych. W przypadku stwierdzenia nieprawidłowości w wyglądzie, nie należy podawać szczepionki.
Szczepionkę należy poddać rekonstytucji poprzez dodanie całego rozpuszczalnika z ampułki do fiolki z proszkiem. Fiolką należy silnie wstrząsnąć, aż proszek ulegnie całkowitemu rozpuszczeniu.
Ze względu na niewielkie różnice pH, szczepionka po rekonstytucji może przyjmować kolor od jasnobrzoskwiniowego do różowego. Jest to normalne zjawisko i nie ma wpływu na działanie szczepionki. W razie stwierdzenia innych zmian, nie należy podawać szczepionki.
Należy pobrać z powrotem całą zawartość fiolki. Do podania szczepionki należy użyć nowej igły.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
DOPUSZCZENIE DO OBROTU
GlaxoSmithKline Biologicals S.A.
rue de l’Institut 89 1330 Rixensart, Belgia
4690











