Spis treści:
- NAZWA PRODUKTU LECZNICZEGO Gensulin R, 100 j.m./ml, roztwór do wstrzykiwań
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO Gensulin R, 100 j.m./ml, roztwór do wstrzykiwań
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przygotowanie dawki
Zdjąć plastikową nakładkę ochronną z kapsla (nie zrywać kapsla).
Przetrzeć odkrytą część korka roztworem alkoholu. Nie wyjmować korka!
Nabrać powietrze do strzykawki w objętości równej dawce insuliny.
Igłą nasadzoną na strzykawkę przekłuć gumowy korek i wstrzyknąć powietrze do fiolki.
Obrócić fiolkę ze strzykawką do góry dnem.
Upewnić się, że koniec igły znajduje się w roztworze insuliny.
Nabrać do strzykawki odpowiednią objętość insuliny.
Pęcherzyki powietrza usunąć ze strzykawki.
Powtórnie sprawdzić zalecaną dawkę i wyjąć igłę z fiolki.
Wstrzykiwanie dawki
Odkazić skórę w miejscu, gdzie ma być dokonane wstrzyknięcie.
Jedną ręką ustabilizować skórę, przez jej naciągnięcie lub uszczypnięcie dużej powierzchni w celu utworzenia fałdu skórnego.
Wziąć strzykawkę w drugą rękę i trzymać ją jak ołówek. Wkłuć igłę prosto w skórę (kąt 90). Upewnić się, że igła jest całkowicie wkłuta i dobrze umieszczona w warstwie tłuszczu pod skórą, a nie w głębszych warstwach skóry (w przypadku bardzo szczupłych osób może być konieczne
ustawienie igły pod kątem, zamiast prostopadle).
Aby wstrzyknąć insulinę, należy wepchnąć tłok do samego końca, wstrzykując dawkę w czasie poniżej 5 sekund.
Trzymać watkę z alkoholem blisko igły i wyciągnąć igłę ze skóry. Przycisnąć przez kilka sekund watkę z alkoholem w miejscu wstrzyknięcia. Nie pocierać skóry w miejscu wstrzyknięcia!
Aby uniknąć uszkodzenia tkanek, zaleca się przy każdym zastrzyku zmieniać miejsce wstrzyknięcia. Kolejne miejsce wstrzyknięcia powinno być oddalone od poprzedniego, o co najmniej 1-2 cm.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
obrzęki, szczególnie w przypadku gdy wcześniej obserwowana niewystarczająca kontrola metaboliczna uległa poprawie w wyniku intensywnej insulinoterapii;
przyrost masy ciała;
reakcje w miejscu wstrzyknięcia, takie jak: przebarwienie, krwawienie, stwardnienie, guzek lub naciek, ból, wysypka, pokrzywka lub krosty;
świąd, w tym świąd uogólniony;
zawroty głowy.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
1 ml roztworu Gensulin R zawiera 100 j.m. insuliny ludzkiej (Insulinum humanum) rozpuszczalnej, otrzymywanej metodą rekombinacji DNA E. coli.
Każda fiolka zawiera 10 ml roztworu, co odpowiada 1000 j.m. insuliny rozpuszczalnej.
Produkt leczniczy Gensulin R, zawiera wyłącznie insulinę ludzką, jest w 100% zgodny ze składem
aminokwasowym insuliny produkowanej przez człowieka w odróżnieniu od insulin zwierzęcych czy innych analogów insulin otrzymanych na drodze rekombinacji genetycznej, których skład różni się w różnym stopniu od insuliny ludzkiej.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Gensulin R: roztwór do wstrzykiwań w fiolce.
Produkt leczniczy Gensulin R to jałowy, przezroczysty, bezbarwny roztwór wodny ludzkiej insuliny, o pH 7-7,6.
Leczenie pacjentów z cukrzycą, którzy wymagają stosowania insuliny w celu utrzymania prawidłowego metabolizmu glukozy.
Cukrzyca u kobiet w ciąży.
Dawkowanie
Dawkowanie ustala lekarz zgodnie z indywidualnym zapotrzebowaniem pacjenta na insulinę. W cukrzycy typu 2 średnia dawka początkowa wynosi 0,2 j.m./kg masy ciała.
Sposób podawania
Produkt leczniczy Gensulin R w fiolce 10 ml należy podawać we wstrzyknięciach podskórnych.
Pomimo, że nie jest to zalecane, produkt można również podawać we wstrzyknięciach domięśniowych. W szczególnych okolicznościach można ją także podać dożylnie.
Produkt leczniczy Gensulin R można stosować w intensywnej insulinoterapii jako insulinę doposiłkową, prandialną.
Produkt leczniczy Gensulin R podaje się we wstrzyknięciu podskórnym przez wstrzyknięcie w okolicę brzucha, udo, ramię, okolicę mięśnia naramiennego lub okolicę pośladkową. Miejsca wstrzyknięć należy zmieniać w obrębie tego samego obszaru w celu zmniejszenia ryzyka lipodystrofii i
amyloidozy skórnej (patrz punkty 4.4 i 4.8).
Należy zwrócić uwagę, aby w trakcie podawania insuliny Gensulin R nie wprowadzić igły do naczynia krwionośnego. Po wstrzyknięciu insuliny nie należy masować miejsca iniekcji. Należy poinformować pacjentów o właściwym sposobie wykonywania iniekcji.
Insulina Gensulin R może być podawana jednocześnie z Gensulin N (patrz punkt Instrukcja dotycząca przygotowania leku do stosowania – Mieszanie insulin).
Produkt leczniczy Gensulin R należy podawać w ciągu 15 min przed posiłkiem.
Produkt leczniczy Gensulin R może być stosowany w leczeniu skojarzonym z doustnymi lekami przeciwcukrzycowymi np: metforminą lub glimepirydem.
Instrukcja dotycząca przygotowania leku do stosowania
Fiolka Gensulin R nie wymaga mieszania roztworu przed użyciem. Produkt można stosować tylko, jeżeli jest przezroczysty, bezbarwny, nie zawiera nierozpuszczalnych zanieczyszczeń i wygląda jak woda.
Każde opakowanie zawiera Ulotkę dla pacjenta z instrukcją dotyczącą sposobu wykonania iniekcji.
Podawanie produktu leczniczego Gensulin R za pomocą strzykawki
Do podawania insuliny przeznaczone są specjalne strzykawki z oznaczeniem stężenia insuliny. Zaleca się używać strzykawek tego samego rodzaju i producenta. Zawsze należy sprawdzić, czy używana strzykawka jest wyskalowana odpowiednio do stężenia stosowanego produktu insuliny.
Mieszanie roztworu Gensulin R w fiolkach z zawiesiną Gensulin N w fiolkach
Insulina Gensulin R może być podawana jednocześnie z Gensulin N.
Decyzja o zmieszaniu roztworu Gensulin R z zawiesiną Gensulin N może być podjęta tylko przez lekarza. Podczas przygotowywania mieszanin, do strzykawki należy zawsze wprowadzać jako
pierwszą insulinę krótkodziałającą – Gensulin R. Podając insulinę należy postępować identycznie jak podano wyżej.
Hipoglikemia.
Nadwrażliwość na insulinę ludzką lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, chyba, że jest to częścią programu odczulania.
Zmianę typu lub marki stosowanej u pacjenta insuliny należy przeprowadzać pod ścisłym nadzorem lekarza. Zmiana mocy, marki (producenta), typu (rozpuszczalna, izofanowa, mieszanka), pochodzenia (insulina zwierzęca, ludzka, analog insuliny ludzkiej) i (lub) metody produkcji (rekombinacja DNA lub insulina pochodzenia zwierzęcego) może spowodować konieczność modyfikacji dawki.
W przypadku zmiany produktu z insuliny pochodzenia zwierzęcego na insulinę ludzką, u niektórych pacjentów może być konieczna zmiana dawki. Jeżeli konieczna jest zmiana dawki, powinna ona nastąpić przy podaniu pierwszej dawki nowej insuliny lub w czasie pierwszych kilku tygodni lub miesięcy jej stosowania.
U niektórych pacjentów, po zmianie insuliny pochodzenia zwierzęcego na insulinę ludzką, wczesne objawy ostrzegawcze hipoglikemii mogą być mniej wyraźnie zaznaczone lub zupełnie różne od tych występujących podczas stosowania insuliny pochodzenia zwierzęcego. W przypadku uzyskania
u pacjenta lepszej kontroli glikemii (np. przez zastosowanie intensywnej insulinoterapii) objawy
ostrzegawcze hipoglikemii mogą być mniej wyraźne lub wcale się nie pojawić. Należy poinformować o tym pacjentów. Inne sytuacje, które mogą spowodować zmianę lub osłabienie wczesnych objawów ostrzegawczych hipoglikemii to: długotrwała cukrzyca, neuropatia cukrzycowa, przyjmowanie
niektórych leków, np. -adrenolityków. Niewyrównana hipoglikemia lub hiperglikemia może prowadzić do utraty przytomności, śpiączki lub zgonu.
Stosowanie nieodpowiednich dawek lub przerwanie leczenia, zwłaszcza w przypadku cukrzycy insulinozależnej, może prowadzić do hiperglikemii i kwasicy ketonowej – stanów, które potencjalnie mogą być śmiertelne.
Stosowanie ludzkiej insuliny może spowodować wytworzenie przeciwciał, jednak ich miano jest niższe niż w przypadku stosowania oczyszczonej insuliny pochodzenia zwierzęcego.
Zapotrzebowanie na insulinę może ulec znacznej zmianie w przypadku chorób trzustki, nadnerczy, przysadki mózgowej, tarczycy, zaburzeń czynności nerek lub wątroby.
Zapotrzebowanie na insulinę może być zwiększone podczas chorób z wysoką gorączką, ciężkiego zakażenia, chorób i zaburzeń czynności przewodu pokarmowego przebiegających z nudnościami, wymiotami, biegunką, powolnym opróżnianiem żołądka oraz z zaburzeniami wchłaniania, jak również w przypadku zaburzeń emocjonalnych.
Modyfikacja dawki może być również konieczna w przypadku zmiany aktywności fizycznej pacjenta lub sposobu odżywiania.
Osoby zamierzające przekroczyć przynajmniej dwie strefy czasowe powinny skonsultować się
z lekarzem w celu zmiany schematu podawania insuliny. W czasie podróży lotniczej należy insulinę przechowywać w bagażu podręcznym, a nie w luku bagażowym (nie może ulec zamrożeniu).
Podczas długotrwałego leczenia insuliną może rozwinąć się oporność na insulinę. W razie wystąpienia insulinooporności należy zastosować większe dawki insuliny.
Jednoczesne stosowanie produktu leczniczego Gensulin R z pioglitazonem:
Zgłaszano przypadki niewydolności serca w czasie jednoczesnego stosowania insuliny i pioglitazonu, szczególnie u pacjentów z czynnikami ryzyka niewydolności serca. Należy o tym pamiętać przed zastosowaniem leczenia skojarzonego produktem Gensulin R z pioglitazonem. W przypadku leczenia skojarzonego tymi lekami należy obserwować, czy u pacjentów nie występują objawy przedmiotowe i podmiotowe niewydolności serca, zwiększenie masy ciała i obrzęki. Należy odstawić pioglitazon w przypadku wystąpienia jakichkolwiek objawów niewydolności serca.
Pacjentów należy poinformować o konieczności ciągłego zmieniania miejsca wstrzyknięcia, w celu zmniejszenia ryzyka lipodystrofii i amyloidozy skórnej. Po wstrzyknięciu insuliny w obszarze występowania takich odczynów, może być opóźnione wchłanianie insuliny i pogorszona możliwość
kontroli glikemii. Zgłaszano, że nagła zmiana miejsca wstrzyknięcia na obszar niedotknięty zmianami skutkuje wystąpieniem hipoglikemii. Po zmianie miejsca wstrzyknięcia zaleca się kontrolę stężenia glukozy we krwi; można też rozważyć dostosowanie dawki leków przeciwcukrzycowych.
Substancje pomocnicze
Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
Niektóre produkty lecznicze mogą zmieniać metabolizm glukozy. Lekarz powinien rozważyć możliwość wystąpienia interakcji i zapytać pacjenta o inne stosowane przez niego produkty lecznicze.
Zapotrzebowanie na insulinę może wzrosnąć pod wpływem substancji o działaniu
hiperglikemizującym, takich jak glikokortykosteroidy, hormony tarczycy, hormon wzrostu, danazol,
2-sympatykomimetyki (ritodryna, salbutamol, terbutalina), tiazydy.
Zapotrzebowanie na insulinę może się zmniejszyć pod wpływem substancji o działaniu hipoglikemizującym, takich jak np. doustne leki hipoglikemizujące, salicylany (np. kwas
acetylosalicylowy), niektóre leki przeciwdepresyjne (inhibitory monoaminooksydazy), niektóre inhibitory konwertazy angiotensyny (kaptopril, enalapril), antagoniści receptora angiotensyny II, nieselektywne leki -adrenolityczne i alkohol.
Zapotrzebowanie na insulinę może się zmniejszyć bądź zwiększyć pod wpływem analogów somatostatyny (oktreotyd, lanreotyd).
Ciąża
U pacjentek leczonych insuliną (cukrzyca insulinozależna lub cukrzyca ciężarnych) konieczne jest utrzymanie właściwej kontroli przez cały okres ciąży. Zapotrzebowanie na insulinę zwykle zmniejsza się w pierwszym trymestrze ciąży oraz wzrasta w drugim i trzecim trymestrze. Należy poinformować pacjentki chore na cukrzycę, że w przypadku zajścia w ciążę lub planowania ciąży powinny
powiadomić o tym lekarza prowadzącego.
U kobiet w ciąży chorych na cukrzycę, konieczne jest dokładne kontrolowanie stężenia glukozy i ogólnego stanu zdrowia.
Bezpośrednio po porodzie zapotrzebowanie na insulinę gwałtownie zmniejsza się. Karmienie piersią
U pacjentek z cukrzycą karmiących piersią, może być konieczna modyfikacja dawki insuliny i (lub)
stosowanej diety, ponieważ w okresie karmienia piersią zapotrzebowanie na insulinę jest mniejsze niż przed ciążą, a wyrównanie do pierwotnego zapotrzebowania następuje po 6-9 miesiącach.
U pacjenta na skutek hipoglikemii może być obniżona zdolność koncentracji i reagowania. Może stanowić to zagrożenie w sytuacjach, kiedy te zdolności są szczególnie wymagane np. prowadzenie pojazdów lub obsługiwanie maszyn.
Należy poinformować pacjentów, żeby zachowali ostrożność w celu uniknięcia hipoglikemii podczas prowadzenia pojazdów. Jest to szczególnie ważne u osób, które słabiej odczuwają wczesne objawy ostrzegawcze hipoglikemii lub nie są ich całkowicie świadome oraz u osób, u których często
występuje hipoglikemia. W takich przypadkach należy rozważyć zasadność prowadzenia pojazdu.
Podczas stosowania insuliny u pacjentów chorych na cukrzycę najczęściej występującym działaniem niepożądanym jest hipoglikemia. Ciężka hipoglikemia może prowadzić do utraty przytomności, a w skrajnych przypadkach do śmierci. Częstość występowania hipoglikemii nie jest przedstawiana,
ponieważ hipoglikemia jest zarówno skutkiem podania dawki insuliny jak również innych czynników, np. stosowanej diety i poziomu aktywności fizycznej.
Zaburzenia układu immunologicznego
Miejscowa reakcja alergiczna jest częstym (1/100 do <1/10) działaniem niepożądanym.
W miejscu wstrzyknięcia insuliny może wystąpić rumień, obrzęk i swędzenie. Objawy te zwykle przemijają w ciągu kilku dni lub kilku tygodni. W niektórych przypadkach objawy miejscowe mogą być spowodowane innymi czynnikami niż insulina, np. substancjami drażniącymi występującymi w środkach do odkażania skóry lub stosowaniem złej techniki wykonania iniekcji.
Ogólnoustrojowe objawy uczuleniowe, będące objawami uogólnionej nadwrażliwości na insulinę występują bardzo rzadko (<1/10 000), ale są potencjalnie bardziej niebezpieczne.
Do objawów tych należą: wysypka na całym ciele, duszność, świszczący oddech, zmniejszenie
ciśnienia tętniczego krwi, przyspieszone tętno i pocenie. W ciężkich przypadkach objawy uogólnionej alergii mogą stanowić zagrożenie życia. Nieliczne przypadki ciężkiej alergii na produkt leczniczy Gensulin R wymagają natychmiastowego leczenia. Może być konieczna zmiana insuliny lub odczulanie.
Zaburzenia skóry i tkanki podskórnej
Częstość nieznana: amyloidoza skórna;
Lipodystrofia i amyloidoza skórna mogą wystąpić w miejscu wstrzyknięcia i spowodować miejscowe opóźnienie wchłaniania insuliny. Ciągła zmiana miejsca wstrzyknięcia w obrębie danego obszaru może zmniejszyć ryzyko wystąpienia takich reakcji lub im zapobiec (patrz punkt 4.4).
Po wprowadzeniu insuliny do obrotu zgłaszano także następujące działania niepożądane:
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C
02-222 Warszawa; Tel.: + 48 22 49 21 301; Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie istnieje jednoznaczna definicja przedawkowania insuliny, ponieważ stężenie glukozy w surowicy krwi jest rezultatem złożonych zależności pomiędzy stężeniem insuliny, dostępnością glukozy
i innymi procesami metabolicznymi. W wyniku nadmiernej aktywności insuliny w stosunku do spożytego pokarmu i wydatkowanej energii może wystąpić hipoglikemia.
Objawami hipoglikemii mogą być: apatia, stan splątania, kołatanie serca, bóle głowy, poty i wymioty.
Łagodna hipoglikemia ustępuje po doustnym podaniu glukozy lub innych produktów zawierających cukier.
Wyrównanie umiarkowanie nasilonej hipoglikemii polega na domięśniowym lub podskórnym podaniu glukagonu, a następnie doustnym podaniu węglowodanów, kiedy stan pacjenta wystarczająco się poprawi. W przypadku braku reakcji pacjenta na glukagon, należy podać dożylnie roztwór glukozy.
Jeżeli pacjent jest w stanie śpiączki, należy podać domięśniowo lub podskórnie glukagon.
W przypadku, gdy glukagon nie jest dostępny lub, gdy pacjent nie reaguje na podanie glukagonu, należy podać dożylnie roztwór glukozy. Natychmiast po odzyskaniu świadomości, pacjent powinien otrzymać posiłek.
Może być konieczne długotrwałe doustne podawanie węglowodanów i obserwacja pacjenta, ponieważ hipoglikemia może wystąpić ponownie po krótkotrwałej poprawie klinicznej.
Grupa farmakoterapeutyczna: Insuliny o krótkim czasie działania, kod ATC: A10AB01 Zasadniczym działaniem insuliny jest regulowanie metabolizmu glukozy.
Ponadto, insulina ma działanie anaboliczne i antykataboliczne, różne w zależności od rodzaju tkanki. W tkance mięśniowej powoduje nasilenie syntezy glikogenu, kwasów tłuszczowych, glicerolu i białek, zwiększenie wychwytu aminokwasów z jednoczesnym obniżeniem intensywności procesów glikogenolizy, glukoneogenezy, ketogenezy, lipolizy, katabolizmu białek i zużycia aminokwasów.
Poniżej pokazano typowy profil aktywności (krzywa zużycia glukozy) po podskórnym podaniu insuliny. W trakcie stosowania obserwowany jest zakres odchyleń od wartości średniej, jakich pacjent może doświadczać zarówno w czasie jak i w zależności od intensywności działania insuliny.
Indywidualne odchylenia mogą zależeć od takich czynników jak: wielkość dawki, miejsce wstrzyknięcia, temperatura ciała i aktywność fizyczna pacjenta.
Gensulin R
Aktywność insuliny
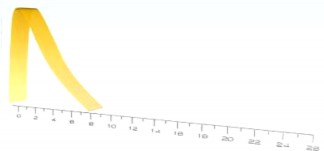
Czas (godziny)
Farmakokinetyka insuliny nie odzwierciedla aktywności metabolicznej hormonu. Dlatego oceniając aktywność insuliny bardziej właściwe jest analizowanie krzywych zużycia glukozy (jak wyjaśniono powyżej).
Ograniczone dane niekliniczne nie wykazały innych działań toksycznych mających znaczenie kliniczne dla człowieka, oprócz działania związanego z farmakodynamiczną aktywnością polegającą na obniżaniu stężenia glukozy we krwi (hipoglikemia).
Glicerol Metakrezol Kwas solny
Sodu wodorotlenek Woda do wstrzykiwań
Nie należy mieszać insuliny Gensulin R z insulinami wytwarzanymi przez innych wytwórców oraz z insulinami pochodzenia zwierzęcego.
3 lata
Przechowywać w temperaturze od 2°C do 8°C. Nie zamrażać.
Po pierwszym otwarciu opakowania bezpośredniego produkt leczniczy przechowywać w temperaturze do 25°C przez 28 dni. Chronić przed światłem.
Fiolek, które są używane lub mają być używane, nie przechowywać w lodówce. Można je nosić przy sobie. Produkt leczniczy Gensulin R należy chronić przed wysoką temperaturą.
Fiolka szklana, zamknięta kapslem aluminiowym z dwuwarstwowym krążkiem gumowym i nakładką z polipropylenu, zawierająca 10 ml produktu Gensulin R, umieszczona w tekturowym pudełku.
Nie należy powtórnie stosować zużytych igieł. Igłę należy usunąć w bezpieczny sposób. Nie należy dzielić się igłami z innymi osobami. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami.
BIOTON S.A.
ul. Starościńska 5
02-516 Warszawa
Pozwolenie nr 8520
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 29.12.2000 r. Data ostatniego przedłużenia pozwolenia: 17.11.2009 r.











