Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
zmniejszenie wydzielania wydzieliny oskrzelowej, które może powodować zagęszczenie zalegającej wydzieliny i powstanie czopu oskrzelowego (trudnego do usunięcia z dróg oddechowych).
Zaburzenia żołądka i jelit
zmniejszenie wydzielania śliny,
suchość w jamie ustnej.
Zaburzenia ogólne i stany w miejscu podania
zmniejszenie wydzielania potu,
brak wydzielania potu.
Powyższe działania niepożądane nasilają się wraz ze zwiększaniem dawkowania atropiny. Po zastosowaniu dużych dawek atropiny mogą wystąpić następujące działania niepożądane:
Zaburzenia układu immunologicznego
anafilaksja.
Zaburzenia układu nerwowego
omamy,
bóle głowy,
zawroty głowy,
nerwowość,
senność,
osłabienie,
zmęczenie,
bezsenność,
dezorientacja i (lub) pobudzenie, zwłaszcza u pacjentów w podeszłym wieku.
Zaburzenia oka
rozszerzenie źrenic,
zaburzenia akomodacji oka,
podwyższone ciśnienie wewnątrzgałkowe.
Zaburzenia serca
przyspieszenie czynności serca z możliwością wystąpienia trzepotania lub migotania przedsionków, rozkojarzenia przedsionkowo-komorowego i dodatkowych skurczów komorowych.
Zaburzenia naczyniowe
zaczerwienienie twarzy.
Zaburzenia żołądka i jelit
zaparcie,
zmniejszenie wydzielania żołądkowego,
utrata smaku,
nudności,
wymioty,
wzdęcia.
Zaburzenia skóry i tkanki podskórnej
pokrzywka i wysypka, niekiedy przebiegające ze złuszczaniem naskórka.
Zaburzenia nerek i dróg moczowych
zatrzymanie moczu.
Zdarzały się przypadki ciężkiej bradykardii wywołanej hiperkaliemią, która nie ustępowała po podaniu atropiny.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
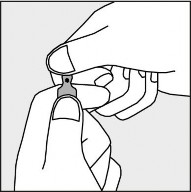
Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki.
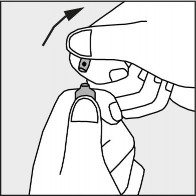
Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
ATROPINUM SULFURICUM WZF, 0,5 mg/ml, roztwór do wstrzykiwań ATROPINUM SULFURICUM WZF, 1 mg/ml, roztwór do wstrzykiwań
Każdy ml roztworu do wstrzykiwań zawiera 0,5 mg lub 1 mg atropiny siarczanu (Atropini sulfas). Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań Klarowny, bezbarwny płyn
Bradykardia zatokowa, arytmia
Wprowadzenie do znieczulenia ogólnego (premedykacja)
Zatrucie insektycydami fosforoorganicznymi, zatrucie lekami cholinomimetycznymi Zatrucie grzybami zawierającymi muskarynę
Odwracanie blokady nerwowo-mięśniowej
Pomocniczo w stanach spastycznych mięśniówki gładkiej w jamie brzusznej (kolka wątrobowa, nerkowa)
W diagnostyce radiologicznej, gdy pożądane jest wywołanie rozkurczu mięśniówki gładkiej i zwolnienie pasażu jelitowego
Dawkowanie
Dorośli, młodzież w wieku powyżej 12 lat oraz pacjenci w podeszłym wieku
Bradykardia zatokowa, arytmia
Domięśniowo lub dożylnie: 0,3 do 0,6 mg co 4-6 godziny do dawki całkowitej 2 mg.
W reanimacji: 0,5 mg; dawkę można powtarzać w odstępach 5-minutowych do momentu ustabilizowania rytmu serca.
W przypadku zatrzymania akcji serca należy podać dożylnie jednorazową dawkę 3 mg. Jeżeli nie można podać atropiny dożylnie podczas reanimacji, należy podać przez rurkę dotchawiczą dawkę 2-3 razy wyższą niż dawka stosowana dożylnie.
Wprowadzenie do znieczulenia ogólnego (premedykacja)
Domięśniowo lub podskórnie: 0,3 do 0,6 mg podana 30-60 minut przed zabiegiem lub ta sama dawka podana dożylnie bezpośrednio przed zabiegiem.
Zatrucie insektycydami fosforoorganicznymi, zatrucie lekami cholinomimetycznymi, zatrucie grzybami zawierającymi muskarynę
Domięśniowo lub dożylnie: 1 do 2 mg, dawkę można powtarzać co 5 do 60 minut do zaniku objawów zatrucia; nie przekraczać maksymalnej dawki 100 mg w ciągu pierwszych 24 godzin.
Odwracanie blokady nerwowo-mięśniowej
Dożylnie od 0,6 mg do 1,2 mg podawać kilka minut przed lub jednocześnie z neostygminą w dawce od 0,5 mg do 2 mg (używając oddzielnych strzykawek).
Pomocniczo w stanach spastycznych mięśniówki gładkiej w jamie brzusznej (kolka wątrobowa, nerkowa)
Domięśniowo lub dożylnie: od 0,5 mg do 1 mg.
W diagnostyce radiologicznej, gdy pożądane jest wywołanie rozkurczu mięśniówki gładkiej i zwolnienie pasażu jelitowego
Domięśniowo: 1 mg.
Dzieci w wieku poniżej 12 lat
Zwykle dawka domięśniowa, dożylna lub podskórna wynosi 10 mikrogramów/kg mc.
(0,01 mg/kg mc.); nie przekraczać 0,4 mg. Jeżeli zachodzi konieczność dawki te można powtórzyć co 4-6 godzin.
W zagrożeniu życia w przypadku wystąpienia ciężkich zaburzeń serca
W celu ratowania życia: dożylnie 20 mikrogramów/kg mc. (0,02 mg/kg mc.); minimalna dawka: 0,01 mg, którą można powtarzać co 5 minut do maksymalnej dawki 0,1 mg.
Wprowadzenie do znieczulenia ogólnego (premedykacja)
Domięśniowo lub podskórnie; podawać 30-60 minut przed zabiegiem chirurgicznym. Dzieci o masie ciała do 3 kilogramów: 100 mikrogramów (0,1 mg).
Dzieci o masie ciała od 7 do 9 kilogramów: 200 mikrogramów (0,2 mg).
Dzieci o masie ciała od 12 do 16 kilogramów: 300 mikrogramów (0,3 mg).
Dzieci o masie ciała powyżej 20 kilogramów: dawki jak dla pacjentów dorosłych.
Odwracanie blokady nerwowo-mięśniowej
Dożylnie; noworodki, niemowlęta i dzieci: 20 mikrogramów/kg mc. (0,02 mg/kg mc.). Maksymalna dawka 0,6 mg.
Zatrucie insektycydami fosforoorganicznymi, zatrucie lekami cholinomimetycznymi, zatrucie grzybami zawierającymi muskarynę
Domięśniowo lub dożylnie: 50 mikrogramów/kg mc. (0,05 mg/kg mc.) co 10-30 minut; podawać do momentu zaniku objawów zatrucia.
Sposób podawania
Podanie podskórne, domięśniowe lub dożylne.
Zamieszczone poniżej przeciwwskazania nie odnoszą się do stosowania atropiny w stanach zagrożenia życia (np. zatrzymaniu akcji serca).
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Niedrożność szyi pęcherza moczowego, np. wynikająca z rozrostu gruczołu krokowego Refluksowe zapalenie przełyku.
Myasthenia gravis (z wyjątkiem sytuacji, gdy atropinę stosuje się w celu leczenia niepożądanych działań wywołanych przez środki cholinomimetyczne).
Niedrożność porażenna jelit.
Ciężkie wrzodziejące zapalenie okrężnicy.
Choroby powodujące niedrożność przewodu pokarmowego. Jaskra z wąskim kątem.
Ostrożnego stosowania i szczególnej obserwacji wymaga stosowanie atropiny u dzieci i osób starszych z uwagi na większą wrażliwość na lek.
Ostrożnie podawać pacjentom w wieku powyżej 40 lat ze względu na ryzyko rozrostu gruczołu krokowego i wystąpienia zaburzeń drożności dróg moczowych.
Podanie atropiny może spowodować ostry napad jaskry u osób podatnych, przyspieszyć wystąpienie całkowitej niedrożności w przypadku zwężenia odźwiernika i zatrzymania moczu u pacjentów
z przerostem gruczołu krokowego.
W przebiegu chorób układu oddechowego zablokowanie wydzielania gruczołowego, będące skutkiem działania atropiny, może na skutek zagęszczenia wydzieliny pogorszyć wentylację i nasilić duszność. Należy zachować ostrożność podczas stosowania atropiny u tych pacjentów.
Atropinę należy stosować z zachowaniem ostrożności u pacjentów z podwyższoną temperaturą ciała (może dojść do podwyższenia temperatury ciała), z nadczynnością tarczycy, chorobami wątroby lub nerek, z nadciśnieniem tętniczym. Podczas stosowania atropiny, pacjent nie powinien przebywać
w pomieszczeniach, gdzie panują wysokie temperatury.
Cholinolityki poprzez swoje działanie znoszące wpływ nerwu błędnego na serce wywierają hamujący wpływ na węzeł zatokowo-przedsionkowy i dlatego te leki należy ostrożnie stosować u pacjentów
z tachyarytmią, zastoinową niewydolnością serca, dławicą piersiową.
Podczas stosowania leków cholinolitycznych u pacjentów z neuropatią autonomicznego układu nerwowego należy zachować szczególną ostrożność.
Leki cholinolityczne zmniejszają motorykę układu pokarmowego, działają rozkurczająco na
mięśniówkę gładką przewodu pokarmowego i mogą opóźnić opróżnianie zawartości żołądka. Leki te należy stosować z zachowaniem ostrożności u osób z chorobą wrzodową żołądka, refluksem
przełykowym lub przepukliną rozworu przełykowego, związanego z zapaleniem przełyku, biegunką lub zakażeniem przewodu pokarmowego.
Zdarzały się przypadki ciężkiej bradykardii wywołanej hiperkaliemią, która nie ustępowała po podaniu atropiny.
Wystąpienie paradoksalnego bloku przedsionkowo-komorowego lub zahamowania zatokowego odnotowano po podaniu atropiny u kilku pacjentów po przeszczepie serca.
Atropinę należy stosować ze szczególną ostrożnością w procedurach terapeutycznych lub diagnostycznych u pacjentów po przeszczepie serca. Podczas stosowania zaleca się monitorowanie EKG, należy również zapewnić dostępność sprzętu używanego podczas resuscytacji.
Dawki atropiny nie większe niż 1 mg w niewielkim stopniu pobudzają ośrodkowy układ nerwowy. Wyższe dawki mogą powodować zaburzenia psychiczne i zahamowanie czynności ośrodkowego układu nerwowego. Szczególnie wrażliwe są dzieci i osoby w podeszłym wieku.
Leki wykazujące działanie cholinolityczne podawane z atropiną nasilają jej efekty, np. trójpierścieniowe leki przeciwdepresyjne, leki przeciwskurczowe, leki stosowane w chorobie
Parkinsona, niektóre leki przeciwhistaminowe, pochodne fenotiazyny, dizopiramid, chinidyna.
Atropina poprzez opóźnianie opróżniania żołądka może powodować zwolnienie lub przyspieszenie wchłaniania niektórych leków przyjętych doustnie.
Podczas znieczulenia z użyciem propofolu i równoczesnego stosowania atropiny, częstość akcji serca odpowiadająca na dożylne podanie atropiny może być zmniejszona (i nie można temu skutecznie przeciwdziałać podając dużą dawkę atropiny); może to być spowodowane hamującym działaniem propofolu na współczulny układ nerwowy.
Należy zachować szczególną ostrożność podczas wykonywania echokardiografii obciążeniowej z użyciem dobutaminy i atropiny lub podczas równoczesnego podawania amin katecholowych
z atropiną u pacjentów, którzy wydają się być pod wpływem silnego stresu lub występuje u nich stan hiperadrenergiczny (ryzyko wystąpienia zespołu Tako-tsubo).
Ciąża
Atropina przenika przez łożysko. Nie przeprowadzono badań u ludzi, natomiast badań przeprowadzonych na zwierzętach jest niewiele.
Podanie dożylne atropiny kobiecie w ciąży oraz w czasie porodu może spowodować tachykardię u płodu.
Lek może być stosowany u kobiet w ciąży jedynie w przypadkach, gdy w opinii lekarza korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu.
Karmienie piersią
Niewielkie ilości atropiny przenikają do mleka kobiecego i mogą wywołać działanie przeciwmuskarynowe u dziecka. Może dojść do zahamowania laktacji.
Produkt wywiera znaczny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Działania niepożądane zależą od wielkości zastosowanej dawki i zazwyczaj przemijają po zaprzestaniu podawania produktu.
Po zastosowaniu względnie niedużych dawek atropiny mogą wystąpić następujące działania niepożądane:
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Objawy
Suchość w jamie ustnej z towarzyszącym uczuciem pieczenia, trudności w przełykaniu, światłowstręt, zaczerwienienie i suchość skóry, podwyższenie temperatury ciała, wysypka, nudności i wymioty,
tachykardia oraz podwyższenie ciśnienia tętniczego.
Wskutek pobudzenia ośrodkowego układu nerwowego mogą wystąpić: nerwowość, drżenia,
zmieszanie, pobudzenie, omamy, delirium. Objawy te mogą przekształcić się w senność, stupor, niewydolność układu oddechowego i krążenia niekiedy prowadzącą do zgonu.
Leczenie
W ciężkich przypadkach należy podać dożylnie, domięśniowo lub podskórnie od 1 mg do 4 mg fizostygminy. W razie konieczności dawkę fizostygminy można powtórzyć, ponieważ jest ona szybko eliminowana z organizmu.
W celu uzyskania sedacji u majaczących pacjentów może być podany diazepam, jednak z uwagi na ryzyko wystąpienia zahamowania ośrodkowego występującego po zatruciu atropiną, stosowanie dużych dawek leku uspokajającego jest przeciwwskazane.
Należy utrzymywać prawidłową wentylację dróg oddechowych, a w przypadku wystąpienia niewydolności oddechowej należy zastosować inhalacje z tlenem i dwutlenkiem węgla.
Gorączkę należy zmniejszać za pomocą okładów z lodu lub chłodnej wody.
Należy podać pacjentowi odpowiednią ilość płynów. Może być konieczne cewnikowanie pacjenta. W przypadku wystąpienia światłowstrętu, pacjent powinien być przeniesiony do zaciemnionego pokoju.
Grupa farmakoterapeutyczna: spazmolityki, środki antycholinergiczne lub pobudzające perystaltykę; alkaloidy Atropa belladonna, aminy trzeciorzędowe,
kod ATC: A03BA01
Atropina jest konkurencyjnym antagonistą receptorów muskarynowych w obrębie układu przywspółczulnego. Działa na receptory występujące w gruczołach zewnątrzwydzielniczych, mięśniach gładkich, mięśniu sercowym i ośrodkowym układzie nerwowym.
Skutki obwodowe działania atropiny obejmują: tachykardię, zmniejszenie wytwarzania śliny, potu, zmniejszenie wydzielania oskrzelowego, wydzieliny nosa, płynu łzowego i żołądkowego, zmniejszenie perystaltyki jelit i zahamowanie oddawania moczu.
Atropina przyspiesza rytm zatokowy oraz zwiększa szybkość przewodnictwa między przedsionkami i komorami mięśnia sercowego. Zwykle czynność serca ulega przyspieszeniu, ale początkowo może wystąpić bradykardia.
Atropina hamuje wydzielanie oskrzelowe poprzez działanie na układ oddechowy, polegające na zwiotczeniu mięśni gładkich oskrzeli i wywołaniu rozszerzenia oskrzeli.
Po podaniu dożylnym atropiny, jej wpływ na częstość pracy serca występuje po 2 do 4 minutach. Maksymalne stężenie w osoczu po podaniu domięśniowym pojawia się w ciągu 30 minut, jednak wpływ na czynność serca, wydzielanie potu i wydzielanie śliny występuje po około 60 minutach.
W przypadku podania atropiny domięśniowo i dożylnie stężenie w osoczu jest porównywalne po upływie 60 minut. Atropina ulega dystrybucji do tkanek organizmu i przenika przez barierę
krew/mózg.
Okres półtrwania w fazie eliminacji wynosi 2 do 5 godzin. 50% dawki ulega wiązaniu z białkami.
Atropina ulega metabolizmowi w wątrobie na drodze utleniania i sprzęgania do nieaktywnych metabolitów.
Jest wydalana z moczem - około 50% dawki w ciągu 4 godzin, 90% w ciągu doby, około 30% do 50% dawki wydalane jest w postaci niezmienionej.
Atropina jest lekiem stosowanym w medycynie od wielu lat i jej wpływ na organizm ludzki jest dobrze znany.
Kwas solny rozcieńczony (do ustalenia pH) Woda do wstrzykiwań
Nie są znane.
3 lata
Przechowywać w temperaturze poniżej 25C.
Przechowywać ampułki w opakowaniu zewnętrznym w celu ochrony przed światłem, nie zamrażać.
Ampułki ze szkła bezbarwnego o pojemności 1 ml po 10 sztuk, w tekturowym pudełku.
Produkt można podawać podskórnie, domięśniowo lub dożylnie.
Instrukcja otwierania ampułki
Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu.
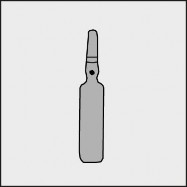
Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia.
Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
Rysunek 1.
Rysunek 2.
Rysunek 3.
Warszawskie Zakłady Farmaceutyczne Polfa S.A. ul. Karolkowa 22/24; 01-207 Warszawa
Atropinum sulfuricum WZF, 0,5 mg/ml
Pozwolenie nr 8600
Atropinum sulfuricum WZF, 1 mg/ml Pozwolenie nr 8601
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 29.01.2001 r. (wcześniej wytwarzany według FP)
Data ostatniego przedłużenia pozwolenia: 23.01.2013 r.











