Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Wersja 10, 02/2016
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Oczyszczanie jelita grubego przed badaniami diagnostycznymi jelita grubego oraz przed zabiegami chirurgicznymi i porodem
Zaparcia występujące sporadycznie, np. po operacjach oraz zaparcia po
zastosowaniu środków kontrastowych
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą, wymienioną w punkcie 6.1
Perforacja jelita grubego
Niedrożność jelit, zarośnięcie odbytu, wrzodziejące zapalenie jelita grubego
Ciężki stan ogólny, choroby serca, zastoinowa niewydolność krążenia
Podejrzenie perforacji, niedrożności lub wrzodziejącego zapalenia jelita
Ciężka niewydolność nerek
Nadciśnienie
Zapalenie wyrostka robaczkowego
Bóle brzucha, nudności, wymioty o nieustalonej przyczynie
Wiek poniżej trzech lat
Odwodnienie
Ciąża
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
RECTANAL, (14 g+5 g)/100 ml , roztwór doodbytniczy
100 ml roztworu doodbytniczego zawiera w przeliczeniu na substancje bezwodne: sodu diwodorofosforan jednowodny (Natrii dihydrophosphas monohydricus) 14 g; disodu fosforan dwunastowodny (Dinatrii phosphas dodecahydricus) 5 g.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór doodbytniczy
Bezbarwny, przezroczysty roztwór
Rectanal jest wskazany do stosowania u dorosłych oraz dzieci i młodzieży w wieku od 3 lat.
Dawkowanie
Dorośli
Produkt leczniczy podaje się doodbytniczo, wyciskając z butelki ok. 120 do 150 ml roztworu, wieczorem w dniu poprzedzającym wykonanie badania lub zabiegu operacyjnego oraz w dniu operacji. Wlew doodbytniczy w dniu poprzedzającym operację można powtórzyć w przypadku nie uzyskania pełnego oczyszczenia. Nie stosować częściej niż jeden raz na dobę.
Roztwór wprowadzany do odbytnicy powinien mieć temperaturę pokojową.
Po zastosowaniu produktu leczniczego należy podać pacjentowi doustnie dodatkową porcję płynów. Środków przeczyszczających nie należy stosować dłużej niż jeden tydzień.
Przed zabiegiem operacyjnym zaleca się wykonanie badania stężenia elektrolitów we krwi.
Dzieci i młodzież
Dzieciom w wieku od 3 do 12 lat produkt leczniczy podaje się doodbytniczo, wyciskając z pojemnika 60 do 90 ml roztworu, wieczorem w dniu poprzedzającym wykonanie badania lub zabiegu operacyjnego oraz w dniu operacji. Wlew doodbytniczy w dniu poprzedzającym operację
można powtórzyć w przypadku nie uzyskania pełnego oczyszczenia. Nie stosować częściej niż jeden raz na dobę.
U dzieci produkt należy stosować szczególnie ostrożnie, a u dzieci w wieku od 3 do 5 lat wyłącznie z przepisu lekarza i pod jego nadzorem.
Roztwór wprowadzany do odbytnicy powinien mieć temperaturę pokojową.
Po zastosowaniu produktu leczniczego należy podać pacjentowi doustnie dodatkową porcję płynów. Środków przeczyszczających nie należy stosować dłużej niż jeden tydzień.
Przed zabiegiem operacyjnym poleca się wykonanie badania stężenia elektrolitów we krwi.
Produktu leczniczego Rectanal nie należy stosować u dzieci w wieku do 3 lat, ze względu na bezpieczeństwo stosowania.
Sposób podawania
Środki ostrożności, które należy podjąć przed użyciem lub podaniem produktu leczniczego
Instrukcja dotycząca przygotowania produktu leczniczego przed podaniem, patrz punkt 6.6.
Po założeniu aplikatora na butelkę według instrukcji w p. 6.6 końcówkę
aplikatora należy natłuścić wazeliną lub płynną parafiną w celu łatwiejszego wprowadzenia do odbytnicy
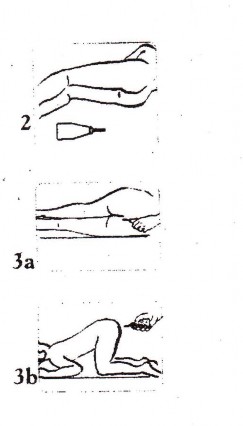
Jeśli pacjent podaje sam sobie produkt leczniczy, powinien ułożyć się na boku (najlepiej lewym) i zgiąć obie nogi w stawach biodrowych i kolanach (rys. 2 i 3a).
Jeśli ktoś podaje produkt leczniczy, pacjent powinien przyjąć pozycję podpartą na łokciach i kolanach (rys 3b).
Końcówkę aplikatora należy ostrożnie wprowadzić do odbytnicy. Następnie powoli ściskając butelkę, wprowadzić jej zawartość do odbytnicy. Pacjent powinien starać się zaciskać zwieracz odbytu. Butelka zawiera nadmiar roztworu, dlatego nie trzeba jej całkowicie opróżniać,
Po wprowadzeniu roztworu do jelita pacjent powinien pozostawać 2-5 minut w jednej z opisanych pozycji, aż do wystąpienia uczucia parcia, a następnie wypróżnić się. Najskuteczniejsze jest
ułożenie z miednicą powyżej poziomu głowy. Można to uzyskać podkładając wałek z koca lub poduszki pod miednicę.
W przypadku zwężenia odbytu, bądź ubytków śluzówki odbytu, zabieg można wykonać przedłużając
sztywną końcówkę butelki miękkim cewnikiem, np. cewnikiem Foleya. Podobną technikę należy stosować podczas wlewki przez sztuczny odbyt. W takim przypadku najlepszą pozycją jest ułożenie na wznak.
Uwaga!
Nigdy nie należy używać siły podczas wprowadzania końcówki aplikatora do naturalnego lub sztucznego odbytu, gdyż grozi to uszkodzeniem ściany jelita, z ciężkimi konsekwencjami (krwawienie lub perforacja).
Nie należy również wykonywać wlewek w pozycji stojącej. Jest to niewygodne i mało skuteczne.
Pacjentom nieprzytomnym, o ograniczonej świadomości oraz z chorobami serca produkt leczniczy można podawać tylko w obecności wykwalifikowanego personelu medycznego.
Specjalne środki ostrożności należy zachować stosując produkt leczniczy u pacjentów z
zaburzeniami czynności nerek oraz u pacjentów otrzymujących leki moczopędne lub leki mogące
wywołać zaburzenia wodno-elektrolitowe. U pacjentów ze sztucznym odbytem oraz u pacjentów, u których występują pierwotne lub wtórne zaburzenia elektrolitowe, produkt leczniczy należy stosować z dużą ostrożnością; zaleca się kontrolowanie stężenia elektrolitów. Jeśli podczas lub po zastosowaniu płynu doodbytniczego pojawią się krwawienia lub nasilone skurcze jelit, zabieg należy przerwać i zgłosić się do lekarza. W zaparciach stosować sporadycznie, zachować szczególną ostrożność u osób w podeszłym wieku oraz nie stosować częściej niż raz na dobę.
Dzieci i młodzież
Jeśli u dziecka nie nastąpi wypróżnienie, należy porozumieć się z lekarzem, ponieważ zatrzymanie płynu doodbytniczego może spowodować odwodnienie.
U pacjentów stosujących leki blokujące kanały wapniowe lub leki moczopędne mogą wystąpić zmiany stężenia elektrolitów.
Ciąża
Rectanal jest przeciwwskazany do stosowania w okresie ciąży, ze względu na ryzyko wystąpienia zaburzeń elektrolitowych (patrz punkt 4.3).
Karmienie piersią Brak wpływu Płodność
Brak wpływu
Rectanal wywiera znaczny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Ze względu na działanie produktu leczniczego, przez co najmniej 12 godzin po jego zastosowaniu nie należy prowadzić pojazdów.
Częstość występowania działań nieporządanych określono następująco:
rzadko (1/10 000 do <1/1 000). Rzadko:
zaburzenia metabolizmu i odżywiania: przemijająca hipokalcemia i hiponatremia, prowadzące do odwodnienia
Rzadko:
zaburzenia żołądka i jelit: zaburzenia czynności jelita grubego (w przypadku częstego stosowania) Dzieci i młodzież
W grupie wiekowej zgodnej ze wskazaniami (p.4.1) istnieje podobne jak u dorosłych ryzyko wystąpienia działań niepożądanych.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie zgłoszono żadnego przypadku przedawkowania.
Produkt zawarty jest w jednorazowym opakowaniu, co praktycznie uniemożliwia przedawkowanie u dorosłych. Jednak u pacjentów, u których występują bezwzględne przeciwwskazania oraz u pacjentów szczególnie wrażliwych może dojść do zaburzeń stężenia elektrolitów, zakwaszenia oraz odwodnienia (patrz punkt 4.4). W takim przypadku należy doprowadzić do normalizacji stężenia elektrolitów.
Grupa farmakoterapeutyczna: środki przeczyszczające; wlewki doodbytnicze; kod ATC: brak kodu ATC
Mechanizm działania
Produkt o działaniu oczyszczającym jelito grube jest hipertonicznym roztworem fosforanów sodu podawanym drogą doodbytniczą. Poprzez działanie osmotyczne w świetle jelita grubego zapobiega wchłanianiu wody powodując zmiękczenie mas kałowych.
Rezultat działania farmakodynamicznego
Zwiększenie objętości i zmiękczenie mas kałowych natychmiastowo pobudza odruch defekacji.
Wchłanianie
Jony fosforanowe wchłaniane są do krwi w niewielkim stopniu. Dystrybucja
Jony fosforanowe przedostają się do przestrzeni pozanaczyniowej i śródkomórkowej. Eliminacja
Jony fosforanowe są wydalane w moczu.
Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa nie ujawniają
żadnego szczególnego zagrożenia dla człowieka. Brak istotnych danych dla przepisującego produkt leczniczy.
Sodu benzoesan (E 211)
Sodu propionian (E 281) Woda oczyszczona
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności.
3 lata
Brak specjalnych zaleceń dotyczących przechowywania
Butelki polietylenowe (PE) z nakrętką i aplikatorem zamkniętym w woreczku w tekturowym pudełku:
1 butelka po 150 ml (OTC)
20 butelek po 150 ml Opakowanie przeznaczone do stosowania w lecznictwie zamkniętym 50 butelek po 150 ml Opakowanie przeznaczone do stosowania w lecznictwie zamkniętym Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Abu przygotować produkt leczniczy do stosowania należy wyjąć z woreczka aplikator. Sparwdzić, czy krawędzie zaworka gumowego nie są zawiniete a sam zaworek rozłożony jest prawidłowo na całej powierchni aplikatora. W razie potrzeby poprawić położenie zaworka aby przylegał on szczelnie do powierzchni aplikatora. Odkręcić nakrętkę na szyjce butelki i nakręcić aplikator na gwint szyjki butelki do lekkiego oporu a nastepnie przystąpić do czynności opisanych w p. 4.2
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Farmaceutyczno-Chemiczna Spółdzielnia Pracy „GALENUS", ul. Hutnicza 8, 03-791 Warszawa Tel.: 022 6782601, 022 6782519
Faks: 022 6782601
Pozwolenie nr 9550
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 29 sierpnia 2002 r. Data ostatniego przedłużenia pozwolenia: 13 czerwca 2012 r.
26,02,2019











