Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
leczenie raka in situ
leczenie profilaktyczne w celu zapobiegania nawrotom:
raka nabłonkowego ograniczonego tylko do błony śluzowej
Ta G1-G2 jeśli to jest guz wieloogniskowy i (lub) nawracający
raka nabłonkowego umiejscowionego w błonie właściwej, ale nie mięśniowej pęcherza moczowego (T1)
raka in situ.
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
BCG-medac, proszek i rozpuszczalnik do sporządzania zawiesiny do podawania do pęcherza moczowego
1 fiolka po rekonstytucji zawiera
nie mniej niż 2 x 108 i nie więcej niż 3 x 109 żywych cząstek BCG (Bacillus Calmette-Guérin), szczep
RIVM wyprowadzony ze szczepu 1173-P2.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek i rozpuszczalnik do sporządzania zawiesiny do podawania do pęcherza moczowego Biały proszek i bezbarwny, klarowny roztwór
Leczenie nieinwazyjnego raka nabłonkowego pęcherza moczowego:
Zawartość jednej fiolki stanowi pojedynczą dawkę do podania do pęcherza moczowego. Czas trwania leczenia
Rak in situ
Standardowy schemat leczenia składa się z pojedynczej dawki produktu raz w tygodniu przez sześć kolejnych tygodni, jako leczenie wprowadzające. Leczenia bakteriami BCG nie można rozpocząć przed upływem 2 – 3 tygodni od resekcji przezcewkowej (TUR, ang. transurethral resection).
Po 4 tygodniach przerwy należy kontynuować leczenie podtrzymujące opisane poniżej, przez co
najmniej rok. Schematy leczenia podtrzymującego zostały opisane poniżej.
Leczenie wprowadzające (leczenie profilaktyczne w celu zapobiegania nawrotom)
Leczenie bakteriami BCG należy rozpocząć po około 2 – 3 tygodniach po resekcji przezcewkowej lub po biopsji pęcherza moczowego i po bezurazowym cewnikowaniu i powtarzać co tydzień przez
6 tygodni. W przypadku guzów o umiarkowanym i wysokim ryzyku należy zastosować leczenie podtrzymujące.
Schemat pojedynczego cyklu leczenia to 12 miesięczna terapia, w tym w czasie produkt jest podawany raz w miesiącu. Inny schemat leczenia podtrzymującego to 3 podania z tygodniową przerwą w 3, 6, 12, 18, 24, 30 i 36 miesiącu od rozpoczęcia leczenia przez minimum 1 rok do 3 lat. Podczas stosowania tego schematu leczenia podaje się do 27 dawek tego produktu w okresie trzech lat.
Metody leczenia według różnych schematów, z zastosowaniem różnych szczepów BCG, były oceniane w badaniach klinicznych obejmujących dużą grupę pacjentów. W chwili obecnej nie można jednoznacznie stwierdzić, który z opisanych schematów jest najkorzystniejszy.
Chociaż leczenie podtrzymujące zmniejsza prawdopodobieństwo nawrotu choroby i może zmniejszyć progresję, to u niektórych pacjentów działania niepożądane oraz dyskomfort związany z leczeniem mogą przeważyć korzyści wynikające z leczenia. Dlatego przed rozpoczęciem lub kontynuacją leczenia podtrzymującego należy przeprowadzić ocenę stosunku korzyści do ryzyka oraz uwzględnić preferencje pacjenta.
Sposób podawania
Produkt leczniczy BCG-medac należy podawać w warunkach wymaganych podczas przeprowadzenia wziernikowania pęcherza moczowego.
Pacjent nie powinien przyjmować płynów cztery godziny przed i dwie godziny po podaniu produktu. Pęcherz moczowy musi być opróżniony przed podaniem bakterii BCG. BCG-medac wprowadza się do pęcherza za pomocą cewnika przez cewkę moczową pod małym ciśnieniem. Jeżeli jest to możliwe, podaną do pęcherza moczowego zawiesinę BCG-medac należy pozostawić w pęcherzu na 2 godziny. W tym czasie, zawiesina powinna mieć dostateczny kontakt z całą powierzchnią błony śluzowej pęcherza. Dlatego też pacjenci powinni wstać po zabiegu tak szybko jak to możliwe. Po 2 godzinach pacjent powinien opróżnić pęcherz (zaleca się oddanie moczu w pozycji siedzącej).
Jeżeli nie ma przeciwwskazań, zaleca się intensywne nawadnianie pacjentów przez 48 godzin po podaniu każdej dawki.
Instrukcja dotycząca rekonstytucji produktu leczniczego przed podaniem, patrz punkt 6.6.
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego BCG-medac u dzieci. Dane nie są dostępne. W związku z tym tego produktu leczniczego nie należy stosować u dzieci.
Nie ma specjalnych zaleceń lub przeciwwskazań dotyczących stosowania produktu u pacjentów w podeszłym wieku.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w
punkcie 6.1.
Produktu BCG-medac nie należy stosować u pacjentów z zaburzoną czynnością układu immunologicznego, z wrodzonym lub nabytym niedoborem odporności, spowodowanym współistniejącymi chorobami (np. u pacjentów z dodatnim wynikiem testu na obecność wirusa HIV,
białaczką, chłoniakiem), leczonych przeciwnowotworowo (np. produktami leczniczymi o działaniu cytostatycznym, radioterapią) lub leczonych lekami immunosupresyjnymi (np. kortykosteroidami).
Produktu BCG-medac nie należy stosować u pacjentów z czynną gruźlicą w wywiadzie. Należy wykluczyć ryzyko istnienia czynnej gruźlicy u pacjenta, poprzez przeprowadzenie odpowiedniego wywiadu. Jeżeli są wskazania zaleca się wykonanie diagnostycznego testu zgodnie z lokalnymi zasadami.
Radioterapia pęcherza moczowego w przeszłości
Stosowanie BCG-medac jest przeciwwskazane u kobiet karmiących piersią (patrz punkt 4.6).
BCG-medac nie można podawać przed upływem 2 - 3 tygodni po resekcji przezcewkowej, biopsji pęcherza moczowego lub po urazie podczas cewnikowania.
Perforacja pęcherza moczowego (patrzy punkt 4.4) Ostra infekcja układu moczowego (patrzy punkt 4.4)
Produktu leczniczego BCG-medac nie stosować w żadnym wypadku podskórnie, śródskórnie, domięśniowo, dożylnie lub jako szczepionki przeciw gruźlicy.
Leczenie objawów, oznak lub zespołów objawowych
Patrz punkt 4.8.
Liczba podanych dawek BCG
Działania niepożądane po podaniu produktu leczniczego zawierajacego bakterie BCG występują często, lecz zazwyczaj są łagodne i przemijające. Liczba działań niepożądanych zazwyczaj rośnie wraz ze wzrostem liczby podanych dawek bakterii BCG.
Ciężkie ogólnoustrojowe zakażenia lub reakcje związane z podaniem bakterii BCG
Zakażenia lub reakcje związane z podaniem bakterii BCG zdarzają się rzadko i opisywane są jako wzrost temperatury ciała powyżej 39,5°C przez co najmniej 12 godzin, powyżej 38,5°C przez co najmniej 48 godzin, prosówkowe zapalenie płuc, ziarniniakowe zapalenie wątroby, zmiany w wynikach badań oceniających czynność wątroby, zaburzenia funkcji narządów (innych niż układ moczowo-płciowy) z zapaleniem ziarniniakowym stwierdzonym w materiale biopsyjnym, zespół Reitera.
Przed rozpoczęciem terapii należy wziąć pod uwagę możliwość wystąpienia ciężkich infekcji ogólnoustrojowych.
W przypadku urazu podczas podawania bakterii BCG może wystąpić posocznica z możliwym wstrząsem septycznym oraz śmierć.
Przed każdym podaniem produktu BCG-medac należy wykluczyć zakażenia układu moczowego, ponieważ zapalenie błony pęcherza moczowego może zwiększać ryzyko rozprzestrzeniania się bakterii BCG poprzez krew. Jeśli zakażenie zostanie stwierdzone podczas trwania kuracji, należy przerwać leczenie do czasu normalizacji wyników badania moczu oraz ukończenia leczenia antybiotykami.
U pacjentów z np. tętniakiem lub z protezami zgłaszano występowanie zakażeń wszczepów i
przeszczepów. Przeżywalność bakterii BCG
W pojedynczych przypadkach zgłaszano, że bakterie BCG mogą przeżywać w układzie moczowym dłużej niż 16 miesięcy.
Gorączka lub krwiomocz o dużym nasileniu
Leczenie należy przerwać do czasu unormowania się temperatury ciała i wyleczenia krwiomoczu. Mała pojemność pęcherza moczowego
U pacjentów z pęcherzem o małej pojemności występuje zwiększone ryzyko wystąpienia przykurczu pęcherza moczowego.
HLA-B27
U pacjentów z antygenem zgodności tkankowej HLA-B27 mogą nasilić się objawy choroby reumatycznej lub objawy zespołu Reitera.
Ostrzeżenia dotyczące przygotowywania
Produkt nie powinien być przygotowywany do podania przez ten sam personel i w tym samym pomieszczeniu, w którym przygotowywane są inne dożylne produkty lecznicze o działaniu cytotoksycznym. BCG-medac nie powinien być przygotowywany przez osobę z obniżonym poziomem odporności. Należy unikać kontaktu produktu BCG-medac ze skórą lub błonami śluzowymi. Kontakt może prowadzić do reakcji nadwrażliwości lub zakażenia zanieczyszczonego miejsca.
Pacjenci z obniżoną odpornością
Pacjenci z obniżoną odpornością nie powinni kontaktować się z pacjentami leczonymi produktem
BCG-medac, chociaż nie zanotowano jeszcze przypadku transmisji bakterii pomiędzy ludźmi. Próba tuberkulinowa
Podanie BCG-medac do pęcherza moczowego może wywoływać wrażliwość na tuberkulinę, co może skomplikować interpretację skórnych prób tuberkulinowych, stosowanych w celu diagnozowania zakażenia prątkami z rodzaju Mycobacterium. W związku z tym analiza reaktywności na tuberkulinę może być wykonana przed podaniem produktu BCG-medac.
Ciąża
Nie zaleca się stosowania produktu BCG-medac u kobiet w ciąży (patrz punkt 4.6). Przenoszenie drogą płciową
Zaleca się stosowanie prezerwatyw podczas stosunków płciowych przez tydzień od podania bakterii BCG, jakkolwiek nie ma doniesień o przenoszeniu bakterii BCG drogą płciową.
Ogólne warunki w zakresie higieny
Po oddaniu moczu zaleca się umycie rąk oraz okolic genitaliów. Ma to szczególne znaczenie po pierwszym oddaniu moczu, po podaniu bakterii BCG. Jeżeli dojdzie do zanieczyszczenia zmian skórnych, zaleca się stosowanie odpowiedniego środka dezynfekującego.
Rozlanie produktu BCG-medac
W przypadku rozlania zawiesiny, zanieczyszczone miejsce należy zmyć środkiem dezynfekcyjnym o potwierdzonym działaniu przeciwko mykobakteriom. Skażoną skórę należy zdezynfekować odpowiednim środkiem odkażającym.
Bakterie BCG są wrażliwe na działanie przeciwgruźliczych produktów leczniczych (np. etambutol, streptomycyna, kwas p-aminosalicylowy [PAS], izoniazyd [INH] i rifampicyna), antybiotyków i środków odkażających drogi moczowe. Opisywano występowanie oporności na pyrazinamid i cykloserynę.
Należy unikać równoczesnego podawania produktów leczniczych przeciwgruźliczych i antybiotyków, takich jak fluorochinolony, doksacyklina lub gentamycyna w trakcie leczenia bakteriami BCG z powodu wrażliwości prątków na te produkty lecznicze.
Ciąża
Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania bakterii BCG u kobiet w okresie ciąży. Nie przeprowadzono badań dotyczących szkodliwego wpływu na reprodukcję u zwierząt. Produkt BCG-medac nie jest zalecany do stosowania w okresie ciąży.
Karmienie piersią
Brak wystarczających danych dotyczących przenikania bakterii BCG/metabolitów do mleka ludzkiego. Produkt BCG-medac jest przeciwwskazany w okresie karmienia piersią (patrz punkt 4.3).
Płodność
Dopęcherzowe leczenie bakteriami BCG wpływa negatywnie na spermatogenezę i może powodować oligospermię lub azoospermię. Badania na zwierzętach wskazują, że objawy te mogą mieć charakter przejściowy i odwracalny. Jednakże, przed rozpoczęciem leczenia, mężczyzna powinien uzyskać informację na temat możliwości przechowywania nasienia.
Miejscowe i ogólne działania niepożądane, występujące podczas leczenia produktem BCG-medac, mogą mieć wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Zakażenia i zarażenia pasożytnicze | Bardzo często ( 1/10): Zapalenie pęcherza moczowego i reakcje zapalne (ziarniniak) Niezbyt często ( 1/1 000 do < 1/100): Zakażenia w obrębie pęcherza moczowego, zapalenie jąder, ciężkie reakcje ogólnoustrojowe lub zakażenia bakteriami BCG, posocznica BCG, prosówkowe zapalenie płuc, ropień skórny, zespół Reitera (zapalenie spojówek, asymetryczne zapalenie kilku stawów oraz zapalenie pęcherza moczowego) Rzadko ( 1/10 000 do < 1/1 000): |
Układy i narządy | Częstość występowania objawów niepożądanych |
Zakażenia naczyniowe (np. zakażenie w obrębie tętniaka), ropień w obrębie nerki Zakażenia bakteriamii BCG implantów oraz tkanki otaczającej (np. zakażenie wszczepu aorty, rozrusznika pracy serca, plastyka biodra lub kolana), zapalenie szyjnych węzłów chłonnych, lokalne zapalenia węzłów chłonnych, zapalenie kości i szpiku, zakażenie szpiku kostnego, ropień w obrębie mięśnia lędźwiowo-udowego, zakażenia w obrębie żołędzia prącia, oporne na leczenie przeciwgruźlicze zapalenie jąder lub najądrza | |
Zaburzenia krwi i układu chłonnego | Niezbyt często ( 1/1 000 do < 1/100): Cytopenia, niedokrwistość Nieznana (częstość nie może być określona na podstawie dostępnych danych): |
Zaburzenia układu immunologicznego | Bardzo często ( 1/10): Przejściowa reakcja na bakterie BCG (gorączka < 38,5°C, objawy grypopodobne (złe samopoczucie, gorączka, dreszcze, ogólne poczucie dyskomfortu) |
Zaburzenia oka | Zapalenie naczyniówki i siatkówki, zapalenie spojówek, zapalenie błony naczyniowej oka |
Bardzo rzadko (< 1/10 000): Przetoka naczyniowa | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Niezbyt często ( 1/1 000 do < 1/100): Ziarniniak płuc |
Zaburzenia żołądka i jelit | Bardzo często ( 1/10): Nudności |
Niezbyt często ( 1/1 000 do < 1/100): Zapalenie wątroby | |
Zaburzenia skóry i tkanki podskórnej | Niezbyt często ( 1/1 000 do < 1/100): Wysypka skórna |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | Niezbyt często ( 1/1 000 do < 1/100): Zapalenie stawów, ból stawów |
Zaburzenia nerek i dróg moczowych | Bardzo często ( 1/10): Częste oddawanie moczu z uczuciem dyskomfortu i bólu Często ( 1/100 do < 1/10): Nietrzymanie moczu Niezbyt często ( 1/1 000 do < 1/100): Widoczny krwiomocz, zatrzymanie moczu w pęcherzu moczowym, niedrożność układu moczowego, kurcz pęcherza moczowego Nieznana (częstość nie może być określona na podstawie dostępnych danych): Niewydolność nerek, odmiedniczkowe zapalenie nerek, zapalenie nerek (w tym cewkowo-śródmiąższowe zapalenie nerek, śródmiąższowe zapalenie nerek oraz kłębuszkowe zapalenie nerek) |
Częstość występowania objawów niepożądanych | |
Zaburzenia układu rozrodczego i piersi | Bardzo często ( 1/10): Bezobjawowe, ziarniakowe zapalenie gruczołu krokowego Niezbyt często ( 1/1 000 do < 1/100): Zapalenie najądrza, objawowe, ziarniakowe zapalenie gruczołu krokowego Nieznana (częstość nie może być określona na podstawie dostępnych danych): Zaburzenia układu rozrodczego (np. ból w obrębie pochwy, dyspareunia), oligospermia, azoospermia |
Często ( 1/100 do < 1/10): Gorączka > 38,5°C Niezbyt często (1/1 000 do < 1/100): Niedociśnienie Bardzo rzadko (< 1/10 000): Obrzęk obwodowy |
Działania niepożądane w trakcie trwania leczenia bakteriami BCG występują często, ale są na ogół łagodne i mają charakter przemijający. Działania niepożądane ulegają nasileniu proporcjonalnie do liczby dawek.
W rzadkich przypadkach może wystąpić zapalenie stawów, ból stawów oraz wysypka skórna. Przypadki te można przypisać reakcji nadwrażliwości pacjenta na bakterie BCG. W niektórych przypadkach konieczne może być przerwanie podawania produktu BCG-medac.
Miejscowe działania niepożądane
Uczucie dyskomfortu i ból podczas oddawania moczu oraz częste oddawanie moczu występuje u 90% pacjentów. Zapalenie pęcherza i odczyny zapalne (ziarniniak) mogą być podstawowym skutkiem działania przeciwnowotworowego. Inne miejscowe działania niepożądane obserwowane są niezbyt często: widoczny krwiomocz, zakażenie układu moczowego, retrakcja pęcherza moczowego, skurcz pęcherza moczowego, niedrożność układu moczowego, zapalenie jąder i zapalenie najądrzy. W rzadkich przypadkach obserwowano ropnie w obrębie nerek. Ponadto, z nieznaną częstością wystąpić mogą zaburzenia narządów płciowych (np. ból w obrębie pochwy, dyspareunia).
Przemijające, ogólnoustrojowe działania niepożądane bakterii BCG
Niewielkie podwyższenie temperatury ciała, objawy grypopodobne i ogólnie złe samopoczucie. Objawy te zwykle ustępują w ciągu 24 – 48 godzin i należy je leczyć stosując standardowe leczenie objawowe. Reakcje te są także objawami przedmiotowymi rozpoczynającej się reakcji immunologicznej. Wszyscy pacjenci otrzymujący produkt powinni być uważnie monitorowani i pouczeni o zgłaszaniu wszystkich przypadków wystąpienia wysokiej temperatury i innych zdarzeń poza układem moczowym.
Ciężkie ogólnoustrojowe działania niepożądane/zakażenia
Ogólnoustrojowe działania niepożądane/zakażenia definiuje się jako: wzrost temperatury ciała powyżej 39,5°C przez co najmniej 12 godzin, powyżej 38,5°C przez co najmniej 48 godzin, prosówkowe zapalenie płuc wywołane prątkami BCG, ziarniniakowe zapalenie wątroby, zmiany w wynikach badań oceniających czynność wątroby, zaburzenia czynności narządów (innych niż układ moczowo-płciowy) z zapaleniem ziarniniakowym, stwierdzonym w materiale biopsyjnym, zespół Reitera. Ciężkie, ogólnoustrojowe reakcje/zakażenia, związane ze stosowaniem bakterii BCG, mogą prowadzić do rozwoju posocznicy wywołanej przez BCG, która jest stanem zagrożenia życia.
Zalecane leczenie, patrz: tabela poniżej.
Objawy, oznaki i zespoły objawowe | Leczenie |
Objawy podrażnienia pęcherza moczowego trwające krócej niż 48 godzin | Leczenie objawowe |
Objawy podrażnienia pęcherza moczowego trwające 48 godzin lub dłużej | Należy przerwać leczenie produktem BCG-medac i rozpocząć leczenie chinolonami. Jeśli po 10 dniach nie nastąpi całkowite wyleczenie, należy podawać izoniazyd (INH)* przez 3 miesiące. W przypadku leczenia lekami przeciwgruźliczymi, leczenie produktem BCG-medac należy przerwać. |
Równoczesne, bakteryjne zakażenia układu moczowego | Należy przełożyć leczenie produktem BCG-medac do czasu, aż wyniki badania moczu unormują się i leczenie antybiotykami zostanie zakończone. |
Inne objawy niepożądane ze strony układu moczowo-płciowego: objawowe ziarniniakowe zapalenie gruczołu krokowego, zapalenie jąder i najądrzy, niedrożność cewki moczowej, ropnie w obrębie nerek | Przerwać leczenie produktem BCG-medac. Podawać izoniazyd (INH)* i rifampicynę* przez 3 do 6 miesięcy w zależności od wskazań. W przypadku stosowania leków przeciwgruźliczych, leczenie produktem BCG-medac powinno być przerwane. |
Gorączka poniżej 38,5°C trwająca krócej niż 48 godzin | Objawowe leczenie paracetamolem. |
Zmiany skórne, zapalenie stawów, ból stawów, zespół Reitera | Należy przerwać leczenie produktem BCG-medac. Podawać leki przeciwhistaminowe lub niesteroidowe leki przeciwzapalne. Jeśli nie ma skutku należy podawać przez 3 miesiące izoniazyd (INH)*. W przypadku stosowania leków przeciwgruźliczych, leczenie produktem BCG-medac należy przerwać. |
Ogólnoustrojowe reakcje/zakażenia na prątki BCG** bez objawów wstrząsu septycznego | Należy przerwać leczenie produktem BCG-medac. Należy rozważyć konsultację ze specjalistą od chorób zakaźnych. Podawać trzy leki przeciwgruźlicze* przez 6 miesięcy. |
Ogólnoustrojowe reakcje na bakterie BCG/zakażenia z objawami wstrząsu septycznego | Należy przerwać leczenie produktem BCG-medac. Natychmiast podać trzy leki przeciwgruźlicze* w połączeniu z wysokimi dawkami krótko działających kortykosteroidów. Należy uzyskać opinię specjalisty chorób zakaźnych. |
* Uwaga: bakterie BCG są wrażliwe na obecnie stosowane przeciwgruźlicze produkty lecznicze z wyjątkiem pyrazinamidu. Jeśli jest konieczne skojarzone leczenie przeciwgruźlicze, najczęściej zalecanymi lekami są: izoniazyd (INH) rifampicyna i etambutol.
** Definicja – patrz: Ciężkie ogólnoustrojowe działania niepożądane/zakażenia.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, PL-02-222 Warszawa, Tel.: + 48 22 49-21-301, Faks: + 48 22 49-21-
309, Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Istnieje małe prawdopodobieństwo przedawkowania, ponieważ zawartość jednej fiolki BCG-medac odpowiada jednej dawce.
Nie ma danych wskazujących na możliwość wystąpienia innych objawów po przedawkowaniu niż
opisane działania niepożądane.
Grupa farmakoterapeutyczna: leki immunostymulujące, inne leki immunostymulujące, kod ATC: L03AX03
Produkt BCG-medac jest liofilizowaną zawiesiną żywych bakterii Bacillus Calmette-Guérin o małym potencjale zakaźnym, wywodzących się od bakterii Mycobacterium bovis, szczep RIVM.
Produkt BCG-medac pobudza układ immunologiczny i wykazuje aktywność przeciwnowotworową.
Badania wskazują, że bakterie BCG działają jako nieswoisty immunostymulator za pośrednictwem nie tylko jednego mechanizmu, ale przez różnorodne działania obejmujące wpływ na komórki układu immunologicznego. BCG wpływa pobudzająco na śledzionę, nasila aktywność makrofagów w śledzionie i aktywuje naturalne komórki cytotoksyczne. Podanie bakterii BCG zwiększa ilość granulocytów, monocytów i (lub) makrofagów oraz limfocytów T, co wskazuje na miejscową aktywację układu immunologicznego. Zwiększa się wydzielanie cytokin IL1, IL2, IL6 i TNF.
Większość bakterii ulega wydaleniu z moczem w ciągu pierwszych godzin po podaniu. Nie wiadomo czy mykobakterie mogą przenikać przez ścianę dróg moczowych. Istnieją pojedyncze doniesienia, że bakterie BCG przeżywały w układzie moczowym dłużej niż 16 miesięcy (patrz punkt 4.4).
Toksyczność, właściwości immunostymulujące, aktywność przeciwnowotworowa szczepu BCG- RIVM była badana na różnych gatunkach zwierząt. Duże dawki bakterii BCG hamowały przyrost masy u myszy. Obserwowano również zaburzenia czynności wątroby u myszy. Po podaniu dożylnym, u królików obserwowano wzrost temperatury ciała. Dawki wielokrotnie podawane do pęcherza świnkom morskim powodowały stany zapalne ściany pęcherza moczowego. Nieoczekiwanymi działaniami niepożądanymi po podaniu dużych dawek były ziarniniakowe zmiany w wątrobie i płucach. Podanie dopęcherzowe u psów powodowało minimalne uszkodzenia mechaniczne nabłonka bez zmian zapalnych w zrębie nabłonka.
Nie przeprowadzono badań dotyczących działania mutagennego, karcynogennego i wpływu na zdolności rozrodcze.
Proszek: Poligelina, Glukoza bezwodna
Polisorbat 80
Rozpuszczalnik:
Sodu chlorek,
Woda do wstrzykiwań
Nie mieszać produktu leczniczego BCG-medac z roztworami hipo- i hipertonicznymi.
2 lata.
Po rekonstytucji produkt należy natychmiast zużyć.
Przechowywać w lodówce (2°C – 8°C). Nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem. Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt 6.3.
Fiolka z proszkiem (szkło typ I) z gumowym korkiem i system do rekonstytucji i podawania (worek z
PVC z łącznikami do fiolki i do cewnika) z rozpuszczalnikiem po 50 ml, oraz 2 cewniki różnego typu. Opakowanie zawiera: 1, 3 lub 5 zestawów (fiolka + system + 2 cewniki).
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Instrukcje dotyczące stosowania i przygotowania produktu leczniczego do stosowania
Należy zachować ostrożność podczas wprowadzenia cewnika, aby uniknąć uszkodzeń nabłonka, które mogą prowadzić do ogólnoustrojowego zakażenia bakteriami BCG. Należy rozważyć zastosowanie lubrykantu, aby uniknąć urazów podczas zabiegu cewnikowania. W przypadku kobiet można stosować mniejsze ilości lubrykantu niż w przypadku mężczyzn. Opróżnienie pęcherza po zabiegu cewnikowania pozwoli zmniejszyć ilość pozostałego lubrykantu przed podaniem bakterii BCG.
Przed zastosowaniem, produkt należy poddać rekonstytucji w warunkach aseptycznych w jałowym 0,9% roztworze chlorku sodu (patrz niżej). Przed zastosowaniem zmieszać zawiesinę przez delikatne obracanie. Należy unikać kontaktu produktu BCG-medac ze skórą. Zaleca się stosowanie rękawiczek. Widoczne makroskopowo cząstki nie wpływają na skuteczność i bezpieczeństwo produktu.
Należy stosować się do następujących zasad, dotyczących stosowania układu z łącznikiem stożkowym.
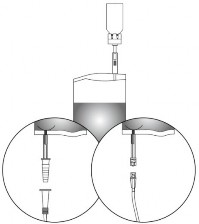
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
DOPUSZCZENIE DO OBROTU
medac
Gesellschaft für klinische Spezialpräparate mbH Theaterstr. 6
22880 Wedel Niemcy
10218
11.03.2004; 08.08.2013











