Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
erytromycyna, umiarkowany inhibitor CYP3A4 i P-gp, nie zmienia farmakokinetyki rysperydonu ani czynnej frakcji przeciwpsychotycznej;
ryfampicyna, silny induktor CYP3A4 i P-gp, zmniejszała stężenie czynnej frakcji przeciwpsychotycznej w osoczu.
Antycholinoesterazy:
donepezil i galantamina, substraty zarówno CYP2D6 i CYP3A4, nie wykazują istotnego klinicznie wpływu na farmakokinetykę rysperydonu ani jego czynnej frakcji przeciwpsychotycznej.
Leki przeciwpadaczkowe:
karbamazepina, silny induktor CYP3A4 i P-gp, zmniejsza stężenie czynnej frakcji
przeciwpsychotycznej rysperydonu w osoczu. Podobne działanie można zaobserwować podczas stosowania leków, takich jak np. fenytoina i fenobarbital, indukujących enzym wątrobowy CYP3A4 jak również P-gp;
topiramat zmniejszał w umiarkowanym stopniu biodostępność rysperydonu, ale nie jego czynnej frakcji przeciwpsychotycznej. Dlatego ta interakcja może nie mieć znaczenia klinicznego.
Leki przeciwgrzybicze:
itrakonazol, silny inhibitor CYP3A4 i P-gp, w dawkach 200 mg/dobę zwiększał stężenie czynnej frakcji przeciwpsychotycznej w osoczu o około 70%, przy dawkach rysperydonu od 2 do 8 mg/dobę;
ketokonazol, silny inhibitor CYP3A4 i P-gp, w dawkach 200 mg/dobę zwiększał stężenie rysperydonu, a zmniejszał stężenie 9-hydroksyrysperydonu w osoczu.
Leki przeciwpsychotyczne:
fenotiazyny, mogą zwiększać stężenie rysperydonu w osoczu ale nie jego czynnej frakcji przeciwpsychotycznej.
Leki przeciwwirusowe:
inhibitory proteazy: nie ma danych z oficjalnych badań; ponieważ jednak rytonawir jest silnym inhibitorem CYP3A4 i słabym inhibitorem CYP2D6, to rytonawir i wzmacniane rytonawirem inhibitory proteazy mogą zwiększać stężenia czynnej frakcji przeciwpsychotycznej rysperydonu.
Leki beta-adrenolityczne:
niektóre leki beta-adrenolityczne mogą powodować zwiększenie stężenia rysperydonu w osoczu, ale nie jego czynnej frakcji przeciwpsychotycznej.
Inhibitory kanałów wapniowych:
werapamil, umiarkowany inhibitor CYP3A4 i inhibitor P-gp, zwiększa stężenia rysperydonu i jego czynnej frakcji przeciwpsychotycznej w osoczu.
Leki żołądkowo-jelitowe:
antagoniści receptora H2: cymetydyna i ranitydyna, słabe inhibitory CYP2D6 i CYP3A4, zwiększały biodostępność rysperydonu, lecz tylko w niewielkim stopniu jego czynnej frakcji przeciwpsychotycznej.
Selektywne inhibitory zwrotnego wychwytu serotoniny i trójpierścieniowe leki przeciwdepresyjne:
fluoksetyna, silny inhibitor CYP2D6, zwiększa stężenie rysperydonu w osoczu lecz w mniejszym stopniu jego czynnej frakcji przeciwpsychotycznej;
paroksetyna, silny inhibitor CYP2D6, zwiększa stężenie rysperydonu w osoczu, ale w dawkach do 20 mg/dobę, a w mniejszym stopniu jego czynnej frakcji
przeciwpsychotycznej. Większe dawki paroksetyny mogą jednak zwiększać stężenie czynnej frakcji przeciwpsychotycznej rysperydonu;
trójpierścieniowe leki przeciwdepresyjne, mogą zwiększać stężenia rysperydonu w osoczu, ale nie jego czynnej frakcji przeciwpsychotycznej. Amitryptylina nie wpływa na
farmakokinetykę rysperydonu i jego czynnej frakcji przeciwpsychotycznej;
sertralina, słaby inhibitor CYP2D6 oraz fluwoksamina, słaby inhibitor CYP3A4,
w dawkach do 100 mg/dobę, nie wywołują istotnych klinicznie zmian stężeń rysperydonu i jego czynnej frakcji przeciwpsychotycznej. Natomiast, w dawkach większych niż
100 mg/dobę, sertralina lub fluwoksamina mogą zwiększać stężenia rysperydonu i jego czynnej frakcji przeciwpsychotycznej.
Wpływ rysperydonu na farmakokinetykę innych produktów leczniczych
Leki przeciwpadaczkowe:
rysperydon nie wykazuje istotnego klinicznie wpływu na farmakokinetykę walproinianu czy topiramatu.
Leki przeciwpsychotyczne:
arypiprazol, substrat CYP2D6 i CYP3A4: rysperydon w postaci tabletek lub wstrzyknięć nie wpływał na sumaryczną farmakokinetykę arypiprazolu i jego czynnego metabolitu dehydroarypiprazolu.
Glikozydy naparstnicy:
rysperydon nie wykazuje istotnego klinicznie wpływu na farmakokinetykę digoksyny. Lit:
rysperydon nie wykazuje istotnego klinicznie wpływu na farmakokinetykę litu.
Jednoczesne stosowanie rysperydonu z furosemidem
Informacje dotyczące zwiększonej śmiertelności pacjentów w podeszłym wieku z otępieniem, jednocześnie otrzymujących furosemid - patrz punkt 4.4.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
jedna fiolka zawierająca proszek
jeden adapter fiolki umożliwiający sporządzenie zawiesiny (określane jako adapter fiolki)
jedna ampułkostrzykawka zawierająca rozpuszczalnik dla Rispolept Consta
dwie igły Terumo SurGuard®3 do wstrzyknięcia domięśniowego:
jedna igła 21G UTW 1-cal (0,8 mm x 25 mm) z zabezpieczeniem, do wstrzyknięcia do mięśnia naramiennego
jedna igła 20G TW 2-cale (0,9 mm x 51 mm) z zabezpieczeniem, do wstrzyknięcia do mięśnia pośladkowego.
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Rispolept Consta, 25 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
o przedłużonym uwalnianiu
Rispolept Consta, 37,5 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
o przedłużonym uwalnianiu
Rispolept Consta, 50 mg, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań
o przedłużonym uwalnianiu
Każda fiolka zawiera 25 mg, 37,5 mg lub 50 mg rysperydonu.
1 ml sporządzonej zawiesiny zawiera 12,5 mg, 18,75 mg lub 25 mg rysperydonu. Substancje pomocnicze o znanym działaniu
1 ml sporządzonej zawiesiny zawiera 3 mg sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań o przedłużonym uwalnianiu.
Fiolka z proszkiem
Biały lub białawy, sypki proszek.
Ampułkostrzykawka z rozpuszczalnikiem do sporządzania zawiesiny
Przezroczysty, bezbarwny roztwór wodny
Produkt leczniczy Rispolept Consta jest wskazany w leczeniu podtrzymującym schizofrenii u pacjentów aktualnie leczonych doustnymi lekami przeciwpsychotycznymi.
Dawkowanie
Dorośli
Dawka początkowa
Dla większości pacjentów zalecana dawka wynosi 25 mg domięśniowo, co dwa tygodnie.
U pacjentów przyjmujących stałą dawkę rysperydonu doustnie, przez co najmniej dwa tygodnie, należy rozważyć następujący schemat przestawiania. Pacjenci leczeni dawką 4 mg rysperydonu lub mniejszą, podawanego doustnie, powinni otrzymywać 25 mg produktu leczniczego Rispolept Consta, natomiast u pacjentów leczonych większymi dawkami doustnymi, należy rozważyć
większą dawkę produktu leczniczego Rispolept Consta – 37,5 mg.
U pacjentów nieprzyjmujących aktualnie rysperydonu doustnie, należy rozważyć zastosowanie wstępnego leczenia rysperydonem doustnie - przed wyborem początkowej dawki domięśniowej. Zalecana dawka początkowa wynosi 25 mg produktu leczniczego Rispolept Consta, co dwa tygodnie. U pacjentów leczonych większymi doustnymi dawkami leków przeciwpsychotycznych należy rozważyć większą dawkę produktu leczniczego Rispolept Consta – 37,5 mg.
Należy zapewnić wystarczająco skuteczną terapię doustną postacią rysperydonu lub poprzednim lekiem przeciwpsychotycznym, w trakcie trzytygodniowego okresu opóźnienia od wykonania pierwszej iniekcji produktu leczniczego Rispolept Consta (patrz punkt 5.2).
Rispolept Consta nie powinien być stosowany w ostrym pogorszeniu schizofrenii bez
zapewnienia wystarczająco skutecznej terapii doustną postacią rysperydonu lub poprzednim lekiem przeciwpsychotycznym, w trakcie trzytygodniowego okresu opóźnienia od wykonania pierwszej iniekcji produktu leczniczego Rispolept Consta.
Dawka podtrzymująca
Dla większości pacjentów zalecana dawka wynosi 25 mg domięśniowo, co dwa tygodnie. Dla niektórych pacjentów może być korzystne podanie większej dawki: 37,5 mg lub 50 mg. Dawek nie należy zwiększać częściej, niż raz na 4 tygodnie. Wyników zwiększenia dawki należy oczekiwać najwcześniej po trzech tygodniach od podania pierwszej iniekcji zawierającej większą dawkę. W badaniach klinicznych nie zaobserwowano dodatkowych korzyści po podaniu dawki 75 mg. Nie zaleca się stosowania dawek większych niż 50 mg podawanych co dwa tygodnie.
Pacjenci w wieku podeszłym
Nie jest konieczne dostosowywanie dawki. Zalecana dawka wynosi 25 mg domięśniowo, co dwa tygodnie. U pacjentów nieprzyjmujących aktualnie rysperydonu doustnie, zalecana dawka wynosi 25 mg produktu leczniczego Rispolept Consta, co dwa tygodnie. U pacjentów przyjmujących stałą dawkę doustnego rysperydonu przez co najmniej dwa tygodnie należy rozważyć poniższy schemat przestawiania. Pacjenci leczeni dawką 4 mg lub mniej doustnego rysperydonu powinni otrzymywać 25 mg produktu leczniczego Rispolept Consta, natomiast u pacjentów leczonych
większymi dawkami doustnymi, należy rozważyć większą dawkę produktu leczniczego Rispolept Consta - 37,5 mg.
Należy zapewnić wystarczająco skuteczne leczenie przeciwpsychotyczne w trakcie
trzytygodniowego okresu opóźnienia od wykonania pierwszej iniekcji produktu leczniczego Rispolept Consta (patrz punkt 5.2). Dane kliniczne dotyczące stosowania produktu Rispolept Consta u osób w podeszłym wieku, są ograniczone. Produkt leczniczy Rispolept Consta należy stosować z ostrożnością u osób w podeszłym wieku.
Zaburzenia czynności wątroby i nerek
Nie przeprowadzono badań produktu leczniczego Rispolept Consta u pacjentów z zaburzeniami czynności wątroby lub nerek.
W razie konieczności stosowania produktu leczniczego Rispolept Consta u pacjentów
z zaburzeniami czynności wątroby lub nerek, zaleca się podanie doustne rysperydonu w dawce początkowej 0,5 mg dwa razy na dobę w pierwszym tygodniu leczenia. W drugim tygodniu można stosować dawkę 1 mg dwa razy na dobę lub 2 mg raz na dobę. W przypadku, gdy
całkowita dawka dobowa, wynosząca co najmniej 2 mg, jest dobrze tolerowana, produkt leczniczy Rispolept Consta można podawać w postaci wstrzyknięć w dawce 25 mg co dwa tygodnie.
Należy zapewnić wystarczająco skuteczne leczenie przeciwpsychotyczne w trakcie
trzytygodniowego okresu opóźnienia od wykonania pierwszej iniekcji produktu leczniczego Rispolept Consta (patrz punkt 5.2).
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Rispolept Consta u dzieci i młodzieży w wieku poniżej 18 lat. Dane nie są dostępne.
Sposób podawania
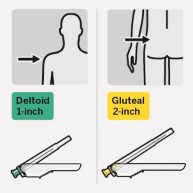
Produkt leczniczy Rispolept Consta należy podawać co dwa tygodnie w głębokiej, domięśniowej iniekcji w mięsień naramienny lub pośladkowy, używając w tym celu odpowiedniej bezpiecznej igły. Do iniekcji w mięsień naramienny należy użyć 1-calowej igły, dokonując wstrzyknięć na
zmianę raz w jedno, raz w drugie ramię. Do iniekcji w mięsień pośladkowy należy użyć
2-calowej igły, dokonując wstrzyknięć na zmianę raz w jeden, raz w drugi pośladek. Produktu nie wolno wstrzykiwać dożylnie (patrz punkt 4.4 oraz punkt 6.6).
W celu uzyskania informacji dotyczących przygotowania produktu leczniczego do stosowania, patrz punkt 6.6.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
U pacjentów, którzy nie przyjmowali nigdy wcześniej rysperydonu w żadnej postaci, zaleca się sprawdzenie tolerancji za pomocą doustnej postaci rysperydonu zanim rozpocznie się leczenie produktem leczniczym Rispolept Consta (patrz punkt 4.2).
Pacjenci w podeszłym wieku z otępieniem
Stosowanie produktu leczniczego Rispolept Consta u pacjentów w podeszłym wieku
z otępieniem nie było przedmiotem badań, dlatego nie jest on wskazany do stosowania w tej grupie pacjentów. Produkt leczniczy Rispolept Consta nie jest zarejestrowany jako lek, który może być stosowany w leczeniu zaburzeń zachowania związanych z otępieniem.
Zwiększona umieralność u osób w podeszłym wieku z otępieniem
W metaanalizie 17 kontrolowanych badań klinicznych z zastosowaniem atypowych leków przeciwpsychotycznych, w tym również rysperydonu podawanego doustnie, u pacjentów w podeszłym wieku z otępieniem, którzy otrzymywali atypowe leki przeciwpsychotyczne, występowała zwiększona umieralność w porównaniu z grupą otrzymującą placebo. W
kontrolowanych placebo badaniach doustnie podawanego produktu leczniczego Rispolept, w tej populacji pacjentów umieralność wynosiła 4,0% wśród pacjentów leczonych rysperydonem i 3,1% wśród pacjentów otrzymujących placebo. Iloraz szans przy 95% przedziale ufności wynosił 1,21 (0,7; 2,1). Średni wiek zmarłych pacjentów wynosił 86 lat (w przedziale od 67 do 100 lat).
Dane z dwóch dużych badań obserwacyjnych wykazały, że u osób w podeszłym wieku z otępieniem, leczonych klasycznymi lekami przeciwpsychotycznymi, występuje również nieznacznie zwiększone ryzyko zgonu w porównaniu do osób nieleczonych. Brak wystarczających danych, aby podać dokładną ocenę wielkości ryzyka. Nie jest też znana
przyczyna zwiększonego ryzyka. Nie wiadomo, w jakim stopniu stwierdzona w badaniach obserwacyjnych zwiększona umieralność, może być przypisywana lekom przeciwpsychotycznym, wobec niektórych cech pacjentów.
Jednoczesne stosowanie z furosemidem
W kontrolowanych placebo badaniach klinicznych doustnych postaci produktu leczniczego Rispolept, przeprowadzanych z udziałem pacjentów w podeszłym wieku z otępieniem, w grupie otrzymującej furosemid i rysperydon obserwowano występowanie większej umieralności (7,3%; średni wiek pacjentów 89 lat, w przedziale od 75 do 97 lat) w porównaniu do pacjentów
leczonych samym rysperydonem (3,1%; średni wiek pacjentów 84 lata, w przedziale od 70 do 96 lat) lub otrzymujących sam furosemid (4,1%; średni wiek pacjentów 80 lat, w przedziale od 67 do 90 lat). Zwiększoną umieralność u pacjentów leczonych furosemidem w skojarzeniu z rysperydonem stwierdzono w dwóch spośród czterech badań klinicznych. Jednoczesne podawanie rysperydonu z innymi diuretykami (głównie tiazydowymi w małych dawkach) nie było związane z podobnymi obserwacjami.
Nie znaleziono dotąd jednoznacznego patofizjologicznego mechanizmu, który mógłby tłumaczyć te obserwacje ani żadnego spójnego wzorca dla przyczyny śmierci. Jednakże, należy zachować szczególną ostrożność i rozważyć ryzyko w stosunku do korzyści przed podjęciem decyzji
o jednoczesnym podawaniu tych leków oraz podawaniu rysperydonu jednocześnie z innymi silnymi diuretykami. Zwiększona umieralność nie występuje u pacjentów leczonych równocześnie rysperydonem i innymi diuretykami. Niezależnie od stosowanego leczenia, odwodnienie jest ogólnym czynnikiem ryzyka wpływającym na umieralność i dlatego
u pacjentów w podeszłym wieku z otępieniem nie powinno się do niego dopuszczać.
Zdarzenia niepożądane naczyniowo-mózgowe (ang. Cerebrovascular Adverse Events, CVAE)
W randomizowanych badaniach klinicznych z kontrolą placebo, przeprowadzonych u pacjentów z otępieniem, stosujących niektóre atypowe leki przeciwpsychotyczne, stwierdzono około
trzykrotne zwiększenie częstości ryzyka zdarzeń niepożądanych naczyniowo-mózgowych. Połączone dane z sześciu kontrolowanych placebo badań produktu leczniczego Rispolept, przeprowadzonych na grupach pacjentów, głównie w podeszłym wieku (wiek > 65 lat) z
otępieniem wykazały, że zdarzenia niepożądane naczyniowo-mózgowe (ciężkie i nie, łącznie) wystąpiły u 3,3% (33/1009) pacjentów leczonych rysperydonem oraz u 1,2% (8/712) pacjentów, którym podawano placebo. Iloraz szans (przy 95% przedziale ufności) wynosił 2,96 (1,34; 7,50). Mechanizm tego zwiększonego ryzyka nie jest znany. Zwiększone ryzyko nie może być wykluczone dla innych leków przeciwpsychotycznych ani innych populacji. Produkt leczniczy Rispolept Consta należy stosować z ostrożnością u pacjentów z czynnikami ryzyka udaru mózgu.
Niedociśnienie ortostatyczne
W związku z tym, że rysperydon blokuje receptory alfa, może wystąpić niedociśnienie (niedociśnienie ortostatyczne), zwłaszcza podczas początkowej fazy leczenia. Klinicznie istotne niedociśnienie obserwowano po wprowadzeniu leku do obrotu u pacjentów leczonych rysperydonem i lekami przeciwnadciśnieniowymi. Należy zachować ostrożność podczas stosowania rysperydonu u pacjentów z chorobami układu krążenia (np. niewydolność serca,
zawał mięśnia sercowego, zaburzenia przewodzenia, odwodnienie, hipowolemia lub choroby naczyniowo-mózgowe). Należy ocenić ryzyko/korzyści dalszej terapii produktem leczniczym Rispolept Consta gdy istotnie kliniczne niedociśnienie się utrzymuje.
Leukopenia, neutropenia i agranulocytoza
Podczas stosowania leków przeciwpsychotycznych, w tym produktu leczniczego Rispolept Consta, stwierdzano wystąpienie leukopenii, neutropenii i agranulocytozy. Agranulocytozę po wprowadzeniu produktu do obrotu zgłaszano bardzo rzadko (< 1/10 000 pacjentów). Pacjentów z istotną klinicznie leukopenią lub polekową leukopenią/neutropenią w wywiadzie, należy monitorować przez pierwsze kilka miesięcy leczenia. Należy rozważyć zaprzestanie stosowania produktu leczniczego Rispolept Consta przy pierwszym objawie istotnego klinicznie
zmniejszenia liczby leukocytów, wobec braku innych czynników przyczynowych. Pacjentów ze znaczącą klinicznie neutropenią należy uważnie obserwować, czy nie występuje u nich gorączka lub inne objawy przedmiotowe lub podmiotowe infekcji, oraz podjąć natychmiastowe leczenie w razie wystąpienia takich objawów. U pacjentów z ciężką neutropenią (bezwzględna liczba neutrofilów < 1 x 109/l) należy zaprzestać stosowania produktu leczniczego Rispolept Consta
i badać liczbę leukocytów do czasu, gdy wynik będzie prawidłowy. Późne dyskinezy/objawy pozapiramidowe
Działanie leków wykazujących właściwości antagonistyczne w stosunku do receptorów dopaminowych związane jest z występowaniem późnych dyskinez, charakteryzujących się rytmicznymi, mimowolnymi ruchami, zwłaszcza mięśni języka i (lub) mięśni twarzy.
Wystąpienie objawów pozapiramidowych jest czynnikiem ryzyka późnych dyskinez.
W przypadku wystąpienia objawów przedmiotowych i podmiotowych późnych dyskinez, należy rozważyć przerwanie leczenia wszelkimi lekami przeciwpsychotycznymi.
Należy zachować ostrożność u pacjentów otrzymujących jednocześnie leki psychostymulujące (np. metylofenidat) i rysperydon, gdyż mogą wystąpić objawy pozapiramidowe podczas dostosowywania dawki jednego lub obu leków. Zaleca się stopniowe wycofywanie terapii stymulantem (patrz punkt 4.5).
Złośliwy zespół neuroleptyczny
Istnieją doniesienia o występowaniu, podczas leczenia lekami przeciwpsychotycznymi,
złośliwego zespołu neuroleptycznego, charakteryzującego się: podwyższeniem temperatury ciała, sztywnością mięśni, niestabilnością układu autonomicznego, zaburzeniami świadomości
i zwiększeniem aktywności fosfokinazy kreatynowej w surowicy. Dodatkowe objawy mogą obejmować mioglobinurię (rabdomioliza) i ostrą niewydolność nerek. W takim przypadku należy przerwać stosowanie wszystkich leków przeciwpsychotycznych, w tym produktu leczniczego Rispolept Consta.
Choroba Parkinsona i otępienie z obecnością ciał Lewy’ego
W przypadku przepisywania leków przeciwpsychotycznych, w tym produktu leczniczego Rispolept Consta, pacjentom z chorobą Parkinsona lub otępieniem z obecnością ciał Lewy’ego, lekarze powinni rozważyć stosunek ryzyka do korzyści. Rysperydon może zaostrzyć przebieg choroby Parkinsona. U pacjentów w obu grupach może występować zwiększone ryzyko
złośliwego zespołu neuroleptycznego i zwiększona wrażliwość na leki przeciwpsychotyczne. Pacjenci ci zostali wyłączeni z badań klinicznych. Objawy zwiększonej wrażliwości na leki przeciwpsychotyczne mogą obejmować: splątanie, zaburzenie świadomości, niestabilność postawy z częstymi upadkami, które towarzyszą objawom pozapiramidowym.
Reakcje nadwrażliwości
Pomimo, że przed rozpoczęciem leczenia produktem leczniczym Rispolept Consta należy określić tolerancję na rysperydon podawany doustnie, po wprowadzeniu produktu do obrotu
raportowano rzadkie reakcje anafilaktyczne u pacjentów, którzy wcześniej tolerowali rysperydon podawany doustnie (patrz punkty 4.2 i 4.8).
W razie wystąpienia reakcji nadwrażliwości, należy przerwać stosowanie produktu leczniczego Rispolept Consta; włączyć w razie potrzeby ogólne środki wspomagające i obserwować pacjenta aż do ustąpienia objawów przedmiotowych i podmiotowych (patrz punkty 4.3 i 4.8).
Hiperglikemia i cukrzyca
Podczas leczenia produktem leczniczym Rispolept Consta, stwierdzano wystąpienie hiperglikemii, cukrzycy i zaostrzenie przebiegu wcześniej występującej cukrzycy. W niektórych przypadkach zgłaszano wcześniej zwiększenie masy ciała, co może być czynnikiem
predysponującym. Kwasica ketonowa była zgłaszana bardzo rzadko, a śpiączka cukrzycowa rzadko. Zaleca się prowadzenie odpowiedniej obserwacji klinicznej, zgodnie z wytycznymi terapii przeciwpsychotycznej. U pacjentów leczonych jakimkolwiek atypowym lekiem
przeciwpsychotycznym, w tym produktem leczniczym Rispolept Consta, należy obserwować objawy hiperglikemii (takie jak: polidypsja, poliuria, nadmierne łaknienie i osłabienie),
a pacjentów z cukrzycą należy regularnie badać, czy nie pogarsza się u nich kontrola glikemii. Zwiększenie masy ciała
Podczas stosowania produktu leczniczego Rispolept Consta stwierdzano przypadki znacznego zwiększenia masy ciała. Należy regularnie kontrolować masę ciała.
Hiperprolaktynemia
Hiperprolaktynemia jest częstym działaniem niepożądanym występującym podczas leczenia
produktem leczniczym Rispolept Consta. Zaleca się badanie stężenia prolaktyny w osoczu u pacjentów z działaniami niepożądanymi prawdopodobnie związanymi z prolaktyną (np.: ginekomastia, zaburzenia miesiączkowania, brak owulacji, zaburzenia płodności, zmniejszone libido, zaburzenia wzwodu i mlekotok).
Badania hodowli tkankowych wskazują, że prolaktyna może stymulować wzrost komórek nowotworowych w guzach piersi u ludzi. Pomimo, że nie stwierdzono do tej pory w badaniach klinicznych i epidemiologicznych wyraźnego związku z podawanymi lekami
przeciwpsychotycznymi, należy zachować ostrożność u pacjentów z wywiadem w tym kierunku. Rispolept Consta należy stosować z ostrożnością u pacjentów ze stwierdzonymi wcześniej hiperprolaktynemią lub guzami prolaktynozależnymi.
Wydłużenie odstępu QT
Wydłużenie odstępu QT było bardzo rzadko zgłaszane po wprowadzeniu produktu do obrotu.
Podobnie jak w przypadku innych leków przeciwpsychotycznych, zaleca się ostrożność
w przypadku przepisywania rysperydonu pacjentom z chorobami układu krążenia, wywiadem rodzinnym w kierunku wydłużenia odstępu QT, bradykardią lub zaburzeniami elektrolitowymi (niedoborem potasu lub magnezu), ponieważ rysperydon może zwiększać ryzyko wystąpienia działań arytmogennych, a także w przypadku jednoczesnego stosowania rysperydonu z lekami,
o których wiadomo, że wydłużają odstęp QT. Drgawki
Należy zachować ostrożność podczas stosowania produktu leczniczego Rispolept Consta u pacjentów z drgawkami w wywiadzie lub z innymi stanami, które mogą obniżać próg drgawkowy.
Priapizm
W związku z działaniem blokującym receptor alfa-adrenergiczny, podczas leczenia produktem leczniczym Rispolept Consta może wystąpić priapizm.
Regulacja temperatury ciała
Lekom przeciwpsychotycznym przypisywano właściwość zakłócania zdolności organizmu do obniżania temperatury podstawowej ciała. Zaleca się zachowanie odpowiedniej ostrożności
w przypadku przepisywania produktu leczniczego Rispolept Consta pacjentom, u których mogą wystąpić czynniki sprzyjające podwyższeniu podstawowej temperatury ciała, np. wykonujących intensywny wysiłek fizyczny, narażonych na działanie ekstremalnie wysokich temperatur,
przyjmujących jednocześnie leki o działaniu przeciwcholinergicznym lub odwodnionych. Żylna choroba zakrzepowo-zatorowa
Podczas stosowania leków przeciwpsychotycznych zgłaszano przypadki żylnej choroby zakrzepowo-zatorowej (ang. Venous thromboembolism, VTE). Ze względu na występujące często u pacjentów leczonych lekami przeciwpsychotycznymi, nabyte czynniki ryzyka VTE, przed rozpoczęciem leczenia i podczas leczenia produktem leczniczym Rispolept Consta należy
zidentyfikować wszystkie możliwe czynniki ryzyka VTE i podjąć odpowiednie działania zapobiegawcze.
Śródoperacyjny zespół wiotkiej tęczówki
U pacjentów przyjmujących leki o działaniu antagonistycznym na receptory alfa1a- adrenergiczne, w tym produkt leczniczy Rispolept Consta, stwierdzano podczas operacji usunięcia zaćmy śródoperacyjny zespół wiotkiej tęczówki (ang. Intraoperative Floppy Iris Syndrome, IFIS) (patrz punkt 4.8).
Zespół IFIS może zwiększać ryzyko powikłań ocznych w trakcie i po zabiegu. Przed zabiegiem trzeba poinformować wykonującego go okulistę o aktualnym lub wcześniejszym przyjmowaniu leków o działaniu antagonistycznym na receptory alfa1a-adrenergiczne. Nie ustalono możliwych korzyści z odstawienia leków blokujących receptory alfa1 przed zabiegiem usunięcia zaćmy
i należy to rozważyć wobec ryzyka przerwania leczenia przeciwpsychotycznego. Działanie przeciwwymiotne
W badaniach przedklinicznych rysperydonu obserwowano jego działanie przeciwwymiotne. W przypadku stosowania leku u ludzi, działanie to może maskować objawy przedmiotowe
i podmiotowe przedawkowania niektórych leków lub stany, takie jak niedrożność jelit, zespół Reye’a i nowotwór mózgu.
Zaburzenia czynności nerek i wątroby
Przeprowadzono badania nad rysperydonem podawanym doustnie u pacjentów z niewydolnością nerek lub wątroby, jednakże w przypadku produktu leczniczego Rispolept Consta nie
wykonywano takich badań, dlatego należy zachować ostrożność podając go pacjentom z tej grupy (patrz punkt 4.2).
Podawanie leku
Należy uważać, aby uniknąć nieumyślnego podania produktu leczniczego Rispolept Consta do naczynia krwionośnego.
Substancje pomocnicze
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na dawkę, to znaczy lek uznaje się za „wolny od sodu”.
Nie prowadzono systematycznych badań interakcji produktu leczniczego Rispolept Consta stosowanego w skojarzeniu z innymi lekami. Dane interakcji lekowych przedstawione w tym punkcie opierają się na badaniach dotyczących produktu leczniczego Rispolept podawanego doustnie.
Interakcje farmakodynamiczne
Leki, o których wiadomo, że wydłużają odstęp QT
Podobnie jak w przypadku innych leków przeciwpsychotycznych, zalecana jest ostrożność podczas przepisywania rysperydonu jednocześnie z lekami wydłużającymi odstęp QT, takimi jak: leki przeciwarytmiczne (tj. chinidyna, dyzopiramid, prokainamid, propafenon, amiodaron,
sotalol), trójpierścieniowe leki przeciwdepresyjne (np. amitryptylina), czteropierścieniowe leki przeciwdepresyjne (np. maprotylina), niektóre leki przeciwhistaminowe, inne leki
przeciwpsychotyczne, niektóre leki przeciwmalaryczne (tj. chinina i meflochina) oraz z lekami powodującymi zaburzenia równowagi elektrolitowej (hipokaliemia, hipomagnezemia),
bradykardię lub z lekami hamującymi metabolizm wątrobowy rysperydonu. Powyższa lista ma charakter informacyjny i nie jest listą wyczerpującą.
Leki działające ośrodkowo i alkohol
Rysperydon należy stosować z ostrożnością w skojarzeniu z innymi substancjami działającymi ośrodkowo - w szczególności alkoholem, opioidami, lekami przeciwhistaminowymi oraz benzodiazepinami - ze względu na zwiększone ryzyko sedacji.
Lewodopa i agoniści dopaminy
Rispolept Consta może antagonizować działanie lewodopy i innych agonistów
dopaminergicznych. Jeśli to skojarzenie wydaje się konieczne, szczególnie w schyłkowej fazie choroby Parkinsona, należy zastosować najmniejsze skuteczne dawki obu leków.
Leki działające hipotensyjnie
Po wprowadzeniu rysperydonu do obrotu obserwowano istotne klinicznie niedociśnienie po zastosowaniu rysperydonu w skojarzeniu z lekami przeciwnadciśnieniowymi.
Leki psychostymulujące
Jednoczesne stosowanie leków psychostymulujących (np. metylofenidatu) z rysperydonem może prowadzić do wystąpienia objawów pozapiramidowych po zmianie dawkowania jednego lub obu leków (patrz punkt 4.4).
Interakcje farmakokinetyczne
Rysperydon jest metabolizowany głównie z udziałem CYP2D6 i w mniejszym stopniu CYP3A4. Zarówno rysperydon, jak i jego czynny metabolit 9-hydroksyrysperydon, są substratami glikoproteiny P (P-gp). Substancje modyfikujące aktywność CYP2D6 lub substancje silnie hamujące lub indukujące aktywność CYP3A4 i (lub) P-gp, mogą wpływać na farmakokinetykę czynnej frakcji przeciwpsychotycznej rysperydonu.
Silne inhibitory CYP2D6
Jednoczesne stosowanie produktu leczniczego Rispolept Consta z silnym inhibitorem CYP2D6 może prowadzić do zwiększenia w osoczu stężenia rysperydonu, a w mniejszym stopniu czynnej frakcji przeciwpsychotycznej. Większe dawki silnego inhibitora CYP2D6 mogą zwiększać
stężenie czynnej frakcji przeciwpsychotycznej rysperydonu (np. paroksetyna, patrz niżej). Oczekuje się, że inne inhibitory CYP2D6, takie jak chinidyna, mogą podobnie wpływać na stężenie rysperydonu. Należy ponownie ocenić dawkowanie produktu leczniczego Rispolept
Consta podczas rozpoczynania lub kończenia jednoczesnego podawania paroksetyny, chinidyny czy innego silnego inhibitora CYP2D6, szczególnie w większych dawkach.
Inhibitory CYP3A4 i (lub) P-gp
Jednoczesne podawanie produktu leczniczego Rispolept Consta z silnym inhibitorem CYP3A4 i (lub) P-gp może znacząco zwiększyć stężenie czynnej frakcji przeciwpsychotycznej rysperydonu w osoczu. Należy ponownie ocenić dawkowanie produktu leczniczego Rispolept
Consta podczas rozpoczynania lub kończenia jednoczesnego podawania itrakonazolu czy innego silnego inhibitora CYP3A4 i (lub) P-gp.
Induktory CYP3A4 i (lub) P-gp
Jednoczesne podawanie produktu leczniczego Rispolept Consta z silnym induktorem CYP3A4 i (lub) P-gp może zmniejszyć stężenie czynnej frakcji przeciwpsychotycznej rysperydonu
w osoczu. Należy ponownie ocenić dawkowanie produktu leczniczego Rispolept Consta podczas rozpoczynania lub kończenia jednoczesnego podawania karbamazepiny czy innego silnego induktora CYP3A4 i (lub) P-gp. Induktory CYP3A4 wykazują maksymalne działanie
w zależności od czasu - ich maksymalne działanie może wystąpić co najmniej po 2 tygodniach po rozpoczęciu podawania. Podobnie, w razie zaprzestania ich stosowania, indukcja CYP3A4 może nie ustępować przynajmniej przez 2 tygodnie.
Leki silnie wiążące się z białkami
Nie stwierdza się istotnego klinicznie wypierania leków z białek osocza, gdy produkt leczniczy Rispolept Consta przyjmuje się jednocześnie z lekami silnie wiążącymi się z białkami.
W razie skojarzonego stosowania leków, należy zapoznać się z charakterystykami odpowiednich produktów leczniczych, w celu poznania szlaków metabolizmu i możliwej konieczności dostosowania dawki.
Dzieci i młodzież
Badania dotyczące interakcji przeprowadzono wyłącznie u dorosłych. Nie wiadomo, czy wyniki tych badań mają znaczenie u dzieci i młodzieży.
Przykłady
Poniżej wymieniono przykłady leków, które potencjalnie mogą wykazywać lub nie wykazują interakcji z rysperydonem:
Wpływ innych produktów leczniczych na farmakokinetykę rysperydonu
Antybiotyki:
Ciąża
Brak wystarczających danych dotyczących stosowania rysperydonu u kobiet w okresie ciąży. W badaniach na zwierzętach nie stwierdzono działania teratogennego rysperydonu, lecz stwierdzano innego rodzaju toksyczny wpływ na reprodukcję (patrz punkt 5.3). Potencjalne
zagrożenie dla człowieka nie jest znane.
Noworodki, które były narażone na działanie leków przeciwpsychotycznych (w tym produktu leczniczego Rispolept Consta) podczas trzeciego trymestru ciąży, są w grupie ryzyka działań niepożądanych, w tym zaburzeń pozapiramidowych i (lub) objawów odstawienia o różnym
nasileniu i czasie trwania po porodzie. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane.
Produktu leczniczego Rispolept Consta nie należy stosować w okresie ciąży, jeśli nie jest to bezwzględnie konieczne.
Karmienie piersią
W badaniach przeprowadzanych na zwierzętach stwierdzono przenikanie rysperydonu
i 9-hydroksyrysperydonu do mleka. Wykazano również, że rysperydon i 9-hydroksyrysperydon także przenikają w małych ilościach do mleka kobiet karmiących piersią. Brak danych
dotyczących działań niepożądanych występujących u niemowląt karmionych piersią. Dlatego należy rozważyć stosunek korzyści z karmienia piersią do potencjalnego ryzyka dla dziecka.
Płodność
Jak w przypadku innych leków będących antagonistami receptorów D2, Rispolept Consta zwiększa stężenie prolaktyny. Hiperprolaktynemia może hamować wytwarzanie GnRH
w podwzgórzu, co powoduje zmniejszenie wydzielania gonadotropin w przysadce. To z kolei, na skutek zaburzeń steroidogenezy w gonadach, może hamować czynności rozrodcze zarówno
u kobiet, jak i u mężczyzn.
Nie stwierdzono takich działań w badaniach przedklinicznych.
Rispolept Consta wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn, ze względu na potencjalne oddziaływanie na układ nerwowy i zaburzenia widzenia (patrz punkt 4.8). Dlatego pacjentom należy doradzać powstrzymanie się od prowadzenia pojazdów lub obsługiwania maszyn do czasu poznania ich indywidualnej
wrażliwości na lek.
Najczęściej zgłaszane działania niepożądane (częstość ≥ 1/10) to: bezsenność, lęk, ból głowy, infekcje górnych dróg oddechowych, parkinsonizm i depresja.
Występujące działania niepożądane, zależne od dawki, obejmowały parkinsonizm i akatyzję.
Po wprowadzeniu produktu na rynek odnotowano ciężkie reakcje w miejscu wstrzyknięcia,
w tym martwicę, ropień, zapalenie tkanki łącznej, wrzód, krwiak, torbiel i guzek. Częstość ich występowania jest nieznana (nie może być oszacowana na podstawie dostępnych danych).
Pojedyncze przypadki wymagały interwencji chirurgicznej.
Poniżej podano wszystkie działania niepożądane zgłoszone w trakcie badań klinicznych i po wprowadzeniu produktu do obrotu, z częstością występowania ustaloną na podstawie badań klinicznych produktu leczniczego Rispolept Consta. Zastosowano następujące określenia odnoszące się do częstości występowania: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1000), bardzo rzadko
(< 1/10 000) i nieznana (częstość nie może być określona na podstawie dostępnych danych).
W obrębie każdej grupy o określonej częstości występowania, objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Klasyfikacja układów i narządów | Działanie niepożądane | |||||
Częstość | ||||||
Bardzo często | Często | Niezbyt często | Rzadko | Bardzo rzadko | Nieznana | |
Zakażenia | zakażenie | zapalenie płuc, | zakażenie dróg | |||
i zarażenia | górnych dróg | zapalenie | oddechowych, | |||
pasożytnicze | oddechowych | oskrzeli, | zapalenie | |||
zapalenie zatok, | pęcherza | |||||
zakażenie dróg | moczowego, | |||||
moczowych, | zakażenie ucha, | |||||
grypa | zakażenie oka, | |||||
zapalenie | ||||||
migdałków, | ||||||
grzybica | ||||||
paznokci, | ||||||
zapalenie tkanki | ||||||
łącznej, | ||||||
zakażenie, | ||||||
zakażenie | ||||||
miejscowe, | ||||||
zakażenie | ||||||
wirusowe, | ||||||
akaroza skórna, | ||||||
ropień | ||||||
podskórny | ||||||
Zaburzenia | niedokrwistość | leukopenia, | agranulocytozac, | |||
krwi i układu | trombocytopeni | neutropenia, | ||||
chłonnego | a, zmniejszenie | zwiększenie liczby | ||||
wartości | eozynofili | |||||
hematokrytu, | ||||||
Zaburzenia | nadwrażliwość | reakcja | ||||
układu | anafilaktycznac | |||||
immunologicz | ||||||
nego | ||||||
Zaburzenia | hiperprolaktyne | obecność | nieprawidłowe | |||
endokrynolog | miaa | glukozy w | wydzielanie | |||
iczne | moczu | hormonu | ||||
antydiuretycznego | ||||||
Zaburzenia | hiperglikemia, | cukrzycab, | zatrucie wodnec, | cukrzycowa | ||
metabolizmu | zwiększenie | jadłowstręt, | hipoglikemia, | kwasica | ||
i odżywiania | masy ciała, | zwiększenie | hiperinsulinemiac, | ketonowa | ||
zwiększenie | stężenia | polidypsja, | ||||
apetytu, | trójglicerydów | |||||
zmniejszenie | we krwi, | |||||
masy ciała, | zwiększenie | |||||
zmniejszenie | stężenia | |||||
apetytu | cholesterolu we | |||||
krwi | ||||||
Zaburzenia | bezsennośćd, | zaburzenia snu, | mania, stan | katatonia, | ||
psychiczne | depresja, lęk | pobudzenie, | splątania, | somnambulism, | ||
zmniejszone | anorgazmia, | zaburzenia | ||||
libido | nerwowość, | odżywiania | ||||
koszmary senne | związane ze snem, | |||||
przytępiony afekt | ||||||
Klasyfikacja układów i narządów | Działanie niepożądane | |||||
Częstość | ||||||
Bardzo często | Często | Niezbyt często | Rzadko | Bardzo rzadko | Nieznana | |
Zaburzenia | parkinsonizmd | sedacja/senność, | dyskineza | złośliwy zespół | ||
układu | , ból głowy | akatyzjad, | późna, | neuroleptyczny, | ||
nerwowego | dystoniad, | niedokrwienie | zaburzenia | |||
zawroty głowy, | mózgu, utrata | naczyniowo- | ||||
dyskinezad, | świadomości, | mózgowe, brak | ||||
drżenie | napady | reakcji na bodźce, | ||||
drgawkowed, | zmniejszony | |||||
omdlenie, | poziom | |||||
nadpobudliwość | świadomości, | |||||
psychomotorycz | śpiączka | |||||
na, zaburzenia | cukrzycowa, | |||||
równowagi, | kiwanie głową | |||||
nieprawidłowa | ||||||
koordynacja, | ||||||
zawroty głowy | ||||||
zależne od | ||||||
postawy ciała, | ||||||
zaburzenia | ||||||
koncentracji, | ||||||
dyzartria, | ||||||
zaburzenia | ||||||
smaku, | ||||||
niedoczulica, | ||||||
parestezje | ||||||
Zaburzenia | niewyraźne | zapalenie | zamknięcie tętnicy | |||
oka | widzenie | spojówek, suche | siatkówki, jaskra, | |||
oko, zwiększone | zaburzenia ruchu | |||||
łzawienie, | gałek ocznych, | |||||
przekrwienie | rotacyjne ruchy | |||||
oczu | gałek ocznych, | |||||
światłowstręt, | ||||||
owrzodzenia | ||||||
brzegów powiek, | ||||||
zespół wiotkiej | ||||||
tęczówki | ||||||
(śródoperacyjny)c | ||||||
Zaburzenia ucha i błędnika | zawroty głowy, szum w uszach, ból ucha | |||||
Klasyfikacja układów i narządów | Działanie niepożądane | |||||
Częstość | ||||||
Bardzo często | Często | Niezbyt często | Rzadko | Bardzo rzadko | Nieznana | |
Zaburzenia | tachykardia | migotanie | niemiarowość | |||
serca | przedsionków, | zatokowa | ||||
blok | ||||||
przedsionkowo- | ||||||
komorowy, | ||||||
zaburzenia | ||||||
przewodzenia, | ||||||
wydłużenie | ||||||
odstępu QT w | ||||||
EKG, | ||||||
bradykardia, | ||||||
nieprawidłowy | ||||||
zapis EKG, | ||||||
kołatanie serca | ||||||
Zaburzenia naczyniowe | niedociśnienie, nadciśnienie | niedociśnienie ortostatyczne | zatorowość płucna, zakrzepica żylna, napady zaczerwienienia | |||
Zaburzenia | duszność, ból | hiperwentylacja, | zespół bezdechu | |||
układu | gardła i krtani, | przekrwienie | śródsennego, | |||
oddechowego, | kaszel, | dróg | zachłystowe | |||
klatki | przekrwienie | oddechowych, | zapalenie płuc, | |||
piersiowej | błony śluzowej | sapanie, | przekrwienie płuc, | |||
i śródpiersia | nosa | krwawienie z | rzężenia, dysfonia, | |||
nosa | zaburzenia | |||||
oddechowe | ||||||
Zaburzenia | ból w jamie | nietrzymanie | zapalenie trzustki, | ileus | ||
żołądka i jelit | brzusznej, | stolca, dysfagia, | niedrożność jelit, | |||
uczucie | wzdęcia | obrzęk języka, | ||||
dyskomfortu w | kamienie kałowe, | |||||
jamie brzusznej, | zapalenie warg | |||||
wymioty, | ||||||
nudności, | ||||||
zaparcia, | ||||||
zapalenie | ||||||
żołądka i jelit, | ||||||
biegunka, | ||||||
niestrawność, | ||||||
suchość w jamie | ||||||
ustnej, ból zęba | ||||||
Zaburzenia | wysypka | świąd, łysienie, | polekowe wykwity | obrzęk | Zespół | |
skóry i tkanki | wyprysk, sucha | skórne, pokrzywka, | naczyniorucho | Stevensa- | ||
podskórnej | skóra, rumień | hiperkeratoza, | wy | Johnsona/ | ||
odbarwienie | łupież, zaburzenia | toksyczna | ||||
skóry, trądzik, | skóry, uszkodzenie | nekroliza | ||||
łojotokowe | skóry | naskórkac | ||||
zapalenie skóry | ||||||
Klasyfikacja układów i narządów | Działanie niepożądane | |||||
Częstość | ||||||
Bardzo często | Często | Niezbyt często | Rzadko | Bardzo rzadko | Nieznana | |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | skurcze mięśni, ból mięśniowo- szkieletowy, ból pleców, ból stawów | zwiększone stężenie kinazy fosfokreatynow ej we krwi, zesztywnienie stawów, obrzęk stawów, osłabienie mięśni, ból szyi | rabdomioliza, nieprawidłowa postawa ciała, | |||
Zaburzenia nerek i dróg moczowych | nietrzymanie moczu | częstomocz, zastój moczu, dyzuria | ||||
Ciąża, połóg i okres okołoporodo wy | noworodkowy zespół odstawienia c | |||||
Zaburzenia układu rozrodczego i piersi | zaburzenia erekcji, brak miesiączki, mlekotok | zaburzenia ejakulacji, opóźnione miesiączkowani e, zaburzenia miesiączkowani ad, ginekomastia, zaburzenia funkcji seksualnych, ból piersi, dyskomfort piersi, wydzielina z pochwy | priapizmc, obrzęk piersi, powiększenie piersi, wydzielina z piersi | |||
Zaburzenia ogólne i stany w miejscu podania | obrzękd, gorączka, ból w klatce piersiowej, osłabienie (astenia), zmęczenie, ból, reakcja w miejscu wstrzyknięcia | obrzęk twarzy, dreszcze, zwiększenie temperatury ciała, nieprawidłowy sposób chodzenia, pragnienie, dyskomfort w klatce piersiowej, złe samopoczucie, dziwne samopoczucie, stwardnieniec | hipotermia, zmniejszenie temperatury ciała, ochłodzenie obwodowych części ciała, zespół odstawienia leku, uczucie dyskomfortu | |||
Klasyfikacja układów i narządów | Działanie niepożądane | |||||
Częstość | ||||||
Bardzo często | Często | Niezbyt często | Rzadko | Bardzo rzadko | Nieznana | |
Zaburzenia wątroby i dróg żółciowych | zwiększenie aktywności aminotransferaz, zwiększenie aktywności gammaglutamyl otransferazy | zwiększenie aktywności enzymów wątrobowych | żółtaczka | |||
Urazy, zatrucia i powikłania po zabiegach | upadek | ból związany z procedurami medycznymi | ||||
a Hiperprolaktynemia może w niektórych przypadkach prowadzić do ginekomastii, zaburzeń menstruacji, braku miesiączki, braku owulacji, mlekotoku, zaburzeń płodności, zmniejszonego libido, zaburzeń wzwodu.
b W badaniach z kontrolą placebo cukrzycę zgłaszano u 0,18% osób leczonych rysperydonem w porównaniu do 0,11% w grupie placebo. Całkowita częstość występowania cukrzycy we
wszystkich badaniach klinicznych wyniosła 0,43% u wszystkich osób leczonych rysperydonem. c Nie stwierdzono w badaniach klinicznych produktu leczniczego Rispolept Consta, lecz stwierdzano po wprowadzeniu rysperydonu do obrotu.
d Zespół pozapiramidowy może się objawiać: parkinsonizmem (zwiększone wydzielanie śliny, sztywność mięśni szkieletowych, parkinsonizm, ślinienie się, objaw koła zębatego w parkinsonizmie, bradykinezja, hipokinezja, maskowaty wyraz twarzy, napięcie mięśni, akineza, sztywność karku, sztywność mięśni, chód parkinsonowski i nieprawidłowy odruch z gładzizny
czoła, parkinsonowskie drżenie spoczynkowe), akatyzją (akatyzja, niepokój ruchowy, hiperkinezja i zespół niespokojnych nóg), drżeniem, dyskinezą (dyskineza, drganie mięśni, choreoatetoza,
atetoza i drgawki kloniczne mięśni), dystonią. Dystonia obejmuje tu dystonię, zwiększone napięcie mięśni, kręcz szyi, mimowolne skurcze mięśni, przykurcz mięśni, kurcz powiek, rotacyjne ruchy gałki ocznej, porażenie języka, skurcze mięśni twarzy, skurcz krtani, miotonię, opistotonus, skurcz mięśni ust i gardła, pleurototonus, skurcz języka oraz szczękościsk. Należy zauważyć, że wymieniono szeroki zakres objawów, które niekoniecznie muszą mieć podłoże pozapiramidowe.
Bezsenność obejmuje: trudności z zasypianiem, bezsenność śródnocną. Napady drgawkowe
obejmują: uogólniony napad toniczno-kloniczny. Zaburzenia miesiączkowania obejmują:
nieregularne miesiączkowanie, skąpe miesiączkowanie. Obrzęk obejmuje: obrzęk uogólniony, obrzęk obwodowy, obrzęk ciastowaty.
Działania niepożądane stwierdzone podczas stosowania postaci farmaceutycznych paliperydonu
Paliperydon jest czynnym metabolitem rysperydonu, dlatego profile działań niepożądanych tych substancji (w tym zarówno postaci doustnych, jak i postaci do wstrzyknięć) odpowiadają sobie wzajemnie. Oprócz wyżej wymienionych działań niepożądanych, podczas stosowania produktów paliperydonu stwierdzono wymienione poniżej działania, które mogą wystąpić podczas stosowania produktu leczniczego Rispolept Consta.
Zaburzenia serca:
Zespół posturalnej tachykardii ortostatycznej. Reakcja anafilaktyczna
Po wprowadzeniu do obrotu, rzadko zgłaszano przypadki reakcji anafilaktycznej po
wstrzyknięciu produktu leczniczego Rispolept Consta u pacjentów, którzy wcześniej tolerowali rysperydon podawany doustnie (patrz punkt 4.4).
Oddziaływania związane z grupą leków
Podobnie jak w przypadku innych leków przeciwpsychotycznych, stwierdzano bardzo rzadkie
przypadki wydłużenia odstępu QT po wprowadzeniu rysperydonu do obrotu. Innymi, związanymi z klasą, oddziaływaniami na serce opisywanymi dla leków przeciwpsychotycznych, w przypadku których występuje wydłużenie odcinka QT, są: arytmia komorowa, migotanie komór, tachykardia komorowa, nagła śmierć, zatrzymanie akcji serca i częstoskurcz komorowy typu torsade de pointes.
Żylna choroba zakrzepowo-zatorowa
Podczas leczenia lekami przeciwpsychotycznymi zgłaszano przypadki żylnej choroby zakrzepowo-zatorowej, w tym zatorowość płucną i zakrzepicę żył głębokich (częstość nieznana).
Zwiększenie masy ciała
W trwającym 12 tygodni badaniu metodą podwójnie ślepej próby z kontrolą placebo, u 9% pacjentów otrzymujących produkt leczniczy Rispolept Consta w porównaniu z 6% pacjentów otrzymujących placebo, zaobserwowano na końcu badania zwiększenie masy ciała o ≥ 7%.
W trwającym przez 1 rok badaniu otwartym produktu leczniczego Rispolept Consta, zmiany masy ciała u poszczególnych pacjentów wynosiły zazwyczaj ± 7% w porównaniu ze stanem przed rozpoczęciem badania. U 25% pacjentów zaobserwowano ≥ 7% zwiększenie masy ciała.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów
Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Aleje Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Ponieważ przedawkowanie postaci pozajelitowej produktu leczniczego jest mniej
prawdopodobne niż w przypadku przyjmowania jego postaci doustnej, poniżej przedstawiono informacje dotyczące postaci doustnej.
Objawy
Opisywane objawy przedmiotowe i podmiotowe wynikały z nasilenia wyników farmakologicznego działania rysperydonu. Były to: senność i sedacja, tachykardia
i niedociśnienie oraz objawy pozapiramidowe. Po przedawkowaniu odnotowano przypadki wydłużenia odstępu QT i drgawek. Częstoskurcz komorowy typu torsade de pointes stwierdzano w związku z jednoczesnym przedawkowaniem rysperydonu podawanego doustnie i paroksetyny.
W przypadku ostrego przedawkowania, należy zawsze brać pod uwagę możliwość zatrucia wieloma lekami jednocześnie.
Leczenie
Należy uzyskać i utrzymać drożność dróg oddechowych oraz zapewnić odpowiednią podaż tlenu i wentylację. Należy natychmiast rozpocząć kontrolowanie czynności układu krążenia z ciągłym zapisem elektrokardiograficznym, w celu wykrycia ewentualnych zaburzeń rytmu.
Nie ma swoistego antidotum na rysperydon, dlatego należy wdrożyć odpowiednie leczenie podtrzymujące. Niedociśnienie i zapaść krążeniową należy leczyć odpowiednimi środkami, takimi jak dożylnie podawane płyny i (lub) leki sympatykomimetyczne. W razie wystąpienia ciężkich objawów pozapiramidowych należy wdrożyć leczenie antycholinergiczne. Należy
dokładnie obserwować pacjenta i monitorować parametry życiowe do czasu ustąpienia objawów zatrucia.
Grupa farmakoterapeutyczna: Inne leki przeciwpsychotyczne, kod ATC: N05AX08. Mechanizm działania
Rysperydon jest wybiórczym antagonistą monoaminergicznym o unikatowych właściwościach.
Charakteryzuje się dużym powinowactwem do receptorów serotoninergicznych 5-HT2
i dopaminergicznych D2. Rysperydon wiąże się również z receptorami alfa-1-adrenergicznymi i, z mniejszym powinowactwem, z receptorami histaminergicznymi H1 i receptorami α-2-
adrenergicznymi. Rysperydon nie wykazuje powinowactwa do receptorów cholinergicznych. Chociaż rysperydon jest silnym antagonistą receptorów dopaminergicznych D2, co wiąże się z korzystnym wpływem na wytwórcze objawy schizofrenii, w mniejszym stopniu ogranicza
aktywność motoryczną i wywołuje katalepsję niż klasyczne neuroleptyki. Zrównoważone ośrodkowe działanie antagonistyczne na receptory serotoninergiczne i dopaminergiczne może zmniejszyć prawdopodobieństwo wystąpienia pozapiramidowych działań niepożądanych
i rozszerzyć oddziaływanie terapeutyczne na objawy negatywne i zaburzenia afektywne występujące w przebiegu schizofrenii.
Skuteczność kliniczna
Skuteczność produktu leczniczego Rispolept Consta (25 mg i 50 mg) w leczeniu objawów
zaburzeń psychotycznych (schizofrenii lub zaburzeń schizoafektywnych) określono w próbie klinicznej z okresem obserwacji wynoszącym 12 tygodni, z grupą kontrolną placebo, z udziałem dorosłych pacjentów z psychozą, leczonych w szpitalu i ambulatoryjnie, którzy spełniali kryteria rozpoznania schizofrenii według DSM-IV.
W trwającym 12 tygodni badaniu porównawczym, z udziałem pacjentów ze schizofrenią
o stabilnym przebiegu, wykazano równą skuteczność produktu leczniczego Rispolept Consta oraz rysperydonu w postaci tabletek doustnych. Skuteczność i bezpieczeństwo długotrwałego stosowania (50 tygodni) produktu leczniczego Rispolept Consta określono także w badaniu otwartym z udziałem pacjentów z psychozą o stabilnym przebiegu, leczonych w szpitalu
i ambulatoryjnie, którzy spełniali kryteria rozpoznania schizofrenii lub zaburzeń schizoafektywnych według DSM-IV. Podczas długotrwałego stosowania produktu leczniczego Rispolept Consta skuteczność się utrzymywała (Rycina 1).
Średnia
Rycina 1. Średni wynik całkowitej punktacji w Skali Objawów Pozytywnych i Negatywnych (ang. Possitive and Negative Syndrome Scale, PANSS) w czasie, u pacjentów ze schizofrenią, wyznaczony metodą ekstrapolacji ostatniej obserwacji (ang. Last Observation Carried Forward, LOCF).
90
Placebo RIS 25 mg
RIS 50 mg
85
80
75
70
65
Początkowo
2
4
6
Tygodnie
8
10
12
Punkt końcowy
Wyjśc
Tygod
Endpt
Wchłanianie
Wchłanianie rysperydonu z produktu leczniczego Rispolept Consta jest całkowite.
Po wstrzyknięciu domięśniowym pojedynczej dawki produktu leczniczego Rispolept Consta, profil uwalniania leku składa się z początkowego uwolnienia małej dawki leku (< 1% dawki), potem następuje okres latencji trwający 3 tygodnie. Główne uwalnianie rysperydonu zaczyna się po 3 tygodniach, trwa od 4. do 6. tygodnia i kończy się w 7. tygodniu. Dlatego też, w okresie pierwszych 3 tygodni stosowania produktu leczniczego Rispolept Consta, należy podawać uzupełniające leki przeciwpsychotyczne w postaci doustnej (patrz punkt 4.2).
Uzależnienie schematu dawkowania (wstrzyknięcie domięśniowe, co dwa tygodnie) od profilu uwalniania zapewnia utrzymywanie się stężenia terapeutycznego leku w osoczu od 4 do
6 tygodni od ostatniego wstrzyknięcia produktu leczniczego Rispolept Consta.
Po wielokrotnych domięśniowych wstrzyknięciach produktu leczniczego Rispolept Consta w dawce 25 mg lub 50 mg co dwa tygodnie, mediana minimalnego stężenia przed podaniem
kolejnej dawki oraz stężenia maksymalnego czynnej frakcji przeciwpsychotycznej leku wahała się, odpowiednio, w zakresie 9,9–19,2 ng/ml oraz 17,9–45,5 ng/ml. Nie obserwowano kumulacji rysperydonu podczas długotrwałego stosowania leku (12 miesięcy) u pacjentów, którym podawano lek w postaci wstrzyknięć w dawce od 25 mg do 50 mg co dwa tygodnie.
W powyżej opisanych badaniach podawano lek we wstrzyknięciach do mięśnia pośladkowego. Wstrzyknięcia leku w tych samych dawkach do mięśni naramiennego i pośladkowego są biorównoważne i w związku z tym mogą być stosowane zamiennie.
Dystrybucja
Dystrybucja rysperydonu przebiega szybko. Objętość dystrybucji wynosi 1–2 l/kg mc. W osoczu rysperydon wiąże się z albuminami i kwaśną glikoproteiną alfa 1. Rysperydon w osoczu jest
związany z białkami w 90%, a 9-hydroksyrysperydon w 77%. Metabolizm i eliminacja
Rysperydon jest metabolizowany przez cytochrom CYP2D6 do 9-hydroksyrysperydonu, który ma podobne właściwości farmakologiczne do właściwości rysperydonu. Rysperydon i 9- hydroksyrysperydon tworzą aktywną frakcję przeciwpsychotyczną. CYP2D6 podlega polimorfizmowi genetycznemu. Osoby intensywnie metabolizujące z udziałem CYP2D6
zamieniają szybko rysperydon na 9-hydroksyrysperydon, podczas gdy osoby słabo
metabolizujące z udziałem CYP2D6 zamieniają go znacznie wolniej. Chociaż u osób intensywnie metabolizujących jest mniejsze stężenie rysperydonu, a większe stężenie 9-hydroksyrysperydonu niż u osób słabo metabolizujących, to farmakokinetyki rysperydonu i 9-hydroksyrysperydonu
łącznie (tzw. aktywna frakcja przeciwpsychotyczna), po podaniu dawki pojedynczej i dawek wielokrotnych, są podobne u osób intensywnie i słabo metabolizujących z udziałem CYP2D6.
Inną ścieżką metaboliczną rysperydonu jest N-dealkilacja. Badania in vitro przeprowadzone na ludzkich mikrosomach wątrobowych wykazały, że rysperydon, w klinicznie istotnych stężeniach, nie hamuje znacząco metabolizmu leków ulegających przemianom katalizowanym przez izoenzymy cytochromu P450, w tym CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 i CYP3A5. W okresie tygodnia od chwili podania doustnego, 70% dawki jest wydalane z moczem, a 14% z kałem. W moczu, rysperydon oraz 9-hydroksyrysperydon stanowi 35-45% dawki podanej doustnie. Pozostała część to niewykazujące aktywności metabolity.
Faza eliminacji kończy się około 7 do 8 tygodni po ostatnim wstrzyknięciu produktu leczniczego Rispolept Consta.
Liniowość
Właściwości farmakokinetyczne rysperydonu charakteryzują się liniowością w zakresie dawek 25 mg-50 mg, wstrzykiwanych co 2 tygodnie.
Osoby w podeszłym wieku, osoby z zaburzeniami czynności wątroby lub nerek
Badania farmakokinetyki, dotyczące jednorazowej dawki rysperydonu podanego doustnie, wykazały większe stężenia w osoczu o średnio 43%, dłuższy okres półtrwania o 38%
i zmniejszenie o 30% klirensu czynnej frakcji przeciwpsychotycznej u pacjentów w podeszłym wieku.
U dorosłych z umiarkowanymi zaburzeniami czynności nerek, klirens czynnej frakcji
przeciwpsychotycznej wynosił około 48% klirensu u młodych zdrowych dorosłych osób (zakres wieku 25-35 lat). U dorosłych z ciężkimi zaburzeniami czynności nerek, klirens czynnej frakcji przeciwpsychotycznej wynosił około 31% klirensu u młodych zdrowych dorosłych osób. Okres półtrwania czynnej frakcji przeciwpsychotycznej wynosił 16,7 godzin u młodych dorosłych, 24,9 godzin u dorosłych z umiarkowanymi zaburzeniami czynności nerek (lub był około 1,5 razy dłuższy niż u młodych dorosłych) oraz 28,8 godzin u osób z ciężkimi zaburzeniami czynności nerek (lub był około 1,7 razy dłuższy niż u młodych dorosłych). Stężenie rysperydonu w osoczu u pacjentów z niewydolnością wątroby było prawidłowe, jednak średnie stężenie wolnej frakcji rysperydonu w osoczu zwiększyło się u tych pacjentów o 37,1%.
Klirens i okres półtrwania w fazie eliminacji podanego doustnie rysperydonu i czynnej frakcji przeciwpsychotycznej u dorosłych z umiarkowanymi i ciężkimi zaburzeniami czynności wątroby nie różniły się znacząco od analogicznych parametrów u młodych zdrowych dorosłych osób.
Zależności farmakokinetyczno-farmakodynamiczne
Nie stwierdzono związku między stężeniami aktywnej frakcji przeciwpsychotycznej w osoczu,
a zmianami całkowitej punktacji skali PANSS (ang. Positive and Negative Syndrome Scale) oraz całkowitej punktacji skali ESRS (ang. Extrapyramidal Symptom Rating Scale), obserwowanymi podczas kolejnych wizyt w badaniach III fazy, których celem było określenie skuteczności
i bezpieczeństwa stosowania leku. Płeć, rasa i palenie tytoniu
Analiza farmakokinetyki w populacji nie wskazuje na widoczny wpływ płci, rasy lub nawyku palenia tytoniu na farmakokinetykę rysperydonu lub aktywnej frakcji przeciwpsychotycznej.
Podobnie jak w badaniach dotyczących długotrwałego działania toksycznego doustnych produktów zawierających rysperydon, przeprowadzonych na szczurach i psach, głównymi objawami działania produktu leczniczego Rispolept Consta (podawanego domięśniowo przez okres do 12 miesięcy) było indukowane prolaktyną pobudzenie gruczołów sutkowych, zmiany w układzie rozrodczym u samców i samic oraz zaburzenia ze strony ośrodkowego układu nerwowego, związane z aktywnością farmakodynamiczną rysperydonu. W badaniach toksykologicznych, przeprowadzanych na młodych szczurach, stwierdzano zwiększoną
śmiertelność i opóźnienie rozwoju u ich potomstwa. W 40-tygodniowym badaniu wystąpiło opóźnienie dojrzewania płciowego u młodych psów. Na podstawie pola pod krzywą (AUC) nie stwierdzono zaburzenia wzrostu kości długich u psów przy narażeniu 3,6 razy większym od maksymalnej ekspozycji u młodzieży (1,5 mg/dobę), natomiast u młodzieży, w przypadku ekspozycji 15 razy większej od maksymalnej ekspozycji na lek, zaobserwowano wpływ na kości długie i dojrzewanie płciowe.
Rysperydon nie wykazywał działania teratogennego u szczurów ani u królików. W badaniach nad rozmnażaniem u szczurów pod wpływem rysperydonu, działania niepożądane dotyczyły
zachowań rodziców podczas kojarzenia się oraz masy urodzeniowej i przeżywalności potomstwa. U szczurów, ekspozycja na rysperydon w okresie płodowym wiązała się z deficytami funkcji
poznawczych u zwierząt dorosłych. Inne środki będące antagonistami dopaminy, podane
ciężarnym zwierzętom, negatywnie oddziaływały na uczenie się i rozwój ruchowy potomstwa.
Podawanie produktu leczniczego Rispolept Consta samcom i samicom szczurów przez 12 i 24 miesięcy, w dawce 40 mg/kg mc. przez 2 tygodnie, spowodowało wystąpienie
osteodystrofii. Dawka produktu powodująca osteodystrofię u szczurów, w przeliczeniu na mg/m2 powierzchni ciała, była ośmiokrotnie większa od maksymalnej dawki zalecanej u ludzi i wiązała się z dwukrotnie większym stężeniem rysperydonu w osoczu w porównaniu do maksymalnego stężenia w osoczu u ludzi, które jest przewidywane po podaniu maksymalnej zalecanej dawki produktu. Nie zaobserwowano osteodystrofii u psów, u których przez 12 miesięcy stosowano produkt leczniczy Rispolept Consta w dawce do 20 mg/kg mc. przez 2 tygodnie. Podanie tej dawki wiązało się z osiągnięciem stężenia leku w osoczu, które było 14-krotnie większe od
stężenia u ludzi po podaniu maksymalnej zalecanej dawki produktu.
Nie odnotowano żadnych danych wskazujących na potencjalne działanie genotoksyczne leku.
Zgodnie z oczekiwaniami względem silnie działającego antagonisty receptorów dopaminergicznych D2, w badaniach działania rakotwórczego na szczurach i myszach,
stwierdzano zwiększenie częstości występowania gruczolaków przysadki (u myszy), hormonalnie czynnych gruczolaków trzustki (u szczurów) i gruczolaków gruczołów sutkowych (u obu gatunków).
W badaniu działania rakotwórczego na szczurach szczepu Wistar (podszczep Hannover) po podaniu domięśniowym produktu leczniczego Rispolept Consta (w dawkach 5 lub 40 mg/kg m c. przez 2 tygodnie), w dawce 40 mg/kg mc. obserwowano większą częstość hormonalnie czynnych guzów trzustki, przysadki mózgowej i rdzenia nadnerczy, a po podaniu leku w dawkach 5 lub
40 mg/kg mc. stwierdzono większą częstość guzów gruczołów sutkowych. Guzy te, stwierdzane po podawaniu leku doustnie i domięśniowo, mogą być związane z przedłużonym zablokowaniem receptora dopaminergicznego D2 oraz z hiperprolaktynemią. Badania na hodowlach tkankowych wskazują, że rozwój komórek w ludzkich guzach piersi może być stymulowany przez prolaktynę. Hiperkalcemia obserwowana w obu grupach dawkowych szczurów, otrzymujących produkt leczniczy Rispolept Consta, mogła przyczynić się do zwiększenia częstości występowania guzów rdzenia nadnerczy. Nie ma dowodów na to, że hiperkalcemia może powodować powstawanie guzów chromochłonnych (phaeochromocytoma) u ludzi.
Gruczolaki cewkowe nerek występowały u samców szczura, którym podawano Rispolept Consta w dawce 40 mg/kg mc. przez 2 tygodnie. Guzy nerek nie występowały w grupach kontrolnych po podaniu małej dawki produktu, roztworu 0,9% NaCl, ani po podaniu nośnika w postaci mikrosfer. Mechanizm powstawania nowotworów nerek u samców szczurów szczepu Wistar (podszczep Hannover), którym podawano produkt leczniczy Rispolept Consta, nie jest znany.
Wzrost częstości nowotworów nerek wywołanych terapią nie został potwierdzony w badaniach rakotwórczości po podaniu doustnym u szczurów szczepu Wistar (podszczep Wiga) ani u myszy szczepu Swiss. Badania różnic międzyosobniczych w zakresie profilu narządów zaatakowanych przez nowotwór sugerują, że szczury podszczepu Wistar (podszczep Hannover) użyte w badaniu rakotwórczości, różnią się w sposób znaczący od szczurów szczepu Wistar (podszczep Wiga) użytych w badaniu rakotwórczości jamy ustnej, jeśli chodzi o związane z wiekiem, samoistnie
zachodzące w nerkach zmiany o charakterze nienowotworowym, wzrost stężenia prolaktyny w surowicy, jak również zmiany w nerkach, w reakcji na rysperydon. Brak danych wskazujących na powodowanie zmian związanych z nerkami u psów długotrwale leczonych produktem leczniczym Rispolept Consta.
Znaczenie wystąpienia osteodystrofii, guzów związanych z wpływem leku na wydzielanie prolaktyny i przypuszczalnie swoistych dla szczurów guzów nerek ,w odniesieniu do ryzyka u ludzi jest nieznane.
U szczurów i psów, po podaniu dużych dawek produktu leczniczego Rispolept Consta, obserwowano podrażnienie w miejscu wstrzyknięcia. W trwającym 24 miesiące badaniu rakotwórczości u szczurów nie stwierdzono zwiększenia zapadalności na guzy w miejscu wstrzyknięcia domięśniowego, ani w grupie otrzymującej lek, ani w grupie kontrolnej.
Modele zwierzęce in vitro i in vivo wykazały, że duże dawki rysperydonu mogą powodować wydłużenie odstępu QT, teoretycznie zwiększającego u pacjentów ryzyko częstoskurczu komorowego typu torsade de pointes.
Proszek
Polimer 7525 DL JN1[poli(D,L-laktydo-ko-glikolid)].
Rozpuszczalnik
Polisorbat 20,
Karmeloza sodowa 40 mPas, Disodu wodorofosforan dwuwodny, Kwas cytrynowy bezwodny,
Sodu chlorek,
Sodu wodorotlenek, Woda do wstrzykiwań.
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 6.6.
3 lata w temperaturze 2 - 8°C.
Po przygotowaniu zawiesiny: wykazano stabilność chemiczną i fizyczną sporządzonego produktu przez okres 24 godzin w temperaturze 25ºC.
Z mikrobiologicznego punktu widzenia produkt powinien być podawany natychmiast po sporządzeniu. Jeśli nie jest niezwłocznie użyty, odpowiedzialność za okres i warunki przechowywania ponosi użytkownik. Sporządzoną zawiesinę można przechowywać nie dłużej niż 6 godzin w temperaturze 25ºC, chyba że przygotowanie zawiesiny przeprowadzono
w kontrolowanych i zwalidowanych warunkach aseptycznych.
Przechowywać w lodówce (2ºC do 8ºC).
Poza lodówką produkt leczniczy Rispolept Consta może być przechowywany w temperaturze poniżej 25°C, maksymalnie przez 7 dni przed podaniem.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Warunki przechowywania produktu leczniczego po sporządzeniu, patrz punkt 6.3.
Urządzenie z bezigłowym dostępem do fiolki
Rispolept Consta dostępny jest w opakowaniu zawierającym 1 zestaw lub opakowaniu zbiorczym zawierającym 5 zestawów.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Ważna informacja
W celu zapewnienia pomyślnego podania produktu leczniczego Rispolept Consta, należy uważnie (krok po kroku) zapoznać się z „Instrukcją użytkowania urządzenia”.
Używać wyłącznie składników zestawu
Składniki tego zestawu są przeznaczone specjalnie do stosowania z produktem leczniczym Rispolept Consta. Do przygotowania zawiesiny produktu leczniczego Rispolept Consta musi być użyty wyłącznie rozpuszczalnik znajdujący się w opakowaniu.
Nie wolno zastępować ŻADNEGO ze składników zestawu znajdującego się w opakowaniu.
Nie przechowywać zawiesiny po jej sporządzeniu
Należy podać zawiesinę tak szybko po sporządzeniu, jak to możliwe, aby uniknąć sedymentacji.
Właściwe podawanie
Musi być podana cała zawartość fiolki, aby pacjent otrzymał właściwą dawkę produktu leczniczego Rispolept Consta.
Urządzenie do jednorazowego użytku
Nie używać powtórnie
Aby wyroby medyczne działały zgodnie z przeznaczeniem, wymagane są określone właściwości materiałowe. Właściwości te zostały sprawdzone tylko dla jednorazowego użycia. Wszelkie próby ponownego wykorzystania urządzenia mogą prowadzić do jego uszkodzenia lub
pogorszenia działania.
Zawartość opakowania
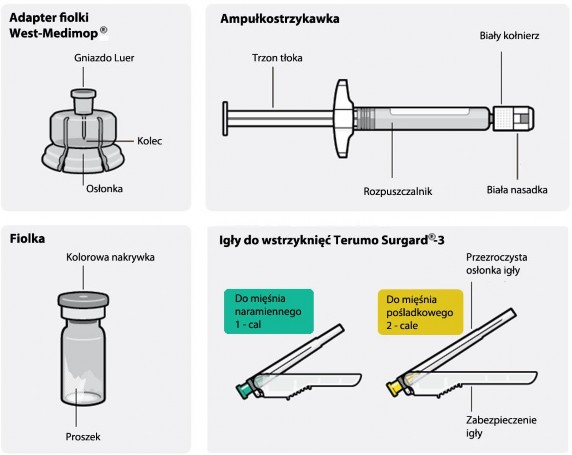
Krok 1 | Montaż zestawu |
Wyjąć opakowanie Połączyć fiolkę z adapterem
Należy odczekać 30 minut Przed sporządzeniem zawiesiny wyjąć opakowanie produktu Rispolept Consta z lodówki i pozostawić na nie mniej niż 30 minut. Nie podgrzewać w żaden sposób. |
Usunąć nakrywkę z fiolki Oderwać kolorową nakrywkę z fiolki. Przetrzeć z góry gumowy szary korek gazikiem nasączonym alkoholem. Pozostawić do wyschnięcia. Nie zdejmować szarego gumowego korka. |
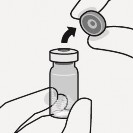
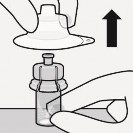
Przygotować adapter fiolki Uchwycić sterylny blister, jak pokazano. Oderwać i usunąć papier zaklejający blister. Nie wyjmować adaptera z blistra. Nigdy nie dotykać kolca. Spowoduje to jego zanieczyszczenie. |
Połączyć adapter z fiolką Postawić fiolkę na twardej powierzchni i trzymać u podstawy. Ustawić adapter centralnie nad szarym gumowym korkiem. Wcisnąć adapter prosto w dół, aż mocno zaciśnie się na szczycie fiolki. Nie zakładać adaptera na fiolkę pod kątem, gdyż może dojść do wycieku rozpuszczalnika podczas wprowadzania go do fiolki. Nieprawidłowo |

Połączenie ampułkostrzykawki z adapterem
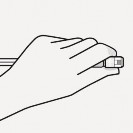
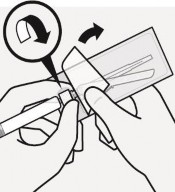
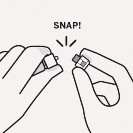
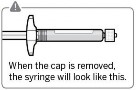
Usunąć sterylny blister Adapter można wyciągnąć ze sterylnego blistra tylko, gdy jest się przygotowanym do usunięcia białej nasadki z ampułkostrzykawki Trzymać fiolkę pionowo, aby zapobiec wyciekowi. Trzymając fiolkę za podstawę, pociągnąć i zdjąć sterylny blister. Nie wstrząsać. Nie dotykać odkrytego gniazda luer w adapterze. Spowoduje to jego zanieczyszczenie. |
Prawidłowo uchwycić ampułkostrzykawkę Trzymać za biały kołnierz na końcu ampułkostrzykawki. Nie trzymać za szklany cylinder podczas łączenia. Nieprawidłowo | Trzask ! Usunąć nasadkę Trzymając za biały kołnierz odłamać białą nasadkę. Nie odkręcać ani nie odcinać białej nasadki. Nie dotykać końcówki ampułkostrzykawki. Spowoduje to jej zanieczyszczenie. Wygląd ampułkostrzykawki po zdjęciu nasadki Odłamaną nasadkę można wyrzucić. |
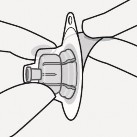
Połączyć ampułkostrzykawkę z adapterem Trzymać stabilnie adapter za osłonkę. Trzymając ampułkostrzykawkę za biały kołnierz włożyć jej koniec do gniazda luer w adapterze. Nie trzymać za szklany cylinder ampułkostrzykawki. Może to spowodować poluzowanie lub odłączenie się białego kołnierza. Połączyć ampułkostrzykawkę z adapterem, przykręcając ją zgodnie z ruchem wskazówek zegara, aż połączenie będzie pewne. Nie dokręcać zbyt forsownie. Zbyt mocne wkręcanie może spowodować uszkodzenie końcówki ampułkostrzykawki. |
Krok 2 | Sporządzanie zawiesiny |
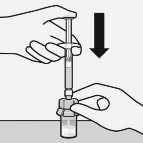
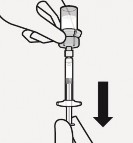
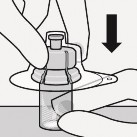
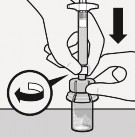
Wstrzyknąć rozpuszczalnik
Wstrzyknąć do fiolki cały rozpuszczalnik zawarty
Zawartość fiolki będzie teraz pod ciśnieniem.
Należy trzymać wciśnięty tłok kciukiem

w ampułkostrzykawce.
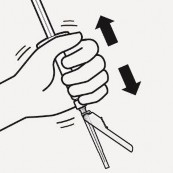
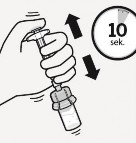
Rozproszyć proszek w rozpuszczalniku Wstrząsać energicznie przez co najmniej 10 sekund trzymając wciśnięty tłok, jak pokazano.
Obejrzeć zawiesinę.
Zawiesina prawidłowo
wymieszana będzie jednorodna, gęsta
i mleczna w kolorze. Proszek będzie widoczny w płynie. Natychmiast przejść do następnego etapu, aby zawiesina nie uległa sedymentacji.
Przenieść zawiesinę do
ampułkostrzykawki Obrócić fiolkę do góry dnem. Powoli
ciągnąć za tłok, by pobrać z fiolki do
ampułkostrzykawki całą objętość zawiesiny.
Usunąć adapter fiolki
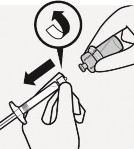
Trzymając za biały kołnierz
ampułkostrzykawki należy odkręcić
ampułkostrzykawkę od adaptera.
Oderwać część etykiety z fiolki
w miejscu perforacji i nakleić oderwaną naklejkę na
ampułkostrzykawkę, dla celów identyfikacyjnych.
Usunąć zarówno fiolkę, jak i adapter we właściwy sposób.
Krok 3 | Dołączenie igły | |||
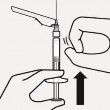
Do mięśnia Do mięśnia naramiennego pośladkowego 1 - cal 2 - cale Wybrać odpowiednią igłę Wybrać igłę w zależności od miejsca wstrzyknięcia (w mięsień pośladkowy lub naramienny). |
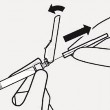
Dołączyć igłę Rozerwać częściowo blister i chwycić podstawę igły, jak pokazano. Trzymając ampułkostrzykawkę za biały kołnierz, połączyć ją z gniazdem luer w igle wkręcając zgodnie z ruchem wskazówek zegara, aż połączenie będzie pewne. Nie dotykać gniazda luer w igle. Spowoduje to zanieczyszczenie. |
Ponownie wymieszać zawiesinę Usunąć całkowicie blister. Bezpośrednio przed wstrzyknięciem należy wstrząsnąć ponownie ampułkostrzykawką, gdyż może pojawić się osad. | ||
Do mięśnia Do mięśnia
naramiennego pośladkowego
1 - cal 2 - cale

Krok 4 Wstrzyknięcie dawki
Następnie
Zdjąć
przezroczystą osłonkę z igły Odgiąć
zabezpieczenie igły w kierunku
ampułkostrzykawki, jak pokazano.
Trzymając
ampułkostrzykawkę za biały kołnierz,
zdjąć przezroczystą osłonkę z igły.
Nie przekręcać osłonki, ponieważ połączenie typu luer mogłoby się obluzować.
Usunąć pęcherzyki powietrza
Trzymając
ampułkostrzykawkę igłą do góry, delikatnie postukać, aby pęcherzyki powietrza
przemieściły się do ujścia
ampułkostrzykawki. Usunąć powietrze przez ostrożne
i powolne naciśnięcie tłoka.
Wstrzyknąć Niezwłocznie wstrzyknąć całą zawartość
ampułkostrzykawki w wybrany mięsień (pośladkowy lub naramienny) pacjenta (domięśniowo – im.).
Wstrzyknięcia w mięsień
pośladkowy należy dokonać w górny
zewnętrzny
kwadrant pośladka. Nie podawać dożylnie.
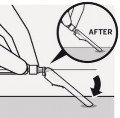
Zabezpieczyć igłę
Trzymając
ampułkostrzykawkę jedną ręką, oprzeć
zabezpieczenie igły o płaską twardą powierzchnię pod kątem 45 stopni.
Wcisnąć igłę w zabezpieczenie szybkim, zdecydowanym ruchem, tak by
całkowicie w nim się schowała.
Unikać zakłucia się igłą:
Nie używać dwóch rąk.
Nie odłączać umyślnie
zabezpieczenia igły ani niewłaściwie się z nim obchodzić.
Nie próbować prostować igły ani zakładać na nią zabezpieczenia, gdy igła jest skrzywiona lub uszkodzona.
Usunąć we właściwy sposób Należy sprawdzić, czy igła jest
całkowicie zamknięta
w zabezpieczeniu igły.
Usunąć do specjalnego pojemnika na zużyte środki medyczne.
Usunąć również drugą,
niewykorzystaną igłę dostarczoną w opakowaniu.
Janssen-Cilag International NV Turnhoutseweg 30
B-2340 Beerse Belgia
Rispolept Consta, 25 mg - 10582
Rispolept Consta, 37,5 mg - 10581
Rispolept Consta, 50 mg - 10580
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: Rispolept Consta, 25 mg: 22 maja 2007
Rispolept Consta, 37,5 mg: 29 kwietnia 2004
Rispolept Consta, 50 mg: 29 kwietnia 2004
Data ostatniego przedłużenia pozwolenia:
Rispolept Consta, 25 mg, 37,5 mg, 50 mg: 23 lipca 2018
09.04.2021