Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania Dawkowanie
Przeciwwskazania
z rakiem gruczołu krokowego zależnego od androgenów oraz rakiem gruczołu sutkowego
z nowotworami wątroby występujących obecnie lub w przeszłości,
z nadwrażliwością na substancję czynną lub na którąkolwiek substancję pomocniczą (patrz punkt 6.1).
Stosowanie produktu Nebido jest przeciwwskazane u kobiet.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Nebido, 1000 mg/4 ml, roztwór do wstrzykiwań
Każdy mililitr roztworu do wstrzykiwań zawiera 250 mg testosteronu undecylanu (Testosteroni undecanoas), co odpowiada 157,9 mg testosteronu.
Każda ampułka / fiolka z 4 ml roztworu do wstrzykiwań zawiera 1000 mg testosteronu undecylanu, co odpowiada 631,5 mg testosteronu.
Substancja pomocnicza o znanym działaniu:
2000 mg benzylu benzoesanu na ampułkę / fiolkę. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań.
Przejrzysty, bezbarwny do żółtawo-brązowego roztwór olejowy.
Testosteronowa terapia zastępcza w hipogonadyzmie męskim, gdy niedobór testosteronu jest potwierdzony przez objawy kliniczne i badania biochemiczne (patrz punkt 4.4).
Jedną ampułkę / fiolkę produktu Nebido (odpowiadającą 1000 mg testosteronu undecylanu) wstrzykuje się co 10 do 14 tygodni. Wstrzyknięcia wykonywane z taką częstością pozwalają utrzymać wystarczające stężenie testosteronu i nie prowadzą do kumulacji.
Rozpoczęcie leczenia
Przed rozpoczęciem leczenia i we wstępnej jego fazie należy oznaczać stężenie testosteronu w osoczu. W zależności od stężenia testosteronu w osoczu i objawów klinicznych, pierwszy odstęp między wstrzyknięciami można skrócić do minimalnie 6 tygodni, przy zalecanych odstępach od 10 do 14 tygodni w leczeniu podtrzymującym. Po takiej dawce nasycającej można szybciej uzyskać wystarczające stężenie testosteronu w stanie stacjonarnym.
Leczenie podtrzymujące i indywidualizacja leczenia
Odstępy między wstrzyknięciami powinny się mieścić w zalecanym zakresie od 10 do 14 tygodni. Podczas leczenia podtrzymującego należy uważnie monitorować stężenia testosteronu w osoczu. Zaleca się regularne oznaczanie stężeń testosteronu w osoczu. Oznaczenia należy wykonywać pod koniec przerwy między wstrzyknięciami, oceniając objawy kliniczne. Stężenia testosteronu powinny się mieścić w dolnej jednej trzeciej zakresu normy. Stężenia poniżej zakresu normy wskazują na potrzebę skrócenia przerwy między wstrzyknięciami. W przypadku wysokich stężeń w osoczu można rozważyć wydłużenie przerw.
Szczególne grupy pacjentów
Dzieci i młodzież
Produktu leczniczego Nebido nie należy stosować u dzieci i młodzieży. Brak dostępnych danych klinicznych u mężczyzn w wieku poniżej 18 lat (patrz punkt 4.4).
Pacjenci w podeszłym wieku
Na podstawie ograniczonych danych dotyczących stosowania Nebido u pacjentów w podeszłym wieku wnioskuje się, że nie ma potrzeby zmiany dawkowania (patrz punkt 4.4).
Pacjenci z zaburzeniami czynności wątroby
Nie przeprowadzono badań u pacjentów z zaburzeniami czynności wątroby. Stosowanie Nebido jest przeciwwskazane u pacjentów z nowotworem wątroby występującym obecnie lub w przeszłości (patrz punkt 4.3).
Pacjenci z zaburzeniami czynności nerek
Nie przeprowadzono badań u pacjentów z zaburzeniami czynności nerek.
Sposób podawania
Podawanie domięśniowe
Wstrzyknięcia należy wykonywać bardzo powoli (przez dwie minuty). Nebido musi być wstrzykiwany wyłącznie domięśniowo. Należy zadbać, aby wstrzykiwać Nebido głęboko do mięśnia pośladkowego, zachowując zwykłe środki ostrożności jak przy podawaniu domięśniowym. Należy zwrócić szczególną uwagę, aby nie podać produktu donaczyniowo (patrz punkt 4.4, sekcja „Sposób podawania”). Zawartość ampułki / fiolki powinna zostać wstrzyknięta domięśniowo natychmiast po jej otwarciu. (Dla ampułki patrz punkt 6.6 “Wskazówki dotyczące przygotowania/otwierania ampułki OPC (One-Point-Cut)”).
Stosowanie produktu Nebido jest przeciwwskazane u mężczyzn:
Nie zaleca się stosowania Nebido u dzieci i młodzieży.
Nebido należy stosować tylko wtedy, gdy przed rozpoczęciem leczenia wykazano hipogonadyzm (hiper- lub hipogonadotropowy) i wykluczono inną etiologię objawów. Na niedobór testosteronu powinny jasno wskazywać objawy kliniczne (regresja drugorzędowych cech płciowych, zmiana budowy ciała, astenia, osłabienie libido, zaburzenia erekcji, itp.); należy go potwierdzić dwoma niezależnymi pomiarami stężenia testosteronu we krwi.
Pacjenci w podeszłym wieku
Istnieje ograniczone doświadczenie dotyczące bezpieczeństwa i skuteczności ze stosowaniem Nebido u pacjentów w wieku, powyżej 65 lat. Aktualnie nie ma konsensusu dotyczącego swoistych dla wieku wartości referencyjnych stężenia testosteronu. Należy jednak wziąć pod uwagę, że fizjologiczne stężenie testosteronu w surowicy zmniejsza się wraz z wiekiem.
Badanie lekarskie i testy laboratoryjne
Badanie lekarskie
Przed rozpoczęciem leczenia testosteronem, każdego pacjenta należy poddać szczegółowemu badaniu, aby wykluczyć raka gruczołu krokowego. U pacjentów leczonych testosteronem należy starannie
i regularnie wykonywać badania gruczołu krokowego i sutków, zgodnie z zalecanym sposobem postępowania (badanie per rectum, oznaczanie PSA). Należy je przeprowadzać przynajmniej raz
w roku, a u pacjentów w wieku podeszłym i obciążonych zwiększonym ryzykiem (czynniki kliniczne i rodzinne), dwa razy w roku. Należy wziąć pod uwagę lokalne wytyczne dotyczące monitorowania bezpieczeństwa podczas testosteronowej terapii zastępczej.
Testy laboratoryjne
Należy monitorować stężenie testosteronu na początku i regularnie podczas leczenia. Lekarze powinni indywidualnie dostosowywać dawkowanie w celu zapewnienia stężenia testosteronu występującego podczas prawidłowej czynności gonad. U pacjentów otrzymujących długoterminowe leczenie androgenami należy również regularnie monitorować następujące parametry laboratoryjne: hemoglobinę, hematokryt, testy czynnościowe wątroby i profil lipidowy (patrz punkt 4.8).
Z powodu zmienności wyników laboratoryjnych, wszystkie pomiary stężenia testosteronu należy przeprowadzać w tym samym laboratorium.
Nowotwory
Androgeny mogą przyspieszyć progresję utajonego raka gruczołu krokowego i łagodnego rozrostu gruczołu krokowego.
Należy zachować ostrożność, stosując produkt Nebido u pacjentów z rakiem, którzy są zagrożeni hiperkalcemią (i następczą hiperkalcynurią) z powodu przerzutów do kości. Zaleca się regularne monitorowanie stężenia wapnia w osoczu u tych pacjentów.
Stwierdzono przypadki łagodnych i złośliwych nowotworów wątroby u pacjentów otrzymujących androgenne substancje hormonalne. W przypadku wystąpienia poważnych dolegliwości
w nadbrzuszu, powiększenia wątroby lub wystąpienia objawów krwawienia w obrębie jamy brzusznej u mężczyzn stosujących Nebido, należy rozważyć wykonanie diagnostyki różnicowej w celu wykluczenia nowotworu wątroby.
Niewydolność serca, wątroby lub nerek
U pacjentów z ciężką niewydolnością serca, wątroby lub nerek lub chorobą niedokrwienną serca, leczenie testosteronem może spowodować poważne powikłania w postaci obrzęków, przebiegających z zastoinową niewydolnością serca lub bez niej. W takim przypadku należy natychmiast przerwać leczenie.
Niewydolność wątroby lub nerek
Nie prowadzono badań, które miałyby wykazać skuteczność i bezpieczeństwo tego produktu
u chorych z zaburzoną czynnością nerek lub wątroby. Dlatego należy zachować ostrożność stosując testosteronową terapię zastępczą u tych pacjentów.
Niewydolność serca
Należy zachować ostrożność u pacjentów ze skłonnością do obrzęków np. w przypadku ciężkiej niewydolności serca, wątroby lub nerek, albo choroby niedokrwiennej serca, gdyż leczenie androgenami może spowodować zwiększenie retencji sodu i wody. W przypadku wystąpienia ciężkich powikłań charakteryzujących się obrzękiem, z lub bez zastoinowej niewydolności serca, leczenie należy natychmiast przerwać (patrz punkt 4.8). Testosteron może powodować zwiększenie ciśnienia tętniczego krwi, dlatego produkt Nebido należy stosować z zachowaniem ostrożności u mężczyzn z nadciśnieniem.
Zaburzenia krzepnięcia krwi
Należy zawsze pamiętać o ograniczeniach stosowania wstrzyknięć domięśniowych u pacjentów z nabytymi lub wrodzonymi zaburzeniami krwawienia.
Stwierdzono, że testosteron i jego pochodne nasilają działanie doustnych leków przeciwzakrzepowych z grupy pochodnych kumaryny (patrz również punkt 4.5).
Należy zachować ostrożność podczas stosowania testosteronu u pacjentów z trombofilią lub czynnikami ryzyka żylnej choroby zakrzepowo-zatorowej (VTE), ponieważ wyniki badań po wprowadzeniu do obrotu oraz publikowane dane wykazały występowanie u tych pacjentów podczas leczenia testosteronem incydentów zakrzepowych (np. zakrzepicy żył głębokich, zatorowości płucnej, zakrzepicy w oku). U pacjentów z trombofilią notowano przypadki VTE nawet podczas leczenia przeciwzakrzepowego, dlatego po wystąpieniu pierwszego zdarzenia zakrzepowego należy dokładnie rozważyć kontynuowanie leczenia testosteronem. Jeśli leczenie będzie kontynuowane, należy podjąć dalsze działania w celu minimalizacji u danego pacjenta ryzyka wystąpienia VTE.
Inne stany
Należy zachować ostrożność, stosując produkt Nebido u pacjentów z padaczką i migreną, ponieważ może dojść do zaostrzenia tych stanów.
U pacjentów leczonych androgenami, u których po terapii zastępczej dochodzi do normalizacji stężeń testosteronu w osoczu, może nastąpić poprawa wrażliwości na insulinę. Dlatego może być konieczne zmniejszenie dawki leków hipoglikemizujących.
Niektóre objawy kliniczne takie, jak: drażliwość, nerwowość, zwiększenie masy ciała, przedłużone lub częste erekcje, mogą wskazywać na nadmierną ekspozycję na androgeny, wymagającą zmiany dawkowania.
Może dojść do nasilenia wcześniej istniejącego bezdechu sennego.
Sportowców leczonych substytucyjnie testosteronem z powodu pierwotnego lub wtórnego hipogonadyzmu męskiego, należy poinformować, że ten produkt zawiera substancję czynną, która może dawać dodatni wynik w testach antydopingowych.
Androgeny nie są odpowiednim środkiem do przyspieszania rozwoju mięśni u osób zdrowych ani do wzmacniania sprawności fizycznej.
Jeżeli objawy nadmiaru androgenów utrzymują się lub nawracają podczas stosowania zalecanych dawek, należy całkowicie odstawić produkt Nebido.
Nadużywanie produktu leczniczego i uzależnienie od produktu leczniczego
Testosteron był nadużywany zazwyczaj w dawkach przekraczających dawkę zalecaną w zarejestrowanym wskazaniu oraz w skojarzeniu z innymi anabolicznymi steroidami androgennymi. Nadużywanie testosteronu oraz innych anabolicznych steroidów androgennych może prowadzić do poważnych działań niepożądanych, w tym: zdarzeń sercowo-naczyniowych (w niektórych przypadkach zakończonych zgonem), zdarzeń wątrobowych i (lub) psychiatrycznych. Nadużywanie testosteronu może doprowadzić do uzależnienia oraz wystąpienia objawów z odstawienia po znacznym zmniejszeniu dawki lub nagłym przerwaniu stosowania. Nadużywanie testosteronu oraz innych anabolicznych steroidów androgennych wiąże się z poważnym zagrożeniem zdrowia i jest odradzane.
Sposób podawania
Jak wszystkie roztwory olejowe, produkt Nebido należy wstrzykiwać domięśniowo i bardzo powoli (przez dwie minuty). Mikrozatory płuc wywołane roztworem olejowym mogą rzadko prowadzić do wystąpienia takich objawów jak: kaszel, duszność, złe samopoczucie, nadmierne pocenie się, ból
w klatce piersiowej, zawroty głowy, parestezje, omdlenie. Reakcje te mogą pojawić się podczas wykonywania wstrzyknięcia lub bezpośrednio po nim i mają charakter odwracalny. Podczas każdego wstrzyknięcia produktu Nebido oraz bezpośrednio po nim, pacjenta należy obserwować, aby umożliwić wczesne stwierdzenie objawów, które mogą wskazywać na mikrozatorowość płucną (POME) wywołaną roztworem olejowym. Leczenie jest zazwyczaj wspomagające, np. przez dodatkowe podanie tlenu.
Po podaniu produktu Nebido obserwowano reakcje anafilaktyczne.
Informacje o substancjach pomocniczych
Ten produkt leczniczy zawiera 2000 mg benzylu benzoesanu w każdej ampułce / fiolce w pojemności 4 ml, co odpowiada 500 mg/ml.
Doustne leki przeciwzakrzepowe
Stwierdzono, że testosteron i jego pochodne zwiększają aktywność doustnych leków przeciwzakrzepowych pochodnych kumaryny. Pacjenci otrzymujący doustne leki przeciwzakrzepowe wymagają ścisłego monitorowania, zwłaszcza na początku i na końcu leczenia androgenami. Zaleca się częstsze określanie czasu protrombinowego oraz INR.
Inne interakcje
Jednoczesne podawanie testosteronu z hormonem adrenokortykotropowym (ACTH) lub kortykosteroidami może nasilać powstawanie obrzęków; z tego względu należy zachować ostrożność podając te substancje czynne, zwłaszcza u pacjentów z chorobami serca lub wątroby, albo ze skłonnością do obrzęków.
Interakcje w badaniach laboratoryjnych: androgeny mogą zmniejszać stężenia globuliny wiążącej tyroksynę, prowadząc do zmniejszenia stężeń całkowitego T4 i zwiększonego wychwytu T3 i T4 na żywicy. Jednak stężenia wolnych hormonów tarczycy mogą pozostać niezmienione i nie występują kliniczne objawy zaburzeń czynności tarczycy.
Płodność
Testosteronowa terapia zastępcza odwracalnie hamuje spermatogenezę (patrz punkt 4.8 oraz punkt 5.3).
Ciąża i karmienie piersią
Nebido nie jest wskazany do stosowania u kobiet i nie wolno go stosować u kobiet w ciąży lub matek karmiących (patrz punkt 4.3).
Nebido nie ma wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Zapoznając się z działaniami niepożądanymi związanymi ze stosowaniem androgenów, należy odnieść się także do punktu 4.4.
Podczas leczenia produktem Nebido najczęściej zgłaszanymi działaniami niepożądanymi są: trądzik oraz ból w miejscu wstrzyknięcia.
Mikrozatory płuc wywołane roztworem olejowym mogą, rzadko, prowadzić do wystąpienia takich objawów jak: kaszel, duszność, złe samopoczucie, nadmierne pocenie się, ból w klatce piersiowej, zawroty głowy, parestezje, omdlenie. Reakcje te mogą pojawić się podczas wykonywania wstrzyknięcia lub bezpośrednio po nim i mają charakter odwracalny. W badaniach klinicznych
(w ≥1/10 000 i < 1/1000 wstrzyknięć), jak również po wprowadzeniu produktu do obrotu występowały sytuacje, w których firma lub osoba zgłaszająca podejrzewała rozpoznanie mikrozatoru płuc wywołanego roztworem olejowym (patrz punkt 4.4).
Po podaniu produktu Nebido obserwowano reakcje anafilaktyczne.
Androgeny mogą przyspieszyć progresję utajonego raka gruczołu krokowego i łagodnego rozrostu gruczołu krokowego.
W tabeli 1 poniżej przedstawiono działania niepożądane zgodnie z klasyfikacją grup układowo- narządowych zgodnie z terminologią MedDRA (MedDRA SOCs) zgłaszane dla Nebido. Częstość występowania działań niepożądanych określono na podstawie danych z badań klinicznych
i zdefiniowano jako Często: (≥1/100 do <1/10), Niezbyt często: (≥1/1 000 do <1/100) i rzadko
( 1/10 000 do < 1/1000). Działania niepożądane pochodzą z sześciu badań klinicznych (N=422) i zostały ocenione jako przynajmniej możliwie związane przyczynowo ze stosowaniem produktu Nebido.
Tabelaryczne zestawienie działań niepożądanych
Tabela 1: Działania niepożądane zgodnie z klasyfikacją grup układowo-narządowych zgodnie
z terminologią MedDRA SOCs zebrane na podstawie danych z sześciu badań klinicznych, N=422 (100,0%), tj. mężczyźni z niedoczynnością gonad leczeni za pomocą domięśniowych wstrzyknięć 4 ml (N=302) oraz 3 ml (N=120) roztworu TU 250 mg/ml.
Klasyfikacja układów i narządów | Często ( 1/100 do < 1/10) | Niezbyt często ( 1/1 000 do <1/100) | Rzadko ( 1/10 000 do < 1/1000) |
Zaburzenia krwi i układu chłonnego | Policytemia Zwiększony hematokryt* Zwiększona liczba |
Klasyfikacja układów i narządów | Często ( 1/100 do < 1/10) | Niezbyt często ( 1/1 000 do <1/100) | Rzadko ( 1/10 000 do < 1/1000) |
erytrocytów* Zwiększone stężenie hemoglobiny* | |||
Zaburzenia układu immunologicznego | Reakcja nadwrażliwości | ||
Zaburzenia metabolizmu i odżywiania | Zwiększenie masy ciała | Zwiększenie apetytu Zwiększone stężenie hemoglobiny glikozylowanej Hipercholesterolemia Zwiększone stężenie triglicerydów we krwi Zwiększone stężenie cholesterolu we krwi | |
Zaburzenia psychiczne | Depresja Zaburzenia emocjonalne Bezsenność Niepokój Agresja Drażliwość | ||
Zaburzenia układu nerwowego | Ból głowy Migrena Drżenie | ||
Zaburzenia naczyniowe | Uderzenia gorąca | Zaburzenia sercowo- naczyniowe Nadciśnienie Zawroty głowy | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Zapalenie oskrzeli Zapalenie zatok Kaszel Duszność Chrapanie Dysfonia | ||
Zaburzenia żołądka i jelit | Biegunka Nudności |
Klasyfikacja układów i narządów | Często ( 1/100 do < 1/10) | Niezbyt często ( 1/1 000 do <1/100) | Rzadko ( 1/10 000 do < 1/1000) |
Zaburzenia wątroby i dróg żółciowych | Nieprawidłowe wyniki testów czynnościowych wątroby Zwiększona aktywność aminotransferazy asparaginowej | ||
Zaburzenia skóry i tkanki podskórnej | Trądzik | Łysienie Rumień Wysypka 1 Świąd Sucha skóra | |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Ból stawów Ból kończyny Zaburzenia mięśniowe2 Sztywność mięśni szkieletowych Zwiększenie aktywności fosfokinazy kreatynowej | ||
Zaburzenia nerek i dróg moczowych | Zmniejszony wypływ moczu Zatrzymanie moczu Zaburzenie czynności układu moczowego Oddawanie moczu w nocy Bolesne lub utrudnione oddawanie moczu | ||
Zaburzenia układu rozrodczego i piersi | Zwiększone stężenie swoistego antygenu sterczowego Nieprawidłowy wynik badania gruczołu krokowego Łagodny rozrost gruczołu krokowego | Dysplazja gruczołu krokowego Stwardnienie gruczołu krokowego Zapalenie gruczołu krokowego Zaburzenie czynności gruczołu krokowego Zaburzenia libido Ból jąder Stwardnienie piersi Ból piersi Ginekomastia Zwiększone stężenie estradiolu Zwiększone stężenie testosteronu we krwi | |
Zaburzenia ogólne i stany w miejscu podania | Różne rodzaje reakcji w miejscu wstrzyknięcia 3 | Zmęczenie, znużenie Astenia Nadmierne pocenie |
Klasyfikacja układów i narządów | Często ( 1/100 do < 1/10) | Niezbyt często ( 1/1 000 do <1/100) | Rzadko ( 1/10 000 do < 1/1000) |
się4 | |||
Urazy, zatrucia i powikłania po zabiegach | Mikrozatory płuc wywołane roztworem olejowym** |
* Odpowiednią częstość obserwowano w związku ze stosowaniem produktów zawierających testosteron
** Częstość w oparciu o liczbę iniekcji
W celu opisania określonych działań niepożądanych zastosowano najbardziej odpowiednie terminy MedDRA. Nie wymieniono synonimów i ich stanów pokrewnych, ale należy również wziąć je pod uwagę.
1 Wysypka, w tym wysypka grudkowa
2 Zaburzenie mięśniowe: skurcze mięśnia, uszkodzenie mięśnia oraz ból mięśniowy
3 Różne rodzaje reakcji w miejscu wstrzyknięcia: ból w miejscu wstrzyknięcia, uczucie dyskomfortu w miejscu wstrzyknięcia, świąd w miejscu wstrzyknięcia, rumień w miejscu wstrzyknięcia, krwiak w miejscu wstrzyknięcia, podrażnienie w miejscu wstrzyknięcia, reakcja w miejscu wstrzyknięcia
4 Nadmierne pocenie się: nadmierne pocenie się oraz poty nocne
Opis wybranych działań niepożądanych
Mikrozatory płuc wywołane roztworem olejowym mogą, rzadko, prowadzić do wystąpienia takich objawów jak: kaszel, duszność, złe samopoczucie, nadmierne pocenie się, ból w klatce piersiowej, zawroty głowy, parestezje, omdlenie. Reakcje te mogą pojawić się podczas wykonywania wstrzyknięcia lub bezpośrednio po nim i mają charakter odwracalny. W badaniach klinicznych
(w ≥1/10 000 i < 1/1000 wstrzyknięć), jak również po wprowadzeniu produktu do obrotu występowały sytuacje, w których firma lub osoba zgłaszająca podejrzewała rozpoznanie mikrozatoru płuc wywołanego roztworem olejowym (patrz punkt 4.4 ).
Podczas stosowania innych produktów zawierających testosteron, poza wyżej wymienionymi działaniami niepożądanymi, odnotowano również: nerwowość, wrogość, bezdech senny, różne reakcje skórne, w tym łojotok, przyśpieszony porost włosów, zwiększenie częstości erekcji oraz bardzo rzadko żółtaczkę.
Leczenie dużymi dawkami testosteronu prowadzi często do przemijającego zahamowania lub zmniejszenia spermatogenezy, skutkiem czego jest zmniejszenie rozmiaru jąder. Testosteronowa terapia zastępcza w leczeniu upośledzonej czynności hormonalnej jąder (hipogonadyzm) może rzadko powodować długotrwałe, bolesne erekcje (priapizm). Duże dawki lub długoterminowe podawanie testosteronu sporadycznie prowadzi do zatrzymania wody w organizmie oraz wystąpienia obrzęków.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Faks: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
W razie przedawkowania nie stosuje się szczególnego postępowania leczniczego oprócz odstawienia produktu lub zmniejszenia dawki.
Grupa farmakoterapeutyczna: androgeny, pochodne 3-oksoandrostenu (4) Kod ATC: G03B-A03
Undecylan testosteronu jest estrem naturalnie występującego androgenu – testosteronu. Forma czynna, testosteron, powstaje przez odszczepienie łańcucha bocznego.
Testosteron jest najważniejszym androgenem u mężczyzn, syntetyzowanym głównie w jądrach i w niewielkim stopniu, w korze nadnerczy.
Testosteron jest odpowiedzialny za ekspresję męskich cech w czasie rozwoju płodowego, we wczesnym dzieciństwie i w okresie pokwitania, a tym samym za utrzymanie fenotypu męskiego
i funkcji zależnych od androgenów (np. spermatogenezy, dodatkowych gruczołów płciowych). Działa też np. w skórze, mięśniach, szkielecie, nerkach, wątrobie, szpiku kostnym i ośrodkowym układzie nerwowym.
Zależnie od narządu docelowego, spektrum działania testosteronu jest głównie androgenne
(np. gruczoł krokowy, pęcherzyki nasienne, najądrze) lub białkowo-anaboliczne (mięśnie, kości, hematopoeza, nerki, wątroba).
Działanie testosteronu w niektórych narządach występuje po obwodowej konwersji testosteronu
do estradiolu, który wówczas wiąże się z receptorami estrogenowymi w jądrze komórki docelowej, np. przysadki, tkanki tłuszczowej, mózgu, kości i komórki Leydiga w jądrze.
Wchłanianie
Nebido jest podawanym domięśniowo produktem testosteronu undecylanu o przedłużonym uwalnianiu (forma depot), a zatem nie zachodzi efekt pierwszego przejścia. Po domięśniowym wstrzyknięciu olejowego roztworu testosteronu undecylanu, związek ten jest stopniowo uwalniany i niemal całkowicie rozkładany przez esterazy osocza na testosteron i kwas undecylenowy.
Zwiększenie stężeń testosteronu w osoczu powyżej wartości wyjściowych można zaobserwować jeden dzień po podaniu.
Stan stacjonarny
Po pierwszym wstrzyknięciu domięśniowym 1000 mg testosteronu undecylanu u mężczyzn
z hipogonadyzmem, średnie wartości Cmax wynoszące 38 nmol/l (11 ng/ml) uzyskano po siedmiu dniach. Drugą dawkę podano sześć tygodni po pierwszym wstrzyknięciu, osiągając maksymalne stężenia testosteronu około 50 nmol/l (15 ng/ml). Przy następnych trzech dawkach utrzymywano stałe odstępy między wstrzyknięciami wynoszące 10 tygodni, uzyskując stan stacjonarny między trzecią
a piątą dawką. Średnie wartości Cmax i Cmin testosteronu w stanie stacjonarnym wynosiły odpowiednio około 37 nmol/l (11 ng/ml) i 16 nmol/l (5 ng/ml). Mediana zmienności śród- i międzyosobniczej
(współczynnik zmienności, %) wartości Cmin wynosiła odpowiednio 22% (zakres: 9% – 28%) i 34% (zakres: 25% – 48%).
Dystrybucja
W surowicy u mężczyzn, około 98% testosteronu jest związane z globuliną wiążącą hormony płciowe (sex hormone binding globulin – SHBG) i albuminą. Tylko wolna frakcja testosteronu jest uważana za biologicznie czynną. Po dożylnym wlewie testosteronu u mężczyzn w podeszłym wieku okres półtrwania testosteronu wynosił w przybliżeniu jedną godzinę, a pozorną objętość dystrybucji ustalono na około 1,0 l/kg.
Biotransformacja
Testosteron uzyskany w wyniku rozkładu estru testosteronu undecylanu jest metabolizowany w taki sam sposób jak testosteron endogenny. Kwas undecylenowy jest metabolizowany na drodze
β-oksydacji w taki sam sposób jak inne alifatyczne kwasy karboksylowe. Głównymi czynnymi metabolitami testosteronu są estradiol i dihydrotestosteron.
Wydalanie
Testosteron podlega intensywnemu metabolizmowi wątrobowemu i pozawątrobowemu. Po podaniu testosteronu (znakowanego izotopem radioaktywnym), około 90% aktywności pojawia się w moczu w postaci związków sprzężonych z kwasem glukoronowym i siarkowym, a około 6% w kale,
po przejściu krążenia jelitowo-wątrobowego. Do substancji czynnych w moczu należą androsteron i etiocholanon. Po domięśniowym podaniu formy depot szybkość uwalniania charakteryzuje się okresem półtrwania 90 ± 40 dni.
W badaniach toksykologicznych nie ujawniono innego działania niż to, które można wyjaśnić na podstawie profilu hormonalnego produktu Nebido.
Stwierdzono, że testosteron nie jest mutagenny in vitro przy zastosowaniu modelu odwrotnej mutacji (test Amesa) lub komórek jajnikowych chomika. W badaniach na zwierzętach laboratoryjnych stwierdzono związek między leczeniem androgenami a występowaniem określonych raków. Dane
z eksperymentów na szczurach wykazały zwiększoną zapadalność na raka gruczołu krokowego po leczeniu testosteronem.
Wiadomo, że hormony płciowe ułatwiają rozwój pewnych nowotworów indukowanych przez znane czynniki rakotwórcze. Znaczenie kliniczne tych ostatnich obserwacji nie jest znane.
Badania nad płodnością u gryzoni i naczelnych wykazały, że leczenie testosteronem może zaburzać płodność przez hamowanie spermatogenezy w sposób zależny od dawki.
Benzylu benzoesan
Olej rycynowy, oczyszczony
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności.
5 lat
Produkt należy zużyć natychmiast po pierwszym otwarciu.
Brak specjalnych zaleceń dotyczących przechowywania.
Ampułka
Ampułki o pojemności 5 ml ze szkła brązowego (typu I) zawierające 4 ml roztworu. Wielkość opakowania: 1 x 4 ml
Fiolka
Fiolka o pojemności 6 ml ze szkła brązowego (typu I) z korkiem z gumy szarej brombutylowej (foil- clad ETFE) i kapslem zawierająca 4 ml roztworu.
Wielkość opakowania: 1 x 4 ml
Podczas przechowywania w niskich temperaturach właściwości tego roztworu na bazie oleju mogą przejściowo ulec zmianie (np. wyższa lepkość, zmętnienie). Jeśli produkt przechowywany jest w niskiej temperaturze, przed użyciem należy go doprowadzić do temperatury pokojowej lub temperatury ciała.
Roztwór do wstrzykiwań domięśniowych przed użyciem należy skontrolować wzrokowo; można stosować tylko roztwory nie zawierające cząsteczek stałych.
Produkt jest przeznaczony tylko do jednorazowego użytku. Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Ampułka
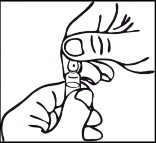
Wskazówki dotyczące przygotowania/otwierania ampułki OPC (One-Point-Cut):
Na ampułce poniżej kolorowego punktu, znajduje się nacięcie, które eliminuje konieczność napiłowania szyjki. Przed otwarciem należy upewnić się, że roztwór z górnej części ampułki spłynął do dolnej części. Do otwarcia ampułki należy użyć obu rąk przytrzymując jedną ręką dolną część ampułki natomiast drugą ręką należy odłamać górną część ampułki w kierunku od kolorowego punktu.
Fiolka
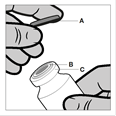
Fiolka służy wyłącznie do jednorazowego użycia. Zawartość fiolki wstrzykiwać domięśniowo, natychmiast po pobraniu do strzykawki. Po usunięciu plastikowego wieczka (A) nie usuwać metalowego pierścienia (B) ani karbowanej nasadki (C).
Bayer AG
Kaiser-Wilhelm-Allee 1
51373 Leverkusen Niemcy
11740
27.07.2005/14.12.2009
26.10.2022











