Spis treści:
- Nazwa produktu leczniczego
- Skład jakościowy i ilościowy substancji czynnych
- Postać farmaceutyczna
- Szczegółowe dane kliniczne
- Właściwości farmakologiczne 5.1.Właściwości farmakodynamiczne
- Szczegółowe dane farmaceutyczne
- Podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu
- Numer pozwolenia na dopuszczenie do obrotu
- Data wydania pierwszego pozwolenia na dopuszczenie do obrotu / data przedłużenia pozwolenia
- Data zatwierdzenia lub częściowej zmiany tekstu Charakterystyki Produktu Leczniczego
Charakterystyka produktu leczniczego
Nazwa produktu leczniczego
Skład jakościowy i ilościowy substancji czynnych
Postać farmaceutyczna
Szczegółowe dane kliniczne
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi lekami i inne rodzaje interakcji
Stosowanie w okresie ciąży i karmienia piersią
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
Właściwości farmakologiczne 5.1.Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Szczegółowe dane farmaceutyczne
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności przy przechowywaniu
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Podmiot odpowiedzialny posiadający pozwolenie na dopuszczenie do obrotu
Numer pozwolenia na dopuszczenie do obrotu
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu / data przedłużenia pozwolenia
Data zatwierdzenia lub częściowej zmiany tekstu Charakterystyki Produktu Leczniczego
ZIELE PIOŁUNU, zioła do zaparzania, 1 g/g
1 g produktu zawiera 1 g Artemisia absinthium L., herba (ziele piołunu).
Zioła do zaparzania
Tradycyjnie stosuje się w okresowej utracie apetytu oraz w łagodnych niestrawnościach/ dolegliwościach żołądkowo-jelitowych.
Tradycyjny produkt leczniczy roślinny do stosowania w określonych wskazaniach, wynikających wyłącznie z jego długotrwałego stosowania.
W okresowej utracie apetytu: Dorośli i osoby w podeszłym wieku: 1 łyżeczkę (1g) ziela zalać ¾ szklanki (150 ml) wrzącej wody, pozostawić pod przykryciem na 10 minut, przecedzić. Przyjmować po ¾ szklanki naparu na pół godziny przed posiłkami 2-3 razy dziennie. Stosować zawsze świeży napar.
Dawka dobowa ziela piołunu: 2-3 g
Młodzież i dzieci poniżej 18 lat: Nie zaleca się stosowania.
Czas stosowania: Nie stosować dłużej niż 2 tygodnie. Jeżeli objawy utrzymują się pomimo stosowania produktu leczniczego należy skonsultować się z lekarzem lub farmaceutą.
W łagodnych niestrawnościach/dolegliwościach żołądkowo-jelitowych: Dorośli i osoby w podeszłym wieku: 1 łyżeczkę (1g) ziela zalać ¾ szklanki (150 ml) wrzącej wody, pozostawić pod przykryciem na 10 minut, przecedzić. Przyjmować po ¾ szklanki naparu 2- 3 razy dziennie po posiłkach. Stosować zawsze świeży napar.
Dawka dobowa ziela piołunu: 2-3 g
Młodzież i dzieci poniżej 18 lat: Nie zaleca się stosowania.
Czas stosowania: Nie stosować dłużej niż 2 tygodnie. Jeżeli objawy utrzymują się pomimo stosowania produktu leczniczego należy skonsultować się z lekarzem lub farmaceutą.
Nadwrażliwość na substancję czynną i inne rośliny z rodziny astrowatych Asteraceae (dawniej złożonych Compositae). Niedrożność i zapalenie dróg żółciowych, choroby wątroby.
Pacjenci z kamicą żółciową i innymi chorobami dróg żółciowych przed przyjęciem preparatów z ziela piołunu powinni skonsultować się z lekarzem. Stosowanie produktów leczniczych zawierających ziele piołunu może mieć wpływ na aktywność leków działających poprzez receptory GABA, nawet jeśli nie zostało to zaobserwowane klinicznie. Nie zaleca się stosowania leku u dzieci i młodzieży poniżej 18 lat ze względu na brak danych na temat bezpieczeństwa w tej grupie pacjentów.
Brak doniesień.
Brak lub ograniczone dane dotyczące stosowania leku podczas ciąży i laktacji. Lek nie powinien być stosowany u kobiet w ciąży i w czasie laktacji.
Ziele piołunu może osłabiać zdolność prowadzenia pojazdów i obsługę maszyn dlatego pacjenci stosujący produkt leczniczy nie powinni prowadzić pojazdów i obsługiwać maszyn.
Nieznane. W przypadku wystąpienia objawów niepożądanych, należy poinformować o nich lekarza lub farmaceutę.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie odnotowano przypadków przedawkowania.
Nie wymagane Zgodnie z artykułem 16c(1)(a)(iii) Dyrektywy 2001/83/EC, z późniejszymi zmianami.
Nie wymagane Zgodnie z artykułem 16c(1)(a)(iii) Dyrektywy 2001/83/EC, z późniejszymi zmianami.
Nie wymagane Zgodnie z artykułem 16c(1)(a)(iii) Dyrektywy 2001/83/EC, z późniejszymi zmianami, chyba że są niezbędne do bezpiecznego stosowania produktu.
Tujon ocenia się jako neurotoksyczny, dlatego powinny być preferowane chemotypy z niską zawartością tujonu.
Przeprowadzono badania toksyczności reprodukcyjnej z użyciem suchych etanolowych wyciągów z ziela piołunu podanych doustnie ciężarnym szczurom. Wyniki wykazały zmniejszenie miejsc implantacji oraz zmniejszenie wskaźnika urodzeń młodych. Tujon jest znany z właściwości stymulujących macicę.
Dzienne przyjęcie w dawce 3,0 mg na osobę jest akceptowalne przy stosowaniu maksymalnie przez 2 tygodnie.
Nie prowadzono badań w kierunku genotoksyczności, potencjału rakotwórczego i toksyczności reprodukcyjnej.
Brak.
Brak.
1 rok.
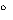
Przechowywać w temperaturze nie wyższej niż 30 C. Chronić od światła, wilgoci i wpływu obcych zapachów. Przechowywać w miejscu niedostępnym i niewidocznym dla dzieci.
Torebka z papieru kredowego powlekana polietylenem Opakowanie zawiera 50g produktu leczniczego Ziele piołunu.
Bez specjalnych wymagań.
Zakład Zielarski „KAWON-HURT” Nowak Sp.J. Krajewice 119
63-800 Gostyń
tel/fax 65 572 08 22, 65 572 34 60
IL-4223/LN
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 14.12.1992 r. Data wydania przedłużenia pozwolenia na dopuszczenie do obrotu: 16.10.2014 r.











