Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
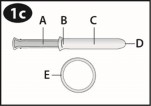
Tłok
Uchwyt
Cylinder
Otwór w cylindrze
System terapeutyczny dopochwowy NuvaRing
Postępowanie w wypadku dłuższej przerwy w stosowaniu NuvaRing
Postępowanie, gdy NuvaRing znajdzie się tymczasowo poza pochwą
NuvaRing powinien się znajdować w pochwie nieprzerwanie przez okres 3 tygodni. W wypadku samoistnego wypadnięcia systemu terapeutycznego dopochwowego NuvaRing, należy go umyć w zimnej lub letniej (nie gorącej) wodzie i jak najszybciej ponownie założyć.
Jeśli NuvaRing znajdował się poza pochwą przez czas krótszy niż 3 godziny, nie wpłynęło to na skuteczność antykoncepcyjną. Pacjentka powinna jak najszybciej ponownie założyć system terapeutyczny dopochwowy, nie później niż w ciągu 3 godzin od wypadnięcia.
Jeśli pacjentka podejrzewa lub jest pewna, że NuvaRing znajdował się poza pochwą przez czas dłuższy niż 3 godziny w pierwszym lub drugim tygodniu stosowania, skuteczność antykoncepcyjna systemu terapeutycznego dopochwowego NuvaRing mogła się zmniejszyć.
Pacjentka powinna jak najszybciej ponownie założyć system terapeutyczny dopochwowy. Dodatkowo przez okres pierwszych 7 dni stosowania systemu terapeutycznego dopochwowego NuvaRing po jego ponownym założeniu należy stosować mechaniczne metody antykoncepcji, takie jak prezerwatywa dla mężczyzn. Im dłużej NuvaRing znajdował się poza pochwą i im bliżej planowanej przerwy w jego stosowaniu miało to miejsce, tym ryzyko ciąży jest większe.
Jeśli pacjentka podejrzewa lub jest pewna, że NuvaRing znajdował się poza pochwą przez czas dłuższy niż 3 godziny w trzecim tygodniu stosowania, skuteczność antykoncepcyjna systemu terapeutycznego dopochwowego NuvaRing mogła się zmniejszyć. Pacjentka powinna wyrzucić ten system terapeutyczny dopochwowy i wybrać jedno z dwóch poniższych rozwiązań:
Postępowanie w wypadku dłuższego stosowania NuvaRing
Przeciwwskazania
Występowanie lub ryzyko żylnej choroby zakrzepowo-zatorowej (ang. venous thromboembolism, VTE)
Żylna choroba zakrzepowo-zatorowa - czynna (leczona przeciwzakrzepowymi produktami leczniczymi) lub przebyta żylna choroba zakrzepowo-zatorowa, np.
zakrzepica żył głębokich (ang. deep venous thrombosis, DVT), zatorowość płucna (ang. pulmonary embolism, PE).
Znana dziedziczna lub nabyta predyspozycja do występowania żylnej choroby zakrzepowo-zatorowej np. oporność na aktywowane białko C (ang. activated protein C, APC) (w tym czynnik V Leiden) niedobór antytrombiny III, niedobór białka C, niedobór białka S.
Rozległy zabieg operacyjny związany z długotrwałym unieruchomieniem (patrz punkt 4.4).
Wysokie ryzyko żylnej choroby zakrzepowo-zatorowej wskutek występowania wielu czynników ryzyka (patrz punkt 4.4).
Występowanie lub ryzyko tętniczych zaburzeń zakrzepowo-zatorowych (ang. arterial thromboembolism, ATE)
Tętnicze zaburzenia zakrzepowo-zatorowe - czynne (np. zawał mięśnia sercowego) lub objawy prodromalne (np. dławica piersiowa).
Choroby naczyń mózgowych - czynny udar, przebyty udar lub objawy prodromalne w wywiadzie (np. przemijający napad niedokrwienny, ang. transient ischaemic attack, TIA).
Stwierdzona dziedziczna lub nabyta skłonność do występowania tętniczych zaburzeń zakrzepowo-zatorowych np. hiperhomocysteinemia i obecność przeciwciał antyfosfolipidowych (przeciwciała antykardiolipinowe, antykoagulant toczniowy).
Migrena z ogniskowymi objawami neurologicznymi w wywiadzie.
Wysokie ryzyko zaburzeń zakrzepowo-zatorowych tętnic z powodu występowania wielu czynników ryzyka (patrz punkt 4.4) lub występowania jednego z poważnych czynników ryzyka, takich jak:
cukrzyca z powikłaniami naczyniowymi
ciężkie nadciśnienie tętnicze
ciężka dyslipoproteinemia.
Zapalenie trzustki obecnie lub w przeszłości, jeśli współwystępuje z ciężką hipertriglicerydemią.
Ciężka choroba wątroby obecnie lub w przeszłości, tak długo jak parametry czynności wątroby nie powrócą do normy.
Występowanie obecnie lub w przeszłości nowotworów wątroby (łagodnych lub złośliwych).
Obecność lub podejrzenie złośliwych nowotworów narządów rodnych lub piersi zależnych od hormonów płciowych.
Krwawienia z pochwy o nieznanej etiologii.
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Jednoczesne stosowanie systemu terapeutycznego dopochwowego NuvaRing z produktami leczniczymi zawierającymi ombitaswir, parytaprewir, rytonawir oraz dasabuwir lub z produktami leczniczymi zawierającymi glekaprewir, pibrentaswir jest przeciwwskazane (patrz
punkty 4.4 oraz 4.5).
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Ryzyko żylnej choroby zakrzepowo-zatorowej
Stosowanie jakichkolwiek złożonych hormonalnych środków antykoncepcyjnych wiąże się ze zwiększonym ryzykiem żylnej choroby zakrzepowo-zatorowej w porównaniu do sytuacji, gdy terapia nie jest stosowana. Stosowanie produktów zawierających lewonorgestrel, norgestimat lub noretisteron jest związane z najmniejszym ryzykiem żylnej choroby zakrzepowo-zatorowej. Stosowanie innych produktów, takich jak system terapeutyczny dopochwowy NuvaRing może być związane z dwukrotnie większym ryzykiem. Decyzja
o zastosowaniu produktu spoza grupy najmniejszego ryzyka żylnej choroby zakrzepowo- zatorowej powinna zostać podjęta wyłącznie po rozmowie z pacjentką, w celu
zapewnienia, że rozumie ona ryzyko żylnej choroby zakrzepowo-zatorowej związane z systemem terapeutycznym dopochwowym NuvaRing, jak obecne czynniki ryzyka wpływają na to ryzyko oraz, że ryzyko żylnej choroby zakrzepowo-zatorowej jest
największe w pierwszym roku stosowania. Istnieją pewne dowody, świadczące, że ryzyko zwiększa się, gdy złożone hormonalne środki antykoncepcyjne są przyjmowane ponownie po przerwie w stosowaniu wynoszącej 4 tygodnie lub więcej.
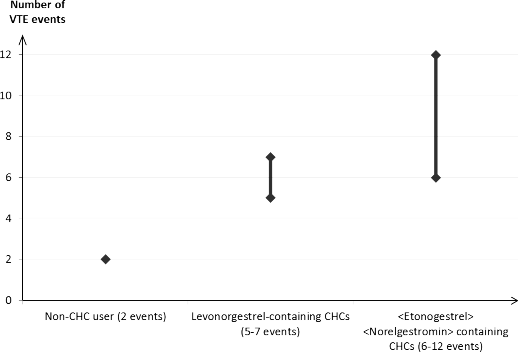
U około 2 na 10 000 kobiet, które nie stosują złożonych hormonalnych środków antykoncepcyjnych i nie są w ciąży, w okresie roku rozwinie się żylna choroba zakrzepowo- zatorowa. Jakkolwiek ryzyko to może być znacznie większe, w zależności od czynników ryzyka występujących u danej pacjentki (patrz poniżej).
Szacuje się że spośród 10 000 kobiet, które stosują małe dawki złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel, u około 6 kobiet1, w okresie roku rozwinie się żylna choroba zakrzepowo-zatorowa. Uzyskano niejednoznaczne wyniki dotyczące ryzyka żylnej choroby zakrzepowo-zatorowej związanego ze stosowaniem systemu terapeutycznego dopochwowego NuvaRing w porównaniu do złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel (relatywne ryzyko szacowane
w zakresie od braku wzrostu, RR=0,96, do prawie dwukrotnego wzrostu ryzyka, RR=1,90). Przekłada się to na 6 do 12 przypadków żylnej choroby zakrzepowo-zatorowej w okresie roku na 10 000 kobiet stosujących system terapeutyczny dopochwowy NuvaRing.
W obydwu sytuacjach, liczba przypadków żylnej choroby zakrzepowo-zatorowej przypadających na okres roku jest mniejsza niż oczekiwana liczba przypadków u kobiet w ciąży lub w okresie poporodowym.
Żylna choroba zakrzepowo-zatorowa może być śmiertelna w 1-2% przypadków.
1 Punkt środkowy z zakresu od 5 do 7 na 10 000 kobiet w okresie roku, w oparciu o relatywne ryzyko wynoszące około 2,3 do 3,6 dla złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel
w porównaniu do sytuacji, gdy terapia nie jest stosowana.
Liczba przypadków żylnej choroby zakrzepowo-zatorowej przypadających na 10 000 kobiet w okresie roku
Złożone hormonalne środki antykoncepcyjne zawierające lewonorgestrel
(5-7 przypadków)
Liczba przypadków żylnej choroby zakrzepowo- zatorowej
Pacjentki niestosujące złożonych hormonalnych środków antykoncepcyjnych (2 przypadki)
Złożone hormonalne środki antykoncepcyjne zawierające <5-Etonogestrel>
(6-12 przypadków)
U pacjentek stosujących złożone hormonalne środki antykoncepcyjne niezwykle rzadko zgłaszano przypadki zakrzepicy w innych naczyniach krwionośnych, np. wątrobowych, krezkowych, nerkowych, lub w żyłach i tętnicach siatkówki.
Czynniki ryzyka żylnej choroby zakrzepowo-zatorowej
Ryzyko żylnych powikłań zakrzepowo-zatorowych u pacjentek stosujących złożone hormonalne środki antykoncepcyjne może znacząco wzrosnąć w przypadku występowania dodatkowych czynników ryzyka, szczególnie, jeśli występuje kilka czynników ryzyka jednocześnie (patrz tabela).
Stosowanie systemu terapeutycznego dopochwowego NuvaRing jest przeciwwskazane, jeśli
u pacjentki występuje jednocześnie kilka czynników ryzyka, zwiększających ryzyko zakrzepicy żylnej (patrz punkt 4.3). Jeśli u kobiety wstępuje więcej niż jeden czynnik ryzyka, możliwe jest, że zwiększenie ryzyka jest większe niż suma pojedynczych czynników – w tym przypadku należy ocenić całkowite ryzyko żylnej choroby zakrzepowo-zatorowej. Jeśli ocena stosunku korzyści do ryzyka jest negatywna, nie należy przepisywać złożonych hormonalnych środków antykoncepcyjnych (patrz punkt 4.3).
Tabela: Czynniki ryzyka żylnej choroby zakrzepowo-zatorowej
Czynnik ryzyka
Uwagi
Otyłość (wskaźnik masy ciała (BMI) powyżej 30 kg/m2)
Ryzyko istotnie zwiększa się ze wzrostem BMI.
Jest to szczególnie istotne do oceny, jeśli występują również inne czynniki ryzyka.
Długotrwałe unieruchomienie, rozległy zabieg operacyjny, jakikolwiek zabieg operacyjny w obrębie kończyn dolnych lub miednicy, zabieg neurochirurgiczny lub poważny uraz
W powyższych sytuacjach zaleca się przerwanie stosowania plastrów/tabletek/systemu dopochwowego na co najmniej 4 tygodnie przed planowanym zabiegiem chirurgicznym i nie wznawianie stosowania produktu przed upływem dwóch tygodni od czasu powrotu do sprawności ruchowej. Należy stosować inną
metodę antykoncepcji, aby uniknąć niezamierzonego zajścia w ciążę.
Czynnik ryzyka
Uwagi
Uwaga: tymczasowe unieruchomienie, w tym podróż samolotem >4 godzin może również stanowić czynnik ryzyka żylnej choroby zakrzepowo-zatorowej, szczególnie u kobiet ze
współistniejącymi innymi czynnikami ryzyka.
Należy rozważyć leczenie przeciwzakrzepowe, jeśli stosowania systemu terapeutycznego dopochwowego NuvaRing nie przerwano odpowiednio wcześnie.
Dodatni wywiad rodzinny (występowanie żylnych zaburzeń zakrzepowo-zatorowych u rodzeństwa bądź rodziców, szczególnie
w stosunkowo młodym wieku, np. przed 50 rokiem życia).
Jeśli podejrzewa się predyspozycję genetyczną, przed podjęciem decyzji o stosowaniu złożonego hormonalnego środka antykoncepcyjnego kobieta powinna zostać skierowana na konsultację u specjalisty.
Inne schorzenia związane z żylną chorobą zakrzepowo-zatorową
Nowotwór, toczeń rumieniowaty układowy, zespół hemolityczno-mocznicowy, przewlekłe zapalne choroby jelit (np. choroba Leśniowskiego-Crohna lub
wrzodziejące zapalenie jelita grubego) oraz niedokrwistość sierpowatokrwinkowa.
Wiek
Szczególnie w wieku powyżej 35 lat.
Nie osiągnięto konsensusu, co do możliwej roli żylaków oraz zakrzepowego zapalenia żył powierzchniowych na wystąpienie lub progresję żylnej choroby zakrzepowo-zatorowej.
Należy uwzględnić zwiększone ryzyko wystąpienia choroby zakrzepowo-zatorowej w ciąży oraz w szczególności w 6-tygodniowym okresie poporodowym („Ciąża i laktacja” patrz punkt 4.6).
Objawy żylnej choroby zakrzepowo-zatorowej (zakrzepicy żył głębokich oraz zatorowości płucnej)
Należy poinformować pacjentkę, że w razie wystąpienia następujących objawów należy natychmiast zgłosić się do lekarza i powiedzieć personelowi medycznemu, że stosuje się złożone hormonalne środki antykoncepcyjne.
Objawy zakrzepicy żył głębokich (ang. deep vein thrombosis, DVT) mogą obejmować:
obrzęk nogi i/lub stopy lub obrzęk wzdłuż żyły w nodze;
ból lub tkliwość w nodze, które mogą być odczuwane wyłącznie w czasie stania lub chodzenia;
zwiększona temperatura w zmienionej chorobowo nodze; czerwona lub przebarwiona skóra nogi.
Objawy zatorowości płucnej (ang. pulmonary embolism, PE) mogą obejmować:
nagły napad niewyjaśnionego spłycenia oddechu lub przyspieszenia oddechu;
nagły napad kaszlu, który może być połączony z krwiopluciem;
ostry ból w klatce piersiowej;
ciężkie zamroczenie lub zawroty głowy;
przyspieszone lub nieregularne bicie serca.
Niektóre z tych objawów (np. „spłycenie oddechu”, „kaszel”) są niespecyficzne i mogą być niepoprawnie zinterpretowane jako występujące częściej lub mniej poważne stany (np. zakażenia układu oddechowego).
Inne objawy zamknięcia naczyń mogą obejmować: nagły ból, obrzęk oraz lekko niebieskie przebarwienie kończyn.
Jeżeli zamkniecie naczynia wystąpi w oku, objawy mogą obejmować bezbolesne zaburzenia widzenia, które mogą przekształcić się w utratę widzenia. W niektórych przypadkach utrata widzenia może nastąpić niemal natychmiast.
Ryzyko tętniczych zaburzeń zakrzepowo-zatorowych
Badania epidemiologiczne wykazały związek pomiędzy stosowaniem hormonalnych środków antykoncepcyjnych, a zwiększonym ryzykiem tętniczych zaburzeń zakrzepowo-zatorowych (zawału mięśnia sercowego) lub incydentów naczyniowo-mózgowych (np. przemijającego napadu niedokrwiennego, udaru). Przypadki tętniczych zaburzeń zakrzepowo-zatorowych mogą być śmiertelne.
Czynniki ryzyka tętniczych zaburzeń zakrzepowo-zatorowych
Ryzyko wystąpienia tętniczych powikłań zakrzepowo-zatorowych lub napadów naczyniowo- mózgowych u pacjentek stosujących złożone hormonalne środki antykoncepcyjne jest zwiększone u kobiet, u których występują czynniki ryzyka (patrz tabela). Stosowanie systemu terapeutycznego dopochwowego NuvaRing jest przeciwwskazane, jeżeli u pacjentki występuje jeden poważny lub jednocześnie kilka czynników ryzyka tętniczych zaburzeń zakrzepowo-zatorowych, które stawiają
pacjentkę w grupie wysokiego ryzyka zakrzepicy tętniczej (patrz punkt 4.3). Jeśli u kobiety wstępuje więcej niż jeden czynnik ryzyka, możliwe jest, że zwiększenie ryzyka jest większe niż suma pojedynczych czynników – w tym przypadku należy ocenić całkowite ryzyko. Jeśli ocena stosunku korzyści do ryzyka jest negatywna, nie należy przepisywać złożonych hormonalnych środków antykoncepcyjnych (patrz punkt 4.3).
Tabela: Czynniki ryzyka tętniczych zaburzeń zakrzepowo-zatorowych
Czynnik ryzyka
Uwagi
Wiek
Szczególnie w wieku powyżej 35 lat.
Palenie
Należy dokładnie pouczyć kobiety, aby nie paliły, jeśli zamierzają stosować złożone hormonalne środki antykoncepcyjne. Kobiety w wieku powyżej 35 lat, które nie zaprzestały palenia, należy dokładnie pouczyć, aby stosowały inną metodę antykoncepcji.
Nadciśnienie tętnicze
Otyłość (wskaźnik masy ciała (BMI) powyżej 30 kg/m2)
Ryzyko istotnie wzrasta wraz ze wzrostem BMI.
Jest to szczególnie ważne dla kobiet, u których występują również inne czynniki ryzyka.
Dodatni wywiad rodzinny (występowanie tętniczych zaburzeń zakrzepowo-zatorowych u rodzeństwa bądź rodziców, szczególnie
w stosunkowo młodym wieku, np. przed 50. rokiem życia)
Jeśli podejrzewa się predyspozycję genetyczną, przed podjęciem decyzji o stosowaniu złożonego hormonalnego środka antykoncepcyjnego kobieta powinna zostać skierowana na konsultację u specjalisty.
Migrena
Zwiększenie częstości występowania lub nasilenia migreny w trakcie stosowania złożonych hormonalnych środków antykoncepcyjnych (która może zapowiadać wystąpienie incydentu naczyniowo-mózgowego) może
być powodem do natychmiastowego przerwania stosowania.
Inne schorzenia związane ze zdarzeniami niepożądanymi w obrębie
naczyń
Cukrzyca, hiperhomocysteinemia, wady zastawkowe serca, migotanie przedsionków, dyslipoproteinemia
oraz toczeń rumieniowaty układowy.
Objawy tętniczych zaburzeń zakrzepowo-zatorowych
Należy poinformować pacjentkę, że w razie wystąpienia następujących objawów należy natychmiast zgłosić się do lekarza i powiedzieć personelowi medycznemu, że stosuje się złożone hormonalne środki antykoncepcyjne.
Objawy napadu naczyniowo-mózgowego mogą obejmować:
nagłe zdrętwienie lub osłabienie twarzy, rąk lub nóg, szczególnie po jednej stronie ciała;
nagłe trudności z chodzeniem, zawroty głowy, utratę równowagi lub koordynacji;
nagłe splątanie, trudności z mówieniem lub rozumieniem;
nagłe trudności z widzeniem w jednym lub obydwu oczach;
nagłe, ciężkie lub długotrwałe bóle głowy bez przyczyny;
utratę przytomności lub omdlenie z drgawkami lub bez drgawek.
Przejściowe objawy sugerują, że zdarzenie jest przemijającym napadem niedokrwiennym (ang. transient ischaemic attack, TIA).
Objawy zawału serca (ang. myocardial infarction, MI) mogą być następujące:
ból, uczucie dyskomfortu, ociężałość, uczucie ściskania lub pełności w klatce piersiowej, ramieniu lub poniżej mostka;
uczucie dyskomfortu promieniujące do pleców, szczęki, gardła, ramienia, żołądka;
uczucie pełności, niestrawności lub zadławienia;
pocenie się, nudności, wymioty lub zawroty głowy;
skrajne osłabienie, niepokój lub spłycenie oddechu;
przyspieszone lub nieregularne bicie serca.
W razie podejrzenia lub potwierdzonych objawów żylnej choroby zakrzepowo-zatorowej lub tętniczych zaburzeń zakrzepowo-zatorowych należy przerwać stosowanie złożonych hormonalnych środków antykoncepcyjnych. Ze względu na teratogenne skutki leczenia przeciwzakrzepowego (pochodne kumaryny), należy rozpocząć stosowanie innej, skutecznej metody antykoncepcji.
Wymagane badania lekarskie
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne Etonogestrel
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
opakowanie zawierające 1 system terapeutyczny dopochwowy NuvaRing
opakowanie zawierające 1 system terapeutyczny dopochwowy NuvaRing oraz 1 aplikator
opakowanie zawierające 3 systemy terapeutyczne dopochwowe NuvaRing
opakowanie zawierające 3 systemy terapeutyczne dopochwowe NuvaRing oraz 3 aplikatory Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
NuvaRing, (0,120 mg + 0,015 mg)/24 h, System terapeutyczny dopochwowy
NuvaRing zawiera 11,7 mg etonogestrelu (Etonogestrelum) i 2,7 mg etynyloestradiolu (Ethinylestradiolum). System terapeutyczny dopochwowy uwalnia etonogestrel i etynyloestradiol w średniej ilości odpowiednio 0,120 mg i 0,015 mg w ciągu 24 godzin, przez okres 3 tygodni.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
System terapeutyczny dopochwowy.
NuvaRing jest elastycznym, przezroczystym, bezbarwnym lub prawie bezbarwnym pierścieniem o średnicy zewnętrznej 54 mm. Średnica systemu terapeutycznego dopochwowego w przekroju wynosi 4 mm.
Antykoncepcja
NuvaRing jest przeznaczony dla kobiet w wieku rozrodczym. Bezpieczeństwo stosowania i skuteczność produktu oceniono w grupie kobiet w wieku od 18 do 40 lat.
Decyzja o przepisaniu systemu terapeutycznego dopochwowego NuvaRing powinna zostać podjęta na podstawie indywidualnej oceny czynników ryzyka u kobiety, zwłaszcza ryzyka żylnej choroby zakrzepowo-zatorowej oraz ryzyka żylnej choroby zakrzepowo-zatorowej związanego ze stosowaniem systemu terapeutycznego dopochwowego NuvaRing, w odniesieniu do innych złożonych hormonalnych środków antykoncepcyjnych (patrz punkty 4.3 oraz 4.4).
Dawkowanie
Żeby działanie antykoncepcyjne było skuteczne, system terapeutyczny dopochwowy NuvaRing musi być stosowany zgodnie z zaleceniami (patrz „Jak stosować NuvaRing” i „Jak rozpocząć stosowanie systemu terapeutycznego dopochwowego NuvaRing”).
Dzieci i młodzież
Nie badano bezpieczeństwa stosowania ani skuteczności systemu terapeutycznego dopochwowego NuvaRing u młodzieży w wieku poniżej 18 lat.
Sposób podawania
Jak Stosować nuvaring
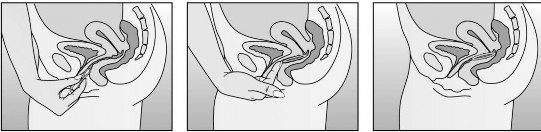
Pacjentka umieszcza NuvaRing w pochwie samodzielnie. Lekarz powinien poinstruować pacjentkę, w jaki sposób zakładać i usuwać NuvaRing. W celu założenia systemu terapeutycznego dopochwowego pacjentka powinna przyjąć najwygodniejszą dla siebie pozycję, np. stojąc z jedną
nogą uniesioną, siedząc w kucki lub leżąc. NuvaRing należy ścisnąć i umieścić w pochwie tak, aby nie przeszkadzał. Opcjonalnie system terapeutyczny dopochwowy można umieścić w pochwie za pomocą Aplikatora NuvaRing, który jest dystrybuowany osobno lub jest dołączony do opakowania. Aplikator NuvaRing może nie być dostępny we wszystkich krajach. Umiejscowienie systemu terapeutycznego dopochwowego NuvaRing w pochwie nie ma zasadniczego znaczenia dla jego działania antykoncepcyjnego (patrz Ryciny 1-4).
Po założeniu systemu terapeutycznego dopochwowego NuvaRing (patrz punkt „Jak rozpocząć stosowanie systemu terapeutycznego dopochwowego NuvaRing”), pozostaje on w pochwie nieprzerwanie przez 3 tygodnie. Należy zalecić pacjentkom, aby regularnie sprawdzały obecność systemu terapeutycznego dopochwowego NuvaRing w pochwie (na przykład przed i po stosunku płciowym). W razie przypadkowego wypadnięcia systemu terapeutycznego dopochwowego NuvaRing należy postępować zgodnie z zaleceniami zawartymi w punkcie 4.2 „Postępowanie, gdy NuvaRing znajdzie się tymczasowo poza pochwą” (więcej informacji: patrz również punkt 4.4 „Samoistne wypadnięcie”). NuvaRing należy usunąć po 3 tygodniach stosowania, w tym samym dniu tygodnia,
w którym był założony. Po przerwie w stosowaniu systemu terapeutycznego dopochwowego trwającej jeden tydzień, zakłada się nowy system terapeutyczny dopochwowy (np. jeśli NuvaRing założono
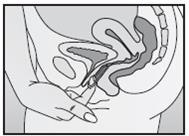
w środę około godz. 22, należy go usunąć również w środę, 3 tygodnie później, około godziny 22. W następną środę należy założyć nowy system terapeutyczny dopochwowy). NuvaRing można usunąć, zaczepiając palcem wskazującym o brzeg systemu terapeutycznego dopochwowego lub chwytając system terapeutyczny dopochwowy palcem wskazującym i środkowym i pociągając go (Rycina 5). Zużyty system terapeutyczny dopochwowy należy włożyć do saszetki (przechowywać w miejscu niedostępnym dla dzieci i zwierząt) i zutylizować w sposób zgodny z zaleceniami podanymi w punkcie 6.6. Krwawienie z odstawienia występuje zwykle po upływie 2-3 dni po
usunięciu systemu terapeutycznego dopochwowego NuvaRing i może nie ustąpić całkowicie do czasu założenia nowego systemu terapeutycznego dopochwowego.
Stosowanie z innymi metodami dopochwowej antykoncepcji mechanicznej dla kobiet
System terapeutyczny dopochwowy NuvaRing może utrudniać prawidłowe założenie i umieszczenie niektórych środków antykoncepcji mechanicznej dla kobiet, takich jak diafragma, kapturek naszyjkowy lub prezerwatywa dla kobiet. Nie należy stosować tych metod antykoncepcji, jako dodatkowej metody antykoncepcji z systemem terapeutycznym dopochwowym NuvaRing.
Jak założyć system terapeutyczny dopochwowy NuvaRing używając wyłącznie palców:
Rycina 1 Wyjąć NuvaRing z saszetki |
|
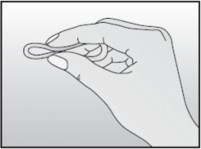
Rycina 2 Ścisnąć NuvaRing |
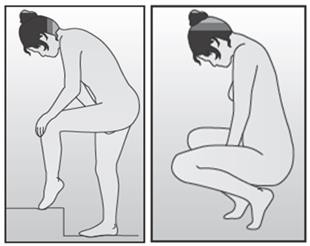
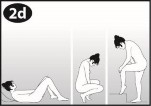
Rycina 3 Wybrać najwygodniejszą pozycję do założenia NuvaRing |
Rycina 4A Rycina 4B Rycina 4C Włożyć NuvaRing do pochwy jedną ręką (Rycina 4A), w razie potrzeby drugą ręką rozchylając wargi sromowe. Umieścić NuvaRing wewnątrz pochwy tak, aby nie przeszkadzał (Rycina 4B). NuvaRing pozostawia się w pochwie przez 3 tygodnie (Rycina 4C). | |
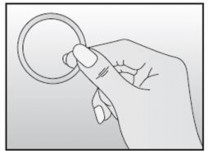
| Rycina 5: NuvaRing można usunąć, zaczepiając palcem wskazującym o brzeg systemu terapeutycznego dopochwowego lub chwytając system terapeutyczny dopochwowy palcem wskazującym i środkowym i pociągając go. |
Jak założyć system terapeutyczny dopochwowy NuvaRing używając aplikatora:
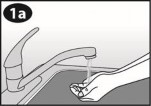
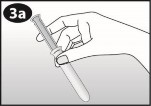
1: Przygotowanie
| Przed otwarciem opakowania należy umyć ręce. Opakowanie należy otworzyć WYŁĄCZNIE tuż przed użyciem aplikatora. NIE NALEŻY stosować aplikatora, jeśli opakowanie lub jego zawartość są w widoczny sposób uszkodzone. |
| Aplikator jest przeznaczony do użytku WYŁĄCZNIE z systemem terapeutycznym dopochwowym NuvaRing. Nie należy stosować go z innymi produktami leczniczymi. |
| Należy zapoznać się z rysunkiem przedstawiającym aplikator i jego poszczególne części. |
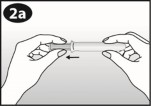
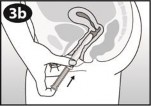
2: Ustawienie tłoka i przyjęcie odpowiedniej pozycji
| Należy odciągnąć delikatnie tłok do końca. |
| Należy ścisnąć przeciwległe strony systemu terapeutycznego dopochwowego i wsunąć go do otworu w cylindrze. |
| Należy delikatnie wepchnąć system terapeutyczny dopochwowy do środka cylindra. Końcówka systemu terapeutycznego dopochwowego powinna odrobinę wystawać z otworu w cylindrze. |
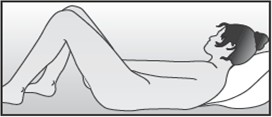
| Należy wybrać najwygodniejszą pozycję do założenia systemu terapeutycznego dopochwowego, na przykład leżąc, siedząc w kucki lub stojąc z jedną nogą uniesioną. |
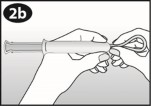
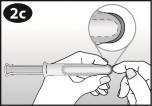
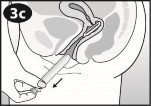
3: Założenie systemu terapeutycznego dopochwowego i usunięcie aplikatora
| Należy chwycić aplikator za uchwyt kciukiem i palcem środkowym. |
| Należy delikatnie wsunąć cylinder do pochwy do momentu, aż palce (znajdujące się na uchwycie) dotkną ciała. Następnie za pomocą palca wskazującego należy delikatnie nacisnąć tłok do końca. Podczas użycia aplikatora u niektórych kobiet występowało przejściowe, łagodne uczucie szczypania. |
| System terapeutyczny dopochwowy zostanie wypchnięty z aplikatora. Należy delikatnie wysunąć aplikator. |
| Należy upewnić się, że system terapeutyczny dopochwowy NIE pozostał w aplikatorze. Użyty aplikator należy wyrzucić do zwykłego domowego pojemnika na odpadki. NIE NALEŻY wyrzucać aplikatora do toalety. NIE NALEŻY używać aplikatora ponownie. |
Jak rozpocząć stosowanie systemu terapeutycznego dopochwowego nuvaring
W poprzednim cyklu nie stosowano hormonalnego środka antykoncepcyjnego
NuvaRing należy założyć pierwszego dnia naturalnego cyklu (tj. pierwszego dnia miesiączki). Można również rozpocząć stosowanie systemu terapeutycznego dopochwowego NuvaRing między
Pacjentka powinna jak najszybciej założyć nowy system terapeutyczny dopochwowy. Dodatkowo przez następne 7 dni należy stosować mechaniczne metody antykoncepcji, takie jak prezerwatywa dla mężczyzn. Jeśli w czasie przerwy w stosowaniu systemu terapeutycznego dopochwowego NuvaRing miał miejsce stosunek, należy upewnić się, że pacjentka nie jest
w ciąży. Im przerwa w stosowaniu NuvaRing była dłuższa, tym ryzyko ciąży jest większe.
Mimo, że nie jest to zalecany sposób postępowania, jeśli system terapeutyczny dopochwowy NuvaRing był stosowany nie dłużej niż 4 tygodnie, skuteczność antykoncepcyjna jest zachowana. Pacjentka może zrobić jednotygodniową przerwę w jego stosowaniu, a następnie założyć nowy system terapeutyczny dopochwowy. Jeśli NuvaRing stosowano dłużej niż
4 tygodnie, skuteczność antykoncepcyjna może być zmniejszona, a przed założeniem nowego systemu terapeutycznego dopochwowego należy upewnić się, że pacjentka nie jest w ciąży.
Jeśli pacjentka nie stosowała się do zaleconego sposobu użycia systemu terapeutycznego dopochwowego NuvaRing i w kolejnej przerwie w jego stosowaniu krwawienie z odstawienia nie wystąpiło, przed założeniem nowego systemu terapeutycznego dopochwowego należy upewnić się, że pacjentka nie jest w ciąży.
Jak opóźnić wystąpienie krwawienia lub przesunąć je w czasie
W wyjątkowych przypadkach, aby opóźnić wystąpienie krwawienia z odstawienia, pacjentka może założyć nowy system terapeutyczny dopochwowy, opuszczając tygodniową przerwę w jego stosowaniu. Nowy system terapeutyczny dopochwowy można używać przez następne 3 tygodnie.
W tym czasie może występować krwawienie śródcykliczne lub plamienie. Po tygodniowej przerwie w stosowaniu systemu terapeutycznego dopochwowego powraca się do normalnego stosowania NuvaRing.
Aby przesunąć w czasie wystąpienie krwawienia z odstawienia na inny dzień tygodnia niż ten, do którego pacjentka jest przyzwyczajona, pacjentka może skrócić kolejną przerwę w stosowaniu NuvaRing o dowolną liczbę dni. Im przerwa w stosowaniu systemu terapeutycznego dopochwowego NuvaRing jest krótsza, tym większe jest prawdopodobieństwo braku krwawienia z odstawienia po jego usunięciu i wystąpienia krwawienia śródcyklicznego lub plamienia w czasie stosowania następnego systemu terapeutycznego dopochwowego.
Złożonych hormonalnych środków antykoncepcyjnych nie należy stosować w następujących przypadkach. Jeżeli jakikolwiek z podanych objawów wystąpi po raz pierwszy w okresie stosowania systemu terapeutycznego dopochwowego NuvaRing, należy jak najszybciej usunąć system terapeutyczny dopochwowy.
Ostrzeżenia
Jeżeli występuje którykolwiek z poniższych stanów lub czynniki ryzyka, należy omówić z pacjentką zasadność stosowania systemu terapeutycznego dopochwowego NuvaRing.
W razie pogorszenia lub wystąpienia po raz pierwszy któregokolwiek z wymienionych stanów lub czynników ryzyka kobieta powinna zgłosić się do lekarza prowadzącego, który zadecyduje, czy konieczne jest przerwanie stosowania systemu terapeutycznego dopochwowego NuvaRing.
Przed rozpoczęciem lub wznowieniem stosowania systemu terapeutycznego dopochwowego NuvaRing należy zebrać kompletny wywiad lekarki (w tym wywiad rodzinny) i sprawdzić, czy pacjentka nie jest w ciąży. Należy dokonać pomiaru ciśnienia tętniczego krwi oraz przeprowadzić badanie fizykalne, biorąc pod uwagę przeciwwskazania (patrz punkt 4.3) oraz ostrzeżenia (patrz punkt 4.4). Ważne jest zwrócenie uwagi kobiety na informacje dotyczące zakrzepicy żył i tętnic, w tym na ryzyko stosowania systemu terapeutycznego dopochwowego NuvaRing w porównaniu z innymi złożonymi hormonalnymi środkami antykoncepcyjnymi, objawy żylnej choroby
zakrzepowo-zatorowej oraz zaburzeń zakrzepowo-zatorowych tętnic, znane czynniki ryzyka oraz co należy robić w przypadku podejrzenia zakrzepicy.
Należy również polecić kobietom dokładne przeczytanie ulotki i stosowanie się do znajdujących się w niej zaleceń. Częstość i rodzaj badań powinny zostać dobrane na podstawie przyjętych zaleceń praktyki i dostosowane do każdej pacjentki.
Należy poinformować kobiety, że hormonalne środki antykoncepcyjne nie chronią przed zarażeniem wirusem HIV (AIDS) oraz innymi chorobami przenoszonymi drogą płciową.
Zmniejszona skuteczność
Skuteczność systemu terapeutycznego dopochwowego NuvaRing może być zmniejszona w wypadku nieprzestrzegania zaleceń (punkt 4.2) lub jednoczesnego stosowania produktów leczniczych zmniejszających stężenie etynyloestradiolu i (lub) etonogestrelu w osoczu (punkt 4.5).
Zmniejszona kontrola cyklu
W czasie stosowania systemu terapeutycznego dopochwowego NuvaRing mogą występować nieregularne krwawienia (plamienia i krwawienia śródcykliczne). Jeśli nieregularne krwawienia są zjawiskiem nowym, a dotychczas w czasie poprawnego stosowania systemu terapeutycznego dopochwowego NuvaRing cykle były regularne, należy rozważyć przyczyny pozahormonalne, wdrażając odpowiednie metody diagnostyczne dla wykluczenia choroby nowotworowej lub ciąży. Do metod tych może się zaliczać zabieg wyłyżeczkowania jamy macicy.
U niektórych kobiet krwawienie z odstawienia może nie wystąpić w czasie przerwy w stosowaniu systemu terapeutycznego dopochwowego NuvaRing. Jeśli NuvaRing był stosowany zgodnie
z zaleceniami opisanymi w punkcie 4.2, prawdopodobieństwo ciąży jest bardzo małe. Jeśli jednak NuvaRing nie był stosowany zgodnie z zaleceniami i nie wystąpiło spodziewane krwawienie
z odstawienia lub jeśli spodziewane krwawienie nie wystąpiło dwukrotnie, przed kontynuowaniem stosowania systemu terapeutycznego dopochwowego NuvaRing należy upewnić się, że pacjentka nie jest w ciąży.
Ekspozycja partnera na etynyloestradiol i etonogestrel
Wielkość ekspozycji na etynyloestradiol i etonogestrel w czasie stosunku i jej potencjalne znaczenie farmakologiczne dla partnera nie zostały określone.
Uszkodzenie nuvaring
Bardzo rzadko zgłaszano przypadki uszkodzenia systemu terapeutycznego dopochwowego NuvaRing w czasie stosowania (patrz punkt 4.5). W związku z uszkodzeniem systemu terapeutycznego dopochwowego zgłaszano uszkodzenia ściany pochwy. Pacjentka powinna w takim przypadku usunąć uszkodzony system terapeutyczny dopochwowy i jak najszybciej założyć nowy, dodatkowo przez następnych 7 dni stosować mechaniczne metody antykoncepcji, takie jak prezerwatywa dla mężczyzn. Należy upewnić się, że pacjentka nie jest w ciąży, a pacjentka powinna się skontaktować z lekarzem.
Samoistne wypadnięcie
Istnieją doniesienia o samoistnym wypadnięciu systemu terapeutycznego dopochwowego NuvaRing, na przykład z powodu niewłaściwego założenia systemu terapeutycznego dopochwowego NuvaRing, w czasie usuwania tamponu, podczas stosunku lub w przypadku ciężkiego i nawykowego zaparcia. Wypadnięcie systemu terapeutycznego dopochwowego NuvaRing niezauważone przez dłuższy czas może spowodować brak skuteczności antykoncepcyjnej i (lub) wystąpienie krwawienia śródcyklicznego. Z tych względów pacjentki powinny regularnie sprawdzać obecność systemu terapeutycznego dopochwowego NuvaRing w pochwie (na przykład przed i po stosunku płciowym).
Jeśli NuvaRing znajdował się poza pochwą przez czas krótszy niż 3 godziny, nie wpłynęło to na skuteczność antykoncepcyjną. Pacjentka powinna umyć system terapeutyczny dopochwowy w zimnej lub letniej (nie gorącej) wodzie i jak najszybciej założyć go ponownie, nie później niż w ciągu
3 godzin od wypadnięcia.
Jeśli pacjentka podejrzewa lub jest pewna, że NuvaRing znajdował się poza pochwą przez czas dłuższy niż 3 godziny, skuteczność antykoncepcyjna mogła się zmniejszyć. W tym przypadku należy postępować zgodnie z instrukcją zawartą w punkcie 4.2 „Postępowanie, gdy NuvaRing znajdzie się tymczasowo poza pochwą”.
INTERAKCJE Z INNYMI PRODUKTAMI LECZNICZYMI
Uwaga: W celu określenia potencjalnych interakcji, należy zapoznać się z informacjami dotyczącymi jednocześnie stosowanych produktów leczniczych.
Wpływ innych produktów leczniczych na system terapeutyczny dopochwowy NuvaRing
Mogą występować interakcje z produktami leczniczymi lub produktami ziołowymi, które indukują enzymy mikrosomalne, co może skutkować zwiększeniem klirensu hormonów płciowych i może prowadzić do wystąpienia krwawienia śródcyklicznego i (lub) zmniejszenia skuteczności antykoncepcyjnej.
Postępowanie
Indukcja enzymów może być widoczna już po kilku dniach leczenia. Maksymalna indukcja enzymów jest na ogół widoczna w ciągu kilku tygodni. Po przerwaniu leczenia, indukcja enzymów może utrzymywać się przez około 4 tygodnie.
Krótkotrwałe leczenie
Kobiety podczas leczenia produktami leczniczymi lub produktami ziołowymi indukującymi enzymy, w trakcie stosowania systemu terapeutycznego dopochwowego NuvaRing powinny czasowo stosować mechaniczne metody antykoncepcji lub jeszcze jedną metodę antykoncepcji. Uwaga: systemu terapeutycznego dopochwowego NuvaRing nie należy stosować z diafragmą, kapturkiem naszyjkowym lub prezerwatywą dla kobiet. Antykoncepcja mechaniczna musi być stosowana przez cały okres jednoczesnego przyjmowania produktów leczniczych indukujących enzymy i przez 28 dni po ich odstawieniu. Jeśli jednocześnie stosowane produkty lecznicze indukujące enzymy przyjmowane są przez okres dłuższy niż 3 tygodnie stosowania systemu terapeutycznego dopochwowego, następny system terapeutyczny dopochwowy należy założyć natychmiast, bez przerwy w stosowaniu systemu terapeutycznego dopochwowego.
Długotrwałe leczenie
Kobietom długotrwale leczonym produktami leczniczymi indukującymi enzymy wątrobowe zaleca się stosowanie innej, skutecznej, niehormonalnej metody antykoncepcji.
W literaturze opisano następujące interakcje.
Substancje zwiększające klirens złożonych hormonalnych środków antykoncepcyjnych
Mogą występować interakcje z produktami leczniczymi lub produktami ziołowymi, które indukują enzymy mikrosomalne, zwłaszcza enzymy cytochromu P450 (CYP), co może prowadzić do zwiększenia klirensu, powodującego zmniejszenie stężenia hormonów płciowych w osoczu
i zmniejszenia skuteczności złożonych hormonalnych środków antykoncepcyjnych, w tym systemu terapeutycznego dopochwowego NuvaRing. Do tych produktów należy fenytoina, fenobarbital, prymidon, bosentan, karbamazepina, ryfampicyna, a prawdopodobnie również okskarbazepina, topiramat, felbamat, gryzeofulwina, niektóre inhibitory proteazy HIV (np. rytonawir)
i nienukleozydowe inhibitory odwrotnej transkryptazy (np. efawirenz) oraz produkty zawierające ziele dziurawca zwyczajnego (Hypericum perforatum).
Substancje wywierające różny wpływ na klirens złożonych hormonalnych środków antykoncepcyjnych Jednoczesne podawanie z hormonalnymi środkami antykoncepcyjnymi wielu połączeń inhibitorów proteazy HIV (np. nelfinawir) i nienukleozydowych inhibitorów odwrotnej transkryptazy (np. newirapiny) i (lub) połączeń z produktami leczniczymi wirusa zapalenia wątroby typu C (np. boceprewir, telaprewir), może zwiększać lub zmniejszać stężenie progestagenów, w tym etonogestrelu, lub estrogenu w osoczu. W niektórych przypadkach wpływ netto tych zmian może mieć znaczenie kliniczne.
Substancje zmniejszające klirens złożonych hormonalnych środków antykoncepcyjnych
Kliniczne znaczenie potencjalnych interakcji z inhibitorami enzymów pozostaje nieznane. Jednoczesne podawanie silnych (np. ketokonazol, itrakonazol, klarytromycyna) lub umiarkowanych (np. flukonazol, diltiazem, erytromycyna) inhibitorów CYP3A4 może zwiększać stężenie estrogenu lub progestagenu, w tym etonogestrelu.
Zgłaszano przypadki uszkodzenia systemu terapeutycznego dopochwowego podczas jednoczesnego stosowania produktów dopochwowych, w tym przeciwgrzybiczych produktów leczniczych,
antybiotyków oraz środków nawilżających (patrz punkt 4.4 „Uszkodzenie NuvaRing”). Jak wynika z badań farmakokinetycznych, produkty lecznicze przeciwgrzybicze i środki plemnikobójcze stosowane dopochwowo nie powinny wpływać na skuteczność antykoncepcyjną i bezpieczeństwo stosowania systemu terapeutycznego dopochwowego NuvaRing.
Hormonalne środki antykoncepcyjne mogą zaburzać metabolizm innych produktów leczniczych, zwiększając stężenie jednych produktów leczniczych (np. cyklosporyny), a zmniejszając innych (np. lamotryginy) w osoczu i tkankach.
Interakcje farmakodynamiczne
Jednoczesne stosowanie z produktami leczniczymi zawierającymi ombitaswir, parytaprewir, rytonawir oraz dasabuwir, z rybawiryną lub bez rybawiryny lub z produktami leczniczymi zawierającymi glekaprewir, pibrentaswir może zwiększać ryzyko zwiększonej aktywności AlAT (patrz
punkty 4.3 oraz 4.4). W związku z tym pacjentki stosujące system terapeutyczny dopochwowy NuvaRing muszą stosować alternatywną metodę antykoncepcji (np. antykoncepcję zawierającą wyłącznie progestagen lub metody niehormonalne) przed rozpoczęciem stosowania powyższego schematu leczenia skojarzonego. Stosowanie systemu terapeutycznego dopochwowego NuvaRing można ponownie rozpocząć 2 tygodnie po zakończeniu leczenia powyższym schematem leczenia skojarzonego.
Badania diagnostyczne
Stosowanie antykoncepcji hormonalnej może wpływać na wyniki niektórych badań diagnostycznych, w tym parametrów biochemicznych czynności wątroby, tarczycy, nadnerczy i nerek, stężenia białek nośnikowych w osoczu (np. globuliny wiążącej kortykosteroidy i globuliny wiążącej hormony płciowe), poszczególnych frakcji lipidów i lipoprotein, parametrów metabolizmu węglowodanów, wskaźników układu krzepnięcia i fibrynolizy. Mimo tych odchyleń poszczególne parametry na ogół pozostają w granicach normy laboratoryjnej.
Interakcje z tamponami
Badania farmakokinetyczne wykazały, że stosowanie tamponów nie ma wpływu na wchłanianie hormonów uwalnianych z systemu terapeutycznego dopochwowego NuvaRing. W rzadkich przypadkach NuvaRing może wypaść w czasie usuwania tamponu (patrz punkt „Postępowanie, gdy NuvaRing znajdzie się tymczasowo poza pochwą”).
Płodność
System terapeutyczny dopochwowy NuvaRing jest wskazany do stosowania w celu zapobiegania ciąży. Jeśli kobieta zechce zajść w ciążę i w związku z tym zaprzestać stosowania systemu terapeutycznego dopochwowego NuvaRing, przed próbą zajścia w ciążę należy odczekać do wystąpienia naturalnego krwawienia miesiączkowego, ponieważ pomoże to ustalić termin porodu.
Ciąża
NuvaRing nie jest wskazany do stosowania w ciąży. Jeśli w czasie stosowania systemu terapeutycznego dopochwowego NuvaRing pacjentka zajdzie w ciążę, powinna system terapeutyczny dopochwowy usunąć. Rozległe badania epidemiologiczne nie wykazały ani zwiększonego ryzyka wad wrodzonych u dzieci, których matki przed zajściem w ciążę stosowały złożone hormonalne środki antykoncepcyjne, ani działania teratogennego tych produktów stosowanych nieświadomie we wczesnej ciąży.
Badanie kliniczne prowadzone w małej grupie kobiet wykazało, że stężenie hormonów płciowych w jamie macicy u pacjentek stosujących NuvaRing jest zbliżone do stężenia obserwowanego
u pacjentek stosujących złożone doustne hormonalne środki antykoncepcyjne (patrz punkt 5.2) pomimo stosowania dopochwowego. Jak dotąd nie ma danych na temat wyników zakończenia ciąż u pacjentek stosujących NuvaRing.
Podejmując decyzję o ponownym rozpoczęciu stosowania systemu terapeutycznego dopochwowego NuvaRing należy wziąć pod uwagę, zwiększone ryzyko żylnej choroby zakrzepowo-zatorowej
u kobiet w okresie poporodowym (patrz punkty 4.2 i 4.4).
Karmienie piersią
Stosowanie estrogenów może wpływać na karmienie piersią, zmniejszając ilość pokarmu i zmieniając jego skład. Z tych względów NuvaRing nie jest zalecany do czasu całkowitego zaprzestania karmienia piersią. Niewielka ilość hormonów płciowych i (lub) ich metabolitów może być wydzielana z mlekiem matki, jednak nie ma dowodów na to, aby mogło to mieć niekorzystny wpływ na zdrowie dziecka.
Na podstawie badań farmakodynamicznych stwierdzono, że NuvaRing nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Do najczęstszych działań niepożądanych obserwowanych w badaniach klinicznych z zastosowaniem systemu terapeutycznego dopochwowego NuvaRing należał ból głowy oraz zapalenie pochwy
i upławy, zgłaszane przez 5-6% kobiet.
Opis wybranych działań niepożądanych
U kobiet stosujących złożone hormonalne środki antykoncepcyjne odnotowano zwiększone ryzyko zakrzepicy żył i tętnic oraz zdarzeń zakrzepowo-zatorowych, w tym zawału serca, udaru, przemijającego napadu niedokrwiennego, zakrzepicy żylnej oraz zatorowości płucnej, zostały one szerzej omówione w punkcie 4.4.
Także inne działania niepożądane zgłaszane przez kobiety stosujące złożone hormonalne środki antykoncepcyjne zostały opisane szczegółowo w punkcie 4.4.
Działania niepożądane zgłoszone w badaniach klinicznych, badaniach obserwacyjnych lub w okresie po wprowadzeniu produktu leczniczego NuvaRing do obrotu przedstawiono w poniższej tabeli. Do opisania poszczególnych zdarzeń niepożądanych użyto najbardziej odpowiednich terminów według MedDRA.
Wszystkie działania niepożądane zostały wymienione zgodnie z klasyfikacją układów i narządów oraz według częstości występowania; często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1000) oraz nieznana (częstość nie może być określona na podstawie dostępnych danych).
Klasyfikacja układów i narządów | Często | Niezbyt często | Rzadko | Nieznana1 |
Zakażenia i zarażenia pasożytnicze | zapalenie pochwy | zapalenie szyjki macicy, zapalenie pęcherza, zakażenia dróg moczowych | ||
Zaburzenia układu immunologicznego | reakcje nadwrażliwości, w tym reakcja anafilaktyczna oraz nasilenie objawów dziedzicznego oraz nabytego |
Klasyfikacja układów i narządów | Często | Niezbyt często | Rzadko | Nieznana1 |
obrzęku naczynioruchowe go | ||||
Zaburzenia metabolizmu i odżywiania | zwiększenie apetytu | |||
Zaburzenia psychiczne | depresja, zmniejszenie popędu płciowego | zmieniony nastrój, chwiejność nastroju, nagłe zmiany nastroju | ||
Zaburzenia układu nerwowego | bóle głowy, migrena | zawroty głowy, niedoczulica | ||
Zaburzenia oka | zaburzenia widzenia | |||
Zaburzenia naczyniowe | uderzenia gorąca | żylna choroba zakrzepowo- zatorowa tętnicze zaburzenia zakrzepowo- zatorowe | ||
Zaburzenia żołądka i jelit | bóle brzucha, nudności | wzdęcia, biegunka, wymioty, zaparcia | ||
Zaburzenia skóry i tkanki podskórnej | trądzik | łysienie, egzema, świąd, wysypka, pokrzywka | ostuda | |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | ból pleców, skurcze mięśni, ból w kończynie | |||
Zaburzenia nerek i dróg moczowych | zaburzenia w oddawaniu moczu, parcie na mocz, częstomocz | |||
Zaburzenia układu rozrodczego i piersi | tkliwość piersi, świąd żeńskich narządów płciowych, bolesne miesiączkowanie, bóle w obrębie miednicy, upławy | brak miesiączki, bolesność piersi, powiększenie piersi, guzek w piersi, polip szyjki macicy, krwawienie w trakcie stosunku, dyspareunia, wywinięcie szyjki macicy, dysplazja włóknisto- torbielowata piersi, krwotoczne miesiączki, krwotok maciczny, dyskomfort | mlekotok | dolegliwości prącia |
Klasyfikacja układów i narządów | Często | Niezbyt często | Rzadko | Nieznana1 |
w obrębie miednicy, zespół napięcia przedmiesiączkowego, skurcz macicy, uczucie palenia w pochwie, nieprzyjemny zapach z pochwy, ból w pochwie, dyskomfort sromu i pochwy, suchość sromu i pochwy | ||||
Zaburzenia ogólne i stany w miejscu podania | uczucie zmęczenia, drażliwość, złe samopoczucie, obrzęk, uczucie obecności ciała obcego | obrośniecie systemu terapeutycznego dopochwowego przez tkankę pochwy | ||
Badania diagnostyczne | zwiększenie masy ciała | zwiększenie ciśnienia krwi | ||
Urazy, zatrucia i powikłania po zabiegach | dyskomfort związany z użytkowaniem systemu terapeutycznego dopochwowego, wypadnięcie systemu terapeutycznego dopochwowego | powikłania związane ze stosowaniem systemu terapeutycznego dopochwowego | uszkodzenie ściany pochwy związane z uszkodzeniem systemu terapeutycznego dopochwowego |
1 Lista działań niepożądanych oparta na raportach spontanicznych.
Istnieją doniesienia na temat nowotworów zależnych od hormonów płciowych (np. nowotwory wątroby, piersi) u pacjentek przyjmujących złożone hormonalne środki antykoncepcyjne. Więcej informacji patrz punkt 4.4.
Bardzo rzadko zgłaszano przypadki uszkodzenia systemu terapeutycznego dopochwowego NuvaRing w czasie stosowania (patrz punkty 4.4 i 4.5).
Interakcje
Interakcje innych produktów leczniczych (induktorów enzymów) z hormonalnymi środkami antykoncepcyjnymi mogą prowadzić do wystąpienia krwawienia śródcyklicznego i (lub) zmniejszenia skuteczności antykoncepcyjnej (patrz punkt 4.5).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Faks: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Jak dotąd nie ma doniesień o ciężkich szkodliwych działaniach związanych z przedawkowaniem hormonalnych środków antykoncepcyjnych. Objawy, jakie mogą wystąpić to: nudności, wymioty oraz niewielkie krwawienie z pochwy u młodych dziewcząt. Po przedawkowaniu nie stosuje się żadnego antidotum, w razie potrzeby należy stosować leczenie objawowe.
Grupa farmakoterapeutyczna: inne leki ginekologiczne, dopochwowe środki antykoncepcyjne, system terapeutyczny dopochwowy z progestagenem i estrogenem, kod ATC: G02BB01.
Mechanizm działania
NuvaRing zawiera etonogestrel i etynyloestradiol. Etonogestrel jest progestagenem, pochodną
19-nortestosteronu i wykazuje wysokie powinowactwo do receptorów dla progesteronu w narządach docelowych. Etynyloestradiol jest estrogenem szeroko stosowanym w produktach antykoncepcyjnych. Działanie antykoncepcyjne systemu terapeutycznego dopochowego NuvaRing opiera się na wielu mechanizmach, z których najważniejszy to hamowanie owulacji.
Skuteczność kliniczna i bezpieczeństwo stosowania
Badania kliniczne prowadzono wśród kobiet w wieku od 18 do 40 lat na całym świecie (USA, Europa i Brazylia). Skuteczność antykoncepcyjna była porównywalna do skuteczności antykoncepcyjnej złożonych doustnych środków antykoncepcyjnych. Na podstawie badań klinicznych z użyciem systemu terapeutycznego dopochwowego NuvaRing uzyskano przedstawione w poniższej tabeli współczynniki Pearl’a (liczba ciąż na 100 kobietolat stosowania).
Analiza Metoda | Współczynnik Pearl’a | 95% CI | Ilość cykli |
ITT (pacjentka + błąd metody) | 0,96 | 0,64 – 1,39 | 37 977 |
PP (błąd metody) | 0,64 | 0,35 – 1,07 | 28 723 |
W przypadku stosowania złożonych doustnych środków antykoncepcyjnych o większej dawce (0,05 mg etynyloestradiolu) ryzyko raka endometrium i raka jajnika jest mniejsze. Jak dotąd nie ustalono, czy odnosi się to również do środków antykoncepcyjnych o mniejszej dawce estrogenu, takich jak NuvaRing.
PROFIL KRWAWIEŃ
Duże badanie porównawcze z zastosowaniem doustnego środka antykoncepcyjnego zawierającego lewonorgestrel + etynyloestradiol w dawkach odpowiednio 150/30 μg (n= 512 w porównaniu do n=518), oceniające profil krwawień w czasie 13 kolejnych cykli wykazało małą częstość występowania plamień i krwawień śródcyklicznych u kobiet stosujących NuvaRing (2,0-6,4%).
Ponadto u większości pacjentek krwawienia z dróg rodnych występowały jedynie w okresie przerwy w stosowaniu systemu terapeutycznego dopochwowego NuvaRing (58,8-72,8%).
WPŁYW NA GĘSTOŚĆ MINERALNĄ KOŚCI
Wpływ systemu terapeutycznego dopochwowego NuvaRing (n=76) na gęstość mineralną kości (ang. BMD) badano w porównaniu z dopochwową wkładką antykoncepcyjną nie zawierającą hormonów (ang. IUD) (n=31) przez okres dwóch lat. Nie stwierdzono negatywnego wpływu na gęstość mineralną kości.
Dzieci i młodzież
Nie badano bezpieczeństwa stosowania ani skuteczności systemu terapeutycznego dopochwowego NuvaRing u młodzieży w wieku poniżej 18 lat.
Wchłanianie
Etonogestrel uwalniany z systemu terapeutycznego dopochwowego NuvaRing jest szybko wchłaniany przez błonę śluzową pochwy. Maksymalne stężenie w osoczu wynoszące około 1700 pg/ml etonogestrel osiąga po tygodniu od założenia systemu terapeutycznego dopochwowego. Stężenie
w osoczu wykazuje nieznaczne wahania i powoli się zmniejsza do około 1600 pg/ml po upływie 1 tygodnia, 1500 pg/ml po upływie 2 tygodni i 1400 pg/ml po upływie 3 tygodni stosowania.
Całkowita biodostępność wynosi niemal 100%, jest więc wyższa niż po podaniu doustnym.
U niewielkiej liczby kobiet stosujących NuvaRing lub doustny środek antykoncepcyjny zawierający 0,150 mg dezogestrelu i 0,020 mg etynyloestradiolu zmierzono stężenie etonogestrelu w szyjce i jamie macicy. Obserwowane wartości były porównywalne.
Dystrybucja
Etonogestrel wiąże się z albuminami osocza i z globuliną wiążącą hormony płciowe (SHBG). Pozorna objętość dystrybucji etonogestrelu wynosi 2,3 l/kg mc.
Metabolizm
Etonogestrel podlega dobrze poznanym przemianom metabolicznym wspólnym dla związków steroidowych. Pozorny klirens osocza wynosi około 3,5 l/godz. Nie stwierdzono bezpośrednich interakcji z jednocześnie podawanym etynyloestradiolem.
Eliminacja
Stężenie etonogestrelu w osoczu zmniejsza się w dwóch fazach. W końcowej fazie eliminacji okres półtrwania wynosi około 29 godzin. Etonogestrel i jego metabolity są wydalane wraz z moczem
i żółcią w stosunku 1,7:1. Okres połowicznej eliminacji metabolitów wynosi około 6 dni.
Etynyloestradiol
Wchłanianie
Etynyloestradiol uwalniany z systemu terapeutycznego dopochwowego NuvaRing jest szybko wchłaniany przez błonę śluzową pochwy. Maksymalne stężenie w osoczu wynoszące około 35 pg/ml występuje po 3 dniach od założenia systemu terapeutycznego dopochwowego NuvaRing i zmniejsza się do 19 pg/ml po upływie 1 tygodnia, 18 pg/ml po upływie 2 tygodni i 18 pg/ml po upływie
3 tygodni stosowania. Ogólnoustrojowa miesięczna ekspozycja na etynyloestradiol (AUC0-∞) przy stosowaniu systemu terapeutycznego dopochwowego NuvaRing wynosi 10,9 ng.godz/ml. Całkowita biodostępność wynosi około 56%, co jest porównywalne z podaniem doustnym etynyloestradiolu.
U niewielkiej liczby kobiet stosujących NuvaRing lub doustny środek antykoncepcyjny zawierający 0,150 mg dezogestrelu i 0,020 mg etynyloestradiolu zmierzono stężenie etynyloestradiolu w szyjce i jamie macicy. Obserwowane wartości były porównywalne.
Dystrybucja
Etynyloestradiol wiąże się w znacznym stopniu, lecz niespecyficznie z albuminami osocza. Pozorna objętość dystrybucji wynosi około 15 l/kg mc.
Metabolizm
Etynyloestradiol jest metabolizowany głównie na drodze hydroksylacji aromatycznej, choć tworzy się również szereg innych pochodnych hydroksylowych i metylowych. Występują one jako wolne metabolity oraz w postaci sprzężonej z siarczanami i glukuronidami. Pozorny klirens wynosi około 35 l/godz.
Eliminacja
Stężenie etynyloestradiolu w osoczu zmniejsza się w dwóch fazach. Końcowa faza eliminacji charakteryzuje się dużą zmiennością osobniczą okresu półtrwania; średnio wynosi on 34 godziny. Etynyloestradiol nie jest wydalany w postaci niezmienionej; jego metabolity są wydalane z moczem i żółcią w stosunku 1,3:1. Okres połowicznej eliminacji metabolitów wynosi około 1,5 doby.
Szczególne grupy pacjentów
Dzieci i młodzież
Nie badano farmakokinetyki systemu terapeutycznego dopochwowego NuvaRing u zdrowych dziewcząt w wieku poniżej 18 lat, po pierwszej miesiączce.
Pacjentki z zaburzeniami czynności nerek
Nie przeprowadzono badań oceniających wpływ choroby nerek na właściwości farmakokinetyczne systemu terapeutycznego dopochwowego NuvaRing.
Pacjentki z zaburzeniami czynności wątroby
Nie przeprowadzono badań oceniających wpływ choroby wątroby na właściwości farmakokinetyczne systemu terapeutycznego dopochwowego NuvaRing. Niemniej jednak u kobiet z zaburzeniami czynności wątroby hormony steroidowe mogą być słabo metabolizowane.
Grupy etniczne
Nie przeprowadzono badań oceniających właściwości farmakokinetyczne u pacjentek z różnych grup etnicznych.
Dane niekliniczne na temat etynyloestradiolu i etonogestrelu, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród nie ujawniają żadnego szczególnego zagrożenia dla człowieka poza tym, które jest ogólnie znane.
Ocena ryzyka zagrożenia dla środowiska (ang. ERA, Environmental risk assessment)
Badania oceniające ryzyko zagrożenia dla środowiska wykazały, że 17α-etynyloestradiol
i etonogestrel mogą stanowić zagrożenie dla organizmów wód powierzchniowych (patrz punkt 6.6).
Etylenu i octanu winylu kopolimer, 28% octanu winylu Etylenu i octanu winylu kopolimer, 9% octanu winylu Magnezu stearynian
Nie dotyczy.
40 miesięcy.
Przed wydaniem produktu leczniczego pacjentce:
Przechowywać w lodówce (w temperaturze 2°C-8°C) (maksymalnie przez 3 lata).
W chwili wydania:
Farmaceuta umieszcza datę wydania produktu na opakowaniu. NuvaRing powinien być użyty nie później niż 4 miesiące od daty wydania, ale we wszystkich przypadkach powinien być użyty przed upływem terminu ważności w zależności, co następuje wcześniej.
Po wydaniu produktu leczniczego pacjentce:
Przechowywać w temperaturze poniżej 30°C (maksymalnie przez 4 miesiące). Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem i wilgocią.
NuvaRing
Saszetka zawiera jeden system terapeutyczny dopochwowy NuvaRing. Saszetka jest wykonana z folii aluminiowej, pokrytej od wewnątrz polietylenem małej gęstości i od zewnątrz poli (tereftalanu) etylenu (PET). Saszetkę można powtórnie zamknąć po otwarciu i jest ona odporna na zamoczenie.
Saszetki są umieszczone w tekturowym pudełku wraz z ulotką.
Aplikator NuvaRing
Dostępny oddzielnie lub dołączony do opakowania. Aplikator NuvaRing może nie być dostępny we wszystkich krajach. Aplikator jest plastikowym, niesterylnym wyrobem medycznym, wykonanym z polimeru polipropylenowego, zawierającym dodatek zmniejszający tarcie (stanowiący mniej niż 5%). Jest on przeznaczony do jednorazowego użycia (tzn. jednorazowy). Każdy aplikator jest zapakowany oddzielnie. Aplikator posiada oznakowanie CE, które jest wytłoczone na wyrobie medycznym.
Produkt jest dostępny w następujących opakowaniach:
NuvaRing
Patrz punkt 4.2. Farmaceuta powinien umieścić datę wydania produktu na opakowaniu. Zaleca się, aby w przypadku opakowań zawierających 3 systemy umieszczać datę wydania zarówno na opakowaniu zewnętrznym, jak i na saszetce. Należy zużyć NuvaRing przed upływem 4 miesięcy od daty wydania, ale we wszystkich przypadkach powinien być użyty przed upływem terminu ważności w zależności, co następuje wcześniej. Po usunięciu systemu terapeutycznego dopochwowego NuvaRing należy go umieścić w zamykanej saszetce i wyrzucić z innymi odpadkami domowymi
w taki sposób, aby uniknąć narażenia innych osób. Ten produkt leczniczy może stanowić zagrożenie dla środowiska (patrz punkt 5.3). Nie należy wyrzucać systemu terapeutycznego dopochwowego NuvaRing do toalety. Nieużywane (przeterminowane) systemy terapeutyczne należy usunąć zgodnie z lokalnymi przepisami.
Aplikator NuvaRing
Aplikator NuvaRing nie może być używany ponownie; jest on przeznaczony do jednorazowego użycia. W razie przypadkowego upuszczenia aplikatora, należy umyć go w zimnej lub letniej (NIE gorącej) wodzie. Aplikator należy wyrzucić do zwykłego domowego pojemnika na odpadki natychmiast po użyciu. Nie należy wyrzucać aplikatora do toalety.
Organon Polska Sp. z o.o. ul. Marszałkowska 126/134 00-008 Warszawa
14121
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 02 października 2007 r. Data ostatniego przedłużenia pozwolenia: 30 października 2012 r.
04.09.2022