Spis treści:
- NAZWA PRODUKTU LECZNICZEGO LADYBON, 2,5 mg, tabletki
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO LADYBON, 2,5 mg, tabletki
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Leczenie objawów niedoboru estrogenu u kobiet, u których od ostatniej miesiączki upłynął co
najmniej rok.
Zapobieganie osteoporozie u kobiet po menopauzie z grupy wysokiego ryzyka wystąpienia złamań, które nie tolerują lub u których istnieją przeciwwskazania do stosowania innych produktów wskazanych do stosowania w zapobieganiu osteoporozie (patrz również punkt 4.4).
Należy dokładnie ocenić ryzyko ogólne, indywidualnie u każdej kobiety, szczególnie u pacjentek powyżej 60. roku życia oraz należy rozważyć ryzyko wystąpienia udaru mózgu (patrz punkty 4.4 i 4.8).
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Ciąża i karmienie piersią.
Rozpoznany rak piersi, rak piersi w wywiadzie lub podejrzenie raka piersi – tibolon zwiększał
ryzyko nawrotu raka piersi w badaniu z grupą kontrolną otrzymującą placebo.
Rozpoznany nowotwór złośliwy zależny od estrogenów lub jego podejrzenie (np. rak endometrium);
Niezdiagnozowane krwawienie z dróg rodnych.
Nieleczona hiperplazja endometrium.
Przebyta choroba zakrzepowo-zatorowa lub obecna żylna choroba zakrzepowo-zatorowa (zakrzepica żył głębokich, zatorowość płucna).
Rozpoznane zaburzenia zakrzepowe (np. niedobór białka C, białka S lub antytrombiny, patrz punkt 4.4).
Czynna lub niedawno przebyta tętnicza choroba zakrzepowo-zatorowa (np. dusznica bolesna, zawał mięśnia sercowego, udar mózgu, przemijające napady niedokrwienne).
Ostra choroba wątroby lub choroba wątroby w wywiadzie, do czasu powrotu parametrów czynności wątroby do normy.
Porfiria.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Mięśniak gładkokomórkowy (włókniakomięśniak gładki macicy) lub endometrioza.
Czynniki ryzyka zaburzeń zakrzepowo-zatorowych (patrz niżej).
Czynniki ryzyka nowotworów zależnych od estrogenów, np. rak piersi u krewnej pierwszego stopnia.
Nadciśnienie tętnicze.
Choroby wątroby (np. gruczolak wątroby).
Cukrzyca z lub bez zajęcia naczyń.
Kamica żółciowa.
Migrena lub (silne) bóle głowy.
Toczeń rumieniowaty układowy.
Hiperplazja endometrium w wywiadzie (patrz niżej).
Padaczka.
Astma.
Otoskleroza.
Żółtaczka lub pogorszenie czynności wątroby.
Istotny wzrost ciśnienia tętniczego.
Wystąpienie po raz pierwszy migrenowych bólów głowy.
Ciąża.
Hiperplazja endometrium i rak endometrium
Dane dostępne z badań z randomizacją, z grupą kontrolną, są sprzeczne, jakkolwiek badania obserwacyjne zgodnie wykazały zwiększone ryzyko rozpoznania raka endometrium u kobiet, które stosowały tibolon w normalnej praktyce klinicznej (patrz punkt 4.8). W badaniach tych ryzyko wzrastało z czasem stosowania. Tibolon zwiększa grubość endometrium mierzoną w przezpochwowym badaniu ultrasonograficznym.
W ciągu pierwszych miesięcy leczenia mogą występować krwawienia lub plamienia w środku cyklu (patrz punkt 5.1). Należy poinformować pacjentki o konieczności zgłaszania przypadków krwawienia lub plamienia w środku cyklu, jeśli nadal występuje ono po 6 miesiącach od rozpoczęcia leczenia, pojawi się po tym czasie lub jeśli utrzymuje się po przerwaniu leczenia. Pacjentkę należy skierować na badanie ginekologiczne, które może obejmować biopsję endometrium, w celu wykluczenia złośliwego nowotworu endometrium.
Rak piersi
Metaanaliza badań epidemiologicznych, obejmująca m.in. badanie Million Women Study (MWS) wykazała znaczny wzrost ryzyka wystąpienia raka piersi w związku ze stosowaniem dawki 2,5 mg.
Ryzyko to uwidaczniało się w ciągu 3 lat stosowania i zwiększało się z wraz z wydłużeniem czasu stosowania, patrz punkt 4.8. Po zaprzestaniu terapii dodatkowe ryzyko z czasem maleje, a czas powrotu do poziomu początkowego zależy od czasu trwania HTZ. Jeśli HTZ trwała ponad 5 lat, ryzyko może się utrzymywać przez 10 lat lub dłużej.
Rak jajnika
Rak jajnika występuje dużo rzadziej niż rak piersi. Dane epidemiologiczne z dużej metaanalizy wskazują na nieco zwiększone ryzyko pojawienia się tego nowotworu u kobiet stosujących wyłącznie estrogenową lub złożoną estrogenowo-progestagenową HTZ, które staje się widoczne w ciągu 5 lat jej stosowania i zmniejsza się z czasem po jej zaprzestaniu. Niektóre inne badania, w tym badanie WHI sugerują, że stosowanie skojarzonej hormonalnej terapii zastępczej może wiązać się z podobnym lub nieco mniejszym ryzykiem (patrz punkt 4.8).
W badaniu Million Women Study wykazano, że ryzyko względne wystąpienia raka jajnika u kobiet stosujących tibolon było podobne do poziomu ryzyka związanego ze stosowaniem innych form HTZ.
Żylna choroba zakrzepowo-zatorowa (ŻChZZ)
HTZ jest związana z 1,3 – 3-krotnym zwiększeniem ryzyka wystąpienia żylnej choroby zatorowo- zakrzepowej, w tym zakrzepicy żył głębokich lub zatorowości płucnej. Wystąpienie tych zdarzeń jest bardziej prawdopodobne w pierwszym roku stosowania hormonalnej terapii zastępczej, niż w latach późniejszych (patrz punkt 4.8). W badaniu epidemiologicznym z wykorzystaniem bazy danych z Wielkiej Brytanii, ryzyko wystąpienia żylnej choroby zakrzepowo-zatorowej związanej ze stosowaniem tibolonu było niższe niż ryzyko związane ze stosowaniem konwencjonalnej HTZ, ale jedynie niewielki odsetek kobiet stosował w okresie badania tibolon i nie można wykluczyć niewielkiego zwiększenia ryzyka w porównaniu z kobietami nie stosującymi terapii hormonalnej.
U pacjentek ze stwierdzoną zwiększoną krzepliwością krwi występuje zwiększone ryzyko żylnej choroby zakrzepowo-zatorowej i hormonalna terapia zastępcza może dodatkowo zwiększyć to ryzyko. Dlatego u tych pacjentek HTZ jest przeciwwskazana (patrz punkt 4.3).
Ogólnie uznane czynniki ryzyka wystąpienia żylnej choroby zakrzepowo-zatorowej obejmują stosowanie estrogenów, podeszły wiek, duże zabiegi operacyjne, przedłużające się unieruchomienie, nadwagę (BMI > 30 kg/m²), ciążę/okres popołogowy, toczeń rumieniowaty układowy (SLE) i raka. Brak jest zgodności opinii na temat potencjalnego znaczenia obecności żylaków na wystąpienie żylnej choroby zakrzepowo-zatorowej.
Podobnie jak w przypadku wszystkich pacjentów po leczeniu chirurgicznym, konieczne jest rozważenie zastosowania postępowania zapobiegającego wystąpieniu żylnej choroby zakrzepowo- zatorowej po zabiegu. Jeżeli spodziewane jest okresowe unieruchomienie po planowym zabiegu chirurgicznym zalecane jest czasowe zaprzestanie stosowania hormonalnej terapii zastępczej przez okres 4 do 6 tygodni przed zabiegiem chirurgicznym. Leczenie hormonalne nie powinno być wznawiane do czasu, gdy pacjentka nie osiągnie pełnej sprawności ruchowej.
W przypadku kobiet bez ŻChZZ w wywiadzie, ale z krewnym pierwszego stopnia, u którego zakrzepica wystąpiła w młodym wieku, można zalecić przeprowadzenie badania przesiewowego po dokładnym rozważeniu jego ograniczeń (jedynie część zaburzeń prowadzących do zwiększonej krzepliwości może być wykryta w badaniach przesiewowych). Jeżeli zostanie rozpoznane zaburzenie zwiększające krzepliwość, które prowadzi do zakrzepicy u członków rodziny lub jeżeli zaburzenia są ciężkie (np. niedobór antytrombiny, białka C lub białka S, lub złożone postacie tych niedoborów) hormonalna terapia zastępcza jest przeciwwskazana.
U kobiet, które już są w trakcie leczenia przeciwkrzepliwego konieczne jest staranne rozważenie korzyści i ryzyka stosowania hormonalnej terapii zastępczej lub tibolonu.
Jeśli dojdzie do rozwoju ŻChZZ po rozpoczęciu leczenia, lek należy odstawić. Pacjentkę należy poinformować, aby niezwłocznie zgłosiła się do lekarza, w przypadku wystąpienia potencjalnych objawów mogących wskazywać na zaburzenia zakrzepowo-zatorowe (np. bolesny obrzęk nogi, nagły ból w klatce piersiowej, duszność).
Choroba wieńcowa
Brak jest dowodów z randomizowanych badań z grupą kontrolną na ochronne działanie przed wystąpieniem zawału mięśnia sercowego u kobiet z (lub bez) istniejącej choroby wieńcowej, które otrzymywały HTZ z użyciem produktów estrogenowo-progestagenowych lub zawierających jedynie estrogen. W badaniu epidemiologicznym z użyciem GPRD nie znaleziono dowodów ochronnego działania przed wystąpieniem zawału mięśnia sercowego u kobiet w okresie pomenopauzalnym, które stosowały tibolon.
Niedokrwienny udar mózgu
Inne stany
Tibolon nie jest przeznaczony do stosowania w celu antykoncepcyjnym.
Leczenie tibolonem powoduje zależne od dawki zmniejszenie cholesterolu frakcji HDL (z 16,7% dla dawki 1,25 mg do 21,8% dla dawki 2,5 mg w ciągu 2 lat). Całkowite stężenia trójglicerydów i lipoprotein były również zmniejszone. Zmniejszenie stężenia cholesterolu całkowitego i frakcji VLDL nie były zależne od dawki. Stężenia cholesterolu frakcji LDL były niezmienione. Znaczenie kliniczne tych wyników nie jest znane.
Estrogeny mogą powodować retencję płynów i dlatego należy uważnie obserwować pacjentki
z nieprawidłową funkcją serca lub nerek.
U kobiet z hipertrójglicerydemią rozpoznaną przed rozpoczęciem leczenia konieczne są okresowe badania kontrolne w czasie terapii z użyciem estrogenu lub HTZ, ponieważ donoszono o rzadkich przypadkach znacznego zwiększenia stężenia trójglicerydów w osoczu krwi prowadzącym do wystąpienia zapalenia trzustki w czasie stosowania leczenia z użyciem estrogenu.
Leczenie tibolonem prowadzi do niewielkiego zmniejszenia stężenia globuliny wiążącej hormony tarczycy (ang. thyroid-binding globulin – TBG) i stężenia całkowitej tyroksyny (T4). Stężenia całkowite trójjodotyroniny (T3) pozostają bez zmian. Tibolon zmniejsza stężenie globuliny wiążącej hormony płciowe (ang. sex-hormone-binding globulin – SHBG) bez wpływu na stężenia globuliny wiążącej kortykosterydy (ang. corticoid-binding globulin – CBG) i wolnego kortyzolu.
Hormonalna terapia zastępcza nie powoduje poprawy funkcji poznawczych. Istnieją dowody zwiększonego ryzyka wystąpienia demencji u kobiet, u których rozpoczęto stosowanie HTZ z użyciem preparatów złożonych lub zawierających jedynie estrogen po 65. roku życia.
Produkt zawiera laktozę jednowodną. Lek nie powinien być stosowany u pacjentek z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy i galaktozy.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Obserwowano zwiększenie ryzyka wystąpienia raka piersi do 2-krotnie wyższego u kobiet stosujących leczenie produktami leczniczymi złożonymi estrogenowo-progestagenowymi przez okres dłuższy niż 5 lat.
Zwiększenie ryzyka u kobiet stosujących same estrogeny i tibolon jest mniejsze niż w przypadku pacjentek stosujących leczenie skojarzone estrogen-progestagen.
Poziom ryzyka jest zależny od czasu stosowania leków hormonalnych (patrz punkt 4.4).
Przedstawiono wyniki badania epidemiologicznego (MWS).
Tabela 2. Million Women Study – szacowane dodatkowe ryzyko raka piersi po 5 latach stosowania
Wiek
(lata)
Dodatkowe przypadki na 1000 kobiet nie stosujących HTZ*w okresie 5-cio letnim
Współczynnik
ryzyka i 95%CI#
Dodatkowe przypadki na 1000 kobiet stosujących HTZ w okresie 5-cio letnim
(95%CI)
HTZ zawierająca wyłącznie estrogen
50 - 65
9 - 12
1,2
1 - 2 (0-3)
Złożona HTZ zawierająca estrogen i progestagen
50 - 65
9 - 12
1,7
6 (5-7)
Tibolon
50 - 65
9 - 12
1,3
3 (0-6)
*W oparciu o podstawową częstość występowania w krajach rozwiniętych.
#Wskaźnik ogólnego ryzyka. Współczynnik ryzyka nie jest stały, rośnie wraz z wydłużeniem
czasu stosowania.
Ryzyko rozwoju raka endometrium
Ryzyko zachorowania na raka endometrium wynosi około 5 przypadków na każde 1000 kobiet z
zachowaną macicą niestosujących HTZ ani tibolonu.
Badanie z randomizacją, z grupą kontrolną otrzymującą placebo, z udziałem kobiet, u których nie przeprowadzono badania przesiewowego w kierunku nieprawidłowości endometrium przed rozpoczęciem terapii (co odpowiada praktyce klinicznej), wykazało zwiększone ryzyko raka endometrium (badanie LIFT, średnia wieku 68 lat). W badaniu tym, po 2,9 roku, w grupie placebo (n=1773) nie zdiagnozowano żadnego przypadku raka endometrium w porównaniu do 4 przypadków raka endometrium w grupie przyjmującej tibolon (n=1746). Odpowiada to 0,8 dodatkowego zdiagnozowanego przypadku raka endometrium na każde 1000 kobiet przyjmujących tibolon przez jeden rok w tym badaniu (patrz punkt 4.4).
Ryzyko udaru niedokrwiennego
Względne ryzyko wystąpienia udaru niedokrwiennego nie zależy od wieku lub czasu trwania stosowania terapii, ale ponieważ ryzyko wyjściowe jest silnie uzależnione od wieku, ogólne ryzyko udaru niedokrwiennego u kobiet stosujących HTZ lub tibolon będzie zwiększać się wraz z wiekiem, patrz punkt 4.4.
W randomizowanym badaniu z grupą kontrolną, trwającym 2 lata i 9 miesięcy, oszacowano 2,2-krotny wzrost ryzyka wystąpienia udaru mózgu wśród kobiet (średnia wieku 68 lat), które stosowały tibolon w dawce 1,25 mg (28/2249) w porównaniu z grupą placebo (13/2257). W większości przypadków (80%) był to udar o etiologii niedokrwiennej. Wyjściowe ryzyko wystąpienia udaru jest silnie zależne od wieku. Częstość występowania udaru mózgu po 5 latach szacuje się na 3 przypadki na 1000 kobiet w przedziale wiekowym 50–59 lat i 11 przypadków na 1000 kobiet w przedziale wiekowym 60–69 lat. U kobiet stosujących tibolon przez 5 lat liczba dodatkowych przypadków może wynieść 4 przypadki na 1000 kobiet w wieku 50–59 lat i 13 przypadków na 1000 kobiet w wieku 60–69 lat.
Inne działania niepożądane, o których donoszono w związku z terapią estrogenowo-progestagenową:
Rak jajnika
Stosowanie HTZ z użyciem preparatów zawierających jedynie estrogen lub preparatów złożonych estrogenowo-progestagenowych wiązało się z nieco zwiększonym ryzykiem rozpoznania raka jajnika (patrz punkt 4.4).
W metaanalizie 52 badań epidemiologicznych stwierdzono zwiększone ryzyko wystąpienia raka jajnika u kobiet stosujących aktualnie HTZ w porównaniu z kobietami, które nigdy jej nie stosowały (RR 1,43, 95% CI 1,31–1,56). W przypadku kobiet w wieku od 50 do 54 lat stosujących HTZ przez 5
lat prowadzi to w przybliżeniu do 1 dodatkowego zachorowania na 2000 kobiet. W przypadku kobiet w wieku od 50 do 54 lat, które nie stosują HTZ, rak jajnika zostanie rozpoznany u około 2 na 2000 kobiet w okresie 5 lat.
W badaniu Million Women Study stosowanie tibolonu przez okres 5 lat prowadziło do wystąpienia 1 dodatkowego przypadku raka na 2500 kobiet (patrz punkt 4.4).
Żylna choroba zakrzepowo-zatorowa
HTZ jest związana z 1,3 – 3-krotnym zwiększeniem ryzyka względnego wystąpienia żylnej choroby zatorowo-zakrzepowej, w tym zakrzepicy żył głębokich lub zatorowości płucnej. Wystąpienie tych zdarzeń jest bardziej prawdopodobne w pierwszym roku stosowania HTZ, niż w latach późniejszych (patrz punkt 4.4). Poniżej przedstawiono wyniki badania WHI:
Tabela 3. Badanie WHI - dodatkowe ryzyko żylnej choroby zakrzepowo-zatorowej w czasie 5- letniego stosowania.
Wiek (lata)
Częstość występowania na 1000 kobiet w okresie 5-cio letnim w grupie
placebo
Współczynnik
ryzyka i
95% CI
Dodatkowe przypadki na 1000 kobiet stosujących HTZ
Produkty doustne zawierające jedynie estrogen*
50-59
7
1,2 (0,6 - 2,4)
1 (-3 – 10)
Produkty doustne zawierające estrogen i progestagen
50-59
4
2,3 (1,2 – 4,3)
5 (1 - 13)
*Badanie u kobiet bez macicy
Ryzyko choroby wieńcowej jest nieznacznie zwiększone u kobiet w wieku powyżej 60 lat stosujących HTZ z użyciem produktów złożonych zawierających estrogen i progestagen (patrz punkt 4.4). Nie ma dowodów wskazujących na to, że ryzyko zawału mięśnia sercowego podczas stosowania tibolonu jest inne niż w przypadku innych rodzajów HTZ.
Choroby pęcherzyka żółciowego.
Choroby skóry i tkanki podskórnej: ostuda, rumień wielopostaciowy, rumień
guzowaty, plamica naczyniowa.
Prawdopodobna demencja powyżej 65. roku życia (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02 - 222 Warszawa tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce.
Dzięki zgłaszaniu działań niepożądanych będzie można zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Łagodzenie objawów niedoboru estrogenów
Złagodzenie objawów menopauzalnych uzyskuje się zwykle w ciągu kilku pierwszych tygodni leczenia.
Wpływ na endometrium i charakter krwawień
Istnieją doniesienia o przypadkach hiperplazji i raka endometrium u pacjentek leczonych tibolonem (patrz punkty 4.4 i 4.8).
Brak krwawienia miesiączkowego odnotowano u 88% kobiet, które stosowały tibolon w dawce 2,5 mg przez okres 12 miesięcy. Krwawienia i (lub) plamienia występowały u 32,6% kobiet w ciągu pierwszych 3 miesięcy leczenia i u 11,6% kobiet po 11–12 miesiącach leczenia.
Zapobieganie osteoporozie
Niedobór estrogenów po menopauzie wiąże się ze zwiększeniem obrotu kostnego i utratą masy kostnej. Wydaje się, że działanie ochronne utrzymuje się przez cały czas przyjmowania HTZ. Po odstawieniu leczenia utrata masy kostnej zachodzi w takim samym tempie, jak u kobiet nieleczonych.
W badaniu LIFT wykazano, że wśród kobiet (średnia wieku 68 lat) stosujących tibolon zmniejszyła się liczba nowych złamań kręgów w porównaniu do grupy placebo w ciągu 3 lat leczenia (analiza zgodna z intencją leczenia [ITT]: iloraz szans tibolonu do placebo 0,57; 95% CI [0,42, 078]).
Po 2 latach leczenia tibolonem (2,5 mg), wzrost gęstości mineralnej kości (ang. bone mass density – BMD) w odcinku lędźwiowym kręgosłupa wynosił 2,6 ± 3,8%. Odsetek kobiet, u których wartość BMD w kręgosłupie lędźwiowym utrzymywała się na stałym poziomie lub wzrosła wynosił do 76%. Drugie badanie potwierdziło te wyniki.
Tibolon (2,5 mg) wpływał również na BMD okolicy biodrowej. W jednym badaniu po 2 latach leczenia wzrost BMD wynosił 0,7 ± 3,9% w szyjce kości udowej i 1,7 ± 3,0% w całej okolicy biodrowej. Odsetek kobiet, u których wartość BMD okolicy biodrowej nie zmieniła się lub wzrosła, sięgał 72,5%. Drugie badanie wykazało wzrost BMD po 2 latach, sięgający 1,3 ± 5,1% w szyjce kości udowej i 2,9% ± 3,4% w całej okolicy biodrowej. Odsetek kobiet, u których wartość BMD w okolicy biodrowej nie uległa zmianie lub wzrosła, wynosił 84,7%.
Wpływ na piersi
W badaniach klinicznych gęstość mammograficzna u kobiet leczonych tibolonem nie uległa zwiększeniu w porównaniu z placebo.
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Szczególne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Każda tabletka zawiera 2,5 mg tibolonu.
Substancja pomocnicza o znanym działaniu: każda tabletka zawiera 87 mg laktozy jednowodnej. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka.
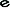
Białe lub prawie białe, płaskie, okrągłe tabletki, z wytłoczonym znakiem “ ” po jednej stronie.
Dawkowanie
Należy stosować jedną tabletkę na dobę. Nie ma potrzeby modyfikowania dawki u pacjentek w podeszłym wieku. Tabletki należy połykać w całości i popijać niewielką ilością wody lub innego płynu. Zaleca się, aby tabletki przyjmować o tej samej porze dnia. Nie należy jednocześnie z produktem Ladybon stosować progestagenu.
Zarówno przy rozpoczynaniu, jak i kontynuacji leczenia objawów pomenopauzalnych należy stosować najmniejszą skuteczną dawkę, przez możliwie najkrótszy czas (patrz punkt 4.4).
Rozpoczynanie leczenia produktem Ladybon
W przypadku naturalnej menopauzy kobieta powinna rozpocząć leczenie produktem Ladybon po upływie 12 miesięcy od ostatniego naturalnego krwawienia. W przypadku menopauzy po zabiegu chirurgicznym leczenie produktem Ladybon można rozpocząć natychmiast.
Przed rozpoczęciem stosowania tibolonu należy zdiagnozować każde nieregularne i (lub) nieprzewidziane krwawienie z dróg rodnych zarówno u kobiet stosujących, jak i niestosujących hormonalnej terapii zastępczej (HTZ), w celu wykluczenia zmian nowotworowych (patrz punkt 4.3).
Przejście z sekwencyjnego lub złożonego produktu do hormonalnej terapii zastępczej (HTZ)
Przy zmianie z sekwencyjnej HTZ, leczenie produktem Ladybon należy rozpocząć od razu następnego dnia po zakończeniu poprzedniego cyklu leczenia. Przy zamianie z ciągłej złożonej HTZ, stosowanie produktu Ladybon można rozpocząć w dowolnym momencie.
Pominięcie tabletki
W razie pominięcia tabletki należy ją przyjąć jak najszybciej, chyba, że od pominięcia tabletki upłynęło ponad 12 godzin. W takim przypadku nie należy przyjmować pominiętej tabletki, a jedynie następną dawkę zgodnie z dotychczasowym schematem. Pominięcie tabletki może zwiększyć prawdopodobieństwo wystąpienia krwawienia i plamienia w środku cyklu.
W leczeniu objawów pomenopauzalnych, HTZ powinna być stosowana wyłącznie w przypadku, gdy wpływają one negatywnie na jakość życia. We wszystkich przypadkach należy co najmniej raz w roku dokonywać starannej oceny ryzyka względem korzyści wynikających z leczenia i kontynuować HTZ tylko tak długo, jak długo korzyści przewyższają ryzyko.
Dane dotyczące zagrożenia związanego ze stosowaniem HTZ w leczeniu przedwczesnej menopauzy są ograniczone. Jednak ze względu na niski poziom bezwzględnego ryzyka u młodszych kobiet, bilans korzyści i ryzyka u tych kobiet może być korzystniejszy niż u kobiet starszych.
Ryzyko wystąpienia udaru mózgu, raka piersi i raka błony śluzowej macicy u kobiet z zachowaną macicą, (patrz poniżej oraz punkt 4.8) powinno być dokładnie oszacowane dla każdej pacjentki, mając na uwadze jej indywidualne czynniki ryzyka i uwzględniając częstość występowania i cechy charakterystyczne obu nowotworów i udaru w kategoriach reakcji pacjentek na leczenie, zachorowalności oraz śmiertelności.
Badania lekarskie / kontrola wyników leczenia
Przed włączeniem HTZ po raz pierwszy lub po przerwie w jej stosowaniu należy przeprowadzić z pacjentką pełny wywiad lekarski, włącznie z wywiadem rodzinnym. Wykonując badanie przedmiotowe (obejmujące badanie ginekologiczne i badanie piersi), należy kierować się danymi
uzyskanymi w wywiadzie, jak również zwrócić uwagę na przeciwwskazania i ostrzeżenia dotyczące stosowania produktu.
Podczas leczenia zalecane jest wykonywanie okresowych badań kontrolnych, których rodzaj i częstość należy dostosować indywidualnie dla każdej pacjentki. Należy poinformować pacjentki, jakie zmiany w piersiach powinny zgłaszać swojemu lekarzowi lub pielęgniarce (patrz niżej – „Rak piersi”).
Badania kontrolne, w tym odpowiednie metody obrazowania np.: mammografia, powinny być przeprowadzane zgodnie z aktualnie przyjętą praktyką dotyczącą badań przesiewowych, dostosowaną do potrzeb klinicznych danej pacjentki.
Stany wymagające nadzoru
W przypadku obecności któregokolwiek z wymienionych niżej schorzeń, ich wystąpienia w przeszłości, i (lub) nasilenia podczas ciąży lub wcześniejszego leczenia hormonalnego, pacjentka powinna zostać poddana ścisłemu nadzorowi. Należy pamiętać, że wymienione schorzenia mogą nawracać lub nasilać się podczas leczenia tibolonem, w szczególności:
Wskazania do natychmiastowego zaprzestania terapii:
Leczenie powinno zostać przerwane, w przypadku stwierdzenia przeciwwskazania lub w
następujących sytuacjach:
Ponieważ tibolon może zwiększać aktywność fibrynolityczną krwi, może nasilać działanie leków przeciwkrzepliwych. Takie działanie obserwowano w przypadku warfaryny. Należy zachować ostrożność podczas jednoczesnego stosowania z lekami przeciwkrzepliwymi, szczególnie w przypadku rozpoczynania i zakończenia równoczesnego leczenia tibolonem. Jeśli konieczne, należy dostosować dawkę warfaryny.
Informacje dotyczące interakcji farmakokinetycznych z tibolonem są ograniczone. Badania in vivo wykazały, że stosowanie tibolonu wpływa na właściwości farmakokinetyczne równocześnie stosowanego midazolamu – substratu cytochromu P450 3A4 – a wpływ ten ma umiarkowane znaczenie. Na podstawie tej obserwacji można oczekiwać interakcji z innymi lekami będącymi substratami CYP3A4.
Związki, które indukują aktywność CYP3A4, takie jak barbiturany, karbamazepina, hydantoiny i ryfampicyna mogą zwiększać metabolizm tibolonu i tym samym wpływać na jego działanie terapeutyczne.
Preparaty ziołowe zawierające dziurawiec zwyczajny (Hypericum perforatum) mogą indukować metabolizm estrogenów i progestagenów przez CYP3A4. Klinicznie, zwiększony metabolizm estrogenów i progestagenów może prowadzić do osłabienia ich działania oraz zmieniać profil krwawienia macicznego.
Ciąża
Stosowanie tibolonu w okresie ciąży jest przeciwwskazane (patrz punkt 4.3). Jeśli kobieta zajdzie w ciążę podczas stosowania tibolonu, leczenie należy natychmiast przerwać. Nie ma żadnych danych klinicznych dotyczących ekspozycji na tibolon w okresie ciąży. Badania na zwierzętach wskazują na toksyczny wpływ na reprodukcję (patrz punkt 5.3). Potencjalne ryzyko dla człowieka jest nieznane.
Karmienie piersią
Stosowanie tibolonu w okresie karmienia piersią jest przeciwwskazane (patrz punkt 4.3).
Płodność
W badaniach na zwierzętach tibolon wykazywał działanie antykoncepcyjne ze względu na swoje właściwości hormonalne.
Tibolon nie ma wpływu lub wpływ jest znikomy na zdolność prowadzenia pojazdów i obsługiwania
maszyn.
W punkcie opisano działania niepożądane odnotowane w 21 badaniach klinicznych z grupą kontrolną otrzymującą placebo (w tym badanie LIFT), w których 4079 kobiet stosowało dawki terapeutyczne (1,25 mg lub 2,5 mg) tibolonu, a 3476 kobiet otrzymywało placebo. Czas leczenia w tych badaniach wynosił od 2 miesięcy do 4,5 lat. Tabela 1 przedstawia działania niepożądane, których częstość występowania była statystycznie istotnie większa podczas stosowania tibolonu w porównaniu do placebo.
Tabela 1. Działania niepożądane tibolonu.
Klasyfikacja układów i narządów MedDRA | Często ≥ 1/100 do < 1/10 | Niezbyt często ≥ 1/1000 do < 1/100 | Rzadko ≥ 1/10000 do < 1/1000 |
Zaburzenia metabolizmu i odżywiania | | Obrzęk** | |
Zaburzenia żołądka i jelit | Ból podbrzusza | Dyskomfort brzucha** | |
Klasyfikacja układów i narządów MedDRA | Często ≥ 1/100 do < 1/10 | Niezbyt często ≥ 1/1000 do < 1/100 | Rzadko ≥ 1/10000 do < 1/1000 |
Zaburzenia skóry i tkanki podskórnej | Nadmierne owłosienie | Trądzik | Świąd** |
Zaburzenia układu rozrodczego i piersi | Upławy Przerost endometrium Krwotok pomenopauzalny Tkliwość piersi Świąd narządów płciowych Kandydoza pochwy Krwotok z pochwy Ból w obrębie miednicy Dysplazja szyjki macicy Wydzielina z narządu rodnego Zapalenie sromu i pochwy | Umiarkowany ból piersi Zakażenia grzybicze Grzybica pochwy Ból brodawek sutkowych | |
Badania diagnostyczne | Zwiększenie masy ciała Nieprawidłowy wymaz z szyjki macicy* | | |
*Zazwyczaj zmiany łagodne. Częstość występowania patologii szyjki macicy (raka szyjki macicy) nie była zwiększona w grupie leczonych tibolonem w porównaniu do grupy stosującej placebo.
** Te działania niepożądane zostały zidentyfikowane po wprowadzeniu tibolonu do obrotu. Kategorię częstości oszacowano na podstawie odpowiednich badań klinicznych.
Po wprowadzeniu do obrotu zaobserwowano też inne działania niepożądane, w tym: zawroty głowy, wysypkę, łojotokowe zapalenie skóry, ból głowy, migrena, zaburzenia widzenia (w tym nieostre widzenie), depresja, dolegliwości ze strony układu mięśniowo-szkieletowego, takie jak ból stawów lub mięśni oraz zaburzenia czynności wątroby.
Ryzyko raka piersi
Ostra toksyczność tibolonu u zwierząt jest bardzo mała. W związku z tym, w razie przyjęcia nawet kilku tabletek jednocześnie nie należy się spodziewać objawów toksyczności. W przypadku ostrego przedawkowania mogą wystąpić nudności i wymioty, a u kobiet krwawienie z dróg rodnych. Nie jest znane specyficzne antidotum. W razie potrzeby należy wdrożyć leczenie objawowe.
Grupa farmakoterapeutyczna: Hormony płciowe i modulatory układu rozrodczego, inne estrogeny,
kod ATC: G 03 CX 01
Po podaniu doustnym tibolon jest szybko metabolizowany do trzech związków, które odpowiadają za działanie farmakologiczne tibolonu. Dwa z tych metabolitów (3α-OH-tibolon i 3β-OH-tibolon) mają działanie estrogenopodobne, zaś trzeci metabolit (Δ4-izomer tibolonu) ma działanie gestagenne
i androgenopodobne.
Tibolon zastępuje estrogeny w sytuacji utraty wytwarzania estrogenów u kobiet po menopauzie, i łagodzi objawy pomenopauzalne. Tibolon zapobiega utracie masy kostnej po menopauzie lub usunięciu jajników (owariektomii).
Wyniki badań klinicznych dotyczących tibolonu:
Wchłanianie i metabolizm
Po podaniu doustnym tibolon szybko i intensywnie się wchłania. Spożywanie posiłków nie ma
istotnego wpływu na stopień wchłaniania.
Z uwagi na szybki metabolizm, stężenia tibolonu w osoczu są bardzo małe. Stężenie w osoczu Δ4- izomeru tibolonu również jest bardzo małe. Z tego względu niektórych parametrów farmakokinetycznych nie można określić. Maksymalne stężenia metabolitów 3α-OH i 3β-OH w osoczu są większe, ale nie dochodzi do ich akumulacji.
Tibolon SD MD | 3α-OH-metabolit SD MD | 3-OH-metabolit SD MD | Δ4-izomer SD MD | |||||
Cmax (ng/ml) | 1,37 | 1,72 | 14,23 | 14,15 | 3,43 | 3,75 | 0,47 | 0,43 |
Cśrednie | - | - | - | 1,88 | - | - | - | - |
Tmax (h) | 1,08 | 1,19 | 1,21 | 1,15 | 1,37 | 1,35 | 1,64 | 1,65 |
T1/2 (h) | - | - | 5,78 | 7,71 | 5,87 | - | - | - |
Cmin (ng/ml) | - | - | - | 0,23 | - | - | - | - |
AUC0-24 (ng/ml x godz.) | - | - | 53,23 | 44,73 | 16,23 | 9,20 | - | - |
Tabela 4. Parametry farmakokinetyczne tibolonu (2,5 mg)
SD (single dose) = pojedyncze podanie, MD (multiple dose) = podanie wielokrotne Wydalanie
Tibolon jest wydalany głównie w postaci skoniugowanych metabolitów (przede wszystkim
siarczanowych). Część podanej dawki wydalana jest w moczu, ale większość wydalana jest z kałem.
Inne specjalne populacje
Farmakokinetyczne parametry tibolonu i jego metabolitów nie zależą od czynności nerek.
W badaniach przeprowadzonych na zwierzętach tibolon, poprzez swoje właściwości hormonalne, zaburzał płodność i wywierał działanie embriotoksyczne. U myszy i szczurów laboratoryjnych tibolon nie wykazywał działania teratogennego. Teratogenne właściwości obserwowano u królików przy podawaniu dawek zbliżonych do dawek powodujących poronienie (patrz punkt 4.6). W warunkach in vivo tibolon nie wywiera działania genotoksycznego. Działanie rakotwórcze obserwowano u niektórych szczepów laboratoryjnych szczurów (nowotwory wątroby) i myszy (nowotwory pęcherza), jednak znaczenie kliniczne tych obserwacji nie jest pewne.
Laktoza jednowodna
Skrobia ziemniaczana Askorbylu palmitynian (E304) Magnezu stearynian
Nie dotyczy.
2 lata.
Przechowywać w temperaturze poniżej 25 °C.
Przechowywać w oryginalnym opakowaniu, w celu ochrony przed światłem i wilgocią.
Blister z folii PVC/PVDC/Aluminium w tekturowym pudełku. Wielkość opakowania: 1×28 lub 3×28 tabletek.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań.
DOPUSZCZENIE DO OBROTU
Zentiva, k.s., U kabelovny 130 Dolní Měcholupy, 102 37 Prague 10, Republika Czeska.
Pozwolenie nr: 14953
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 04.11.2008 Data ostatniego przedłużenia pozwolenia: 28.06.2010
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
10/2020











