Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- Właściwości farmakodynamiczne
- Wykaz substancji pomocniczych
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
EPHEDRINUM HYDROCHLORICUM WZF, 25 mg/ml, roztwór do wstrzykiwań
Każdy ml roztworu zawiera 25 mg Ephedrini hydrochloridum (efedryny chlorowodorku). Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań Klarowny, bezbarwny płyn
Stany skurczowe dróg oddechowych.
Hipotensja podczas znieczulenia podpajęczynówkowego i zewnątrzoponowego.
Dawkowanie
Stany skurczowe dróg oddechowych
Dorośli:
Domięśniowo lub podskórnie od 12,5 mg do 25 mg. Maksymalnie do 150 mg w ciągu 24 godzin, w dawkach podzielonych.
Dzieci:
Podskórnie 3 mg/kg mc. na dobę lub 25 do 100 mg/m2 pc. na dobę w 4-6 dawkach podzielonych.
Zwalczanie hipotensji
Dorośli i dzieci w wieku powyżej 12 lat:
Dożylnie, wyłącznie po rozcieńczeniu (sposób rozcieńczenia patrz pkt. 6.6). Podawać powoli, najczęściej w dawce od 2,5 mg do 5 mg (maksymalnie 10 mg). W zależności od osiąganego efektu dawki można powtarzać co 3-4 minuty, maksymalnie do osiągnięcia dawki 30 mg. Jeśli podanie 30 mg efedryny nie przynosi oczekiwanego efektu należy rozważyć wybór innego leku. Nie należy przekraczać maksymalnej dobowej dawki 150 mg w dawkach podzielonych.
Dzieci w wieku poniżej 12 lat:
Dożylnie, wyłącznie po rozcieńczeniu (sposób rozcieńczenia patrz pkt. 6.6). Podawać produkt powoli w dawce od 0,5 do 0,75 mg/kg mc. lub 17-25 mg/m2 pc., w razie konieczności dawki można
powtarzać co 3-4 minuty w zależności od osiąganego efektu.
Osoby w podeszłym wieku:
Nie ma konieczności modyfikowania dawkowania.
W uzasadnionych przypadkach u osób dorosłych, przed wykonaniem blokady centralnej, efedryna może zostać podana profilaktycznie, domięśniowo bez rozcieńczenia w dawce od 12,5 mg do 25 mg.
Sposób podawania
Przed podaniem dożylnym produkt leczniczy musi zostać rozcieńczony. Efedryna może być stosowana dożylnie wyłącznie pod nadzorem lekarza. Instrukcja dotycząca rozcieńczania produktu leczniczego przed podaniem, patrz punkt 6.6.
Nadwrażliwość na efedrynę, inne aminy sympatykomimetyczne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1
Choroba niedokrwienna serca Nadciśnienie tętnicze
Nadczynność tarczycy Przerost prostaty
Efedrynę należy stosować ostrożnie u pacjentów z dławicą piersiową ze względu na dodatnie działanie chronotropowe i inotropowe.
Leki sympatykomimetyczne, w tym Ephedrinum hydrochloricum WZF, mogą wpływać na działanie układu sercowo-naczyniowego. Dane pochodzące z badań przeprowadzonych po wprowadzeniu
efedryny do obrotu oraz opublikowane w literaturze wskazują na rzadko występujące przypadki niedokrwienia mięśnia sercowego, związanego ze stosowaniem leków z grupy beta-agonistów. Pacjentów z ciężką chorobą serca (np. arytmią, tachykardią, ciężką niewydolnością serca), którzy otrzymują produkt Ephedrinum hydrochloricum WZF należy poinformować, aby zasięgnęli porady lekarskiej, jeżeli wystąpią u nich ból w klatce piersiowej lub inne objawy świadczące o zaostrzeniu choroby serca. Należy zwrócić uwagę na takie objawy jak duszność i ból w klatce piersiowej, ponieważ mogą pochodzić zarówno od układu oddechowego, jak i od serca.
Szczególną uwagę należy również zachować stosując efedrynę u pacjentów ze stwardnieniem tętnic, nadciśnieniem i tętniakiem oraz innymi zaburzeniami przebiegającymi ze zwężeniem naczyń.
U pacjentów otrzymujących efedrynę i jednocześnie przyjmujących glikozydy nasercowe, chinidynę lub trójpierścieniowe leki przeciwdepresyjne zwiększa się ryzyko wystąpienia arytmii.
Należy zachować ostrożność u pacjentów z cukrzycą, efedryna zwiększa ryzyko wystąpienia hipoglikemii.
Należy zachować ostrożność u pacjentów z jaskrą zamkniętego kąta.
U pacjentów z rozrostem gruczołu krokowego, w wyniku skurczu zwieracza i jednoczesnego
zwiotczenia pęcherza moczowego, efedryna może powodować trudności w oddawaniu moczu aż do zatrzymania moczu włącznie.
Długotrwałe stosowanie efedryny może powodować wystąpienie niepokoju. Należy unikać długotrwałego stosowania efedryny u pacjentów z nerwicą. Dzieci są mniej podatne na pobudzający wpływ efedryny.
Po długotrwałym podawaniu produktu nie dochodzi do jego kumulacji, jednak obserwowano wystąpienie tolerancji i uzależnienia.
Efedryna może dawać pozytywne wyniki testów antydopingowych u sportowców.
Produkt może być rozcieńczany w 0,9% roztworze NaCl. Zawartość sodu pochodzącego z rozcieńczalnika, powinna być brana pod uwagę w obliczeniu całkowitej zawartości sodu
w przygotowanym rozcieńczeniu produktu. W celu uzyskania dokładnej informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia produktu, należy zapoznać się z charakterystyką produktu leczniczego stosowanego rozcieńczalnika.
Nie należy stosować efedryny łącznie z lekami sympatykomimetycznymi (np. pseudoefedryna, fenylefryna, metylofenidat, fenylopropanolamina) ze względu na ryzyko wystąpienia ostrego nadciśnienia.
Nie należy stosować efedryny jednocześnie z inhibitorami MAO, ani wcześniej niż po 14 dniach od zaprzestania ich stosowania.
Jednoczesne stosowanie efedryny z selektywnymi inhibitorami wychwytu zwrotnego noradrenaliny i serotoniny (SNRI) może spowodować wystąpienie napadowego nadciśnienia i arytmii.
Trójpierścieniowe leki przeciwdepresyjne hamują działanie podwyższające ciśnienie wywoływane przez efedrynę. Jednocześnie stosowane z efedryną mogą również powodować wystąpienie napadowego nadciśnienia i arytmii.
Jednoczesne stosowanie z linezolidem może nasilać działania hipertensyjne. Efedryna działa przeciwstawnie do leków obniżających ciśnienie tętnicze.
Jednoczesne stosowanie z guanidyną i jej pochodnymi może prowadzić do znacznego wzrostu ciśnienia krwi.
Acetazolamid i inne związki alkalizujące mocz powodują zwiększenie stężenia leku we krwi i mogą nasilać jego działanie toksyczne.
Jednoczesne stosowanie efedryny z glikozydami nasercowymi lub środkami stosowanymi
w znieczuleniu ogólnym takimi jak: cyklopropan, halotan i inne anestetyki halogenowe może spowodować wystąpienie zaburzeń rytmu serca.
Jednoczesne stosowanie z doksapramem może prowadzić do wystąpienia nadciśnienia. Oksytocyna nasila działanie hipertensyjne efedryny.
Salbutamol i inne leki pobudzające układ współczulny nasilają działanie niepożądane efedryny na układ krążenia i nie należy stosować ich jednocześnie z efedryną. Dopuszcza się jednoczesne ostrożne stosowanie w małych dawkach salbutamolu lub leków pobudzających układ współczulny
w postaciach do inhalacji.
Jednoczesne stosowanie z teofiliną może powodować wystąpienie bezsenności, nadmiernej nerwowości i dyskomfortu ze strony przewodu pokarmowego.
Efedryna zwiększa klirens deksametazonu.
Efedryna zwiększa stężenie fenytoiny w krwi, przypuszczalnie może również zwiększać stężenie barbituranów i prymidonu w osoczu.
Ciąża
Efedryna przenika przez barierę łożyska powodując u płodu przyspieszenie akcji serca. Efedryna może być stosowana u kobiet w ciąży, jeżeli w opinii lekarza korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu.
Karmienie piersią
Efedryna przenika do mleka karmiących matek. Istnieją doniesienia o objawach pobudzenia u dzieci karmionych piersią przez matki stosujące efedrynę. Nie należy stosować produktu w okresie karmienia piersią.
Produkt nie zaburza zdolności prowadzenia pojazdów i obsługiwania maszyn.
Po dawkach znacznie większych niż zalecane lub u ludzi szczególnie wrażliwych, efedryna może wywołać nadmierną pobudliwość nerwową i może wpływać niekorzystnie na bezpieczeństwo prowadzenia pojazdów i obsługiwania maszyn.
W przypadku stosowania efedryny w celu zwalczania hipotensji, prowadzenie pojazdów
i obsługiwanie maszyn wykluczone jest w związku z zaburzeniem, które było wskazaniem do zastosowania leku (hipotensja podczas znieczulenia podpajęczynówkowego i zewnątrzoponowego).
Częstość zdefiniowano w następujący sposób:
często (≥1/100 do <1/10); rzadko (≥1/10 000 do <1/1000); nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia serca
Często: zwiększenie ciśnienia tętniczego, kołatanie serca, tachykardia. Rzadko: zaburzenia rytmu serca.
Częstość nieznana: ból dławicowy, odruchowa bradykardia, zatrzymanie akcji serca, hipotensja.
Zaburzenia naczyniowe
Częstość nieznana: krwotok mózgowy.
Zaburzenia krwi i układu chłonnego
Częstość nieznana: modyfikacja hemostazy pierwotnej.
Zaburzenia układu nerwowego
Często: nerwowość, drażliwość, niepokój, osłabienie, bóle głowy, nadmierne pocenie się, trudności z zaśnięciem.
Częstość nieznana: drżenia, nadmierne ślinienie się.
Zaburzenia układu immunologicznego Częstość nieznana: nadwrażliwość.
Zaburzenia psychiczne
Często: splątanie, lęk, depresja.
Częstość nieznana: strach, zaburzenia o charakterze psychotycznym jak paranoja i omamy.
Zaburzenia oka
Częstość nieznana: epizody jaskry zamkniętego kąta.
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Często: duszność.
Częstość nieznana: obrzęk płuc.
Zaburzenia żołądka i jelit Często: nudności, wymioty.
Częstość nieznana: zmniejszenie apetytu, biegunka, ból brzucha.
Zaburzenia nerek i dróg moczowych Rzadko: ostre zatrzymanie moczu.
Badania diagnostyczne
Częstość nieznana: hipokaliemia, zmiany w stężeniu glukozy w krwi.
Po długotrwałym stosowaniu może rozwinąć się uzależnienie, które wiąże się ze wzrostem agresywności i zaburzeniami o charakterze psychozy schizofrenicznej.
Po zastosowaniu dawek efedryny większych niż zalecane mogą wystąpić drgawki.
Ponadto mogą wystąpić trudności w oddawaniu moczu aż do zatrzymania moczu, zwłaszcza
u pacjentów z rozrostem gruczołu krokowego, oraz rzadkie przypadki alergii skórnej w postaci wysypki.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Po ostrym przedawkowaniu mogą wystąpić: nudności, wymioty, podwyższona temperatura ciała, kołatanie serca, tachykardia, podwyższone ciśnienie tętnicze, objawy podobne do psychoz
paranoidalnych, urojenia i omamy, spadek ciśnienia tętniczego i anuria. Znaczne przedawkowanie może powodować zahamowanie czynności oddechowej, drgawki i śpiączkę.
Dawka śmiertelna u ludzi wynosi około 2 g, co odpowiada stężeniu efedryny we krwi od 3,5 do 20 mg/l.
W przypadku przedawkowania produktu należy dokładnie obserwować pacjenta, zapewnić drożność dróg oddechowych i prawidłowe nawodnienie. Należy zastosować leczenie objawowe.
Jeżeli wystąpi tachykardia nadkomorowa można podać labetalol lub propranolol, monitorując czynność serca za pomocą EKG.
W przypadku wystąpienia hipokaliemii należy zastosować wlew soli potasu jednocześnie z propranololem i dokonać korekty ewentualnej zasadowicy oddechowej.
W przypadku drgawek można zastosować diazepam, fenytoinę lub fenobarbital. Wymuszona diureza, dializa otrzewnowa i hemodializa są nieskuteczne.
Po długotrwałym podawaniu produktu nie dochodzi do jego kumulacji, jednak obserwowano wystąpienie tolerancji i uzależnienia.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: Leki stosowane w chorobach obturacyjnych dróg oddechowych, adrenomimetyki do stosowania ogólnego; agoniści receptorów alfa- i beta-adrenergicznych.
Kod ATC: R03CA02
Grupa farmakoterapeutyczna: Leki pobudzające układ sercowo-naczyniowy, wpływające na receptory adrenergiczne i dopaminergiczne.
Kod ATC: C01CA26
Efedryna jest nieselektywnym lekiem sympatykomimetycznym. Działa głównie pośrednio, przez nasilanie uwalniania noradrenaliny z zakończeń neuronów i hamowanie jej wchłaniania zwrotnego. Rozszerza mięśnie gładkie oskrzeli. Przyspiesza zwolnioną czynność serca i zwiększa siłę jego skurczu. Zwęża naczynia obwodowe (także błony śluzowej nosa), przez co może prowadzić do
wzrostu ciśnienia tętniczego. Zatrzymywanie moczu po podaniu efedryny jest wynikiem skurczu
zwieracza i jednoczesnego zwiotczenia pęcherza moczowego. Lek zmniejsza napięcie mięśni gładkich przewodu pokarmowego, może hamować perystaltykę. Efedryna przenika przez barierę krew-mózg, po jej podaniu obserwuje się objawy słabego pobudzenia ośrodkowego. Efedryna pobudza ośrodek oddechowy. Rozszerza źrenice, jednak nie wpływa na odruchy źrenic na światło. Efedryna jest inhibitorem monoaminooksydazy (IMAO).
Po kilkakrotnym podaniu występuje zjawisko tachyfilaksji.
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Dostępność biologiczna efedryny podanej dożylnie wynosi 100%.
Działanie zwężające naczynia wywołane po wstrzyknięciu domięśniowym efedryny pojawia się po około 10 do 20 minut i utrzymuje się do 1 godziny. Po podaniu podskórnym efedryna zaczyna działać nieco później.
Efedryna jest metabolizowana częściowo w wątrobie i wydalana z moczem głównie w postaci niezmienionej (tylko w 10% jako norefedryna). Wydalanie nerkowe zależy od pH moczu: przy pH 5 okres półtrwania wynosi 3 godziny, natomiast przy pH 6,3 ulega wydłużeniu do 6 godzin.
Brak przedklinicznych danych istotnych dla lekarza przepisującego lek, które nie byłyby wymienione w innych punktach Charakterystyki Produktu Leczniczego.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Kwas solny 10% (do ustalenia pH) Woda do wstrzykiwań
Niezgodności farmaceutyczne
Roztworu efedryny nie należy mieszać z innymi lekami, gdyż istnieje możliwość wystąpienia niezgodności.
Przed podaniem dożylnym produkt leczniczy musi zostać rozcieńczony w 0,9% roztworze NaCl. Instrukcja dotycząca rozcieńczania produktu leczniczego przed podaniem, patrz punkt 6.6.
Okres ważności
3 lata
po rozcieńczeniu: 24 godziny w temperaturze poniżej 25°C
Specjalne środki ostrożności podczas przechowywania
Przechowywać ampułki w opakowaniu zewnętrznym w celu ochrony przed światłem, w temperaturze poniżej 25°C. Nie zamrażać.
Rodzaj i zawartość opakowania
10 ampułek ze szkła bezbarwnego o pojemności 1 ml w tekturowym pudełku.
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Dożylnie produkt może być podawany wyłącznie po rozcieńczeniu. Zawartość ampułki (1 ml) należy rozcieńczyć w:
0,9% roztworze NaCl do objętości 5 ml roztworu, uzyskując roztwór zawierający 5 mg efedryny w 1 ml,
lub
0,9% roztworze NaCl do objętości 10 ml roztworu, uzyskując roztwór zawierający 2,5 mg efedryny w 1 ml.
Wykazano, że pod względem chemicznym i fizycznym stabilność roztworów przygotowanych według ww. schematów wynosi 24 godziny w temperaturze poniżej 25°C.
Ze względów mikrobiologicznych roztwór do infuzji dożylnej należy przygotować bezpośrednio przed podaniem. W razie konieczności, na odpowiedzialność użytkownika, sporządzony roztwór można
przechowywać maksymalnie przez 24 godziny w temperaturze poniżej 25°C, pod warunkiem, że rozcieńczenie przygotowuje się w kontrolowanych i zwalidowanych aseptycznych warunkach.
Niewykorzystane pozostałości należy usunąć.
Instrukcja otwierania ampułki
Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu.
Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia.
Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki.
Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3.
Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
Rysunek 1 Rysunek 2 Rysunek 3
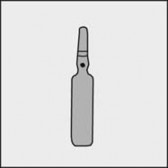
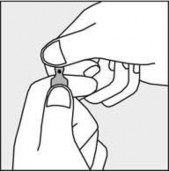
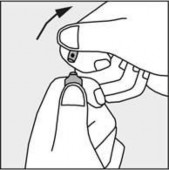
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Warszawskie Zakłady Farmaceutyczne Polfa S.A. ul. Karolkowa 22/24
01-207 Warszawa
Pozwolenie nr 8723
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 25.07.1955 r. Data ostatniego przedłużenia pozwolenia: 22.02.2011 r.











