Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
nadwrażliwość na substancję czynną lub na którykolwiek inhibitor ACE;
obrzęk naczynioruchowy, związany z uprzednim leczeniem inhibitorami ACE, w wywiadzie;
wrodzony lub idiopatyczny obrzęk naczynioruchowy;
drugi i trzeci trymestr ciąży (patrz punkty 4.4 i 4.6);
jednoczesne stosowanie produktu Co-Prestarium z produktami zawierającymi aliskiren u pacjentów z cukrzycą lub zaburzeniem czynności nerek (współczynnik przesączania kłębuszkowego, GFR<60 ml/min/1,73 m2) (patrz punkty 4.5 i 5.1);
jednoczesne stosowanie z produktem złożonym zawierającym sakubitryl i walsartan. Nie wolno rozpoczynać leczenia produktem Co-Prestarium przed upływem 36 godzin od podania ostatniej dawki produktu złożonego zawierającego sakubitryl i walsartan (patrz punkty 4.4 i 4.5);
pozaustrojowe metody leczenia powodujące kontakt krwi z powierzchniami o ujemnym ładunku elektrycznym (patrz punkt 4.5);
znaczne obustronne zwężenie tętnic nerkowych lub zwężenie tętnicy zaopatrującej jedyną nerkę (patrz punkt 4.4).
Związane z amlodypiną:
ciężkie niedociśnienie;
nadwrażliwość na substancję czynną lub pochodne dihydropirydyny;
wstrząs, w tym wstrząs kardiogenny;
zwężenie drogi odpływu z lewej komory (np. zwężenie zastawki aortalnej wysokiego stopnia);
hemodynamicznie niestabilna niewydolność serca po przebyciu ostrego zawału serca.
Związane z produktem Co-Prestarium:
Wszystkie wyżej wymienione przeciwwskazania odnoszące się do każdego składnika preparatu, również dotyczą produktu Co-Prestarium.
nadwrażliwość na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
zawierający trimetoprim i sulfametoksazol) a zwłaszcza antagonistów aldosteronu lub antagonistów receptora angiotensyny. Zastosowanie suplementów potasu, leków moczopędnych oszczędzających potas lub zamienników soli kuchennej zawierających potas, zwłaszcza u pacjentów z zaburzoną czynnością nerek, może doprowadzić do istotnego zwiększenia stężenia potasu w surowicy.
Hiperkaliemia może powodować poważne, czasem śmiertelne zaburzenia rytmu serca. U pacjentów przyjmujących inhibitory ACE należy ostrożnie stosować leki moczopędne oszczędzające potas oraz antagonistów receptora angiotensyny, należy monitorować stężenie potasu w surowicy krwi oraz czynność nerek. Jeżeli jednoczesne stosowanie peryndoprylu i któregokolwiek z wyżej wymienionych preparatów uważa się za właściwe, zaleca się zachowanie ostrożności oraz częstą kontrolę stężenia potasu w surowicy (patrz punkt 4.5).
Pacjenci z cukrzycą
U pacjentów z cukrzycą, leczonych doustnymi lekami przeciwcukrzycowymi lub insuliną, należy ściśle monitorować stężenie glukozy podczas pierwszego miesiąca leczenia inhibitorem ACE (patrz punkt 4.5).
Związane z amlodypiną
Środki ostrożności
Nie ustalono bezpieczeństwa stosowania i skuteczności amlodypiny w przełomie nadciśnieniowym.
Niewydolność serca
Pacjenci z niewydolnością serca powinni być leczeni z zachowaniem środków ostrożności.
W długookresowym badaniu kontrolowanym placebo, w którym stosowano amlodypinę u pacjentów z ciężką niewydolnością serca (III i IV klasa wg NYHA), zanotowano większą częstość wystąpienia obrzęku płuc u pacjentów stosujących amlodypinę w porównaniu z pacjentami stosującymi placebo (patrz punkt 5.1). U pacjentów z zastoinową niewydolnością serca leki z grupy antagonistów wapnia, w tym amlodypinę, należy stosować ostrożnie, ponieważ mogą zwiększać ryzyko występowania zdarzeń sercowo-naczyniowych oraz zgonu.
Zaburzenia czynności wątroby
Okres półtrwania amlodypiny jest przedłużony a wartości AUC są większe u pacjentów
z zaburzeniami czynności wątroby; nie opracowano dotychczas zaleceń dotyczących dawkowania amlodypiny. Z tego względu stosowanie amlodypiny należy rozpocząć od możliwie najmniejszej dawki i zachować ostrożność zarówno podczas rozpoczynania leczenia jak również podczas zwiększania dawki. U pacjentów z ciężkimi zaburzeniami czynności wątroby może być wymagane stopniowe zwiększanie dawki oraz zapewnienie odpowiedniej kontroli.
Pacjenci w podeszłym wieku
Zwiększenie dawki leku u pacjentów w podeszłym wieku wymaga zachowania ostrożności (patrz
punkty 4.2 i 5.2).
Niewydolność nerek
U pacjentów z niewydolnością nerek amlodypina może być stosowana w zwykłych dawkach. Zmiany stężeń amlodypiny w osoczu nie korelują ze stopniem niewydolności nerek. Amlodypina nie podlega dializie.
Związane z produktem Co-Prestarium
Wszystkie ostrzeżenia dotyczące poszczególnych składników, jak wymieniono powyżej, należy także odnosić do produktu Co-Prestarium.
Środki ostrożności
Substancje pomocnicze
Ze względu na zawartość laktozy, pacjenci z rzadko występującą dziedziczną nietolerancją galaktozy, zespołem złego wchłaniania glukozy-galaktozy lub brakiem laktazy nie powinni przyjmować tego produktu leczniczego.
Interakcje
Nie zaleca się jednoczesnego stosowania produktu Co-Prestarium z litem, lekami oszczędzającymi potas, suplementami potasu oraz dantrolenem (patrz punkt 4.5).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Leki przeciwnadciśnieniowe (takie jak beta-adrenolityki) i leki rozszerzające naczynia: jednoczesne stosowanie tych leków może zwiększać działanie obniżające ciśnienie peryndoprylu i amlodypiny.
Jednoczesne stosowanie z nitrogliceryną i innymi azotanami lub lekami rozszerzającymi naczynia, może prowadzić do dalszego obniżenia ciśnienia tętniczego, dlatego należy zachować ostrożność.
Kortykosteroidy, tetrakozaktyd: zmniejszenie działania przeciwnadciśnieniowego (związanego z retencją soli i wody przez kortykosteroidy).
Leki blokujące receptory alfa (prazosyna, alfuzosyna, doksazosyna, tamsulosyna, terazosyna): zwiększone działanie obniżające ciśnienie tętnicze i zwiększone ryzyko niedociśnienia ortostatycznego.
Amifostyna: może zwiększać przeciwnadciśnieniowe działanie amlodypiny.
Trójpierścieniowe leki przeciwdepresyjne/leki przeciwpsychotyczne/leki stosowane w znieczuleniu: zwiększone działanie przeciwnadciśnieniowe i zwiększone ryzyko niedociśnienia ortostatycznego.
Wpływ na płodność, ciążę i laktację
Zważywszy na działanie poszczególnych składników tego produktu leczniczego na ciążę i laktację: produkt Co-Prestarium nie jest zalecany podczas pierwszego trymestru ciąży. Produkt Co-Prestarium jest przeciwwskazany podczas drugiego i trzeciego trymestru ciąży.
Produkt Co-Prestarium nie jest zalecany podczas laktacji. Zatem należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać przyjmowanie produktu Co-Prestarium, biorąc pod uwagę znaczenie tej terapii dla matki.
Ciąża
Związane z peryndoprylem
Nie zaleca się stosowania inhibitorów ACE podczas pierwszego trymestru ciąży (patrz punkt 4.4). Stosowanie inhibitorów ACE jest przeciwwskazane podczas drugiego i trzeciego trymestru ciąży (patrz punkty 4.3 i 4.4).
Dane epidemiologiczne dotyczące ryzyka teratogenności w następstwie narażenia na inhibitory ACE podczas pierwszego trymestru ciąży nie są ostateczne, jednakże nie można wykluczyć niewielkiego zwiększenia ryzyka. Pacjentki planujące ciążę powinny mieć zastosowaną alternatywną terapię hipotensyjną o ustalonym profilu bezpieczeństwa podczas ciąży, chyba że kontynuowane leczenie inhibitorami ACE jest niezbędne. W przypadku stwierdzenia ciąży należy przerwać leczenie inhibitorami ACE i, jeżeli wskazane, wdrożyć leczenie alternatywne.
Wiadomo, że narażenie na inhibitor ACE w drugim i trzecim trymestrze wywołuje działanie toksyczne na ludzki płód (zmniejszona czynność nerek, małowodzie, opóźnienie kostnienia czaszki) i noworodka (niewydolność nerek, niedociśnienie tętnicze, hiperkaliemia) (patrz punkt 5.3).
W przypadku narażenia na inhibitor ACE podczas drugiego i trzeciego trymestru ciąży, zalecane jest przeprowadzenie badania ultrasonograficznego nerek i czaszki.
Należy uważnie obserwować noworodki, których matki przyjmowały inhibitory ACE, z powodu
możliwości wystąpienia niedociśnienia tętniczego (patrz punkty 4.3 i 4.4). Związane z amlodypiną
Nie ustalono bezpieczeństwa stosowania amlodypiny u kobiet w ciąży. W badaniach na zwierzętach po dużych dawkach obserwowano toksyczny wpływ na rozród (patrz punkt 5.3).
Stosowanie w ciąży jest zalecane tylko w przypadkach, gdy nie ma innego, bezpieczniejszego produktu oraz gdy choroba jest związana z większym ryzykiem dla matki i płodu.
Karmienie piersią
Związane z peryndoprylem
Ponieważ brak informacji dotyczącej stosowania peryndoprylu podczas karmienia piersią, nie zaleca się peryndoprylu podczas karmienia piersią, zwłaszcza noworodka lub wcześniaka, a bardziej wskazane są alternatywne metody leczenia o lepszych profilach bezpieczeństwa.
Związane z amlodypiną
Amlodypina przenika do mleka ludzkiego. Oszacowano, że odsetek dawki, jaki przyjmuje niemowlę od karmiącej go piersią matki, mieści się w przedziale międzykwartylowym od 3% do 7%, z wartością maksymalną wynoszącą 15%. Wpływ amlodypiny na organizm niemowląt jest nieznany. Decyzję
o kontynuowaniu lub zaprzestaniu karmienia piersią albo o kontynuowaniu lub zaprzestaniu leczenia amlodypiną należy podejmować po rozważeniu korzyści wynikających z karmienia piersią dla dziecka oraz z leczenia amlodypiną dla matki.
Płodność
Związane z peryndoprylem
Brak wpływu na zdolności rozrodcze lub płodność.
Związane z amlodypiną
U niektórych pacjentów leczonych antagonistami wapnia donoszono o przemijających zmianach biochemicznych w główkach plemników. Dane kliniczne dotyczące potencjalnego działania amlodypiny na płodność są niewystarczające. W jednym badaniu z udziałem szczurów zaobserwowano wystąpienie działań niepożądanych związanych z płodnością u samców (patrz punkt 5.3).
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Podsumowanie profilu bezpieczeństwa
Najczęściej zgłaszane działania niepożądane, występujące po oddzielnym podaniu peryndoprylu
i amlodypiny to: obrzęk, senność, zawroty głowy pochodzenia ośrodkowego, ból głowy (zwłaszcza na początku leczenia), zaburzenie smaku, parestezja, zaburzenia widzenia (w tym podwójne widzenie), szum uszny, zawroty głowy pochodzenia błędnikowego, kołatanie serca, nagłe zaczerwienienie, zwłaszcza twarzy i szyi, niedociśnienie tętnicze (i objawy związane z niedociśnieniem), duszność,
kaszel, ból brzucha, nudności, wymioty, niestrawność, zmiana rytmu wypróżnień, biegunka, zaparcie, świąd, wysypka, wykwit, obrzęk stawów (obrzęk okolicy kostek), kurcze mięśni, zmęczenie, astenia.
Tabelaryczny wykaz działań niepożądanych
Podczas badań klinicznych i (lub) po wprowadzeniu produktu do obrotu obserwowano następujące działania niepożądane, występujące po oddzielnym podaniu peryndoprylu i amlodypiny, które wymieniono zgodnie z klasyfikacją układowo-narządową MedDRA oraz według następującej częstości występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do
<1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000), nieznana częstość (nie może być określona na podstawie dostępnych danych).
Klasyfikacja układowo- narządowa MedDRA
Działania niepożądane
Częstość występowania
Amlodypina
Peryndopryl
Zakażenia i zarażenia pasożytnicze
Zapalenie błony śluzowej nosa
Niezbyt często
Bardzo rzadko
Zaburzenia krwi
i układu chłonnego
Eozynofilia
-
Niezbyt często*
Leukopenia/neutropenia (patrz punkt 4.4)
Bardzo rzadko
Bardzo rzadko
Agranulocytoza lub pancytopenia (patrz
punkt 4.4)
-
Bardzo rzadko
Małopłytkowość (patrz punkt 4.4)
Bardzo rzadko
Bardzo rzadko
Niedokrwistość hemolityczna na skutek
zaburzeń enzymatycznych u pacjentów
z wrodzonym niedoborem dehydrogenazy
glukozo-6-fosforanowej (patrz punkt 4.4)
-
Bardzo rzadko
Zaburzenia układu immunologicznego
Nadwrażliwość
Bardzo rzadko
Niezbyt często
Zaburzenia
endokrynologiczne
Zespół niewłaściwego wydzielania hormonu antydiuretycznego (SIADH)
-
Rzadko
Zaburzenia metabolizmu i odżywiania
Hipoglikemia (patrz punkty 4.4 i 4.5)
-
Niezbyt często*
Hiperkaliemia, przemijająca po przerwaniu leczenia (patrz punkt 4.4)
-
Niezbyt często*
Hiponatremia
-
Niezbyt często*
Hiperglikemia
Bardzo rzadko
-
Zaburzenia psychiczne
Bezsenność
Niezbyt często
-
Zmieniony nastrój (w tym lęk)
Niezbyt często
Niezbyt często
Depresja
Niezbyt często
Niezbyt często*
Zaburzenia snu
-
Niezbyt często
Zaburzenia układu nerwowego
Senność (zwłaszcza na początku leczenia)
Często
Niezbyt często*
Zawroty głowy pochodzenia ośrodkowego (zwłaszcza na początku leczenia)
Często
Często
Ból głowy (zwłaszcza na początku leczenia)
Często
Często
Zaburzenia smaku
Niezbyt często
Często
Drżenie
Niezbyt często
-
Niedoczulica
Niezbyt często
-
Parestezja
Niezbyt często
Często
Omdlenie
Niezbyt często
Niezbyt często*
Stan splątania
Rzadko
Bardzo rzadko
Wzmożone napięcie (hipertonia)
Bardzo rzadko
-
Neuropatia obwodowa
Bardzo rzadko
-
Incydent naczyniowo-mózgowy, prawdopodobnie wtórny do znacznego
niedociśnienia u pacjentów z grupy dużego ryzyka (patrz punkt 4.4)
-
Bardzo rzadko
Zaburzenia pozapiramidowe (zespół
pozapiramidowy)
Nieznana
-
Zaburzenia oka
Zaburzenia widzenia
Często
Często
Podwójne widzenie
Często
-
Zaburzenia ucha i błędnika
Szum uszny
Niezbyt często
Często
Zawroty głowy pochodzenia błędnikowego
-
Często
Zaburzenia serca
Kołatanie serca
Często
Niezbyt często*
Tachykardia
-
Niezbyt często*
Dławica piersiowa (patrz punkt 4.4)
-
Bardzo rzadko
Zawał mięśnia serca, prawdopodobnie wtórny do znacznego niedociśnienia
u pacjentów z grupy dużego ryzyka (patrz
punkt 4.4)
Bardzo rzadko
Bardzo rzadko
Zaburzenia rytmu serca (w tym bradykardia, tachykardia komorowa i migotanie przedsionków)
Niezbyt często
Bardzo rzadko
Zaburzenia naczyniowe
Nagłe zaczerwienienie twarzy i szyi
Często
Rzadko*
Niedociśnienie tętnicze (i objawy związane
z niedociśnieniem)
Niezbyt często
Często
Zapalenie naczyń krwionośnych
Bardzo rzadko
Niezbyt często*
Objaw Raynauda
-
Nieznana
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Duszność
Często
Często
Kaszel
Niezbyt często
Często
Skurcz oskrzeli
-
Niezbyt często
Eozynofilowe zapalenie płuc
-
Bardzo rzadko
Zaburzenia żołądka
i jelit
Rozrost dziąseł
Bardzo rzadko
-
Ból brzucha
Często
Często
Nudności
Często
Często
Wymioty
Niezbyt często
Często
Niestrawność
Często
Często
Zmiana rytmu wypróżnień
Często
-
Suchość błony śluzowej jamy ustnej
Niezbyt często
Niezbyt często
Biegunka
Często
Często
Zaparcie
Często
Często
Zapalenie trzustki
Bardzo rzadko
Bardzo rzadko
Zapalenie błony śluzowej żołądka
Bardzo rzadko
-
Zaburzenia wątroby
i dróg żółciowych
Zapalenie wątroby, żółtaczka
Bardzo rzadko
-
Zapalenie wątroby cytolityczne lub cholestatyczne (patrz punkt 4.4)
-
Bardzo rzadko
Zwiększenie aktywności enzymów wątrobowych (przeważnie związane
z cholestazą)
Bardzo rzadko
-
Zaburzenia skóry
i tkanki podskórnej
Obrzęk Quinckego
Bardzo rzadko
-
Obrzęk naczynioruchowy twarzy, kończyn, warg, błon śluzowych, języka, głośni i (lub)
krtani (patrz punkt 4.4)
Bardzo rzadko
Niezbyt często
Rumień wielopostaciowy
Bardzo rzadko
Bardzo rzadko
Łysienie
Niezbyt często
-
Plamica
Niezbyt często
-
Przebarwienia skóry
Niezbyt często
-
Nadmierne pocenie
Niezbyt często
Niezbyt często
Świąd
Niezbyt często
Często
Wysypka, wykwit
Niezbyt często
Często
Pokrzywka (patrz punkt 4.4)
Niezbyt często
Niezbyt często
Reakcje nadwrażliwości na światło
Bardzo rzadko
Niezbyt często*
Pemfigoid
-
Niezbyt często*
Nasilenie łuszczycy
-
Rzadko
Zespół Stevensa-Johnsona
Bardzo rzadko
-
Zapalenie skóry złuszczające
Bardzo rzadko
-
Toksyczne martwicze oddzielanie się naskórka
Nieznana
-
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej
Obrzęk stawów (obrzęk okolicy kostek)
Często
-
Ból stawów
Niezbyt często
Niezbyt często*
Ból mięśni
Niezbyt często
Niezbyt często*
Kurcze mięśni
Często
Często
Ból pleców
Niezbyt często
-
Zaburzenia nerek i dróg moczowych
Zaburzenia mikcji, oddawanie moczu
w nocy, częstomocz
Niezbyt często
-
Niewydolność nerek
-
Niezbyt często
Ostra niewydolność nerek
-
Rzadko
Bezmocz lub skąpomocz
-
Rzadko*
Zaburzenia układu rozrodczego i piersi
Zaburzenie erekcji
Niezbyt często
Niezbyt często
Ginekomastia
Niezbyt często
-
Zaburzenia ogólne i stany w miejscu podania
Obrzęk
Bardzo często
-
Obrzęk obwodowy
-
Niezbyt często*
Zmęczenie
Często
-
Ból w klatce piersiowej
Niezbyt często
Niezbyt często*
Astenia
Często
Często
Ból
Niezbyt często
-
Złe samopoczucie
Niezbyt często
Niezbyt często*
Gorączka
-
Niezbyt często*
Badania diagnostyczne
Zwiększenie masy ciała, zmniejszenie masy ciała
Niezbyt często
-
Zwiększenie stężenia mocznika we krwi
-
Niezbyt często*
Zwiększenie stężenia kreatyniny we krwi
-
Niezbyt często*
Zwiększenie stężenia bilirubiny we krwi
-
Rzadko
Zwiększenie aktywności enzymów wątrobowych
-
Rzadko
Zmniejszenie stężenia hemoglobiny
i wartości hematokrytu
-
Bardzo rzadko
Urazy, zatrucia i powikłania po zabiegach
Upadki
-
Niezbyt często*
* Częstość określona w badaniach klinicznych dla działań niepożądanych zgłoszonych w spontanicznych raportach.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
Co-Prestarium, 5 mg + 5 mg, tabletki Co-Prestarium, 5 mg + 10 mg, tabletki Co-Prestarium, 10 mg + 5 mg, tabletki Co-Prestarium, 10 mg + 10 mg, tabletki
Jedna tabletka zawiera 5 mg peryndoprylu z argininą, co odpowiada 3,395 mg peryndoprylu oraz 5 mg
amlodypiny w postaci amlodypiny bezylanu (6,935 mg).
Jedna tabletka zawiera 5 mg peryndoprylu z argininą, co odpowiada 3,395 mg peryndoprylu oraz 10 mg amlodypiny w postaci amlodypiny bezylanu (13,870 mg).
Jedna tabletka zawiera 10 mg peryndoprylu z argininą, co odpowiada 6,790 mg peryndoprylu oraz 5 mg amlodypiny w postaci amlodypiny bezylanu (6,935 mg).
Jedna tabletka zawiera 10 mg peryndoprylu z argininą, co odpowiada 6,790 mg peryndoprylu oraz 10 mg amlodypiny w postaci amlodypiny bezylanu (13,870 mg).
Substancja pomocnicza o znanym działaniu: laktoza jednowodna.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka.
Biała, podłużna tabletka o długości 8,5 mm i szerokości 4,5 mm, z wytłoczonym napisem „5/5” po jednej stronie oraz wytłoczonym znakiem „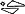 ” po drugiej stronie.
” po drugiej stronie.
Biała, kwadratowa tabletka o długości 8 mm i szerokości 8 mm, z wytłoczonym napisem „5/10” po jednej stronie oraz wytłoczonym znakiem „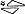 ” po drugiej stronie.
” po drugiej stronie.
Biała, trójkątna tabletka o wymiarach 9,5 mm x 8,8 mm x 8,8 mm, z wytłoczonym napisem „10/5” po jednej stronie oraz wytłoczonym znakiem „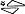 ” po drugiej stronie.
” po drugiej stronie.
Biała, okrągła tabletka o średnicy 8,5 mm, z wytłoczonym napisem „10/10” po jednej stronie oraz wytłoczonym znakiem „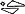 ”po drugiej stronie.
”po drugiej stronie.
Stosowanie produktu Co-Prestarium jest wskazane jako leczenie substytucyjne w terapii nadciśnienia tętniczego samoistnego i (lub) stabilnej choroby wieńcowej u pacjentów, którzy już stosują peryndopryl i amlodypinę w takich samych dawkach.
Dawkowanie
Podanie doustne.
Jedna tabletka na dobę, przyjmowana w pojedynczej dawce, najlepiej rano, przed posiłkiem. Stosowanie złożonego produktu o ustalonych dawkach nie jest odpowiednie do rozpoczęcia terapii.
Jeżeli konieczna jest zmiana dawkowania, można zalecić zmodyfikowanie dawki produktu
Co-Prestarium lub można rozważyć zastosowanie poszczególnych składników preparatu w postaci oddzielnych tabletek.
Szczególne grupy pacjentów
Zaburzenia czynności nerek oraz pacjenci w podeszłym wieku (patrz punkty 4.4 i 5.2)
Wydalanie peryndoprylatu u pacjentów w podeszłym wieku oraz pacjentów z niewydolnością nerek jest zmniejszone. Dlatego też zazwyczaj stosowane postępowanie medyczne powinno obejmować częstą kontrolę stężenia kreatyniny i potasu.
Produkt Co-Prestarium może być stosowany u pacjentów z klirensem kreatyniny większym lub równym 60 ml/min, nie powinien być stosowany u pacjentów z klirensem kreatyniny mniejszym niż 60 ml/min. U tych pacjentów dawkę należy dobierać indywidualnie z zastosowaniem pojedynczych składników produktu.
Amlodypina stosowana w podobnych dawkach u pacjentów w podeszłym wieku i młodszych jest w tym samym stopniu dobrze tolerowana. U pacjentów w podeszłym wieku są zalecane zwykłe schematy dawkowania, ale zwiększania dawkowania należy dokonywać z ostrożnością. Zmiany
stężenia amlodypiny w osoczu nie korelują ze stopniem niewydolności nerek. Amlodypiny nie można usunąć za pomocą dializy.
Zaburzenia czynności wątroby (patrz punkty 4.4 i 5.2)
Schemat dawkowania u pacjentów z łagodnym lub umiarkowanym zaburzeniem czynności wątroby nie został ustalony, dlatego dostosowując dawkę należy zachować ostrożność, dawka początkowa powinna być możliwie najmniejsza spośród wszystkich dostępnych (patrz punkty 4.4 i 5.2). W celu ustalenia optymalnej dawki początkowej i podtrzymującej u pacjentów z zaburzeniem czynności wątroby, należy oddzielnie dostosować dawkę amlodypiny i peryndoprylu. Nie przeprowadzono badań dotyczących farmakokinetyki amlodypiny w ciężkim zaburzeniu czynności wątroby.
Stosowanie amlodypiny należy rozpoczynać od najmniejszej dawki i powoli ją zwiększać u pacjentów z ciężkim zaburzeniem czynności wątroby.
Dzieci i młodzież
Nie należy stosować produktu Co-Prestarium u dzieci oraz młodzieży, ponieważ nie ustalono
skuteczności i tolerancji peryndoprylu w skojarzeniu z amlodypiną w tej grupie wiekowej.
Związane z peryndoprylem:
Wszystkie wymienione poniżej ostrzeżenia, dotyczące każdego składnika, odnoszą się także do
produktu Co-Prestarium.
Związane z peryndoprylem
Ostrzeżenia specjalne
Nadwrażliwość/Obrzęk naczynioruchowy
Rzadko zgłaszano obrzęk naczynioruchowy twarzy, kończyn, warg, błon śluzowych, języka, głośni i (lub) krtani u chorych leczonych inhibitorami konwertazy angiotensyny, w tym peryndoprylem (patrz punkt 4.8).
Obrzęk może wystąpić w każdym momencie leczenia. W takich przypadkach należy natychmiast przerwać stosowanie produktu Co-Prestarium, a pacjent powinien być obserwowany do czasu całkowitego ustąpienia objawów.
Gdy obrzęk obejmuje tylko twarz i wargi, zaburzenia zazwyczaj ustępują bez leczenia, jednak można zastosować leki przeciwhistaminowe w celu złagodzenia objawów.
Obrzęk naczynioruchowy związany z obrzękiem krtani może być śmiertelny. W przypadku, gdy obrzęk obejmuje język, głośnię lub krtań, co mogłoby spowodować niedrożność dróg oddechowych, należy natychmiast zastosować leczenie ratujące życie, czyli podanie adrenaliny i (lub) udrożnienie dróg oddechowych. Pacjenci powinni być pod ścisłą opieką lekarską do czasu całkowitego i trwałego ustąpienia objawów.
U pacjentów, u których w przeszłości występował obrzęk naczynioruchowy niezwiązany
z przyjmowaniem inhibitorów ACE, może wystąpić zwiększone ryzyko obrzęku naczynioruchowego podczas leczenia inhibitorem ACE (patrz punkt 4.3).
Obrzęk jelit był obserwowany rzadko u pacjentów leczonych inhibitorami ACE. Pacjenci zgłaszali bóle brzucha (z nudnościami lub wymiotami albo bez nudności lub wymiotów); w niektórych przypadkach objawy te nie były poprzedzone obrzękiem twarzy, a poziom C-1 esterazy był prawidłowy. Obrzęk naczynioruchowy był diagnozowany w oparciu o procedury medyczne obejmujące tomografię komputerową, badanie ultrasonograficzne lub zabieg chirurgiczny. Objawy obrzęku ustępowały po odstawieniu inhibitora ACE. Obrzęk naczynioruchowy jelit należy wziąć pod uwagę w diagnostyce różnicowej bólów brzucha u pacjentów otrzymujących inhibitory ACE (patrz punkt 4.8).
Jednoczesne stosowanie peryndoprylu z produktem złożonym zawierającym sakubitryl i walsartan jest przeciwwskazane ze względu na zwiększone ryzyko obrzęku naczynioruchowego (patrz punkt 4.3).
Nie wolno rozpoczynać leczenia produktem złożonym zawierającym sakubitryl i walsartan przed upływem 36 godzin od podania ostatniej dawki peryndoprylu. Jeśli leczenie produktem złożonym zawierającym sakubitryl i walsartan jest przerywane, nie wolno rozpoczynać leczenia peryndoprylem przed upływem 36 godzin od podania ostatniej dawki produktu złożonego zawierającego sakubitryl
i walsartan (patrz punkty 4.3 i 4.5). Jednoczesne stosowanie inhibitorów ACE z inhibitorami obojętnej endopeptydazy (ang. neutral endopeptidase, NEP) (np. racekadotryl), inhibitorami mTOR (np. syrolimus, ewerolimus, temsyrolimus) oraz gliptynami (np. linagliptyna, saksagliptyna, sitagliptyna, wildagliptyna) może prowadzić do zwiększenia ryzyka obrzęku naczynioruchowego (np. obrzęk dróg oddechowych lub języka, z zaburzeniami oddychania lub bez takich zaburzeń), patrz punkt 4.5.
Należy zachować ostrożność podczas rozpoczynania stosowania racekadotrylu, inhibitorów mTOR
(np. syrolimus, ewerolimus, temsyrolimus) oraz gliptyn (np. linagliptyna, saksagliptyna, sitagliptyna, wildagliptyna) u pacjenta wcześniej przyjmującego inhibitor ACE.
Reakcje rzekomoanafilaktyczne podczas aferezy lipoprotein o małej gęstości (LDL)
U pacjentów poddanych aferezie lipoprotein o małej gęstości z użyciem siarczanu dekstranu, przyjmujących jednocześnie inhibitory ACE, rzadko obserwowano zagrażające życiu reakcje rzekomoanafilaktyczne. Reakcji tych można jednak uniknąć przez czasowe odstawienie inhibitora ACE przed każdą aferezą.
Reakcje rzekomoanafilaktyczne podczas leczenia odczulającego
U pacjentów przyjmujących inhibitory ACE podczas leczenia odczulającego (np. jadem owadów błonkoskrzydłych) występowały reakcje rzekomoanafilaktyczne. U tych samych pacjentów można uniknąć występowania tych reakcji poprzez czasowe odstawienie inhibitorów ACE, jakkolwiek reakcje nawracały po nieumyślnym wznowieniu leczenia.
Neutropenia/Agranulocytoza/Małopłytkowość/Niedokrwistość
U pacjentów otrzymujących inhibitory ACE była obserwowana neutropenia lub agranulocytoza, małopłytkowość i niedokrwistość. U pacjentów z prawidłową czynnością nerek i bez żadnych innych powikłań neutropenia występuje rzadko. Szczególnie ostrożnie należy stosować peryndopryl
u pacjentów z kolagenozą naczyń, stosujących leki immunosupresyjne, leczonych allopurynolem lub prokainamidem, lub gdy czynniki te występują jednocześnie, szczególnie jeśli wcześniej rozpoznano niewydolność nerek. U niektórych z tych pacjentów rozwinęły się ciężkie zakażenia, które
w niektórych przypadkach były oporne na intensywne leczenie antybiotykami. Jeśli peryndopryl jest stosowany u takich pacjentów, zaleca się okresowe oznaczanie liczby krwinek białych, a pacjenci powinni zostać poinformowani o konieczności zgłaszania każdego objawu zakażenia (np. ból gardła, gorączka).
Nadciśnienie naczyniowo-nerkowe
Podczas leczenia inhibitorami ACE pacjentów z obustronnym zwężeniem tętnic nerkowych lub zwężeniem tętnicy zaopatrującej jedyną nerkę istnieje zwiększone ryzyko niedociśnienia tętniczego oraz niewydolności nerek (patrz punkt 4.3). Leczenie lekami moczopędnymi może stanowić dodatkowy czynnik ryzyka. Zmniejszona czynność nerek może przebiegać z jedynie niewielkimi zmianami stężenia kreatyniny w surowicy, nawet u pacjentów z jednostronnym zwężeniem tętnicy nerkowej.
Podwójna blokada układu renina-angiotensyna-aldosteron (RAA)
Istnieją dowody, iż jednoczesne stosowanie inhibitorów konwertazy angiotensyny (ACE), antagonistów receptora angiotensyny II (AIIRA) lub aliskirenu zwiększa ryzyko niedociśnienia, hiperkaliemii oraz zaburzenia czynności nerek (w tym ostrej niewydolności nerek). W związku z tym nie zaleca się podwójnego blokowania układu RAA poprzez jednoczesne zastosowanie inhibitorów ACE, antagonistów receptora angiotensyny II lub aliskirenu (patrz punkty 4.5 i 5.1).
Jeśli zastosowanie podwójnej blokady układu RAA jest absolutnie konieczne, powinno być prowadzone wyłącznie pod nadzorem specjalisty, a parametry życiowe pacjenta, takie jak: czynność nerek, stężenie elektrolitów oraz ciśnienie tętnicze powinny być ściśle monitorowane.
U pacjentów z nefropatią cukrzycową nie należy stosować jednocześnie inhibitorów ACE oraz antagonistów receptora angiotensyny II.
Pierwotny aldosteronizm
Na ogół pacjenci z pierwotnym hiperaldosteronizmem nie reagują na leki przeciwnadciśnieniowe działające przez hamowanie układu renina-angiotensyna. Z tego względu nie zaleca się stosowania tego produktu.
Ciąża
Nie należy rozpoczynać podawania inhibitorów ACE podczas ciąży. Jeśli kontynuacja leczenia inhibitorem ACE nie jest konieczna, u pacjentek planujących ciążę należy zastosować inne leki przeciwnadciśnieniowe, o ustalonym profilu bezpieczeństwa stosowania podczas ciąży. W momencie
potwierdzenia ciąży, należy natychmiast przerwać leczenie inhibitorami ACE i, jeśli jest to konieczne, należy rozpocząć inne leczenie (patrz punkty 4.3 i 4.6).
Zalecane środki ostrożności
Niedociśnienie tętnicze
Inhibitory ACE mogą powodować nadmierne obniżenie ciśnienia tętniczego. Objawowe niedociśnienie tętnicze występuje rzadko u pacjentów z niepowikłanym nadciśnieniem tętniczym, pojawia się częściej u pacjentów odwodnionych z powodu stosowania leków moczopędnych, diety ubogosodowej, dializ, gdy występuje biegunka lub wymioty lub u pacjentów z ciężkim nadciśnieniem reninozależnym (patrz punkty 4.5 i 4.8).
U pacjentów ze zwiększonym ryzykiem wystąpienia objawowego niedociśnienia tętniczego należy kontrolować ciśnienie tętnicze, czynność nerek oraz stężenie potasu w trakcie leczenia produktem Co-Prestarium.
Dotyczy to także pacjentów z chorobą niedokrwienną serca lub chorobą naczyniową mózgu, u których nadmierny spadek ciśnienia tętniczego może powodować zawał mięśnia serca lub incydent naczyniowo-mózgowy.
W przypadku wystąpienia niedociśnienia tętniczego, pacjenta należy położyć na plecach oraz, jeżeli jest to konieczne, podać dożylnie roztwór chlorku sodu o stężeniu 9 mg/ml (0,9%). Wystąpienie przemijającego niedociśnienia tętniczego nie wyklucza późniejszego stosowania produktu, co zazwyczaj odbywa się bez trudności, gdy ciśnienie tętnicze zwiększy się po zwiększeniu objętości wewnątrznaczyniowej.
Zwężenie zastawki aortalnej i mitralnej/Kardiomiopatia przerostowa
Peryndopryl, tak jak inne inhibitory ACE, należy stosować ze szczególną ostrożnością u pacjentów
ze zwężeniem zastawki mitralnej oraz ze zwężeniem drogi odpływu z lewej komory, jak również
u pacjentów ze zwężeniem zastawki aortalnej i kardiomiopatią przerostową.
Zaburzenia czynności nerek
U pacjentów z zaburzoną czynnością nerek (klirens kreatyniny < 60 ml/min) dawka powinna być ustalana indywidualnie z zastosowaniem pojedynczych składników produktu (patrz punkt 4.2). U pacjentów z zaburzoną czynnością nerek kontrola stężenia potasu i kreatyniny jest częścią standardowego postępowania medycznego (patrz punkt 4.8).
U części pacjentów z obustronnym zwężeniem tętnic nerkowych lub zwężeniem jednostronnym tętnicy nerkowej, którzy byli leczeni inhibitorami ACE, obserwowano zwiększenie stężenia mocznika we krwi i kreatyniny w surowicy. Zaburzenia te były przemijające po przerwaniu leczenia. Dotyczy to szczególnie pacjentów z niewydolnością nerek. W przypadku nadciśnienia nerkowo-naczyniowego istnieje zwiększone ryzyko ciężkiego niedociśnienia i niewydolności nerek. U niektórych pacjentów
z nadciśnieniem tętniczym bez uprzedniej choroby naczyń nerkowych obserwowano zwiększenie stężenia mocznika we krwi i kreatyniny w surowicy, zazwyczaj nieznaczne i przemijające, zwłaszcza w sytuacjach, kiedy peryndopryl był stosowany jednocześnie z lekiem moczopędnym. Objawy takie z większym prawdopodobieństwem mogą wystąpić u pacjentów z istniejącą zaburzoną czynnością nerek.
Niewydolność wątroby
Rzadko stosowanie inhibitorów ACE jest związane z wystąpieniem zespołu rozpoczynającego się od żółtaczki cholestatycznej i prowadzącego do rozwoju piorunującej martwicy wątroby i (czasami) śmierci. Mechanizm tego zespołu nie jest wyjaśniony. U pacjentów otrzymujących inhibitory ACE, u których rozwinęła się żółtaczka, lub u których obserwuje się zwiększenie aktywności enzymów wątrobowych, należy przerwać leczenie inhibitorem ACE i zastosować odpowiednie postępowanie medyczne (patrz punkt 4.8).
Rasa
Inhibitory ACE częściej powodują obrzęk naczynioruchowy u pacjentów rasy czarnej niż u pacjentów innych ras.
Tak jak inne inhibitory ACE, peryndopryl może być mniej skuteczny w obniżaniu ciśnienia tętniczego u pacjentów rasy czarnej niż u pacjentów innych ras, prawdopodobnie z powodu małej aktywności reninowej osocza u pacjentów rasy czarnej z nadciśnieniem tętniczym.
Kaszel
U pacjentów leczonych inhibitorami ACE obserwowano kaszel. Charakteryzuje się on tym, że jest suchy, uporczywy oraz ustępuje po przerwaniu leczenia. W diagnostyce różnicowej kaszlu należy rozważyć, czy kaszel nie jest wywołany przez inhibitor ACE.
Zabiegi chirurgiczne/Znieczulenie
U pacjentów poddawanych rozległym zabiegom chirurgicznym lub znieczuleniu środkami powodującymi niedociśnienie tętnicze, produkt Co-Prestarium może blokować powstawanie angiotensyny II wtórne do kompensacyjnego uwalniania reniny. Leczenie należy przerwać na jeden dzień przed zabiegiem chirurgicznym.
Jeżeli wystąpi niedociśnienie tętnicze i rozważa się taki mechanizm, można je skorygować poprzez zwiększenie objętości płynów.
Hiperkaliemia
U niektórych pacjentów w trakcie stosowania inhibitorów ACE, w tym peryndoprylu, obserwowano zwiększenie stężenia potasu w surowicy, inhibitory ACE mogą powodować hiperkaliemię, ponieważ hamują wydzielanie aldosteronu. Wpływ jest zwykle nieznaczny u pacjentów z prawidłową czynnością nerek. Czynnikami ryzyka hiperkaliemii są: niewydolność nerek, pogorszona czynność nerek, wiek (powyżej 70 lat), cukrzyca, współistniejące inne czynniki, w szczególności odwodnienie, ostra dekompensacja układu krążenia, kwasica metaboliczna oraz jednoczesne stosowanie leków moczopędnych oszczędzających potas (np.: spironolakton, eplerenon, triamteren lub amiloryd), suplementy potasu, a także zamienniki soli kuchennej zawierające potas; lub też u pacjentów, którzy przyjmują inne leki powodujące zwiększenie stężenia potasu w surowicy (np. heparyna, kotrimoksazol
Związane z peryndoprylem
Dane z badania klinicznego wykazały, że podwójna blokada układu renina-angiotensyna-aldosteron (RAA) w wyniku jednoczesnego zastosowania inhibitorów ACE, antagonistów receptora angiotensyny II lub aliskirenu jest związana z większą częstością występowania zdarzeń niepożądanych, takich jak: niedociśnienie, hiperkaliemia oraz zaburzenia czynności nerek (w tym ostra niewydolność nerek) w porównaniu z zastosowaniem leku z grupy antagonistów układu RAA w monoterapii (patrz punkty 4.3, 4.4 i 5.1).
Leki zwiększające ryzyko obrzęku naczynioruchowego
Jednoczesne stosowanie inhibitorów ACE z produktem złożonym zawierającym sakubitryl i walsartan
jest przeciwwskazane ze względu na zwiększone ryzyko obrzęku naczynioruchowego (patrz punkty
4.3 i 4.4). Nie wolno rozpoczynać leczenia produktem złożonym zawierającym sakubitryl i walsartan przed upływem 36 godzin od podania ostatniej dawki peryndoprylu. Nie wolno rozpoczynać leczenia peryndoprylem przed upływem 36 godzin od podania ostatniej dawki produktu złożonego zawierającego sakubitryl i walsartan (patrz punkty 4.3 i 4.4).
Jednoczesne stosowanie inhibitorów ACE z racekadotrylem, inhibitorami mTOR (np. syrolimus, ewerolimus, temsyrolimus) oraz gliptynami (np. linagliptyna, saksagliptyna, sitagliptyna, wildagliptyna) może prowadzić do zwiększenia ryzyka obrzęku naczynioruchowego (patrz punkt 4.4).
Leki wywołujące hiperkaliemię
Chociaż zwykle stężenie potasu w surowicy krwi pozostaje w zakresie wartości prawidłowych,
u niektórych pacjentów leczonych produktem Co-Prestarium może wystąpić hiperkaliemia. Niektóre leki lub grupy terapeutyczne mogą zwiększać częstość wystąpienia hiperkaliemii: aliskiren, sole potasowe, leki moczopędne oszczędzające potas (np. spironolakton, triamteren lub amiloryd), inhibitory ACE, antagoniści receptora angiotensyny II, niesteroidowe leki przeciwzapalne, heparyny, leki immunosupresyjne, takie jak cyklosporyna lub takrolimus; trimetoprim oraz kotrimoksazol (produkt złożony zawierający trimetoprim i sulfametoksazol), ponieważ wiadomo, że trimetoprim działa jak lek moczopędny oszczędzający potas - amiloryd. Skojarzone stosowanie tych leków zwiększa ryzyko hiperkaliemii. Z tego względu nie zaleca się jednoczesnego stosowania produktu Co- Prestarium z wyżej wymienionymi lekami. Jeśli jest wskazane jednoczesne stosowanie, leki te należy stosować z ostrożnością, często monitorując stężenie potasu w surowicy krwi.
Jednoczesne stosowanie przeciwwskazane (patrz punkt 4.3) Aliskiren
U pacjentów z cukrzycą lub zaburzeniami czynności nerek zwiększa się ryzyko hiperkaliemii, pogorszenia czynności nerek oraz chorobowości i śmiertelności z przyczyn sercowo-naczyniowych.
Pozaustrojowe metody leczenia
Pozaustrojowe metody leczenia powodujące kontakt krwi z powierzchniami o ujemnym ładunku elektrycznym, takie jak dializa lub hemofiltracja z użyciem niektórych błon o dużej przepuszczalności (np. błon poliakrylonitrylowych) oraz afereza lipoprotein o małej gęstości z użyciem siarczanu dekstranu - ze względu na zwiększone ryzyko ciężkich reakcji rzekomoanafilaktycznych (patrz punkt 4.3). Jeśli takie leczenie jest konieczne, należy rozważyć użycie błon dializacyjnych innego typu lub zastosować lek przeciwnadciśnieniowy z innej grupy.
Jednoczesne stosowanie niezalecane (patrz punkt 4.4) Aliskiren
U innych osób niż pacjenci z cukrzycą lub zaburzeniami czynności nerek zwiększa się ryzyko hiperkaliemii, pogorszenia czynności nerek oraz chorobowości i śmiertelności z przyczyn sercowo- naczyniowych.
Jednoczesne leczenie inhibitorem ACE i antagonistą receptora angiotensyny II
W literaturze przedmiotowej opisywano, że u pacjentów z jawną chorobą miażdżycową, niewydolnością serca lub z cukrzycą z powikłaniami narządowymi, jednoczesne leczenie inhibitorem ACE i antagonistą receptora angiotensyny II wiąże się z większą częstością występowania niedociśnienia tętniczego, omdlenia, hiperkaliemii i pogorzenia czynności nerek (w tym ostrej niewydolności nerek), w porównaniu ze stosowaniem pojedynczego środka działającego na układ renina-angiotensyna-aldosteron. Podwójną blokadę (na przykład, przez skojarzenie inhibitora ACE
z antagonistą receptora angiotensyny II) należy ograniczyć do indywidualnie określonych przypadków, ze ścisłym kontrolowaniem czynności nerek, stężenia potasu i ciśnienia tętniczego.
Estramustyna
Ryzyko zwiększonej częstości występowania działań niepożądanych, takich jak obrzęk naczynioruchowy.
Leki moczopędne oszczędzające potas (np. triamteren, amiloryd), sole potasowe
Hiperkaliemia (potencjalnie zakończona zgonem), zwłaszcza w przypadku zaburzeń czynności nerek (addytywne działanie hiperkaliemizujące).
Nie zaleca się jednoczesnego stosowania peryndoprylu z wymienionymi powyżej produktami (patrz punkt 4.4). Jeśli mimo to jednoczesne stosowanie tych produktów jest wskazane, należy je stosować ostrożnie i często kontrolować stężenie potasu w surowicy. Stosowanie spironolaktonu
w niewydolności serca – patrz poniżej.
Lit
Podczas jednoczesnego stosowania inhibitorów ACE zgłaszano przemijające zwiększenie stężenia litu
w surowicy oraz zwiększenie jego toksyczności (ciężka neurotoksyczność). Nie jest zalecane
jednoczesne stosowanie peryndoprylu i litu. Jeśli jednoczesne stosowanie okazuje się konieczne, należy uważnie kontrolować stężenie litu w surowicy (patrz punkt 4.4).
Jednoczesne stosowanie wymagające szczególnej ostrożności
Leki przeciwcukrzycowe (insuliny, doustne leki hipoglikemizujące)
Badania epidemiologiczne sugerują, że jednoczesne stosowanie inhibitorów ACE i leków przeciwcukrzycowych (insuliny, doustne leki hipoglikemizujące) może nasilać działanie zmniejszające stężenie glukozy we krwi z ryzykiem hipoglikemii. Jest to najbardziej prawdopodobne podczas pierwszych tygodni leczenia skojarzonego i u pacjentów z zaburzeniami czynności nerek.
Leki moczopędne nieoszczędzające potasu
U pacjentów leczonych lekami moczopędnymi, szczególnie pacjentów z hipowolemią lub niedoborem sodu, może wystąpić nadmierne obniżenie ciśnienia tętniczego po rozpoczęciu leczenia inhibitorem ACE. Prawdopodobieństwo działania hipotensyjnego można zmniejszyć odstawiając lek moczopędny, zwiększając objętość płynów lub podaż soli przed rozpoczęciem leczenia małymi, stopniowo zwiększanymi dawkami peryndoprylu.
W nadciśnieniu tętniczym, jeśli wcześniejsze podawanie leków moczopędnych spowodowało zaburzenia gospodarki wodno-elektrolitowej, należy albo przerwać stosowanie leku moczopędnego przed rozpoczęciem podawania inhibitora ACE, a następnie można ponownie zastosować lek moczopędny nieoszczędzający potasu, albo leczenie inhibitorem ACE należy rozpocząć od małej, stopniowo zwiększanej dawki.
U pacjentów z zastoinową niewydolnością serca, leczonych lekami moczopędnymi, stosowanie inhibitora ACE należy rozpocząć od bardzo małej dawki i, jeśli jest to możliwe, po zmniejszeniu dawki leku moczopędnego nieoszczędzającego potasu.
We wszystkich przypadkach, podczas pierwszych tygodni leczenia inhibitorem ACE, należy monitorować czynność nerek (stężenie kreatyniny).
Leki moczopędne oszczędzające potas (eplerenon, spironolakton)
Eplerenon lub spironolakton w dawce 12,5 mg do 50 mg na dobę, z małą dawką inhibitora ACE: U pacjentów z niewydolnością serca klasy II-IV (wg NYHA), z frakcją wyrzutową lewej komory
<40%, otrzymujących inhibitory ACE i diuretyki pętlowe, istnieje ryzyko hiperkaliemii, potencjalnie zakończonej zgonem, zwłaszcza w przypadku nieprzestrzegania zaleceń dotyczących stosowania leków w tym skojarzeniu.
Przed rozpoczęciem skojarzonego leczenia należy sprawdzić, czy nie występuje hiperkaliemia
lub zaburzenia czynności nerek.
Zaleca się oznaczanie stężenia potasu oraz kreatyniny we krwi raz w tygodniu w pierwszym miesiącu leczenia, a następnie co miesiąc.
Niesteroidowe leki przeciwzapalne (NLPZ), w tym kwas acetylosalicylowy 3 g na dobę
Jeśli inhibitory ACE są podawane jednocześnie z NLPZ (tj. kwasem acetylosalicylowym w dawkach działających przeciwzapalnie, inhibitorami COX-2 i niewybiórczymi NLPZ), może wystąpić osłabienie działania przeciwnadciśnieniowego. Jednoczesne stosowanie inhibitorów ACE i NLPZ może prowadzić do zwiększonego ryzyka pogorszenia czynności nerek, w tym możliwej ostrej niewydolności nerek oraz zwiększenia stężenia potasu w surowicy, zwłaszcza u pacjentów
z uprzednio istniejącą pogorszoną czynnością nerek. Podczas leczenia skojarzonego należy zachować ostrożność, zwłaszcza u osób w podeszłym wieku. Pacjentów należy odpowiednio nawodnić
i rozważyć monitowanie czynności nerek po rozpoczęciu jednoczesnego leczenia oraz cyklicznie
w późniejszym okresie.
Jednoczesne stosowanie wymagające ostrożności
Leki sympatykomimetyczne
Leki sympatykomimetyczne mogą osłabiać działanie przeciwnadciśnieniowe inhibitorów ACE.
Złoto
Reakcje przypominające objawy jak po podaniu azotanów (nitritoid reactions) (w tym zaczerwienienie twarzy, nudności, wymioty i niedociśnienie) były rzadko obserwowane u pacjentów
stosujących preparaty złota we wstrzyknięciach (aurotiojabłczan sodu) i jednocześnie inhibitor ACE,
w tym peryndopryl.
Związane z amlodypiną
Jednoczesne stosowanie niezalecane
Dantrolen (infuzja): u zwierząt po podaniu werapamilu i dożylnym podaniu dantrolenu obserwowano prowadzące do śmierci migotanie komór i zapaść krążeniową powiązaną z hiperkaliemią. Ze względu na ryzyko hiperkaliemii zaleca się unikanie jednoczesnego podawania antagonistów wapnia, takich jak amlodypina, u pacjentów podatnych na hipertermię złośliwą i w leczeniu hipertermii złośliwej.
Jednoczesne stosowanie wymagające szczególnej ostrożności
Induktory CYP3A4: jednoczesne stosowanie znanych induktorów CYP3A4 może powodować zmiany stężenia amlodypiny w osoczu. Dlatego też, zarówno podczas jednoczesnego stosowania, jak i po jego zakończeniu - szczególnie w przypadku silnych induktorów CYP3A4 (np. ryfampicyna, ziele dziurawca zwyczajnego) - należy kontrolować ciśnienie tętnicze i rozważyć konieczność modyfikacji dawki.
Inhibitory CYP3A4: jednoczesne stosowanie amlodypiny z silnymi lub umiarkowanymi inhibitorami CYP3A4 (inhibitory proteazy, azole przeciwgrzybicze, makrolidy, takie jak erytromycyna lub klarytromycyna; werapamil lub diltiazem) może powodować znaczne zwiększenie wpływu amlodypiny na organizm. Znaczenie kliniczne tych zmian farmakokinetycznych może być bardziej widoczne u pacjentów w podeszłym wieku. Może być konieczna kontrola kliniczna oraz dostosowanie dawki.
U pacjentów przyjmujących klarytromycynę i amlodypinę istnieje zwiększone ryzyko niedociśnienia tętniczego. Podczas jednoczesnego stosowania amlodypiny i klarytromycyny zaleca się ścisłą obserwację pacjentów.
Jednoczesne stosowanie wymagające rozważenia
Działanie amlodypiny polegające na obniżaniu ciśnienia tętniczego sumuje się z działaniem obniżającym ciśnienie tętnicze innych produktów leczniczych o właściwościach przeciwnadciśnieniowych.
Takrolimus
Podczas jednoczesnego stosowania z amlodypiną istnieje ryzyko zwiększenia stężenia takrolimusu we krwi. Aby uniknąć toksycznego działania takrolimusu, stosowanie amlodypiny u pacjenta leczonego takrolimusem wymaga monitorowania stężenia takrolimusu we krwi oraz dostosowania dawki takrolimusu, jeśli jest to konieczne.
Inhibitory kinazy mTOR
Inhibitory mTOR, takie jak syrolimus, temsyrolimus i ewerolimus, są substratami CYP3A. Amlodypina jest słabym inhibitorem CYP3A. Podczas jednoczesnego stosowania inhibitorów mTOR, amlodypina może zwiększyć narażenie na inhibitory mTOR.
Cyklosporyna
Nie przeprowadzono badań interakcji dotyczących cyklosporyny i amlodypiny ani u zdrowych ochotników, ani w innych populacjach, z wyjątkiem pacjentów po przeszczepieniu nerki, u których obserwowano zmienne zwiększenie minimalnego stężenia cyklosporyny (średnio o 0%-40%). Należy rozważyć monitorowanie stężenia cyklosporyny u pacjentów po przeszczepieniu nerki, przyjmujących amlodypinę, a w razie konieczności zmniejszyć dawkę cyklosporyny.
Symwastatyna
Wielokrotne, jednoczesne podawanie amlodypiny w dawce 10 mg i symwastatyny w dawce 80 mg powodowało zwiększenie o 77% narażenia na symwastatynę, w porównaniu do podawania symwastatyny w monoterapii. U pacjentów przyjmujących amlodypinę należy zmniejszyć dawkę symwastatyny do 20 mg na dobę.
Inne skojarzenia
W badaniach klinicznych dotyczących interakcji, amlodypina nie wpływała na farmakokinetykę
atorwastatyny, digoksyny ani warfaryny.
Stosowanie amlodypiny z grejpfrutem lub z sokiem grejpfrutowym nie jest zalecane ze względu na możliwość zwiększenia biodostępności, co u niektórych pacjentów może nasilać obniżenie ciśnienia tętniczego.
Związane z produktem Co-Prestarium
Jednoczesne stosowanie wymagające szczególnej ostrożności Baklofen
Nasilone działanie przeciwnadciśnieniowe. Należy monitorować ciśnienie tętnicze oraz dostosować dawkę leku przeciwnadciśnieniowego, jeśli jest to konieczne.
Jednoczesne stosowanie wymagające ostrożności
Nie prowadzono badań nad wpływem produktu Co-Prestarium na zdolność prowadzenia pojazdów i obsługiwania maszyn. Amlodypina wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Zdolność reagowania może ulec osłabieniu, jeśli
u pacjenta wystąpią zawroty głowy, ból głowy, zmęczenie, znużenie lub nudności. Zaleca się ostrożność, zwłaszcza na początku leczenia.
Nie ma danych dotyczących przedawkowania produktu Co-Prestarium u ludzi.
Doświadczenia z umyślnym przedawkowaniem amlodypiny u ludzi są ograniczone.
Objawy: dostępne dane wskazują, że duże przedawkowanie może prowadzić do znacznego rozszerzenia naczyń obwodowych oraz możliwej odruchowej tachykardii. Donoszono o znacznym
i prawdopodobnie długotrwałym zmniejszeniu ciśnienia tętniczego, prowadzącym do wstrząsu, w tym wstrząsu z wystąpieniem zgonu.
Rzadko notowano niekardiogenny obrzęk płuc w następstwie przedawkowania amlodypiny, mogący wystąpić z opóźnieniem (do 24-48 godzin po przyjęciu) i powodujący konieczność wspomagania oddychania. Czynnikami predysponującymi mogą być wczesne działania resuscytacyjne (w tym przeciążenie płynami) mające na celu utrzymanie perfuzji i pojemności minutowej serca.
Leczenie: klinicznie znamienne niedociśnienie spowodowane przedawkowaniem amlodypiny wymaga aktywnego podtrzymywania czynności układu sercowo-naczyniowego, w tym częstego monitorowania czynności serca i układu oddechowego, uniesienia kończyn oraz kontrolowania objętości płynów krążących i ilości wydalanego moczu.
W celu przywrócenia napięcia naczyń krwionośnych i ciśnienia krwi, można zastosować lek zwężający naczynia krwionośne, pod warunkiem, że nie ma dla niego przeciwwskazań. Dożylne podanie glukonianu wapnia może być korzystne w celu odwrócenia skutków blokady kanałów wapniowych.
W niektórych przypadkach warto rozważyć płukanie żołądka. U zdrowych ochotników zastosowanie węgla aktywowanego do 2 godzin po podaniu 10 mg amlodypiny zmniejszyło szybkość absorpcji amlodypiny.
Dializa najprawdopodobniej nie przyniesie spodziewanych korzyści, ponieważ amlodypina silnie wiąże się z białkami.
Dostępne dane dotyczące przedawkowania peryndoprylu u ludzi są ograniczone.
Objawami związanymi z przedawkowaniem inhibitorów ACE są: niedociśnienie tętnicze, wstrząs, zaburzenia gospodarki wodno-elektrolitowej, niewydolność nerek, hiperwentylacja, tachykardia, palpitacje, bradykardia, zawroty głowy, lęk i kaszel.
Zalecanym postępowaniem w przypadku przedawkowania peryndoprylu jest dożylne podanie roztworu soli fizjologicznej. W razie wystąpienia znacznego obniżenia ciśnienia tętniczego należy ułożyć pacjenta w pozycji na plecach z głową umieszczoną niżej. Jeżeli dostępne, można rozważyć podanie we wlewie angiotensyny II i (lub) dożylne podanie katecholamin.
Peryndopryl może być usuwany z krążenia ustrojowego za pomocą hemodializy (patrz punkt 4.4). Zastosowanie rozrusznika serca jest wskazane w przypadku wystąpienia opornej na leczenie bradykardii. Czynności życiowe, stężenia elektrolitów oraz kreatyniny w surowicy powinny być stale monitorowane.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
amlodypina rozszerza obwodowe tętniczki i w ten sposób zmniejsza całkowite opory obwodowe (afterload), które muszą być pokonane przez mięsień sercowy. Ponieważ częstość akcji serca pozostaje stała, zmniejszenie obciążenia redukuje zapotrzebowanie mięśnia serca na energię i zmniejsza zużycie tlenu.
prawdopodobnie amlodypina rozszerza też główne tętnice wieńcowe i tętniczki wieńcowe, zarówno w obszarze zdrowym jak i niedokrwionym. Takie rozszerzenie naczyń zwiększa zaopatrzenie w tlen u pacjentów ze skurczem tętnic wieńcowych (dławica Prinzmetala).
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Grupa farmakoterapeutyczna: Preparaty złożone zawierające inhibitory konwertazy angiotensyny
i antagonistów wapnia; kod ATC: C09BB04.
Peryndopryl
Mechanizm działania
Peryndopryl jest inhibitorem enzymu konwertującego angiotensynę I w angiotensynę II (inhibitor ACE). Enzym konwertujący, kinaza, jest egzopeptydazą, która przekształca angiotensynę I w kurczącą naczynia angiotensynę II; dodatkowo pobudza rozkład bradykininy, substancji rozszerzającej naczynia, do nieczynnych heptapeptydów.
Zahamowanie ACE skutkuje zmniejszeniem stężenia angiotensyny II w osoczu, co prowadzi do zwiększenia aktywności reninowej osocza (poprzez zahamowanie negatywnego sprzężenia zwrotnego spowodowanego uwalnianiem reniny) oraz zmniejszenia sekrecji aldosteronu. Z powodu inaktywacji bradykininy, zahamowanie ACE także powoduje zwiększoną aktywność krążących miejscowych układów kalikreina-kinina (i na tej drodze także zostaje aktywowany układ prostaglandyn). Jest prawdopodobne, że ten mechanizm bierze udział w działaniu obniżającym ciśnienie tętnicze
i odpowiada za część działań niepożądanych (np. kaszel).
Peryndopryl działa za pośrednictwem swojego aktywnego metabolitu, peryndoprylatu. Inne
metabolity nie wykazują aktywności dotyczącej hamowania ACE in vitro.
Skuteczność kliniczna i bezpieczeństwo stosowania Nadciśnienie tętnicze
Peryndopryl jest skuteczny we wszystkich stopniach nadciśnienia tętniczego: łagodnym, umiarkowanym i ciężkim; zmniejsza skurczowe i rozkurczowe ciśnienie zarówno w pozycji leżącej, jak i stojącej.
Peryndopryl zmniejsza opory obwodowe prowadząc do zmniejszenia ciśnienia tętniczego.
W konsekwencji, zwiększa się przepływ naczyniowy bez jakiegokolwiek wpływa na częstość akcji serca.
Przepływ nerkowy, z reguły, zwiększa się, podczas gdy przesączenie kłębuszkowe (GFR) zazwyczaj nie zmienia się.
Aktywność przeciwnadciśnieniowa jest największa w okresie od 4 do 6 godzin po przyjęciu pojedynczej dawki i utrzymuje się przez co najmniej 24 godziny, wskaźnik T/P wynosi 87-100%. Obniżenie ciśnienia tętniczego występuje szybko. U pacjentów odpowiadających na leczenie, normalizacja ciśnienia jest osiągana w ciągu miesiąca i utrzymuje się bez wystąpienia zjawiska tachyfilaksji.
Przerwanie leczenia nie powoduje nadciśnienia „z odbicia”.
Peryndopryl zmniejsza przerost lewej komory serca. U ludzi potwierdzono naczyniorozszerzające właściwości peryndoprylu. Peryndopryl poprawia elastyczność dużych tętnic, a także zmniejsza warstwę środkową ściany małych tętnic.
Stabilna choroba wieńcowa
Wieloośrodkowe, międzynarodowe, randomizowane badanie EUROPA kontrolowane placebo,
z zastosowaniem podwójnie ślepej próby, trwało 4 lata.
12218 pacjentów w wieku powyżej 18 lat zostało losowo przydzielonych do grupy otrzymującej 8 mg
peryndoprylu w połączeniu z tert-butyloaminą (równoważne z 10 mg peryndoprylu w połączeniu
z argininą) (n=6110) lub do grupy otrzymującej placebo (n=6108).
Badana populacja miała potwierdzoną chorobę wieńcową przy braku klinicznych objawów niewydolności serca. Ogólnie, 90% pacjentów przebyło zawał serca i (lub) rewaskularyzację naczyń wieńcowych. Większość pacjentów otrzymywała badany lek dodatkowo do leczenia konwencjonalnego, podczas którego stosowano inhibitory płytek krwi, leki zmniejszające stężenia lipidów i beta-adrenolityki.
Główne kryterium skuteczności stanowiło połączenie śmiertelności z przyczyn sercowo- naczyniowych, zawałów serca niezakończonych zgonem i (lub) zatrzymań akcji serca zakończonych skuteczną resuscytacją. Leczenie z zastosowaniem 8 mg peryndoprylu w połączeniu z tert- butyloaminą (równoważne z 10 mg peryndoprylu w połączeniu z argininą) raz na dobę, spowodowało znamienne zmniejszenie całkowitej częstości występowania pierwszorzędowego punku końcowego
o 1,9% (względne zmniejszenie ryzyka o 20%, 95% CI 9,4; 28,6 - p0,001).
U pacjentów z zawałem serca i (lub) rewaskularyzacją w wywiadzie, całkowite zmniejszenie pierwszorzędowego punktu końcowego wynosiło 2,2%, co odpowiada RRR 22,4% (95% CI [12,0; 31,6]·- p0,001) w porównaniu do placebo.
Dane badań klinicznych dotyczące podwójnej blokady układu renina-angiotensyna-aldosteron (RAAS)
Dwa duże randomizowane, kontrolowane badania kliniczne ONTARGET (ang. ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) i VA NEPHRON-D (ang. The Veterans Affairs Nephropathy in Diabetes) badały jednoczesne zastosowanie inhibitora ACE
z antagonistami receptora angiotensyny II.
Badanie ONTARGET było przeprowadzone z udziałem pacjentów z chorobami układu sercowo- naczyniowego, chorobami naczyń mózgowych w wywiadzie lub cukrzycą typu 2 z towarzyszącymi, udowodnionymi uszkodzeniami narządów docelowych.
Badanie VA NEPHRON-D było przeprowadzone z udziałem pacjentów z cukrzycą typu 2 oraz z nefropatią cukrzycową.
Badania te wykazały brak istotnego korzystnego wpływu na parametry nerkowe i (lub) wyniki
w zakresie chorobowości oraz śmiertelności sercowo-naczyniowej, podczas gdy zaobserwowano zwiększone ryzyko hiperkaliemii, ostrego uszkodzenia nerek i (lub) niedociśnienia, w porównaniu z monoterapią.
Ze względu na podobieństwa w zakresie właściwości farmakodynamicznych tych leków, przytoczone wyniki również mają znaczenie w przypadku innych inhibitorów ACE oraz antagonistów receptora angiotensyny II.
Dlatego też u pacjentów z nefropatią cukrzycową nie należy jednocześnie stosować inhibitorów ACE oraz antagonistów receptora angiotensyny II.
Badanie ALTITUDE (ang. Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints) było zaprojektowane w celu zbadania korzyści z dodania aliskirenu do standardowego leczenia inhibitorem ACE lub antagonistą receptora angiotensyny II u pacjentów
z cukrzycą typu 2 i przewlekłą chorobą nerek oraz (lub) z chorobą układu sercowo-naczyniowego. Badanie zostało przedwcześnie przerwane z powodu zwiększonego ryzyka działań niepożądanych. Zgony sercowo-naczyniowe i udary mózgu występowały częściej w grupie otrzymującej aliskiren w odniesieniu do grupy placebo. W grupie otrzymującej aliskiren odnotowano również częstsze występowanie zdarzeń niepożądanych, w tym ciężkich zdarzeń niepożądanych (hiperkaliemia, niedociśnienie i niewydolność nerek) względem grupy placebo.
Amlodypina
Mechanizm działania
Amlodypina jest inhibitorem napływu jonów wapniowych należącym do grupy dihydropirydyny (powolny bloker kanału wapniowego lub antagonista jonów wapniowych) i hamuje przezbłonowy przepływ jonów wapnia do komórek mięśnia sercowego i komórek błony mięśniowej naczyń.
Mechanizm przeciwnadciśnieniowego działania amlodypiny wynika z bezpośredniego działania rozkurczającego na mięśnie gładkie naczyń.
Dokładny mechanizm, w którym amlodypina zmniejsza objawy dławicowe, nie jest w pełni ustalony. Niemniej wiadomo, że amlodypina redukuje następstwa niedokrwienia w dwóch mechanizmach:
Skuteczność kliniczna i bezpieczeństwo stosowania
U pacjentów z nadciśnieniem tętniczym, jednorazowa dawka dobowa powoduje klinicznie istotne
obniżenie ciśnienia tętniczego zarówno w pozycji leżącej, jak i stojącej przez okres 24 godzin. Z powodu opóźnionego początku działania, amlodypina nie nadaje się do leczenia ostrego nadciśnienia.
U pacjentów z chorobą wieńcową, zastosowanie amlodypiny raz na dobę zwiększa całkowitą pracę serca, wydłuża czas do wystąpienia bólu wieńcowego i czas do obniżenia odcinka ST o 1 mm, zmniejsza częstość bólów dławicowych, a także zastosowanie nitrogliceryny.
Amlodypina nie powoduje żadnych metabolicznych działań niepożądanych lub zmian w stężeniu lipidów w osoczu, jest odpowiednia dla pacjentów z astmą, cukrzycą i dną moczanową.
Choroba niedokrwienna serca
Skuteczność amlodypiny w zapobieganiu zdarzeniom klinicznym u pacjentów z chorobą niedokrwienną serca oceniano w niezależnym, wieloośrodkowym, randomizowanym badaniu prowadzonym metodą podwójnie ślepej próby, kontrolowanym placebo, z udziałem 1997 pacjentów,
o nazwie CAMELOT (ang. Comparison of Amlodipine vs Enalapril to Limit Occurrences of Thrombosis). Przez 2 lata wśród uczestników badania 663 pacjentów otrzymywało amlodypinę
w dawce 5-10 mg, 673 pacjentów otrzymywało enalapryl w dawce 10-20 mg, a 655 pacjentów otrzymywało placebo, poza standardowym leczeniem obejmującym statyny, leki beta-adrenolityczne, leki moczopędne i kwas acetylosalicylowy. Główne wyniki dotyczące skuteczności przedstawiono
w Tabeli 1. Wyniki wskazują, że stosowanie amlodypiny związane było z rzadszymi hospitalizacjami
z powodu dławicy piersiowej i rzadszym wykonywaniem zabiegów rewaskularyzacji u pacjentów
z chorobą niedokrwienną serca.
Tabela 1. Częstość występowania istotnych efektów klinicznych w badaniu CAMELOT | |||||
Wskaźnik występowania zdarzeń sercowo-naczyniowych, liczba przypadków (%) | Porównanie amlodypiny i placebo | ||||
Efekt | Amlodypina | Placebo | Enalapryl | Wskaźnik ryzyka (95% przedział ufności) | Wartość P |
Pierwszorzędowy punkt końcowy Niepożądane zdarzenia sercowo-naczyniowe | 110 (16,6) | 151 (23,1) | 136 (20,2) | 0,69 (0,54-0,88) | ,003 |
Poszczególne elementy | |||||
Rewaskularyzacja wieńcowa | 78 (11,8) | 103 (15,7) | 95 (14,1) | 0,73 (0,54-0,98) | ,03 |
Hospitalizacja z powodu | 51 (7,7) | 84 (12,8) | 86 (12,8) | 0,58 (0,41-0,82) | ,002 |
dławicy | |||||
Zawał mięśnia sercowego niezakończony zgonem | 14 (2,1) | 19 (2,9) | 11 (1,6) | 0,73 (0,37-1,46) | ,37 |
Udar mózgu lub TIA | 6 (0,9) | 12 (1,8) | 8 (1,2) | 0,50 (0,19-1,32) | ,15 |
Zgon z powodów sercowo- | |||||
naczyniowych | 5 (0,8) | 2 (0,3) | 5 (0,7) | 2,46 (0,48-12,7) | ,27 |
Hospitalizacja z powodu zastoinowej niewydolności | 3 (0,5) | 5 (0,8) | 4 (0,6) | 0,59 (0,14-2,47) | ,46 |
serca | |||||
Zatrzymanie krążenia ze | 0 | 4 (0,6) | 1 (0,1) | ND | ,04 |
skuteczną resuscytacją | |||||
Świeżo rozpoznana choroba naczyń obwodowych | 5 (0,8) | 2 (0,3) | 8 (1,2) | 2,6 (0,50-13,4) | ,24 |
Skróty: TIA – przemijający napad niedokrwienny.
Niewydolność serca
Badania hemodynamiczne oraz próby wysiłkowe przeprowadzone w kontrolowanych badaniach klinicznych u chorych z niewydolnością serca klasy II-IV wg NYHA wykazały, że amlodypina nie prowadziła do pogorszenia stanu klinicznego chorych określonego poprzez zdolność do wykonywania wysiłku fizycznego, pomiar frakcji wyrzutowej lewej komory oraz nasilenie objawów klinicznych.
W badaniu kontrolowanym przeprowadzonym z użyciem placebo (PRAISE), u chorych
z niewydolnością serca klasy III-IV wg NYHA leczonych digoksyną, lekami moczopędnymi
i inhibitorami konwertazy angiotensyny wykazano, że zastosowanie amlodypiny nie zwiększało umieralności ani łącznie chorobowości i umieralności pacjentów z niewydolnością serca.
W dalszej obserwacji w długookresowym badaniu klinicznym kontrolowanym placebo (PRAISE-2), stosowanie amlodypiny u pacjentów z niewydolnością serca klasy III i IV wg NYHA bez klinicznych objawów lub cech sugerujących podłoże niedokrwienne choroby, leczonych ustalonymi dawkami inhibitorów konwertazy angiotensyny, glikozydów naparstnicy i leków moczopędnych, amlodypina nie miała wpływu na całkowitą śmiertelność z przyczyn sercowo-naczyniowych. W tej samej grupie pacjentów, przyjmowanie amlodypiny związane było ze zwiększoną ilością raportów dotyczących wystąpienia obrzęku płuc.
Leczenie zapobiegające występowaniu zawałów serca (ALLHAT)
Randomizowane badanie Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) przeprowadzone metodą podwójnie ślepej próby (badanie morbidity-mortality) w celu porównania nowych terapii: amlodypiną 2,5-10 mg/dobę (bloker kanału wapniowego) lub lizynoprylem 10-40 mg/dobę (inhibitor ACE) jako leczenie pierwszego rzutu z tiazydowym lekiem
moczopędnym – chlortalidonem w dawce 12,5-25 mg/dobę u pacjentów z łagodnym i umiarkowanym
nadciśnieniem tętniczym.
33 357 pacjentów z nadciśnieniem tętniczym w wieku 55 lat lub starszych zostało losowo przydzielonych do grup i poddanych średnio 4,9-letniej obserwacji. Pacjenci mieli przynajmniej jeden z czynników ryzyka choroby wieńcowej, w tym: zawał mięśnia serca lub udar w wywiadzie w okresie powyżej 6. miesięcy od włączenia do badania lub udokumentowaną miażdżycę naczyń (51,5%), cukrzycę typu II (36,1%), HDL-C<35 mg/dl (11,6%), przerost lewej komory mięśnia serca rozpoznaną w badaniu EKG lub ECHO (20,9%), palenie tytoniu (21,9%).
Pierwszorzędowym punktem końcowym były zakończone śmiercią przypadki choroby wieńcowej lub zawały mięśnia serca niezakończone zgonem. Nie zaobserwowano istotnej różnicy w odniesieniu do pierwszorzędowego punktu końcowego w grupie chorych otrzymujących amlodypinę i chlortalidon: RR 0,98 (95% CI (0,90-1,70) p=0,65). Wśród drugorzędowych punktów końcowych, częstość niewydolności serca (składowa złożonego punktu końcowego sercowo-naczyniowego) była istotnie większa w grupie otrzymującej amlodypinę w porównaniu z grupą otrzymującą chlortalidon (10,2% vs 7,7%, RR 1,38 (95% CI [1,25-1,52] p<0,001). Niemniej jednak nie stwierdzono istotnej różnicy
w śmiertelności ze wszystkich przyczyn u pacjentów otrzymujących amlodypinę i chlortalidon, RR 0,96 (95% CI [0,89-1,02] p=0,20).
Współczynnik i zakres absorpcji peryndoprylu i amlodypiny z produktu Co-Prestarium nie różni się w sposób istotny, odpowiednio od współczynnika i zakresu absorpcji peryndoprylu i amlodypiny
z oddzielnych postaci farmaceutycznych.
Peryndopryl
Wchłanianie
Peryndopryl po podaniu doustnym wchłania się szybko z przewodu pokarmowego, a maksymalne
stężenie osiąga w ciągu 1 godziny. Okres półtrwania peryndoprylu wynosi 1 godzinę.
Peryndopryl jest prekursorem leku. 27% podanego peryndoprylu dociera do krwiobiegu w postaci czynnego metabolitu peryndoprylatu. Oprócz czynnego peryndoprylatu występuje 5 metabolitów, wszystkie są nieczynne. Maksymalne stężenie peryndoprylatu w osoczu jest osiągane w ciągu
3-4 godzin.
Spożycie pokarmu zmniejsza przekształcanie w peryndoprylat, a w związku z tym biodostępność; peryndopryl z argininą należy przyjmować doustnie, w pojedynczej dawce dobowej, rano, przed posiłkiem.
Wykazano liniową zależność pomiędzy dawką peryndoprylu a jego stężeniem w osoczu. Dystrybucja
Objętość dystrybucji niezwiązanego peryndoprylatu wynosi około 0,2 l/kg.
Stopień związania z białkami osocza wynosi 20%, głównie z enzymem konwertującym angiotensynę, lecz jest zależny od stężenia.
Eliminacja
Peryndoprylat jest wydalany w moczu, a końcowy okres półtrwania jego niezwiązanej frakcji wynosi około 17 godzin, co prowadzi do stanu stacjonarnego w ciągu 4 dni.
Pacjenci w podeszłym wieku, niewydolność serca, niewydolność nerek
Wydalanie peryndoprylatu jest wolniejsze u pacjentów w podeszłym wieku, a także u pacjentów z niewydolnością serca czy nerek (patrz punkt 4.2). W takich przypadkach konieczne jest ścisła obserwacja pacjenta z częstym oznaczaniem stężenia kreatyniny i potasu.
Zaburzenia czynności wątroby
Klirens peryndoprylatu podczas dializy wynosi 70 ml/min.
Właściwości farmakokinetyczne peryndoprylu są zmienione u pacjentów z marskością wątroby – klirens wątrobowy macierzystej cząsteczki jest zmniejszony o połowę. Jednak ilość powstającego peryndoprylatu nie zmniejsza się, a tym samym modyfikacja dawkowania nie jest konieczna (patrz punkty 4.2 i 4.4).
Amlodypina
Wchłanianie, dystrybucja, wiązanie z białkami osocza
Po podaniu doustnym dawek terapeutycznych, amlodypina jest dobrze wchłaniana i maksymalne stężenie we krwi obserwuje się po 6-12 godzinach po zastosowaniu dawki. Całkowita biodostępność wynosi od 64% do 80%. Objętość dystrybucji wynosi około 21 l/kg. W badaniach in vitro wykazano, że prawie 97,5% krążącej amlodypiny jest związane z białkami osocza.
Biodostępność amlodypiny nie ulega zmianie pod wpływem pokarmu.
Metabolizm/Eliminacja
Okres półtrwania w końcowej fazie eliminacji z osocza wynosi około 35-50 godzin i jest stały przy dawkowaniu raz na dobę. Amlodypina jest w znacznym stopniu metabolizowana w wątrobie do nieaktywnych metabolitów, 10% macierzystego leku i 60% metabolitów jest wydalane w moczu.
Pacjenci w podeszłym wieku
Czas do osiągnięcia stężenia maksymalnego w osoczu jest podobny u osób w podeszłym wieku, jak i u osób młodszych. Klirens amlodypiny wykazuje tendencję do zmniejszania się, co powoduje zwiększenie wartości AUC i okresu półtrwania w fazie eliminacji u osób w podeszłym wieku.
U pacjentów z zastoinową niewydolnością serca pole pod krzywą stężenia leku w czasie i okres półtrwania w fazie eliminacji zwiększają się odpowiednio do wieku.
Zaburzenia czynności wątroby
Dostępne są bardzo ograniczone dane kliniczne dotyczące stosowania amlodypiny u pacjentów
z zaburzeniami czynności wątroby. Pacjenci z niewydolnością wątroby mają zmniejszony klirens amlodypiny, czego wynikiem jest dłuższy okres półtrwania oraz zwiększenie wartości AUC o około 40-60%.
Peryndopryl
W badaniach toksyczności przewlekłej po podaniu doustnym (szczury i małpy), narządem narażonym były nerki, których uszkodzenia były odwracalne.
W badaniach in vitro i in vivo nie zaobserwowano działania mutagennego.
Badania toksycznego wpływu na rozrodczość (szczury, myszy, króliki i małpy) nie wykazały działania embriotoksycznego i teratogennego. Jednak wykazano, że inhibitory ACE jako grupa, powodują działania niepożądane poprzez opóźnianie rozwoju płodu, prowadzące do śmierci płodu i wad wrodzonych u gryzoni i królików, uszkodzenia nerek i zwiększenia śmiertelności około-
i poporodowej. Płodność nie została zaburzona ani u samców, ani u samic szczurów.
Podczas długookresowych badań przeprowadzonych na szczurach i myszach nie obserwowano działania rakotwórczego.
Amlodypina
Toksyczny wpływ na rozród
Badania wpływu na rozród przeprowadzone u szczurów i myszy wykazały opóźnienie daty porodu, wydłużenie czasu trwania porodu i zmniejszoną przeżywalność potomstwa po zastosowaniu amlodypiny w dawkach około 50-krotnie większych od maksymalnej zalecanej dawki dla ludzi,
w przeliczeniu na mg/kg mc.
Zaburzenie płodności
Nie stwierdzono wpływu amlodypiny podawanej w dawkach do 10 mg/kg mc./dobę (w przeliczeniu na mg/m2 powierzchni ciała, ośmiokrotnie* większej od maksymalnej zalecanej dawki dla ludzi, wynoszącej 10 mg) na płodność u szczurów (u samców przez 64 dni i u samic przez 14 dni przed parzeniem). W innym badaniu z udziałem szczurów, w którym samcom szczurów podawano bezylan amlodypiny w dawce porównywalnej do dawki stosowanej u ludzi, w przeliczeniu na mg/kg mc., przez 30 dni, stwierdzono zarówno zmniejszenie stężenia hormonu folikulotropowego i testosteronu w osoczu, jak również zmniejszenie gęstości nasienia i liczby dojrzałych spermatyd oraz komórek Sertoliego.
Rakotwórczość, mutagenność
U szczurów i myszy otrzymujących amlodypinę w karmie przez dwa lata, w ilości tak dobranej, aby zapewnić dawkę dobową 0,5, 1,25 i 2,5 mg/kg mc./dobę, nie stwierdzono cech działania rakotwórczego. Największa dawka (która w przypadku myszy była zbliżona, a u szczurów dwukrotnie większa od maksymalnej, klinicznej, zalecanej dawki dla ludzi, wynoszącej 10 mg, w przeliczeniu na mg/m2 powierzchni ciała*) była zbliżona do maksymalnej tolerowanej dawki dla myszy, ale nie dla szczurów.
W badaniach mutagenności nie stwierdzono działań związanych z podawanym lekiem na poziomie genów ani chromosomów.
*Na podstawie masy ciała pacjenta wynoszącej 50 kg.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
Laktoza jednowodna Celuloza mikrokrystaliczna
Krzemionka koloidalna bezwodna
Magnezu stearynian
Nie dotyczy.
3 lata.
Przechowywać pojemnik szczelnie zamknięty w celu ochrony przed wilgocią. Przechowywać
w oryginalnym opakowaniu. Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego.
5, 7, 10, 14, 20, 28, 30 lub 50 tabletek w pojemniku PP, z zakrętką LDPE ze środkiem pochłaniającym wilgoć, w tekturowym pudełku.
Pudełko zawierające 1 pojemnik po 5, 7, 10, 14, 20, 28, 30 lub 50 tabletek.
Pudełko zawierające 2 pojemniki po 28, 30 lub 50 tabletek.
Pudełko zawierające 3 pojemniki po 28 tabletek. Pudełko zawierające 3 pojemniki po 30 tabletek. Pudełko zawierające 4 pojemniki po 30 tabletek. Pudełko zawierające 10 pojemników po 50 tabletek.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE
NA DOPUSZCZENIE DO OBROTU
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex Francja
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
Co-Prestarium, 5 mg + 5 mg: Pozwolenie nr 14896
Co-Prestarium, 5 mg + 10 mg: Pozwolenie nr 14899
Co-Prestarium, 10 mg + 5 mg: Pozwolenie nr 14897
Co-Prestarium, 10 mg + 10 mg: Pozwolenie nr 14898
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 5 listopada 2008 r.
Data ostatniego przedłużenia pozwolenia: 27 sierpnia 2018 r.
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
05/07/2022











