Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLNIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
- DOZYMETRIA
- INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
U osób z nadwrażliwością na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1,
U kobiet w potwierdzonej lub podejrzewanej ciąży (lub gdy ciąża nie została wykluczona),
U kobiet karmiących piersią,
Produktu leczniczy Jodek sodu Na131I POLATOM, kapsułki do diagnostyki, nie należy stosować:
W diagnostyce u dzieci poniżej 10 roku życia,
W badaniu scyntygraficznym tarczycy, z wyjątkiem przypadków raka tarczycy lub jeśli jod - 123 lub technet – 99m nie są dostępne.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLNIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
DOZYMETRIA
INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
Jodek sodu Na131I POLATOM, kapsułki do diagnostyki. Kapsułki twarde, 1-37 MBq.
Jedna kapsułka twarda zawiera sodu jodek [131I] (Natrii iodidi (131I)) o aktywności od 1 MBq do 37 MBq.
Promieniotwórczy izotop jodu [131I] jest otrzymywany z tlenku telluru napromieniowanego neutronami w reaktorze jądrowym lub z produktów rozszczepienia uranu. Okres półtrwania jodu-131 wynosi 8,02 dnia. Izotop ten rozpada się do stabilnego ksenonu-131 emitując promieniowanie gamma o energii 365 keV (81,7%), 637 keV (7,2%) i 284 keV (6,1%) oraz promieniowanie beta o maksymalnej energii 606 keV.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Kapsułki twarde
Produkt leczniczy przeznaczony wyłącznie do diagnostyki.
Produkt leczniczy stosowany jest w diagnostyce zaburzeń czynności tarczycy (nadczynność i niedoczynność), do oceny położenia tkanki tarczycy (w tym ektopii), jej wielkości i kształtu, czynnościowej charakterystyki zmian ogniskowych: guzków „zimnych” (nie gromadzących jodu),
„ciepłych” (gromadzących jod w podobnym stopniu jak prawidłowy miąższ tarczycy), „gorących” (gromadzących jod w wyższym stopniu niż prawidłowy miąższ tarczycy).
Jodek [131I] sodu może być stosowany w celu badania kinetyki radiojodu w tarczycy. Ocena wychwytu tarczycowego jodu i efektywnego okresu półtrwania jodu w tarczycy służyć może do obliczeń dozymetrycznych dawki terapeutycznej radiojodu.
Jodek [131I] sodu stosowany jest u pacjentów leczonych z powodu raka zróżnicowanego tarczycy w celu identyfikacji pozostałości tarczycy oraz w diagnostyce przerzutów raka.
Jodek sodu Na131I POLATOM, kapsułki do diagnostyki, to produkt leczniczy do podawania doustnego.
W diagnostyce scyntygraficznej tarczycy i w celu badania kinetyki radiojodu w tarczycy zaleca się podanie 0,15 - 4 MBq jodku [131I] sodu na 24 godziny przed badaniem. Badanie jodochwytności tarczycy wykonuje się również, w zależności od wskazań, po 4-6 h oraz w okresie kilku pierwszych dób od podania jodku [131I] sodu.
W diagnostyce u pacjentów leczonych z powodu raka zróżnicowanego tarczycy zaleca się podanie 37 – 240 MBq (zwykle 37 – 74 MBq) jodku [131I] sodu. Scyntygrafię całego ciała wykonuje się zwykle po upływie 72 h (lub więcej) od podania jodku [131I] sodu.
W świetle Dyrektywy Europejskiej 97/43/Euratom i aktualnej praktyki w Europie, powyższe aktywności należy traktować jedynie jako ogólną wskazówkę. Należy zwrócić uwagę, że w każdym kraju lekarz specjalista w dziedzinie medycyny nuklearnej powinien uwzględniać diagnostyczne poziomy referencyjne (diagnostic reference level - DRL) oraz zasady określone przez lokalne przepisy. Podanie aktywności większej niż lokalne DRLs powinno być uzasadnione.
Aktywność radiofarmaceutyku podawanego pacjentom powinna być zawsze rozpatrywana w relacji do jego wartości diagnostycznych.
Dzieci i młodzież
Podanie produktu leczniczego u dzieci należy starannie rozważyć, biorąc pod uwagę wskazania kliniczne i ocenę stosunku korzyści do ryzyka w tej grupie pacjentów. Należy pamiętać, że odległe potencjalne działania niepożądane związane z podaniem jodu (131I) u dzieci (zwłaszcza poniżej 10 roku życia) i młodzieży są bardziej prawdopodobne niż u dorosłych.
Aktywność diagnostyczna dla dzieci powinna być częścią dawki dla dorosłych i można ją obliczyć modyfikując aktywność dla dorosłego biorąc pod uwagę masę lub powierzchnię ciała dziecka w oparciu o poniższe wzory.
Aktywność dla dziecka (MBq) = aktywność dla dorosłego (MBq) x masa ciała dziecka (kg)
70 kg
Aktywność dla dziecka (MBq) = aktywność dla dorosłego (MBq) x powierzchnia ciała dziecka (m2)
1.73 m2
Poniżej podano współczynniki do korekty aktywności diagnostycznej u dzieci wg zaleceń Grupy Pediatrycznej Europejskiego Towarzystwa Medycyny Nuklearnej (Paediatric Task Group of EANM)
Część dawki dla dorosłego | ||||||||
3 kg | = | 0.1 | 22 kg | = | 0.50 | 42 kg | = | 0.78 |
4 kg | = | 0.14 | 24 kg | = | 0.53 | 44 kg | = | 0.80 |
6 kg | = | 0.19 | 26 kg | = | 0.56 | 46 kg | = | 0.82 |
8 kg | = | 0.23 | 28 kg | = | 0.58 | 48 kg | = | 0.85 |
10 kg | = | 0.27 | 30 kg | = | 0.62 | 50 kg | = | 0.88 |
12 kg | = | 0.32 | 32 kg | = | 0.65 | 52-54 kg | = | 0.90 |
14 kg | = | 0.36 | 34 kg | = | 0.68 | 56-58 kg | = | 0.92 |
16 kg | = | 0.40 | 36 kg | = | 0.71 | 60-62 kg | = | 0.96 |
18 kg | = | 0.44 | 38 kg | = | 0.73 | 64-66 kg | = | 0.98 |
20 kg | = | 0.46 | 40 kg | = | 0.76 | 68 kg | = | 0.99 |
Produktu leczniczy Jodek sodu Na131I POLATOM, kapsułki do diagnostyki, nie wolno stosować:
Uzasadnienie indywidualnych korzyści/ryzyka
W przypadku każdego pacjenta, ekspozycja na promieniowanie jonizujące musi być uzasadniona spodziewaną korzyścią wynikającą z zastosowania radiofarmaceutyku. Podana aktywność powinna być w każdym przypadku tak mała, jak tylko to możliwe, przy uzyskaniu oczekiwanej informacji diagnostycznej.
Ryzyko wystąpienia reakcji nadwrażliwości (w tym anafilaktycznych i anafilaktoidalnych) jest po podaniu jodku [131I] sodu bardzo małe. Należy jednak mieć je na uwadze i posiadać możliwość szybkiej interwencji w takich przypadkach.
Po podaniu jodku [131I] sodu należy przedsięwziąć niezbędne środki ostrożności w celu uniknięcia skażeń promieniotwórczych otoczenia.
Brak doniesień o zwiększonej częstości występowania nowotworów, białaczki lub mutacji u osób, które otrzymały diagnostyczne aktywności jodku [131I] sodu.
Należy zachować szczególne środki ostrożności u pacjentów z zaburzeniami połykania bądź chorobami górnego odcinka przewodu pokarmowego, szczególnie zwężeniem przełyku. Pacjent powinien połknąć kapsułkę w całości popijając ją, tak by zapewnić jej pasaż do żołądka i jelita cienkiego. Należy rozważyć równoczesne podanie produktu leczniczego z grupy antagonistów receptora H2 lub inhibitorów pompy protonowej.
Niewydolność nerek
Należy zwrócić szczególną uwagę na właściwe ustalenie wskazań u chorych z niewydolnością nerek ze względu na zwiększone napromieniowanie tych chorych związane z ograniczoną zdolnością wydalania jodu-131.
Ciąża
Ciąża, patrz punkt 4.6.
Dzieci i młodzież
Stosowanie u dzieci, patrz punkt 4.2
Przygotowanie pacjenta
Przed rozpoczęciem badania należy zalecić pacjentowi przyjmowanie większych ilości płynów, a w pierwszych godzinach po podaniu kapsułki, częstsze opróżnianie pęcherza moczowego w celu zmniejszenia napromieniowania.
Ze względu na zwolnione wchłanianie jodku [131I] sodu w obecności pokarmu w żołądku, w przypadku niektórych badań (szczególnie wczesnych pomiarów jodochwytności tarczycy) celowe może być pozostawienie pacjenta na czczo na około 2 godziny przed i około 2 godziny po doustnym podaniu radiofarmaceutyku.
W niektórych przypadkach (szczególnie u pacjentów z planowanym leczeniem jodem – 131 z powodu raka tarczycy) wskazana może być dieta z niską zawartością jodu.
Po podaniu produktu leczniczego
Ze względu na retencję 131I w organizmie po jego podaniu, wskazane może być czasowe ograniczenie bliskich kontaktów z małymi dziećmi i kobietami w ciąży, przez czas określony w odpowiednich przepisach.
Specjalne ostrzeżenia
Produkt leczniczy zawiera 80-96 mg sodu w jednej kapsułce. Należy wziąć to pod uwagę w przypadku pacjentów będących na diecie niskosodowej.
U pacjentów z nadwrażliwością na żelatynę i jej metabolity zalecane jest stosowanie jodku [131I] sodu w roztworze.
Wiele substancji wchodzi w różnego rodzaju interakcje z jodkami. Wpływają one na mechanizmy wiązania jodków z białkami lub ich farmakokinetykę. Oznacza to konieczność zapoznania się ze wszystkimi przyjmowanymi przez chorego produktami leczniczymi i podjęcia decyzji o ewentualnym wstrzymaniu wybranej farmakoterapii przed podaniem jodku [131I] sodu.
W tabeli poniżej podano czas, na jaki należy wstrzymać podawanie niektórych substancji:
Substancja czynna | Okres na jaki należy wstrzymać podawanie wymienionej substancji, przed podaniem jodku [131I] sodu |
Produkty lecznicze blokujące czynność tarczycy np. karbimazol, metimazol, propylouracyl, nadchlorany | 2-5 dni przed rozpoczęciem badania |
Salicylany (duże dawki), glikokortykosteroidy, nitroprusydek sodu, nitraty, sulfobromoftaleina, doustne produkty lecznicze przeciwzakrzepowe, produkty lecznicze przeciwhistaminowe, przeciwpasożytnicze, penicyliny, sulfonamidy, tolbutamid, tiocyjanki, tiopental | 1 tydzień |
Fenylobutazon | 1-2 tygodnie |
Produkty lecznicze wykrztuśne i witaminy zawierające jod | 4 tygodnie |
Liotyronina | 2 tygodnie |
Lewotyroksyna | 4 tygodnie |
Amiodaron | 3 - 6 miesięcy |
Produkty do stosowania miejscowego zawierające związki jodu | 1- 9 miesięcy |
Rozpuszczalne w wodzie środki kontrastowe | 1 – 2 miesiące |
Nierozpuszczalne w wodzie środki kontrastowe | 3 - 6 miesięcy |
Kobiety w wieku rozrodczym
Jeżeli zachodzi konieczność podania produktu leczniczego kobiecie w wieku rozrodczym, konieczne jest ustalenie, czy nie jest ona w ciąży. Jeśli u kobiety nie wystąpiła miesiączka w przewidywanym terminie, należy uznać, że jest ona w ciąży do chwili, gdy ciąża zostanie wykluczona. W razie wątpliwości dotyczących możliwej ciąży (jeśli u kobiety nie wystąpiła miesiączka, jeśli miesiączki są bardzo nieregularne, itp.), należy zaproponować pacjentce alternatywne metody diagnostyczne, bez użycia promieniowania jonizującego (jeśli takie istnieją).
Ciąża
Podanie jodku [131I] sodu jest przeciwwskazane w przypadku potwierdzonej lub podejrzewanej ciąży lub
gdy nie można jej wykluczyć (dawka pochłonięta promieniowania jonizującego, absorbowana przez macicę, wynosi 0,01-22 mGy, a gruczoł tarczowy płodu w drugim i trzecim trymestrze ciąży, intensywnie gromadzi jod).
Karmienie piersią
Przed podaniem radiofarmaceutyku kobiecie karmiącej piersią należy rozważyć możliwość odroczenia podania izotopu promieniotwórczego do chwili zakończenia przez matkę karmienia piersią i wybrać najkorzystniejszy sposób postępowania. W przypadku konieczności zastosowania jodku [131I] sodu u kobiety karmiącej, należy zakończyć karmienie piersią.
Brak danych.
Narażenie na promieniowanie jonizujące w przypadku każdego pacjenta musi być uzasadnione korzyścią wynikającą z przeprowadzonego badania. Podana radioaktywność powinna być taka, aby dawka promieniowania otrzymana przez pacjenta była możliwie niska, przy uzyskaniu pożądanego efektu diagnostycznego.
Częstość występowania działań niepożądanych po podaniu produktu leczniczego przedstawiono w tabeli poniżej.
Zaburzenia układu immunologicznego: reakcje nadwrażliwości | Nieznana częstość (częstość nie może być określona na podstawie dostępnych danych) |
Zaburzenia żołądka i jelit: nudności, wymioty | Nieznana częstość (częstość nie może być określona na podstawie dostępnych danych) |
Wady wrodzone, choroby rodzinne i genetyczne: wrodzone zaburzenia czynności tarczycy | Nieznana częstość (częstość nie może być określona na podstawie dostępnych danych |
Narażenie na promieniowanie jonizujące jest związane z ryzykiem wywołania chorób nowotworowych i wad wrodzonych. Obecne dowody wskazują na małe prawdopodobieństwo wystąpienia tego rodzaju działań niepożądanych w przypadku badań diagnostycznych w medycynie nuklearnej.
W większości badań diagnostycznych w medycynie nuklearnej dostarczona dawka promieniowania (dawka skuteczna) jest mniejsza niż 20 mSv. W przypadku jodku [131I] sodu o aktywności 1-37 MBq ten poziom jest zwykle nieco większy.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem:
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181 C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Produkt leczniczy dostarczany jest w kapsułkach o znanej aktywności, co ułatwia lekarzowi
kontrolowanie dawki, jaka ma być podana pacjentowi. Lokalne przepisy mogą zobowiązywać personel wykonujący badania z użyciem radiofarmaceutyków do pomiaru aktywności każdorazowo przed ich podaniem, co dodatkowo ogranicza ryzyko przedawkowania jodku [131I] sodu.
W przypadku podania pacjentowi większej aktywności niż wskazana, należy dążyć do redukcji dawki promieniowania pochłoniętej przez pacjenta poprzez przyśpieszenie eliminacji radionuklidu z moczem (zwiększenie diurezy, częstsze oddawanie moczu). Można również próbować zmniejszyć wchłanianie jodku [131I] sodu podając środki wywołujące wymioty lub zmniejszyć gromadzenie jodu przez tarczycę podając produkty lecznicze blokujące tarczycę np. nadchloran potasu lub produkty zawierające stabilny jod (jod – 127).
Grupa farmakoterapeutyczna: różne radiofarmaceutyki stosowane w diagnostyce tarczycy, jodek [131I] sodu.
kod ATC: V09F X03
Jodek [131I] sodu, w dawkach stosowanych ze wskazań diagnostycznych, nie wykazuje jakiegokolwiek efektu farmakologicznego.
Po podaniu doustnym jodku [131I] sodu, jodki są szybko wchłaniane w górnym odcinku przewodu pokarmowego (90% w ciągu 60 minut). Farmakokinetyka jodu promieniotwórczego jest podobna jak jodu stabilnego. Po przeniknięciu do krwi jodki podlegają dystrybucji w przedziale pozatarczycowym, skąd są wychwytywane głównie przez tarczycę lub wydalane poprzez nerki. Niewielkie ilości jodku [131I] sodu są wychwytywane przez ślinianki, śluzówkę żołądka, sploty naczyniowe mózgu, są też gromadzone w łożysku i wydzielane do mleka kobiet karmiących. Efektywny okres półtrwania jodu promieniotwórczego w osoczu wynosi około 12 h, podczas kiedy dla jodu zgromadzonego w tarczycy wynosi on około 6 dni. Tak więc, po podaniu jodku [131I] sodu, efektywny okres półtrwania około 40% aktywności wynosi 0,4 dnia, a pozostałych 60%, 8 dni. Z moczem wydalane jest około 37 – 75% aktywności, ze stolcem około 10%, niewielkie ilości wydalane są również z potem.
Szybkosc wzgledna przenikania jodu-131 do krwi z kapsulki zelatynowej
110
100
j
e 90
a 80
ln
mys 70
k
a 60
cim 50
s
r
to 40
a 30
w
% 20
10
0
0
15
30
45
60
75
90
105
czas od podania kapsulki, min.

Jon 131I- jest kumulowany w tarczycy dzięki aktywnemu transportowi przez błony komórkowe gruczołu. W gruczole tarczycy jodek jest utleniany do jodu i następnie wbudowywany do reszt tyrozylowych tyreoglobuliny. W normalnych warunkach około 2% krążącego jodu radioaktywnego jest wychwytywane przez tarczycę w ciągu każdej godziny.
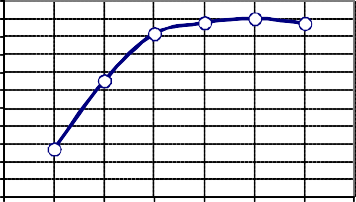
Ponieważ ilość jodu w preparacie jest niewielka w porównaniu z ilościami zwykle przyjmowanymi w pokarmie (40-500 µg/dobę), nie istnieje możliwość zatrucia.
Brak danych dotyczących zarówno toksyczności po wielokrotnym podaniu jodku sodu, jego wpływu na reprodukcję u zwierząt, jak i jego właściwości mutagennych i rakotwórczych.
Sodu węglan
Sodu wodorowęglan
Disodu wodorofosforan dwuwodny Sodu tiosiarczan pięciowodny Kapsułka żelatynowa twarda
Nie dotyczy
21 dni od daty produkcji
Przechowywać w temperaturze poniżej 25oC.
Przechowywać w oryginalnym ołowianym pojemniku osłonowym.
Przechowywanie radiofarmaceutyków powinno odbywać się w sposób zgodny z lokalnymi przepisami dotyczącymi substancji promieniotwórczych.
Kapsułki żelatynowe dla celów diagnostycznych dostarczane są w następujących opakowaniach bezpośrednich:
Pierwszy rodzaj opakowania:
Fiolka polipropylenowa zamknięta polietylenowym korkiem i umieszczona w ołowianym pojemniku osłonowym. W jednej fiolce można umieścić do 10 kapsułek o tej samej aktywności. Do każdego opakowania dołączane jest świadectwo radiofarmaceutyku.
Drugi rodzaj opakowania:
Fiolka polipropylenowa zamknięta polipropylenowym korkiem wyposażonym w absorbent jodu i umieszczona w ołowianym pojemniku osłonowym. Opakowanie zawiera jedną kapsułkę. Do każdego opakowania dołączany jest polipropylenowy aplikator do podawania kapsułki oraz świadectwo radiofarmaceutyku.
Produkty radiofarmaceutyczne mogą być odbierane, stosowane i podawane wyłącznie przez osoby do tego upoważnione, w odpowiednich warunkach klinicznych, a ich odbiór, przechowywanie, stosowanie, przekazywanie i usuwanie podlegają regulacjom przepisów prawnych i (lub) odpowiednim licencjom wydanym przez właściwe lokalne instytucje.
Radiofarmaceutyki powinny być przygotowane przez użytkownika w sposób zapewniający odpowiednie warunki bezpieczeństwa radiologicznego i jakości farmaceutycznej.
Podawanie radioaktywnych produktów leczniczych stwarza w stosunku do innych osób ryzyko ekspozycji na zewnętrzne promieniowanie jonizujące lub skażenie spowodowane plamami moczu,
wymiocin, potu, itp. W kontakcie z promieniowaniem jonizującym należy przedsięwziąć wszelkie środki ostrożności zgodne z obowiązującymi przepisami.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Narodowe Centrum Badań Jądrowych ul. Andrzeja Sołtana 7
05-400 Otwock
Tel: 22 7180700
Fax: 22 7180350
19004
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 27.07.1984 Data ostatniego przedłużenia pozwolenia: 29.07.2013
Jod [131I] rozpada się z okresem połowicznego rozpadu 8,02 dni, emitując promieniowanie beta o maksymalnej energii 606 keV i promieniowanie gamma z najbardziej znaczącym fotonem gamma o energii 365 keV.
Dawka promieniowania pochłaniana przez pacjenta zależy od jodochwytności tarczycy. Stosowany przez ICRP (International Commission on Radiological Protection) model służący do obliczania dawki pochłoniętej odnosi się do podania dożylnego. Ponieważ wchłanianie jodu w przewodzie pokarmowym jest szybkie i całkowite, model dożylny w tym wypadku jest odpowiedni
również do podania doustnego, chociaż należy wziąć pod uwagę dodatkową dawkę promieniowania pochłoniętą przez ścianę żołądka poza dawką wynikającą z wydzielania do soku żołądkowego i śliny. Zakładając średni czas pozostawania jodku [131I] sodu w żołądku wynoszący 0,5 h, po podaniu doustnym dawka pochłonięta przez ściany żołądka wzrasta o ok. 30% w odniesieniu do modelu dożylnego. Zmiany dawek pochłoniętych przez inne narządy i tkanki są bardzo niewielkie. W przypadku zablokowania tarczycy nie zachodzi swoisty wychwyt przez żadne narządy i tkanki. Przypuszcza się, że dystrybucja jest jednolita, a połowiczny okres wydalania wynosi 8 h.
Przy 55% wychwycie przez tarczycę izotopu jodu-131 na skutek krążenia organicznego jodu
i odzyskanych jodków dochodzi do wzrostu dawki dla narządów innych niż tarczyca, przewód pokarmowy i pęcherz moczowy.
Dawka promieniowania pochłonięta przez narządy niewychwytujące jodu jest w dużym stopniu uzależniona od zmian patofizjologicznych wywołanych przez chorobę tarczycy.
Dawki pochłonięte po podaniu jodu-131 wg Annals of the ICRP, Radiation dose to Patients from Radiofarmaceuticals. Vol.18 No.1-4, 1987, p.259-278.
Narząd | Dawka pochłonięta na jednostkę aktywności podaną pacjentowi [mGy/MBq] (z zablokowaną tarczycą, wychwyt 0%) | ||||
Dorośli | 15 lat | 10 lat | 5 lat | 1 rok | |
Nadnercza | 3.7E-02 | 4.2E-02 | 6.7E-02 | 1.1E-01 | 2.0E-01 |
Ściany pęcherza | 6.1E-01 | 7.5E-01 | 1.1E+00 | 1.8E+00 | 3.4E+00 |
Powierzchnia kości | 3.2E-02 | 3.8E-02 | 6.1E-02 | 9.7E-02 | 1.9E-01 |
Piersi | 3.3E-02 | 3.3E-02 | 5.2E-02 | 8.5E-02 | 1.7E-01 |
Przewód pokarmowy: | |||||
Ściany żołądka | 3.4E-02 | 4.0E-02 | 6.4E-02 | 1.0E-01 | 1.9E-01 |
Jelito cienkie | 3.8E-02 | 4.7E-02 | 7.5E-02 | 1.2E-01 | 2.2E-01 |
Jelito grube – odcinek górny | 3.7E-02 | 4.5E-02 | 7.0E-02 | 1.2E-01 | 2.1E-01 |
Jelito grube - odcinek dolny | 4.3E-02 | 5.2E-02 | 8.2E-02 | 1.3E-01 | 2.3E-01 |
Nerki | 6.5E-02 | 8.0E-02 | 1.2E-01 | 1.7E-01 | 3.1E-01 |
Watroba | 3.3E-02 | 4.0E-02 | 6.5E-02 | 1.0E-01 | 2.0E-01 |
Płuca | 3.1E-02 | 3.8E-02 | 6.0E-02 | 9.6E-02 | 1.9E-01 |
Jajniki | 4.2E-02 | 5.4E-02 | 8.4E-02 | 1.3E-01 | 2.4E-01 |
Trzustka | 3.5E-02 | 4.3E-02 | 6.9E-02 | 1.1E-01 | 2.1E-01 |
Szpik kostny | 3.5E-02 | 4.2E-02 | 6.5E-02 | 1.0E-01 | 1.9E-01 |
Śledziona | 3.4E-02 | 4.0E-02 | 6.5E-02 | 1.0E-01 | 2.0E-01 |
Jądra | 3.7E-02 | 4.5E-02 | 7.5E-02 | 1.2E-01 | 2.3E-01 |
Tarczyca | 2.9E-02 | 3.8E-02 | 6.3E-02 | 1.0E-01 | 2.0E-01 |
Macica | 5.4 E-02 | 6.7E-02 | 1.1E-01 | 1.7E-01 | 3.0E-01 |
Pozostałe narządy | 3.2E-02 | 3.9E-02 | 6.2E-02 | 1.0E-01 | 1.9E-01 |
Dawka skuteczna mSv/MBq | 7.2E-02 | 8.8E-02 | 1.4E-01 | 2.1E-01 | 4.0E-01 |
Narażenie ściany pęcherza moczowego stanowi do 50,8% dawki skutecznej. Blokada częściowa: Dawka skuteczna (mSv/MBq) z niewielkim wychwytem tarczycowym jodu | |||||
wychwyt: 0.5 % | 3.0 E-01 | 4.5 E-01 | 6.9 E-01 | 1.5 E+00 | 2.8 E+00 |
wychwyt 1.0 % | 5.2 E-01 | 8.1 E-01 | 1.2 E+00 | 2.7 E+00 | 5.3 E+00 |
wychwyt 2.0 % | 9.7 E-01 | 1.5 E+00 | 2.4 E+00 | 5.3 E+00 | 1.0 E+01 |
Narząd | Dawka pochłonięta na jednostkę aktywności podaną pacjentowi [mGy/MBq] Wychwyt 15% | ||||
Dorośli | 15 lat | 10 lat | 5 lat | 1 rok | |
Nadnercza | 3.6E-02 | 4.3E-02 | 7.1E-02 | 1.1E-01 | 2.2E-01 |
Ściany pęcherza | 5.2E-01 | 6.4E-01 | 9.8E-01 | 1.5E+00 | 2.9E+00 |
Powierzchnia kości | 4.7E-02 | 6.7E-02 | 9.4E-02 | 1.4E-01 | 2.4E-01 |
Piersi | 4.3E-02 | 4.3E-02 | 8.1E-02 | 1.3E-01 | 2.5E-01 |
Przewód pokarmowy: | |||||
Ściany żołądka | 4.6E-01 | 5.8E-01 | 8.4E-01 | 1.5E+00 | 2.9E+00 |
Jelito cienkie | 2.8E-01 | 3.5E-01 | 6.2E-01 | 1.0E+00 | 2.0E+00 |
Jelito grube – odcinek górny | 5.9E-02 | 6.5E-02 | 1.0E-01 | 1.6E-01 | 2.8E-01 |
Jelito grube - odcinek dolny | 4.2E-02 | 5.3E-02 | 8.2E-02 | 1.3E-01 | 2.3E-01 |
Nerki | 6.0E-02 | 7.5E-02 | 1.1E-01 | 1.7E-01 | 2.9E-01 |
Wątroba | 3.2E-02 | 4.1E-02 | 6.8E-02 | 1.1E-01 | 2.2E-01 |
Płuca | 5.3E-02 | 7.1E-02 | 1.2E-01 | 1.9E-01 | 3.3E-01 |
Jajniki | 4.3E-02 | 5.9E-02 | 9.2E-02 | 1.4E-01 | 2.6E-01 |
Trzustka | 5.2E-02 | 6.2E-02 | 1.0E-01 | 1.5E-01 | 2.7E-01 |
Szpik kostny | 5.4E-02 | 7.4E-02 | 9.9E-02 | 1.4E-01 | 2.4E-01 |
Śledziona | 4.2E-02 | 5.1E-02 | 8.1E-02 | 1.2E-01 | 2.3E-01 |
Jądra | 2.8E-02 | 3.5E-02 | 5.8E-02 | 9.4E-02 | 1.8E-01 |
Tarczyca | 2.1E+02 | 3.4E+02 | 5.1E+02 | 1.1E+03 | 2.0E+03 |
Macica | 5.4E-02 | 6.8E-02 | 1.1E-01 | 1.7E-01 | 3.1E-01 |
Pozostałe narządy | 6.5E-02 | 8.9E-02 | 1.4E-01 | 2.2E-01 | 4.0E-01 |
Dawka skuteczna mSv/MBq | 6.6E+00 | 1.0E+01 | 1.5E+01 | 3.4E+01 | 6.2E+01 |
Narząd | Dawka pochłonięta na jednostkę aktywności podaną pacjentowi (mGy/MBq) Wychwyt 35% | ||||
Dorośli | 15 lat | 10 lat | 5 lat | 1 rok | |
Nadnercza | 4.2E-02 | 5.0E-02 | 8.7E-02 | 1.4E-01 | 2.8E-01 |
Ściany pęcherza | 4.0E-01 | 5.0E-01 | 7.6E-01 | 1.2E+00 | 2.3E+00 |
Powierzchnia kości | 7.6E-02 | 1.2E-01 | 1.6E-01 | 2.3E-01 | 3.5E-01 |
Piersi | 6.7E-02 | 6.6E-02 | 1.3E-01 | 2.2E-01 | 4.0E-01 |
Przewód pokarmowy: | |||||
Ściany żołądka | 4.6E-01 | 5.9E-01 | 8.5E-01 | 1.5E+00 | 3.0E+00 |
Jelito cienkie | 2.8E-01 | 3.5E-01 | 6.2E-01 | 1.0E+00 | 2.0E+00 |
Jelito grube – odcinek górny | 5.8E-02 | 6.5E-02 | 1.0E-01 | 1.7E-01 | 3.0E-01 |
Jelito grube - odcinek dolny | 4.0E-02 | 5.1E-02 | 8.0E-02 | 1.3E-01 | 2.4E-01 |
Nerki | 5.6E-02 | 7.2E-02 | 1.1E-01 | 1.7E-01 | 2.9E-01 |
Wątroba | 3.7E-02 | 4.9E-02 | 8.2E-02 | 1.4E-01 | 2.7E-01 |
Płuca | 9.0E-02 | 1.2E-01 | 2.1E-01 | 3.3E-01 | 5.6E-01 |
Jajniki | 4.2E-02 | 5.7E-02 | 9.0E-02 | 1.4E-01 | 2.7E-01 |
Trzustka | 5.4E-02 | 6.9E-02 | 1.1E-01 | 1.8E-01 | 3.2E-01 |
Szpik kostny | 8.6E-02 | 1.2E-01 | 1.6E-01 | 2.2E-01 | 3.5E-01 |
Śledziona | 4.6E-02 | 5.9E-02 | 9.6E-02 | 1.5E-01 | 2.8E-01 |
Jądra | 2.6E-02 | 3.2E-02 | 5.4E-02 | 8.9E-02 | 1.8E-01 |
Tarczyca | 5.0E+02 | 7.9E+02 | 1.2E+03 | 2.6E+03 | 4.7E+03 |
Macica | 5.0E-02 | 6.3E-02 | 1.0E-01 | 1.6E-01 | 3.0E-01 |
Pozostałe narządy | 1.1E-01 | 1.6E-01 | 2.6E-01 | 4.1E-01 | 7.1E-01 |
Dawka skuteczna mSv/MBq | 1.5E+01 | 2.4E+01 | 3.6E+01 | 7.8E+01 | 1.4E+02 |
Narząd | Dawka pochłonięta na jednostkę aktywności podaną pacjentowi (mGy/MBq) Wychwyt 55% | ||||
Dorośli | 15 lat | 10 lat | 5 lat | 1 rok | |
Nadnercza | 4.9E-02 | 5.8E-02 | 1.1E-01 | 1.7E-01 | 3.4E-01 |
Ściany pęcherza | 2.9E-01 | 3.6E-01 | 5.4E-01 | 8.5E-01 | 1.6E-00 |
Powierzchnia kości | 1.1E-01 | 1.7E-01 | 2.2E-01 | 3.2E-01 | 4.8E-01 |
Piersi | 9.1E-02 | 8.9E-02 | 1.9E-01 | 3.1E-01 | 5.6E-01 |
Przewód pokarmowy: | |||||
Ściany żołądka | 4.6E-01 | 5.9E-01 | 8.6E-01 | 1.5E-00 | 3.0E+00 |
Jelito cienkie | 2.8E-01 | 3.5E-01 | 6.2E-01 | 1.0E+00 | 2.0E+00 |
Jelito grube – odcinek górny | 5.8E-02 | 6.7E-02 | 1.1E-01 | 1.8E-01 | 3.2E-01 |
Jelito grube - odcinek dolny | 3.9E-02 | 4.9E-02 | 7.8E-02 | 1.3E-01 | 2.4E-01 |
Nerki | 5.1E-02 | 6.8E-02 | 1.0E-01 | 1.7E-01 | 2.9E-01 |
Wątroba | 4.3E-02 | 5.8E-02 | 9.7E-02 | 1.7E-01 | 3.3E-01 |
Płuca | 1.3E-01 | 1.8E-01 | 3.0E-01 | 4.8E-01 | 8.0E-01 |
Jajniki | 4.1E-02 | 5.6E-02 | 9.0E-02 | 1.5E-01 | 2.7E-01 |
Trzustka | 5.8E-02 | 7.6E-02 | 1.3E-01 | 2.1E-01 | 3.8E-01 |
Szpik kostny | 1.2E-01 | 1.8E-01 | 2.2E-01 | 2.9E-01 | 4.6E-01 |
Śledziona | 5.1E-02 | 6.8E-02 | 1.1E-01 | 1.7E-01 | 3.3E-01 |
Jądra | 2.6E-02 | 3.1E-02 | 5.2E-02 | 8.7E-02 | 1.7E-01 |
Tarczyca | 7.9E+02 | 1.2E+03 | 1.9E+03 | 4.1E+03 | 7.4E+03 |
Macica | 4.6E-02 | 6.0E-02 | 9.9E-02 | 1.6E-01 | 3.0E-01 |
Pozostałe narządy | 1.6E-01 | 2.4E-01 | 3.7E-01 | 5.9E-01 | 1.0E+00 |
Dawka skuteczna mSv/MBq | 2.4E+01 | 3.7E+01 | 5.6E+01 | 1.2E+02 | 2.2E+02 |
Radiofarmaceutyk jest dostarczany w postaci kapsułek o aktywności zgodnej z zamówieniem (aktywność wyznaczana jest na godz. 12ºº w dniu kalibracji).
Podczas obsługi oraz podawania produktu leczniczego, należy ściśle przestrzegać zasad bezpieczeństwa pracy w warunkach narażenia na promieniowanie jonizujące.
Sposób otwierania opakowania z produktem radioaktywnym:
Pierwszy rodzaj opakowania
Sprawdzić radioaktywność i datę kalibracji, umieszczoną na opakowaniu zewnętrznym.
Wyjąć metalową puszkę z tekturowego pudełka i zerwać jej górną pokrywę.
Wyjąć górną część wkładki styropianowej.
Wyjąć pojemnik osłonowy z kapsułką.
Zdjąć górną pokrywę ołowianego pojemnika osłonowego.
Zdjąć plastikową przykrywkę z fiolki polipropylenowej umieszczonej wewnątrz pojemnika ołowianego.
Wyjmować pojedynczo kapsułki z fiolki przy pomocy pęsety.
Drugi rodzaj opakowania:
Sprawdzić radioaktywność i datę kalibracji, umieszczoną na opakowaniu zewnętrznym.
Wyjąć metalową puszkę z tekturowego pudełka i zerwać jej górną pokrywę
Wyjąć górną część wkładki styropianowej.
Wyjąć pojemnik osłonowy z kapsułką.
Rozerwać papierowo – foliowe opakowanie aplikatora a następnie wyjąć aplikator.
Otworzyć pojemnik osłonowy z kapsułką. W tym celu odkręcić pokrywę pojemnika przytrzymując
dolną jego część. Fiolka wraz z kapsułką powinna pozostawać w pojemniku osłonowym.
Połączyć fiolkę z aplikatorem. W tym celu aplikator należy wkręcić do fiolki zawierającej kapsułkę.
W trakcie podawania kapsułki zaleca się, by fiolka zawierająca kapsułkę połączona z aplikatorem była umieszczona w pojemniku osłonowym. Pacjent trzymając pojemnik osłonowy w ręku umieszcza górną część aplikatora w ustach, a następnie przechyla go tak, aby kapsułka wypadła z aplikatora do ust. W przypadkach szczególnych możliwe jest podawanie kapsułki bez pojemnika osłonowego. W tym przypadku, pacjent chwytając za aplikator, wyjmuje fiolkę zawierającą kapsułkę z pojemnika osłonowego, umieszcza górną część aplikatora w ustach i następnie przechyla go tak, aby kapsułka wypadła z aplikatora do ust.
Po podaniu kapsułki aplikator wraz z fiolką należy wyrzucić do odpadów. Pojemnik osłonowy należy zwrócić producentowi.
W przypadku konieczności odłączenia fiolki od aplikatora należy fiolkę wraz z aplikatorem umieścić w pojemniku osłonowym, a następnie przytrzymując pojemnik ręką wykręcić aplikator z fiolki.
W celu wykonania pomiaru aktywności kapsułki należy umieścić górną część aplikatora w chwytaku miernika aktywności a następnie wyjąć aplikator połączony z fiolką zawierającą kapsułkę. Całość umieścić w mierniku aktywności. Po zakończeniu pomiaru fiolkę wraz z aplikatorem umieścić w pojemniku osłonowym. W razie konieczności przeniesienia kapsułki po pomiarze do innego pomieszczenia należy odłączyć aplikator od fiolki w sposób opisany powyżej. Po odłączeniu aplikatora pojemnik przykryć pokrywą.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.











