Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
hipernatremia;
hipertonia;
niewydolność serca;
stany obrzęku u pacjentów z zaburzeniami serca, wątroby lub nerek;
ciężkie nadciśnienie;
kwasica metaboliczna.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Natrium chloratum 0,9% Kabi, 9 mg/ml, rozpuszczalnik do sporządzania leków parenteralnych
100 ml zawiera: | Elektrolity | mmol/l | mEq/l |
Sodu chlorek 0,9 g | Na+ | 154 | 154 |
Cl- | 154 | 154 | |
Woda do wstrzykiwań q.s. do 100 ml |
1 ml roztworu zawiera 9 mg chlorku sodu. Osmolarność: 308 mOsmol/l.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Rozpuszczalnik do sporządzania leków parenteralnych
Przezroczysty i bezbarwny roztwór, wolny lub prawie wolny od cząstek stałych
Nośnik lub rozpuszczalnik do parenteralnego podawania produktów leczniczych stosowanych dożylnie, domięśniowo lub podskórnie.
Dawkowanie
Dawkowanie ustala się w zależności od stężenia, w jakim należy podać rozpuszczony produkt leczniczy.
Sposób podawania
Podanie dożylne, domięśniowe lub podskórne.
Biorąc pod uwagę wskazania do stosowania produktu leczniczego, przeciwwskazania zależą od rodzaju produktu leczniczego, który ma być rozpuszczony.
Podawanie produktu leczniczego jest przeciwwskazane w następujących przypadkach:
Po otwarciu pojemnika roztwór należy zużyć natychmiast.
W przypadku podawania podskórnego nie należy stosować żadnych dodatków, które mogłyby zmienić izotoniczność roztworu.
Nie stosować roztworu jeśli nie jest przezroczysty i zawiera osad.
Przed dodaniem zawartości ampułki do produktu leczniczego, należy sprawdzić zgodność rozpuszczanej substancji z chlorkiem sodu.
U noworodków, zarówno wcześniaków jak i donoszonych, może występować zbyt wysokie stężenie sodu spowodowane niedojrzałością nerek. Dlatego u noworodków, zarówno wcześniaków jak
i donoszonych, powtarzane wstrzyknięcia chlorku sodu można podać po określeniu stężenia sodu we krwi.
Chlorek sodu należy stosować ostrożnie u pacjentów z nadciśnieniem, niewydolnością serca, obrzękiem płuc lub obrzękiem obwodowym, zaburzeniami czynności nerek, w stanie przedrzucawkowym, z hiperaldosteronizmem, marskością wątroby i innymi chorobami wątroby, hiperwolemią, zwężeniem dróg moczowych, hipoproteinemią oraz innymi chorobami i leczeniem (np. kortykosteroidami) związanymi z zatrzymaniem sodu.
Interakcje zależą od produktu leczniczego, który ma być rozpuszczony.
Chlorek sodu wykazuje interakcję z węglanem litu, którego wydzielanie nerkowe jest wprost proporcjonalne do stężenia sodu w organizmie. Podanie chlorku sodu przyspiesza nerkowe wydzielanie litu, przez co ogranicza jego działanie terapeutyczne.
Należy unikać dodawania alkoholu do roztworów chlorku sodu.
Z uwagi na właściwości produktu leczniczego, nie należy spodziewać się jego wpływu na kobiety w okresie ciąży lub podczas karmienia piersią, jeśli sposób podawania jest poprawny i pod kontrolą.
Dane dostępne w literaturze naukowej dotyczące wielu narażonych ciąż wskazują, że podanie kobiecie w okresie ciąży roztworów chlorku sodu w infuzji nie spowodowało działań niepożądanych u płodu bądź noworodka. Podobnie brak dowodów na to, że podanie kobiecie podczas karmienia piersią roztworu chlorku sodu 9 mg/ml jest szkodliwe dla noworodka. Jak dotąd brak innych znaczących danych epidemiologicznych, zarówno dotyczących ciąży, jak i karmienia piersią; dlatego też zaleca się w tych okresach stosować chlorek sodu z zachowaniem ostrożności.
Nie dotyczy.
Mogą wystąpić zaburzenia ogólne i stany w miejscu podania.
Nieodpowiednie lub nadmierne podanie roztworu chlorku sodu 9 mg/ml może wywołać przewodnienie, hipernatremię, hiperchloremię i związane z nimi objawy, takie jak kwasica metaboliczna spowodowana zmniejszeniem stężenia wodorowęglanów, oraz wystąpienie obrzęku. Nadmiar chlorku sodu może wywołać nudności, wymioty i ból głowy.
Gdy Natrium chloratum 0,9% Kabi, rozpuszczalnik do sporządzania leków parenteralnych jest stosowany do rozcieńczania produktów leczniczych do wstrzykiwań, to rodzaj dodawanego produktu leczniczego określa prawdopodobieństwo wystąpienia działań niepożądanych.
W przypadku wystąpienia działań niepożądanych związanych z dodanym produktem leczniczym, należy natychmiast przerwać infuzję, ocenić stan pacjenta, wdrożyć odpowiednie postępowanie korygujące oraz zachować roztwór w razie konieczności jego późniejszej analizy.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
tel.: + 48 22 49 21 301
faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Ze względu na właściwości produktu leczniczego, jeżeli stosuje się go zgodnie ze wskazaniem oraz podaje we właściwy i kontrolowany sposób, nie występuje ryzyko zatrucia.
Niemniej jednak, nadmiar chlorku sodu w najcięższym przypadku wywołuje odwodnienie narządów wewnętrznych, nudności, wymioty, biegunkę, skurcze w obrębie brzucha, pragnienie, zmniejszenie wydzielania śliny, moczu i potu, gorączkę, niedociśnienie, tachykardię, niewydolność nerek, obrzęk płuc, kwasicę, niewydolność oddechową, ból głowy, zawroty głowy, drażliwość, skurcze mięśni, sztywność, śpiączkę i śmierć.
Dzieci i młodzież
U dzieci, śpiączka i drgawki mogą się utrzymywać z powodu odwodnienia komórek. Mogą również wystąpić zaburzenia oddychania z przyspieszonym oddychaniem i zaczerwienienie nosa.
Jeżeli przypadkowe spożycie nadmiernej ilości chlorku sodu nastąpiło niedawno, należy spowodować wymioty lub wykonać płukanie żołądka. W przypadku wystąpienia drgawek należy podać dożylnie diazepam.
Prawidłowe stężenia w osoczu należy przywrócić podając dożylnie 10 do 15 mmol hipotonicznego roztworu soli na dobę.
W przypadku poważnego uszkodzenia nerek, jeśli pacjent umiera lub jeśli stężenie sodu w osoczu przekroczy 200 mmol/l, należy przeprowadzić dializę.
Grupa farmakoterapeutyczna: rozpuszczalniki i środki rozcieńczające, w tym roztwory do przepłukiwań, kod ATC: V07AB.
Chlorek sodu, główna sól odpowiedzialna za utrzymanie prawidłowego ciśnienia płynu pozakomórkowego, jest stosowany w leczeniu zmniejszonej objętości płynu pozakomórkowego, podczas odwodnienia oraz niedoboru sodu, spowodowanymi nadmierną diurezą, zapaleniem żołądka lub obniżonym spożyciem soli.
Sód, składnik egzogenny i niemożliwy do zastąpienia, jest głównym kationem płynu pozakomórkowego i najważniejszym składnikiem osmotycznym w regulacji objętości krążącej krwi. Anion chlorkowy może ulec wymianie na wodorowęglanowy, zawsze dostępny dla metabolizmu komórkowego jako dwutlenek węgla.
Natrium chloratum 0,9% Kabi ma takie samo ciśnienie osmotyczne jak płyny ciała.
W przypadku łagodnej zasadowicy, podanie roztworu fizjologicznego soli daje możliwość uzupełnienia ubytku jonów chlorkowych, wydalenia z moczem nadmiaru wodorowęglanów, a w następstwie obniżenia i normalizacji zasobów zasad.
Ponadto, izotoniczny roztwór chlorku sodu jest odpowiednim nośnikiem do podawania wielu produktów leczniczych i elektrolitów.
Wchłanianie
W związku z podaniem dożylnym tego produktu leczniczego nie zachodzi jego wchłanianie.
Dystrybucja
Elektrolity - sód i chlor dystrybuowane są głównie do płynu pozakomórkowego. Ponieważ roztwór fizjologiczny soli jest izotoniczny, jego podanie nie wpływa na zmianę ciśnienia osmotycznego płynu pozakomórkowego, dzięki czemu woda nie wnika do przestrzeni międzykomórkowych, a obydwa jony właściwie nie przenikają do komórki.
Pomimo że dochodzi do zmniejszenia (poprzez rozcieńczenie) ciśnienia onkotycznego białek osocza, prowadzącego do przedostawania się wody do przestrzeni śródmiąższowej poprzez ściany włośniczek, możliwe jest osiągnięcie stanu równowagi onkotycznej.
Należy wziąć pod uwagę, że najbardziej uwodnioną tkanką w organizmie jest tkanka mięśniowa, podczas gdy sód występuje głównie w kościach, stanowiąc jeden z głównych zapasów kości.
Eliminacja
Jon sodowy jest głównie wydalany przez nerki (95%), a reszta przez skórę (pot) i układ pokarmowy.
Woda wydalana jest głównie przez nerki, skórę, płuca i układ pokarmowy.
Dlatego też nerki są najważniejszym narządem utrzymującym pozakomórkowe stężenie sodu. Wydalana ilość tego kationu zależy od potrzeb organizmu. Może być nawet wytwarzany mocz o stężeniu poniżej 1 mEq sodu/l.
Dzięki doświadczeniu w stosowaniu izotonicznego roztworu chlorku sodu w przywracaniu równowagi wodno-elektrolitowej, jego bezpieczeństwo stosowania w terapii płynowej jest uznawane na całym świecie.
Woda do wstrzykiwań
Kwas solny 25% (do ustalenia pH) Sodu wodorotlenek (do ustalenia pH)
Przed dodaniem zawartości ampułki do produktu leczniczego należy sprawdzić zgodność między dodawanymi produktami leczniczymi.
Natrium chloratum 0,9% Kabi wykazuje niezgodność z hydrokortyzonem, amfoterycyną B, tetracyklinami, cefalotyną, erytromycyną, laktobionianem i solami litu.
Natrium chloratum 0,9% Kabi wykazuje niezgodność z substancjami czynnymi nierozpuszczalnymi w roztworze chlorku sodu z powodu możliwości wytrącenia się składnika czynnego. Wykazuje również niezgodność z produktami leczniczymi, których trwałość lub rozpuszczalność wymagają bardzo kwasowego lub bardzo zasadowego pH.
Okres ważności produktu leczniczego: 2 lata.
Okres ważności po pierwszym otwarciu: należy zużyć natychmiast.
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Ampułki z polietylenu o niskiej gęstości (LDPE). Dostępne opakowania:
20 ampułek po 5 ml
50 ampułek po 5 ml
20 ampułek po 10 ml
50 ampułek po 10 ml
20 ampułek po 20 ml.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Nie ma konieczności dezynfekowania ampułki przed jej otwarciem.
Nie ma konieczności używania żadnych przyrządów do otwarcia ampułki.
Po otwarciu ampułki, jej wylot dokładnie pasuje do końcówki strzykawki (końcówka Luera), dzięki czemu nie ma konieczności używania igły.
Instrukcja obsługi
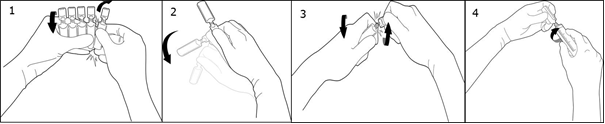
Oderwać jedną ampułkę przekręcając ją w kierunku przeciwnym do pozostałych, nie dotykając końcówki i szyjki ampułki (1). Wstrząsnąć ampułkę jednym ruchem jak pokazano poniżej, w celu usunięcia roztworu z końcówki ampułki (2). Aby otworzyć ampułkę należy przekręcić jej końcówkę w przeciwnym kierunku do pozostałej części ampułki aż do linii odłamania końcówki (3). Połączyć ampułkę ze strzykawką typu Luer lub Luer-Lock jak pokazano na rysunku (4).
Nie ma konieczności używania igły. Stosować zawsze po rozcieńczeniu.
Roztwór nie zawiera żadnych środków konserwujących ani bakteriobójczych, dlatego po otwarciu niezużyte ampułki należy natychmiast wyrzucić.
Fresenius Kabi Polska Sp. z o. o. Al. Jerozolimskie 134
02-305 Warszawa
Pozwolenie nr 16039
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 07.10.2009 r. Data ostatniego przedłużenia pozwolenia: 17.08.2012 r.
02.12.2015 r.











