Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
zmarszczek gładzizny czoła (pionowe zmarszczki pomiędzy brwiami) widocznych podczas maksymalnego marszczenia brwi i/lub
zmarszczek w okolicy bocznego kąta oka (typu kurze łapki) widocznych podczas pełnego uśmiechu
u pacjentów dorosłych w wieku poniżej 65 lat, w przypadku, gdy nasilenie tych zmarszczek ma istotny wpływ na psychikę pacjenta.
Dawkowanie i sposób podawania
Analiza przyczyn niepowodzenia np. wstrzykiwanie do niewłaściwych mięśni, stosowanie nieprawidłowej techniki i powstanie przeciwciał neutralizujących toksynę.
Ponowna ocena znaczenia leczenia toksyną botulinową typu A.
Przeciwwskazania
Nadwrażliwość na substancję czynną lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1;
infekcja w proponowanych miejscach wstrzyknięć;
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi lekami i inne rodzaje interakcji
Wpływ na płodność, ciążę i karmienie piersią Ciąża
Wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności przy przechowywaniu
Rodzaj i zawartość opakowania
Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania
Rozlany produkt należy zetrzeć: za pomocą chłonnego materiału nasączonego roztworem podchlorynu sodu (wybielacz) w przypadku proszku lub za pomocą suchego, chłonnego materiału w przypadku produktu po rekonstytucji.
Skażoną powierzchnię należy czyścić chłonnym materiałem nasączonym roztworem podchlorynu sodu (wybielacz) a następnie wysuszyć.
W przypadku stłuczenia fiolki postępować zgodnie z powyższą instrukcją. Ostrożnie zebrać fragmenty potłuczonego szkła i ścierać produkt uważając przy tym, aby nie skaleczyć skóry.
Jeśli produkt miał kontakt ze skórą, przemyć skażone miejsce roztworem podchlorynu sodu (wybielacz), a następnie spłukać obficie wodą.
Jeśli produkt miał kontakt z oczami, należy przepłukać dokładnie oczy obfitą ilością wody lub oftalmologicznym roztworem do przemywania oczu.
Jeśli produkt miał kontakt z raną, skaleczeniem lub uszkodzoną skórą, skażone miejsce należy dokładnie przepłukać obfitą ilością wody i podjąć odpowiednie działania medyczne zależne od wstrzykniętej dawki.
Należy ściśle przestrzegać instrukcji dotyczących stosowania, przygotowania i usuwania leku.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Azzalure, 125 jednostek Speywood, proszek do sporządzania roztworu do wstrzykiwań
Toksyna botulinowa typ A * ilość odpowiadająca 125 jednostkom Speywood na fiolkę.
*Kompleks toksyny Clostridium botulinum typu A z hemaglutyniną
**Jednostki Speywood są specyficzne dla produktu leczniczego Azzalure i nie mogą być zastępowane innymi preparatami toksyny botulinowej.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek do sporządzania roztworu do wstrzykiwań. Proszek jest biały.
Produkt leczniczy Azzalure jest wskazany w celu tymczasowej poprawy wyglądu umiarkowanych lub silnych
Dawkowanie:
W poszczególnych preparatach występują różne jednostki toksyny botulinowej. Jednostki Speywood są specyficzne dla preparatu Azzalure i nie mogą być zastępowane innymi preparatami toksyny botulinowej.
Dzieci i młodzież
Nie wykazano bezpieczeństwa i skuteczności stosowania produktu leczniczego Azzalure u osób w wieku do 18 lat. Nie zaleca się stosowania produktu leczniczego Azzalure u osób w wieku poniżej 18 lat.
Sposób podawania:
Azzalure powinien być podawany wyłącznie przez lekarzy posiadających odpowiednie kwalifikacje i doświadczenie w zakresie takiego leczenia oraz wymagany sprzęt. Po rekonstytucji Azzalure powinien być zastosowany wyłącznie do leczenia jednego pacjenta podczas jednej sesji.
Instrukcje dotyczące rekonstytucji produktu leczniczego przed podaniem, patrz punkt 6.6.
Usunąć makijaż i zdezynfekować skórę środkiem antyseptycznym o działaniu miejscowym. Wstrzyknięcia domięśniowe należy wykonywać za pomocą jałowej, odpowiednich rozmiarów igły.
Odstępy pomiędzy seriami wstrzyknięć zależą od oceny indywidualnej odpowiedzi pacjenta na leczenie.
Odstępy pomiędzy seriami wstrzyknięć produktu leczniczego Azzalure nie powinny być krótsze niż trzy miesiące.
Zalecane miejsca wstrzykiwania w przypadku zmarszczek gładzizny czoła i zmarszczek w okolicy bocznego kąta oka przedstawiono na poniższej rycinie:
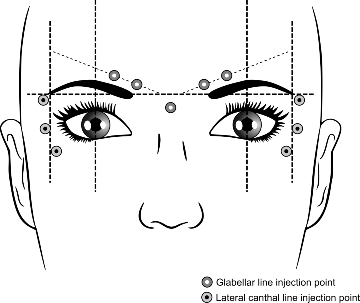
Zmarszczki gładzizny czoła
Zalecana dawka wynosi 50 jednostek Speywood produktu leczniczego Azzalure podzielonych na 5 miejsc wstrzyknięć, 10 jednostek Speywood zostanie wstrzykniętych domięśniowo pod kątem prostym do skóry do każdego z 5 miejsc: 2 wstrzyknięcia w każdy mięsień marszczący (corrugator) i jedno wstrzyknięcie do mięśnia podłużnego nosa (procerus) w pobliżu kąta czołowo-nosowego zgodnie z powyższą ryciną.
Charakterystyczne punkty anatomiczne są łatwiej rozpoznawalne, jeśli są obserwowane i wyczuwane przy maksymalnym zmarszczeniu. Przed wstrzyknięciem należy przycisnąć mocno kciuk lub palec wskazujący poniżej krawędzi oczodołu w celu uniemożliwienia powstania wybroczyny poniżej krawędzi oczodołu. Podczas wstrzykiwania igła powinna być skierowana w górę i środkowo. Dla zmniejszenia ryzyka opadania powieki należy unikać wstrzykiwań w pobliżu mięśnia dźwigacza powieki górnej (levator palpebrae superioris), szczególnie u pacjentów z nasilonymi zespołami opadania brwi (depressor supercilii). Wstrzykiwań do mięśnia marszczącego należy dokonywać w części centralnej takiego mięśnia co najmniej w odległości 1 cm od krawędzi oczodołu.
W badaniach klinicznych najkorzystniejszy efekt leczenia zmarszczek gładzizny czoła występował do 4 miesięcy od wstrzyknięcia leku. U niektórych pacjentów odpowiedź na lek utrzymywała się do 5 miesięcy (patrz punkt 5.1).
Zmarszczki w okolicy bocznego kąta oka
Zalecana dawka wynosi 30 jednostek Speywood na każdą stronę produktu leczniczego Azzalure, podzielonych między 3 miejsca wstrzyknięcia; 10 jednostek Speywood podawane domięśniowo do każdego miejsca wstrzyknięcia. Bardzo płytkie wstrzyknięcia podskórne należy wykonywać pod kątem 20-30°. Wszystkie miejsca wstrzyknięcia powinny znajdować się na zewnętrznej części mięśnia orbicularis oculi, w wystarczającej odległości od krawędzi oczodołu (około 1 - 2 cm), zgodnie z powyższą ryciną.
Charakterystyczne punkty anatomiczne są łatwiej rozpoznawalne, jeśli są obserwowane i wyczuwane podczas pełnego uśmiechu. Należy zachować ostrożność, aby unikać wstrzyknięcia w mięsień jarzmowy większy/mniejszy (zygomaticus major/minor) w celu uniknięcia opadania kącika ust i asymetrycznego uśmiechu.
Informacje ogólne
W przypadku niepowodzenia leczenia lub słabszego działania po ponownym wstrzyknięciu należy stosować alternatywne metody leczenia. W przypadku niepowodzenia leczenia po pierwszej sesji leczenia można rozważać podjęcie następujących działań:
Skuteczność i bezpieczeństwo wielokrotnych wstrzyknięć produktu leczniczego Azzalure oceniano w przypadku zmarszczek gładzizny czoła w okresie do 24 miesięcy oraz do 8 powtórzeń cykli leczenia, a w przypadku zmarszczek w okolicy bocznego kąta oka w okresie do 12 miesięcy oraz do 5 powtórzeń cykli leczenia.
- miastenia rzekomoporaźna, zespół Eaton Lamberta lub stwardnienie boczne zanikowe.
Należy zachować ostrożność, aby nie wstrzyknąć produktu leczniczego Azzalure w naczynie krwionośne.
Wcześniej występujące zaburzenia nerwowo-mięśniowe
Azzalure należy stosować ostrożnie u pacjentów z ryzykiem lub klinicznie potwierdzoną znaczną dysfunkcją przekaźnictwa nerwowo-mięśniowego. U takich pacjentów może występować zwiększona wrażliwość na leki takie jak Azzalure, która może powodować nadmierne osłabienie mięśni.
Nie zaleca się podawania Azzalure u pacjentów z dysfagią i aspiracją w wywiadzie.
Miejscowe i odległe rozprzestrzenianie się efektów działania toksyny
W przypadku toksyny botulinowej bardzo rzadko donoszono o możliwych działaniach niepożądanych związanych z rozprzestrzenianiem się toksyny w miejsca odległe od miejsca podania. Pacjenci leczeni dawkami terapeutycznymi mogą odczuwać nadmierne osłabienie mięśni.
Trudności w połykaniu i oddychaniu o ciężkim nasileniu mogą prowadzić do zgonu.
Należy zalecić pacjentom lub opiekunom natychmiastowe zwrócenie się do lekarza w przypadku wystąpienia zaburzeń połykania, mowy lub oddychania.
Nie wolno przekraczać zalecanej dawki i częstości podawania Azzalure.
Istotne jest zbadanie anatomii twarzy pacjenta przed podaniem Azzalure. Należy brać pod uwagę asymetrię twarzy, opadanie powiek, nadmierną wiotkość skóry, blizny i zmiany tej anatomii będące wynikiem wcześniejszych interwencji chirurgicznych.
Należy zachować ostrożność w przypadku stosowania Azzalure w obecności stanu zapalnego w proponowanym miejscu(ach) wstrzyknięć lub, jeśli docelowy mięsień wykazuje nadmierne osłabienie lub zanik.
Podobnie jak w przypadku wszystkich wstrzyknięć domięśniowych nie zaleca się podawania Azzalure u pacjentów z wydłużonym czasem krzepnięcia.
Podczas leczenia zmarszczek gładzizny czoła i zmarszczek w okolicy bocznego kąta oka produktem leczniczym Azzalure zgłaszano suchość oczu (patrz punkt 4.8). Podczas stosowania toksyny botulinowej, w tym produktu leczniczego Azzalure, może występować zmniejszone wytwarzanie łez, zmniejszona częstość mrugania i zaburzenia w obrębie rogówki.
Powstawanie przeciwciał
Zbyt częste podawanie leku lub zbyt duże dawki mogą zwiększać ryzyko powstania przeciwciał przeciwko toksynie botulinowej. Z klinicznego punktu widzenia powstawanie przeciwciał neutralizujących toksynę może obniżać skuteczność dalszego leczenia.
Jednostki toksyny botulinowej nie są wymienne między różnymi produktami. Dawki zalecane w jednostkach Speywood różnią się od innych preparatów zawierających toksynę botulinową.
Obowiązkowo podczas jednej sesji Azzalure jest stosowany wyłącznie u jednego pacjenta. Pozostałą część niezużytego produktu należy usunąć zgodnie ze wskazówkami podanymi w punkcie 6.6.
Należy stosować szczególne środki ostrożności podczas przygotowania i podawania produktu oraz podczas inaktywacji i usuwania pozostałego niezużytego roztworu (patrz punkt 6.6).
Identyfikowalność
W celu poprawienia identyfikowalności biologicznych produktów leczniczych należy czytelnie zapisać nazwę i numer serii podawanego produktu.
Równoczesne stosowanie leku Azzalure i antybiotyków aminoglikozydowych lub innych środków zakłócających przewodnictwo nerwowo-mięśniowe (np. środki o działaniu kuraryzującym) może być dopuszczalne wyłącznie przy zachowaniu ostrożności, ponieważ mogą one wzmacniać działanie toksyny botulinowej typu A.
Nie prowadzono badań interakcji leków. Nie zostały zgłoszone żadne inne interakcje o znaczeniu klinicznym.
Azzalure nie należy stosować w okresie ciąży, jeśli nie jest to bezwzględnie konieczne. Brak jest wystarczających danych dotyczących stosowania toksyny botulinowej typu A u kobiet w ciąży. Badania przeprowadzone na zwierzętach wykazały toksyczny wpływ na reprodukcję w przypadku stosowania dużych dawek (patrz punkt 5.3). Potencjalne zagrożenie dla człowieka nie jest znane.
Karmienie piersią
Brak jest informacji, czy Azzalure przenika do mleka kobiet. Nie zaleca się stosowania Azzalure podczas laktacji.
Płodność
Brak danych klinicznych dotyczących wpływu produktu leczniczego Azzalure na płodność. Badania na zwierzętach nie dostarczyły dowodów na bezpośredni wpływ produktu leczniczego Azzalure na płodność (patrz punkt 5.3).
Produkt leczniczy Azzalure wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn. Istnieje potencjalne ryzyko miejscowego osłabienia mięśni, zaburzenia widzenia lub astenii związane ze stosowaniem tego produktu, które może tymczasowo ograniczyć zdolność prowadzenia pojazdów lub obsługiwania maszyn.
Podczas różnych badań klinicznych Azzalure podano około 3800 pacjentom.
W badaniach klinicznych kontrolowanych placebo obserwowana częstość występowania reakcji niepożądanych po pierwszym wstrzyknięciu produktu leczniczego Azzalure wynosiła 22,3 % w przypadku leczenia zmarszczek gładzizny czoła (16,6 % w przypadku placebo) oraz 6,2 % w przypadku leczenia zmarszczek w okolicy bocznego kąta oka (2,9 % w przypadku placebo). Większość z tych zdarzeń miała łagodny lub umiarkowany przebieg i były odwracalne.
Do najczęściej występujących reakcji niepożądanych w przypadku leczenia zmarszczek gładzizny czoła należały ból głowy i reakcje w miejscu wstrzyknięcia, a w przypadku leczenia zmarszczek w okolicy bocznego kąta oka - ból głowy, reakcje w miejscu wstrzyknięcia i obrzęk powieki. Na ogół reakcje związane z leczeniem/techniką wstrzykiwań występowały w pierwszym tygodniu po wstrzyknięciu i były przemijające.
Częstość reakcji związanych z leczeniem/techniką wstrzykiwań malała wraz z powtarzaniem cykli. Działania niepożądane mogą być związane z substancją czynną, techniką wstrzyknięcia lub jednym i drugim.
Profil bezpieczeństwa produktu leczniczego Azzalure w jednoczesnym leczeniu zmarszczek gładzizny czoła i zmarszczek w okolicy bocznego kąta oka oceniano w otwartej części badania klinicznego III fazy; rodzaj i częstość występowania reakcji niepożądanych były porównywalne z rodzajem i częstością reakcji niepożądanych obserwowanych u pacjentów leczonych w poszczególnych wskazaniach.
Częstość reakcji niepożądanych określono jak poniżej:
Bardzo często (≥1/10), często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zmarszczki gładzizny czoła:
Zaburzenia układu | Bardzo często |
nerwowego | Ból głowy |
Często | |
Niedowład twarzy (wskutek przejściowego niedowładu mięśni | |
twarzy proksymalnych do miejsca wstrzyknięcia, głównie opisywany |
jako niedowład brwi) Niezbyt często Zawroty głowy | |
Zaburzenia oka | Często Astenopia, opadnięcie powieki, obrzęk powieki, nasilenie łzawienia, zespół suchego oka, drganie mięśni (drganie mięśni wokół oczu) Niezbyt często Upośledzenie widzenia, niewyraźne widzenie, podwójne widzenie Rzadko zaburzenia ruchów gałek ocznych |
Zaburzenia skóry i tkanki podskórnej | Niezbyt często Świąd, wysypka skórna Rzadko Pokrzywka |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często Odczyny w miejscu wstrzyknięcia (np. rumień, obrzęk, podrażnienie, wysypka, świąd, parestezja, ból, dyskomfort, kłucie i krwiaki) |
Zaburzenia układu immunologicznego | Niezbyt często Nadwrażliwość |
Zmarszczki w okolicy bocznego kąta oka:
Klasyfikacja układów i narządów | Reakcje niepożądane |
Zaburzenia układu nerwowego | Często Ból głowy Przejściowy niedowład twarzy (przejściowy niedowład mięśni twarzy proksymalnych do miejsca wstrzyknięcia) |
Zaburzenia oka | Często Obrzęk powieki Opadnięcie powieki Niezbyt często Suchość oka |
Zaburzenia ogólne i stany w miejscu podania | Często Reakcje w miejscu wstrzyknięcia (np. krwiak, świąd i obrzęk) |
Bardzo rzadko donoszono o występowaniu reakcji niepożądanych związanych z działaniem toksyny w miejscach odległych od miejsca jej podania (wzmożone osłabienie mięśniowe, zaburzenia przełykania, zachłystowe zapalenie płuc, które może prowadzić do śmierci) (patrz punkt 4.4).
Doświadczenia po wprowadzeniu do obrotu
Klasyfikacja układów i narządów | Reakcje niepożądane | Częstość |
Zaburzenia ogólne i stany w miejscu podania | Astenia, zmęczenie, choroba grypopodobna | Nieznana |
Zaburzenia układu immunologicznego | Nadwrażliwość | Nieznana |
Zaburzenia układu nerwowego | Niedoczulica | Nieznana |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | Atrofia mięśni | Nieznana |
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądancyh Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181 C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego.
Można oczekiwać, że nadmierne dawki toksyny botulinowej spowodują osłabienie nerwowo- mięśniowe z różnymi objawami. Może być wymagane wspomaganie oddychania w przypadku, gdy nadmierne dawki powodują paraliż mięśni układu oddechowego.
W przypadku przedawkowania pacjent powinien pozostawać pod obserwacją lekarską w zakresie objawów nadmiernego osłabienia mięśni lub paraliżu mięśni. W razie potrzeby należy rozpocząć leczenie objawowe.
Objawy przedawkowania mogą nie wystąpić bezpośrednio po wstrzyknięciu.
Należy rozważyć przyjęcie do szpitala w przypadku pacjentów z objawami zatrucia toksyną botulinową typu A (np. połączenie osłabienia mięśni, opadanie powiek, podwójne widzenie, zaburzenia połykania i mowy lub paraliż mięśni układu oddechowego).
Grupa farmakoterapeutyczna: Inne leki zwiotczające mięśnie, działające obwodowo Kod ATC: M03AX01
Podstawowe działanie farmakodynamiczne toksyny Clostridium botulinum typu A wynika z chemicznego odnerwienia leczonych mięśni powodującego wymierne zmniejszenie potencjału czynnościowego mięśni, które z kolei powoduje miejscowe zmniejszenie działania mięśni lub paraliż.
Toksyna botulinowa typu A jest środkiem rozluźniającym mięśnie, który tymczasowo blokuje aktywność nerwów w mięśniach. Po wstrzyknięciu, toksyna botulinowa typu A działa poprzez blokowanie transportu neuroprzekaźnika, acetylocholiny, w obrębie złącza nerwowo-mięśniowego, położonego pomiędzy zakończeniem nerwowym a włóknem mięśniowym. Mechanizm działania toksyny botulinowej typu A obejmuje cztery główne etapy, z których wszystkie muszą przebiegać prawidłowo, aby działanie to nastąpiło. Działanie leku prowadzi do zatrzymania skurczów mięśni
docelowych. Działanie leku utrzymuje się do czasu, aż zostanie przywrócona czynność złącza i wróci aktywność mięśniowa.
Dane kliniczne
Podczas klinicznego rozwoju Azzalure do różnych badań klinicznych włączono ponad 4500 pacjentów, a około 3800 pacjentów otrzymało produkt leczniczy Azzalure.
Zmarszczki gładzizny czoła
Podczas badań klinicznych 2032 pacjentów z umiarkowanymi lub silnymi zmarszczkami gładzizny czoła było leczonych zalecaną dawką 50 jednostek Speywood. Spośród nich 305 pacjentów było leczonych 50 j. podczas dwóch zasadniczych badań fazy III prowadzonych metodą podwójnie ślepej próby z grupą kontrolną otrzymującą placebo, a 1200 pacjentów było leczonych 50 j. podczas długoterminowego, otwartego badania fazy III obejmującego wielokrotne podanie dawki leku. Pozostali pacjenci byli leczeni w ramach badań pomocniczych i ustalenia dawki.
Mediana czasu do wystąpienia odpowiedzi wynosiła 2-3 dni po podaniu leku, a maksymalne działanie obserwowano w dniu trzydziestym. Podczas obydwu zasadniczych badań fazy III z grupą kontrolną otrzymującą placebo wstrzyknięcia Azzalure znacząco zmniejszyły nasilenie zmarszczek gładzizny czoła przez okres do 4 miesięcy. W jednym z dwóch zasadniczych badań po 5 miesiącach działanie leku nadal było znaczące.
Trzydzieści dni po wstrzyknięciu ocena dokonana przez badaczy wykazała, że u 90% (273/305) pacjentów wystąpiła odpowiedź na leczenie (po maksymalnym zmarszczeniu u pacjentów nie były widoczne żadne lub jedynie łagodne zmarszczki gładzizny czoła) w porównaniu do 3% (4/153) w grupie pacjentów leczonych placebo. Pięć miesięcy po wstrzyknięciu, u 17% (32/190) pacjentów leczonych Azzalure odpowiedź na lek utrzymywała się nadal w porównaniu do 1% (1/92) w grupie pacjentów leczonych placebo. Dokonana przez pacjentów po trzydziestu dniach własna ocena, przy maksymalnym zmarszczeniu wykazała odsetek odpowiedzi wynoszący 82% (251/305) w przypadku pacjentów leczonych Azzalure i 6% (9/153) w przypadku pacjentów leczonych placebo. W jednym zasadniczym badaniu fazy III, w którym oceniano dwustopniową poprawę w opinii badacza przy maksymalnym zmarszczeniu, grupa pacjentów wykazujących taką poprawę obejmowała 77% (79/103).
Przed leczeniem w podgrupie 177 pacjentów występowały umiarkowane lub ciężkie zmarszczki gładzizny czoła w spoczynku. Ocena tej populacji pacjentów dokonana przez badaczy trzydzieści dni po podaniu leku wykazała, że 71% (125/177) pacjentów leczonych Azzalure uznano za pacjentów z odpowiedzią w porównaniu do 10% (8/78) pacjentów leczonych placebo.
Otwarte, długoterminowe badanie z wielokrotnym podaniem dawki leku wykazało, że mediana czasu do wystąpienia odpowiedzi wynosząca 3 dni była utrzymana w ponownych cyklach stosowania leku. Odsetek pacjentów z odpowiedzią przy maksymalnym zmarszczeniu określony przez badacza po 30 dniach był utrzymany podczas kolejnych cykli leczenia (wynosząc od 80% do 91% podczas 5 cykli). Odsetek pacjentów z odpowiedzią wśród pacjentów ze zmarszczkami gładzizny czoła w spoczynku podczas kolejnych cykli podawania leku był zgodny z badaniami obejmującymi podanie jednej dawki i wynosił 56% - 74% pacjentów leczonych Azzalure uznanych przez badaczy za pacjentów z odpowiedzią trzydzieści dni po zastosowaniu leczenia.
Zmarszczki w okolicy bocznego kąta oka
W podwójnie ślepych badaniach klinicznych 308 pacjentów z umiarkowanymi lub ciężkimi zmarszczkami w okolicy bocznego kąta oka przy pełnym uśmiechu było leczonych zalecaną dawką wynoszącą 30 jednostek Speywood na każdą stronę. Spośród nich 252 pacjentów było leczonych w podwójnie ślepym, kontrolowanym placebo badaniu klinicznym fazy III, a 56 pacjentów było leczonych w podwójnie ślepym badaniu klinicznym fazy II ustalenia dawki.
W badaniu klinicznym III fazy wstrzyknięcia produktu leczniczego Azzalure istotnie zmniejszały stopień nasilenia zmarszczek w okolicy bocznej kąta oka w porównaniu z placebo (p ≤ 0,001) w 4., 8. i 12. tygodniu (oceniany przez badaczy podczas pełnego uśmiechu). W przypadku subiektywnej oceny zadowolenia z wyglądu zmarszczek w okolicy bocznego kąta oka występowały statystycznie istotne różnice pomiędzy produktem leczniczym Azzalure i placebo (p≤0,010) na korzyść produktu leczniczego w 4. 8., 12. i 16. tygodniu.
Pierwszorzędowy punkt końcowy wystąpił po 4 tygodniach po wstrzyknięciu: ocena przeprowadzona przez badaczy wykazała, że u 47,2% (119/252) pacjentów wystąpiła odpowiedź na leczenie (brak zmarszczek lub łagodne zmarszczki w okolicy bocznego kąta oka podczas pełnego uśmiechu), w porównaniu z 7,2% (6/83) u pacjentów leczonych placebo.
Analiza post-hoc, przeprowadzona w tym samym punkcie czasowym, 4 tygodnie po wstrzyknięciu, wykazała, że u 75% (189/252) pacjentów leczonych produktem leczniczym Azzalure wystąpiła poprawa o co najmniej 1 stopień podczas pełnego uśmiechu w porównaniu z zaledwie 19% (16/83) pacjentów leczonych placebo.
Łącznie 315 pacjentów zostało włączonych do przedłużenia III fazy badania klinicznego prowadzonego metodą otwartej próby, w której mogli być leczeni jednocześnie we wskazaniu zmarszczek w okolicy bocznego kąta oka oraz zmarszczek gładzizny czoła.
Pacjenci leczeni produktem leczniczym Azzalure w podwójnie ślepych i otwartych fazach badania klinicznego III fazy otrzymali 3 cykle leczenia (mediana) zmarszczek w okolicy bocznego kąta oka. Mediana odstępów pomiędzy wstrzyknięciami w leczeniu zmarszczek w okolicy bocznego kąta oka, które w znacznym stopniu zależały od protokołu badania, wynosiła od 85 do 108 dni. Wyniki wykazały, że w przypadku wielokrotnego wstrzyknięcia skuteczność utrzymuje się przez okres jednego roku.
Badanie poziomu satysfakcji pacjentów w 4., 16. i 52. tygodniu, przeprowadzone po pierwszym cyklu leczenia produktem Azzalure wykazało, że 165/252 pacjentów (65,5%) było bardzo zadowolonych lub zadowolonych z wyglądu zmarszczek w okolicy bocznego kąta oka.
W 16. tygodniu, po 4 tygodniach od zakończenia drugiego cyklu leczenia produktem Azzalure w przypadku pacjentów przypisanych losowo do grupy otrzymującej produkt Azzalure w Części A lub od zakończenia pierwszego cyklu leczenia w przypadku pacjentów przypisanych losowo do grupy otrzymującej placebo, odsetek pacjentów bardzo zadowolonych lub zadowolonych wynosił 233/262 (89,0%). W 52. tygodniu, w którym pacjenci mogli już otrzymać do pięciu cykli leczenia produktem Azzalure, w tym co najmniej jeden cykl w 48. tygodniu, odsetek pacjentów bardzo zadowolonych lub zadowolonych wynosił 255/288 (84,7%).
U żadnego z pacjentów nie stwierdzono obecności przeciwciał neutralizujących toksynę po wielokrotnym wstrzyknięciu produktu leczniczego Azzalure w ciągu jednego roku.
Po domięśniowym wstrzyknięciu zalecanej dawki nie oczekuje się obecności Azzalure w wykrywalnym stężeniu w krwi obwodowej. W związku z tym nie przeprowadzono badań farmakokinetycznych z Azzalure.
W badaniach nad reprodukcją prowadzonych na szczurach i królikach po podaniu dużych dawek obserwowano ciężką toksyczność u matek, której towarzyszyły straty po implantacji jaja.
Po podaniu królikom i szczurom dawek odpowiadających dawkom 60 - 100 – krotnie większym niż zalecana u ludzi (50 j.) nie obserwowano toksycznego wpływu na zarodek i płód. Nie obserwowano działań teratogennych u tych gatunków. U szczurów nastąpiło obniżenie płodności samców i samic w związku z ograniczeniem kopulacji wynikającym z paraliżu mięśni po podaniu dużych dawek.
W badaniu toksyczności przewlekłej prowadzonym na szczurach, nie wykazano toksyczności układowej po podaniu dawek odpowiadających 75-krotności dawki zalecanej u ludzi (50 j.) podzielonych równomiernie na prawy i lewy mięsień pośladkowy.
Badania ostrej toksyczności, toksyczności przewlekłej i tolerancji miejscowej w miejscu wstrzyknięcia, po podaniu klinicznie istotnych dawek, nie wykazywały nietypowych miejscowych ani układowych działań niepożądanych.
Albumina ludzka Laktoza jednowodna.
Produktu leczniczego nie wolno mieszać z innymi lekami poza podanymi w punkcie 6.6.
2 lata.
Roztwór po rekonstytucji:
Wykazano stabilność chemiczną i fizyczną roztworu przez 24 godziny w temperaturze 2-8°C.
Z mikrobiologicznego punktu widzenia roztwór należy wykorzystać natychmiast, chyba że sposób rekonstytucji wyklucza ryzyko zanieczyszczenia mikrobiologicznego. Jeśli produkt nie zostanie wykorzystany natychmiast, za czas i warunki przechowywania przed wykorzystaniem odpowiada użytkownik.
Przechowywać w lodówce (2ºC - 8ºC). Nie zamrażać.
Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt 6.3.
125 jednostek Speywood proszku w fiolce (szkło typu I), z korkiem (z gumy halobutylowej) i wieczkiem (aluminium).
Opakowanie zawiera 1 lub 2 fiolkę(i).
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Należy ściśle przestrzegać instrukcji dotyczących stosowania, przygotowania i usuwania leku.
Rekonstytucję należy wykonać zgodnie z zasadami dobrej praktyki szczególnie w odniesieniu do techniki aseptycznej.
Azzalure musi być rozpuszczony w 0,9% roztworu chlorku sodu (9 mg/ml) do wstrzykiwań.
Zgodnie z poniższą tabelą dotyczącą rozpuszczania, wymaganą objętość 0,9% roztworu chlorku sodu (9 mg/ml) do wstrzykiwań należy pobrać do strzykawki w celu otrzymania klarownego i bezbarwnego roztworu o następującym stężeniu:
Objętość rozpuszczalnika (0,9% roztworu chlorku sodu) dodana do fiolki zawierającej 125 j. | Otrzymana dawka |
0,63 ml | 10 jednostek na 0,05 ml |
1,25 ml | 10 jednostek na 0,1 ml |
Dokładny pomiar 0,63 ml lub 1,25 ml można uzyskać za pomocą strzykawek wyskalowanych w odstępach co 0,1 ml i 0,01 ml.
ZALECENIA DOTYCZĄCE USUWANIA SKAŻONYCH MATERIAŁÓW
Niezwłocznie po użyciu i przed usunięciem, niezużyty lek Azzalure po rekonstytucji (w fiolce lub w strzykawce) należy inaktywować przy pomocy 2 ml rozcieńczonego roztworu podchlorynu sodu w stężeniu 0,55 lub 1% (roztwór Dakina).
Nie opróżniać użytych fiolek, strzykawek i materiałów. Należy wyrzucać je do odpowiednich pojemników i usuwać zgodnie z lokalnymi wymaganiami.
ZALECENIA NA WYPADEK INCYDENTU PODCZAS PRZYGOTOWANIA TOKSYNY BOTULINOWEJ
Ipsen Pharma
65 Quai Georges Gorse
92100 Boulogne-Billancourt Francja
16393
18.01.2010; 03.12.2014
04.07.2022 r.











