Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
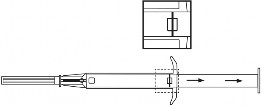
Uwaga: Tłok można przesunąć do przodu w celu wstrzyknięcia implantu tylko wtedy, gdy uprzednio był on całkowicie wysunięty!
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania produktu leczniczego
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Leuprostin, 5 mg, implant
Każdy implant zawiera 5 mg leuproreliny (Leuprorelinum) w postaci leuproreliny octanu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Implant
Cylindryczny pręcik w kolorze białym do bladożółtawego (długości 10 mm) w ampułko-strzykawce.
Paliatywne leczenie pacjentów z zaawansowanym, hormonozależnym rakiem gruczołu krokowego.
Leczenie pacjentów z miejscowo zaawansowanym, hormonozależnym rakiem gruczołu krokowego w połączeniu z radioterapią i po radioterapii.
Leczenie w połączeniu z radioterapią hormonozależnego raka ograniczonego do gruczołu krokowego u pacjentów z umiarkowanym i dużym ryzykiem.
Określenie wskazania do stosowania i monitorowanie przebiegu długotrwałego leczenia powinni
przeprowadzać lekarze z doświadczeniem w leczeniu guzów nowotworowych.
Zalecaną dawką jest pojedyncza dawka 5 mg leuproreliny co 3 miesiące.
Jeśli w wyjątkowych przypadkach termin podania kolejnej dawki jest przesunięty maksymalnie o 4 tygodnie, skuteczność lecznicza u większości pacjentów nie powinna być zmniejszona (patrz punkt 5.2).
Szczególne grupy pacjentów
U pacjentów z zaburzeniami czynności nerek lub wątroby, a także u pacjentów w podeszłym wieku modyfikacja dawki nie jest konieczna.
Dzieci i młodzież
Stosowanie produktu Leuprostin u dzieci i młodzieży jest przeciwwskazane (patrz punkt 4.3).
Leuprostin można stosować w połączeniu z radioterapią w neoadjuwantowym lub adjuwantowym leczeniu miejscowo zaawansowanego, hormonowrażliwego raka gruczołu krokowego, a także miejscowo zaawansowanego raka ograniczonego do gruczołu krokowego u pacjentów
z umiarkowanym i dużym ryzykiem.
Produkt leczniczy Leuprostin powinien być przygotowywany i podawany wyłącznie przez fachowy personel medyczny, który zna te procedury.
Jeden implant wstrzykuje się podskórnie w przednią ścianę jamy brzusznej Przed wstrzyknięciem można zastosować lek miejscowo znieczulający.
Zaleca się wdrożenie wspomagającego leczenia antyandrogenem na około 5 dni przed rozpoczęciem stosowania produktu leczniczego Leuprostin (patrz punkt 4.4).
Należy dokładnie przeczytać instrukcję, gdyż aplikator tego produktu leczniczego może się różnić od innych wcześniej stosowanych.
Nadwrażliwość na substancję czynną, na którąkolwiek substancję pomocniczą wymienioną w punkcie
6.1 lub na inne analogi LHRH (gonadoliberyny).
Potwierdzony brak zależności raka od działania hormonów.
Stosowanie implantu Leuprostin 5 mg jest przeciwwskazane u kobiet i u dzieci.
Stan pacjentów z nadciśnieniem tętniczym należy uważnie monitorować.
U pacjentów leczonych agonistami LHRH (agonistami hormonu uwalniającego gonadotropinę), takimi jak leuprorelina, istnieje zwiększone ryzyko depresji (również ciężkiej). Pacjentów należy poinformować o takim zagrożeniu i w razie wystąpienia objawów zastosować właściwe leczenie.
Obserwowano reakcje alergiczne i anafilaktyczne, w tym reakcje miejscowe (w miejscu wstrzyknięcia) i ogólnoustrojowe.
Po wprowadzeniu produktu leczniczego zawierającego leuprorelinę do obrotu zgłaszano występowanie drgawek u pacjentów leczonych leuproreliny octanem, niezależnie od występowania u nich w wywiadzie padaczki, drgawek lub czynników predysponujących.
Po chirurgicznej kastracji leuprorelina nie powoduje dalszego zmniejszania stężenia testosteronu. Ze względu na krótkotrwałe zwiększenie stężenia testosteronu w surowicy na początku leczenia, co może przemijająco nasilić objawy choroby, stan pacjentów z ryzykiem powikłań neurologicznych, przerzutów do kręgosłupa i zwężenia dróg moczowych należy w pierwszych tygodniach leczenia
w miarę możliwości poddawać stałej kontroli, tak jak w przypadku pacjentów hospitalizowanych.
Należy rozważyć dodatkowe podawanie odpowiedniego leku hamującego wydzielanie androgenów w początkowym etapie leczenia w celu złagodzenia możliwych następstw początkowego zwiększenia stężenia testosteronu i nasilenia objawów klinicznych.
Powodzenie leczenia należy oceniać w regularnych odstępach czasu (zwłaszcza w razie oznak postępu choroby mimo odpowiedniego leczenia) przez badanie kliniczne (palpacyjne badanie per rectum gruczołu krokowego, badanie ultrasonograficzne, densytometrię kości, tomografię komputerową)
i kontrolowanie aktywności fosfataz i (lub) stężenia PSA oraz testosteronu w surowicy.
Hipogonadyzm związany z długotrwałym leczeniem analogami LHRH i (lub) usunięciem jąder (orchidektomii) może prowadzić do osteoporozy ze zwiększonym ryzykiem złamań. Rozwój osteoporozy jest silniejszy po zabiegu orchidektomii (ze zwiększeniem stężenia kortyzolu) niż po podaniu analogów LHRH. U pacjentów obarczonych dużym ryzykiem wspomagające leczenie bisfosfonianem może zapobiec demineralizacji kości.
U niektórych pacjentów leczonych analogami gonadoliberyny (ang. luteinizing-hormone-releasing
hormone, hormon uwalniający hormon luteinizujący - LHRH) notowano zmiany tolerancji glukozy.
Podczas stosowania produktu leczniczego Leuprostin należy ściśle kontrolować stan pacjentów
z cukrzycą.
Leczenie przeciwandrogenowe może spowodować wydłużenie odstępu QT.
U pacjentów z czynnikami ryzyka wydłużenia odstępu QT w wywiadzie oraz u pacjentów otrzymujących jednocześnie produkty lecznicze, które mogą wydłużyć odstęp QT (patrz punkt 4.5), lekarz powinien ocenić przed rozpoczęciem stosowania produktu Leuprostin stosunek korzyści do ryzyka (włącznie z możliwością wystąpienia zaburzeń rytmu serca typu torsade de pointes).
Idiopatyczne nadciśnienie wewnątrzczaszkowe
U pacjentów otrzymujących leuprorelinę notowano występowanie idiopatycznego nadciśnienia śródczaszkowego (rzekomy guz mózgu). Pacjentów należy ostrzec, aby zwracali uwagę na przedmiotowe i podmiotowe objawy idiopatycznego nadciśnienia wewnątrzczaszkowego, w tym ciężki lub nawracający ból głowy, zaburzenia widzenia i szumy uszne. Jeśli u pacjenta wystąpi idiopatyczne nadciśnienie wewnątrzczaszkowe, należy rozważyć przerwanie leczenia leuproreliną.
Nie prowadzono badań dotyczących interakcji.
Ponieważ leczenie przeciwandrogenowe może spowodować wydłużenie odstępu QT, należy uważnie ocenić jednoczesne stosowanie produktu Leuprostin i produktów leczniczych, które wydłużają odstęp QT lub produktów leczniczych, które mogą wywołać zaburzenia rytmu serca typu torsade de pointes, tj. leki przeciwarytmiczne klasy IA (np. chinidyna, dyzopiramid) lub klasy III (np. amiodaron, sotalol, dofetylid, ibutylid), metadon, moksyfloksacyna, leki przeciwpsychotyczne itd. (patrz punkt 4.4).
Leuprostin przeznaczony jest do stosowania wyłącznie u mężczyzn.
Ze względu na występowanie u nielicznych pacjentów uczucia zmęczenia, które pojawia się zwłaszcza na początku leczenia i może być również związane z chorobą nowotworową, produkt leczniczy, nawet stosowany zgodnie z zaleceniami, może zmieniać reakcje pacjenta w sposób zaburzający zdolność prowadzenia pojazdów lub obsługiwania maszyn. Dotyczy to w większym stopniu sytuacji, gdy podczas stosowania leku spożywa się alkohol.
Na początku leczenia leuprorelina powoduje krótkotrwałe zwiększenie stężenia testosteronu
w surowicy, które może spowodować przemijające nasilenie niektórych objawów choroby (wystąpienie lub nasilenie bólu kości, zwężenie dróg moczowych z jego skutkami, ucisk rdzenia kręgowego, osłabienie mięśni nóg, obrzęk limfatyczny). Nasilenie tych objawów zmniejsza się zazwyczaj samoistnie bez konieczności przerwania stosowania produktu Leuprostin.
Działania niepożądane mogą występować w następstwie zahamowania uwalniania hormonów płciowych.
Tabelaryczne zestawienie działań niepożądanych
Działania niepożądane wymieniono zgodnie z klasyfikacją układów i narządów MedDRA oraz
częstością:
bardzo często: 1/10 często: 1/100 do <1/10
niezbyt często: 1/1000 do <1/100 rzadko: 1/10 000 do <1/1000 bardzo rzadko: <1/10 000
częstość nieznana (nie może być określona na podstawie dostępnych danych)
Bardzo często | Często | Niezbyt często | Rzadko | Bardzo rzadko | Częstość nieznana | |
Zaburzenia | uogólnione | reakcje | ||||
układu | reakcje | anafilaktyczne | ||||
immunologiczne | alergiczne | |||||
-go | (goraczka, | |||||
świąd, | ||||||
eozynofilia, | ||||||
wysypka | ||||||
skórna) | ||||||
Zaburzenia metabolizmu i odżywiania | zmniejszenie apetytu, zwiększenie | zmiany w cukrzycowym statusie |
apetytu | metabolicz- nym (zwiększenie lub zmniejsze- nie stężenia glukozy we krwi) | |||||
Zaburzenia psychiczne | zmiany nastroju, depresja, zaburzenia snu | |||||
Zaburzenia układu nerwowego | bóle głowy, parestezje | zawroty głowy pochodzenia obwodowego, przemijające zaburzenia smaku | Tak jak w odniesieniu do innych produktów leczniczych zawierającyc h substancję czynną z tej samej grupy, opisywano bardzo rzadkie przypadki krwotoku do przysadki mózgowej po początkowy m podaniu leuproreliny pacjentom z gruczolakiem przysadki | drgawki, idiopatyczne nadciśnienie śródczaszkowe (rzekomy guz mózgu) (patrz punkt 4.4) | ||
Zaburzenia serca | wydłużenie odstępu QT (patrz punkty 4.4 i 4.5) | |||||
Zaburzenia naczyniowe | uderzenia gorąca | zmiany ciśnienia tętniczego (nadciśnienie lub niedociśnienie tętnicze), zakrzepica | ||||
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | zator płucny | Śródmiąższo-wa choroba płuc | ||||
Zaburzenia żołądka i jelit | nudności i (lub) wymioty | biegunka | ||||
Zaburzenia skóry i tkanki podskórnej | suchość skóry lub błon śluzowych, nocne poty | łysienie | ||||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | ból kości | ból stawów i (lub) pleców, miastenia | demineralizacja kości (patrz punkt 4.4) | |||
Zaburzenia nerek i dróg | oddawanie moczu w nocy, | zatrzymanie moczu |
moczowych | bolesne oddawanie moczu, częstomocz | |||||
Zaburzenia układu rozrodczego i piersi | zmniejszenie lub utrata libido i potencji, zmniejszenie wielkości jąder | ginekomastia | ból jąder | |||
Zaburzenia ogólne i stany w miejscu podania | nasilone pocenie się, reakcje w miejscu wkłucia np. zaczerwienie- nie, ból, obrzęk, świąd, które zazwyczaj ustępują nawet w razie kontynuowa- nia leczenia | odczucie zmeczenia, obrzęki obwodowe | ||||
Badania diagnostyczne | zwiększenie masy ciała | zmniejszenie masy ciała, zwiększenie aktywności LDH, aminotransfe- raz (AlAT, AspAT), gamma-GT i fosfatazy zasadowej, które mogą być także objawem choroby podstawowej |
Istnieją doniesienia z okresu po wprowadzeniu leuproreliny do obrotu o przypadkach śródmiąższowego zapalenia płuc, głównie w Japonii.
Uwagi szczególne
Reakcję na leczenie implantem Leuprostin 5 mg można monitorować, oznaczając stężenie testosteronu w surowicy, aktywność fosfatazy kwaśnej i stężenie PSA. W poczatkowej fazie leczenia stężenie terstosteronu najpierw zwiększa się, po czym zmniejsza w czasie 2 tygodni. Po upływie 2 do 4 tygodni stężenia testosteronu sa porównywalne do obserwowanych po obustronnym usunięciu jąder
i pozostają stałe przez cały okres leczenia.
W początkowej fazie leczenia może wystąpić przemijające zwiększenie aktywności fosfatazy kwaśnej. Powrót do fizjologicznych lub prawie fizjologicznych wartości następuje po kilku tygodniach.
W rzadkich przypadkach występowały ropnie poiniekcyjne. W jednym przypadku wystąpienia ropni poiniekcyjnych zaobserwowano nieprawidłowe wchłanianie leuproreliny z postaci depot, dlatego w takich przypadkach należy kontrolować stężenie testosteronu.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania
produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dotychczas nie obserwowano objawów zatrucia.
Nawet stosowanie octanu leuproreliny w dobowej dawce do 20 mg przez 2 lata (dawka stosowana w pierwszych badaniach klinicznych) nie obserwowano żadnych innych lub nowych działań niepożądanych, które różniłyby się od obserwowanych po zastosowaniu octanu leuproreliny
w dobowej dawce 1 mg lub w dawce 11,25 mg co 3 miesiące.
Grupa farmakoterapeutyczna: hormony i ich pochodne; analogi hormonu uwalniającego gonadotropinę.
Kod ATC: L02AE02
Octan leuproreliny, substancja czynna produktu Leuprostin 5 mg, implant, jest syntetycznym analogiem występującego fizjologicznie, uwalnianego z podwzgórza czynnika LHRH, który kontroluje uwalnianie z przedniego płata przysadki gonadotropowego hormonu luteinizującego LH i hormonu folikulotropowego FSH. Hormony te z kolei stymulują syntezę steroidów gonadalnych.
W przeciwieństwie do fizjologicznego LHRH, który jest uwalniany z podwzgórza w sposób pulsujący, octan leuproreliny (znany również jako agonista LHRH) blokuje podczas długotrwałego leczenia
w sposób ciągły receptory LHRH w przysadce, a po początkowej krótkotrwałej stymulacji powoduje ich niewrażliwość („regulacja w dół”, ang. down-regulation). W wyniku tego następuje przemijające zahamowanie uwalniania gonadotropin z przysadki, po którym zmniejsza się stężenie testosteronu.
Stężenie testosteronu jest zmniejszone, co wpływa na wzrost rakowej tkanki gruczołu krokowego, która fizjologicznie stymulowana jest przez dihydrotestosteron, wytwarzany przez redukcję testosteronu w komórkach gruczołu krokowego.
Ciągłe podawanie octanu leuproreliny prowadzi do zmniejszenia liczby i (lub) wrażliwości (tzw.
„regulacja w dół”) receptorów znajdujących się w przysadce mózgowej i w konsekwencji do zmniejszenia stężenia LH, FSH, i DHT. W trakcie tego procesu stężenie testosteronu zmniejsza się do poziomu kastracyjnego.
Działanie przeciwandrogenowe oraz zahamowanie wzrostu raka gruczołu krokowego wykazano również w badaniach na zwierzętach.
Zgodnie z badaniami nieklinicznymi i klinicznymi, octan leuproreliny podawany co 3 miesiące hamuje uwalnianie gonadotropin po początkowej stymulacji.
U ludzi podskórne podanie octanu leuproreliny powoduje początkowe zwiększenie stężenia LH i FSH, charakteryzujące się przemijającym zwiększeniem stężenia testosteronu i dihydrotestosteronu.
Ponieważ w pojedynczych przypadkach podczas pierwszych 3 tygodni leczenia obserwowano krótkotrwałe nasilenie objawów klinicznych choroby, u mężczyzn z rakiem gruczołu krokowego należy rozważyć podanie antyandrogenów, jako leczenie wspomagające.
Przeciwnie, długotrwałe leczenie octanem leuproreliny powoduje zmniejszenie stężenia LH i FSH u wszystkich pacjentów. Androgeny uzyskują u mężczyzn stężenie podobne do obserwowanego po obustronnym usunięciu jąder. Zmiany te występują zazwyczaj w 2 do 3 tygodni po rozpoczęciu
leczenia i utrzymują się przez cały okres leczenia. Dlatego stosując octan leuproreliny można również badać wrażliwość hormonalną raka gruczołu krokowego oraz możliwą wartość terapeutyczną usunięcia obustronnego jąder. Jeśli to konieczne, usunięcie jąder można zastąpić podawaniem octanu leuproreliny co 3 miesiące. Aktualnie możliwe jest utrzymanie stężenia testosteronu na poziomie kastracyjnym po podawaniu octanu leuproreliny w sposób ciągły przez 5 lat.
Skuteczność kliniczna
W wieloośrodkowym, randomizowanym badaniu III fazy oceniano działanie octanu leuproreliny u 263 pacjentów z miejscowo zaawansowanym rakiem gruczołu krokowego w stadium T3-T4 lub pT3, N0, M0.
U 133 pacjentów stosowano przez 3 lata radioterapię z leczeniem przeciwandrogenowym, a u 130
pacjentów leczenie przeciwandrogenowe samym octanem leuproreliny.
W oparciu o stanowisko Amerykańskiego Towarzystwa Radioterapii i Onkologii ASTRO (ang. American Society for Radiation Oncology) (kryteria Phoenix), przeżycie wolne od progresji w ciągu 5 lat wyniosło 60,9% (64,7%) w terapii skojarzonej w porównaniu z 8,5% (15,4%) w grupie z samą hormonoterapią (p=0,0001; [p = 0,0005]).
Zgodnie z kryteriami ASTRO, ryzyko progresji choroby było 3,8-krotnie większe u pacjentów z grupy poddawanej samej hormonoterapii (95% CI [2,17; 6,49]).
Mediana czasu przeżycia bez wznowy klinicznej lub biochemicznej według kryteriów ASTRO wyniosła 641 dni (95% CI [626; 812]) w grupie otrzymującej samo leczenie hormonalne
w porównaniu z 2804 dniami (95% CI [2090; -]; p <0,0001) w grupie otrzymującej leczenie skojarzone.
Nie stwierdzono statystycznie znaczących różnic dotyczących progresji lokoregionalnej (HR 3,6 [95% CI {1,9; 6,8}; p <0,0001]), czasu do wystąpienia przerzutów odległych (p <0,018) oraz przeżycia wolnego od przerzutów (p=0,018) między grupą otrzymującą leczenie skojarzone i grupą poddawaną samemu leczeniu przeciwandrogenowemu.
Wyniki tego badania wyraźnie wskazują na przewagę stosowanego przez 3 lata połączenia leczenia przeciwandrogenowego z radioterapią nad samą hormonoterapią.
Następujące badania wskazują, że u pacjentów z miejscowo zaawansowanym rakiem gruczołu krokowego skojarzone leczenie z analogami LHRH jest również bardziej korzystne niż sama radioterapia.
Do randomizowanego badania RTOG 85-31 włączono 977 pacjentów z miejscowo zaawansowanym rakiem gruczołu krokowego (T1-T3) z przerzutami do węzłów chłonnych, wykraczającym poza narząd lub naciekającym pęcherzyki nasienne.
U 488 pacjentów stosowano połączenie radioterapii z długotrwałym leczeniem przeciwandrogenowym gosereliną, zaś u 489 pacjentów stosowano samą radioterapię.
Wyniki badania wyraźnie wskazują na przewagę leczenia skojarzonego nad samą radioterapią.
10-letnie przeżycie wolne od progresji wyniosło odpowiednio 37% i 23% (p <0,001); przeżycie bez progresji z wartością PSA <1,5 ng/ml wyniosło 31% i 9%; wznowa miejscowa wystąpiła odpowiednio w 23% i 38% przypadków (p <0,0001), a progresja choroby z przerzutami w 24% i 39% (p <0,0001). Przeżycie ogólne miało wartość, odpowiednio 49% i 39% (p=0,002), a umieralność z powodu raka 16% i 22% (p=0,0052).
W poniższym badaniu klinicznym wykazano przewagę połączenia radioterapii z leczeniem przeciwandrogenowym z zastosowaniem analogów LHRH w porównaniu z samą radioterapią u pacjentów z rakiem ograniczonym do gruczołu krokowego, z umiarkowanym ryzykiem.
Przeprowadzono randomizowane badanie kliniczne III fazy RTOG 94-08 u pacjentów z rakiem ograniczonym do gruczołu krokowego w stopniu zaawansowania T1b, T1c, T2a lub T2b i ze stężeniem PSA ≤10 ng/ml.
Wyodrębniono podgrupę pacjentów z umiarkowanym ryzykiem (6. stopień złośliwości w skali Gleasona w połączeniu ze stężeniem PSA od >10 ng/ml do 20 ng/ml lub stopień zaawansowania T2b),
obejmującą 524 pacjentów poddanych krótkotrwałej supresji androgenowej (4 miesiące: 2 miesiące przed i 2 miesiące w trakcie radioterapii) i 544 pacjentów otrzymujących samą radioterapię.
Spośród pacjentów z umiarkowanym ryzykiem korzystniejsze niż sama radioterapia było połączenie radioterapii i leczenia przeciwandrogenowego z zastosowaniem gosereliny lub octanu leuproreliny.
Przeżycie ogólne po 10 latach wyniosło 61% wobec 54% (HR 1,23, 95% CI [1,02-1,49; p=0,03]),
umieralność z powodu raka wyniosła 3% wobec 10% (HR 2,49, 95% CI [1,50-4,11; p=0,004]),
a progresja was biochemiczna 28% wobec 45% (HR 1,79, 95% CI [1,45-2,21; p <0,001]).
Stosowanie u pacjentów ze zlokalizowanym rakiem gruczołu krokowego z dużym ryzykiem oparte jest na opublikowanych badaniach klinicznych dotyczących radioterapii w połączeniu z agonistami LHRH, w tym z octanem leuproreliny.
Opublikowane dane z pięciu badań klinicznych wyraźnie wskazują na korzyść ze stosowania radioterapii w połączeniu z agonistami LHRH (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 8610 und D’Amico et al.,JAMA 2004). Niemożliwe było wyraźne zróżnicowanie badanej populacji pod względem wskazań: miejscowo zaawansowanego raka gruczołu krokowego i zlokalizowanego raka gruczołu krokowego z dużym ryzykiem. Dane kliniczne wskazują, że po przeprowadzeniu radioterapii bardziej preferowane jest trwające 3 lata niż 6 miesięcy leczenie przeciwandrogenowe. Wytyczne kliniczne zalecają 2-3-letnie leczenie przeciwandrogenowe u pacjentów w stadium od T3 do T4.
U pacjentów z rakiem gruczołu krokowego z przerzutami opornym na kastrację wykazano korzyść ze stosowania dodatkowych czynników, takich jak inhibitory syntezy androgenu (np. octan abirateronu), antyandrogenów (np. enzalutamid), taksanów (np. docetaksel lub paklitaksel) lub środków do radioterapii (np. rad-223) w połączeniu z agonistami LHRH, tj. octan leuproreliny.
Po wstrzyknięciu biodegradowalnego implantu Leuprostin 5 mg, substancja czynna (octan leuproreliny) uwalniana jest z polimeru kwasu mlekowego w sposób ciągły przez 182 dni
(26 tygodni). Polimer wchłaniany jest w taki sam sposób, jak materiał, z którego wykonuje się szwy chirurgiczne.
W ciągu 2 godzin od podskórnego podania pojedynczej dawki produktu Leuprostin 5 mg, implant,
największe stężenie leuproreliny w surowicy wynosiło 5216 pg/ml (5,2 ng/ml).
Podczas 3 miesięcy leczenia produktem Leuprostin 5 mg, implant, wartość AUC wynosiła
32,4 ng/ml*d. Oznaczalne stężenie w surowicy utrzymuje się do 182 dni (26 tygodni) po podaniu.
Objętość dystrybucji leuproreliny u mężczyzn wynosi 36 l, a całkowity klirens ma wartość
139,6 ml/min.
U pacjentów z zaburzeniami czynności nerek lub wątroby stężenie leuproreliny znajdowało się
w zakresie stwierdzanym u pacjentów z prawidłową czynnością nerek lub wątroby. U niektórych pacjentów z przewlekłą niewydolnością nerek oznaczano większe stężenie leuproreliny w surowicy. Wydaje się, że te obserwacje nie mają żadnego znaczenia klinicznego.
Badania niekliniczne dotyczące octanu leuproreliny wykazały wpływ na narządy płciowe, jakiego oczekiwano w oparciu o znane farmakologiczne właściwości leuproreliny.
Rakotwórczość
U szczurów po podskórnym wstrzyknięciu dawek od 0,6 do 4 mg/kg mc. na dobę przez 12 i 24 miesięcy obserwowano zależne od dawki zwiększenie częstości powstawania gruczolaków przysadki. Podobnego działania nie obserwowano u myszy w ciągu 24 miesięcy.
Genotoksyczność
W badaniach in vitro i in vivo dotyczących możliwości wywoływania przez octan leuproreliny mutacji genetycznych i chromosomowych nie stwierdzono żadnego działania mutagennego.
Toksyczny wpływ na reprodukcję
W badaniach toksycznego wpływu na reprodukcję u królików obserwowano zwiększoną umieralność płodów oraz zmniejszenie masy ciała płodów. Wpływ na umieralność płodów jest spodziewaną konsekwencją działania farmakodynamicznego tej substancji.
Tolerancja miejscowa
Niekliniczne badania na psach i królikach ujawniły dobrą tolerancję miejscową implantu Leuprostin.
Kwas polimlekowy
Nie dotyczy.
4 lata
Nie przechowywać w temperaturze powyżej 30°C.
Ampułko-strzykawka z poliwęglanu (PC) z tłokiem z kopolimeru Akrylonitril-Butadien-Styrene (ABS) i igłą, umieszczona w worku z folii PET/Aluminium/PE, w tekturowym pudełku.
Wielkość opakowań:
1x1 implant z 5 mg leuproreliny (w postaci octanu) 2x1 implant z 5 mg leuproreliny (w postaci octanu) 3x1 implant z 5 mg leuproreliny (w postaci octanu) 5x1 implant z 5 mg leuproreliny (w postaci octanu)
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań dotyczących usuwania produktu leczniczego.
DO OBROTU
Sandoz GmbH Biochemiestrasse 10
6250 Kundl, Austria
Pozwolenie nr 17717
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 20.01.2011 r.
Data ostatniego przedłużenia pozwolenia: 06.06.2016 r.
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
05.07.2022 r.











