Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Antykoncepcja hormonalna.
Leczenie trądziku o umiarkowanym nasileniu po niepowodzeniu odpowiedniego leczenia miejscowego lub leczenia antybiotykami doustnymi u kobiet, które zdecydowały się na stosowanie doustnego środka antykoncepcyjnego.
Decyzja o przepisaniu produktu leczniczego Dorin powinna zostać podjęta na podstawie indywidualnej oceny czynników ryzyka u kobiety, zwłaszcza ryzyka żylnej choroby zakrzepowo-zatorowej oraz ryzyka żylnej choroby zakrzepowo-zatorowej związanego ze stosowaniem produktu leczniczego Dorin, w odniesieniu do innych złożonych hormonalnych środków antykoncepcyjnych (patrz punkty
4.3 oraz 4.4).
Dawkowanie i sposób podawania
Brak antykoncepcji hormonalnej w poprzednim miesiącu:
Przyjmowanie tabletek należy rozpocząć w pierwszym dniu naturalnego cyklu (pierwszym dniu krwawienia miesiączkowego).
Zmiana z innego złożonego doustnego środka antykoncepcyjnego:
Przyjmowanie produktu leczniczego Dorin rozpocząć najlepiej w dniu następującym po przyjęciu ostatniej tabletki zawierającej substancję czynną poprzedniego złożonego doustnego środka antykoncepcyjnego lub najpóźniej po zwykłej przerwie w stosowaniu tabletek zawierających substancje czynne lub placebo w ramach poprzedniego złożonego środka antykoncepcyjnego.
Zmiana z systemu terapeutycznego dopochwowego lub systemu transdermalnego:
Zaleca się rozpoczęcie przyjmowania produktu leczniczego Dorin tego samego dnia w którym nastąpiło usunięcie systemu terapeutycznego dopochwowego lub systemu transdermalnego, jednak nie później niż w dniu w którym byłby użyty następny system terapeutyczny lub system transdermalny.
Zmiana z produktu zawierającego wyłącznie progestagen (minitabletka, wstrzyknięcie, implant) lub z systemu terapeutycznego domacicznego uwalniającego progestagen (IUS):
Jeśli pacjentka przyjmowała minitabletki, zmiana leczenia może mieć miejsce w dowolnie wybranym dniu (w przypadku zmiany z implantu lub IUS, powinna się ona odbyć w dniu ich usunięcia, a w przypadku zmiany ze stosowania wstrzyknięcia, w dniu, w którym powinno zostać wykonane następne wstrzyknięcie). We wszystkich tych przypadkach, podczas pierwszych 7 dni przyjmowania produktu leczniczego Dorin należy dodatkowo stosować niehormonalną metodę antykoncepcji (metodę barierową).
Po poronieniu w pierwszym trymestrze ciąży:
Przyjmowanie produktu leczniczego Dorin można rozpocząć natychmiast. W tym przypadku nie ma konieczności stosowania dodatkowej metody antykoncepcji.
Po porodzie lub poronieniu w drugim trymestrze ciąży:
Należy poinformować kobietę, że przyjmowanie tabletek trzeba rozpocząć od 21 do 28 dni po porodzie lub poronieniu w drugim trymestrze ciąży. Jeżeli pacjentka rozpoczyna stosowanie tabletek później, podczas pierwszych 7 dni przyjmowania tabletek musi stosować dodatkową niehormonalną metodę antykoncepcji (metodę barierową). Jeśli pacjentka odbyła stosunek płciowy, przed rozpoczęciem przyjmowania produktu leczniczego Dorin należy upewnić się, że nie jest w ciąży lub należy poczekać aż wystąpi pierwsze krwawienie miesiączkowe.
Kobiety karmiące piersią, patrz punkt 4.6. Postępowanie w przypadku pominięcia tabletek
Jeżeli od czasu planowego przyjęcia tabletki upłynęło mniej niż 12 godzin, skuteczność ochrony antykoncepcyjnej nie ulega zmniejszeniu. Przypomniawszy sobie o pominiętej dawce, należy natychmiast zażyć tabletkę, a kolejne dawki stosować o zwykłej porze.
Jeżeli od czasu planowego przyjęcia tabletki upłynęło więcej niż 12 godzin, skuteczność antykoncepcyjna nie jest w pełni zapewniona.W takim przypadku należy postępować zgodnie z
następującymi dwiema podstawowymi zasadami:
Przeciwwskazania
występowanie lub ryzyko żylnej choroby zakrzepowo-zatorowej (ang. venous thromboembolism, VTE)
żylna choroba zakrzepowo-zatorowa - czynna (leczona przeciwzakrzepowymi produktami leczniczymi) lub przebyta żylna choroba zakrzepowo-zatorowa, np. zakrzepica żył głębokich (ang. deep venous thrombosis, DVT), zatorowość płucna (ang. pulmonary embolism, PE);
znana dziedziczna lub nabyta predyspozycja do występowania żylnej choroby zakrzepowo- zatorowej, np. oporność na aktywowane białko C (ang. activated protein C, APC) (w tym mutacja czynnika V Leiden), niedobór antytrombiny III, niedobór białka C, niedobór białka S;
rozległy zabieg operacyjny związany z długotrwałym unieruchomieniem (patrz punkt 4.4);
wysokie ryzyko żylnej choroby zakrzepowo-zatorowej wskutek występowania wielu czynników ryzyka (patrz punkt 4.4);
występowanie lub ryzyko tętniczych zaburzeń zakrzepowo-zatorowych (ang. arterial thromboembolism, ATE)
tętnicze zaburzenia zakrzepowo-zatorowe - czynne (np. zawał mięśnia sercowego) lub objawy prodromalne (np. dławica piersiowa);
choroby naczyń mózgowych - czynny udar, przebyty udar lub objawy prodromalne
w wywiadzie (np. przemijający napad niedokrwienny, ang. transient ischaemic attack, TIA);
stwierdzona dziedziczna lub nabyta skłonność do występowania tętniczych zaburzeń zakrzepowo-zatorowych, np. hiperhomocysteinemia i obecność przeciwciał antyfosfolipidowych (przeciwciała antykardiolipinowe, antykoagulant toczniowy);
migrena z ogniskowymi objawami neurologicznymi w wywiadzie;
wysokie ryzyko zaburzeń zakrzepowo-zatorowych tętnic, z powodu występowania wielu czynników ryzyka (patrz punkt 4.4) lub występowania jednego z poważnych czynników ryzyka, takich jak:
cukrzyca z powikłaniami naczyniowymi,
ciężkie nadciśnienie tętnicze,
ciężka dyslipoproteinemia;
zapalenie trzustki, występujące obecnie lub w przeszłości, z towarzyszącą ciężką hipertriglicerydemią;
aktualna lub przebyta ciężka choroba wątroby, chyba że czynność wątroby powróci do normy
aktualne lub przebyte łagodne bądź złośliwe nowotwory wątroby;
wystąpienie lub podejrzenie wystąpienia nowotworów hormonozależnych (np. nowotworów narządów płciowych lub piersi);
krwawienie z pochwy o nieustalonej etiologii;
jednoczesne stosowanie produktów leczniczych zawierających ombitaswir z parytaprewirem i rytonawirem oraz dazabuwir, produktów leczniczych zawierających glekaprewir
z pibrentaswirem oraz sofosbuwir z welpataswirem i woksylaprewirem (patrz punkt 4.5);
nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Złożonych hormonalnych środków antykoncepcyjnych nie należy stosować w następujących przypadkach. Jeżeli którykolwiek z podanych stanów wystąpi po raz pierwszy podczas stosowania złożonego doustnego środka antykoncepcyjnego, należy natychmiast przerwać jego przyjmowanie.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ostrzeżenia
Zaburzenia krążenia
Ryzyko żylnej choroby zakrzepowo-zatorowej
Stosowanie jakichkolwiek złożonych hormonalnych środków antykoncepcyjnych wiąże się ze zwiększonym ryzykiem żylnej choroby zakrzepowo-zatorowej, w porównaniu do sytuacji, gdy terapia nie jest stosowana. Stosowanie produktów zawierających lewonorgestrel, norgestymat lub noretisteron jest związane z najmniejszym ryzykiem żylnej choroby zakrzepowo-zatorowej. Inne produkty, takie jak Dorin, mogą mieć nawet do 1,6-krotnie wyższy poziom ryzyka. Decyzja o zastosowaniu produktu spoza grupy produktów z najniższym ryzykiem żylnej choroby zakrzepowo-zatorowej powinna zostać podjęta wyłącznie po rozmowie z pacjentką, w celu zapewnienia, że rozumie ona:
ryzyko żylnej choroby zakrzepowo-zatorowej związane z produktem Dorin,
jak obecne czynniki ryzyka wpływają na to ryzyko,
oraz że ryzyko żylnej choroby zakrzepowo-zatorowej jest największe w pierwszym roku stosowania. Istnieją pewne dowody, świadczące o tym, że ryzyko zwiększa się, gdy złożone hormonalne środki antykoncepcyjne są przyjmowane ponownie po przerwie w stosowaniu
trwającej 4 tygodnie lub dłużej.
U około 2 na 10 000 kobiet, które nie stosują złożonych środków antykoncepcyjnych i nie są w ciąży, w okresie roku rozwinie się żylna choroba zakrzepowo-zatorowa. Jakkolwiek ryzyko to może być znacznie większe, w zależności od czynników ryzyka występujących u danej pacjentki (patrz poniżej).
Badania epidemiologiczne w grupie kobiet, które stosują złożone hormonalne środki antykoncepcyjne (<50 μg etynyloestradiolu) wykazały, że w okresie roku, u około 6 do 12 kobiet na 10 000 rozwinie się żylna choroba zakrzepowo-zatorowa.
Szacuje się, że spośród 10 000 kobiet, które stosują niskie dawki złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel, u około 61 kobiet w okresie roku rozwinie się żylna choroba zakrzepowo- zatorowa.
Szacuje się2, że spośród 10 000 kobiet stosujących złożone hormonalne środki antykoncepcyjne zawierające dienogest i etynyloestradiol u 8 do 11 kobiet w okresie roku rozwinie się żylna choroba zakrzepowo-zatorowa.
Liczba przypadków żylnej choroby zakrzepowo-zatorowej przypadających na okres roku jest mniejsza niż oczekiwana liczba przypadków podczas ciąży lub w okresie poporodowym.
Żylna choroba zakrzepowo-zatorowa może być śmiertelna w 1-2% przypadków.
Liczba przypadków żylnej choroby zakrzepowo-zatorowej na 10 000 kobiet w okresie roku
Złożone hormonalne środki antykoncepcyjne zawierające dienogest i etynyloestradiol (8-11 przypadków)
Złożone hormonalne środki antykoncepcyjne zawierające lewonorgestrel
(5-7 przypadków)
Pacjentki niestosujące złożonych hormonalnych środków antykoncepcyjnych
(2 przypadki)
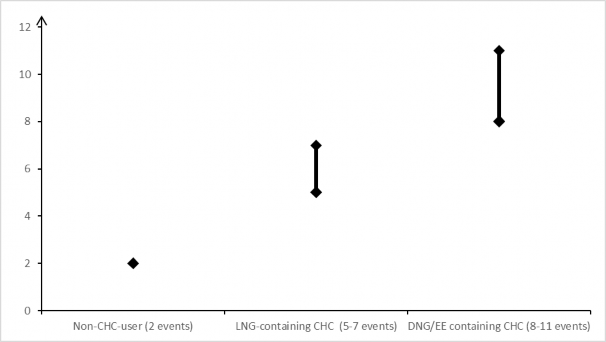
U pacjentek, stosujących złożone hormonalne środki antykoncepcyjne, niezwykle rzadko zgłaszano
Punkt środkowy z zakresu od 5 do 7 na 10 000 kobiet w okresie roku, w oparciu o relatywne ryzyko wynoszące około 2,3 do 3,6 dla złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel w porównaniu do sytuacji, gdy terapia nie jest stosowana.
Na podstawie danych z metaanalizy szacuje się, że ryzyko żylnej choroby zakrzepowo-zatorowej u pacjentek stosujących złozone
hormonalne środki antykoncepcyjne zawierające dienogest i etynyloestradiol jest nieznacznie wyższe w porównaniu do kobiet stosujących złożone hormonalne środki antykoncepcyjne zawierające lewonorgestrel. (Współczynnik zagrożenia 1,57 przy ryzyku w zakresie od 1,07 do 2,30).
przypadki zakrzepicy w innych naczyniach krwionośnych, np. wątrobowych, krezkowych, nerkowych lub w żyłach i tętnicach siatkówki.
Czynniki ryzyka żylnej choroby zakrzepowo-zatorowej
Ryzyko żylnych powikłań zakrzepowo-zatorowych u pacjentek stosujących złożone hormonalne środki antykoncepcyjne może znacząco wzrosnąć w przypadku występowania dodatkowych czynników ryzyka, szczególnie jeśli występuje kilka czynników ryzyka jednocześnie (patrz tabela).
Stosowanie produktu leczniczego Dorin jest przeciwwskazane, jeśli u pacjentki występuje jednocześnie kilka czynników ryzyka, zwiększających ryzyko zakrzepicy żylnej (patrz punkt 4.3). Jeśli u kobiety występuje więcej niż jeden czynnik ryzyka, możliwe jest, że zwiększenie ryzyka jest większe niż suma pojedynczych czynników – w tym przypadku należy ocenić całkowite ryzyko żylnej choroby zakrzepowo-zatorowej. Jeśli ocena stosunku korzyści do ryzyka jest negatywna, nie należy przepisywać złożonych hormonalnych środków antykoncepcyjnych (patrz punkt 4.3).
Tabela: Czynniki ryzyka żylnej choroby zakrzepowo-zatorowej
Czynnik ryzyka
Uwagi
Otyłość (wskaźnik masy ciała (BMI) powyżej 30 kg/m2).
Ryzyko istotnie zwiększa się ze wzrostem BMI. Jest to szczególnie istotne do oceny, jeśli występują również inne czynniki ryzyka.
Długotrwałe unieruchomienie, rozległy zabieg operacyjny, jakikolwiek zabieg operacyjny w obrębie kończyn dolnych lub miednicy, zabieg neurochirurgiczny lub poważny uraz.
Uwaga: tymczasowe unieruchomienie, w tym podróż samolotem >4 godzin, może również stanowić czynnik ryzyka żylnej choroby zakrzepowo- zatorowej, szczególnie u kobiet ze współistniejącymi innymi czynnikami ryzyka.
W powyższych sytuacjach zaleca się przerwanie stosowania tabletek na co najmniej 4 tygodnie przed planowanym zabiegiem chirurgicznym i nie wznawianie stosowania produktu przed upływem dwóch tygodni od czasu powrotu do sprawności ruchowej. Należy stosować inną metodę antykoncepcji, aby uniknąć niezamierzonego zajścia w ciążę.
Należy rozważyć leczenie przeciwzakrzepowe, jeśli stosowania produktu leczniczego Dorin nie przerwano odpowiednio wcześnie.
Dodatni wywiad rodzinny (występowanie żylnych zaburzeń zakrzepowo-zatorowych u rodzeństwa bądź rodziców, szczególnie
w stosunkowo młodym wieku, np. przed 50. rokiem życia).
Jeśli podejrzewa się predyspozycję genetyczną, przed podjęciem decyzji o stosowaniu złożonego hormonalnego środka antykoncepcyjnego kobieta powinna zostać skierowana na konsultację u specjalisty.
Inne schorzenia związane z żylną chorobą zakrzepowo-zatorową.
Nowotwór, toczeń rumieniowaty układowy, zespół hemolityczno-mocznicowy, przewlekłe zapalne choroby jelit (np. choroba Leśniowskiego-Crohna lub wrzodziejące zapalenie jelita grubego) oraz niedokrwistość sierpowatokrwinkowa.
Wiek
Szczególnie w wieku powyżej 35 lat.
Nie osiągnięto konsensusu, co do możliwego wpływu żylaków oraz zakrzepowego zapalenia żył powierzchniowych na wystąpienie lub progresję żylnej choroby zakrzepowo-zatorowej.
Należy uwzględnić zwiększone ryzyko wystąpienia choroby zakrzepowo-zatorowej w ciąży oraz
w szczególności w 6-tygodniowym okresie poporodowym („Wpływ na płodność, ciążę i laktację” patrz
punkt 4.6).
Objawy żylnej choroby zakrzepowo-zatorowej (zakrzepicy żył głębokich oraz zatorowości płucnej)
Należy poinformować pacjentkę, że w razie wystąpienia następujących objawów należy natychmiast zgłosić się do lekarza i powiedzieć personelowi medycznemu, że stosuje się złożone hormonalne środki antykoncepcyjne.
Objawy zakrzepicy żył głębokich (ang. deep vein thrombosis, DVT) mogą obejmować:
obrzęk nogi i (lub) stopy lub obrzęk wzdłuż żyły w nodze;
ból lub tkliwość w nodze, które mogą być odczuwane wyłącznie w czasie stania lub chodzenia;
zwiększoną temperaturę w zmienionej chorobowo nodze; czerwoną lub przebarwioną skórę nogi.
Objawy zatorowości płucnej (ang. pulmonary embolism, PE) mogą obejmować:
nagły napad niewyjaśnionego spłycenia oddechu lub przyspieszenia oddechu;
nagły napad kaszlu, który może być połączony z krwiopluciem;
ostry ból w klatce piersiowej;
ciężkie zamroczenie lub zawroty głowy;
przyspieszone lub nieregularne bicie serca.
Niektóre z tych objawów (np. spłycenie oddechu, kaszel) są niespecyficzne i mogą być niepoprawnie zinterpretowane jako występujące częściej lub mniej poważne stany (np. zakażenia układu oddechowego).
Inne objawy zamknięcia naczyń mogą obejmować: nagły ból, obrzęk oraz lekko niebieskie przebarwienie kończyn.
Jeżeli zamknięcie naczynia wystąpi w oku, objawy mogą obejmować bezbolesne zaburzenia widzenia, które mogą przekształcić się w utratę widzenia. W niektórych przypadkach utrata widzenia może nastąpić niemal natychmiast.
Ryzyko tętniczych zaburzeń zakrzepowo-zatorowych
Badania epidemiologiczne wykazały związek pomiędzy stosowaniem hormonalnych środków antykoncepcyjnych, a zwiększonym ryzykiem tętniczych zaburzeń zakrzepowo-zatorowych (zawału mięśnia sercowego) lub incydentów naczyniowo-mózgowych (np. przemijającego napadu niedokrwiennego, udaru). Przypadki tętniczych zaburzeń zakrzepowo-zatorowych mogą być śmiertelne.
Czynniki ryzyka tętniczych zaburzeń zakrzepowo-zatorowych
Ryzyko wystąpienia tętniczych powikłań zakrzepowo-zatorowych lub napadów naczyniowo- mózgowych u pacjentek stosujących złożone hormonalne środki antykoncepcyjne jest zwiększone u kobiet, u których występują czynniki ryzyka (patrz tabela). Stosowanie produktu leczniczego Dorin jest przeciwwskazane, jeżeli u pacjentki występuje jeden poważny lub jednocześnie kilka czynników ryzyka tętniczych zaburzeń zakrzepowo-zatorowych, które stawiają pacjentkę w grupie wysokiego ryzyka zakrzepicy tętniczej (patrz punkt 4.3). Jeśli u kobiety występuje więcej niż jeden czynnik ryzyka, możliwe jest, że zwiększenie ryzyka jest większe niż suma pojedynczych czynników – w tym przypadku należy ocenić całkowite ryzyko. Jeśli ocena stosunku korzyści do ryzyka jest negatywna, nie należy przepisywać złożonych hormonalnych środków antykoncepcyjnych (patrz punkt 4.3).
Tabela: Czynniki ryzyka tętniczych zaburzeń zakrzepowo-zatorowych
Czynnik ryzyka
Uwagi
Wiek
Szczególnie w wieku powyżej 35 lat.
Palenie
Należy dokładnie pouczyć kobiety, aby nie paliły, jeśli zamierzają stosować złożone hormonalne środki antykoncepcyjne. Kobiety w wieku powyżej 35 lat, które nie zaprzestały palenia, należy dokładnie pouczyć, aby stosowały inną metodę antykoncepcji.
Nadciśnienie tętnicze
Otyłość (wskaźnik masy ciała (BMI) powyżej 30 kg/m2)
Ryzyko istotnie wzrasta wraz ze wzrostem BMI. Jest to szczególnie ważne dla kobiet, u których występują również inne czynniki ryzyka.
Dodatni wywiad rodzinny (występowanie tętniczych zaburzeń zakrzepowo-zatorowych u rodzeństwa bądź rodziców, szczególnie w stosunkowo młodym wieku, np. przed
50. rokiem życia)
Jeśli podejrzewa się predyspozycję genetyczną, przed podjęciem decyzji o stosowaniu złożonego hormonalnego środka antykoncepcyjnego kobieta powinna zostać skierowana na konsultację
u specjalisty.
Migrena
Zwiększenie częstości występowania lub nasilenia migreny w trakcie stosowania złożonych hormonalnych środków antykoncepcyjnych (która może zapowiadać wystąpienie incydentu naczyniowo- mózgowego) może być powodem do natychmiastowego przerwania stosowania.
Inne schorzenia związane ze zdarzeniami niepożądanymi w obrębie naczyń
Cukrzyca, hiperhomocysteinemia, wady zastawkowe serca, migotanie przedsionków, dyslipoproteinemia oraz toczeń rumieniowaty układowy.
Objawy tętniczych zaburzeń zakrzepowo-zatorowych
Należy poinformować pacjentkę, że w razie wystąpienia następujących objawów należy natychmiast zgłosić się do lekarza i powiedzieć personelowi medycznemu, że stosuje się złożone hormonalne środki antykoncepcyjne.
Objawy napadu naczyniowo-mózgowego mogą obejmować:
nagłe zdrętwienie lub osłabienie twarzy, rąk lub nóg, szczególnie po jednej stronie ciała;
nagłe trudności z chodzeniem, zawroty głowy, utratę równowagi lub koordynacji;
nagłe splątanie, trudności z mówieniem lub rozumieniem;
nagłe zaburzenia widzenia w jednym oku lub obydwu oczach;
nagłe, ciężkie lub długotrwałe bóle głowy bez przyczyny;
utratę przytomności lub omdlenie z drgawkami lub bez drgawek.
Przejściowe objawy sugerują, że zdarzenie jest przemijającym napadem niedokrwiennym (ang. transient ischaemic attack, TIA).
Objawy zawału serca (ang. myocardial infarction, MI) mogą być następujące:
ból, uczucie dyskomfortu, ociężałość, uczucie ściskania lub pełności w klatce piersiowej, ramieniu lub poniżej mostka;
uczucie dyskomfortu promieniujące do pleców, szczęki, gardła, ramienia, żołądka;
uczucie pełności, niestrawności lub zadławienia;
pocenie się, nudności, wymioty lub zawroty głowy;
skrajne osłabienie, niepokój lub spłycenie oddechu;
przyspieszone lub nieregularne bicie serca.
Nowotwory
W niektórych badaniach epidemiologicznych wykazano zwiększenie ryzyka raka szyjki macicy u kobiet długotrwale stosujących złożone doustne środki antykoncepcyjne. Wciąż istnieją jednak
rozbieżności dotyczące wpływu zakłócających skutków zachowań seksualnych i innych czynników, takich jak wirus brodawczaka ludzkiego (HPV).
Metaanaliza 54 badań epidemiologicznych wykazała, że u kobiet przyjmujących złożone doustne środki antykoncepcyjne nieznacznie zwiększa się ryzyko względne raka piersi (RR = 1,24). To zwiększone ryzyko zmniejsza się w ciągu 10 lat od zaprzestania stosowania złożonych doustnych środków antykoncepcyjnych w stosunku do podstawowego ryzyka związanego z wiekiem. Ponieważ rak piersi występuje rzadko u kobiet w wieku poniżej 40 lat, zwiększenie liczby rozpoznanych przypadków tej choroby u kobiet stosujących obecnie lub w przeszłości doustne środki antykoncepcyjne jest małe w porównaniu do całkowitego ryzyka wystąpienia raka piersi.
U kobiet stosujących złożone doustne środki antykoncepcyjne w rzadkich przypadkach opisywano występowanie łagodnych nowotworów wątroby, a jeszcze rzadziej złośliwych nowotworów wątroby. W pojedynczych przypadkach nowotwory te prowadziły do wystąpienia zagrażających życiu krwotoków do jamy brzusznej. U kobiet przyjmujących złożone doustne środki antykoncepcyjne w czasie diagnostyki różnicowej silnego bólu w nadbrzuszu, powiększenia wątroby lub objawów krwawienia do jamy brzusznej należy uwzględnić możliwość rozpoznania nowotworu wątroby.
Nowotwory złośliwe mogą zagrażać życiu lub doprowadzić do zgonu. Inne stany kliniczne
U kobiet z hipertriglicerydemią lub dodatnim wywiadem rodzinnym w kierunku hipertriglicerydemii może istnieć zwiększone ryzyko zapalenia trzustki podczas stosowania złożonych doustnych środków antykoncepcyjnych.
Wprawdzie u wielu kobiet przyjmujących złożone doustne środki antykoncepcyjne obserwowano niewielkie zwyżki ciśnienia tętniczego krwi, ale rzadko rozpoznawano istotne klinicznie zwiększenie ciśnienia tętniczego. Jednak, jeżeli podczas przyjmowania złożonego doustnego środka antykoncepcyjnego dojdzie do wystąpienia utrwalonego nadciśnienia tętniczego, lekarz powinien rozważyć zaprzestanie stosowania złożonego doustnego środka antykoncepcyjnego i wdrożenie leczenia przeciwnadciśnieniowego. Jeżeli istnieją wskazania, to po uzyskaniu prawidłowych wartości ciśnienia tętniczego na skutek leczenia przeciwnadciśnieniowego można ponownie rozpocząć stosowanie złożonych doustnych środków antykoncepcyjnych. Jeśli podczas stosowania złożonych doustnych środków antykoncepcyjnych przy istniejącym wcześniej nadciśnieniu, stale podwyższone wartości ciśnienia krwi lub znaczny wzrost ciśnienia krwi nie mogą być odpowiednio kontrolowane leczeniem przeciwnadciśnieniowym, należy zaprzestać stosowania złożonych doustnych środków antykoncepcyjnych.
Opisywano występowanie następujących stanów lub pogorszenie ich przebiegu zarówno w czasie ciąży, jak i podczas stosowania złożonego doustnego środka antykoncepcyjnego, jednak nie dowiedziono w pełni istnienia związku pomiędzy tymi stanami, a stosowaniem złożonego doustnego środka antykoncepcyjnego: żółtaczka i (lub) świąd związane z zastojem żółci, tworzenie kamieni żółciowych, porfiria, toczeń rumieniowaty układowy, zespół hemolityczno-mocznicowy, pląsawica Sydenhama, opryszczka ciężarnych, utrata słuchu związana z otosklerozą.
Egzogenne estrogeny mogą wywoływać lub nasilać objawy dziedzicznego i nabytego obrzęku naczynioruchowego.
Ostre lub przewlekłe zaburzenia czynności wątroby mogą wymagać przerwania stosowania złożonego doustnego środka antykoncepcyjnego do czasu powrotu parametrów czynności wątroby do wartości prawidłowych. Nawrót żółtaczki cholestatycznej i/lub świąd związany z zastojem żółci, które po raz
pierwszy wystąpiły w ciąży lub podczas poprzedniego stosowania steroidowych hormonów płciowych, wymagają zaprzestania przyjmowania złożonych doustnych środków antykoncepcyjnych.
Wprawdzie złożone doustne środki antykoncepcyjne mogą mieć wpływ na insulinooporność obwodową i tolerancję glukozy, ale nie ma dowodów potwierdzających konieczność zmiany ustalonej terapii przeciwcukrzycowej u kobiet przyjmujących złożone doustne środki antykoncepcyjne zawierające małą dawkę estrogenów (<0,05 mg etynyloestradiolu). Niemniej jednak należy dokładnie monitorować stan kobiet chorujących na cukrzycę, zwłaszcza na wczesnym etapie stosowania złożonych doustnych środków antykoncepcyjnych.
Podczas stosowania złożonych doustnych środków antykoncepcyjnych zgłaszano nasilenie depresji endogennej, epilepsji, choroby Leśniowskiego-Crohna oraz wrzodziejącego zapalenia jelita grubego.
Obniżony nastrój i depresja to dobrze znane działania niepożądane stosowania hormonalnych środków antykoncepcyjnych (patrz punkt 4.8). Depresja może mieć ciężki przebieg i jest dobrze znanym czynnikiem ryzyka zachowań samobójczych i samobójstw. Jeśli u pacjentki wystąpią zmiany nastroju lub objawy depresji, również krótko po rozpoczęciu leczenia, zaleca się, aby skonsultowała się z lekarzem.
Niekiedy może pojawić się ostuda, zwłaszcza u kobiet, u których w przeszłości wystąpiła ostuda ciążowa. Kobiety predysponowane do występowania ostudy powinny unikać ekspozycji na słońce i promieniowanie ultrafioletowe podczas stosowania złożonych doustnych środków antykoncepcyjnych
Wymagane badania lekarskie
Przed rozpoczęciem lub wznowieniem stosowania produktu leczniczego Dorin należy zebrać kompletny wywiad lekarski (w tym wywiad rodzinny) i sprawdzić, czy pacjentka nie jest ciąży. Należy dokonać pomiaru ciśnienia tętniczego krwi oraz przeprowadzić badanie fizykalne, biorąc pod uwagę przeciwwskazania (patrz punkt 4.3) oraz ostrzeżenia (patrz punkt 4.4). Ważne jest zwrócenie uwagi kobiety na informacje dotyczące zakrzepicy żył i tętnic, w tym na ryzyko stosowania produktu leczniczego Dorin w porównaniu z innymi złożonymi hormonalnymi środkami antykoncepcyjnymi, objawy żylnej choroby zakrzepowo-zatorowej oraz zaburzeń zakrzepowo-zatorowych tętnic, znane czynniki ryzyka oraz co należy robić w przypadku podejrzenia zakrzepicy.
Należy również polecić kobietom dokładne przeczytanie ulotki i stosowanie się do znajdujących się w niej zaleceń. Częstość i rodzaj badań powinny zostać dobrane na podstawie przyjętych zaleceń
i dostosowane do każdej pacjentki.
Należy poinformować kobiety, że hormonalne środki antykoncepcyjne nie chronią przed zarażeniem wirusem HIV (AIDS) oraz innym chorobami przenoszonymi drogą płciową.
Zmniejszenie skuteczności
Skuteczność złożonych doustnych środków antykoncepcyjnych może być zmniejszona w przypadku np. pominięcia dawki (patrz punkt 4.2), zaburzeń ze strony przewodu pokarmowego (patrz punkt 4.2) lub jednoczesnego stosowania innych produktów leczniczych (patrz punkt 4.5).
Zaburzenia cyklu miesiączkowego
Podczas stosowania wszystkich złożonych doustnych środków antykoncepcyjnych mogą wystąpić nieregularne krwawienia (plamienie lub krwawienie śródcykliczne), zwłaszcza w pierwszych miesiącach przyjmowania tabletek. Dlatego ocena nieregularnych krwawień ma znaczenie po upływie okresu adaptacyjnego trwającego mniej więcej 3 cykle.
Jeżeli nieregularne krwawienia utrzymują się lub występują u kobiety, u której uprzednio występowały regularne cykle, należy rozważyć przyczyny niehormonalne i przeprowadzić odpowiednie badania diagnostyczne w celu wykluczenia nowotworów złośliwych lub ciąży. Może to wymagać także łyżeczkowania jamy macicy.
U niektórych kobiet nie występują krwawienia z odstawienia podczas przerwy w przyjmowaniu tabletek z kolejnych opakowań. Jeżeli złożony doustny środek antykoncepcyjny był przyjmowany zgodnie z zaleceniami opisanymi w punkcie 4.2, prawdopodobieństwo ciąży jest niewielkie. Jeżeli jednak nie przyjmowano złożonego doustnego środka antykoncepcyjnego zgodnie ze wspomnianymi zaleceniami, a podczas 7-dniowej przerwy w przyjmowaniu tabletek nie wystąpiło krwawienie z odstawienia lub jeżeli nie wystąpiły dwa kolejne krwawienia, przed kontynuacją stosowania złożonego doustnego środka antykoncepcyjnego należy upewnić się, że pacjentka nie jest w ciąży.
Produkt leczniczy Dorin zawiera laktozę i sód
Produkt leczniczy Dorin nie powinien być stosowany u pacjentek z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy- galaktozy.
Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę powlekaną, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Liczba przypadków rozpoznania raka piersi u kobiet stosujących złożone doustne środki antykoncepcyjne jest nieznacznie zwiększona. W związku z tym, że rak piersi występuje rzadko u kobiet w wieku poniżej 40 lat to liczba rozpoznań jest niewielka w stosunku do całkowitego ryzyka raka piersi. Związek przyczynowo-skutkowy raka piersi ze złożonymi doustnymi środkami antykoncepcyjnymi nie jest znany.
Guzy wątroby .
Rak szyjki macicy.
Inne
Kobiety z hipertriglicerydemią (wzrasta ryzyko zapalenia trzustki podczas stosowania złożonych doustnych środków antykoncepcyjnych).
Nadciśnienie tętnicze.
Wystąpienie lub pogorszenie objawów, których związek ze stosowaniem COCs nie jest rozstrzygnięty: żółtaczka i (lub) świąd związane z cholestazą, kamica pęcherzyka żółciowego, porfiria, toczeń rumieniowaty układowy, zespół hemolityczno-mocznicowy, pląsawica Sydenhama, opryszczka ciężarnych, otoskleroza związana z utratą słuchu.
Zaburzenia funkcji wątroby.
Zmiany w tolerancji glukozy lub wpływ na insulinooporność obwodową.
Choroba Leśniowskiego-Crohna, wrzodziejące zapalenie jelita grubego.
Ostuda.
Interakcje
Krwawienia śródcykliczne i (lub) nieskuteczność metody antykoncepcyjnej mogą być wynikiem interakcji innych produktów leczniczych (induktorów enzymatycznych) z doustnymi środkami antykoncepcyjnymi (patrz punkt 4.5).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji i Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
Dorin, 0,03 mg + 2 mg, tabletki powlekane
Każda tabletka powlekana zawiera 0,03 mg etynyloestradiolu i 2 mg dienogestu. Substancja pomocnicza o znanym działaniu:
48,53 mg laktozy jednowodnej (patrz punkt 4.4.).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka powlekana.
Biała, okrągła tabletka powlekana.
Sposób podawania: Podanie doustne
Dawkowanie
Sposób przyjmowania produktu leczniczego Dorin
Aby skutecznie zapobiegać ciąży i leczyć umiarkowany trądzik u kobiet, produkt leczniczy Dorin musi być stosowany zgodnie z instrukcją użycia. Aby zachować skuteczność antykoncepcyjną produktu leczniczego Dorin należy zapoznać się z instrukcją w punkcie „Postępowanie w przypadku pominięcia tabletek”.
Widoczna poprawa leczenia objawów trądziku zwykle następuje po co najmniej trzech miesiącach. Dalszą poprawę zgłaszano po sześciu miesiącach leczenia. Po 3-6 miesiącach leczenia, a następnie okresowo, należy ocenić czy jest konieczna kontynuacja leczenia pacjentki.
Należy przyjmować jedną tabletkę produktu leczniczego Dorin każdego dnia, przez 21 dni, popijając niewielką ilością wody w razie konieczności. Tabletki należy przyjmować zgodnie z kolejnością podaną na blistrze. Kolejny blister należy rozpocząć po siedmiodniowej przerwie w przyjmowaniu tabletek. W trakcie siedmiodniowej przerwy nastąpi krwawienie z odstawienia. Krwawienie
z odstawienia zwykle zaczyna się 2-3 dni po przyjęciu ostatniej tabletki z blistra i może się nie zakończyć przed rozpoczęciem następnego opakowania.
Rozpoczęcie stosowania produktu leczniczego Dorin
Jeśli występuje którykolwiek z poniższych stanów lub czynników ryzyka, należy omówić z pacjentką zasadność stosowania produktu leczniczego Dorin.
W razie pogorszenia lub wystąpienia po raz pierwszy któregokolwiek z wymienionych stanów lub czynników ryzyka, kobieta powinna zgłosić się do lekarza prowadzącego, który zadecyduje, czy konieczne jest przerwanie stosowania produktu leczniczego Dorin.
Stosowanie złożonych hormonalnych środków antykoncepcyjnych należy przerwać w przypadku podejrzenia lub potwierdzenia wystąpienia żylnej choroby zakrzepowo-zatorowej lub tętniczych zaburzeń zakrzepowo-zatorowych. W przypadku rozpoczęcia leczenia przeciwzakrzepowego należy wdrożyć odpowiednią, alternatywną metodę antykoncepcji ze względu na działanie teratogenne związane ze stosowaniem terapii przeciwzakrzepowej (pochodne kumaryny).
Uwaga: aby rozpoznać możliwe interakcje jednocześnie stosowanych produktów leczniczych należy się zapoznać z odpowiednimi informacjami ich dotyczącymi.
Wpływ innych produktów leczniczych na działanie produktu leczniczego Dorin.
Mogą wystąpić interakcje z produktami leczniczymi indukującymi enzymy mikrosomalne, co może prowadzić do zwiększonego klirensu hormonów płciowych i powodować wystąpienie krwawienia śródcyklicznego i (lub) brak skuteczności metody antykoncepcyjnej.
Postępowanie
Indukcję enzymatyczną można zaobserwować już po kilku dniach leczenia. Maksymalną indukcję enzymatyczną obserwuje się na ogół w ciągu kilku tygodni. Po odstawieniu leczenia indukcja enzymatyczna może się utrzymywać przez około 4 tygodnie.
Leczenie krótkotrwałe
Kobiety leczone produktami leczniczymi indukującymi enzymy powinny tymczasowo, oprócz stosowania złożonego doustnego środka antykoncepcyjnego, stosować dodatkową metodę mechaniczną lub inną metodę antykoncepcyjną. Metodę mechaniczną należy stosować przez cały okres leczenia produktem leczniczym oraz przez 28 dni po zakończeniu leczenia. Jeśli terapia wykracza poza ilość tabletek w opakowaniu złożonego doustnego środka antykoncepcyjnego, należy natychmiast rozpocząć kolejne opakowanie złożonego doustnego środka antykoncepcyjnego.
Leczenie długotrwałe
U kobiet przyjmujących przez dłuższy czas substancje czynne indukujące enzymy wątrobowe zaleca się stosowanie innej, skutecznej, niehormonalnej metody antykoncepcji.
Przykłady substancji zwiększających klirens złożonych doustnych środków antykoncepcyjnych (i prowadzących -wskutek indukowania enzymów - do zmniejszenia skuteczności złożonych hormonalnych produktów antykoncepcyjnych):
Barbiturany, karbamazepina, fenytoina, prymidon, ryfampicyna i prawdopodobnie również okskarbazepina, topiramat, felbamat, rytonawir, gryzeofulwina oraz produkty zawierające ziele dziurawca zwyczajnego (Hypericum perforatum).
Przykłady substancji o zmiennym wpływie na klirens złożonych doustnych środków antykoncepcyjnych:
Wiele inhibitorów proteazy HIV/HCV i nienukleozydowych inhibitorów odwrotnej transkryptazy może — w przypadku stosowania łącznie ze złożonymi hormonalnymi produktami antykoncepcyjnymi — powodować zwiększenie lub zmniejszenie stężenia estrogenu lub progestagenu W niektórych przypadkach skumulowany efekt tych zmian może być klinicznie istotny.
W związku z tym należy zasięgnąć informacji dotyczących jednoczesnego przepisywania leków przeciw HIV/HCV, aby zidentyfikować potencjalne interakcje i wszelkie związane z nimi zalecenia.
W przypadku jakichkolwiek wątpliwości kobiety stosujące inhibitory proteazy lub nienukleozydowe inhibitory odwrotnej transkryptazy powinny stosować dodatkowe metody antykoncepcji mechanicznej.
Substancje zmniejszające klirens złożonych doustnych środków antykoncepcyjnych (inhibitory enzymów:
Interakcje z inhibitorami enzymów nie są znane.
Jednoczesne stosowanie silnych inhibitorów CYP3A4 może zwiększyć stężenie w osoczu estrogenu lub progesteronu lub obu tych substancji.
Wykazano, że dawka etorykoksybu od 60 do 120 mg/dobę zwiększa stężenie etynyloestradiolu w osoczu 1,4 do 1,6-krotnie, podczas jednoczesnego przyjmowania ze złożonym hormonalnym środkiem antykoncepcyjnym zawierającym 0,035 mg etynyloestradiolu.
Wpływ produktu leczniczego Dorin na inne produkty lecznicze
Złożone doustne środki antykoncepcyjne mogą wpływać na stężenie produktów leczniczych w osoczu i tkankach. Mogą je zarówno zwiększać (np. cyklosporyny), jak i zmniejszać (np. lamotryginy)
Jednak na podstawie badań in vitro, hamowanie enzymów CYP przez dienogest jest mało prawdopodobne w dawkach terapeutycznych.
Dane kliniczne wskazują, że etynyloestradiol hamuje klirens substratów CYP1A2, w wyniku czego ich stężenie może ulec zwiększeniu w stopniu niewielkim (np. teofilina) lub umiarkowanym (tyzanidyna).
Inne rodzaje interakcji
Wyniki badań laboratoryjnych
Stosowanie steroidów antykoncepcyjnych może wpływać na wyniki niektórych badań laboratoryjnych, w tym na: parametry biochemiczne czynności wątroby, tarczycy, nadnerczy i nerek, stężenia białek osoczowych (nośnikowych), np. globuliny wiążącej kortykosteroidy oraz stężenia frakcji lipidów/lipoprotein, parametry metabolizmu węglowodanów i wskaźniki krzepnięcia oraz fibrynolizy. Zmienione wyniki badań laboratoryjnych zazwyczaj pozostają w granicach wartości prawidłowych.
Interakcje farmakodynamiczne
Podczas badań klinicznych u pacjentów leczonych z powodu zakażenia wirusem zapalenia wątroby typu C (HCV) produktami leczniczymi zawierającymi ombitaswir z parytaprewirem i rytonawirem oraz dazabuwir z rybawiryną lub bez, zwiększenie aktywności aminotransferaz (AlAT) do wartości ponad pięciokrotnie większych niż górna granica normy występowało znacząco częściej u kobiet stosujących produkty lecznicze zawierające etynyloestradiol, takie jak złożone hormonalne produkty antykoncepcyjne. Dodatkowo, również u pacjentów leczonych glekaprewirem z pibrentaswirem lub sofosbuwirem z welpataswirem i woksylaprewirem, obserwowano zwiększenie aktywności AlAT u kobiet stosujących leki zawierające etynyloestradiol, takie jak złożone hormonalne środki
antykoncepcyjne (patrz punkt 4.3).
Z tego względu przed rozpoczęciem leczenia za pomocą tych połączeń pacjentki przyjmujące produkt leczniczy Dorin powinny zastosować alternatywne metody antykoncepcji (np. środki antykoncepcyjne zawierające wyłącznie progestagen lub metody niehormonalne). Ponowne stosowanie produktu leczniczego Dorin można rozpocząć po 2 tygodniach od zakończenia leczenia za pomocą wcześniej opisanych połączeń przeciwwirusowych.
Ciąża
Produkt leczniczy Dorin nie jest wskazany do stosowania w okresie ciąży.
Jeżeli kobieta zajdzie w ciążę w trakcie stosowania produktu leczniczego Dorin, należy go natychmiast odstawić.
Wyniki badań epidemiologicznych przeprowadzonych na szeroką skalę, nie wykazują ani zwiększonego ryzyka wad wrodzonych u dzieci urodzonych przez kobiety stosujące złożone doustne środki antykoncepcyjne przed zajściem w ciążę, ani działania teratogennego w przypadku nieumyślnego stosowania złożonych doustnych środków antykoncepcyjnych w ciąży.
W badaniach na zwierzętach stwierdzono działania niepożądane w okresie ciąży i laktacji (patrz punkt 5.3). Na podstawie tych danych, pochodzących z badań na zwierzętach nie można wykluczyć działań niepożądanych ze względu na działanie hormonalne substancji czynnych. Jednakże, ogólne doświadczenie dotyczące stosowania złożonych doustnych środków antykoncepcyjnych w okresie ciąży nie wskazuje na występowanie rzeczywistych działań niepożądanych u ludzi.
Podejmując decyzję o ponownym rozpoczęciu stosowania produktu leczniczego Dorin, należy wziąć pod uwagę zwiększone ryzyko żylnej choroby zakrzepowo-zatorowej u kobiet w okresie poporodowym (patrz punkty 4.2 i 4.4).
Karmienie piersią
Złożone doustne środki antykoncepcyjne mogą wpływać na laktację, zmniejszając ilość i zmieniając skład mleka kobiecego. Niewielkie ilości steroidów antykoncepcyjnych i (lub) ich metabolitów mogą wydzielać się z mlekiem kobiet stosujących złożone doustne środki antykoncepcyjne. Takie ilości mogą wpływać na dziecko. Dlatego produkt leczniczy Dorin nie powinien być stosowany w okresie karmienia piersią, aż do całkowitego odstawienia dziecka od piersi.
Nie przeprowadzono badań nad wpływem produktu leczniczego na zdolność prowadzenia pojazdów i obsługiwania maszyn. U kobiet stosujących złożone doustne środki antykoncepcyjne nie obserwowano wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Częstość występowania działań niepożądanych zgłaszanych w badaniach klinicznych (N = 4942) z produktem leczniczym zawierającym etynylestradiol i dienogest, we wskazaniu doustna antykoncepcja u kobiet, które stosują doustną antykoncepcję podsumowano w tabeli poniżej.
W obrębie każdej grupy o określonej częstości występowania, działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Dodatkowe działania niepożądane zidentyfikowane tylko podczas nadzoru po wprowadzeniu do obrotu, dla których częstość występowania nie została oszacowana, są wymienione w kolumnie częstość „nieznana”.
Klasyfikacja układów i narządów (MedDRA) | Częstość występowania działań niepożądanych | |||
Często (≥1/100 do <1/10) | Niezbyt często (≥1/1 000 do <1/100) | Rzadko (≥1/10 000 do <1/1000) | Nieznana (częstość nie może być określona na podstawie dostępnych danych) | |
Zakażenia | zapalenie pochwy | zapalenie jajników | ||
i zarażenia | lub zapalenie | i jajowodów, zakażenie | ||
pasożytnicze | pochwy | dróg moczowych, | ||
i sromu, | zapalenie pęcherza | |||
kandydoza i inne | moczowego, zapalenie | |||
zakażenia | sutka, zapalenie szyjki | |||
grzybicze pochwy | macicy, zakażenie | |||
i sromu | grzybicze, kandydoza, opryszczka jamy ustnej, | |||
grypa, zapalenie oskrzeli, | ||||
zapalenie zatok, zakażenia | ||||
górnych dróg | ||||
oddechowych, zakażenia | ||||
wirusowe | ||||
Nowotwory | mięśniak gładki macicy, | |||
łagodne, złośliwe i | tłuszczak piersi | |||
nieokreślone (w | ||||
tym torbiele | ||||
i polipy) | ||||
Zaburzenia krwi i układu chłonnego | anemia | |||
Zaburzenia układu | nadwrażliwość | nasilenie objawów | ||
immunologicznego | dziedzicznego i | |||
nabytego obrzęku | ||||
naczynioruchowego | ||||
Zaburzenia endokrynologiczne | wirylizm | |||
Zaburzenia metabolizmu i odżywiania | zwiększony apetyt | jadłowstręt | ||
Zaburzenia psychiczne | obniżenie nastroju | depresja, zaburzenia psychiczne, bezsenność, zaburzenia snu, agresja | zmiany nastroju, zmniejszone libido, zwiększone libido | |
Zaburzenia układu nerwowego | ból głowy | zawroty głowy, migrena | udar niedokrwienny, zaburzenia naczyniowo- mózgowe, dystonia | |
Zaburzenia oka | suchość oczu, podrażnienie oczu, oscylopsja, zaburzenia widzenia | nietolerancja soczewek kontaktowych | ||
Zaburzenia ucha i błędnika | nagła utrata słuchu, szumy uszne, zawroty głowy, zaburzenia słuchu | |||
Zaburzenia serca | zaburzenia sercowo- naczyniowe, tachykardia1 | |||
Zaburzenia | nadciśnienie tętnicze, | żylna choroba | ||
naczyniowe | niedociśnienie | zakrzepowo-zatorowa, | ||
tętnicze | tętnicze zaburzenia | |||
zakrzepowo-zatorowe, | ||||
zatorowość płucna, zakrzepowe zapalenie żył, nadciśnienie rozkurczowe, zaburzenia ortostatyczne, uderzenia gorąca, żylaki, dolegliwości ze strony żył, ból żył | ||||
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | astma, hiperwentylacja | |||
Zaburzenia żołądka i jelit | ból brzucha2, nudności, wymioty, biegunka | zapalenie żołądka, zapalenie jelit, dyspepsja | ||
Zaburzenia skóry i | trądzik, łysienie, | alergiczne zapalenie | pokrzywka, rumień | |
tkanki podskórnej | wysypka3, | skóry, atopowe zapalenie | guzowaty, rumień | |
świąd4 | skóry i (lub) neurodermit, | wielopostaciowy | ||
egzema, łuszczyca, | ||||
nadmierne pocenie się, | ||||
ostuda, zaburzenia | ||||
pigmentacji i (lub) | ||||
nasilona pigmentacja, | ||||
łojotok, łupież, hirsutyzm, | ||||
zmiany skórne, reakcje | ||||
skórne, „skórka | ||||
pomarańczowa” (cellulit), | ||||
„pajączki” naczyniowe | ||||
Zaburzenia | ból pleców, dolegliwości | |||
mięśniowo- | mięśniowo- szkieletowe, | |||
szkieletowe i | ból mięśni, ból kończyn | |||
tkanki łącznej | ||||
Zaburzenia układu | ból piersi5 | nieprawidłowe | dysplazja szyjki macicy, | wydzielina z piersi |
rozrodczego i | krwawienia z | torbiele przydatków | ||
piersi | odstawienia6, | macicy, ból przydatków | ||
krwawienia | macicy, torbiele piersi, | |||
śródcykliczne7, | zmiany włóknisto- | |||
powiększenie piersi8, obrzęk piersi, bolesne miesiączkowanie, | torbielowate piersi, ból podczas stosunku płciowego, mlekotok, | |||
zmiany wydzieliny z | zaburzenia | |||
pochwy, torbiele | miesiączkowania | |||
jajników, ból | ||||
miednicy | ||||
Wady wrodzone, choroby rodzinne i genetyczne | wystąpienie dodatkowego gruczołu sutkowego (bez objawów klinicznych) | |||
Zaburzenia ogólne i stany w miejscu podania | uczucie zmęczenia9 | ból w klatce piersiowej, obrzęk obwodowy, choroby grypopodobne, stan zapalny, gorączka, drażliwość | retencja płynów | |
Badania | zwiększenie | zwiększenie stężenia | ||
diagnostyczne | masy ciała | triglicerydów we krwi, | ||
hipercholesterolemia, | ||||
zmniejszenie masy | ||||
ciała, zmiany masy | ||||
ciała |
1W tym przyspieszona akcja serca.
2W tym ból nadbrzusza i podbrzusza, dolegliwości ze strony brzucha, dyskomfort i wzdęcia.
3W tym wysypka plamista.
4W tym świąd uogólniony.
5W tym uczucie dyskomfortu piersi i tkliwość piersi.
6W tym menorrhagia (miesiączkowanie obfite), skąpe i krótkotrwałe miesiączkowanie, miesiączkowanie sporadyczne oraz brak miesiączki.
7W tym krwotok z pochwy i metrorrhagia (krwawienie maciczne).
8W tym przekrwienie piersi i obrzęk piersi.
9W tym osłabienie i złe samopoczucie.
Opisując poszczególne działania niepożądane, w każdym przypadku zastosowano najbardziej odpowiednie wyrażenia MedDRA. Jednakże należy wziąć pod uwagę ich synonimy lub związane z tymi działaniami zaburzenia, które nie zostały wymienione.
Opis wybranych działań niepożądanych
U kobiet stosujących złożone doustne środki antykoncepcyjne obserwowano następujące ciężkie działania niepożądane, które zostały omówione w punkcie 4.4:
Nowotwory
Ostra toksyczność doustna etynyloestradiolu i dienogestu jest niewielka. Jesli np. dziecko przyjmie kilka tabletek produktu leczniczego Dorin w tym samym czasie, objawy toksyczne sa mało prawdopodobne. W przypadku przedawkowania mogą wystąpić następujące objawy: nudności, wymioty oraz krwawienie z odstawienia. Krwawienie z odstawienia może wystąpić nawet u dziewcząt przed pierwszą miesiączką, jeśli omyłkowo przyjęły ten produkt leczniczy. W większości przypadków nie jest wymagane leczenie specjalistyczne. W razie konieczności należy zastosować leczenie wspomagające.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Etynyloestradiol
Wchłanianie
Etynyloestradiol podany doustnie ulega szybkiemu i całkowitemu wchłonięciu. Maksymalne stężenie w surowicy wynosi około 67 pg/ml i występuje w ciągu 1,5 do 4 godzin. Etynyloestradiol jest
w dużym stopniu metabolizowany podczas wchłaniania oraz w wyniku efektu pierwszego przejścia w wątrobie, przez co jego średnia dostępność biologiczna po podaniu doustnym wynosi około 44%.
Dystrybucja
Etynyloestradiol jest w dużym stopniu (około 98%), lecz niespecyficznie wiązany z albuminami surowicy i powoduje zwiększenie stężenia globuliny wiążącej hormony płciowe SHBG (ang. Sex Hormone-Binding Globulin,) w surowicy. Objętość dystrybucji etynyloestradiolu wynosi 2,8 – 8,6 l/kg.
Metabolizm
Etynyloestradiol ulega przedukładowemu sprzęganiu w błonie śluzowej jelita cienkiego i wątrobie. Jest on metabolizowany głównie poprzez aromatyczną hydroksylację, w wyniku której powstają różne hydroksylowane i metylowane metabolity, wykrywane w surowicy w postaci wolnych metabolitów lub sprzężonych glukuronianów lub siarczanów. Klirens wynosi około 2,3 do 7 ml/min/kg.
Eliminacja
Stężenie etynyloestradiolu w surowicy zmniejsza się w dwóch fazach, określanych przez okresy półtrwania wynoszące odpowiednio około 1 godziny i 10 – 20 godzin. Etynyloestradiol nie jest wydalany w postaci niezmienionej. Metabolity wydalane są z moczem i żółcią w stosunku 4:6. Okres półtrwania wydalania metabolitu wynosi około 1 doby.
Stan stacjonarny
Stan stacjonarny ustala się w drugiej połowie cyklu leczenia, kiedy stężenie etynyloestradiolu w surowicy jest około dwa razy większe w porównaniu z dawką pojedynczą.
Dienogest
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Grupa farmakoterapeutyczna: Progestageny i estrogeny, produkty złożone; antyandrogeny i estrogeny. Kod ATC: G03AA16 i G03HB
Wszystkie hormonalne metody antykoncepcji mają bardzo wysoki stopień skuteczności, pod warunkiem, że są stosowane właściwie. Skuteczność tej metody może być zmniejszona, jeżeli pacjentka nie stosuje się do instrukcji użycia (np. zapomni zażyć tabletki).
Na podstawie badań klinicznych dotyczących stosowania połączeń etynylestradiolu z diogenestem wyliczono indeks Pearla:
Indeks Pearl'a dla niepowodzenia metody: 0,454 (górna dwustronna granica przedziału ufności 95% : 0,701)
Ogólny Indeks Pearl'a: 0,182 (górna dwustronna granica przedziału ufności 95% : 0,358)
Produkt leczniczy Dorin to złożony doustny środek antykoncepcyjny o właściwościach antyandrogennych, zawierający etynyloestradiol i progestagen dienogest.
Działanie antykoncepcyjne produktu leczniczego Dorin polega na interakcji różnych czynników, z których najważniejsze to hamowanie owulacji i zmiany wydzieliny szyjki macicy.
Znaczące działanie antyandrogenne skojarzonego stosowania etynyloestradiolu + dienogestu polega między innymi na zmniejszaniu stężenia androgenów w surowicy. Wieloośrodkowe badania połączenia etynyloestradiol + dienogest wykazały znaczącą poprawę objawów trądziku od łagodnego do umiarkowanego oraz korzystny wpływ na objawy łojotoku.
Dienogest jest pochodną 19-nortestosteronu, in vitro wykazuje 10- do 30-krotnie mniejsze powinowactwo do receptora progesteronowego w porównaniu z innymi syntetycznymi progestagenami. Badania in vivo przeprowadzone na zwierzętach pokazały, że wykazuje on znaczne działanie progesteronowe oraz antyandrogenowe. In vivo, dienogest nie wykazuje znaczącego działania androgenowego, mineralokortykosteroidowego ani glikokortykosteroidowego.
Ustalono, że dawka wyłącznie dienogestu hamująca owulację wynosi 1 mg/dzień. Zastosowanie dużych dawek doustnych środków antykoncepcjyjnych (50 μg etynylestradiolu)
zmniejsza ryzyko raka błony śluzowej macicy i jajników. Nie potwierdzono, czy dotyczy to również mniejszych dawek doustnych środków antykoncepcyjnych.
Wchłanianie
Dienogest podany doustnie jest szybko i praktycznie całkowicie wchłaniany. Po jednorazowym podaniu tabletki produktu Dorin, maksymalne stężenie produktu leczniczego w surowicy występuje po około 2,5 godziny i wynosi 51 ng/ml. Bezwzględna dostępność biologiczna dienogestu z etynyloestradiolem wynosi około 96%.
Dystrybucja
Dienogest wiąże się z albuminami surowicy, a nie wiąże się z globulinami wiążącymi hormony płciowe (SHBG) i globulinami wiążącymi kortykosteroidy (CBG). Około 10% całkowitego stężenia substancji czynnej w surowicy występuje w postaci niezwiązanego steroidu. 90% wiąże się niespecyficznie z albuminami. Zwiększenie stężenia SHBG indukowane etynyloestradiolem nie wpływa na wiązanie dienogestu z białkami osocza. Pozorna objętość dystrybucji dienogestu wynosi 37 do 45 l.
Metabolizm
Dienogest metabolizowany jest głównie na drodze hydroksylacji i sprzęgania do metabolitów, które z endokrynologicznego punktu widzenia, są w zasadzie nieaktywne. Ponieważ metabolity te są bardzo szybko usuwane z osocza, w ludzkim osoczu nie stwierdza się obecności żadnych istotnych metabolitów obok niezmienionego dienogestu. Klirens całkowity (Cl/F) po jednorazowym podaniu wynosi 3,6 l/h.
Eliminacja
Stężenie dienogestu w surowicy zmniejsza się z okresem półtrwania wynoszącym około 9 godzin. Tylko nieznaczne ilości dienogestu wydalane są w postaci niezmienionej przez nerki. Po przyjęciu doustnym 0,1 mg dienogestu na kilogram masy ciała, stosunek jego wydalania z moczem do wydalania z kałem wynosi 3:2. Około 86% przyjętej dawki ulega wydaleniu w ciągu 6 dni, z czego większość (42%) z moczem w ciągu pierwszych 24 godzin.
Stan stacjonarny
Na farmakokinetykę dienogestu nie wpływa stężenie SHBG. W czasie przyjmowania produktu leczniczego raz na dobę, jego stężenie w surowicy zwiększa się 1,5-krotnie, osiągając stan stacjonarny po 4 dobach stosowania.
Badania przedkliniczne z etynyloestradiolem i dienogestem ujawniły oczekiwane estrogenowe i progestagenowe skutki działania.
Dane przedkliniczne, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród, nie ujawniają występowania szczególnego zagrożenia dla człowieka. Jednak należy pamiętać, że steroidowe hormony płciowe mogą nasilać rozwój niektórych tkanek i nowotworów zależnych od hormonów.
Rdzeń tabletki:
Laktoza jednowodna Skrobia kukurydziana Maltodekstryna Magnezu stearynian
Otoczka tabletki:
Laktoza jednowodna Hypromeloza 15 cP Tytanu dwutlenek (E171) Makrogol 4000
Sodu cytrynian
Nie dotyczy.
Brak szczególnych środków ostrożności dotyczących przechowywania produktu leczniczego.
Wielkości opakowań:
21 tabletek – 1 blister po 21 sztuk
42 tabletki – 2 blistry po 21 sztuk
63 tabletki – 3 blistry po 21 sztuk
84 tabletki – 4 blistry po 21 sztuk
126 tabletek – 6 blistrów po 21 sztuk
Blistry PVC/PE/PVDC/Aluminium w tekturowym pudełku.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań dotyczących usuwania.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
SUN-FARM Sp. z o.o.
ul. Dolna 21
05-092 Łomianki
Pozwolenie nr: 20602
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 02.10.2012 Data przedłużenia pozwolenia: 02.11.2018
04.2023











