Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Leczenie epizodów ciężkiej depresji.
Leczenie lęku napadowego z agorafobią lub bez agorafobii.
Leczenie lęku społecznego (fobii społecznej).
Leczenie zaburzeń lękowych uogólnionych.
Leczenie zaburzeń obsesyjno-kompulsyjnych.
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji Interakcje farmakodynamiczne
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Szczególne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Betesda, 20 mg/ml, krople doustne, roztwór
Każdy 1 ml roztworu zawiera 20 mg escytalopramu (Escitalopramum) (w postaci 25,56 mg escytalopramu szczawianu).
Każda kropla roztworu zawiera 1 mg escytalopramu. Substancja pomocnicza o znanym działaniu:
Każda kropla roztworu zawiera 4,7 mg etanolu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Krople doustne, roztwór.
Przezroczysty roztwór o gorzkim smaku.
Nie wykazano bezpieczeństwa stosowania dawek dobowych powyżej 20 mg (20 kropli).
Ten produkt leczniczy podaje się w pojedynczej dawce dobowej i może być przyjmowany
z pokarmem lub bez pokarmu. Może być mieszany w wodą, sokiem pomarańczowym lub sokiem jabłkowym.
Butelkę należy obrócić pionowo w dół. Jeśli nie uda się uzyskać żadnej kropli produktu, należy lekko postukać dłonią w dno butelki aby zainicjować dozowanie kropli.
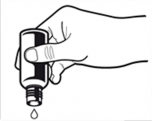
Epizody ciężkiej depresji
Zwykle stosuje się dawkę 10 mg (10 kropli) raz na dobę. W zależności od reakcji pacjenta dawka może zostać zwiększona maksymalnie do 20 mg (20 kropli) na dobę.
Zwykle potrzeba 2 do 4 tygodni, aby uzyskać działanie przeciwdepresyjne. Po ustąpieniu objawów leczenie należy kontynuować przez co najmniej 6 miesięcy, w celu uzyskania trwałej odpowiedzi na leczenie.
Zespół lęku napadowego z agorafobią lub bez agorafobii
Zalecana dawka początkowa wynosi 5 mg (5 kropli) przez pierwszy tydzień leczenia przed zwiększeniem dawki do 10 mg (10 kropli) na dobę. Dawkę można następnie zwiększać maksymalnie do 20 mg (20 kropli) na dobę, w zależności od indywidualnej reakcji pacjenta.
Maksymalną skuteczność osiąga się po około 3 miesiącach stosowania produktu leczniczego.
Leczenie trwa kilka miesięcy.
Fobia społeczna
Zwykle stosuje się dawkę 10 mg (10 kropli) raz na dobę. Zazwyczaj potrzeba 2 do 4 tygodni, aby uzyskać poprawę stanu pacjenta. Dawkę można następnie zmniejszyć do 5 mg (5 kropli) lub zwiększyć maksymalnie do 20 mg (20 kropli) na dobę, w zależności od indywidualnej reakcji pacjenta.
Fobia społeczna jest chorobą o przebiegu przewlekłym i zwykle zalecane jest kontynuowanie leczenia przez 12 tygodni, w celu uzyskania trwałej odpowiedzi na terapię. Przez co najmniej 6 miesięcy analizowano długoterminową terapię u pacjentów odpowiadających na leczenie i można rozważyć indywidualnie jej zastosowanie, w celu zapobiegania nawrotom choroby; efekty prowadzonej terapii należy oceniać w regularnych odstępach czasu.
Fobia społeczna jest dobrze zdefiniowanym rozpoznaniem dla określonej choroby, której nie należy mylić z nadmierną nieśmiałością. Farmakoterapia jest wskazana tylko wtedy, kiedy choroba ta
w istotny sposób utrudnia wykonywanie pracy zawodowej i kontakty społeczne.
Nie przeprowadzono badań porównujących omawiane leczenie z terapią poznawczo-behawioralną. Farmakoterapia jest częścią kompleksowego postępowania terapeutycznego.
Zaburzenia lękowe uogólnione
Dawka początkowa wynosi 10 mg (10 kropli) raz na dobę. W zależności od indywidualnej reakcji pacjenta, dawka może być zwiększona do maksymalnej dawki 20 mg (20 kropli) na dobę.
Przez co najmniej 6 miesięcy analizowano długoterminową terapię u pacjentów odpowiadających na leczenie, otrzymujących 20 mg (20 kropli) escytalopramu na dobę. Korzyści wynikające
z prowadzonej terapii i stosowana dawka powinny być oceniane w regularnych odstępach czasu (patrz
punkt 5.1).
Zaburzenia obsesyjno-kompulsyjne
Dawka początkowa wynosi 10 mg (10 kropli) raz na dobę. Dawkę można następnie zwiększać maksymalnie do 20 mg (20 kropli) na dobę, w zależności od indywidualnej reakcji pacjenta.
Zaburzenia obsesyjno-kompulsyjne są chorobą przewlekłą, dlatego pacjentów należy leczyć przez wystarczająco długi czas, aby upewnić się, że są wolni od objawów choroby.
Korzyści wynikające z prowadzonej terapii i stosowana dawka powinny być oceniane w regularnych odstępach czasu (patrz punkt 5.1).
Pacjenci w podeszłym wieku (w wieku powyżej 65 lat)
Dawka początkowa wynosi 5 mg (5 kropli) na dobę. W zależności od indywidualnej reakcji pacjenta, dawkę można zwiększyć do 10 mg (10 kropli) na dobę (patrz punkt 5.2).
Nie badano skuteczności stosowania tego produktu leczniczego w fobii społecznej u pacjentów w podeszłym wieku.
Dzieci i młodzież (w wieku poniżej 18 lat)
Tego produktu leczniczego nie należy stosować w leczeniu dzieci i młodzieży w wieku poniżej 18 lat (patrz punkt 4.4).
Zaburzenia czynności nerek
U pacjentów z łagodnym lub umiarkowanym zaburzeniem czynności nerek nie jest wymagane dostosowanie dawkowania. Zaleca się zachowanie ostrożności u pacjentów z ciężką niewydolnością nerek (klirens kreatyniny poniżej 30 ml/min) (patrz punkt 5.2).
Zaburzenia czynności wątroby
U pacjentów z łagodnym lub umiarkowanym zaburzeniem czynności wątroby, podczas pierwszych dwóch tygodni leczenia zalecane jest stosowanie początkowej dawki 5 mg (5 kropli) na dobę. Dawkę można następnie zwiększać do 10 mg (10 kropli) na dobę, w zależności od indywidualnej reakcji pacjenta. Zaleca się zachować uwagę i szczególną ostrożność podczas dostosowywania dawki produktu u pacjentów z poważnym zaburzeniem czynności wątroby (patrz punkt 5.2).
Pacjenci wolno metabolizujący leki z udziałem izoenzymu CYP2C19
U pacjentów, którzy wolno metabolizują leki z udziałem izoenzymu CYP2C19, zaleca się dawkę początkową 5 mg (5 kropli) na dobę w pierwszych dwóch tygodniach leczenia. Dawkę można następnie zwiększać do 10 mg (10 kropli) na dobę, w zależności od indywidualnej reakcji pacjenta (patrz punkt 5.2).
Objawy odstawienia podczas przerywania leczenia
Należy unikać nagłego przerywania leczenia. W razie decyzji o przerwaniu leczenia escytalopramem dawkę należy stopniowo zmniejszać przez okres co najmniej 2 tygodni, aby zmniejszyć ryzyko wystąpienia objawów odstawienia (patrz punkt 4.4 i 4.8). W razie wystąpienia objawów nietolerowanych przez pacjenta, będących następstwem zmniejszania dawki lub odstawienia leku, należy rozważyć wznowienie stosowania poprzednio przepisanej dawki. Następnie lekarz może kontynuować zmniejszanie dawki w bardziej stopniowy sposób.
Nadwrażliwość na substancję czynną lub którąkolwiek substancję pomocniczą wymienioną w punkcie
6.1.
Jednoczesne leczenie z nieselektywnymi, nieodwracalnymi inhibitorami monoaminooksydazy (MAO) jest przeciwwskazane ze względu na ryzyko zespołu serotoninowego z pobudzeniem, drżeniem, hipertermią itp. (patrz punkt 4.5).
Leczenie skojarzone escytalopramem oraz odwracalnymi inhibitorami MAO-A (np. moklobemidem) lub odwracalnym nieselektywnym inhibitorem MAO – linezolidem jest przeciwwskazane ze względu na ryzyko wystąpienia zespołu serotoninowego (patrz punkt 4.5).
Escytalopram jest przeciwwskazany u pacjentów z rozpoznanym wydłużeniem odstępu QT lub
z wrodzonym zespołem wydłużonego odstępu QT.
Przeciwwskazane jest stosowanie escytalopramu z innymi produktami leczniczymi powodującymi wydłużenie odstępu QT (patrz punkt 4.5).
Wymienione poniżej specjalne ostrzeżenia i środki ostrożności dotyczące stosowania odnoszą się do grupy selektywnych inhibitorów wychwytu zwrotnego serotoniny (SSRI – Selective Serotonin
Reuptake Inhibitors).
Stosowanie u dzieci i młodzieży w wieku poniżej 18 lat
Tego produktu leczniczego nie należy stosować w leczeniu dzieci i młodzieży w wieku poniżej 18 lat. W toku prób klinicznych zachowania samobójcze (próby samobójcze oraz myśli samobójcze) oraz wrogość (szczególnie agresję, zachowania buntownicze i przejawy gniewu) obserwowano częściej
u dzieci i młodzieży leczonych lekami przeciwdepresyjnymi niż w grupie, której podawano placebo. Jeśli, w oparciu o istniejącą potrzebę kliniczną, podjęta jednak zostanie decyzja o leczeniu, należy uważnie obserwować pacjenta pod kątem wystąpienia objawów samobójczych. Ponadto, brak długoterminowych danych dotyczących bezpieczeństwa stosowania u dzieci i młodzieży dotyczących wzrostu, dojrzewania oraz rozwoju poznawczego i rozwoju zachowania.
Lęk paradoksalny
U niektórych pacjentów z lękiem napadowym może nastąpić nasilenie objawów lękowych
w początkowym okresie leczenia środkami przeciwdepresyjnymi. Ta paradoksalna reakcja zazwyczaj ustępuje w ciągu dwóch tygodni w trakcie kontynuowanego leczenia. Zaleca się rozpoczynanie leczenia od małej dawki, w celu zmniejszenia prawdopodobieństwa wystąpienia stanów lękowych (patrz punkt 4.2).
Napady drgawkowe
Należy przerwać stosowanie escytalopramu u każdego pacjenta, u którego wystąpiły drgawki po raz pierwszy lub jeśli zwiększyła się częstość napadów drgawkowych (u pacjentów z uprzednio zdiagnozowaną padaczką). U pacjentów z nieustabilizowaną padaczką należy unikać stosowania leków z grupy SSRI, a pacjenci z opanowaną farmakologicznie padaczką powinni pozostawać pod ścisłą kontrolą.
Mania
Należy zachować ostrożność podczas stosowania leków z grupy SSRI u pacjentów z manią lub hipomanią w wywiadzie. Leki z grupy SSRI należy odstawić w razie wystąpienia u pacjenta fazy maniakalnej.
Cukrzyca
U pacjentów chorych na cukrzycę leczenie lekami z grupy SSRI może wpływać na kontrolę glikemii (hipoglikemia lub hiperglikemia). Może okazać się konieczne dostosowanie dawkowania insuliny
i (lub) doustnych leków przeciwcukrzycowych.
Samobójstwo, myśli samobójcze lub kliniczne nasilenie choroby
Depresja związana jest ze zwiększonym ryzykiem występowania myśli samobójczych, samookaleczania oraz samobójstw (zachowania samobójcze). Ryzyko to utrzymuje się do czasu uzyskania pełnej remisji. Ponieważ poprawa może nastąpić dopiero po kilku pierwszych tygodniach leczenia lub później, do tego czasu pacjentów należy poddać ścisłej obserwacji. Z doświadczeń klinicznych wynika, że ryzyko samobójstwa może zwiększyć się we wczesnym etapie powrotu
do zdrowia.
Inne zaburzenia psychiczne, w których przepisywany jest ten produkt leczniczy, mogą być również związane ze zwiększonym ryzykiem zachowań samobójczych. Ponadto zaburzenia te mogą współistnieć z ciężkimi zaburzeniami depresyjnymi. W związku z tym u pacjentów leczonych
z powodu innych zaburzeń psychicznych należy podjąć takie same środki ostrożności, jak u pacjentów
z ciężkimi zaburzeniami depresyjnymi.
Pacjenci z myślami samobójczymi w wywiadzie lub pacjenci przejawiający przed rozpoczęciem leczenia znacznego stopnia skłonności samobójcze, należą do grupy zwiększonego ryzyka myśli samobójczych lub prób samobójczych i należy ich poddać ścisłej obserwacji w trakcie leczenia.
Metaanaliza kontrolowanych placebo badań klinicznych leków przeciwdepresyjnych stosowanych
u dorosłych pacjentów z zaburzeniami psychicznym wykazała zwiększone (w porównaniu z placebo) ryzyko zachowań samobójczych u pacjentów w wieku poniżej 25 lat, stosujących produkty przeciwdepresyjne. W trakcie leczenia, zwłaszcza na początku terapii i po zmianie dawki, należy
ściśle obserwować pacjentów, szczególnie z grupy podwyższonego ryzyka.
Pacjentów (oraz ich opiekunów) należy uprzedzić o konieczności zwrócenia uwagi na każdy objaw klinicznego nasilenia choroby, zachowania lub myśli samobójcze oraz nietypowe zmiany
w zachowaniu, a w razie ich wystąpienia, o konieczności niezwłocznego zwrócenia się do lekarza.
Akatyzja/niepokój psychomotoryczny
Stosowanie leków z grupy SSRI lub SNRI może wiązać się z rozwojem akatyzji, która charakteryzuje się subiektywnie nieprzyjemnym lub trudnym do zniesienia niepokojem i potrzebą ruchu, a także
z często towarzyszącą niemożnością stania lub siedzenia w miejscu. Jest to bardziej prawdopodobne w ciągu pierwszych kilku tygodni leczenia. W przypadku pacjentów, u których wystąpią te objawy, zwiększenie dawki może być szkodliwe.
Hiponatremia
Rzadko podczas leczenia lekami z grupy SSRI informowano o występowaniu hiponatremii, prawdopodobnie spowodowanej przez zespół nieprawidłowego wydzielania hormonu antydiuretycznego (SIADH) i na ogół ustępującej po odstawieniu leku. Należy zachować ostrożność u zagrożonych pacjentów, tzn. osób w podeszłym wieku, pacjentów z marskością wątroby lub jednocześnie leczonych lekami, które powodują hiponatremię.
Krwotoki
Podczas stosowania leków z grupy SSRI informowano o krwawieniach śródskórnych, takich jak: wybroczyny i plamica. U pacjentów leczonych lekami z grupy SSRI należy zachować ostrożność zwłaszcza wtedy, gdy równocześnie stosuje się u nich doustne leki przeciwzakrzepowe, leki wpływające na czynność płytek krwi (np. nietypowe leki neuroleptyczne oraz pochodne fenotiazyny, większość leków przeciwdepresyjnych o budowie trójpierścieniowej, kwas acetylosalicylowy
i niesteroidowe leki przeciwzapalne (NLPZ), tyklopidynę oraz dipyridamol) oraz u pacjentów z rozpoznaną skazą krwotoczną.
Leki z grupy SSRI i SNRI mogą zwiększać ryzyko wystąpienia krwotoku poporodowego (patrz
punkty 4.6 i 4.8).
Leczenie elektrowstrząsami
Doświadczenia kliniczne w jednoczesnym stosowaniu leków z grupy SSRI i leczeniu elektrowstrząsami są ograniczone i dlatego zaleca się zachowanie ostrożności.
Zespół serotoninowy
Należy zachować ostrożność, stosując jednocześnie escytalopram z lekami o działaniu serotoninergicznym, takimi jak: sumatryptan lub inne tryptany, opioidy (takie jak buprenorfina i tramadol) oraz tryptofan.
U pacjentów stosujących równocześnie produkty lecznicze leki z grupy SSRI oraz produkty lecznicze o działaniu serotoninergicznym rzadko donoszono o wystąpieniu zespołu serotoninowego. Na takie rozpoznanie wskazuje jednoczesne pojawienie się następujących objawów: pobudzenia, drżeń mięśniowych, drgawek klonicznych mięśni i hipertermii. Jeśli wystąpi taki zespół objawów, należy natychmiast odstawić lek z grupy SSRI i lek o działaniu serotoninergicznym oraz rozpocząć leczenie objawowe (patrz punkt 4.5).
Dziurawiec zwyczajny
Jednoczesne stosowanie leków z grupy SSRI i leków ziołowych zawierających dziurawiec zwyczajny (Hypericum perforatum) może doprowadzić do zwiększenia częstości działań niepożądanych (patrz punkt 4.5).
Objawy odstawienia podczas przerywania leczenia
Objawy odstawienia po zaprzestaniu leczenia występują często, zwłaszcza w razie nagłego przerwania leczenia (patrz punkt 4.8). W badaniach klinicznych działania niepożądane obserwowane po przerwaniu leczenia wystąpiły u około 25% pacjentów leczonych escytalopramem i 15% pacjentów
przyjmujących placebo.
Ryzyko wystąpienia objawów odstawienia może zależeć od wielu czynników, takich jak czas trwania leczenia i dawka oraz częstość zmniejszania dawki. Najczęściej obserwowano zawroty głowy pochodzenia ośrodkowego, zaburzenia czucia (w tym parestezje i uczucie porażenia prądem elektrycznym), zaburzenia snu (w tym bezsenność i intensywne marzenia senne), pobudzenie lub lęk, nudności i (lub) wymioty, drżenie, splątanie, pocenie się, ból głowy, biegunka, palpitacje, chwiejność emocjonalna, drażliwość i zaburzenia widzenia. Przeważnie objawy te są łagodne do umiarkowanych, jednakże u niektórych pacjentów mogą być nasilone.
Objawy odstawienia występują zwykle w ciągu pierwszych kilku dni po przerwaniu leczenia, ale istnieją bardzo rzadkie doniesienia o takich objawach u pacjentów, którzy zapomnieli o przyjęciu dawki.
Na ogół objawy te są ograniczone i ustępują w ciągu 2 tygodni, choć w niektórych przypadkach mogą się przedłużyć (2-3 miesiące lub dłużej). W razie odstawiania leku zaleca się zatem stopniowe zmniejszanie dawki escytalopramu przez okres kilku tygodni lub miesięcy, w zależności od potrzeb pacjenta (patrz „Objawy odstawienia podczas przerywania leczenia”, punkt 4.2).
Choroba niedokrwienna serca
Ze względu na ograniczone doświadczenie kliniczne zaleca się zachowanie ostrożności u pacjentów z chorobą niedokrwienną serca (patrz punkt 5.3).
Wydłużenie odstępu QT
Stwierdzono, że escytalopram powoduje zależne od dawki wydłużenie odstępu QT. Po wprowadzeniu leku do obrotu zgłaszano przypadki wydłużenia odstępu QT i niemiarowości komorowej, w tym zaburzenia typu Torsades de Pointes, głównie u kobiet, u pacjentów z hipokaliemią lub pacjentów
z wcześniejszym wydłużeniem odstępu QT lub innymi chorobami serca (patrz punkt 4.3, 4.5, 4.8, 4.9
i 5.1).
Zaleca się zachowanie ostrożności u pacjentów ze znaczną bradykardią, u pacjentów po przebytym
zawale serca lub z niewyrównaną niewydolnością serca.
Zaburzenia elektrolitów, takie jak hipokalemia lub hipomagnezemia zwiększają ryzyko złośliwych arytmii i powinny być wyrównane przed rozpoczęciem leczenia escytalopramem.
W przypadku pacjentów ze stabilną chorobą serca, przed rozpoczęciem leczenia należy rozważyć wykonanie EKG.
W razie wystąpienia zaburzenia rytmu serca podczas leczenia escytalopramem, leczenie należy przerwać i wykonać badanie EKG.
Jaskra z zamkniętym kątem przesączania
Leki z grupy SSRI, w tym escytalopram, mogą wpływać na rozmiar źrenicy, powodując jej nadmierne rozszerzenie (mydriasis). Może to spowodować zwężenie kąta oka i w efekcie zwiększyć ciśnienie wewnątrzgałkowe i doprowadzić do jaskry z zamkniętym kątem przesączania, szczególnie
u pacjentów predysponowanych. Dlatego u pacjentów z jaskrą w wywiadzie oraz u pacjentów z jaskrą
z zamkniętym kątem przesączania, escytalopram powinien być stosowany z ostrożnością.
Zaburzenia czynności seksualnych
Selektywne inhibitory wychwytu zwrotnego serotoniny (ang. selective serotonin reuptake inhibitors, SSRI) oraz inhibitory wychwytu zwrotnego serotoniny i noradrenaliny (ang. serotonin norepinephrine reuptake inhibitors, SNRI) mogą spowodować wystąpienie objawów zaburzeń czynności seksualnych (patrz punkt 4.8). Zgłaszano przypadki długotrwałych zaburzeń czynności seksualnych, w których objawy utrzymywały się pomimo przerwania stosowania SSRI i (lub) SNRI.
Betesda zawiera etanol
Ten produkt leczniczy zawiera niewielkie ilości etanolu (alkohol), mniej niż 100 mg na dawkę. Każda
kropla roztworu zawiera 4,7 mg etanolu.
Betesda zawiera sód
Lek zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy lek uznaje się za „wolny od sodu”.
Przeciwwskazane leczenie skojarzone
Nieselektywne, nieodwracalne inhibitory MAO
U pacjentów leczonych produktem leczniczym z grupy SSRI w skojarzeniu z nieselektywnym, nieodwracalnym inhibitorem monoaminooksydazy (MAOI) oraz u pacjentów, którzy niedawno przerwali leczenie produktem z grupy SSRI i rozpoczęli leczenie takim inhibitorem MAO, informowano o wystąpieniu ciężkich reakcji niepożądanych (patrz punkt 4.3). W niektórych przypadkach u pacjentów występował zespół serotoninowy (patrz punkt 4.8).
Przeciwwskazane jest stosowanie escytalopramu w skojarzeniu z nieselektywnymi, nieodwracalnymi inhibitorami MAO. Stosowanie escytalopramu można rozpocząć 14 dni po zaprzestaniu stosowania nieodwracalnego inhibitora MAO. Pomiędzy odstawieniem escytalopramu a rozpoczęciem leczenia nieselektywnym, nieodwracalnym inhibitorem MAO należy zachować co najmniej 7-dniową przerwę.
Odwracalny, selektywny inhibitor MAO-A (moklobemid)
Ze względu na zagrożenie zespołem serotoninowym jednoczesne stosowanie escytalopramu
z inhibitorem MAO-A, takim jak moklobemid, jest przeciwwskazane (patrz punkt 4.3). Jeśli takie leczenie skojarzone jest konieczne, można je rozpocząć, podając minimalną zalecaną dawkę; pacjent powinien pozostawać pod stałą kontrolą kliniczną.
Odwracalny, nieselektywny inhibitor MAO (linezolid)
Antybiotyk linezolid jest odwracalnym nieselektywnym inhibitorem MAO i nie powinien być podawany pacjentom leczonym escytalopramem. Jeśli takie leczenie skojarzone okaże się niezbędne, należy stosować minimalne dawki oraz podawać je pod ścisłą kontrolą kliniczną (patrz punkt 4.3).
Nieodwracalny, selektywny inhibitor MAO-B (selegilina)
Podczas stosowania escytalopramu w skojarzeniu z selegiliną (nieodwracalny inhibitor MAO-B), należy zachować ostrożność ze względu na zagrożenie wystąpieniem zespołu serotoninowego.
Stosowanie selegiliny w dawkach do 10 mg na dobę w skojarzeniu z racemicznym cytalopramem było
bezpieczne.
Wydłużenie odstępu QT
Nie przeprowadzono farmakokinetycznych ani farmakodynamicznych badań escytalopramu
w połączeniu z innymi produktami leczniczymi, które wydłużają odstęp QT. Nie można wykluczyć addytywnego działania escytalopramu i tych produktów leczniczych. Dlatego przeciwwskazane jest jednoczesne stosowanie escytalopramu z produktami leczniczymi, które wydłużają odstęp QT, takimi jak: leki przeciwarytmiczne klasy IA i III, leki przeciwpsychotyczne (np. pochodne fenotiazyny, pimozyd, haloperydol), trójpierścieniowe leki przeciwdepresyjne i niektóre leki przeciwbakteryjne (np. sparfloksacyna, moksyfloksacyna, erytromycyna podawana dożylnie, pentamidyna, leki przeciwmalaryczne zwłaszcza halofantryna), niektóre leki przeciwhistaminowe (astemizol, hydroksyzyna, mizolastyna).
Leczenie skojarzone wymagające zachowania środków ostrożności:
Produkty lecznicze o działaniu serotoninergicznym
Jednoczesne podawanie z produktami leczniczymi o działaniu serotoninergicznym (np. opioidy (takie jak buprenorfina i tramadol) oraz tryptany (takie jak sumatryptan), może prowadzić do zespołu serotoninowego (patrz punkt 4.4).
Produkty lecznicze obniżające próg drgawkowy
Produkty lecznicze z grupy SSRI mogą obniżać próg drgawkowy. Zaleca się zachowanie ostrożności podczas jednoczesnego stosowania z innymi produktami leczniczymi, które też mogą obniżać próg drgawkowy, jak np. leki przeciwdepresyjne (trójpierścieniowe i SSRI), neuroleptyki (fenotiazyny, tioksanteny i butyrofenony), meflokin, bupropion i tramadol.
Lit, tryptofan
Informowano o nasileniu działania w przypadkach jednoczesnego stosowania produktów leczniczych z grupy SSRI z litem lub tryptofanem, z tego względu należy zachować ostrożność, podejmując skojarzone leczenie produktami leczniczymi z grupy SSRI oraz wymienionymi lekami.
Ziele dziurawca zwyczajnego
Jednoczesne stosowanie produktów leczniczych z grupy SSRI i leków ziołowych zawierających dziurawiec zwyczajny (Hypericum perforatum) może doprowadzić do zwiększenia częstości działań niepożądanych (patrz punkt 4.4).
Krwotoki
Jednoczesne stosowanie escytalopramu z doustnymi lekami przeciwzakrzepowymi może zmieniać ich działanie. W czasie wprowadzania leczenia escytalopramem lub jego odstawiania u pacjentów leczonych doustnymi lekami przeciwzakrzepowymi należy prowadzić stałą kontrolę parametrów krzepnięcia krwi (patrz punkt 4.4). Jednoczesne stosowanie niesteroidowych leków przeciwzapalnych (NLPZ) może zwiększyć ryzyko krwawień (patrz punkt 4.4).
Alkohol
Nie powinny wystąpić interakcje farmakodynamiczne lub farmakokinetyczne escytalopramu
z alkoholem. Jednakże, podobnie jak w przypadku innych leków psychotropowych, jednoczesne
spożycie alkoholu nie jest wskazane.
Produkty lecznicze wywołujące hipokaliemię lub hipomagnezemię
Należy zachować ostrożność podczas jednoczesnego stosowania leków wywołujących hipokaliemię lub hipomagnezemię, ponieważ stany te zwiększają ryzyko złośliwych arytmii (patrz punkt 4.4).
Interakcje farmakokinetyczne
Wpływ innych produktów leczniczych na właściwości farmakokinetyczne escytalopramu Metabolizm escytalopramu zachodzi głównie z udziałem izoenzymu CYP2C19. Izoenzymy CYP3A4 i CYP2D6 mogą również metabolizować escytalopram, choć w mniejszym stopniu. Wydaje się, że metabolizm głównego metabolitu S-DCT (demetylowanego escytalopramu) jest częściowo katalizowany przez CYP2D6.
Jednoczesne podawanie escytalopramu z omeprazolem w dawce 30 mg na dobę (inhibitor CYP2C19) może spowodować umiarkowane (około 50%) zwiększenie stężenia escytalopramu w osoczu.
Jednoczesne podawanie escytalopramu z cymetydyną w dawce 400 mg dwa razy na dobę (umiarkowanie silny inhibitor enzymów) powodowało umiarkowane zwiększenie (około 70%) stężenia escytalopramu w osoczu. Zaleca się zachowanie ostrożności podczas jednoczesnego stosowania escytalopramu w skojarzeniu cymetydyną. Może być wymagane dostosowanie dawki.
Należy więc zachować ostrożność podczas stosowania escytalopramu w skojarzeniu z inhibitorami CYP2C19 (tj. omeprazolem, esomeprazolem, flukonazolem, fluwoksaminą, lanzoprazolem, tiklopidyną) lub cymetydyną. Może być konieczne zmniejszenie dawki escytalopramu, jeśli wystąpią działania niepożądane podczas leczenia skojarzonego (patrz punkt 4.4).
Wpływ escytalopramu na właściwości farmakokinetyczne innych produktów leczniczych Escytalopram działa hamująco na izoenzym CYP2D6. Zaleca się zachowanie ostrożności podczas jednoczesnego podawania escytalopramu z produktami leczniczymi, które są metabolizowane głównie z udziałem tego enzymu i mają wąski indeks terapeutyczny, np. flekainidem, propafenonem
i metoprololem (stosowane w niewydolności serca) lub niektórymi lekami działającymi na OUN metabolizowanymi głównie z udziałem CYP2D6, np. leki przeciwdepresyjne, takie jak dezypramina, klomipramina i nortryptylina lub leki przeciwpsychotyczne, takie jak rysperydon, tiorydazyna
i haloperydol. Może być wymagane dostosowanie dawki.
Jednoczesne podawanie z dezypraminą lub metoprololem spowodowało w obydwu przypadkach dwukrotne zwiększenie stężenia w osoczu tych dwóch substratów CYP2D6.
Badania in vitro wykazały, że escytalopram może również wykazywać słabe działanie hamujące na izoenzym CYP2C19. Zaleca się zachowanie ostrożności podczas leczenia skojarzonego z lekami metabolizowanymi z udziałem CYP2C19.
Ciąża
Dane kliniczne dotyczące stosowania escytalopramu w okresie ciąży są ograniczone.
Badania na zwierzętach wykazały toksyczny wpływ na rozród (patrz punkt 5.3). Nie należy stosować tego produktu leczniczego podczas ciąży, jeśli nie jest to bezwzględnie konieczne i tylko po dokładnym rozważeniu możliwych zagrożeń wobec oczekiwanych korzyści.
Noworodka należy poddać obserwacji, jeśli matka kontynuuje stosowanie tego produktu leczniczego w późniejszych okresach ciąży, zwłaszcza w trzecim trymestrze. Podczas ciąży należy unikać nagłego odstawienia leku.
W wyniku stosowania przez matkę leku z grupy SSRI/SNRI w późniejszych okresach ciąży
u noworodka wystąpić mogą następujące objawy: zaburzenia oddechowe, sinica, bezdech, napady drgawek, wahania ciepłoty ciała, trudności w pobieraniu pokarmu, wymioty, hipoglikemia, wzmożone napięcie mięśniowe, zmniejszone napięcie mięśniowe, hiperrefleksja, drżenia, drżączka, drażliwość, letarg, ciągły płacz, senność i trudności w zasypianiu. Objawy te mogą być wynikiem działania serotoninergicznego lub reakcji odstawiennych. W większości przypadków powikłania pojawiają się natychmiast lub wkrótce (<24 h) po porodzie.
Dane epidemiologiczne wskazują, że stosowanie inhibitorów wychwytu zwrotnego serotoniny u kobiet w ciąży, zwłaszcza w trzecim trymestrze, może zwiększać ryzyko wystąpienia zespołu przetrwałego nadciśnienia płucnego noworodka (ang. persistent pulmonary hypertension of the
newborn PPHN). Zaobserwowano 5 takich przypadków na 1 000 ciąż. W populacji ogólnej stwierdza się 1 do 2 przypadków zespołu przetrwałego nadciśnienia płucnego noworodka na 1 000 ciąż.
Dane obserwacyjne wskazują na występowanie zwiększonego (mniej niż dwukrotnie) ryzyka krwotoku poporodowego po narażeniu na działanie leków z grupy SSRI lub SNRI w ciągu miesiąca przed porodem (patrz punkty 4.6 i 4.8).
Karmienie piersią
Przypuszcza się, że escytalopram przenika do mleka matki.
Z tego względu nie zaleca się stosowania escytalopramu u matek karmiących.
Płodność
Badania na zwierzętach wykazały, że cytalopram może wpływać na jakość spermy (patrz punkt 5.3). W oparciu o dane dotyczące stosowania u ludzi niektórych leków z grupy SSRI wykazano,
że działanie to jest przemijające.
Dotychczas nie zaobserwowano wpływu na płodność człowieka.
Chociaż wykazano, że escytalopram nie wpływa na sprawność intelektualną ani psychomotoryczną, to wszelkie leki psychoaktywne mogą zaburzać zdolność osądu i sprawność. Pacjentów należy uprzedzić o ryzyku wpływania leku na ich zdolność prowadzenia pojazdów i obsługiwania maszyn.
Działania niepożądane występują najczęściej w pierwszym lub drugim tygodniu leczenia i zwykle zmniejszają swą intensywność i częstość wraz z kontynuowaniem leczenia.
Tabelaryczne zestawienie działań niepożądanych
Poniżej wymieniono działania niepożądane zarówno znane dla SSRI, jak i zgłaszane dla escytalopramu w kontrolowanych placebo badaniach klinicznych albo jako zdarzenia spontaniczne po wprowadzeniu produktu do obrotu, przedstawione zostały poniżej zgodnie z klasyfikacją układów
i narządów i częstością ich występowania.
Częstości pochodzą z badań klinicznych i nie zostały skorygowane względem placebo.
Częstość została zdefiniowana jako występowanie: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do ≤1/100), rzadko (≥1/10 000 do ≤1/1 000), bardzo rzadko (≤1/10 000) lub częstość nieznana (częstość nie może być ustalona na podstawie dostępnych danych).
Klasyfikacja układów i narządów | Częstość | Działanie niepożądane |
Zaburzenia krwi i układu chłonnego | Nieznana | Trombocytopenia |
Zaburzenia układu immunologicznego | Rzadko | Reakcja anafilaktyczna |
endokrynologiczne | Nieznana | Nieprawidłowe wydzielanie hormonu antydiuretycznego |
Zaburzenia metabolizmu i odżywiania | Często | Zmniejszenie łaknienia, zwiększenie łaknienia, zwiększenie masy ciała |
Niezbyt często | Zmniejszenie masy ciała | |
Nieznana | Hiponatremia, anoreksja1 | |
Zaburzenia psychiczne | Często | Lęk, nerwowość, niezwykłe sny, kobiety i mężczyźni: zmniejszenie libido, kobiety: anorgazmia |
Niezbyt często | Bruksizm, pobudzenie, nerwowość, napad paniki, stan dezorientacji | |
Rzadko | Agresja, depersonalizacja, halucynacje | |
Nieznana | Mania, myśli samobójcze, zachowania samobójcze2 | |
Zaburzenia układu nerwowego | Bardzo często | Ból głowy |
Często | Bezsenność, senność, zawroty głowy, parestezje, drżenie | |
Niezbyt często | Zaburzenia smaku, zaburzenia snu, omdlenie | |
Rzadko | Zespół serotoninowy | |
Nieznana | Dyskinezja, zaburzenia ruchowe, drgawki, niepokój psychoruchowy/akatyzja1 | |
Zaburzenia oka | Niezbyt często | Rozszerzenie źrenic, zaburzenia widzenia |
Zaburzenia ucha i błędnika | Niezbyt często | Szumy uszne |
Zaburzenia serca | Niezbyt często | Tachykardia |
Rzadko | Bradykardia | |
Nieznana | Wydłużenie odstępu QT w badaniu EKG, niemiarowości komorowe, w tym zaburzenia typu Torsades de Pointes |
Nieznana | Niedociśnienie ortostatyczne | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Często | Zapalenie zatok, ziewanie |
Niezbyt często | Krwawienie z nosa | |
Bardzo często | Nudności | |
Często | Biegunka, zaparcie, wymioty, suchość w jamie ustnej | |
Niezbyt często | Krwawienia z przewodu pokarmowego (w tym krwawienia z odbytu) | |
Zaburzenia wątroby i dróg żółciowych | Nieznana | Zapalenie wątroby, nieprawidłowe wyniki badań czynności wątroby |
Zaburzenia skóry i tkanki podskórnej | Często | Zwiększona potliwość |
Niezbyt często | Pokrzywka, łysienie, wysypka, rumień | |
Nieznana | Wybroczyny, obrzęk naczynioruchowy | |
Często | Zapalenie stawów, zapalenie mięśni | |
Zaburzenia nerek i dróg moczowych | Nieznana | Zatrzymanie moczu |
Zaburzenia układu rozrodczego i piersi | Często | Mężczyźni: zaburzenia ejakulacji, impotencja |
Niezbyt często | Kobiety: krwotok maciczny, krwotok miesiączkowy | |
Nieznana | Mlekotok Mężczyźni: priapizm Krwotok poporodowy* | |
Zaburzenia ogólne i stany w miejscu podania | Często | Zmęczenie, gorączka |
Niezbyt często | Obrzęk |
1 Działania niepożądane zgłaszane po zastosowaniu leków z grupy SSRI
2 Zgłaszano przypadki myśli samobójczych i zachowań samobójczych podczas leczenia escytalopramem lub we wczesnym
okresie po przerwaniu leczenia (patrz punkt 4.4).
* Zdarzenie to zgłaszano dla grupy leków SSRI i SNRI (patrz punkty 4.4 i 4.6).
Wydłużenie odstępu QT
Po wprowadzeniu produktu leczniczego do obrotu zgłaszano przypadki niemiarowości komorowej, w tym zaburzenia typu Torsades de Pointes, głównie u kobiet, u pacjentów z hipokaliemią lub pacjentów z wcześniejszym wydłużeniem odstępu QT lub innymi chorobami serca (patrz punkt 4.3, 4.4, 4.5, 4.9
i 5.1).
Efekt klasy
Badania epidemiologiczne, prowadzone głównie u pacjentów w wieku 50 lat i powyżej, wykazują zwiększone ryzyko złamań kości u pacjentów przyjmujących produkty lecznicze z grupy SSRI
i trójpierścieniowe leki przeciwdepresyjne. Mechanizm tego zwiększonego ryzyka nie jest znany.
Objawy odstawienia podczas przerywania leczenia
Przerwanie stosowania leków z grupy SSRI/SNRI (szczególnie nagłe) często prowadzi do wystąpienia objawów odstawienia. Obserwowane były: zawroty głowy pochodzenia ośrodkowego, zaburzenia czucia (w tym parestezje i uczucie porażenia prądem elektrycznym), zaburzenia snu (w tym bezsenność i intensywne marzenia senne), pobudzenie lub lęk, nudności i (lub) wymioty, drżenie, splątanie, pocenie się, ból głowy, biegunka, palpitacje, chwiejność emocjonalna, drażliwość
i zaburzenia widzenia. Przeważnie objawy te są łagodne do umiarkowanych i ustępują samoistnie, jednakże u niektórych pacjentów mogą być nasilone i (lub) mogą się przedłużyć. Dlatego też, jeśli nie jest potrzebne kontynuowanie leczenia, należy kończyć terapię stopniowo zmniejszając dawkę leku (patrz punkt 4.2 i punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301, fax: + 48 22 49-21-309,
strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Toksyczność
Dane kliniczne na temat przedawkowania escytalopramu są ograniczone i w wielu przypadkach dotyczą jednoczesnego przedawkowania innych leków. W większości przypadków informowano o łagodnym nasileniu objawów lub niewystępowaniu objawów. Rzadko informowano o zgonach w wyniku przedawkowania samego escytalopramu; w większości przypadków dochodziło do przedawkowania jednocześnie z innymi lekami. Dawki od 400 mg do 800 mg samego escytalopramu nie powodowały ciężkich objawów.
Objawy
Do objawów zgłaszanych w przypadkach przedawkowania escytalopramu zalicza się głównie objawy ze strony ośrodkowego układu nerwowego (od zawrotów głowy, drżenia i pobudzenia po rzadkie przypadki zespołu serotoninowego, drgawek i śpiączki), układu pokarmowego (nudności/wymioty) i układu sercowo-naczyniowego (niedociśnienie tętnicze, częstoskurcz, wydłużenie odstępu QT
i niemiarowość) oraz zaburzenia gospodarki elektrolitowej i wodnej (hipokaliemia, hiponatremia).
Postępowanie
Brak swoistego antidotum. Należy zapewnić drożność dróg oddechowych, odpowiednie nasycenie tlenem oraz czynność oddechową. Można rozważyć płukanie żołądka i zastosowanie węgla aktywnego. Możliwie jak najszybciej po spożyciu należy wykonać płukanie żołądka. Zaleca się monitorowanie czynności serca i objawów czynności życiowych oraz ogólne objawowe postępowanie podtrzymujące.
U pacjentów z zastoinową niewydolnością serca/bradyarytmiami stosujących jednocześnie leki wydłużające odstęp QT lub u pacjentów z zaburzeniami metabolizmu, jak np. z zaburzeniami czynności wątroby, w razie przedawkowania zalecane jest monitorowanie za pomocą EKG.
Grupa farmakoterapeutyczna: leki przeciwdepresyjne, selektywne inhibitory wychwytu zwrotnego serotoniny.
Kod ATC: N 06 AB 10.
Mechanizm działania
Escytalopram jest selektywnym inhibitorem wychwytu zwrotnego serotoniny (5-HT) z wysokim powinowactwem do pierwotnego miejsca wiązania. Wiąże się także do miejsca allosterycznego transportera serotoniny z 1 000-krotnie mniejszym powinowactwem.
Escytalopram nie ma lub ma bardzo niewielkie powinowactwo do wielu receptorów, w tym receptorów 5-HT1A, 5-HT2, DA, D1 i D2, receptorów adrenergicznych α1, α2, i β oraz receptorów histaminowych H1, muskarynowych cholinergicznych, benzodiazepinowych i opioidowych.
Zahamowanie wychwytu zwrotnego 5-HT jest jedynie prawdopodobnym mechanizmem działania wyjaśniającym farmakologiczne i kliniczne oddziaływanie escytalopramu.
Działanie farmakodynamiczne
W podwójnie zaślepionym, kontrolowanym placebo badaniu EKG u zdrowych ochotników, zmiana odstępu QTc (oceniona na podstawie korekty metodą Fridericia) wyniosła 4,3 milisekundy (90% CI: 2,2; 6,4) po dawce 10 mg na dobę oraz 10,7 milisekund (90% CI: 8,6, 12,8) po ponadterapautycznej
dawce 30 mg na dobę (patrz punkt 4.3, 4.4, 4.5, 4.8 i 4.9).
Skuteczność kliniczna
Epizody ciężkiej depresji
Escytalopram okazał się skuteczny w krótkotrwałym leczeniu epizodów ciężkiej depresji w trzech z czterech krótkoterminowych (8-tygodniowych) badań z podwójnie ślepą próbą kontrolowanych placebo. W długoterminowym badaniu dotyczącym profilaktyki nawrotów, 274 pacjentów, którzy zareagowali na leczenie escytalopramem w dawce 10 mg lub 20 mg na dobę w początkowej
8-tygodniowej fazie otwartej, zostało losowo przydzielonych do dalszego leczenia albo
escytalopramem w tej samej dawce, albo placebo, w czasie do 36 tygodni. W tym badaniu
u pacjentów, którym podawano escytalopram, czas do nawrotu choroby w okresie następujących 36 tygodni był znacząco dłuższy niż u osób otrzymujących placebo.
Fobia społeczna
Escytalopram okazał się skuteczny zarówno w trzech krótkotrwałych (12-tygodniowych) badaniach, jak i u osób odpowiadających na leczenie w 6-miesięcznym badaniu dotyczącym zapobiegania nawrotom fobii społecznej. W 24-tygodniowym badaniu, którego celem było ustalenie dawkowania, wykazano skuteczność escytalopramu w dawce 5 mg, 10 mg i 20 mg.
Zaburzenie lękowe uogólnione
Escytalopram w dawce 10 mg i 20 mg na dobę okazał się skuteczny w każdym z czterech badań
z podwójnie ślepą próbą, kontrolowanych placebo.
W wynikach zbiorczych uzyskanych z trzech badań o podobnym schemacie, obejmujących
421 pacjentów leczonych escytalopramem i 419 pacjentów otrzymujących placebo – odpowiednio 47,5% i 28,9% pacjentów odpowiedziało na leczenie i u 37,1% i 20,8% uzyskano remisję. Trwały efekt obserwowano od 1. tygodnia.
Utrzymywanie się skuteczności escytalopramu w dawce 20 mg na dobę zostało dowiedzione w 24- do
76-tygodniowym, randomizowanym badaniu, oceniającym utrzymywanie się skuteczności
u 373 pacjentów, którzy zareagowali na leczenie podczas 12 tygodniowego otwartego leczenia
wstępnego.
Zaburzenie obsesyjno-kompulsyjne
W randomizowanym badaniu klinicznym z podwójnie ślepą próbą po 12 tygodniach pacjenci otrzymujący escytalopram w dawce 20 mg na dobę wyodrębnili się pod względem całkowitej punktacji w skali Y-BOCS od grupy otrzymującej placebo. Po 24 tygodniach pacjenci otrzymujący escytalopram w obu dawkach, 10 i 20 mg na dobę, wykazywali przewagę nad pacjentami otrzymującymi placebo.
Wykazano, że escytalopram w dawkach 10 mg i 20 mg na dobę zapobiega nawrotom u pacjentów, którzy wykazali pożądaną reakcję na escytalopram w trwającej 16 tygodni fazie otwartej badania i uczestniczyli następnie w trwającej 24 tygodnie randomizowanej kontrolowanej placebo fazie
z podwójnie ślepą próbą.
Wchłanianie
Escytalopram wchłania się prawie całkowicie, niezależnie od spożycia pokarmu (średnia wartość Tmax wynosi 4 godziny po podaniu dawki wielokrotnej). Należy się spodziewać, że bezwzględna biodostępność escytalopramu wyniesie około 80%, podobnie jak racemicznego cytalopramu.
Dystrybucja
Pozorna objętość dystrybucji (Vd, β/F) po podaniu doustnym wynosi około 12 do 26 l/kg mc. Escytalopram i jego główne metabolity wiążą się z białkami osocza w mniej niż 80%.
Metabolizm
Escytalopram jest metabolizowany w wątrobie do metabolitów demetylowanych oraz didemetylowanych. Obydwa metabolity są farmakologicznie czynne. Jest również możliwe, że azot ulega utlenieniu, tworząc metabolit w postaci N-tlenku. Zarówno lek macierzysty, jak i metabolity, są częściowo wydalane w postaci glukuronidów. Po wielokrotnym podaniu dawki średnie stężenia metabolitu demetylowanego i didemetylowanego wynoszą zazwyczaj odpowiednio 28-31% i <5% stężenia escytalopramu. Biotransformacja escytalopramu do metabolitu demetylowanego zachodzi głównie z udziałem izoenzymu CYP2C19. Możliwy jest również pewien udział izoenzymów CYP3A4 oraz CYP2D6.
Eliminacja
Okres półtrwania wyznaczony w fazie eliminacji (t1/2β) po podaniu dawki wielokrotnej wynosi około 30 godzin, a klirens osoczowy po podaniu doustnym wynosi około 0,6 l/min. Okres półtrwania głównych metabolitów jest znamiennie dłuższy. Zakłada się, że escytalopram i główne metabolity są eliminowane zarówno drogą wątrobową (metaboliczną), jak i nerkową, a zasadnicza część dawki wydalana jest w postaci metabolitów w moczu.
Liniowość
Farmakokinetyka ma charakter liniowy. Stan stacjonarny stężenia w osoczu osiągany jest po około tygodniu. Średnie stężenie w stanie stacjonarnym wynoszące 50 nmol/l (zakres 20 do 125 nmol/l) osiągane jest podczas podawania dawki dobowej wynoszącej 10 mg.
Pacjenci w podeszłym wieku (powyżej 65 lat)
Wydaje się, że eliminacja escytalopramu zachodzi wolniej u pacjentów w podeszłym wieku niż u młodszych. Wartość pola pod krzywą stężenie – czas (AUC) jest o około 50% większa u osób w podeszłym wieku w porównaniu z młodymi zdrowymi ochotnikami (patrz punkt 4.2).
Zaburzenia czynności wątroby
U pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby (kryterium A i B według klasyfikacji Childa i Pugha) okres półtrwania escytalopramu był około dwa razy dłuższy, a ekspozycja około 60% większa niż u osób z prawidłową czynnością wątroby (patrz punkt 4.2).
Zaburzenia czynności nerek
Po podawaniu racemicznego cytalopramu u pacjentów z zaburzeniem czynności nerek (klirens kreatyniny 10-53 ml/min) obserwowano dłuższy okres półtrwania oraz niewielkie zwiększenie wartości pola pod krzywą stężenie-czas. Nie badano stężenia w osoczu metabolitów, ale może być ono zwiększone (patrz punkt 4.2).
Polimorfizm
Zaobserwowano, że u osób wolno metabolizujących przy udziale izoenzymu CYP2C19, stężenie
escytalopramu w osoczu było dwa razy większe niż u osób o szybkim metabolizmie. U osób
z wolniejszym metabolizmem przy udziale izoenzymu CYP2D6 nie zaobserwowano istotnej zmiany narażenia (patrz punkt 4.2).
W przypadku escytalopramu nie wykonano pełnego zestawu konwencjonalnych badań przedklinicznych, ponieważ przeprowadzone na szczurach badania toksykologiczno-kinetyczne
i toksykologiczne escytalopramu i cytalopramu wykazały podobny profil. Wszystkie informacje dotyczące cytalopramu można zatem odnieść do escytalopramu.
W porównawczych badaniach toksykologicznych na szczurach escytalopram i cytalopram wykazywał działanie toksyczne na serce, w tym powodował zastoinową niewydolność serca po trwającym kilka
tygodni podawaniu dawek wywołujących ogólne działanie toksyczne. Toksyczne działanie na serce ma związek raczej z maksymalnymi stężeniami w osoczu niż z ogólną ekspozycją (AUC). Maksymalne stężenia w osoczu, przy których nie było działań niepożądanych, były osiem razy większe od osiąganych podczas stosowania klinicznego, podczas gdy wartość AUC dla escytalopramu była zaledwie 3 do 4 razy większa niż ekspozycja w czasie stosowania klinicznego. W przypadku cytalopramu wartości AUC dla S-enancjomeru były 6 do 7 razy większe niż ekspozycja podczas stosowania klinicznego. Wyniki te są zapewne związane z nadmiernym wpływem na aminy biogenne, co jest wtórne do pierwotnego działania farmakologicznego i skutkuje efektem hemodynamicznym (redukcja przepływu krwi w naczyniach wieńcowych) oraz niedokrwieniem. Jednak dokładny mechanizm działania kardiotoksycznego nie jest jasny. Doświadczenia kliniczne w stosowaniu cytalopramu oraz doświadczenia uzyskane na podstawie badań klinicznych z escytalopramem nie wskazują, aby wyniki te korelowały z działaniem obserwowanym podczas stosowania klinicznego.
Po dłuższym podawaniu escytalopramu i cytalopramu u szczurów obserwowano zwiększenie zawartości fosfolipidów w niektórych tkankach, np. płucach, najądrzach i wątrobie. Zwiększenie zawartości fosfolipidów w najądrzach i wątrobie stwierdzono po ekspozycji na lek podobnej jak u ludzi. Działanie to przemijało po zaprzestaniu podawania leku. Kumulację fosfolipidów
(fosfolipidozę) u zwierząt obserwowano w związku z wieloma lekami o właściwościach amfifilnych kationów. Nie wiadomo, czy zjawisko to ma jakieś znaczenie u człowieka.
W badaniu toksycznego oddziaływania na rozwój u szczurów działanie embriotoksyczne (zmniejszenie masy ciała płodów i przemijające opóźnienie kostnienia) obserwowano po narażeniu wyrażonym wartością AUC większą od narażenia obserwowanego podczas zastosowania klinicznego. Nie stwierdzono zwiększonej częstości występowania wad rozwojowych. Badania w okresie około-
i pourodzeniowym wykazały zmniejszenie przeżywalności w okresie laktacji, po narażeniu wyrażonym wartością AUC większym niż narażenie obserwowane podczas zastosowania klinicznego.
Badania na zwierzętach wykazały, że cytalopram powoduje zmniejszenie wskaźnika płodności
i wskaźnika ciąży, zmniejszenie liczby implantacji zarodków i nieprawidłową spermę, po narażeniu znacznie przekraczającym narażenie uzyskiwane u ludzi. Brak danych dotyczących powyższego działania z badań na zwierzętach dla escytalopramu.
Propylu galusan Kwas cytrynowy Etanol 96%
Sodu wodorotlenek (do uzyskania właściwego pH) Woda oczyszczona
Nie wolno mieszać produktu leczniczego z innymi produktami leczniczymi w przypadku braku badań zgodności.
2 lata.
Po pierwszym otwarciu: 8 tygodni, jeśli produkt jest przechowywany w temperaturze poniżej 25ºC. Butelkę należy trzymać szczelnie zamkniętą.
Brak specjalnych zaleceń dotyczących warunków przechowywania produktu leczniczego. Po pierwszym otwarciu: Nie przechowywać w temperaturze powyżej 25°C.
Butelkę trzymać szczelnie zamkniętą i w pozycji pionowej.
Warunki przechowywania produktu leczniczego po pierwszym otwarciu, patrz punkt 6.3.
1 butelka zawierająca 15 ml roztworu w tekturowym pudełku,
5 butelek zawierających 15 ml roztworu w tekturowym pudełku.
Butelka z oranżowego szkła (typu III) z kroplomierzem z PE zamknięta zakrętką z PP/PE zabezpieczającą przed dostępem dzieci.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
do stosowania
Bez specjalnych wymagań.
DOPUSZCZENIE DO OBROTU
Aristo Pharma Sp. z o.o. ul. Baletowa 30
02-867 Warszawa
Pozwolenie numer: 21131
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 19 kwietnia 2013 Data ostatniego przedłużenia pozwolenia: 19.12.2018 r.
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
maj 2023











