Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Obecność lub ryzyko wystąpienia żylnej choroby zakrzepowo-zatorowej (ŻChZZ).
Żylna choroba zakrzepowo-zatorowa – czynna ŻChZZ (podczas leczenia lekami przeciwzakrzepowymi) bądź przebyta (np. zakrzepica żył głębokich lub zatorowość płucna).
Stwierdzona dziedziczna lub nabyta predyspozycja do żylnej choroby zakrzepowo-zatorowej, np. oporność na APC (w tym obecność czynnika V Leiden), niedobór antytrombiny III, niedobór białka C, niedobór białka S.
Przebycie dużego zabiegu chirurgicznego połączonego z długotrwałym unieruchomieniem (patrz punkt 4.4).
Duże ryzyko wystąpienia żylnej choroby zakrzepowo-zatorowej z powodu współwystępowania kilku czynników ryzyka (patrz punkt 4.4).
Obecność lub ryzyko wystąpienia tętniczej choroby zakrzepowo-zatorowej.
Tętnicza choroba zakrzepowo-zatorowa - czynna tętnicza choroba zakrzepowo- zatorowa, przebyta tętnicza choroba zakrzepowo-zatorowa (np. zawał mięśnia sercowego) lub schorzenia zwiastujące wystąpienie tętniczej choroby zakrzepowo-zatorowej (np. dławica piersiowa).
Choroba naczyń mózgowych - aktualny udar mózgu, przebyty udar mózgu lub schorzenia zwiastujące wystąpienie udaru mózgu [np. przemijający napad niedokrwienia mózgu (TIA, ang. transient ischaemic attack)].
Stwierdzona dziedziczna lub nabyta predyspozycja do tętniczej choroby zakrzepowo-zatorowej, np. hiperhomocysteinemia i obecność przeciwciał antyfosfolipidowych (przeciwciał antykardiolipinowych, antykoagulantu toczniowego).
Dodatni wywiad w kierunku migreny z ogniskowymi objawami neurologicznymi.
Duże ryzyko wystąpienia tętniczej choroby zakrzepowo-zatorowej z powodu współwystępowania kilku czynników ryzyka (patrz punkt 4.4) lub występowania jednego poważnego czynnika ryzyka, takiego jak:
cukrzyca z objawami naczyniowymi,
ciężkie nadciśnienie,
ciężka dyslipoproteinemia.
Matki karmiące piersią w okresie krótszym niż 6 tygodni po porodzie.
Rak endometrium lub inny, rozpoznany estrogenozależny nowotwór.
Krwawienie z narządu rodnego o niewyjaśnionej etiologii.
Palenie 15 lub więcej papierosów na dobę u pacjentek w wieku powyżej 35 lat.
Ostra lub przewlekła choroba wątroby taka, jak zapalenie wątroby (wirusowe lub niewirusowe) lub ciężka postać marskości wątroby, lub występowanie tych chorób w wywiadzie przez okres przynajmniej 3 miesięcy po powrocie nieprawidłowych wartości prób czynnościowych wątroby do wartości prawidłowych; gruczolaki wątroby lub nowotwory wątroby.
Rozpoznany lub podejrzewany rak piersi.
Zapalenie trzustki, także w wywiadzie, jeśli ma związek z ciężką hipertriglicerydemią.
Produkt jest przeciwwskazany do stosowania u dziewcząt, które nie osiągnęły wieku dojrzałości płciowej – nie rozpoczęły miesiączkowania.
Produkt leczniczy Elin jest przeciwwskazany do jednoczesnego stosowania z produktami leczniczymi zawierającymi ombitaswir z parytaprewirem i rytonawirem, dazabuwir,
z produktami leczniczymi zawierającymi glekaprewir z pibrentaswirem oraz sofosbuwir z welpataswirem i woksylaprewirem (patrz punkt 4.5).
W przypadku pierwszego wystąpienia powyższych stanów podczas stosowania produktu leczniczego Elin wówczas jego stosowanie należy natychmiast przerwać.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ostrzeżenia:
jednostronny obrzęk kończyny dolnej lub stopy bądź obrzęk na przebiegu żyły w obrębie kończyny dolnej;
ból lub bolesność uciskowa w obrębie kończyny dolnej, przy czym objawy te mogą się ujawniać tylko podczas przebywania w pozycji stojącej bądź podczas chodzenia;
zwiększona temperatura kończyny dolnej; zaczerwienienie lub przebarwienia skóry w obrębie kończyny dolnej.
Objawy zatorowości płucnej mogą być następujące:
nagłe pojawienie się duszności o niewyjaśnionej przyczynie bądź przyspieszonego oddechu;
nagłe pojawienie się kaszlu, któremu może towarzyszyć krwioplucie;
ostry ból w klatce piersiowej;
nasilone uczucie zbliżającego się omdlenia lub nasilone zawroty głowy;
przyspieszona lub nieregularna akcja serca.
Niektóre z wymienionych objawów (np. duszność czy kaszel) są nieswoiste i mogą być błędnie zinterpretowane jako objawy częściej występujących lub lżejszych schorzeń (np. zakażenia układu oddechowego).
Inne objawy niedrożności naczyń mogą obejmować: nagły ból, obrzęk i nieznaczne zsinienie kończyny.
Jeśli niedrożność dotyczy naczyń w gałce ocznej, wówczas objawy mogą wahać się od bezbolesnego nieostrego widzenia do postępującej utraty wzroku. Czasem do utraty wzroku może dochodzić prawie natychmiast.
Ryzyko rozwoju tętniczej choroby zakrzepowo-zatorowej
W badaniach epidemiologicznych wykazano związek pomiędzy stosowaniem złożonych hormonalnych środków antykoncepcyjnych a zwiększonym ryzykiem tętniczej choroby zakrzepowo-zatorowej (zawału mięśnia sercowego) lub zwiększonym ryzykiem zdarzeń mózgowonaczyniowych (przemijającego napadu niedokrwienia mózgu, udaru mózgu). Tętnicze zdarzenia zakrzepowo-zatorowe mogą kończyć się zgonem.
Czynniki ryzyka tętniczej choroby zakrzepowo-zatorowej
Ryzyko wystąpienia tętniczych powikłań zakrzepowo-zatorowych bądź zdarzeń mózgowonaczyniowych u kobiet stosujących złożone hormonalne środki antykoncepcyjne, u których występują czynnik ryzyka (patrz tabela). Stosowanie produktu leczniczego Elin jest przeciwwskazane u kobiet, u których występuje jeden poważny czynnik ryzyka lub u których współwystępuje kilka czynników ryzyka tętniczej choroby zakrzepowo-zatorowej narażających je na zwiększone ryzyko zakrzepicy tętniczej (patrz punkt 4.3). Jeśli u kobiety występuje więcej niż jeden czynnik ryzyka, możliwe jest że wypadkowe ryzyko jest większe aniżeli wynikałoby to z prostego zsumowania poszczególnych czynników ryzyka - w tym wypadku należy dokonać oceny całkowitego ryzyka tętniczej choroby zakrzepowo-zatorowej. Jeśli bilans korzyści i zagrożeń zostanie uznany za ujemny, wówczas złożonego hormonalnego środka antykoncepcyjnego nie należy przepisywać (patrz punkt 4.3).
Tabela: Czynniki ryzyka tętniczej choroby zakrzepowo-zatorowej
Czynniki ryzyka
Uwagi
Zaawansowany wiek.
Zwłaszcza wiek powyżej 35 lat.
Palenie tytoniu
Kobietom należy zdecydowanie odradzać palenie tytoniu, jeśli noszą się one z zamiarem stosowania złożonego hormonalnego środka
antykoncepcyjnego. Kobietom w wieku powyżej 35 lat, które nie wyrażają chęci
przerwania palenia, należy zdecydowanie zalecić stosowanie innej metody antykoncepcji.
Nadciśnienie tętnicze
Otyłość (wskaźnik masy ciała powyżej 30 kg/m2)
W miarę wzrostu BMI ryzyko znacznie wzrasta.
Szczególnie istotne u kobiet, u których występują dodatkowe czynniki ryzyka
Obciążenie rodzinne (tętnicza choroba
zakrzepowo-zatorowa u brata, siostry lub rodzica, szczególnie we względnie młodym wieku, np. przed ukończeniem 50 lat).
W przypadku podejrzewania predyspozycji dziedzicznych pacjentkę powinno się skierować do specjalisty w celu uzyskania porady przed podjęciem decyzji o rozpoczęciu stosowania jakiegokolwiek złożonego hormonalnego środka antykoncepcyjnego.
Migrena
Zwiększenie częstości występowania lub nasilenia migreny podczas stosowania złożonych hormonalnych środków antykoncepcyjnych (które może zwiastować wystąpienie zdarzenia mózgowonaczyniowego)
może stanowić powód natychmiastowego odstawienia produktu
Inne choroby związane z naczyniowymi zdarzeniami niepożądanymi
Cukrzyca, hiperhomocysteinemia, wady zastawkowe serca i migotanie przedsionków, dyslipoproteinemia i toczeń rumieniowaty
układowy.
Objawy tętniczej choroby zakrzepowo-zatorowej
W przypadku wystąpienia objawów kobieta powinna pilnie uzyskać pomoc lekarską i powiadomić lekarza, iż przyjmuje złożone hormonalne środki antykoncepcyjne.
Objawy zdarzenia mózgowo-naczyniowego mogą być następujące:
nagłe zdrętwienie lub osłabienie siły mięśniowej w obrębie twarzy, kończyny górnej lub kończyny dolnej, szczególnie jeśli jednostronne;
nagłe zaburzenia chodu, zawroty głowy, zaburzenia równowagi lub koordynacji ruchowej;
nagła dezorientacja, zaburzenia mowy lub zaburzenia rozumienia pisma lub mowy;
nagłe zaburzenia widzenia w jednym lub obu oczach;
nagły nasilony lub długotrwały ból głowy bez wyraźnej przyczyny;
utrata przytomności lub omdlenie z towarzyszącym napadem lub bez towarzyszącego napadu.
Przemijający charakter objawów podczas opisanego zdarzenia sugeruje rozpoznanie przemijającego napadu niedokrwienia mózgu (TIA, ang. transient ischaemic attack).
Objawy zawału mięśnia sercowego mogą być następujące:
ból, dyskomfort, uczucie nacisku, ciężkości, uczucie ściskania lub wypełnienia w klatce piersiowej, w obrębie kończyny górnej lub poniżej mostka;
dyskomfort promieniujący do pleców, żuchwy, gardła, kończyny górnej, żołądka;
uczucie przepełnienia, niestrawności lub dławienia się;
poty, nudności, wymioty lub zawroty głowy;
nasilone uczucie osłabienia, lęk lub duszność;
przyspieszona lub nieregularna akcja serca. Nowotwory
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
cyklosporyna;
prednizolon;
teofilina.
Leki, których stężenie w osoczu może się zmniejszyć (z powodu pobudzenia glukuronidacji) - przykłady:
lamotrygina.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Elin, 250 mikrogramów + 35 mikrogramów, tabletki
Każda tabletka zawiera 250 mikrogramów norgestymatu oraz 35 mikrogramów etynyloestradiolu.
Substancja pomocnicza o znanym działaniu: laktoza. Każda tabletka zawiera 89,203 mg laktozy.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka
Niebieskie, okrągłe, niepowlekane tabletki o ściętych brzegach i średnicy 6,4 mm, z wytłoczonym numerem „146“ na jednej stronie i gładkie po drugiej.
Doustny środek antykoncepcyjny.
Podejmując decyzję o przepisaniu kobiecie produktu leczniczego Elin należy wziąć pod uwagę aktualnie występujące u danej kobiety czynniki ryzyka, szczególnie czynniki ryzyka rozwoju żylnej choroby zakrzepowo-zatorowej (ŻChZZ), a także to, jak ryzyko ŻChZZ związane ze stosowaniem produktu leczniczego Elin przedstawia się na tle ryzyka związanego ze stosowaniem innych złożonych hormonalnych środków antykoncepcyjnych (patrz punkty 4.3 i 4.4).
Podanie doustne. Dawkowanie
Dzieci i młodzież
Produkt jest przeciwwskazany do stosowania u dziewcząt, które nie osiągnęły wieku dojrzałości płciowej – nie rozpoczęły miesiączkowania (patrz punkt 4.3).
Pacjentki dorosłe
Należy przyjmować codziennie jedną tabletkę, o stałej porze (najlepiej wieczorem) przez ciągły okres 21 dni, po którym następuje 7-dniowa przerwa w przyjmowaniu tabletek.
Kolejne opakowanie należy rozpocząć po upływie 7-dniowej przerwy. W tym okresie nie trzeba stosować dodatkowych środków antykoncepcyjnych. W czasie przerwy w
przyjmowaniu tabletek można spodziewać się krwawienia występującego zazwyczaj na początku 2. do 4. dnia po przyjęciu ostatniej tabletki.
Pacjentki w podeszłym wieku
Ten produkt leczniczy nie jest wskazany do stosowania u kobiet po menopauzie. Sposób podawania
Rozpoczęcie przyjmowania
Przyjmowanie tabletek rozpoczyna się 1. dnia naturalnego cyklu miesiączkowego pacjentki, czyli pierwszego dnia krwawienia.
Przejście z innego środka antykoncepcyjnego
Przejście ze złożonego, hormonalnego środka antykoncepcyjnego (złożone, doustne środki antykoncepcyjne, krążek dopochwowy albo system transdermalny)
Przyjmowanie produktu najlepiej rozpocząć w dniu po przyjęciu ostatniej tabletki aktywnej (zawierającej substancję czynną) uprzednio stosowanego złożonego, doustnego środka antykoncepcyjnego, ale najpóźniej w dniu po zakończeniu zwykłej przerwy w przyjmowaniu poprzednich tabletek lub po przyjęciu ostatniej tabletki zawierającej placebo uprzednio stosowanego złożonego, doustnego środka antykoncepcyjnego. W przypadku uprzedniego stosowania krążka dopochwowego lub systemu transdermalnego przyjmowanie produktu najlepiej rozpocząć w dniu ich usunięcia, ale najpóźniej w dniu, na który przypadałoby ich ponowne zaaplikowanie.
Przejście z metody zawierającej wyłącznie progestagen (minipigułka, wstrzyknięcie, implant lub wewnątrzmaciczny system antykoncepcyjny wydzielający progestagen)
Kobieta może każdego dnia przejść z minipigułki na produkt (z implantu lub systemu wewnątrzmacicznego w dniu ich usunięcia, z leku podawanego w postaci iniekcji – w dniu przypadającym na kolejne podanie), jednak we wszystkich przypadkach przez pierwszych 7 dni przyjmowania tabletek powinno się zalecać stosowanie dodatkowej antykoncepcyjnej metody barierowej.
Podawanie produktu po porodzie
Po porodzie drogami natury podawanie doustnych środków antykoncepcyjnych niekarmiącym matkom można rozpocząć 21 dni po porodzie, o ile pacjentka w pełni się porusza i nie wystąpiły u niej powikłania poporodowe. Nie ma też konieczności stosowania dodatkowych środków antykoncepcyjnych. Jeżeli podawanie produktu rozpocznie się później niż 21 dni po porodzie, przez pierwszych 7 dni przyjmowania tabletek konieczne jest stosowanie dodatkowych środków antykoncepcyjnych.
Jeżeli po porodzie doszło do stosunku płciowego, należy się z wstrzymać z przyjmowaniem doustnych środków antykoncepcyjnych do pierwszego dnia pierwszego krwawienia miesiączkowego.
Informacje dla kobiet karmiących piersią, patrz punkty 4.3, 4.4 oraz 4.6.
Stosowanie produktu po usunięciu ciąży lub poronieniu
Po usunięciu ciąży w pierwszym trymestrze
Stosowanie produktu można rozpocząć natychmiast. W takim przypadku nie ma konieczności stosowania dodatkowych środków antykoncepcyjnych.
Po porodzie lub usunięciu ciąży w drugim trymestrze ciąży
Należy zalecać rozpoczęcie przyjmowania produktu w dniu 21. do 28. po porodzie lub usunięciu ciąży w drugim trymestrze. W przypadku późniejszego rozpoczęcia przez pierwszych 7 dni należy zalecać stosowanie dodatkowej metody barierowej. Jeżeli jednak kobieta odbyła już stosunek płciowy, to przed rozpoczęciem stosowania złożonego, doustnego środka antykoncepcyjnego należy wykluczyć ciążę albo zaczekać do momentu wystąpienia pierwszego krwawienia miesiączkowego.
Informacje dotyczące pacjentek karmiących piersią, patrz punkt 4.6.
Opóźnienie miesiączki
Aby opóźnić wystąpienie miesiączki, kobieta powinna rozpocząć nowe opakowanie produktu w dniu po zakończeniu aktualnego opakowania, bez robienia przerwy w stosowaniu tabletek. Przyjmowanie tabletek należy kontynuować w zwyczajny sposób.
Podczas przyjmowania tabletek z drugiego opakowania u pacjentki może wystąpić niewielkie plamienie lub krwawienie międzymiesiączkowe, co nie zmniejsza jednak ochrony antykoncepcyjnej, o ile nie pominięto przyjęcia żadnych tabletek.
Kolejne opakowanie produktu należy rozpocząć po zwyczajnej, 7-dniowej przerwie w przyjmowaniu tabletek, nawet jeśli miesiączka nadal występuje.
Ograniczona skuteczność
Jeżeli produkt przyjmowany jest zgodnie z instrukcją stosowania, zajście w ciążę jest wysoce nieprawdopodobne. Jednakże skuteczność doustnych środków antykoncepcyjnych może się zmniejszyć w przypadku poniższych okoliczności:
Postępowanie w przypadku pominięcia tabletek
Jeżeli opóźnienie w przyjęciu tabletki nie przekroczy 12 godzin, stopień ochrony przed ciążą pozostanie niezmieniony. Kobieta powinna wtedy przyjąć tabletkę możliwie jak najszybciej, a kolejne dawki powinna przyjąć o zwykłej porze.
Jeżeli opóźnienie w przyjęciu tabletki przekroczy 12 godzin, stopień ochrony przed ciążą może się zmniejszyć. W przypadku pominięcia przyjęcia tabletek należy kierować się następującymi, podstawowymi zasadami:
Złożonych hormonalnych środków antykoncepcyjnych nie należy stosować w wymienionych poniżej stanach i schorzeniach.
Jeśli u pacjentki występuje którykolwiek stan lub czynnik ryzyka, wówczas należy z nią omówić kwestię tego, czy stosowanie u niej produktu leczniczego Elin jest odpowiednie.
W przypadku nasilenia lub pojawienia się po raz pierwszy któregokolwiek z wymienionych schorzeń lub czynników ryzyka pacjentka powinna skontaktować się z lekarzem, który ustali, czy istnieje konieczność przerwania stosowania produktu leczniczego Elin.
Ryzyko rozwoju żylnej choroby zakrzepowo-zatorowej (ŻChZZ)
Stosowanie jakichkolwiek złożonych hormonalnych środków antykoncepcyjnych niesie ze sobą zwiększone ryzyko wystąpienia żylnej choroby zakrzepowo-zatorowej (ŻChZZ) w porównaniu z kobietami niestosującymi tych preparatów. Stosowanie produktów zawierających lewonorgestrel, norgestymat (w tym Elin) lub noretysteron wiąże się z niższym ryzykiem rozwoju ŻChZZ. Decyzja o zastosowaniu produktu leczniczego Elin powinna zostać podjęta po przedyskutowaniu tej kwestii z pacjentką w celu upewnienia się, że pacjentka rozumie, na czym polega ryzyko ŻChZZ związane ze stosowaniem produktu leczniczego Elin, w jaki sposób aktualnie występujące u niej czynniki ryzyka wpływają na ryzyko wystąpienia ŻChZZ, oraz to, że ryzyko wystąpienia ŻChZZ jest większe w pierwszym roku stosowania omawianego produktu. Istnieją ponadto pewne dowody na to, że ryzyko to jest zwiększone, kiedy stosowanie złożonego hormonalnego środka antykoncepcyjnego jest wznawiane po przerwie wynoszącej co najmniej 4 tygodnie.
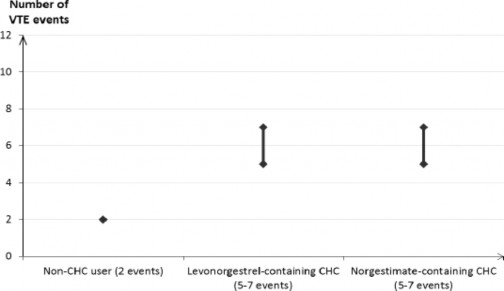
Wśród kobiet niestosujących złożonych hormonalnych środków antykoncepcyjnych i niebędących w ciąży u około 2 na 10 000 dochodzi do rozwoju ŻChZZ w ciągu jednego roku. Jednak u danej kobiety ryzyko to może być dużo wyższe, gdyż zależy ono również od istniejących u niej czynników ryzyka (patrz niżej).
Szacuje się, że u około 61 na 10 000 kobiet stosujących złożony hormonalny środek antykoncepcyjny zawierający lewonorgestrel dochodzi do rozwoju ŻChZZ w ciągu jednego roku.
Z aktualnie dostępnych danych wynika, że ryzyko rozwoju ŻChZZ w przypadku stosowania złożonych hormonalnych środków antykoncepcyjnych zawierających norgestymat jest podobne do ryzyka związanego ze stosowaniem złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel.
Liczba przypadków ŻChZZ na rok jest mniejsza niż liczba przypadków ŻChZZ, jakiej należałoby się spodziewać u kobiet w ciąży lub kobiet w okresie połogu.
ŻChZZ może prowadzić do zgonu w 1–2% przypadków.
1 Punkt środkowy z zakresu od 5 do 7 na 10 000 kobiet w okresie roku, w oparciu o relatywne ryzyko wynoszące około 2,3 do 3,6 dla złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel w porównaniu do sytuacji, gdy terapia nie jest stosowana.
Liczba przypadków ŻChZZ na 10 000 kobiet w ciągu jednego roku
U pacjentek stosujących złożone hormonalne środki antykoncepcyjne niezwykle rzadko opisuje się przypadki zakrzepicy w innych łożyskach naczyniowych, np. w obrębie naczyń żylnych i tętniczych wątroby, krezki, nerek, mózgu czy siatkówki.
Czynniki ryzyka ŻChZZ
Ryzyko powikłań zakrzepowo-zatorowych w krążeniu żylnym u kobiet używających złożone hormonalne środki antykoncepcyjne może ulegać znacznemu zwiększeniu w przypadku istnienia dodatkowych czynników ryzyka, szczególnie zaś w przypadku ich współwystępowania (patrz tabela).
Stosowanie produktu leczniczego Elin jest przeciwwskazane u kobiet, u których współwystępuje kilka czynników ryzyka narażających je na zwiększone ryzyko zakrzepicy żylnej (patrz punkt 4.3). Jeśli u kobiety występuje więcej niż jeden czynnik ryzyka, możliwe jest że wypadkowe ryzyko jest większe aniżeli wynikałoby to z prostego zsumowania poszczególnych czynników ryzyka - w tym wypadku należy dokonać oceny całkowitego ryzyka ŻChZZ. Jeśli bilans korzyści i zagrożeń zostanie uznany za ujemny, wówczas złożonego hormonalnego środka antykoncepcyjnego nie należy przepisywać (patrz punkt 4.3).
Tabela: Czynniki ryzyka ŻChZZ
Czynnik ryzyka | Uwagi |
Otyłość (wskaźnik masy ciała powyżej 30 kg/m2). | W miarę wzrostu BMI ryzyko znacznie wzrasta. Kwestia ta jest szczególnie istotna, jeśli z czynnikiem tym współwystępują inne czynniki ryzyka. |
Długotrwałe unieruchomienie (w tym lot samolotem trwający dłużej niż 4 godziny), przebycie dużego zabiegu chirurgicznego, | W tych sytuacjach zaleca się przerwanie stosowania plastrów/tabletek/pierścieni antykoncepcyjnych (co najmniej cztery tygodnie przed zabiegiem w przypadku zabiegów planowych). Stosowanie |
przebycie jakiegokolwiek zabiegu chirurgicznego w obrębie kończyn dolnych lub miednicy, przebycie zabiegu neurochirurgicznego bądź doznanie jakiegokolwiek dużego urazu. Uwaga! Tymczasowe unieruchomienie, w tym lot samolotem trwający dłużej niż 4 godziny, może również stanowić czynnik ryzyka rozwoju ŻChZZ, szczególnie u kobiet ze współwystępującymi innymi czynnikami ryzyka. | wymienionych środków antykoncepcyjnych można wznowić najwcześniej dwa tygodnie po całkowitym uruchomieniu pacjentki. W celu uniknięcia niezamierzonej ciąży należy stosować inną metodę antykoncepcji. Jeśli pacjentka z odpowiednio dużym wyprzedzeniem nie odstawiła produktu leczniczego Elin, wówczas można rozważyć włączenie leczenia antytrombotycznego. |
Obciążenie rodzinne (żylna choroba zakrzepowo-zatorowa u brata, siostry lub rodzica, szczególnie we względnie młodym wieku (np. przed ukończeniem 50 lat). | W przypadku podejrzewania predyspozycji dziedzicznych pacjentkę powinno się skierować do specjalisty w celu uzyskania porady przed podjęciem decyzji o rozpoczęciu stosowania jakiegokolwiek złożonego hormonalnego środka antykoncepcyjnego. |
Inne schorzenia związane z ŻChZZ | Nowotwory złośliwe, toczeń rumieniowaty układowy, zespół hemolityczno- mocznicowy, przewlekłe choroby zapalne jelit (choroba Leśniowskiego-Crohna i wrzodziejące zapalenie jelita grubego) oraz niedokrwistość sierpowatokrwinkowa. |
Wiek | Zwłaszcza wiek powyżej 35 lat. |
Zdania są podzielone co do ewentualnej roli żylaków kończyn dolnych i zakrzepowego zapalenia żył powierzchownych w przyczynianiu się do rozwoju lub progresji zakrzepicy naczyń żylnych.
Należy brać pod uwagę zwiększone ryzyko powikłań zakrzepowo-zatorowych w okresie ciąży i w 6-tygodniowym okresie połogu (informacje na temat „Wpływu na płodność, ciążę i laktację” – patrz punkt 4.6; patrz też wykres dotyczący ryzyka rozwoju ŻChZZ).
Objawy ŻChZZ (zakrzepicy żył głębokich i zatorowości płucnej)
W przypadku wystąpienia objawów kobieta powinna pilnie uzyskać pomoc lekarską i powiadomić lekarza, iż przyjmuje złożone hormonalne środki antykoncepcyjne.
Objawy zakrzepicy żył głębokich mogą być następujące:
Wyniki niektórych badań epidemiologicznych wskazały, że długotrwałe stosowanie doustnych środków antykoncepcyjnych (powyżej 5 lat) jest związane ze zwiększeniem ryzyka wystąpienia nowotworu szyjki macicy, jednak nadal nie osiągnięto konsensusu, w jakim stopniu ma to związek ze skutkami zachowań seksualnych i innych czynników, takich jak ludzki wirus brodawczaka (HPV).
Metaanaliza danych z 54 badań epidemiologicznych wskazuje na to, że u kobiet, które obecnie przyjmują złożone, doustne środki antykoncepcyjne występuje nieco większe ryzyko (RR = 1,24) zachorowania na raka piersi. To podwyższone ryzyko stopniowo zanika w ciągu 10 lat po zakończeniu stosowania złożonych, doustnych środków antykoncepcyjnych. Z racji tego, iż rak piersi występuje rzadko u kobiet w wieku poniżej 40 lat, zwiększona liczba zachorowań na raka piersi obecnych i byłych użytkowniczek złożonych, doustnych środków antykoncepcyjnych jest niewielka w porównaniu do ogólnego ryzyka zachorowania na raka piersi. Badania te nie dostarczają dowodów dotyczących związków przyczynowych.
Przypadki raka piersi rozpoznane u pacjentek, które kiedykolwiek stosowały złożone, doustne środki antykoncepcyjne, były raczej mniej zaawansowane klinicznie niż u kobiet, które nigdy nie stosowały tych środków. Zaobserwowany schemat zwiększonego ryzyka może wynikać z wcześniejszego rozpoznawania raka piersi u pacjentek, które stosowały złożone, doustne środki antykoncepcyjne, działania biologicznego tych środków czy połączenia obu czynników.
U pacjentek przyjmujących złożone, doustne środki antykoncepcyjne stwierdzano w rzadkich przypadkach łagodne nowotwory wątroby, a jeszcze rzadziej złośliwe nowotwory wątroby.
W pojedynczych przypadkach nowotwory te prowadziły do zagrażających życiu krwotoków do jamy brzusznej. Z tego względu, jeśli u pacjentki stosującej doustny środek antykoncepcyjny wystąpi silny ból w nadbrzuszu, powiększenie wątroby lub objawy krwotoku do jamy brzusznej, podczas diagnozy różnicowej należy wziąć pod uwagę nowotwór wątroby.
Stosowanie złożonych, doustnych środków antykoncepcyjnych z większą dawką substancji czynnej (50 μg etynyloestradiolu) wiąże się z mniejszym ryzykiem zachorowania na raka endometrium i raka jajników. Dotychczas nie potwierdzono, czy dotyczy to także złożonych, doustnych środków antykoncepcyjnych o zmniejszonej dawce.
Inne stany
U pacjentek, których masa ciała jest równa lub większa od 90 kg, skuteczność antykoncepcyjna środka może być zmniejszona.
Pacjentki z hipertriglicerydemią lub wywiadem rodzinnym w tym kierunku mogą być narażone na podwyższone ryzyko zapalenia trzustki, jeżeli stosują złożone, hormonalne środki antykoncepcyjne.
Mimo iż u wielu kobiet przyjmujących hormonalne środki antykoncepcyjne stwierdzano nieznaczny wzrost ciśnienia tętniczego krwi, to przypadki istotne klinicznie występowały rzadko. Zaprzestanie stosowania złożonych, doustnych środków antykoncepcyjnych jest uzasadnione jedynie w tych rzadkich przypadkach. Jeżeli podczas stosowania złożonego, hormonalnego środka antykoncepcyjnego u pacjentek z wcześniejszym nadciśnieniem, ciągle podwyższone wartości ciśnienia krwi lub istotnie podwyższone ciśnienie krwi nie obniżą się
odpowiednio w wyniku zastosowania terapii przeciwnadciśnieniowej, złożony, hormonalny środek antykoncepcyjny należy odstawić. Jeśli terapia przeciwnadciśnieniowa przywróci prawidłowe ciśnienie krwi, można wznowić stosowanie środka.
Podczas ciąży i stosowania złożonych, doustnych środków antykoncepcyjnych stwierdzano pojawienie się lub zaostrzenie istniejących stanów tu wymienionych, jednak dowody na związek ze stosowaniem złożonych, doustnych środków antykoncepcyjnych nie są jednoznaczne: żółtaczka i (lub) świąd związany z zastojem żółci, kamienie żółciowe, porfiria, toczeń rumieniowaty układowy, zespół hemolityczno-mocznicowy, pląsawica Sydenhama, opryszczka ciężarnych, utrata słuchu związana z otosklerozą.
Estrogeny pochodzenia zewnętrznego mogą wywoływać lub zaostrzać objawy dziedzicznego lub nabytego obrzęku naczynioruchowego.
Ostre lub przewlekłe zaburzenia czynności wątroby mogą być przyczyną przerwania stosowania złożonych, hormonalnych środków antykoncepcyjnych do czasu, gdy wskaźniki wątrobowe powrócą do normy. Nawrót świądu spowodowanego zastojem żółci, który wystąpił podczas ostatniej ciąży lub wcześniejszego stosowania hormonów płciowych, stwarza konieczność przerwania stosowania złożonych, hormonalnych środków antykoncepcyjnych.
Mimo iż złożone, hormonalne środki antykoncepcyjne mogą wpływać na tkankową oporność na insulinę i tolerancję glukozy, to nie ma dowodów na konieczność modyfikowania schematu terapeutycznego u kobiet z cukrzycą stosujących złożone, doustne środki antykoncepcyjne w małej dawce (zawierające <0,05 mg etynyloestradiolu). Mimo to pacjentki z cukrzycą należy uważnie obserwować, szczególnie w początkowym okresie stosowania złożonych, doustnych środków antykoncepcyjnych.
Obniżony nastrój i depresja to dobrze znane działania niepożądane stosowania hormonalnych środków antykoncepcyjnych (patrz punkt 4.8). Depresja może mieć ciężki przebieg i jest dobrze znanym czynnikiem ryzyka zachowań samobójczych i samobójstw. Jeśli u pacjentki wystąpią zmiany nastroju lub objawy depresji, również krótko po rozpoczęciu leczenia, zaleca się, aby skonsultowała się z lekarzem.
Podczas stosowania złożonych, doustnych środków antykoncepcyjnych zgłaszano nasilenie depresji endogennej, padaczki, choroby Leśniowskiego-Crohna oraz wrzodziejącego zapalenia jelita grubego.
Sporadycznie może wystąpić ostuda, szczególnie u pacjentek, u których w wywiadzie występowała ostuda podczas ciąży. Kobiety ze skłonnością do ostudy podczas przyjmowania złożonych, doustnych środków antykoncepcyjnych powinny unikać ekspozycji na słońce lub promieniowanie ultrafioletowe. Ostuda często nie ustępuje.
Badania lekarskie i konsultacje
Przed rozpoczęciem lub wznowieniem stosowania produktu leczniczego Elin należy przeprowadzić szczegółowy wywiad chorobowy (z wywiadem rodzinnym) oraz wykluczyć ciążę. Należy zmierzyć ciśnienie tętnicze i przeprowadzić badanie fizykalne pod kątem obecności przeciwwskazań (patrz punkt 4.3) i ostrzeżeń (patrz punkt 4.4). Należy zwrócić uwagę kobiety na informacje dotyczące zakrzepicy żylnej i tętniczej, w tym na informacje dotyczące ryzyka związanego ze stosowaniem produktu leczniczego Elinna tle innych złożonych hormonalnych środków antykoncepcyjnych, informacje dotyczące objawów ŻChZZ i tętniczej choroby zakrzepowo-zatorowej, a także informacje dotyczące znanych czynników ryzyka i sposobu postępowania w przypadku podejrzenia zakrzepicy.
Należy poinstruować kobietę, aby dokładnie przeczytała ulotkę dla pacjenta i stosowała się do zaleceń. Częstość i rodzaj badań lekarskich należy określić na podstawie obowiązujących wytycznych i dostosować indywidualnie do pacjentki.
Należy również poinformować kobietę, że hormonalne środki antykoncepcyjne nie chronią przed zakażeniem HIV (AIDS) ani przed innymi chorobami przenoszonymi drogą płciową.
Zmniejszona skuteczność
Skuteczność złożonych, doustnych środków antykoncepcyjnych może być zmniejszona w przypadku pominięcia tabletek z substancją czynną (patrz punkt 4.2), zaburzeń żołądkowo- jelitowych podczas przyjmowania tabletek z substancją czynną (patrz punkt 4.2) lub jednoczesnego stosowania innych leków (patrz punkt 4.5).
Zmniejszona kontrola cyklu
U kobiet przyjmujących złożone, hormonalne środki antykoncepcyjne, zwłaszcza w początkowych miesiącach ich stosowania, mogą wystąpić nieregularne krwawienia (plamienia lub krwawienia międzymiesiączkowe). Z uwagi na to opinia lekarska na temat nieregularnych krwawień będzie miała znaczenie dopiero po okresie adaptacji, trwającym około 3 cykle. Jeśli nieregularne krwawienia międzymiesiączkowe utrzymują się lub pojawiły się po wcześniejszych, regularnych cyklach, a złożony, doustny środek antykoncepcyjny jest przyjmowanie zgodnie z zaleconym schematem, należy rozważyć inną przyczynę niż ta wynikająca ze stosowania złożonych, doustnych środków antykoncepcyjnych. Należy przeanalizować przyczyny niehormonalne, a w razie konieczności przeprowadzić odpowiednią diagnostykę celem wykluczenia choroby organicznej lub ciąży. Badania diagnostyczne mogą obejmować wyłyżeczkowanie jamy macicy.
U niektórych kobiet może nie występować krwawienie z odstawienia podczas przerwy w stosowaniu tabletek. Jeżeli złożony, doustny środek antykoncepcyjny był stosowany zgodnie z zaleceniami opisanymi w punkcie 4.2, ciąża jest mało prawdopodobna. Jeśli jednak złożony, doustny środek antykoncepcyjny nie był stosowany zgodnie z tymi zaleceniami przed pierwszym brakiem krwawienia z odstawienia albo jeśli u kobiety nie wystąpią dwa kolejne krwawienia z odstawienia, to przed kontynuowaniem stosowania złożonych, doustnych środków antykoncepcyjnych należy wykluczyć ciążę.
U niektórych pacjentek po odstawieniu antykoncepcji hormonalnej może wystąpić brak lub skąpe miesiączki, szczególnie gdy dotyczyło ich to wcześniej.
Podczas przyjmowania norgestymatu z etynyloestradiolem nie należy stosować preparatów ziołowych zawierających ziele dziurawca (Hypericum perforatum) (patrz punkt 4.5).
Substancje pomocnicze
Tabletki zawierają laktozę. Produkt nie powinien być stosowany u pacjentek z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
Produkt zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy produkt uznaje się za
„wolny od sodu”.
Wpływ innych leków na produkt Elin
Mogą wystąpić interakcje z innymi produktami leczniczymi indukującymi enzymy mikrosomalne w postaci zwiększenia klirensu hormonów płciowych, co może powodować krwawienia śródcykliczne i (lub) nieskuteczność antykoncepcji.
Postępowanie
Indukcja enzymów może wystąpić po kilku dniach leczenia. Maksymalna indukcja enzymatyczna jest zazwyczaj widoczna w ciągu kilku tygodni. Po zakończeniu leczenia indukcja enzymatyczna może utrzymywać się przez około 4 tygodnie.
Leczenie krótkoterminowe
Kobiety leczone produktami leczniczymi indukującymi enzymy mikrosomalne powinny stosować tymczasowo mechaniczną lub inną metodę antykoncepcji oprócz doustnego środka antykoncepcyjnego. Dodatkowe metody muszą być stosowane podczas całego okresu terapii skojarzonej oraz przez 28 dni po zakończeniu leczenia.
Leczenie długoterminowe
Kobietom stosującym przez długi okres leki indukujące enzymy wątrobowe, zaleca się stosowanie innej, skutecznej, niehormonalnej metody antykoncepcji.
W piśmiennictwie opisano następujące interakcje.
Produkty lecznicze zwiększające klirens doustnych środków antykoncepcyjnych (zmniejszające skuteczność poprzez indukcję enzymów) np.:
barbiturany, bozentan, karbamazepina, fenytoina, prymidon, ryfampicyna, i leki stosowane
w leczeniu zakażeń wirusem HIV (rytonawir, newirapina, efawirenz) i prawdopodobnie także felbamat, gryzeofulwina, okskarbazepina, topiramat oraz produkty lecznicze roślinne zawierające dziurawiec zwyczajny (Hypericum perforatum).
Produkty lecznicze wywierające wpływ na klirens doustnych środków antykoncepcyjnych: Równoczesne stosowanie doustnych środków antykoncepcyjnych z inhibitorami proteazy HIV i nienukleozydowymi inhibitorami odwrotnej transkryptazy, włączając połączenie
z inhibitorami HCV, może zwiększać lub zmniejszać stężenie estrogenów lub progestagenów w osoczu.
W niektórych przypadkach zmiany te mogą mieć znaczenie kliniczne.
Dlatego też, przepisując równoczesne stosowanie produktów leczniczych przeciwko HIV/HCV należy wziąć pod uwagę możliwe interakcje oraz odpowiednie zalecenia.
W przypadku jakichkolwiek wątpliwości, u kobiet podczas terapii inhibitorami proteazy lub nienukleozydowymi inhibitorami odwrotnej transkryptazy należy stosować dodatkową, mechaniczną metodę antykoncepcji.
Produkty lecznicze wpływające na wchłanianie
Leki zwiększające motorykę przewodu pokarmowego, jak np. metoklopramid, mogą zmniejszać wchłanianie hormonów.
Leczenie węglem aktywnym będzie ograniczać wchłanianie hormonów steroidowych.
Potencjalnie znaczące klinicznie zmiany stężenia w osoczu jednocześnie podawanych leków:
Złożone, hormonalne środki antykoncepcyjne mogą także wpływać na farmakokinetykę niektórych leków, jeśli są one stosowane jednocześnie.
Leki, których stężenie w osoczu może wzrosnąć (z powodu zahamowania aktywności enzymu CYP) - przykłady:
Interakcje farmakodynamiczne
Podczas badań klinicznych u pacjentów leczonych z powodu zakażenia wirusem zapalenia wątroby typu C (HCV) produktami leczniczymi zawierającymi ombitaswir z parytaprewirem i rytonawirem oraz dazabuwir z rybawiryną lub bez, zwiększenie aktywności aminotransferaz (AlAT) do wartości ponad pięciokrotnie większych niż górna granica normy występowało znacząco częściej u kobiet stosujących produkty lecznicze zawierające etynyloestradiol, takie jak złożone hormonalne produkty antykoncepcyjne. Dodatkowo, również u pacjentów leczonych glekaprewirem z pibrentaswirem lub sofosbuwirem z welpataswirem
i woksylaprewirem, obserwowano zwiększenie aktywności AlAT u kobiet stosujących leki zawierające etynyloestradiol, takie jak złożone hormonalne środki antykoncepcyjne (patrz punkt 4.3).
Dlatego pacjentka przyjmująca produkt leczniczy Elin musi zmienić metodę antykoncepcji na alternatywną (np. antykoncepcja zawierająca wyłącznie progestagen lub metody niehormonalne) przed rozpoczęciem leczenia za pomocą tych połączeń. Produkt leczniczy Elin można zastosować ponownie po 2 tygodniach po zakończeniu leczenia za pomocą wcześniej opisanych połączeń.
Badania laboratoryjne
Stosowanie steroidów antykoncepcyjnych może wpływać na wyniki pewnych badań laboratoryjnych, w tym biochemiczne parametry wątroby, tarczycy, nadnerczy i czynności nerek, stężeń osoczowych białek (nośnikowych), np. globuliny wiążącej kortykosteroidy i frakcji lipidowej i (lub) lipoproteinowej, parametry metabolizmu węglowodanów, parametry krzepnięcia i fibrynolizy. Zmiany na ogół pozostają w zakresie norm laboratoryjnych.
Ciąża
Produkt przeciwwskazany w ciąży. Przed zaprzestaniem przyjmowania produktu potwierdzić podejrzenie ciąży.
Przy wznawianiu stosowania produktu leczniczego Elin w okresie połogu należy rozważyć zwiększone ryzyko ŻChZZ (patrz punkty 4.2 i 4.4).
Karmienie piersią
Steroidy zawarte w środkach antykoncepcyjnych i (lub) ich metabolity mogą przenikać do mleka.
Stosowanie złożonych, doustnych środków antykoncepcyjny jest przeciwwskazane u kobiet karmiących, które urodziły mniej niż 6 tygodni temu (patrz punkt 4.3); stosowanie środków u kobiet karmiących pomiędzy 6. tygodniem a 6. miesiącem po porodzie musi mieć kliniczne uzasadnienie (patrz punkt 4.4).
Kobietom karmiącym piersią, zamiast stosowania tabletek złożonych, które zmniejszają laktację, należy zalecać stosowanie „minipigułek” (zawierających wyłącznie progestagen).
Płodność
Norgestymat stosowany w monoterapii i w skojarzeniu z etynyloestradiolem jest skutecznym środkiem przeciwowulacyjnym. Po zakończeniu stosowania doustnego środka antykoncepcyjnego pacjentka powinna powstrzymać się od zajścia w ciążę przynajmniej do
momentu wystąpienia jednej, naturalnej miesiączki, aby można było ustalić wiek ciąży. W takim okresie należy stosować inną metodę antykoncepcji.
Stosowanie norgestymatu w skojarzeniu z etynyloestradiolem u szczurów płci żeńskiej dla wszystkich wielkości dawek skutkowało zależnym od dawki zahamowaniem płodności, zmniejszeniem skuteczności zagnieżdżenia się komórki jajowej oraz mniejszą liczebnością miotów, a także większą resorpcją płodów. Skojarzenie to wykazuje umiarkowanie silne działanie progestagenne w badaniu in vivo, które mierzy przerost endometrium u królików oraz skutecznie blokuje owulację u szczurów, chomików i królików.
Nie przeprowadzono badań dotyczących wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Nie stwierdzono wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn u pacjentek stosujących złożone, doustne środki antykoncepcyjne.
Opis wybranych działań niepożądanych
U kobiet używających złożonych hormonalnych środków antykoncepcyjnych występuje zwiększone ryzyko występowania zdarzeń zakrzepowych i zakrzepowo-zatorowych w krążeniu żylnym i tętniczym, w tym zawału mięśnia sercowego, udaru mózgu, przemijających napadów niedokrwienia mózgu, zakrzepicy żylnej i zatorowości płucnej - omówiono je szerzej w punkcie 4.4.
Pewne niepożądane działania produktu, które przypisuje się stosowaniu doustnych środków antykoncepcyjnych wymagają natychmiastowej konsultacji lekarskiej i (lub) zaprzestania przyjmowania takich środków. Do tego rodzaju niepożądanych działań należą: zawał mięśnia sercowego, zakrzepica żył głębokich, zatorowość płucna, incydenty mózgowo-naczyniowe, zakrzepica żył siatkówki, nowy przypadek migrenowego bólu głowy, rak piersi, gruczolaki wątroby, nowotwory wątroby, wysokie ciśnienie tętnicze, obrzęk naczynioruchowy, pokrzywka oraz nadwrażliwość.
Podczas badań diagnostycznych oraz leczenia należy stosować inne środki antykoncepcji niehormonalnej.
Według danych zbiorczych dotyczących bezpieczeństwa stosowania z 5 badań klinicznych najczęściej zgłaszanym (˃10% częstości występowania) działaniem niepożądanym był ból głowy (27,9%). Najczęściej zgłaszanym (˃10% częstości występowania) działaniem niepożądanym określonym podczas badań po wprowadzeniu produktu do obrotu była biegunka (11,8%).
Najczęściej zgłaszanymi (˃10%) działaniami niepożądanymi w trakcie pierwszego cyklu badań klinicznych były: zaburzenia miesiączkowania (40,4%), nudności (29,1%), krwawienie z dróg rodnych (26,3%), zaburzenia żołądkowo-jelitowe [zgłaszane jako nudności lub wymioty] (24,6%) oraz nieprawidłowe krwawienie z odstawienia (16,9%). Częstość powyższych działań niepożądanych była największa w cyklu 1. i z kolejnymi cyklami zmniejszała się, za wyjątkiem częstości występowania zaburzeń miesiączkowania. Częstość zgłaszania wymiotów była największa w cyklu 12 (11,8%).
Bezpieczeństwo norgestymatu + etynyloestradiolu badano w pięciu badaniach klinicznych (2 randomizowane badania z aktywną kontrolą oraz 3 otwarte badania bez grupy kontrolnej) z udziałem 1891 zdrowych kobiet w wieku rozrodczym. W 3 badaniach pacjentki
obserwowano do 24 cykli, a w pozostałych 2 badania do 12 cykli. Dodatkowe badanie bez grupy kontrolnej (n=8 331) służyło zgłaszaniu działań niepożądanych według cyklu terapii, do 24 cykli. Z uwagi na to, że częstość występowania działań niepożądanych różni się w zależności od cyklu terapii, podczas przypisywania działań niepożądanych do kategorii częstości posługiwano się danymi z cykli o największej liczbie zdarzeń.
W poniższej tabeli występują wszystkie zdarzenia niepożądane zgłoszone podczas stosowania norgestymatu z etynyloestradiolem w trakcie badań klinicznych lub pochodzące z danych dotyczących stosowania tabletek norgestymatu i etynyloestradiolu, które uzyskano po wprowadzeniu produktu do obrotu.
Przedstawione kategorie częstości opracowano zgodnie z następującą konwencją: Bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych).
Zakażenia i zarażenia pasożytnicze | |
Często | Zakażenie dróg moczowych, zakażenia pochwy |
Nowotwory łagodne, złośliwe i nieokreślone (w tym torbiele i polipy) | |
Niezbyt często | Dysplazja szyjki macicy |
Rzadko | Torbiele piersi |
Nieznana częstość występowania | Gruczolaki wątroby, rak piersi, łagodny nowotwór piersi, ogniskowy rozrost guzkowy wątroby, gruczolakowłókniak piersi |
Zaburzenia układu immunologicznego | |
Często | Nadwrażliwość |
Nieznana częstość występowania | Nasilenie objawów dziedzicznego lub nabytego obrzęku naczynioruchowego |
Zaburzenia metabolizmu i odżywiania | |
Często | Zatrzymanie płynów w organizmie |
Niezbyt często | Zmniejszone lub zwiększone łaknienie, zmiany masy ciała |
Rzadko | Zaburzenia apetytu |
Nieznana częstość występowania | Dyslipidemia |
Zaburzenia psychiczne | |
Często | Zmiany nastroju, depresja, nerwowość, bezsenność |
Niezbyt często | Lęk, zaburzenia popędu płciowego |
Rzadko | Utrata popędu płciowego |
Zaburzenia układu nerwowego | |
Bardzo często | Bóle głowy |
Często | Migrena, zawroty głowy |
Niezbyt często | Omdlenie, parestezje |
Nieznana częstość występowania | Incydent naczyniowo-mózgowy, drgawki |
Zaburzenia oka | |
Niezbyt często | Zaburzenia widzenia, suchość oczu |
Nieznana częstość występowania | Nietolerancja szkieł kontaktowych, zakrzepica żył siatkówki* |
Zaburzenia ucha i błędnika | |
Rzadko | Zawroty głowy |
Zaburzenia serca | |
Niezbyt często | Kołatanie serca |
Rzadko | Tachykardia |
Nieznana częstość występowania | Zawał mięśnia sercowego |
Zaburzenia naczyniowe | |
Niezbyt często | Zakrzepica, nadciśnienie tętnicze, uderzenia gorąca |
Rzadko | Żylne zdarzenia zakrzepowe lub tętnicze zdarzenia zakrzepowe |
Nieznana częstość występowania | Zakrzepica żył głębokich* |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | |
Niezbyt często | Duszność |
Nieznana częstość występowania | Zatorowość płucna* |
Zaburzenia żołądka i jelit | |
Bardzo często | Zaburzenia żołądkowo - jelitowe, wymioty, biegunka, nudności |
Często | Bóle żołądkowo - jelitowe, bóle brzucha, wzdęcia, zaparcia, wiatry |
Rzadko | Zapalenie trzustki |
Zaburzenia wątroby i dróg żółciowych | |
Rzadko | Zapalenie wątroby |
Zaburzenia skóry i tkanki podskórnej | |
Często | Trądzik, wysypka |
Niezbyt często | Łysienie, hirsutyzm, pokrzywka, świąd, rumień, przebarwienia skóry |
Rzadko | Nasilone pocenie, nadwrażliwość na światło |
Nieznana częstość występowania | Obrzęk naczynioruchowy, rumień guzowaty, nocne poty |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | |
Często | Bolesne skurcze mięśni, ból kończyn, ból pleców |
Niezbyt często | Ból mięśni |
Zaburzenia układu rozrodczego i piersi | |
Bardzo często | Zaburzenia miesiączkowania, krwotok maciczny, nieprawidłowe krwawienie z odstawienia |
Często | Brak miesiączki, upławy, ból piersi |
Niezbyt często | Wydzielina z piersi, powiększenie piersi, torbiel jajnika, suchość sromu i pochwy |
Rzadko | Upławy |
Nieznana częstość występowania | Zahamowanie laktacji |
Zaburzenia ogólne i stany w miejscu podania | |
Często | Ból w klatce piersiowej, obrzęki, osłabienie |
Badania diagnostyczne | |
Często | Zwiększenie masy ciała |
Niezbyt często | Zmniejszenie masy ciała |
* Nie stwierdzono w badaniach klinicznych, co uniemożliwia określenie częstości. Patrz punkt 4.4 dla częstości opartej na standardowych wskaźnikach zgłaszania zdarzeń dla podobnych złożonych, hormonalnych środków antykoncepcyjnych.
Interakcje
Interakcje pomiędzy doustnymi środkami antykoncepcyjnymi a innymi produktami leczniczymi (induktorami enzymatycznymi) mogą prowadzić do krwawienia śródcyklicznego i (lub) braku skuteczności antykoncepcyjnej (patrz punkt 4.5).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie zaobserwowano żadnego ciężkiego szkodliwego wpływu na stan zdrowia po przedawkowaniu. Objawy, jakie mogą wystąpić to: nudności, wymioty i krwawienie z dróg rodnych. Ponieważ brak jest odtrutki, należy zastosować leczenie objawowe.
Grupa farmakoterapeutyczna: hormonalne środki antykoncepcyjne do stosowania ogólnego; progestageny i estrogeny, dawki stałe, kod ATC: G03AA11
Norgestymat + etynyloestradiol działają dzięki mechanizmowi hamowania wydzielania gonadotropin w wyniku działania estrogenowego i progestagenowego etynyloestradiolu i norgestymatu. Podstawowym mechanizmem działania jest zahamowanie owulacji, ale do skuteczności antykoncepcyjnej środka może przyczyniać się także wpływ na zmianę właściwości śluzu szyjkowego, motoryki jajowodów oraz błony śluzowej trzonu macicy.
Wchłanianie
Norgestymat i etynyloestradiol są szybko wchłaniane po podaniu doustnym. Po jednorazowym lub wielokrotnym (trzy cykle) podawaniu norgestymatu/etynyloestradiolu, stężenie norgestymatu w surowicy pozostaje poniżej granicy oznaczalności ilościowej
(0,1 ng/ml). Natomiast stężenie metabolitów norgestymatu - norelgestrominu i norgestrelu - obecne w krążeniu jest mierzalne, osiągając stężenie maksymalne w surowicy po około 1,5 godziny od podania. Zwiększenie wartości Cmax oraz AUC dla norelgestrominu jest proporcjonalne do dawki w zakresie dawek norgestymatu od 0,180 do 0,250 mg. Stężenie etynyloestradiolu w osoczu jest mierzalne w okresie 0,5 godziny od podania dawki, osiągając stężenie maksymalne po około 1,2 godziny od podania.
Dystrybucja
Norelgestromin i norgestrel w dużym stopniu (>97%) wiążą się z białkami osocza. Norelgestromin jest związany z albuminami, ale nie z SHBG, natomiast norgestrel jest związany głównie z SHBG, a w znacznie mniejszym stopniu z albuminami. Etynyloestradiol w znacznym stopniu wiąże się z albuminami osocza.
Badania wykazały, że brak, w porównaniu do innych progestagenów w antykoncepcji doustnej, wiązania się norelgestrominu z SHBG ma podstawowe znaczenie dla zwiększenia jego aktywności biologicznej. W przeciwieństwie do tego norgestrel powstający z norgestymatu jest w znacznym stopniu związany z SHBG, co ogranicza jego aktywność biologiczną.
Metabolizm
Norgestymat jest szybko metabolizowany podczas pierwszego przejścia (przez jelito i (lub) wątrobę) do norelgestrominu (maksymalne stężenia w osoczu występują w ciągu 2 godzin) i norgestrelu, które są farmakologicznie czynnymi progestagenami. Etynyloestradiol jest metabolizowany do różnych metabolitów hydroksylowanych oraz ich związków sprzężonych, czyli glukuronianów lub siarczanów.
Eliminacja
Zarówno norelgestromin, norgestrel, jak i etynyloestradiol są następnie metabolizowane, a ich metabolity są wydalane przez nerki i z kałem. Wartości okresu półtrwania w fazie eliminacji w stanie równowagi dynamicznej wynosiły od 10 do 15 godzin dla etynyloestradiolu, 24,9 godzin dla norelgestrominu oraz 45 godzin dla norgestrelu. Po podaniu norgestymatu znakowanego radioizotopem węgla 14C 47% podanej dawki promieniotwórczej zostało wydalone z moczem, a 37% z kałem.
Farmakokinetyka stanu równowagi dynamicznej
Po podaniu 0,250 mg norgestymatu + 0,035 mg etynyloestradiolu średnia AUC0-24h w stanie równowagi dynamicznej określona na podstawie stężeń substancji niezwiązanych z SHBG w surowicy wynosiła 18,1 godz. ng/ml w odniesieniu do norelgestrominu oraz 3,64 godz. ng/ml w odniesieniu do norgestrelu. AUC dla norgestrelu, po przyjęciu 0,250 mg norgestymatu łącznie z 0,035 mg etynyloestradiolu, odpowiada ekspozycji po przyjęciu lewonorgestrelu w dawce około 30 mikrogramów w połączeniu z etynyloestradiolem.
Badania niekliniczne nie wykazały szczególnych zagrożeń dla człowieka, poza tymi, które wymieniono w innych punktach Charakterystyki Produktu Leczniczego. Badania te obejmowany m.in. badania toksyczności po podaniu jednorazowym i wielokrotnym, badania genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród i rozwój potomstwa z zastosowaniem złożonego środka zawierającego norgestymat oraz etynyloestradiol.
Laktoza bezwodna Laktoza jednowodna Powidon K-25
all-rac-α-tokoferol Celuloza mikrokrystaliczna Kroskarmeloza sodowa
Skrobia żelowana (Starch 1500)
Magnezu stearynian Indygotyna, lak (E132)
Nie dotyczy.
2 lata
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Blistry z PVC/PVdC/Aluminium, zawierające 21 tabletek. Każdy blister pakowany jest w torebkę z potrójnie laminowanej folii aluminiowej.
Wielkości opakowań:
21 tabletek
21 tabletek (1 blister po 21 tabletek)
63 tabletki (3 blistry po 21 tabletek)
126 tabletek (6 blistrów po 21 tabletek)
273 tabletek (13 blistrów po 21 tabletek)
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań.
Zakłady Farmaceutyczne POLPHARMA S.A. ul. Pelplińska 19
83-200 Starogard Gdański
Pozwolenie nr 21205
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 23.05.2013 r. Data ostatniego przedłużenia pozwolenia: 14.06.2018 r.
24.03.2023 r.











