Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1
Wrodzone wady metabolizmu aminokwasów
Ciężkie zaburzenia układu krążenia z zagrożeniem życia (np. wstrząs)
Hipoksja
Kwasica metaboliczna
Ciężka niewydolność wątroby
Ciężka niewydolność nerek bez leczenia nerkozastępczego
Niewyrównana niewydolność serca
Ostry obrzęk płuc
Zaburzenia równowagi elektrolitów i płynów
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Podczas przygotowywania mieszanin:
Dodatkowe informacje:
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
Aminoplasmal Paed 10%, roztwór do infuzji
Roztwór do infuzji zawiera:
w 1 ml | w 100 ml | w 250 ml | |
Izoleucyna | 5,10 mg | 0,51 g | 1,28 g |
Leucyna | 7,60 mg | 0,76 g | 1,90 g |
Lizyna jednowodna (odpowiada lizynie) | 9,88 mg (8,80 mg) | 0,99 g (0,88 g) | 2,47 g (2,20 g) |
Metionina | 2,00 mg | 0,20 g | 0,50 g |
Fenyloalanina | 3,10 mg | 0,31 g | 0,78 g |
Treonina | 5,10 mg | 0,51 g | 1,28 g |
Tryptofan | 4,00 mg | 0,40 g | 1,00 g |
Walina | 6,10 mg | 0,61 g | 1,53 g |
Arginina | 9,10 mg | 0,91 g | 2,28 g |
Histydyna | 4,60 mg | 0,46 g | 1,15 g |
Alanina | 15,90 mg | 1,59 g | 3,98 g |
Glicyna | 2,00 mg | 0,20 g | 0,50 g |
Kwas asparaginowy | 6,60 mg | 0,66 g | 1,65 g |
Kwas glutaminowy | 9,30 mg | 0,93 g | 2,33 g |
Prolina | 6,10 mg | 0,61 g | 1,53 g |
Seryna | 2,00 mg | 0,20 g | 0,50 g |
N-acetylotyrozyna (odpowiada tyrozynie) | 1,30 mg (1,06 mg) | 0,13 g (0,11 g) | 0,33 g (0,27 g) |
Acetylocysteina (odpowiada cysteinie) | 0,700 mg (0,520 mg) | 0,070 g (0,052 g) | 0,175 g (0,13 g) |
Tauryna | 0,300 mg | 0,030 g | 0,075 g |
Łączna zawartość aminokwasów | 0,1 g | 10 g | 25 g |
Łączna zawartość azotu | 0,0152 g | 1,52 g | 3,8 g |
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do infuzji
Przejrzysty, bezbarwny lub lekko żółtawy roztwór
Wartość energetyczna [kJ/l (kcal/l)] | 1700 (406) |
Osmolarność teoretyczna [mOsm/l] | 790 |
Kwasowość (miareczkowanie do pH 7,4) [mmol NaOH/l] | 23 |
pH | ok. 6,1 |
Źródło aminokwasów w żywieniu pozajelitowym w skojarzeniu z roztworami dostarczającymi energię (glukozę i tłuszcze) oraz elektrolity, jeśli żywienie doustne lub dojelitowe nie jest możliwe, jest
niewystarczające lub przeciwwskazane.
Roztwór jest wskazany do stosowania u noworodków, urodzonych o czasie lub przedwcześnie niemowląt, małych dzieci i starszych dzieci.
Dawkowanie
Dzieci i młodzież
Podane poniżej zasady dawkowania dla grup wiekowych stanowią przybliżone wartości orientacyjne.
Dokładne dawki powinny być dostosowywane indywidualnie na podstawie wieku, stopnia rozwoju i choroby podstawowej.
Infuzję należy rozpocząć z szybkością o wartości poniżej docelowej wartości szybkości infuzji, zwiększając do wartości docelowej w ciągu pierwszej godziny.
Podaż aminokwasów w ramach żywienia pozajelitowego uważana za właściwą dla większości dzieci:
Dawka dobowa dla noworodków urodzonych przedwcześnie:
1,5-4,0 g aminokwasów/kg masy ciała ≙ 15-40 ml/kg masy ciała
Dawka dobowa dla noworodków urodzonych o czasie (w wieku od 0 do 27 dni):
1,5-3,0 g /kg masy ciała ≙ 15-30 ml/kg masy ciała
Dawka dobowa dla niemowląt i małych dzieci (w wieku od 28 dni do 23 miesięcy):
1,0-2,5 g /kg masy ciała ≙ 10-25 ml/kg masy ciała
Dawka dobowa dla starszych dzieci (w wieku od 2 do 11 lat):
1,0-2,0 g/kg masy ciała ≙ 10-20 ml/kg masy ciała
Dzieci w ciężkim stanie: W przypadku dzieci w ciężkim stanie zalecana dawka aminokwasów może być większa (do 3,0 g aminokwasów/kg masy ciała na dobę).
Pacjenci z niewydolnością nerek i (lub) wątroby
Dawki należy dostosować indywidualnie u pacjentów z niewydolnością wątroby lub nerek (patrz również punkt 4.4). Aminoplasmal Paed 10% jest przeciwwskazany w ciężkiej niewydolności wątroby i ciężkiej niewydolności nerek bez leczenia nerkozastępczego (patrz punkt 4.3).
Czas trwania leczenia
Roztwór można podawać tak długo, jak wskazane jest żywienie pozajelitowe.
Sposób podawania Podanie dożylne.
Wyłącznie do infuzji do żyły centralnej.
Podczas stosowania u dzieci w przedziale wiekowym od wcześniaka do 2 lat, roztwór (w worku i zestawie do podawania) należy chronić przed światłem do momentu zakończenia podawania (patrz punkt 4.4, 6.3
i 6.6). Podczas przygotowywania mieszanin stosowanie opakowania ochronnego chroniącego przed dostępem światła może być niemożliwe. Należy jednak w jak największym stopniu zmniejszyć narażenie na działanie światła podczas przygotowywania mieszanin.
W przypadku zaburzeń metabolizmu aminokwasów innego pochodzenia niż wymieniono w punkcie 4.3 produkt leczniczy należy podawać wyłącznie po przeprowadzeniu starannej oceny korzyści i ryzyka.
Narażenie na działanie światła roztworów do dożylnego żywienia pozajelitowego, szczególnie po dodaniu pierwiastków śladowych i (lub) witamin, może mieć niepożądany wpływ na efekt kliniczny u noworodków, ze względu na wytwarzanie nadtlenków i innych produktów rozpadu. Podczas stosowania u dzieci
w przedziale wiekowym od wcześniaka do 2 lat, produkt leczniczy Aminoplasmal Paed 10% należy chronić przed światłem otoczenia do momentu zakończenia podawania (patrz punkt 4.2, 6.3 i 6.6). Podczas przygotowywania mieszanin stosowanie opakowania ochronnego chroniącego przed dostępem światła może być niemożliwe. Należy jednak w jak największym stopniu zmniejszyć narażenie na działanie światła podczas przygotowywania mieszanin.
Należy zachować ostrożność, podając duże objętości płynów infuzyjnych pacjentom z niewydolnością serca. Należy zachować ostrożność w przypadku pacjentów z podwyższoną osmolarnością surowicy.
Przed rozpoczęciem żywienia pozajelitowego należy wyrównać zaburzenia równowagi płynów i elektrolitów (np. odwodnienie hipotoniczne, hiponatremia, hipokaliemia).
Należy regularnie monitorować stężenie elektrolitów w surowicy, stężenie glukozy we krwi, równowagę płynów, równowagę kwasowo-zasadową i czynność nerek.
Monitorowanie powinno także obejmować stężenie białka w surowicy i testy czynnościowe wątroby. U pacjentów z niewydolnością nerek dawkę należy starannie dostosować do indywidualnych potrzeb,
stopnia niewydolności narządu i rodzaju stosowanego leczenia nerkozastępczego (hemodializa, hemofiltracja
itp).
U pacjentów z niewydolnością wątroby dawkę należy starannie dostosować do indywidualnych potrzeb i stopnia niewydolności narządu.
Roztwory aminokwasów są tylko jednym z elementów żywienia pozajelitowego. Aby zapewnić pełne
żywienie pozajelitowe, wraz z aminokwasami należy podawać substraty stanowiące niebiałkowe źródło energii, niezbędne kwasy tłuszczowe, elektrolity, witaminy, płyny i pierwiastki śladowe.
W przypadku mikroelementów należy stosować preparaty dla dzieci.
Podczas długotrwałego stosowania (kilka tygodni) należy dokładnie kontrolować parametry morfologii krwi i czynniki krzepnięcia.
Nieznane.
Aminoplasmal Paed 10% jest przeznaczony do stosowania wyłącznie u dzieci i młodzieży.
Nie dotyczy.
Mogą wystąpić działania niepożądane, które jednakże nie są wyraźnie związane z produktem, tylko z żywieniem pozajelitowym, szczególnie w początkowym jego etapie.
Działania niepożądane są wymienione zgodnie z częstością ich występowania w następujący sposób: Bardzo często (≥1/10)
Często (≥1/100 do <1/10) Niezbyt często (≥1/1 000 do <1/100)
Rzadko (≥1/10 000 do <1/1 000) Bardzo rzadko (<1/10 000)
Nieznana (częstość nie może być określona na podstawie dostępnych danych)
Zaburzenia układu immunologicznego
Nieznana: reakcje alergiczne
Zaburzenia żołądka i jelit
Niezbyt często: nudności, wymioty
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych
i Produktów Biobójczych Al. Jerozolimskie 181C, 02 222 Warszawa,
Tel.: + 48 22 49 21 301,
Faks: + 48 22 49 21 309,
strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy przedawkowania płynów
Przedawkowanie lub zbyt duża szybkość infuzji mogą prowadzić do przewodnienia, zaburzeń równowagi elektrolitów i obrzęku płuc.
Objawy przedawkowania aminokwasów
Przedawkowanie lub zbyt duża szybkość infuzji mogą prowadzić do wystąpienia reakcji nietolerancji, których objawy obejmują nudności, wymioty, dreszcze, ból głowy, kwasicę metaboliczną, hiperamonemię i utratę aminokwasów przez nerki.
Leczenie
W przypadku wystąpienia reakcji nietolerancji należy tymczasowo przerwać infuzję aminokwasów i wznowić ją w późniejszym czasie przy mniejszej szybkości infuzji.
Grupa farmakoterapeutyczna: substytuty krwi i roztwory do perfuzji, roztwory dożylne do żywienia pozajelitowego, aminokwasy.
kod ATC: B05BA01
Mechanizm działania
Celem żywienia pozajelitowego jest dostarczenie wszystkich substancji odżywczych niezbędnych do wzrostu, utrzymania i regeneracji tkanek organizmu itp.
Aminokwasy mają szczególne znaczenie, ponieważ są częściowo niezbędne w procesie syntezy białka. Aminokwasy podawane dożylnie są włączane do odpowiednich zasobów wewnątrznaczyniowych i wewnątrzkomórkowych aminokwasów. Zarówno aminokwasy endogenne, jak i egzogenne służą jako substrat do syntezy białek funkcjonalnych i strukturalnych.
W celu zapobiegania metabolizmowi aminokwasów w procesie wytwarzania energii oraz zasilania podczas innych energochłonnych procesów w organizmie niezbędne jest jednoczesne dostarczanie niebiałkowych
źródeł energii (w postaci węglowodanów lub tłuszczów).
Wchłanianie
Ponieważ ten produkt leczniczy jest podawany we wlewie dożylnym, dostępność biologiczna aminokwasów zawartych w roztworze wynosi 100%.
Dystrybucja
Aminokwasy są budulcem różnorodnych białek w różnych tkankach organizmu. Ponadto każdy aminokwas występuje w postaci wolnej we krwi i wewnątrz komórek.
Skład roztworu aminokwasów został opracowany w oparciu o wyniki badań klinicznych metabolizmu
w warunkach dożylnego podawania aminokwasów. Ilości aminokwasów zawartych w roztworze ustalono w taki sposób, aby możliwe było osiągnięcie jednorodnego wzrostu stężenia wszystkich aminokwasów
w osoczu. Stosunki fizjologiczne aminokwasów w osoczu, tzn. homeostaza aminokwasów, są zatem zachowane podczas infuzji produktu leczniczego.
Prawidłowy wzrost i rozwój płodu zależą od ciągłego zaopatrywania w aminokwasy przez matkę. Łożysko jest odpowiedzialne za transport aminokwasów między dwoma układami krążenia.
Metabolizm
Aminokwasy, które nie biorą udziału w syntezie białka, są metabolizowane w następujący sposób: grupa aminowa zostaje oddzielona od szkieletu węglowego na drodze transaminacji. Łańcuch węglowy jest
utleniany bezpośrednio do postaci CO2 lub zużywany w wątrobie jako substrat w procesie glukoneogenezy. Grupa aminowa także ulega metabolizmowi w wątrobie do mocznika.
Eliminacja
Tylko niewielkie ilości aminokwasów są wydalane w niezmienionej postaci z moczem.
Nie przeprowadzono badań nieklinicznych nad produktem Aminoplasmal Paed 10%. Aminokwasy zawarte w produkcie Aminoplasmal Paed 10% są substancjami naturalnie występującymi w organizmie.
W związku z tym nie należy spodziewać się działań toksycznych, jeśli są należycie przestrzegane wskazania, przeciwwskazania i zalecenia dotyczące dawkowania.
Kwas cytrynowy jednowodny (do ustalania pH) Woda do wstrzykiwań
Aminoplasmal Paed 10% można mieszać wyłącznie z innymi składnikami odżywczymi, takimi jak węglowodany, tłuszcze, witaminy i pierwiastki śladowe, dla których wykazano zgodność.
Dane dotyczące zgodności dla różnych domieszek (np. elektrolitów, pierwiastków śladowych, witamin) oraz okres ważności tego typu domieszek można uzyskać na prośbę od wytwórcy. Patrz również punkt 6.6.
W zamkniętym opakowaniu (worek w opakowaniu ochronnym)
2 lata
Po pierwszym otwarciu
Po pierwszym otwarciu produkt leczniczy należy natychmiast zużyć.
Podczas stosowania u dzieci w przedziale wiekowym od wcześniaka do 2 lat, roztwór (w worku i zestawie do podawania) należy chronić przed światłem do momentu zakończenia podawania (patrz punkt 4.2, 4.4
i 6.6).
Podczas przygotowywania mieszanin
Podczas przygotowywania mieszanin stosowanie opakowania ochronnego chroniącego przed dostępem światła może być niemożliwe. Należy jednak w jak największym stopniu zmniejszyć narażenie na działanie światła podczas przygotowywania mieszanin.
Po dodaniu domieszek
Z mikrobiologicznego punktu widzenia mieszanki należy podać bezpośrednio po przygotowaniu. Jeśli mieszanka nie jest używana natychmiast, odpowiedzialność za warunki i czas przechowywania mieszanki przed zastosowaniem ponosi użytkownik i zazwyczaj nie powinny one przekraczać 24 godzin i 2°C-8°C, chyba że rozcieńczanie przeprowadzono w kontrolowanych i zwalidowanych warunkach aseptycznych.
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. Nie zamrażać.
Aminoplasmal Paed 10% jest dostarczany w workach z wielowarstwowej folii (z polipropylenu, SEBS (styren/etylen/butylen/styren) i kopoliestru eteru). Wewnętrzna warstwa, stykająca się z roztworem, jest wykonana z polipropylenu. Pojemność worków wynosi 100 ml lub 250 ml.
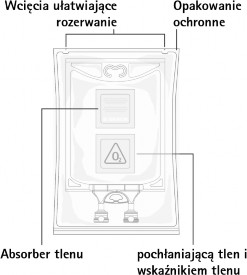
Worek umieszczony w zewnętrznym opakowaniu ochronnym. Substancja pochłaniająca tlen i wskaźnik tlenu są umieszczone w przestrzeni między workiem i opakowaniem ochronnym; wskaźnik tlenu jest
termoformowanym blistrem zawierającym wrażliwy na tlen barwnik rezorufinę sodową; saszetka
zawierająca substancję pochłaniającą tlen jest wykonana z obojętnego materiału i zawiera wodorotlenek żelaza.
Wielkości opakowań: 12 x 100 ml i 12 x 250 ml.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań dotyczących usuwania.
Pojemniki są przeznaczone wyłącznie do jednorazowego użytku. Po użyciu usunąć opakowanie ochronne, wskaźnik tlenu, saszetkę zawierającą substancję pochłaniającą tlen, pojemnik i wszelką niezużytą zawartość.
Przed otwarciem opakowania ochronnego należy sprawdzić kolor wskaźnika tlenu (patrz rysunek A). Nie stosować, jeśli wskaźnik tlenu przybrał kolor różowy. Stosować tylko wtedy, gdy wskaźnik tlenu jest żółty.
Stosować wyłącznie, jeśli roztwór jest przejrzysty, bezbarwny lub lekko żółtawy, nie zawiera cząstek stałych oraz jeśli worek i jego zamknięcie nie są uszkodzone.
Podczas stosowania u dzieci w przedziale wiekowym od wcześniaka do 2 lat, roztwory do żywienia pozajelitowego zawierające produkt leczniczy Aminoplasmal Paed 10% należy chronić przed światłem do momentu zakończenia podawania. Narażenie takich roztworów na działanie światła otoczenia, szczególnie po dodaniu pierwiastków śladowych i (lub) witamin, prowadzi do wytworzenia się nadtlenków i innych produktów rozpadu, co można ograniczyć zapewniając ochronę przed światłem (patrz punkt 4.2, 4.4 i 6.3).
Podczas przygotowywania mieszanin stosowanie opakowania ochronnego chroniącego przed dostępem światła może być niemożliwe. Należy jednak w jak największym stopniu zmniejszyć narażenie na działanie światła podczas przygotowywania mieszanin.
Do podawania stosować wyłącznie sterylny zestaw do infuzji.
Jeśli w warunkach pełnego żywienia pozajelitowego konieczne jest dodanie do tego produktu leczniczego innych składników odżywczych, takich jak węglowodany, tłuszcze, witaminy, elektrolity i pierwiastki
śladowe, dodawanie domieszek należy przeprowadzić z zachowaniem ściśle aseptycznych warunków. Dokładnie wymieszać po dodaniu wszelkich domieszek. Należy zwrócić szczególną uwagę na zgodność dodatków.
Aminoplasmal Paed 10%: Przygotowanie produktu leczniczego do stosowania Rysunek A: Worek i opakowanie ochronne
Rysunek B: Worek
W celu otwarcia:
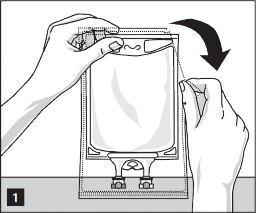
Wyjąć worek z opakowania ochronnego, rozdzierając nacięcia na górze, i wyjąć pojemnik z roztworem (rysunek 1).
Usunąć opakowanie ochronne, wskaźnik tlenu i pochłaniacz tlenu.
Sprawdzić, czy nie występują wycieki. Jeśli zauważono wyciek, produkt należy usunąć, ponieważ może on nie być sterylny.
W celu dodania leku:
Domieszki należy przygotowywać przestrzegając ściśle zasad aseptyki.
Zgodne leki uzupełniające można dodać przez port do podawania leków (przezroczysty).
Podczas przygotowywania mieszanin stosowanie opakowania ochronnego chroniącego przed dostępem światła może być niemożliwe. Należy jednak w jak największym stopniu zmniejszyć narażenie na działanie światła podczas przygotowywania mieszanin.
Przygotowanie do podania:
Pojemnik nie zawiera polichlorku winylu, DEHP ani lateksu.
B. Braun Melsungen AG Carl-Braun-Straße 1 34212 Melsungen Niemcy
Adres pocztowy:
34209 Melsungen Niemcy
Telefon: +49-5661-71-0
Faks: +49-5661-71-4567
Pozwolenie nr 21477
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 18.09.2013 Data ostatniego przedłużenia pozwolenia: 19.05.2021
10 DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
2023-04-14











