Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Zapobieganie powikłaniom kostnym (złamania patologiczne, złamania kompresyjne kręgów, napromienianie lub operacje kości, lub hiperkalcemia wywołana chorobą nowotworową) u dorosłych pacjentów z zaawansowanym procesem nowotworowym z zajęciem kości.
Leczenie hiperkalcemii wywołanej chorobą nowotworową (ang. tumor-induced hypercalcaemia–TIH) u dorosłych pacjentów.
Dawkowanie i sposób podawania
Dla pacjentów z prawidłowym stężeniem kreatyniny w surowicy przed rozpoczęciem leczenia (< 1,4 mg/dl lub < 124 µmol/L), wzrost o 0,5 mg/dl lub 44 µmol/L;
Dla pacjentów z podwyższonym stężeniem kreatyniny w surowicy przed rozpoczęciem leczenia (> 1,4 mg/dl lub > 124 µmol/L), wzrost o 1,0 mg/dl lub 88 µmol/L.
W badaniach klinicznych wznawiano podawanie produktu leczniczego kwasu zoledronowego tylko wtedy, gdy stężenie kreatyniny powróciło do zakresu wartości wyjściowej ± 10% (patrz punkt 4.4). Leczenie produktem leczniczym kwasu zoledronowego należy wznowić podając taką samą dawkę, jaką podawano w chwili przerwania terapii.
Dzieci i młodzież
Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności kwasu zoledronowego u dzieci w wieku od 1 roku do 17 lat. Aktualne dane przedstawiono w punkcie 5.1, ale brak zaleceń dotyczących dawkowania.
Sposób podawania Podanie dożylne.
Produkt leczniczy Zoledronic Acid Noridem 4 mg koncentrat do sporządzania roztworu do infuzji, następnie rozcieńczony w 100 mL (patrz punkt 6.6), należy podawać w pojedynczej infuzji dożylnej trwającej przynajmniej 15 minut.
U pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności nerek zaleca się stosowanie zmniejszonych dawek produktu leczniczego Zoledronic Acid Noridem (patrz punkt „Dawkowanie” powyżej i punkt 4.4).
Sposób przygotowania zmniejszonych dawek produktu leczniczego Zoledronic Acid Noridem Pobrać odpowiednią objętość koncentratu, zgodnie z ustalonym dawkowaniem:
4,4 mL dla dawki 3,5 mg
4,1 mL dla dawki 3,3 mg
3,8 mL dla dawki 3,0 mg
Instrukcja dotycząca rozcieńczania produktu leczniczego przed podaniem, patrz punkt 6.6.
Pobrany koncentrat należy rozcieńczyć w 100 mL jałowego roztworu 0,9% NaCl lub w 5% roztworze glukozy. Dawkę leku należy podać w jednorazowej infuzji dożylnej, trwającej nie krócej niż 15 minut.
Nie należy mieszać koncentratu produktu leczniczego Zoledronic Acid Noridem z roztworami do infuzji zawierającymi wapń lub inne kationy dwuwartościowe, takimi jak roztwór Ringera z dodatkiem mleczanu, i należy go podawać jako pojedynczą dawkę dożylną przez oddzielną linię infuzyjną.
Należy utrzymywać odpowiedni stan nawodnienia pacjentów przed i po podaniu produktu leczniczego Zoledronic Acid Noridem.
Przeciwwskazania
Nadwrażliwość na substancję czynną, na inne bisfosfoniany lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1 .
Karmienie piersią (patrz punkt 4.6)
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
siła działania bisfosfonianu (większe ryzyko występuje po podaniu leków o dużej sile działania), droga podania (większe ryzyko występuje w przypadku podania pozajelitowego) i dawka skumulowana bifosfonianu;
rozpoznanie raka, choroby współistniejące (np niedokrwistość, koagulopatia, zakażenia), palenie tytoniu
leczenie skojarzone: chemioterapia, inhibitory angiogenezy (patrz punkt 4.5), radioterapia głowy i szyi, leczenie kortykosteroidami;
choroby zębów w przeszłości, nieodpowiednia higiena jamy ustnej, choroba przyzębia, inwazyjne zabiegi stomatologiczne (np ekstrakcję zębów) i źle dopasowane protezy zębowe.
Należy zachęcać wszystkich pacjentów do należytego dbania o higienę jamy ustnej, przechodzenia rutynowych kontrolnych badań stomatologicznych i natychmiastowego zgłaszania wszelkich objawów w obrębie jamy ustnej, takich jak ruchomość zębów, ból lub
obrzęk, lub brak gojenia się owrzodzenia albo obecność wydzieliny podczas leczenia produktem leczniczym kwasu zoledronowego. W trakcie leczenia inwazyjne zabiegi stomatologiczne należy wykonywać jedynie po starannym rozważeniu i unikać ich przeprowadzania w terminie bliskim do podania leku.. Jeśli podczas terapii bisfosfonianami wystąpi martwica kości szczęki, przeprowadzenie zabiegów z zakresu chirurgii szczękowej może przyczynić się do nasilenia tego stanu. W przypadku pacjentów wymagających przeprowadzenia zabiegów stomatologicznych nie istnieją dane, które potwierdziłyby, że przerwanie leczenia bisfosfonianem zmniejsza ryzyko wystąpienia martwicy kości szczęki.
Plan postępowania z pacjentami, u których wystąpi martwica kości szczęki powinien zostać ustalony w ścisłej współpracy pomiędzy lekarzem prowadzącym a stomatologiem lub chirurgiem szczękowym posiadającym doświadczenie w leczeniu martwicy kości szczęki. Należy rozważyć czasowe przerwanie leczenia kwasem zoledronowym, aż do ustąpienia tego stanu oraz zminimalizować czynniki ryzyka, martwicy kości szczęki, o ile jest to możliwe.
Martwica kości innych miejsc anatomicznych
Podczas stosowania bisfosfonianów notowano martwicę kości przewodu słuchowego zewnętrznego, głównie związaną z długotrwałym leczeniem. Możliwe czynniki ryzyka martwicy kości przewodu słuchowego zewnętrznego obejmują stosowanie steroidów i chemioterapii i (lub) czynniki ryzyka, miejscowe, takie jak zakażenie lub uraz. Możliwość wystąpienia martwicy kości przewodu słuchowego zewnętrznego należy rozważyć u pacjentów przyjmujących bisfosfoniany, u których występują objawy związane z uchem, w tym przewlekłe zakażenia ucha.
Ponadto, odnotowano sporadyczne przypadki martwicy kości w innych miejscach, w tym w biodrze ikości udowej, zgłaszane głównie u dorosłych pacjentów z rakiem leczonych produktem leczniczym acidum zoledronicum.
Ból mięśniowo-szkieletowy
Doświadczenie po wprowadzeniu produktu leczniczego do obrotu wykazało ciężki i sporadycznie powodujący niesprawność ból kości, stawów i (lub) mięśni u pacjentów leczonych produktem leczniczym kwasu zoledronowego. Jednakże takie doniesienia nie były częste. Czas pojawienia się objawów może być różny, od jednego dnia do kilku miesięcy po rozpoczęciu leczenia. U większości pacjentów objawy te łagodnieją po zakończeniu leczenia. Część pacjentów miała nawroty objawów po powtórnym rozpoczęciu leczenia produktem leczniczym zoledronowym lub innym bisfosfonianem.
Nietypowe złamania kości udowej
Zgłaszano przypadki nietypowych złamań podkrętarzowych i trzonu kości udowej u osób stosujących bisfosfoniany, głównie u pacjentów długotrwale leczonych z powodu osteoporozy. Te poprzeczne lub krótkie, skośne złamania mogą pojawić się w dowolnym miejscu wzdłuż całej kości udowej - od miejsca zlokalizowanego tuż pod krętarzem mniejszym aż do okolicy nadkłykciowej. Do tego typu złamań dochodzi po minimalnym urazie lub bez urazu, a niektórzy pacjenci odczuwają ból uda lub ból w pachwinie. W badaniach obrazowych często na kilka tygodni lub miesięcy przed całkowitym złamaniem kości udowej widoczne są cechy złamań z przeciążenia. Złamania często występują obustronnie, dlatego u leczonych bisfosfonianami pacjentów, u których stwierdzono złamanie trzonu kości udowej, należy zbadać kość udową w drugiej kończynie. Zgłaszano również słabe gojenie się tych złamań. Na podstawie indywidualnej oceny stosunku korzyści do ryzyka u pacjentów, u których podejrzewa się nietypowe złamanie kości udowej, należy rozważyć odstawienie bisfosfonianów do czasu przeprowadzenia oceny.
Należy zalecić pacjentom, żeby zgłaszali pojawienie się jakiegokolwiek bólu w obrębie uda, biodra lub pachwiny występującego w trakcie leczenia bisfosfonianami, a każdy pacjent zgłaszający się z takimi objawami powinien być zbadany pod względem obecności niecałkowitego złamania kości udowej.
Hipokalcemia
U pacjentów leczonych produktem leczniczym kwasu zoledronowego zgłaszano występowanie hipokalcemii. Wtórnie do przypadków ciężkiej hipokalcemii zgłaszano występowanie arytmii serca i neurologicznych zdarzeń niepożądanych (w tym drgawek, niedoczulicy i tężyczki). Zgłaszano przypadki ciężkiej hipokalcemii wymagające hospitalizacji. W niektórych przypadkach hipokalcemia może zagrażać życiu pacjenta (patrz punkt 4.8). Zaleca się ostrożność podczas stosowania produktu leczniczego Zoledronic Acid Noridem z produktami leczniczymi, o których wiadomo, że powodują hipokalcemię, ponieważ mogą one mieć synergiczne działanie skutkujące ciężką hipokalcemią (patrz punkt 4.5). Przed rozpoczęciem leczenia produktem leczniczym Zoledronic Acid Noridem należy oznaczyć stężenie wapnia w surowicy i skorygować istniejącą hipokalcemię. Pacjenci powinni otrzymywać odpowiednią suplementację wapniem i witaminą D.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
in vivo: hamowanie resorpcji kości przez osteoklasty, co zmienia mikrośrodowisko szpiku kostnego, powodując zmniejszenie podatności szpiku na wzrost komórek nowotworowych, działanie antyangiogenne i działanie przeciwbólowe;
in vitro: hamowanie proliferacji osteoblastów, bezpośrednie działanie cytostatyczne i proapoptotyczne dotyczące komórek nowotworowych, synergizm działania cytostatycznego z innymi lekami przeciwnowotworowymi, działanie przeciwadhezyjne i przeciwinwazyjne.
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
z korkiem z gumy bromobutylowej pokrytym fluoropolimerem
z aluminiowym uszczelnieniem i plastikowym zamknięciem typu flip-off i
Szczególne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Zoledronic Acid Noridem; 4 mg/5 mL, koncentrat do sporządzania roztworu do infuzji
Jedna fiolka z 5 mL koncentratu zawiera 4 mg kwasu zoledronowego (Acidum zoledronicum) bezwodnego.
Jeden mililitr koncentratu zawiera kwas zoledronowy (w postaci kwasu zoledronowego jednowodnego) co odpowiada 0,8 mg kwasu zoledronowego (bezwodnego).
Substancja pomocnicza o znanym działaniu
Jeden mililitr koncentratu do sporządzania roztworu do infuzji zawiera 1,13 mg sodu w postaci sodu cytrynianu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Koncentrat do sporządzania roztworu do infuzji.
Klarowny roztwór bez widocznych cząstek o pH od 5,5 do 7,0 i osmolalności 290-320 mOsm/kg.
Produkt leczniczy Zoledronic Acid Noridem może być przepisywany i podawany pacjentom wyłącznie przez lekarzy mających doświadczenie w dożylnym podawaniu leków z grupy bisfosfonianów. Pacjenci którym podano produkt leczniczy Zoledronic Acid Noridem powinni otrzymać ulotkę dla pacjenta oraz kartę przypominającą dla pacjenta.
Dawkowanie
Zapobieganie powikłaniom kostnym u pacjentów z zaawansowanym procesem nowotworowym z zajęciem kości
Dorośli i osoby w podeszłym wieku
Zalecana dawka w zapobieganiu powikłaniom kostnym u pacjentów z zaawansowanymi nowotworami z przerzutami do kości wynosi 4 mg kwasu zoledronowego co 3 do 4 tygodni.
Pacjenci powinni także otrzymywać doustną suplementację preparatami wapnia w ilości 500 mg/dobę oraz witaminą D w ilości 400 j.m./dobę.
Podejmując decyzję o leczeniu pacjentów z przerzutami do kości w celu zapobiegania powikłaniom kostnym należy uwzględnić, że początek działania leku występuje po 2-3 miesiącach.
Leczenie TIH
Dorośli i osoby w podeszłym wieku

Zalecana dawka w leczeniu hiperkalcemii (stężenie wapnia w surowicy z uwzględnieniem wapnia związanego z albuminami 12,0 mg/dl lub 3,0 mmol/L) to jednorazowa dawka 4 mg kwasu zoledronowego.
Zaburzenie czynności nerek TIH:
Zastosowanie produktu leczniczego kwasu zoledronowego u pacjentów z TIH oraz z ciężką niewydolnością nerek można rozważyć wyłącznie po dokonaniu oceny ryzyka względem korzyści z leczenia. W badaniach klinicznych wyłączono z leczenia pacjentów, u których stężenie kreatyniny w surowicy przekraczało 400 µmol/L lub 4,5 mg/dl. Nie ma konieczności modyfikacji dawkowania u pacjentów z TIH , u których stężenie kreatyniny w surowicy jest mniejsze niż 400 µmol/L lub 4,5 mg/dl (patrz punkt 4.4).
Zapobieganie powikłaniom kostnym u pacjentów z zaawansowanym procesem nowotworowym z zajęciem kości:
Rozpoczynając terapię produktem leczniczym kwasu zoledronowegou pacjentów ze szpiczakiem mnogim lub z przerzutami guzów litych do kości, należy oznaczyć stężenie kreatyniny w surowicy oraz klirens kreatyniny (CLcr). Klirens kreatyniny oblicza się na podstawie stężenia kreatyniny w surowicy przy pomocy wzoru Cockcroft-Gaulta. Produkt leczniczy kwasu zoledronowego nie jest wskazany do stosowania u pacjentów z ciężkimi zaburzeniami czynności nerek przed rozpoczęciem terapii, rozumianymi w tej populacji jako wartość CLcr < 30 mL/min. W badaniach klinicznych z produktem leczniczym kwasu zoledronowego wyłączono z leczenia pacjentów, u których stężenie kreatyniny w surowicy przekraczało 265 µmol/L lub 3,0 mg/dl.
U pacjentów z przerzutami do kości i łagodnymi do umiarkowanych zaburzeniami czynności nerek przed rozpoczęciem terapii, definiowanymi w tej populacji na podstawie wartości CLcr od 30 do 60 mL/min, zaleca się następujące dawkowanie produktu leczniczego Zoledronic Acid Noridem (patrz także punkt 4.4):
Klirens kreatyniny przed leczeniem (mL/min) | Zalecana dawka produktu leczniczego Zoledronic Acid Noridem* |
> 60 | 4,0 mg kwasu zoledronowego |
50–60 | 3,5 mg* kwasu zoledronowego |
40–49 | 3,3 mg* kwasu zoledronowego |
30–39 | 3,0 mg* kwasu zoledronowego |
*Dawki obliczano przyjmując, że docelowe wartości AUC wynoszą 0,66 (mg•h/L) (CLcr = 75 mL/min). Uważa się, że podanie mniejszych dawek pacjentom z zaburzeniami czynności nerek pozwoli osiągnąć takie same wartości AUC, jak u pacjentów z klirensem kreatyniny 75 mL/min.
Po wprowadzeniu produktu leczniczego Zoledronic Acid Noridem, przed podaniem każdej następnej dawki należy oznaczać stężenie kreatyniny w surowicy, a leczenie należy przerwać, jeśli czynność nerek ulegnie pogorszeniu. W badaniach klinicznych pogorszenie czynności nerek definiowano w następujący sposób:
Ogólne
Pacjentów należy zbadać przed podaniem produktu leczniczego Zoledronic Acid Noridem, aby upewnić się, że są odpowiednio nawodnieni.
Należy unikać przewodnienia u pacjentów z ryzykiem wystąpienia niewydolności krążenia.
Po rozpoczęciu leczenia produktem leczniczym Zoledronic Acid Noridem należy dokładnie monitorować badane standardowo w hiperkalcemii parametry metaboliczne, takie jak: stężenie wapnia, fosforanów i magnezu w surowicy. W przypadku wystąpienia hipokalcemii, hipofosfatemii lub hipomagnezemii, może być konieczne wprowadzenie krótkotrwałej terapii uzupełniającej. Pacjenci z nieleczoną hiperkalcemią mają z reguły w pewnym stopniu zaburzoną czynność nerek. Dlatego u takich pacjentów należy rozważyć dokładne monitorowanie czynności nerek.
Produkt leczniczy Zoledronic Acid Noridem zawiera tę samą substancję czynną co produkty kwasu zoledronowego stosowane przy osteoporozie. Pacjenci leczeni produktem leczniczym Zoledronic Acid Noridem nie powinni jednocześnie otrzymywać produktów kwasu zoledronowego ani innych bisfosfonianów, ponieważ łączne skutki działania tych leków nie są znane.
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na fiolkę, czyli zasadniczo nie zawiera sodu.
Niewydolność nerek
Stan pacjentów z TIH i objawami pogorszenia czynności nerek należy odpowiednio ocenić, decydując, czy oczekiwana korzyść wynikająca z podawania produktu leczniczego kwasu zoledronowego przewyższa możliwe ryzyko.
Podejmując decyzję o leczeniu pacjentów z przerzutami do kości w celu zapobieżenia powikłaniom kostnym należy pamiętać, że początek efektu leczniczego występuje po 2–3 miesiącach.
Istnieją doniesienia o pogorszeniu czynności nerek po zastosowaniu produktu leczniczego kwasu zoledronowego. Do czynników, które mogą zwiększać ryzyko pogorszenia czynności nerek należą: odwodnienie, zaburzenie czynności nerek przed rozpoczęciem leczenia, podawanie wielu cykli produktu leczniczego Zoledronic Acid Noridem i innych bisfosfonianów oraz zastosowanie innych produktów leczniczych o toksycznym działaniu na nerki. Pogorszenie czynności nerek jest rzadsze, chociaż możliwe po podaniu kwasu zoledronowego w dawce 4 mg w czasie 15 minut. Donoszono o pogorszeniu funkcji nerek do niewydolności nerek i konieczności przeprowadzenia dializ u pacjentów po dawce początkowej lub pojedynczej 4 mg kwasu zoledronowego. Także, chociaż rzadziej, u niektórych pacjentów otrzymujących produkt leczniczy kwasu zoledronowego długotrwale w zalecanych dawkach, w celu zapobiegania powikłaniom kostnym, może wystąpić zwiększenie stężenia kreatyniny w surowicy.
Przed podaniem każdej kolejnej dawki produktu leczniczego Zoledronic Acid Noridem należy oznaczyć stężenie kreatyniny w surowicy. Rozpoczynając terapię u pacjentów z przerzutami do kości oraz łagodnymi do umiarkowanych zaburzeniami czynności nerek zaleca się podanie mniejszych dawek kwasu zoledronowego. U pacjentów z oznakami pogorszenia czynności nerek podczas leczenia, produkt leczniczy Zoledronic Acid Noridem
należy odstawić. Terapię powinno się wznowić jedynie wówczas, gdy stężenie kreatyniny w surowicy powróci do wartości wyjściowych z 10% odchyleniem. Leczenie produktem leczniczym Zoledronic Acid Noridem należy wznowić, podając taką samą dawkę, jaką stosowano przed przerwaniem leczenia.
Ze względu na potencjalny wpływ kwasu zoledronowego, na czynność nerek, brak szczegółowych danych klinicznych dotyczących bezpieczeństwa jego stosowania u pacjentów z istniejącą ciężką niewydolnością nerek (w badaniach klinicznych określoną, jako stężenie kreatyniny w surowicy ≥400 μmol/L lub ≥4,5 mg/dl dla pacjentów z TIH, i ≥265 µmol/Llub
≥3,0 mg/dl dla pacjentów z nowotworami i przerzutami do kości), oraz tylko ograniczone dane farmakokinetyczne dotyczące pacjentów z istniejącą ciężką niewydolnością nerek (klirens kreatyniny < 30 mL/min), nie zaleca się stosowania produktu leczniczego Zoledronic Acid Noridem u pacjentów z ciężkim zaburzeniemczynności nerek.
Niewydolność wątroby
Z uwagi na ograniczone dane kliniczne w grupie pacjentów z ciężkim zaburzeniem czynności wątroby, nie można podać specjalnych zaleceń dla tej grupy pacjentów.
Martwica
Martwica kości szczęki
Występowanie martwicy kości szczęki (ONJ, ang. osteonecrosis of the jaw) u pacjentów otrzymujących produkt leczniczy kwasu zoledronowego zgłaszano niezbyt często w badaniach klinicznych. Dane z okresu po wprowadzeniu produktu do obrotu oraz z literatury fachowej wskazują na większą częstość występowania martwicy kości szczęki w zależności od rodzaju nowotworu złośliwego (zaawansowany rak piersi, szpiczak mnogi). W jednym z badań stwierdzono częstsze przypadki martwicy kości szczęki u pacjentów ze szpiczakiem w porównaniu z innym rodzajami nowotworów (patrz punkt 5.1). Występowanie martwicy kości szczęki (ONJ, ang. osteonecrosis of the jaw) u pacjentów otrzymujących produkt leczniczy kwasu zoledronowego zgłaszano niezbyt często w badaniach klinicznych oraz po wprowadzeniu do obrotu.
Należy opóźnić rozpoczęcie leczenia lub nowego kursu terapii u pacjentów z niewygojonymi, otwartymi zmianami w obrębie tkanek miękkich jamy ustnej, z wyjątkiem sytuacji, które wymagają natychmiastowej pomocy lekarskiej. U pacjentów ze współistniejącymi czynnikami ryzyka, przed rozpoczęciem leczenia bifosfonianami zaleca się przeprowadzenie badania stomatologicznego i odpowiedniego zachowawczego leczenia stomatologicznego oraz indywidualnej oceny stosunku korzyści do ryzyka.
Dokonując oceny indywidualnego ryzyka wystąpienia ONJ należy wziąć pod uwagę następujące czynniki:
W badaniach klinicznych, w których produkt leczniczy kwasu zoledronowego podawany był równocześnie z powszechnie stosowanymi lekami przeciwnowotworowymi, diuretykami, antybiotykami i lekami przeciwbólowymi, nie stwierdzono klinicznie istotnych interakcji. Kwas zoledronowy wiąże się w niewielkim stopniu z białkami osocza i nie hamuje aktywności enzymów ludzkiego cytochromu P450 in vitro (patrz punkt 5.2), ale nie przeprowadzono badań klinicznych dotyczących interakcji.
Zaleca się zachowanie ostrożności w przypadku podawania bisfosfonianów z antybiotykami z grupy aminoglikozydów, kalcytoniną lub pętlowymi lekami moczopędnymi, ponieważ łącznie mogą one wywoływać efekt addycyjny, w wyniku czego mniejsze stężenie wapnia w surowicy utrzymuje się przez okres dłuższy niż wymagany (patrz punkt 4.4).
Wskazana jest ostrożność w czasie równoczesnego stosowania produktu leczniczego Zoledronic Acid Noridem z innymi potencjalnie nefrotoksycznymi produktami leczniczymi. Podczas leczenia produktem leczniczym Zoledronic Acid Noridem należy również zwrócić uwagę na możliwość powstania hipomagnezemii.
U pacjentów ze szpiczakiem mnogim ryzyko pogorszenia czynności nerek może zwiększać się wtedy, gdy produkt leczniczy kwasu zoledronowego podaje się w skojarzeniu z talidomidem.
Zaleca się zachowanie ostrożności, gdy podaje się produkt leczniczy kwasu zoledronowego z lekami antyangiogennymi, ponieważ obserwowano zwiększenie częstości występowania martwicy kości szczęki u pacjentów leczonych jednocześnie tymi lekami.
Ciąża
Brak wystarczających danych dotyczących stosowania kwasu zoledronowego u kobiet w ciąży. Badania nad wpływem kwasu zoledronowego na płodność zwierząt wykazały toksyczny wpływ na reprodukcję (patrz punkt 5.3). Potencjalne zagrożenie dla człowieka nie jest znane. Produktu leczniczego kwasu zoledronowego nie stosować w okresie ciąży. Kobietom w wieku rozrodczym należy doradzić unikanie zajścia w ciążę
Karmienie piersią
Nie wiadomo czy kwas zoledronowy jest wydzielany do mleka. Produkt leczniczy kwasu zoledronowego jest przeciwwskazany do stosowania u kobiet karmiących piersią (patrz punkt 4.3).
Płodność
Kwas zoledronowy badano na szczurach w poszukiwaniu możliwych działań niepożądanych na płodność rodziców i pokolenia F1. Obserwowano nasilenie farmakologicznych działań kwasu zoledronowego, co przypisywano hamującemu wpływowi na metabolizm wapnia w kościach, powodującemu hipokalcemię okołoporodową, skutek grupy bisfosfonianów, trudne porody i wcześniejsze zakończenie badania. Wyniki te wykluczyły możliwość definitywnego określenia wpływu kwasu zoledronowego na płodność ludzi.
Działania niepożądane, takie jak zawroty głowy i senność mogą wywierać wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn, dlatego stosując produkt leczniczy Zoledronic Acid Noridem należy zachować ostrożność podczas prowadzenia pojazdu i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
W ciągu trzech dni po podaniu produktu leczniczego kwasu zoledronowego często zgłaszano występowanie reakcji ostrej fazy, z takimi objawami jak ból kości, gorączka, uczucie zmęczenia, bóle stawów, bóle mięśni dreszcze i zapalenie stawów z obrzękiem; objawy te zazwyczaj ustępują w ciągu kilku dni (patrz opis wybranych działań niepożądanych).
Do ważnych zidentyfikowanych działań niepożądanych produktu leczniczego kwasu zoledronowego stosowanego w zarejestrowanych wskazaniach należą: zaburzenia czynności nerek, martwica kości szczęki, reakcja ostrej fazy, hipokalcemia, migotanie przedsionków, anafilaksja choroba śródmiąższowa płuc. Częstość występowania każdego z tych działań przedstawiono w Tabeli 1.
Tabelaryczne zestawienie działań niepożądanych
Następujące działania niepożądane, wymienione w Tabeli 1, zebrano w badaniach klinicznych oraz na podstawie zgłoszeń spontanicznych po stosowaniu kwasu zoledronowego w dawce 4 mg, głównie długookresowo.
Tabela 1




Działania niepożądane zostały sklasyfikowane zgodnie z częstością występowania, najczęściej występujące podano jako pierwsze. Zastosowano następującą skalę: bardzo często ( 1/10), często ( 1/100 do <1/10), niezbyt często ( 1/1000 do <1/100), rzadko ( 1/10000 do <1/1 000), bardzo rzadko (<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia krwi i układu chłonnego | ||
Często: | Niedokrwistość | |
Niezbyt często: | Trombocytopenia, leukopenia | |
Rzadko: | Pancytopenia | |
Zaburzenia układu immunologicznego | ||
Niezbyt często: | Reakcja nadwrażliwości | |
Rzadko: | Obrzęk naczynioruchowy | |
Zaburzenia psychiczne | ||
Niezbyt często: | Niepokój, zaburzenia snu | |
Rzadko: | Splątanie | |
Zaburzenia układu nerwowego | ||
Często: | Ból głowy | |
Niezbyt często: Bardzo rzadko: | Zawroty głowy, parestezje, zaburzenia smaku, niedoczulica, przeczulica, drżenie, senność Drgawki, niedoczulica i tężyczka (wtórne do hipokalcemii) | |
Zaburzenia oka | ||
Często: | Zapalenie spojówek | |
Niezbyt często: | Niewyraźne widzenie, zapalenie twardówki i zapalenie oczodołu | |
Rzadko: | Zapalenie błony naczyniowej oka | |
Bardzo rzadko: | Zapalenie nadtwardówki | |
Zaburzenia serca | ||
Niezbyt często: | Nadciśnienie, niedociśnienie, migotanie przedsionków, niedociśnienie objawiające się omdleniem lub zapaścią sercową | |
Rzadko: | Bradykardia, arytmia serca (wtórna do hipokalcemii) | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | ||
Niezbyt często: | Duszność, kaszel, skurcz oskrzeli | |
Rzadko: | Choroba śródmiąższowa płuc | |
Zaburzenia żołądka i jelit | ||
Często: | Nudności, wymioty, zmniejszony apetyt | |
Niezbyt często: | Biegunka, zaparcie, bóle brzucha, niestrawność, zapalenie jamy ustnej, suchość w jamie ustnej | |
Zaburzenia skóry i tkanki podskórnej | ||
Niezbyt często: | Świąd, wysypka (w tym wysypka rumieniowata i grudkowata), wzmożona potliwość | |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | ||
Często: | Bóle kości, bóle mięśni, bóle stawów, uogólniony ból | |
Niezbyt często: | Skurcze mięśni, martwica kości szczęki | |
Bardzo rzadko | Martwica kości przewodu słuchowego zewnętrznego (działanie niepożądane związane ze stosowaniem leków z grupy bisfosfonianów) i innych miejsc anatomicznych, w tym kości udowej i biodra | |
Zaburzenia nerek i dróg moczowych | ||
Często: | Zaburzenia czynności nerek | |
Niezbyt często: | Ostra niewydolność nerek, krwiomocz, białkomocz | |
Rzadko: | Nabyty zespół Fanconiego | |
Zaburzenia ogólne i stany w miejscu podania | ||
Często: | Gorączka, objawy grypopodobne (w tym zmęczenie, dreszcze, złe samopoczucie i zaczerwienienie) | |
Niezbyt często: | Osłabienie, obrzęki obwodowe, reakcje w miejscu podania (w tym ból, podrażnienie, obrzmienie, stwardnienie), bóle w klatce piersiowej, zwiększenie masy ciała, reakcja | |
Rzadko: | anafilaktyczna/wstrząs anafilaktyczny, pokrzywka Zapalenie stawów i obrzęk stawów jako objaw reakcji ostrej fazy | |
Badania diagnostyczne | ||
Bardzo często: | Hipofosfatemia | |
Często: | Zwiększenie stężenia kreatyniny i mocznika we krwi, hipokalcemia | |
Niezbyt często: | Hipomagnezemia, hipokaliemia | |
Rzadko: | Hiperkaliemia, hipernatremia | |
Opis wybranych działań niepożądanych
Zaburzenia czynności nerek
Stosowanie produktu leczniczego kwasu zoledronowego było związane ze zgłoszeniami zaburzeń czynności nerek. W zbiorczej analizie danych dotyczących bezpieczeństwa stosowania, pochodzących z badań rejestracynych produktu leczniczego kwasu zoledronowego w zapobieganiu powikłaniom kostnym u pacjentów z zaawansowanym procesem nowotworowym z przerzutami do kości, częstość występowania zaburzeń czynności nerek (działań niepożądanych) podejrzewanych o związek z produktem leczniczym kwasu zoledronowego była następująca: szpiczak mnogi (3,2%), rak prostaty (3,1%), rak piersi (4,3%), płuc i inne nowotowry lite (3,2%). Do czynników mogących zwiększać ryzyko pogorszenia czynności nerek należy odwodnienie, współistniejące zaburzenia czynności nerek, wielokrotne cykle leczenia produktem leczniczym kwasu zoledronowego lub innymi bisfosfonianami, jak również jednoczesne stosowanie nefrotoksycznych produktów leczniczych lub krótszego czasu infuzji niż obecnie zalecany. U pacjentów, którzy przyjęli początkową dawkę lub pojedynczą dawkę wynoszącą 4 mg kwasu zoledronowego, zgłaszano pogorszenie czynności nerek, progresję do niewydolności nerek lub do dializowania (patrz punkt 4.4).
Martwica kości szczęki
Zgłaszano przypadki martwicy kości (szczęki i żuchwy),, przede wszystkim u pacjentów z rozpoznaniem raka, leczonych produktami leczniczymi hamującymi resorpcję kości, takimi jak produkt leczniczy kwasu zoledronowego (patrz punkt 4.4). Wielu z tych pacjentów otrzymywało także chemioterapię oraz kortykosteroidy i stwierdzono u nich oznaki miejscowego zakażenia, w tym zapalenia szpiku. Większość tych doniesień dotyczy pacjentów z rozpoznaniem raka, po ekstrakcji zębów lub innych zabiegach stomatologicznych.
Migotanie przedsionków
W jednym randomizowanym, podwójnie ślepym, kontrolowanym badaniu trwającym 3 lata oceniano skuteczność i bezpieczeństwo stosowania kwasu zoledronowego w dawce 5 mg podawanego raz na rok i porównywano go z placebo w leczeniu osteoporozy pomenopauzalnej (PMO). Całkowita częstość występowania migotania przedsionków wyniosła 2,5% (96 spośród 3 862) i 1,9% (75 spośród 3 852) u pacjentów otrzymujących odpowiednio kwas zoledronowy i placebo. Częstość ciężkich działań niepożądanych w

postaci migotania przedsionków wyniosła 1,3% (51 spośród 3 862) i 0,6% (22 spośród 3 852) u pacjentów otrzymujących odpowiednio kwas zoledronowy i placebo. Dysproporcji obserwowanej w tym badaniu nie stwierdzano w innych badaniach z kwasem zoledronowym, także w badaniach z produktem leczniczym kwasu zoledronowego (kwas zoledronowy) 4 mg podawane co 3 4 tygodnie pacjentom onkologicznym. Mechanizm odpowiedzialny za zwiększoną częstość występowania migotania przedsionków w tym jednym badaniu klinicznym nie jest znany.
Reakcja ostrej fazy
To działanie niepożądane polega na występowaniu zespołu objawów takich jak gorączka, bóle mięśni, ból głowy, bóle kończyn, nudności, wymioty, biegunka, bóle stawów i zapalenie stawów z obrzękiem.. Czas wystąpienia reakcji ostrej fazy wynosi ≤ 3 dni po podaniu infuzji produktu leczniczego acidum zoledronicum, a reakcję tę określa się również terminem objawy „grypopodobne” lub objawy „po podaniu dawki”.
Nietypowe złamania kości udowej
W okresie po wprowadzeniu produktu do obrotu zgłaszano następujące działania (rzadko): nietypowe złamania podkrętarzowe i trzonu kości udowej (działanie niepożądane leków należących do klasy bisfosfonianów).
Działania niepożądane leku związane z hipokalcemią
Hipokalcemia jest ważnym zidentyfikowanym ryzykiem związanym ze stosowaniem produktu leczniczego kwasu zoledronowego w zatwierdzonych wskazaniach. Przegląd przypadków zgłaszanych podczas badań klinicznych oraz po wprowadzeniu leku do obrotu dostarczył wystarczających dowodów na istnienie związku między leczeniem produktem leczniczym kwasu zoledronowego, zgłaszanymi zdarzeniami hipokalcemii a wtórnym rozwojem arytmii serca. Ponadto, zebrano dowody na istnienie związku między hipokalcemią a wtórnymi zdarzeniami neurologicznymi zgłaszanymi w tych przypadkach, w tymdrgawkami, niedoczulicą i tężyczką (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departament Monitorowania Niepożądanych, Działań Produktów Leczniczych Urzędu, Rejestracji Produktów Leczniczych, Wyrobów, Medycznych i Produktów Biobójczych,
Al. Jerozolimskie 181C, 02-222 Warszawa Tel: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Doświadczenie kliniczne z ostrym przedawkowaniem produktu leczniczego kwasu zoledronowego jest ograniczone. Zgłaszano niezamierzone podanie dawek wynoszących do 48 mg kwasu zoledronowego. Należy dokładnie monitorować pacjentów, którzy otrzymali dawki większe niż zalecane (patrz punkt 4.2), ponieważ obserwowano zaburzenia czynności nerek (w tym niewydolność nerek) oraz nieprawidłowe stężenia elektrolitów w surowicy (w tym wapnia, fosforu i magnezu). W przypadku hipokalcemii należy podać glukonian wapnia w infuzji, zależnie od wskazań klinicznych..
Grupa farmakoterapeutyczna: leki stosowane w leczeniu chorób kości, bisfosfoniany, kod ATC: M05 BA 08
Kwas zoledronowy należy do klasy bisfosfonianów i działa głównie na tkankę kostną. Jest on inhibitorem resorpcji kości przez osteoklasty.
Selektywne działanie bisfosfonianów na tkankę kostną wynika z ich dużego powinowactwa do zmineralizowanej kości, ale dokładny mechanizm prowadzący do zaburzenia aktywności osteoklastów pozostaje nadal niewyjaśniony. W długookresowych badaniach na zwierzętach wykazano, że kwas zoledronowy hamuje resorpcję kości nie wpływając negatywnie na tworzenie, mineralizację oraz właściwości mechaniczne tkanki kostnej.
Poza silnym działaniem hamującym resorpcję kości, kwas zoledronowy ma także liczne właściwości przeciwnowotworowe, które mogą wpływać na jego ogólną skuteczność w leczeniu przerzutów nowotworowych do kości. W badaniach przedklinicznych wykazano następujące właściwości:
Wyniki badań klinicznych w zapobieganiu powikłaniom kostnym u pacjentów z zaawansowanym procesem nowotworowym z zajęciem kości
W pierwszym, randomizowanym, kontrolowanym placebo badaniu, które prowadzono metodą podwójnie ślepej próby, porównywano kwas zoledronowy w dawce 4 mg z placebo w zapobieganiu powikłaniom kostnym (ang. skeletal related events, SRE) u pacjentów z rakiem prostaty. Kwas zoledronowy w dawce 4 mg znacząco zmniejszał ilość pacjentów, u których wystąpił co najmniej jeden epizod SRE, zwiększał medianę czasu do wystąpienia pierwszego incydentu SRE o ponad 5 miesięcy i zmniejszał ilość powikłań kostnych w ciągu roku na jednego pacjenta (ang. skeletal morbidity rate, SMR). Analiza przypadków wielokrotnych wykazała zmniejszenie o 36% ryzyka wystąpienia SRE u pacjentów otrzymujących kwas zoledronowy w dawce 4 mg w porównaniu z placebo. Pacjenci otrzymujący kwas zoledronowy w dawce 4 mg donosili o mniejszym wzroście bólu w porównaniu z otrzymującymi placebo. Różnica osiągnęła istotność statystyczną w 3, 9, 21 i 24 miesiącu. U mniejszej liczby pacjentów otrzymujących kwas zoledronowy w dawce 4 mg wystąpiły patologiczne złamania. Wyniki leczenia były słabiej wyrażone u pacjentów z uszkodzeniami blastycznymi. Wyniki skuteczności przedstawiono w Tabeli 2.
W drugim badaniu obejmującym guzy lite inne niż rak sutka lub prostaty, kwas zoledronowy w dawce 4 mg istotnie zmniejszał liczbę pacjentów z SRE, zwiększał medianę czasu do wystąpienia pierwszego incydentu SRE o ponad 2 miesiące i zmniejszał SMR. Analiza przypadków wielokrotnych wykazała 30,7% zmniejszenie ryzyka wystąpienia SRE u pacjentów otrzymujących kwas zoledronowy w dawce 4 mg w porównaniu z placebo. Wyniki skuteczności przedstawiono w Tabeli 3.
Tabela 2: Wyniki skuteczności (pacjenci z rakiem prostatyleczeni hormonalnie) | ||||||
Wszystkie SRE (+TIH) | Złamania* | Radioterapia Kości | ||||
kwas zoledronowy 4 mg | Placebo | kwas zoledronowy 4 mg | Placebo | kwas zoledronowy 4 mg | Placebo | |
N | 214 | 208 | 214 | 208 | 214 | 208 |
Procent pacjentów z SRE (%) | 38 | 49 | 17 | 25 | 26 | 33 |
Wartość p | 0,028 | 0,052 | 0,119 | |||
Mediana czasu do SRE (dni) | 488 | 321 | NR | NR | NR | 640 |
Wartość p | 0,009 | 0,020 | 0,055 | |||
SMR | 0,77 | 1,47 | 0,20 | 0,45 | 0,42 | 0,89 |
Wartość p | 0,005 | 0,023 | 0,060 | |||
Zmniejszenie ryzyka wielokrotnego wystąpienia wystąpienia SRE** (%) | 36 | - | NA | NA | NA | NA |
Wartość p | 0,002 | NA | NA | |||
* Obejmuje złamania kręgów i inne
** Obejmuje wszystkie powikłania kostne, ich całkowitą ilość jak również czas do wystąpienia każdego przypadku w czasie badania
Tabela 3: Wyniki skuteczności (guzy lite inne niż rak piersi lub gruczołu krokowego) | |||
Wszystkie SRE (+TIH) | Złamania* | Radioterapia | |
NR = nie osiągnięto NA = nie dotyczy
Kości | ||||||
kwas zoledronowy 4 mg | Placebo | kwas zoledronowy 4 mg | Placebo | kwas zoledronowy 4 mg | Placebo | |
N | 257 | 250 | 257 | 250 | 257 | 250 |
Procent pacjentów z SRE (%) | 39 | 48 | 16 | 22 | 29 | 34 |
Wartość p | 0,039 | 0,064 | 0,173 | |||
Mediana czasu do SRE (dni) | 236 | 155 | NR | NR | 424 | 307 |
Wartość p | 0,009 | 0,020 | 0,079 | |||
SMR | 1,74 | 2,71 | 0,39 | 0,63 | 1,24 | 1,89 |
Wartość p | 0,012 | 0,066 | 0,099 | |||
Zmniejszenie ryzyka wystąpienia licznych przypadków** (%) | 30,7 | - | NA | NA | NA | NA |
Wartość p | 0,003 | NA | NA | |||
* Obejmuje złamania kręgów i inne
** Obejmuje wszystkie powikłania kostne, ich całkowitą ilość jak również czas do wystąpienia każdego przypadku w czasie badania
NR = nie osiągnięto NA = nie dotyczy
W trzecim randomizowanym badaniu fazy III, prowadzonym metodą podwójnie ślepej próby, w którym porównywano kwas zoledronowy w dawce 4 mg z pamidronianem w dawce 90 mg co 3 do 4 tygodni u pacjentów ze szpiczakiem mnogim lub rakiem sutka, u których wystąpiło co najmniej jedno uszkodzenie kości. Wyniki wskazują, że kwas zoledronowy w dawce 4 mg wykazywał skuteczność porównywalną z pamidronianem (Pam) w dawce 90 mg w zapobieganiu SRE. Analiza przypadków wielokrotnych wykazała 16% zmniejszenie ryzyka wystąpienia SRE u pacjentów otrzymujących kwas zoledronowy w dawce 4 mg w porównaniu do pacjentów otrzymujących pamidronian. Wyniki skuteczności przedstawiono w Tabeli 4.
Tabela 4: Wyniki skuteczności (pacjenci z rakiem piersi i szpiczakiem mnogim) | |||||||
Wszystkie SRE (+TIH) | Złamania* | Radioterapia Kości | |||||
kwas zoledronowy 4 mg | Pam 90 mg | kwas zoledronowy 4 mg | Pam 90 mg | kwas zoledronowy 4 mg | Pam 90 mg | ||
N | 561 | 555 | 561 | 555 | 561 | 555 | |
Procent pacjentów z SRE (%) | 48 | 52 | 37 | 39 | 19 | 24 | |
Wartość p | 0,198 | 0,653 | 0,037 | ||||
Mediana czasu do SRE (dni) | 376 | 356 | NR | 714 | NR | NR | |
Wartość p | 0,151 | 0,672 | 0,026 | ||||
SMR | 1 ,04 | 1,39 | 0,53 | 0,60 | 0,47 | 0,71 | |
Wartość p | 0,084 | 0,614 | 0,015 | ||||
Zmniejszenie ryzyka wystąpienia licznych przypadków** (%) | 16 | - | NA | NA | NA | NA | |
Wartość p | 0,030 | NA | NA | ||||
* Obejmuje złamania kręgów i inne
** Obejmuje wszystkie powikłania kostne, ich całkowitą ilość, jak również czas do wystąpienia każdego przypadku w czasie badania
NR = nie osiągnięto NA = nie dotyczy
Kwas zoledronowy w dawce 4 mg był również badany w podwójnie ślepym, randomizowanym badaniu kontrolowanym placebo, z udziałem 228 pacjentek z udokumentowanymi przerzutami raka piersi do kości, w celu oceny wpływu kwasu zoledronowego w dawce 4 mg na wskaźnik częstości występowania powikłań kostnych, obliczanych jako całkowita liczba powikłań kostnych (z wyjątkiem hiperkalcemii oraz po uwzględnieniu wcześniejszych złamań) podzielona przez całkowity okres ryzyka. Pacjentki otrzymywały kwas zoledronowy w dawce 4 mg lub placebo co cztery tygodnie przez jeden
rok. Dokonano równomiernego przydziału pacjentek do grupy kwasu zoledronowego lub do grupy placebo.
Częstość występowania powikłań kostnych (liczba powikłań/osobo-rok) wyniosła 0,628 dla kwasu zoledronowego i 1,096 dla placebo. Odsetek pacjentek z co najmniej jednym powikłaniem kostnym (z wyjątkiem hiperkalcemii) wyniósł 29,8% w grupie kwasu zoledronowego i 49,6% w grupie placebo (p=0,003). Mediana czasu do wystąpienia pierwszego powikłania kostnego nie została osiągnięta pod koniec badania w ramieniu kwasu zoledronowego i była istotnie wydłużona w porównaniu do placebo (p=0,007). W analizie wieloczynnikowej kwas zoledronowy w dawce 4 mg zmniejszał ryzyko powikłań kostnych o 41% w porównaniu do placebo (współczynnik ryzyka = 0,59, p=0,019).
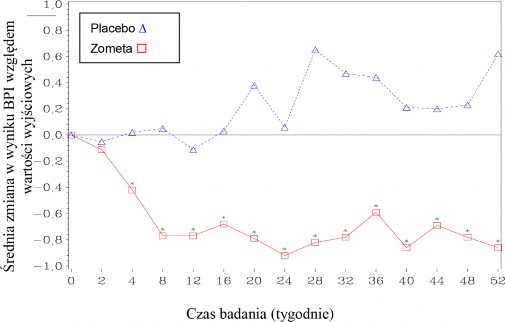
W grupie kwasu zoledronowego obserwowano statystycznie istotną poprawę nasilenia bólu (ocenianego przy użyciu skali pomiaru bólu Brief Pain Inventory, BPI) po 4 tygodniach oraz w każdym kolejnym punkcie czasowym badania, w porównaniu z placebo (Rycina 1). Wynik punktowy oceny bólu w grupie kwasu zoledronowego utrzymywał się poniżej wartości wyjściowych, a zmniejszeniu nasilenia bólu towarzyszyła tendencja obniżenia wyniku punktowego dotyczącego zużycia środków przeciwbólowych.
Rycina 1: Średnie zmiany w wyniku punktowym w skali BPI względem wartości wyjściowych. Statystycznie istotne różnice zaznaczono (*p<0,05) dla porównania między grupami terapii (4 mg kwasu zoledronowego vs. placebo)

Badanie CZOL446EUS122/SWOG
Głównym celem tego badania obserwacyjnego było oszacowanie skumulowanej częstości występowania martwicy kości szczęki po upływie 3 lat u pacjentów z rakiem i przerzutami do kości przyjmujących kwas zoledronowy. Terapię inhibitorem resorpcji kości, inne rodzaje terapii przeciwnowotworowej oraz opiekę stomatologiczną prowadzono zgodnie ze wskazaniami klinicznymi w celu zapewnienia jak najlepszej opieki zdrowotnej (opiekę akademickąa i środowiskową). Początkowe badanie stomatologiczne było zalecane, jednak nie było ono obowiązkowe.
Wśród 3491 pacjentów kwalifikujących się do oceny potwierdzono 87 przypadków rozpoznania martwicy kości szczęki. Szacowany skumulowany odsetek potwierdzonych przypadków martwicy kości szczęki po upływie 3 lat wyniósł 2,8% (95% CI: 2,3–3,5%) łącznie. Odsetek po 1. roku wyniósł 0,8%, a po 2. roku – 2,0%. Odsetek potwierdzonych przypadków martwicy kości szczęki po 3 latach był najwyższy wśród pacjentów ze szpiczakiem (4,3%), a najniższy wśród pacjentek z rakiem piersi (2,4%). Liczba potwierdzonych przypadków choroby była w sposób statystycznie istotny większa wśród pacjentów ze szpiczakiem mnogim (p=0,03) niż wśród pozostałych pacjentów z nowotworami złośliwymi łącznie.
Wyniki badań klinicznych w leczeniu TIH
Badania kliniczne kwasu zoledronowego w hiperkalcemii wywołanej chorobą nowotworową (TIH) wykazały, że wpływa on na zmniejszenie stężenia wapnia w surowicy i obniżenie wydalania wapnia przez nerki. W badaniach I fazy dotyczących doboru dawki u pacjentów z łagodną do umiarkowanej hiperkalcemią wywołaną chorobą nowotworową (TIH),, stwierdzono, że dawki skuteczne mieściły się w przybliżeniu w zakresie 1,2 do 2,5 mg.
W celu porównania skuteczności kwasu zoledronowego w dawce 4 mg z pamidronianem w dawce 90 mg, połączono, poddając zaplanowanej analizie, wyniki dwóch podstawowych, wieloośrodkowych badań u pacjentów z hiperkalcemią wywołaną chorobą nowotworową (TIH). Skorygowane względem albumin stężenie wapnia w surowicy powracało szybciej do wartości prawidłowych w 4. dniu leczenia kwasem zoledronowym w dawce 8 mg i w 7. dniu leczenia kwasem zoledronowym w dawkach 4 mg i 8 mg. Obserwowano następujący odsetek odpowiedzi:
Tabela 5: Odsetek całkowitych odpowiedzi uzyskanych w poszczególnych dniach leczenia, w połączonych badaniach dotyczących TIH
Dzień 4. | Dzień 7. | Dzień 10. | |
Kwas zoledronowy 4 mg (N=86) | 45,3% (p=0,104) | 82,6% (p=0,005)* | 88,4% (p=0,002)* |
Kwas zoledronowy 8 mg (N=90) | 55,6% (p=0,021)* | 83,3% (p=0,010)* | 86,7% (p=0,015)* |
Pamidronian 90 mg (N=99) | 33,3% | 63,6% | 69,7% |
*wartości p - porównanie z pamidronianem | |||

Mediana czasu potrzebnego do uzyskania prawidłowego stężenia wapnia w surowicy (normokalcemii) wynosiła 4 dni. Mediana czasu do ponownego zwiększenia stężenia wapnia w surowicy z uwzględnieniem wapnia związanego z albuminami ( 2,9 mmol/L) wynosiła 30–40 dni w grupie pacjentów leczonych kwasem zoledronowym i 17 dni w grupie otrzymującej pamidronian w dawce 90 mg (wartości p: 0,001 dla dawki 4 mg i 0,007 dla dawki 8 mg kwasu zoledronowego). Nie było statystycznie istotnej różnicy między dwoma dawkami kwasu zoledronowego.
W badaniach klinicznych, kwas zoledronowy w dawce 8 mg podano ponownie 69 pacjentom, u których doszło do ponownego zwiększenia stężenia wapnia lub którzy byli niewrażliwi na początkowe leczenie (kwas zoledronowy w dawce 4 mg, 8 mg lub pamidronian w dawce 90 mg). Wskaźnik odpowiedzi u tych pacjentów wynosił ok. 52%. Wyżej wymienieni pacjenci otrzymywali przy ponownym podaniu kwasu zoledronowego tylko dawkę 8 mg, dlatego brak jest danych pozwalających na dokonanie porównania z dawką 4 mg.
W badaniach klinicznych wykonanych u pacjentów z hiperkalcemią wywołaną chorobą nowotworową (TIH) ogólny profil bezpieczeństwa (rodzaj i ciężkość działań niepożądanych) wśród wszystkich trzech leczonych grup (kwas zoledronowy w dawce 4 mg i 8 mg oraz pamidronian w dawce 90 mg) był podobny.
Dzieci
Wyniki badania klinicznego w leczeniu ciężkiej wrodzonej łamliwości kości u dzieci w wieku od 1 do 17 lat
Działanie kwasu zoledronowego po podaniu dożylnym w leczeniu dzieci (w wieku od 1 do 17 lat) z ciężką wrodzoną łamliwością kości (typu I, III i IV) porównano z działaniem pamidronianu po podaniu dożylnym w jednym międzynarodowym, wieloośrodkowym, randomizowanym, otwartym badaniu z udziałem odpowiednio 74 i 76 pacjentów w każdej z grup terapeutycznych. Okres leczenia w tym badaniu wynosił 12 miesięcy i był poprzedzony 4-9 tygodniowym okresem kwalifikacji, podczas którego dzieci przyjmowały witaminę D i wapń pierwiastkowy przez co najmniej 2 tygodnie. W badaniu klinicznym dzieciom w wieku od 1 do < 3 lat podawano 0,025 mg kwasu zoledronowego na kg mc. (maksymalnie do 0,35 mg na pojedynczą dawkę), co 3 miesiące. Pacjenci w wieku od 3 do 17 lat otrzymywali 0,05 mg kwasu zoledronowego na kg mc. (maksymalnie do 0,83 mg na pojedynczą dawkę), co 3 miesiące. Fazę rozszerzoną badania przeprowadzono w celu oceny długotrwałego bezpieczeństwa ogólnego i bezpieczeństwa dla nerek po podaniu kwasu zoledronowego raz w roku lub dwa razy w roku przez dalsze 12 miesięcy dzieciom, które ukończyły 12-miesięczne leczenie kwasem zoledronowym lub pamidronianem w badaniu głównym.
Pierwszorzędowym punktem końcowym badania była procentowa zmiana względem wartości wyjściowych w gęstości mineralnej kości kręgosłupa lędzwiowego (BMD po 12 miesiącach leczenia. Szacunkowe wyniki badania nad BMD były podobne, ale badanie nie było wystarczająco dobrze zaprojektowane, aby wykazać przewagę skuteczności kwasu zoledronowego. W szczególności, nie było oczywistych dowodów na skuteczność w przypadku wystąpienia złamania lub bólu. Działania niepożądane obejmujące złamania kości długich kończyn dolnych zgłaszano u około 24% (kość udowa) i 14% (kość piszczelowa) pacjentów leczonych kwasem zoledronowym w stosunku do 12% i 5% pacjentów z ciężką wrodzoną łamliwością kości leczonych pamidronianem, bez względu na typ choroby i związek przyczynowy, ale liczba złamań była porównywalna u pacjentów leczonych kwasem zoledronowym i pamidronianem: 43% (32/74) w stosunku do 41% (31/76). Interpretację ryzyka wystąpienia złamania utrudnia fakt, że u pacjentów z ciężką wrodzoną łamliwością kości złamania występują często, stanowiąc część procesu chorobowego.


Rodzaj działań niepożądanych obserwowany u tej grupy pacjentów był podobny do działań niepożądanych obserwowanych wcześniej u dorosłych z zaawansowanym rakiem kości (patrz punkt 4.8). Działania niepożądane przedstawione w Tabeli 6 pogrupowano według częstości występowania. Zastosowano następującą skalę: bardzo często ( 1/10), często ( 1/100 do


<1/10), niezbyt często ( 1/1000 do <1/100), rzadko ( 1/10 000 do <1/1000), bardzo rzadko (<1/10 000) i częstość nieznana (nie może być określona na podstawie dostępnych danych).
Tabela 6: Działania niepożądane zaobserwowane u dzieci z ciężką wrodzoną łamliwością kości1
Zaburzenia układu nerwowego | ||
Często: | Ból głowy | |
Zaburzenia serca | ||
Często: | Tachykardia | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | ||
Często: | Nieżyt nosa i gardła | |
Zaburzenia żołądka i jelit | ||
Bardzo często: | Wymioty, nudności | |
Często: | Ból brzucha | |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | ||
Często: | Bóle kości, bóle stawów, bóle mięśni | |
Zaburzenia ogólne i stany w miejscu podania | ||
Bardzo często: | Gorączka, zmęczenie | |
Często: | Reakcje ostrej fazy, ból | |
Badania diagnostyczne | ||
Bardzo często: | Hipokalcemia | |
Często: | Hipofosfatemia | |
1 Działania niepożądane występujące z częstością < 5% oceniono pod względem medycznym i wykazano, że te przypadki są zgodne z ustalonym profilem bezpieczeństwa produktu leczniczego kwasu zoledronowego (patrz punkt 4.8).
U dzieci z ciężką wrodzoną łamliowścią kości kwas zoledronowy wydaje się wiązać z wyraźniejszym ryzykiem wystąpienia reakcji ostrej fazy, hipokalcemii i niewyjaśnionej tachykardii, w porównaniu do pamidronianu, ale ta różnica zmniejszała się po podaniu kolejnych wlewów.
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań kwasu zoledronowego we wszystkich podgrupach populacji dzieci i młodzieży w leczeniu hiperkalcemii wywołanej chorobą nowotworową i zapobieganiu powikłaniom kostnym u pacjentów z zaawansowanym procesem nowotworowym z zajęciem kości (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
W grupie 64 pacjentów z przerzutami nowotworowymi do kości, stosowano kwas zoledronowy w dawkach 2, 4, 8 i 16 mg w pojedynczej lub wielokrotnej 5-minutowej i 15- minutowej infuzji, uzyskując, niezależnie od podanej dawki leku, następujące dane farmakokinetyczne.
Po rozpoczęciu infuzji kwasu zoledronowego, jego stężenie w osoczu gwałtownie zwiększa się, osiągając stężenie maksymalne pod koniec infuzji. Następnie obserwuje się szybkie zmniejszenie stężenia leku do < 10% wartości maksymalnej po 4 godzinach i < 1% wartości maksymalnej po 24 godzinach. Następnie przez długi okres, do drugiej infuzji kwasu zoledronowego w 28 dniu, obserwowano bardzo małe stężenia, nie przekraczające 0,1% wartości maksymalnej.
Eliminacja kwasu zoledronowego z organizmu po podaniu dożylnym odbywa się trójfazowo: w formie szybkiego, dwufazowego usuwania leku z krążenia ogólnego z okresem półtrwania t½α wynoszącym 0,24 godziny i t½β 1,87 godziny, po którym następuje długa faza eliminacji z okresem półtrwania w końcowej fazie eliminacji t½γ wynoszącym 146 godzin. Nie stwierdzono kumulacji leku kwasu zoledronowego w osoczu po wielokrotnym podaniu co 28 dni. Kwas zoledronowy nie jest metabolizowany i wydala się przez nerki w formie niezmienionej. W ciągu pierwszych 24 godzin 39 ± 16% podanej dawki leku pojawia się w moczu, podczas gdy pozostała część wiąże się przede wszystkim z tkanką kostną. Z kości lek uwalnia się bardzo powoli do krążenia ogólnego i jest wydalany przez nerki. Całkowity klirens leku wynosi 5,04 ± 2,5 l/godz. i jest niezależny od dawki, płci, wieku, rasy i masy ciała. Przedłużenie czasu infuzji z 5 minut do 15 minut spowodowało zmniejszenie stężenia kwasu zoledronowego pod koniec infuzji o 30%, ale nie miało wpływu na powierzchnię pola pod krzywą w układzie stężenie w osoczu względem czas.
Tak jak w przypadku innych bisfosfonianów, zmienność międzyosobnicza parametrów farmakokinetycznych kwasu zoledronowego była duża.
Brak jest danych farmakokinetycznych dla kwasu zoledronowego w grupach pacjentów z hiperkalcemią lub z niewydolnością wątroby. Kwas zoledronowy nie hamuje aktywności enzymów ludzkiego cytochromu P450 in vitro i nie ulega biotransformacji. W badaniach na zwierzętach mniej niż 3% podanej dawki leku wydalało się z kałem, co wskazuje, że wątroba nie odgrywa istotnej roli w farmakokinetyce kwasu zoledronowego.
Klirens nerkowy kwasu zoledronowego był skorelowany z klirensem kreatyniny. Klirens nerkowy stanowi 75 ± 33% klirensu kreatyniny, którego średnia wartość u 64 badanych pacjentów z rakiem wynosiła 84 ± 29 mL/min (w zakresie od 22 do 143 mL/min). Analiza populacyjna wykazała, że u pacjentów z klirensem kreatyniny wynoszącym 20 mL/min (ciężkie zaburzenie czynności nerek) lub 50 mL/min (umiarkowane zaburzenie czynności nerek), przewidywany klirens kwasu zoledronowego powinien wynosić odpowiednio 37% i 72% klirensu u pacjenta z klirensem kreatyniny wynoszącym 84 mL/min. U pacjentów z ciężką niewydolnością nerek (klirens kreatyniny < 30 mL/min) dostępne są tylko ograniczone dane farmakokinetyczne.
W badaniu in vitro kwas zoledronowy wykazywał słabe powinowactwo do elementów morfotycznych krwi ludzkiej, przy średnim stosunku stężeń krew/ osocze wynoszącym 0,59 w zakresie stężeń od 30 ng/mL do 5000 ng/mL. Wiązanie z białkami osocza jest małe, a niezwiązana frakcja waha się od 60% przy stężeniu kwasu zoledronowego 2 ng/mL do 77% przy stężeniu 2000 ng/mL.
Szczególne populacje pacjentów
Dzieci i młodzież
Ograniczone dane farmakokinetyczne u dzieci z ciężką wrodzoną łamliwością kości wskazują, że farmakokinetyka kwasu zoledronowego u dzieci w wieku od 3 do 17 lat jest podobna, jak u pacjentów dorosłych po podaniu podobnej dawki w mg/kg mc. Wiek, masa ciała, płeć i klirens kreatyniny wydają się nie mieć wpływu na ogólnoustrojową ekspozycję na kwas zoledronowy.
Toksyczność po podaniu jednorazowym
Największa pojedyncza dawka leku podawana dożylnie, która nie powodowała śmierci, wynosiła 10 mg/kg mc. u myszy i 0,6 mg/kg u szczurów.
Toksyczność długo- i krótkookresowa po podaniu wielokrotnym
Kwas zoledronowy podawany podskórnie szczurom i dożylnie psom w dawkach do 0,02 mg/kg mc. na dobę przez 4 tygodnie, był dobrze tolerowany. Podskórne podawanie kwasu zoledronowego szczurom w dawce 0,001 mg/kg mc. /dobę oraz dożylne psom w dawce 0,005 mg/kg mc. co 2–3 dni, w okresie czasu do 52 tygodni, było również dobrze tolerowane.
Najczęściej obserwowanym działaniem po podaniu wielokrotnym było zwiększenie pierwotnej warstwy gąbczastej przynasad kości długich u zwierząt w okresie wzrostu, w niemal wszystkich badanych dawkach. Zjawisko to jest wynikiem farmakologicznego działania związku polegającego na zahamowaniu procesu resorpcji kości.
W badaniach długookresowych, z wielokrotnym podawaniem pozajelitowym u zwierząt, margines bezpieczeństwa w odniesieniu do wpływu na nerki był wąski. Jednakże skumulowane wyniki badania największych dawek nie powodujących działań niepożądanych (ang. No adverse event level - NOAEL) po podaniu jednorazowym (1,6 mg/kg mc.) i po podaniu wielokrotnym, w czasie do jednego miesiąca (0,06–0,6 mg/kg mc./dobę), nie wskazywały na działanie na nerki przy dawkach równych lub przekraczających największą proponowaną dawkę terapeutyczną u ludzi. W badaniach narażenia długotrwałego w dawkach z przedziału największej proponowanej dawki terapeutycznej dla ludzi kwas zoledronowy działał toksycznie na inne narządy, w tym na przewód pokarmowy, wątrobę, śledzionę i płuca, oraz w miejscu dożylnego podania.
Toksyczny wpływ na reprodukcję

Kwas zoledronowy podawany podskórnie szczurom w dawkach 0,2 mg/kg, wykazywał działanie teratogenne. Chociaż nie obserwowano działania teratogennego lub toksycznego na płód u królików, jednak stwierdzano toksyczne działanie u matek. U szczurów, po podaniu najniższej badanej dawki (0,01 mg/kg mc.) obserwowano dystocję.
Mutagenność i rakotwórczość
Przeprowadzone testy na mutagenność i rakotwórczość nie wykazały mutagennego ani rakotwórczego działania kwasu zoledronowego.
Mannitol (E421)
Sodu cytrynian (E331) Woda do wstrzykiwań
W celu uniknięcia potencjalnych niezgodności, produktu leczniczego Zoledronic Acid Noridem, koncentrat należy rozcieńczyć 0,9% m/v roztworem chlorku sodu lub 5% m/v roztworem glukozy.
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 6.6.
Nie należy mieszać koncentratu produktu leczniczego z roztworami do infuzji zawierającymi wapń lub inne kationy dwuwartościowe, takimi jak roztwór Ringera z dodatkiem mleczanu, i należy go podawać jako samodzielny roztwór dożylny przez oddzielną linię infuzyjną.
36 miesięcy.
Po rozcieńczeniu: Wykazano stabilność chemiczną i fizyczną. Roztwór produktu leczniczego Zoledronic Acid Noridem zachowuje trwałość przez 24 godziny w temperaturze 2-8°C, po rozcieńczeniu w 100 mL fizjologicznego roztworu chlorku sodu lub 5% w/v roztworze glukozy. Jeżeli roztwór przechowywany był w lodówce, wówczas przed podaniem musi zostać ogrzany do temperatury pokojowej.
Z mikrobiologicznego punktu wiedzenia, o ile metoda otwarcia i rozcieńczenia nie eliminuje ryzyka skażenia mikrobiologicznego, rozcieńczony roztwór do infuzji należy natychmiast zużyć. Jeśli produkt leczniczy nie zostanie natychmiast zużyty, odpowiedzialność za czas i warunki jego przechowywania przed użyciem ponosi użytkownik.
Brak specjalnych zaleceń dotyczących przechowywania.
Warunki przechowywania odtworzonego produktu leczniczego, patrz punkt 6.3.
Produkt leczniczy Zoledronic Acid Noridem 4 mg/5 mL koncentrat do sporządzania roztworu do infuzji dostarczany jest w opakowaniach zawierających 1, 4 lub 10 fiolek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
5 mL koncentratu w plastikowej fiolce z bezbarwnego kopolimeru cykloolefiny
5 mL koncentratu w szklanej fiolce z przezroczystego, bezbarwnego szkła typu I z powłoką SiO2 od wewnątrz.
Przed podaniem 5,0 mL koncentratu stanowiącego zawartość jednej fiolki lub odpowiednią ilość koncentratu pobraną z fiolki należy rozcieńczyć w 100 mL roztworu niezawierającego jonów wapnia (0,9% m/v roztwór chlorku sodu lub 5% m/v roztwór glukozy).
Dodatkowe informacje dotyczące postępowania z produktem leczniczym Zoledronic Acid Noridem, w tym wskazówki dotyczące przygotowania zmniejszonych dawek podano w punkcie 4.2.
Podczas przygotowywania infuzji należy przestrzegać zasad aseptyki. Produkt przeznaczony wyłącznie do jednorazowego użytku.
Należy używać wyłącznie przezroczystych roztworów, bez wytrąconych cząstek i zabarwienia.
Badania z zastosowaniem butelek szklanych, jak również kilku typów worków infuzyjnych i linii infuzyjnych wykonanych z polichlorku winylu, polietylenu i polipropylenu (napełnionych 0,9% w/v roztworem chlorku sodu lub 5% w/v roztworem glukozy) nie wykazały niezgodności z produktem leczniczym kwasu zoledronowego.
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
21498
30/09/2013/ 30/04/2018
30/10/2020











