Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
przed rozpoczęciem leczenia domperydonem;
podczas fazy rozpoczynania leczenia;
następnie w zależności od wskazań klinicznych.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do
Należy zawsze stosować nową igłę do każdego wstrzyknięcia, co zapobiega zanieczyszczeniu.
Nie wolno przekazywać innym osobom igieł i wstrzykiwacza.
Przed podaniem leku Dacepton należy zapoznać się ze wstrzykiwaczem oraz jego Instrukcją stosowania, tak aby postępować właściwie.
Jeśli wstrzykiwacz jest uszkodzony lub nie działa prawidłowo (z powodu wady mechanicznej), należy zapoznać się z informacjami znajdującymi się w instrukcji stosowania wstrzykiwacza.
Należy umyć ręce.
Przed zastosowaniem wstrzykiwacza należy przygotować gaziki chirurgiczne i jedną igłę zabezpieczoną osłonką ochronną.
Postępować zgodnie z Instrukcją stosowania wstrzykiwacza.
Przygotowanie wstrzykiwacza / wymiana wkładu
Wyjąć wstrzykiwacz z opakowania i usunąć osłonkę ochronną.

Usunąć osłonkę wkładu obracając ją w kierunku zgodnym z ruchem wskazówek zegara.

Do osłonki wprowadzić nowy wkład.
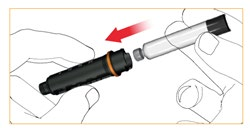
Przesunąć gwintowany pręt do końca, najlepiej naciskając opuszką palca na kołnierz.
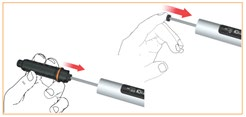
Wprowadzić tuleję wkładu do obudowy i zablokować ją obracając przeciwnie do ruchu wskazówek zegara.

Mocowanie igły wstrzykiwacza
Należy postępować zgodnie z instrukcją stosowania igły wstrzykiwacza. Oderwać folię ochronną.
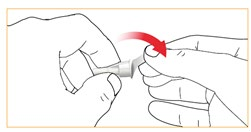
Kliknąć / zamocować igłę na obudowie wkładu.
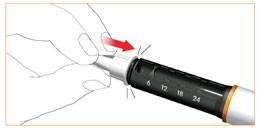
Zdjąć zewnętrzną osłonkę ochronną igły. Zachować ją w celu bezpiecznej utylizacji igły po wykonaniu wstrzyknięcia.
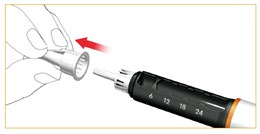
Zdjąć i usunąć wewnętrzną osłonkę ochronną igły.

Uzbrajanie i kontrola działania
Przed zastosowaniem należy usunąć z wkładu znajdujące się w nim powietrze. Nastawić dawkę testową przekręcając pokrętło. Skontrolować ustawienie dawki patrząc pionowo z góry, nie pod kątem, na okienko odczytu; musi być wyraźnie widoczny symbol „“. Ten etap nazywany jest uzbrajaniem i jest ważny, ponieważ pozwala się upewnić, że po zastosowaniu wstrzykiwacza zostanie podana pełna dawka leku.
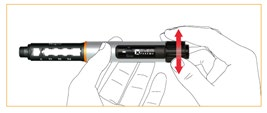
W celu sprawdzenia działania wstrzykiwacza należy ustawić go pionowo i delikatnie postukać
w obudowę wkładu, tak aby pęcherzyki powietrza uniosły się do górnej części.
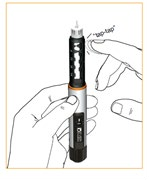
Nacisnąć na tłok.
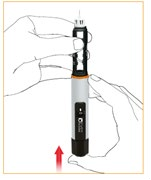
Z igły wydostanie się kilka kropli leku. Jeśli tak się nie stanie, powtórzyć poprzedni krok.

Nastawianie dawki
Nastawić dawkę docelową przekręcając pokrętło zgodnie z ruchem wskazówek zegara. Skorygować dawkę obracając pokrętło w kierunku przeciwnym do ruchu wskazówek zegara.

Wstrzykiwanie leku
Oczyścić skórę w miejscu planowanego wstrzyknięcia oraz w jego sąsiedztwie za pomocą gazika chirurgicznego.
Dacepton należy wstrzykiwać w okolicę z przodu talii (brzuch) lub w zewnętrzną powierzchnię
uda, w tkankę pod skórą (podskórnie), tak jak pokaże pacjentowi lekarz lub pielęgniarka.
W celu wykonania wstrzyknięcia należy wcisnąć tłok do samego końca. Trzymać tłok całkowicie wciśnięty podczas wstrzykiwania leku. Po podaniu całej dawki leku należy odczekać 6 sekund
a następnie powoli wyciągnąć igłę. Podczas 6 sekund oczekiwania tłok może być wciśnięty lub pozostawiony wolno. Aby się upewnić, że została podana cała dawka leku, należy sprawdzić, czy w okienku odczytu jest widoczna wartość „0,0”.
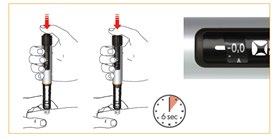
Za każdym razem należy zmieniać miejsce wstrzyknięcia leku Dacepton. Zmniejszy to możliwość wystąpienia reakcji skórnej w miejscu podania leku Dacepton. Nie wstrzykiwać leku Dacepton w okolicę skóry, która jest bolesna, zaczerwieniona, zakażona lub uszkodzona.
Leku nie wolno nigdy wstrzykiwać bezpośrednio do żyły (dożylnie) ani w mięsień (domięśniowo).
Usuwanie igły wstrzykiwacza po każdym wstrzyknięciu
Po każdym wstrzyknięciu należy zdjąć i usunąć igłę.
Nałożyć ostrożnie zewnętrzną osłonkę ochronną na igłę wstrzykiwacza.
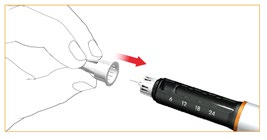
Przekręcić igłę wstrzykiwacza obracając zewnętrzną osłonkę ochronną zgodnie z ruchem wskazówek zegara i bezpiecznie usunąć igłę.

Inna możliwość:
Umieścić zewnętrzną osłonkę ochronną igły we właściwej przegródce załączonego pudełka. Otwór zewnętrznej osłonki ochronnej igły powinien być skierowany ku górze. Zachowując ostrożność wprowadzić igłę (dołączoną do wstrzykiwacza) do otworu osłonki. Nie dotykając osłonki należy mocno wcisnąć i przekręcić wstrzykiwacz odwrotnie do ruchu wskazówek zegara, co spowoduje odłączenie igły.

Po każdym użyciu wstrzykiwacza należy umieścić na nim nasadkę.
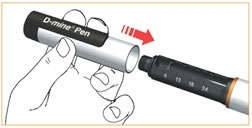
Pozostawić wkład z lekiem we wstrzykiwaczu.
Nowy wkład z lekiem można stosować do 15 dni (więcej informacji, patrz punkt 6.3 „Okres
ważności”).
Jeśli ilość roztworu jest zbyt mała do podania kolejnej dawki, wkład należy usunąć i wyrzucić.
Należy usunąć igłę w bezpieczny sposób, jak opisano w Instrukcji stosowania wstrzykiwacza.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Dacepton, 10 mg/ml, roztwór do wstrzykiwań we wkładzie
1 ml roztworu zawiera 10 mg apomorfiny chlorowodorku półwodnego.
Każdy wkład o pojemności 3 ml zawiera 30 mg apomorfiny chlorowodorku półwodnego.
Substancje pomocnicze o znanym działaniu:
sodu pirosiarczyn (E 223) 1 mg/ml sód mniej niż 2,3 mg/ml
Pełen wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań we wkładzie
Roztwór jest przezroczysty, bezbarwny do żółtawego, bez cząstek stałych.
pH: 3,0 – 4,0
Osmolalność: 62,5 mOsm/kg
Leczenie obniżających sprawność fluktuacji ruchowych (zjawisk „on-off”) u pacjentów z chorobą Parkinsona, które utrzymują się pomimo stosowania doustnych leków przeciw chorobie Parkinsona.
Wybór pacjentów, kwalifikujących się do leczenia za pomocą produktu Dacepton, 10 mg/ml, roztwór do wstrzykiwań we wkładzie
Pacjenci, zakwalifikowani do leczenia za pomocą produktu Dacepton, roztwór do wstrzykiwań
we wkładzie, powinni potrafić rozpoznawać u siebie początek objawów stanu „off” oraz wykonywać sobie wstrzyknięcia bądź mieć odpowiedzialnego opiekuna, który w razie potrzeby potrafiłby wykonywać im wstrzyknięcia.
Pacjenci leczeni apomorfiną będą zazwyczaj wymagali rozpoczęcia leczenia domperydonem co najmniej 2 dni wcześniej. Dawkę domperydonu należy dobrać tak, aby była to najmniejsza skuteczna dawka i należy ją odstawić tak szybko jak to możliwe. Przed podjęciem decyzji
o rozpoczęciu leczenia domperydonem i apomorfiną, u każdego pacjenta indywidualnie należy uważnie ocenić ryzyko wystąpienia wydłużenia odcinka QT, tak by spodziewane korzyści równoważyły ryzyko (patrz punkt 4.4).
Apomorfinę należy wprowadzać w kontrolowanym otoczeniu specjalistycznej kliniki. Pacjent powinien być kontrolowany przez lekarza z doświadczeniem w leczeniu choroby Parkinsona (np. neurolog). Leczenie pacjenta lewodopą, z agonistami receptorów dopaminowych lub bez nich, należy zoptymalizować przed rozpoczęciem podawania produktu Dacepton.
Dorośli
Sposób podania
Dacepton, roztwór do wstrzykiwań we wkładzie, jest przeznaczony do podawania wielu dawek
w sporadycznych wstrzyknięciach podskórnych (bolus), wyłącznie za pomocą przeznaczonego do tego wstrzykiwacza D-mine Pen.
Pacjentów oraz ich opiekunów należy dokładnie poinstruować, jak przygotować i wstrzyknąć dawkę, ze szczególnym zwróceniem uwagi na właściwe stosowanie wymaganego wstrzykiwacza (patrz instrukcja stosowania zawarta w opakowaniu wstrzykiwacza). Występują różnice pomiędzy wstrzykiwaczem do tego produktu leczniczego, a wstrzykiwaczami do innych produktów zawierających apomorfinę obecnych w obrocie. W związku z powyższym, jeśli pacjent otrzymywał dotychczas określony rodzaj wstrzykiwacza i szkolenie w zakresie jego obsługi, zmiana rodzaju wstrzykiwacza musi być połączoną z ponownym szkoleniem przeprowadzonym przez personel służby zdrowia.
Jeśli we wstrzykiwaczu znajduje się powietrze, przed zastosowaniem wstrzykiwacza należy je usunąć (patrz Instrukcja stosowania wstrzykiwacza).
Apomorfiny nie wolno podawać drogą dożylną.
Nie stosować, jeśli roztwór zmienił barwę na zieloną. Przed zastosowaniem należy sprawdzić roztwór wzrokowo. Można stosować jedynie roztwory przezroczyste i bezbarwne do żółtawych, bez cząstek stałych.
Wyznaczenie dawki progowej
Wyznaczenie dawki progowej dla każdego pacjenta opiera się na schemacie stopniowego zwiększania dawki. Zaleca się stosowanie następującego schematu:
1 mg apomorfiny chlorowodorku półwodnego (0,1 ml), co odpowiada około
15-20 mikrogramom/kg masy ciała, można wstrzykiwać podskórnie w stanie hipokinetycznym lub
„off”, a następnie należy przez 30 minut obserwować odpowiedź motoryczną pacjenta.
Jeśli pacjent nie reaguje na dawkę lub odpowiedź nie jest zadowalająca, należy podać drugą dawkę apomorfiny chlorowodorku półwodnego, która wynosi 2 mg (0,2 ml), a następnie przez 30 minut obserwować odpowiedź motoryczną pacjenta.
Dawkę można stopniowo zwiększać, zachowując przynajmniej czterdziestominutowe odstępy pomiędzy kolejnymi wstrzyknięciami, aż do uzyskania zadowalającej odpowiedzi motorycznej.
Ustalenie leczenia
Po określeniu właściwej dawki, pojedyncze wstrzyknięcie podskórne można podawać w dolną część brzucha lub zewnętrzną część uda, w momencie, kiedy występują pierwsze objawy epizodu „off”. Nie można wykluczyć, że u tej samej osoby wchłanianie może się różnić w zależności od miejsca podania leku. Należy więc obserwować pacjenta przez kolejną godzinę w celu oceny jakości odpowiedzi na leczenie. W zależności od reakcji pacjenta można dokonywać zmiany dawkowania.
Dawkowanie można zmieniać stosownie do odpowiedzi pacjenta na leczenie.
Optymalna dawka chlorowodorku apomorfiny różni się u indywidualnych pacjentów, natomiast po
ustaleniu, pozostaje ona względnie stała u danego pacjenta.
Ostrzeżenia dotyczące stosowania ciągłego
Dobowa dawka produktu Dacepton różni się znacznie pomiędzy pacjentami, zazwyczaj znajduje się w zakresie od 3 do 30 mg, podawana w 1 do 10 wstrzyknięciach, a niekiedy w 12 oddzielnych wstrzyknięciach na dobę.
Zaleca się, aby całkowita dobowa dawka apomorfiny chlorowodorku półwodnego nie przekraczała
100 mg, a dawka podana w pojedynczym wstrzyknięciu nie była większa niż 10 mg.
Wstrzykiwacz D-mine Pen wymagany do podawania produktu Dacepton w postaci roztworu do wstrzykiwań we wkładzie nie jest odpowiedni dla pacjentów wymagających dawek większych niż 6 mg/jednorazowe podanie (bolus).
U tych pacjentów należy stosować inne produkty lecznicze.
W badaniach klinicznych zazwyczaj możliwe było pewne zmniejszenie dawki lewodopy; efekt ten różni się znacznie u poszczególnych pacjentów i musi być uważnie kontrolowany przez doświadczonego lekarza.
Po ustaleniu leczenia u niektórych pacjentów można stopniowo zmniejszyć dawkę domperydonu,
jednak jedynie u niewielu udało się go skutecznie odstawić bez wymiotów lub hipotonii.
Dzieci i młodzież
Produkt Dacepton w postaci roztworu do wstrzykiwań we wkładzie jest przeciwwskazany u dzieci i młodzieży w wieku poniżej 18 lat (patrz punkt 4.3).
Osoby w podeszłym wieku
Pacjenci w podeszłym wieku są szeroko reprezentowani w populacji pacjentów z chorobą Parkinsona; stanowią znaczny odsetek pacjentów uczestniczących w badaniach klinicznych apomorfiny.
Postępowanie w przypadku pacjentów w podeszłym wieku leczonych apomorfiną nie różni się od pacjentów młodszych. Jednakże zaleca się dodatkowe środki ostrożności podczas rozpoczynania leczenia u pacjentów w podeszłym wieku ze względu na ryzyko wystąpienia hipotonii ortostatycznej.
Zaburzenie czynności nerek
U pacjentów z zaburzeniem czynności nerek można zastosować schemat dawkowania podobny do zalecanego u dorosłych i pacjentów w podeszłym wieku (patrz punkt 4.4).
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną
w punkcie 6.1.
Produkt jest przeciwwskazany u pacjentów z depresją oddechową, otępieniem, chorobami psychicznymi lub niewydolnością wątroby.
Apomorfiny chlorowodorku półwodnego nie wolno stosować u pacjentów, u których występuje odpowiedź „on” na lewodopę zakłócona ciężkimi dyskinezami lub dystonią.
Jednoczesne stosowanie ondansetronu (patrz punkt 4.5).
Produkt Dacepton, 10 mg/ml, roztwór do wstrzykiwań we wkładzie, jest przeciwwskazany u dzieci i młodzieży w wieku poniżej 18 lat.
Apomorfiny chlorowodorek półwodny należy podawać ostrożnie pacjentom z chorobami nerek, płuc lub układu krążenia oraz osobom ze skłonnością do nudności i wymiotów.
Dodatkową ostrożność zaleca się podczas rozpoczynania leczenia u pacjentów w podeszłym wieku i (lub) osłabionych.
Ponieważ apomorfina może powodować niedociśnienie tętnicze, nawet w przypadku wcześniejszego podawania domperydonu, należy zachować ostrożność u pacjentów ze współistniejącą chorobą serca lub przyjmujących produkty lecznicze wazoaktywne, takie jak leki przeciwnadciśnieniowe, szczególnie u pacjentów ze współistniejącą hipotonią ortostatyczną.
Ponieważ apomorfina, szczególnie w dużych dawkach, może wydłużać odstęp QT, należy zachować ostrożność w przypadku leczenia pacjentów z ryzykiem niemiarowości typu torsade de pointes.
Podczas jednoczesnego stosowania z domperydonem należy uważnie ocenić czynniki ryzyka
u indywidualnego pacjenta. Należy to zrobić przed rozpoczęciem oraz podczas leczenia. Ważne czynniki ryzyka obejmują istniejące ciężkie choroby serca, jak zastoinowa niewydolność krążenia, ciężkie zaburzenia czynności wątroby lub istotne zaburzenia elektrolitowe. Należy także ocenić leczenie aktualnie stosowane, które może wpływać na równowagę elektrolitową, metabolizm cytochromu CYP3A4 lub wydłużenie odstępu QT. Zaleca się monitorowanie wpływu leczenia na długość odstępu QT. Badanie EKG należy wykonać:
Należy poinformować pacjenta o konieczności zgłaszania jakichkolwiek objawów ze strony serca,
w tym kołatania serca, omdlenia lub stanów jak przed omdleniem. Pacjenci powinni zgłaszać również wszelkie zmiany kliniczne które mogą powodować hipokaliemię, jak nieżyt żołądka i jelit lub rozpoczęcie leczenia lekami moczopędnymi.
Czynniki ryzyka należy oceniać podczas każdej wizyty pacjenta.
Stosowanie apomorfiny związane jest z miejscowymi reakcjami podskórnymi. Można je niekiedy zmniejszyć zmieniając miejsca wstrzyknięcia lub ewentualnie stosując w miejscach występowania ultrasonoterapię (jeśli jest do dyspozycji), aby uniknąć guzków i stwardnienia.
U pacjentów leczonych apomorfiną donoszono o przypadkach niedokrwistości hemolitycznej i trombocytopenii. Jeśli jednocześnie z apomorfiną podaje się lewodopę, należy w regularnych odstępach czasu wykonywać badania hematologiczne.
Zaleca się ostrożność w podawaniu skojarzonym apomorfiny z innymi produktami leczniczymi, szczególnie tymi z wąskim zakresem terapeutycznym (patrz punkt 4.5).
U wielu pacjentów z zaawansowaną chorobą Parkinsona współwystępują dolegliwości neuropsychiczne. Istnieją dowody na to, że u niektórych pacjentów apomorfina może zaostrzyć zaburzenia neuropsychiczne. Należy zachować szczególną ostrożność, jeśli tym pacjentom podaje się apomorfinę.
Stosowanie apomorfiny wiązało się z sennością oraz epizodami nagłego zaśnięcia, szczególnie
u pacjentów z chorobą Parkinsona. Pacjenci muszą być o tym poinformowani i należy zalecić ostrożność w trakcie przyjmowania apomorfiny podczas prowadzenia pojazdów lub obsługiwania maszyn. Pacjentom, u których występuje senność, nie wolno prowadzić pojazdów ani obsługiwać maszyn. Ponadto, można rozważyć zmniejszenie dawkowania lub zakończenie leczenia.
Zaburzenia kontroli zachowań impulsywnych
Pacjentów należy regularnie obserwować pod kątem występowania zaburzeń kontroli zachowań impulsywnych. Pacjentów i ich opiekunów należy uświadomić, że osoby przyjmujące agonistów receptorów dopaminowych w leczeniu choroby Parkinsona, w tym apomorfinę, są narażone na zaburzenia kontroli zachowań impulsywnych, takie jak patologiczne uzależnienie od hazardu,
zwiększone libido, hiperseksualność, kompulsywna potrzeba zakupów lub wydawania pieniędzy,
niepohamowany apetyt, kompulsywne jedzenie.
Należy rozważyć zmniejszenie dawkowania lub stopniowe zakończenie leczenia, jeśli pojawią się wymienione objawy.
Zespół dysregulacji dopaminowej (ang. Dopamine Dysregulation Syndrome, DDS) jest uzależnieniem prowadzącym do nadmiernego stosowania produktu, obserwowanym u niektórych pacjentów leczonych apomorfiną. Przed rozpoczęciem leczenia należy poinformować pacjentów i opiekunów
o potencjalnym ryzyku wystąpienia DDS.
Dacepton zawiera sodu pirosiarczyn, który może rzadko powodować ciężkie reakcje alergiczne
i skurcz oskrzeli.
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) sodu w 10 ml roztworu, to znaczy lek
uznaje się za „wolny od sodu”.
Pacjenci zakwalifikowani do leczenia apomorfiny chlorowodorkiem półwodnym prawie na pewno przyjmują też inne leki na chorobę Parkinsona. W początkowym etapie podawania apomorfiny chlorowodorku półwodnego należy obserwować pacjenta, czy nie występują nietypowe działania niepożądane lub objawy nasilenia działania.
Produkty lecznicze z grupy neuroleptyków mogą mieć działanie antagonistyczne, jeśli stosuje się je z apomorfiną. Istnieje możliwość interakcji między klozapiną a apomorfiną, jednak klozapinę można także stosować w celu złagodzenia objawów powikłań neuropsychicznych.
Nie badano możliwego wpływu apomorfiny na stężenie w osoczu innych leków. Dlatego zaleca się zachowanie ostrożności podczas jednoczesnego stosowania apomorfiny i innych produktów leczniczych, szczególnie tych z wąskim indeksem terapeutycznym.
Leki przeciwnadciśnieniowe i wpływające na czynność serca
Nawet podczas jednoczesnego stosowania z domperydonem, apomorfina może nasilać działanie przeciwnadciśnieniowe leków z tej grupy (patrz punkt 4.4).
Zaleca się unikanie podawania apomorfiny z innymi lekami o znanych właściwościach wydłużających odstęp QT.
Ponieważ podczas jednoczesnego podawania apomorfiny i ondansetronu zgłaszano występowanie nasilonego niedociśnienia tętniczego oraz utratę przytomności, jednoczesne podawania apomorfiny i ondansetronu jest przeciwwskazane.
Ciąża
Nie ma doświadczenia ze stosowaniem apomorfiny u kobiet w ciąży.
Badania reprodukcji u zwierząt nie wskazują na działanie teratogenne, jednak podawane szczurom dawki toksyczne dla matek mogą prowadzić do niewydolności oddechowej noworodków. Potencjalne ryzyko dla ludzi jest nieznane. Patrz punkt 5.3.
Nie należy stosować produktu Dacepton u kobiet w ciąży, chyba że jest to bezwzględnie konieczne.
Karmienie piersią
Nie wiadomo, czy apomorfina przenika do mleka ludzkiego. Decyzję, czy kontynuować lub przerwać karmienie piersią bądź kontynuować lub odstawić produkt Dacepton, należy podjąć uwzględniając korzyści z karmienia piersią dla dziecka i korzyści z podawania produktu Dacepton dla kobiety.
Apomorfiny chlorowodorek półwodny może w niewielkim lub umiarkowanym stopniu wpływać na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Pacjenci leczeni apomorfiną, u których występuje senność i (lub) nagłe epizody snu, muszą zostać
poinformowani, aby powstrzymali się od prowadzenia pojazdów i wykonywania czynności
(np. obsługiwanie maszyn), w przypadku których zmniejszona czujność może narazić pacjenta lub inne osoby na ryzyko ciężkiego urazu lub śmierci do chwili ustąpienia takich nawracających epizodów i senności (patrz także punkt 4.4).
Bardzo często: (≥ 1/10) |
Często: (≥ 1/100 do < 1/10) |
Niezbyt często: (≥ 1/1 000 do < 1/100) |
Rzadko: (≥ 1/10 000 do < 1/1 000) |
Bardzo rzadko: (< 1/10 000) |
Częstość nieznana: (częstość nie może być określona na podstawie dostępnych danych) |
Zaburzenia krwi i układu chłonnego | Niezbyt często: U pacjentów leczonych apomorfiną opisywano niedokrwistość hemolityczną i trombocytopenię. Rzadko: Podczas leczenia apomorfiny chlorowodorkiem półwodnym rzadko występowała eozynofilia. |
Zaburzenia układu immunologicznego | Rzadko: Wskutek zawartości sodu pirosiarczynu mogą występować reakcje alergiczne (w tym anafilaksja i skurcz oskrzeli). |
Zaburzenia psychiczne | Bardzo często: Omamy. Często: Podczas leczenia apomorfiny chlorowodorkiem półwodnym występowały zaburzenia neuropsychiczne (w tym przemijające łagodne stany splątania i omamy wzrokowe). Częstość nieznana: Zaburzenia kontroli zachowań impulsywnych: U pacjentów leczonych agonistami receptorów dopaminowych, w tym apomorfiną, stwierdzano objawy patologicznego hazardu, nasilonego libido, hiperseksualności, kompulsywnego kupowania lub wydawania pieniędzy, obżarstwa i kompulsywnego jedzenia (patrz punkt 4.4). Agresja, pobudzenie. |
Zaburzenia układu nerwowego | Często: Na początku leczenia może wystąpić przemijająca sedacja po podaniu dawki apomorfiny chlorowodorku półwodnego, ustępująca zazwyczaj po kilku pierwszych tygodniach. Apomorfina powoduje senność. Stwierdzano także zawroty głowy i oszołomienie. Niezbyt często: Apomorfina może wywoływać dyskinezy w okresach „on”, które w niektórych przypadkach mogą być ciężkie, a u niektórych pacjentów mogą prowadzić do przerwania leczenia. Apomorfina może powodować epizody nagłego zaśnięcia. Patrz punkt 4.4. Nieznana: Omdlenie Ból głowy. |
Zaburzenia naczyniowe | Niezbyt często: Niezbyt często występuje hipotonia ortostatyczna, zazwyczaj przemijająca (patrz punkt 4.4). |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Często: Podczas leczenia apomorfiną donoszono często o ziewaniu. Niezbyt często: Donoszono o trudnościach w oddychaniu. |
Zaburzenia żołądka i jelit | Często: Nudności i wymioty, szczególnie po pierwszym podaniu apomorfiny, zazwyczaj w wyniku niezastosowania domperydonu (patrz punkt 4.2). |
Zaburzenia skóry i tkanki podskórnej | Niezbyt często: Stwierdzano wysypkę miejscową i uogólnioną. |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często: U większości pacjentów występują reakcje w miejscu podania, szczególnie w przypadku stosowania ciągłego. Mogą obejmować guzki podskórne, stwardnienie, rumień, tkliwość uciskową i zapalenie tkanki podskórnej. Mogą także wystąpić różne reakcje miejscowe (np. podrażnienie, świąd, siniaczenie i ból). Niezbyt często: Stwierdzano martwicę i owrzodzenie w miejscu podania. Częstość nieznana: Zgłaszano występowanie obrzęku obwodowego. |
Badania diagnostyczne | Niezbyt często: U pacjentów otrzymujących apomorfinę stwierdzano dodatni wynik testu Coombsa. |
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa,
tel.: + 48 22 49-21-301, fax: +48 22 49-21-309, strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Doświadczenie kliniczne z przedawkowaniem apomorfiny w przypadku tej drogi podania jest
niewielkie. Objawy przedawkowania można leczyć empirycznie zgodnie z następującymi zaleceniami:
Silne wymioty można leczyć domperydonem. Depresję oddechową można leczyć naloksonem.
Hipotonia: należy zastosować odpowiednie postępowanie, np. unieść część łóżka, na której leżą kończyny dolne.
Bradykardię można leczyć atropiną.
Grupa farmakoterapeutyczna: leki stosowane w chorobie Parkinsona; leki dopaminergiczne Kod ATC: N04BC07.
Mechanizm działania
Apomorfina bezpośrednio pobudza receptory dopaminowe; jakkolwiek ma właściwości agonistyczne wobec receptorów D1 i D2, nie podziela z lewodopą szlaków transportu ani metabolicznych.
Chociaż podawanie apomorfiny u zdrowych zwierząt doświadczalnych zmniejsza szybkość uwalniania impulsów z komórek nigrostriatalnych, a w przypadku małej dawki stwierdzono, że zmniejsza aktywność lokomotoryczną (uważa się, że oznacza to presynaptyczne hamowanie endogennego uwalniania dopaminy), jej działanie w przypadku utraty zdolności ruchowych
w parkinsonizmie może wynikać z działania na receptory postsynaptyczne. Takie działanie dwufazowe stwierdza się także u ludzi.
Dystrybucja i Eliminacja
Zachowanie apomorfiny po podaniu podskórnym można opisać za pomocą modelu dwukompartmentowego, z okresem półtrwania dystrybucji 5 (±1,1) minut i okresem półtrwania eliminacji 33 (±3,9) minut. Odpowiedź kliniczna jest dobrze skorelowana ze stężeniem apomorfiny w płynie mózgowo-rdzeniowym; dystrybucję substancji czynnej najlepiej opisuje model dwukompartmentowy.
Wchłanianie i Metabolizm
Apomorfina jest szybko i całkowicie wchłaniana z tkanki podskórnej, co pozostaje skorelowane
z szybkim zapoczątkowaniem działania klinicznego (4-12 minut), a szybki klirens wyjaśnia krótki czas działania klinicznego substancji czynnej (około 1 godziny). Apomorfina jest metabolizowana poprzez glukuronidację i sulfonowanie co najmniej dziesięciu procent całkowitej ilości; innych szlaków nie opisano.
Wyniki badań toksyczności po wielokrotnym podaniu podskórnym nie wskazują na szczególne zagrożenia dla ludzi wykraczające poza informacje podane w innych punktach ChPL.
Badania genotoksyczności in vitro wykazują działanie mutagenne i klastogenne, najprawdopodobniej poprzez produkty utleniania apomorfiny. W przeprowadzonych badaniach in vitro sama apomorfina nie była jednak genotoksyczna.
Wpływ apomorfiny na rozród badano u szczurów. U tego gatunku apomorfina nie była teratogenna, stwierdzono jednak, że dawki toksyczne dla matki mogły powodować utratę opieki ze strony matki i niewydolność oddechową u noworodków.
Nie przeprowadzono badań działania rakotwórczego.
Sodu pirosiarczyn (E 223)
Kwas solny (do ustalenia pH)
Sodu wodorotlenek (do ustalenia pH)
Woda do wstrzykiwań
Nie należy mieszać produktu leczniczego z innymi produktami leczniczymi.
Przed otwarciem: 24 miesiące.
Po pierwszym otwarciu: trwałość chemiczną i fizyczną potwierdzono dla okresu do 15 dni
w temperaturze 25°C.
Z mikrobiologicznego punktu widzenia produkt należy zużyć natychmiast, chyba że otwarcie
i rozcieńczenie odbyło się w kontrolowanych i zwalidowanych warunkach aseptycznych. Jeśli roztwór nie zostanie zużyty natychmiast, odpowiedzialność za czas i warunki przechowywania gotowego roztworu przed użyciem ponosi użytkownik.
Nie przechowywać w temperaturze powyżej 25˚C. Nie przechowywać w lodówce ani nie zamrażać.
Przechowywać wkład w opakowaniu zewnętrznym w celu ochrony przed światłem.
Warunki przechowywania dotyczą produktu po pierwszym otwarciu, jak i w czasie pomiędzy pobieraniem kolejnych dawek.
Warunki przechowywania produktu leczniczego po pierwszym otwarciu, patrz punkt 6.3.
Wkłady z bezbarwnego szkła typu I, z korkiem z gumy bromobutylowej, z aluminiowym wieczkiem (flip-off) i uszczelnieniem z gumy bromobutylowej /syntetycznego poliizoprenu, umieszczone na plastikowej tacce w tekturowym pudełku, zawierające przezroczysty roztwór do wstrzykiwań.
Każdy wkład zawiera 3 ml roztworu do wstrzykiwań.
Opakowania zawiera: 5, 10, 30, 2 x 5 (opakowanie zbiorcze), 6 x 5 (opakowanie zbiorcze) i 3 x 10
(opakowanie zbiorcze) wkładów o pojemności 3 ml, umieszczonych na plastikowej tacce, w tekturowym pudełku.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
stosowania
Nie stosować, jeśli roztwór zmienił barwę na zieloną.
Przed zastosowaniem należy sprawdzić roztwór wzrokowo. Można stosować jedynie roztwory przezroczyste i bezbarwne do żółtawych, bez cząstek stałych, w nieuszkodzonych opakowaniach.
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi wymaganiami.
Każdy wkład z niewykorzystaną zawartością należy wyrzucić po 15 dniach po pierwszym otwarciu. Należy poinstruować pacjenta, jak należy bezpiecznie wyrzucić igłę po każdym wstrzyknięciu.
UWAGA: opakowanie NIE zawiera wstrzykiwacza oraz igieł.
Dacepton we wstrzykiwaczu jest przeznaczony do stosowania razem ze wstrzykiwaczem D-mine Pen i igłami do jednorazowego stosowania, co jest opisane w Instrukcji stosowania wstrzykiwacza.
Opis wstrzykiwacza
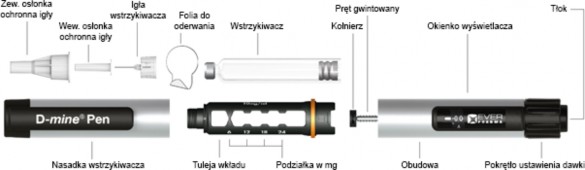
Gdzie i w jaki sposób wstrzykiwać lek Dacepton
DOPUSZCZENIE DO OBROTU
EVER Neuro Pharma GmbH Oberburgau 3
4866 Unterach am Attersee Austria
Pozwolenie nr 23778
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 02.03.2017 Data ostatniego przedłużenia pozwolenia: 08.12.2021
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
03.02.2022











