Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
nadwrażliwością na substancję czynną lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
zakaźnym zapaleniem błony naczyniowej oka.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
implant, u 21,6% osób 2 implanty, u 3,5% osób 3 implanty, a u 0,5% osób 4 implanty i u 0% osób
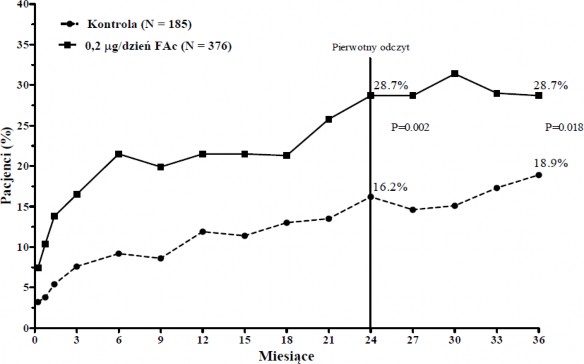
> 4 implanty). Pierwotnym punktem końcowym w obu badaniach była liczba osób, u których wzrok poprawił się o 15 lub więcej liter w ciągu 24 miesięcy. W każdym z tych badań osiągnięto pierwotny punkt końcowy skuteczności dla implantu ILUVIEN (zintegrowane wyniki pierwotnego punktu końcowego skuteczności, patrz Wykres 1).
Wykres 1: Odsetek osób z poprawą ≥ 15 liter w stosunku do okresu przed leczeniem, zintegrowane badania FAME
ILUVIEN (N=376)
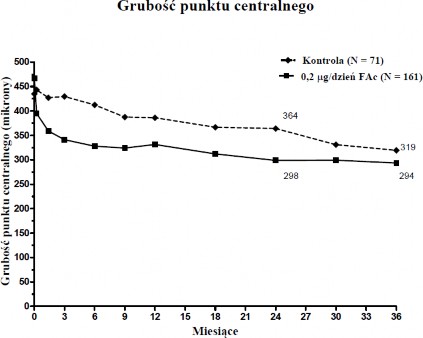
Gdy oceniano skuteczność jako funkcję czasu trwania choroby, osoby z czasem trwania DMO większym od mediany (≥ 3 lat) wykazywały znacząco korzystną reakcję na implant ILUVIEN, podczas gdy osoby z krótszym czasem trwania DMO nie wykazywały dodatkowej korzyści
w stosunku do leczenia kontrolnego w odniesieniu do poprawy wzroku (Wykresy 2 i 3). Dane tych podgrup wspomagają wskazanie z punktu 4.1 o stosowaniu u pacjentów z przewlekłym DMO
(tj. z czasem trwania co najmniej 3 lata).
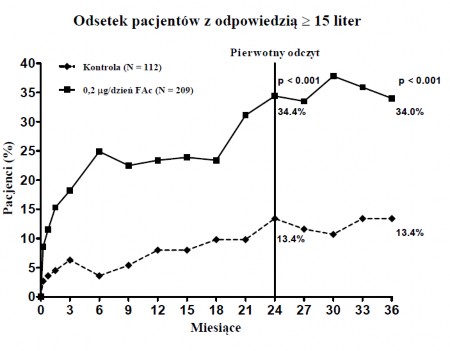
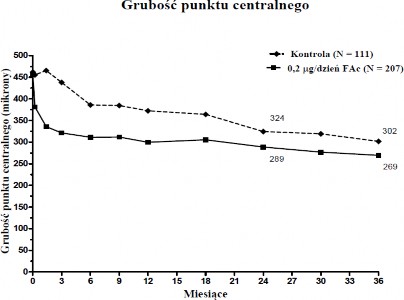
Wykres 2: Porównanie odsetka osób z poprawą w stosunku do okresu przed leczeniem ≥ 15 liter według badania najlepszej skorygowanej ostrości wzroku (BCVA) i średnią zmianą w stosunku do okresu przed leczeniem nadmiernej grubości punktu centralnego poprzez Podgrupę czasu trwania DMO ≥ 3 lat
DMO ≥ 3 lat
ILUVIEN (N=209)
ILUVIEN (N=207)
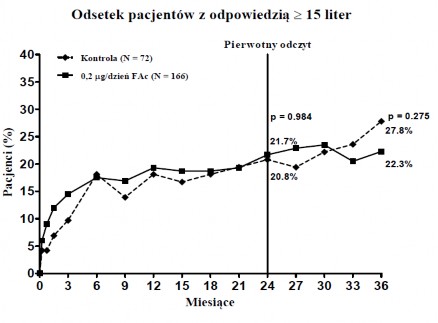
Wykres 3: Porównanie średniej zmiany w porównaniu z okresem przed leczeniem nadmiernej grubości punktu centralnego i procent osób z poprawą ≥ 15 liter w porównaniu z okresem przed leczeniem według BCVA poprzez Podgrupę czasu trwania DMO < 3 lat
DMO < 3 lat
ILUVIEN (N=166)
ILUVIEN (N=161)
Zakończono sześcioletnie badanie rejestrowe oceniające bezpieczeństwo stosowania po dopuszczeniu do obrotu (badanie IRISS; M-01-12-001) obejmujące dane od 556 pacjentów (695 oczu), które nie wykazało żadnych dodatkowych zagrożeń dla bezpieczeństwa oprócz tych określonych w badaniach FAME.
Niezakaźne zapalenie obejmujące tylny odcinek błony naczyniowej oka
Program opracowujący zastosowanie produktu ILUVIEN w terapii niezakaźnego zapalenia obejmującego tylny odcinek błony naczyniowej oka składa się z dwóch badań III fazy oceniających bezpieczeństwo i skuteczność dawki 0,2 µg/dzień fluocynolonu acetonidu w porównaniu
z wstrzyknięciem placebo w okresie 36 miesięcy. Oba badania są to prospektywne, randomizowane, prowadzone z podwójnie ślepą próbą i z grupą kontrolną otrzymującą wstrzyknięcie placebo, wieloośrodkowe badania, obejmujące razem 282 pacjentów, którzy otrzymali bądź pojedyncze leczenie fluocynolonem acetonidu (188 uczestników badania) lub wstrzyknięcie placebo
(94 uczestników badania). Kryteria kwalifikujące do badania miały na celu włączenie do badania pacjentów z nawracającą i nieustępującą postacią choroby. Parametry okulistyczne pacjentów zakwalifikowanych do badań w punkcie początkowym podano w Tabeli 2:
Tabela 2: Parametry okulistyczne badanego oka w punkcie początkowym w populacji wyodrębnionej zgodnie z zaplanowanym leczeniem (ITT): PSV-FAI-001 i PSV-FAI-005
Populacja ITT
PSV-FAI-001
PSV-FAI-005
Implant FAI (N=87)
Wstrzyknięcie
placebo (N=42)
Implant
FAI (N=101)
Wstrzyknięcie
placebo (N=52)
Litery w BCVA, Średnia (SD)
66,9 (15,49)
64,9 (15,53)
66,4 (15,85)
63,6 (16,82)
Stopień zaawansowania
zamglenia ciałka szklistego 0/0,5+
48 (55,2)
21 (50,0)
37 (36,6)
14 (27,0)
1/2+
39 (44,8)
21 (50,0)
64 (63,3)
38 (73,1)
3/4+
0
0
0
0
Wysięk komórek zapalnych w komorze przedniej oka 0/0,5+
77 (88,5)
33 (78,6)
93 (92,0)
49 (94,3)
1/2+
10 (11,5)
9 (21,4)
8 (7,9)
3 (5,8)
3/4+
0
0
0
0
Ciśnienie wewnątrzgałkowe (IOP),
Średnia (SD)
13,9 (3,12)
13,6 (3,15)
13,3 (3,07)
13,1 (2,60)
Stopień zaawansowania obrzęku plamki żółtej (μm)
CST<300
37 (42,5)
14 (33,3)
70 (69,3)
36 (69,2)
CST≥300
48 (55,2)
27 (64,3)
30 (29,7)
14 (26,9)
BCVA = najlepsza skorygowana ostrość wzroku; CST = grubość siatkówki w polu centralnym; SD = odchylenie standardowe
Dane podano w formacie „Liczba (%)”, jeśli nie zaznaczono inaczej.
Główny punkt końcowy skuteczności był określony jako odsetek uczestników badania, u których nie wystąpił nawrót zapalenia błony naczyniowej oka w okresie między randomizacją a miesiącem 6, gdzie nawrót choroby definiowano jako:
≥ 2-stopniowy wzrost liczby komórek w polu widzenia w porównaniu z punktem początkowym lub którymkolwiek punktem czasowym przed miesiącem 6; lub
zwiększenie zamglenia ciała szklistego o ≥ 2 stopnie w porównaniu z punktem początkowym lub którymkolwiek punktem czasowym przed miesiącem 6; lub
utrata najlepszej skorygowanej ostrości wzroku o ≥ 15 liter w porównaniu z punktem początkowym lub którymkolwiek punktem czasowym przed miesiącem 6.
Każde kryterium stosowane do zdefiniowania nawrotu choroby odnosiło się wyłącznie do niezakaźnego zapalenia błony naczyniowej oka. Pacjent, u którego wcześniej nie wystąpił nawrót choroby według definicji podanych w punktach (a), (b), (c), a przyjmował ogólnoustrojowy kortykosteroid lub lek immunosupresyjny, lub kortykosteroid podawany dogałkowo/okołogałkowo lub
miejscowo do badanego oka w którymkolwiek momencie badania przed miesiącem 6, był uważany za pacjenta, u którego wystąpił nawrót choroby. Nawrót choroby mógł być leczony według standardu opieki zgodnego z kryteriami określonymi w protokole.
W każdej z prób klinicznych III fazy osiągnięto główny punkt końcowy. Tabela 3 i 4 zawierają wyniki dla głównych punktów końcowych skuteczności porównujące odsetek nawrotów zapalenia błony naczyniowej badanego oka z grupą kontrolną placebo. Wykres 4 zawiera porównanie czasu do wystąpienia nawrotu zapalenia błony naczyniowej oka w grupach pacjentów poddanych leczeniu.
Tabela 3: Odsetek uczestników badania, u których wystąpił nawrót zapalenia błony naczyniowej badanego oka w ciągu 6 miesięcy (Populacja ITT): PSV-FAI-001 i PSV-FAI-005
Populacja ITT
PSV-FAI-001
PSV-FAI-005
Implant FAI
(N=87)
Wstrzyknięcie placebo
(N=42)
Implant FAI
(N=101)
Wstrzyknięcie placebo
(N=52)
Nawrót choroby w ciągu 6 miesięcy, n (%)
24 (27,6)
38 (90,5)
26 (25,7%)
31 (59,6%)
Brak nawrotu choroby w ciągu 6 miesięcy, n (%)
63 (72,4)
4 (9,5)
75 (74,3%)
21 (40,4%)
Różnica w porównaniu z grupą
terapii rzekomej 1
Iloraz szans
24,94
4,26
95% CI
8,04; 77,39
2,09; 8,67
Wartość p
<0,001
<0,001
Różnica w porównaniu z grupą terapii rzekomej 2
Różnica procentowa
62,9%
33,9%
95% CI
(50,0%; 75,8%)
(18,0%; 49,7%)
Wartość p
<0,001
<0,001
1 Iloraz szans oraz 95% przedział ufności (ang. confidence interval, CI) zostały obliczone metodą Mantela-Haenszela. Wartość p pochodzi z testu chi-kwadrat z poprawką na ciągłość, porównującego w grupach poddanych leczeniu liczbę uczestników badania, u których wystąpił bądź nie nawrót zapalenia błony naczyniowej oka w miesiącu 6.
2 Wartość p pochodzi z testu chi-kwadrat Cochrana-Mantela-Haenszela dla skojarzenia ogólnego porównującego w grupach poddanych leczeniu liczbę uczestników badania, u których wystąpił bądź nie nawrót zapalenia błony naczyniowej oka w miesiącu 6.
Tabela 4: Odsetek uczestników badania, u których wystąpił nawrót zapalenia błony naczyniowej badanego oka w ciągu 6 miesięcy (Populacja ITT): Dane zbiorcze z badań terapii zapalenia błony naczyniowej oka
Populacja ITT
Implant FAI (N=188)
Wstrzyknięcie placebo
(N=94)
Nawrót choroby w ciągu 6 miesięcy, n (%)
50 (26,6)
69 (73,4)
Brak nawrotu choroby w ciągu 6 miesięcy, n (%)
138 (73,4)
25 (26,6)
Różnica w porównaniu z grupą terapii
rzekomej1
Iloraz szans
7,62
95% CI
(4,35; 13,34)
Wartość p
<0,001
Różnica w porównaniu z grupą terapii rzekomej 2
Różnica procentowa
46,8%
95% CI
(35,9%; 57,8%)
Wartość p
<0,001
CI = przedział ufności
1 Iloraz szans oraz 95% przedział ufności (ang. confidence interval, CI) zostały obliczone metodą Mantela-Haenszela. Wartość p pochodzi z testu chi-kwadrat z poprawką na ciągłość, porównującego w grupach poddanych leczeniu liczbę uczestników badania, u których wystąpił bądź nie nawrót zapalenia błony naczyniowej oka w miesiącu 6.
2 Wartość p pochodzi z testu chi-kwadrat Cochrana-Mantela-Haenszela dla skojarzenia ogólnego porównującego w grupach poddanych leczeniu liczbę uczestników badania, u których wystąpił bądź nie nawrót zapalenia błony naczyniowej oka w miesiącu 6.
Wykres 4: Wykres Kaplana-Meiera dla czasu do pierwszych nawrotów zapalenia błony naczyniowej badanego oka w ciągu 6 miesięcy (ITT): Dane zbiorcze z badań terapii zapalenia błony naczyniowej oka
Czas (Dni)
Implant FAI (N=188) Wstrzyknięcie placebo (N=94)
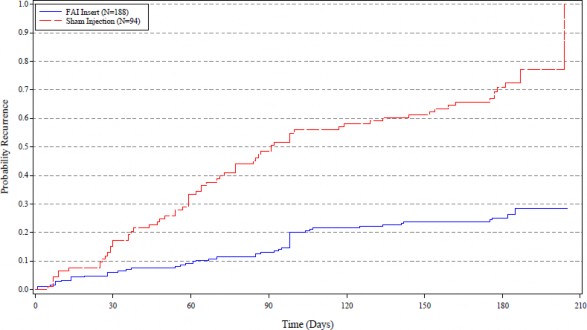

Wartość p (p<0,001) porównująca dwa rozkłady czasu do nawrotu zapalenia błony naczyniowej została obliczona na podstawie testu logarytmicznego rang.
W populacji ITT, częstość nawrotów zapalenia błony naczyniowej badanego oka zgłaszanych
w szóstym miesiącu była znacznie (p<0,001) niższa w grupie otrzymującej produkt ILUVIEN (37,9%) niż w grupie otrzymującej wstrzyknięcie placebo (97,6%); iloraz szans dla różnicy w porównaniu
z wstrzyknięciem placebo wynosił 67,09 (95% CI: 8,81; 511,06).
Utrzymującą się skuteczność wykazano na podstawie wyników dla 36 miesięcy trwania pierwszego rozpoczętego badania III fazy (PSV-FAI-001) (tabela zawiera wyniki badania PSV-FAI-001 dla głównego punktu końcowego skuteczności, porównujące odsetek nawrotów zapalenia błony naczyniowej badanego oka z grupą kontrolną terapii rzekomej, natomiast wykres zawiera porównanie czasu do nawrotu zapalenia błony naczyniowej w grupach poddanych leczeniu).
Tabela 5: Odsetek uczestników badania, u których wystąpił nawrót zapalenia błony naczyniowej badanego oka w ciągu 36 miesięcy (Populacja ITT) PSV-FAI-001
Populacja ITT
Implant FAI (N=87)
Wstrzyknięcie placebo (N=42)
Nawrót choroby w ciągu 36 miesięcy, n (%)
57 (65,5%)
41 (97,6%)
Brak nawrotu choroby w ciągu 36 miesięcy, n (%)
30 (34,5%)
1 (2,4%)
Różnica w porównaniu z grupą terapii rzekomej1
Iloraz szans
21,58
95% CI
(2,83; 164,70)
Wartość p
<0,001
Różnica w porównaniu z grupą terapii rzekomej 2
Różnica procentowa
32,1%
95% CI
(21,1%; 43,1%)
Wartość p
<0,001
1 Iloraz szans oraz 95% przedział ufności (ang. confidence interval, CI) zostały obliczone metodą Mantela-Haenszela. Wartość p pochodzi z testu chi-kwadrat z poprawką na ciągłość, porównującego w grupach poddanych leczeniu liczbę uczestników badania, u których wystąpił bądź nie nawrót zapalenia błony naczyniowej oka w miesiącu 36.
2 Wartość p pochodzi z testu chi-kwadrat Cochrana-Mantela-Haenszela dla skojarzenia ogólnego, porównującego w grupach poddanych leczeniu liczbę uczestników badania, u których wystąpił bądź nie nawrót zapalenia błony naczyniowej oka w miesiącu 36.
Wykres 5: Wykres Kaplana-Meiera dla czasu do pierwszego nawrotu zapalenia błony naczyniowej badanego oka w ciągu 36 miesięcy (Populacja ITT): PSV-FAI-001
Implant FAI (N=87) Wstrzyknięcie placebo (N=42)
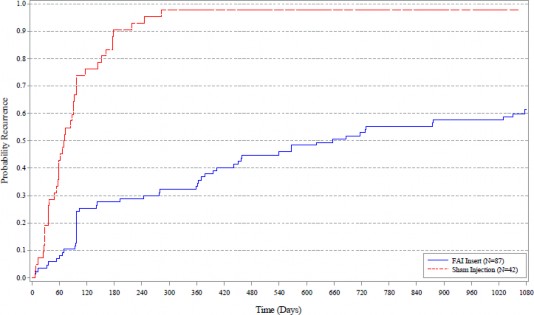

W populacji ITT, częstość nawrotów zapalenia błony naczyniowej badanego oka zgłaszanych w ciągu 36 miesięcy była znacznie (p<0,001) niższa w grupie otrzymującej produkt ILUVIEN niż w grupie otrzymującej wstrzyknięcie placebo.
Tabela 6: Liczba nawrotów zapalenia błony naczyniowej badanego oka w ciągu 6 miesięcy w populacji wyodrębnionej zgodnie z zaplanowanym leczeniem (ang. Intent-To-Treat, ITT): PSV-FAI-001 i PSV-FAI-005
Populacja ITT
PSV-FAI-001
PSV-FAI-005
Implant FAI
(N=87)
Wstrzyknięcie placebo
(N=42)
Implant FAI
(N=101)
Wstrzyknięcie placebo
(N=52)
Całkowita liczba nawrotów choroby
36
70
59
53
Liczba pacjentów, u których
wystąpił co najmniej jeden nawrót choroby
24
38
26
31
Liczba nawrotów choroby przypadająca na jednego
pacjenta
N
87
42
101
52
Średnia (SD)
0,4 (0,76)
1,7 (1,07)
0,6 (1,34)
1,0 (1,21)
Mediana
0,0
1,0
0,0
1,0
Minimum, maksimum
(0; 3)
(0; 5)
(0; 9)
(0; 6)
0
63 (72,4%)
4 (9,5%)
75 (74,3%)
21 (40,4%)
1
14 (16,1%)
18 (42,9%)
12 (11,9
%)
18 (34,6%)
2
8 (9,2%)
10 (23,8%)
4 (4,0 %)
8 (15,4%)
3
2 (2,3%)
9 (21,4%)
7 (6,9%)
3 (5,8 %)
4
0 (0,0%)
0 (0,0%)
1 (1,0%)
1 (1,9%)
5
0 (0,0%)
1 (2,4%)
1 (1,0%)
0 (0,0%)
>5
0 (0,0%)
0 (0,0%)
1 (1,0%)
1 (1,9%)
Różnica w porównaniu
z grupą terapii rzekomej 1
Szacunek
-1,3
-0,4
95% CI
(-1,62; -0,88)
(-0,87; 0,00)
Wartość p
<0,001
0,051
1 Wartość p pochodzi z analizy wariancji z jednej próbki z grupą poddaną leczeniu jako efektem stałym porównującej średnią liczbę nawrotów zapalenia błony naczyniowej w ciągu 36 miesięcy
Tabela 7: Liczba nawrotów zapalenia błony naczyniowej badanego oka w ciągu 36 miesięcy
w populacji wyodrębnionej zgodnie z zaplanowanym leczeniem (Populacja ITT): PSV-FAI-001
Populacja ITT
Implant FAI (N=87)
Wstrzyknięcie placebo (N=42)
Całkowita liczba nawrotów choroby
149
223
Liczba pacjentów, u których wystąpił co najmniej jeden nawrót choroby
57
41
Liczba nawrotów choroby przypadająca na
jednego pacjenta
N
87
42
Średnia (SD)
1,7 (2,42)
5,3 (3,84)
Mediana
1,0
5,0
Minimum, maksimum
(0; 15)
(0; 15)
0
30 (34,5%)
1 (2,4%)
1
29 (33,3%)
5 (11,9%)
2
7 (8,0%)
7 (16,7%)
3
8 (9,2%)
4 (9,5%)
4
4 (4,6%)
3 (7,1%)
5
2 (2,3%)
5 (11,9%)
>5
7 (8,0%)
17 (40,5%)
Różnica w porównaniu z grupą terapii rzekomej 1
Szacunek
-3,6
95% CI
(-4,89, -2,30)
Wartość p
<0,001
1 Wartość p pochodzi z analizy wariancji z jednej próbki z grupą poddaną leczeniu jako efektem stałym porównującej średnią liczbę nawrotów zapalenia błony naczyniowej w ciągu 36 miesięcy.
U pacjentów leczonych produktem ILUVIEN znacznie rzadziej dochodziło do nawrotów choroby w ciągu 36 miesięcy niż w grupie terapii rzekomej (1,7 nawrotów i 5,3 nawrotów, odpowiednio, p<0,001).
Tabela 8: Liczba terapii wspomagających stosowanych przeciwko zapaleniu błony naczyniowej badanego oka w ciągu 6 miesięcy (Populacja ITT): PSV-FAI-001 i PSV-FAI-005
Populacja ITT
PSV-FAI-001
PSV-FAI-005
Implant FAI
(N=87)
Wstrzyknięcie placebo
(N=42)
Implant FAI
(N=101)
Wstrzyknięcie placebo
(N=52)
Ogólnoustrojowy kortykosteroid lub lek immunosupresyjny
Całkowita liczba nawrotów choroby
21
24
25
14
Liczba pacjentów, u których wystąpił co najmniej jeden nawrót
choroby
13 (14,9%)
16 (38,1%)
14
(13,9%)
11 (21,2%)
Różnica w porównaniu z grupą terapii rzekomej 1
Różnica procentowa
23,2%
7,3%
95% CI
(6,7%; 39,6%)
(-5,7%; 20,3%)
Wartość p
0,003
0,249
Kortykosteroid podawany dogałkowo/okołogałkowo
Całkowita liczba nawrotów choroby
5
35
2
19
Liczba uczestników badania,
u których wystąpił co najmniej jeden nawrót choroby
5 (5,7%)
24 (57,1%)
2 (2%)
19 (36,5%)
Różnica w porównaniu z grupą
terapii rzekomej 1
Różnica procentowa
51,4%
34,6%
95% CI
(35,7%; 67,1%)
(21,2%; 47,9%)
Wartość p
<0,001
<0,001
Kortykosteroid podawany miejscowo
Całkowita liczba nawrotów choroby
17
22
11
17
Liczba uczestników badania,
u których wystąpił co najmniej jeden nawrót choroby
15 (17,2%)
18 (42,9%)
10 (9,9%)
12 (23,1%)
Różnica w porównaniu z grupą terapii rzekomej 1
Różnica procentowa
25,6%
13,2%
95% CI
(8,7%; 42,6%)
(0,3%; 26,0%)
Wartość p
0,002
0,028
1 Wartość p pochodzi z testu chi-kwadrat Cochrana-Mantela-Haenszela dla skojarzenia ogólnego, porównującego w grupach poddanych leczeniu liczbę uczestników badania, u których zastosowano bądź nie terapię wspomagającą.
Tabela 9: Liczba terapii wspomagających stosowanych przeciwko zapaleniu błony naczyniowej badanego oka w ciągu 36 miesięcy (Populacja ITT): PSV-FAI-001
Populacja ITT
Implant FAI (N=87)
Wstrzyknięcie
placebo (N=42)
Ogólnoustrojowy kortykosteroid lub lek immunosupresyjny
Całkowita liczba nawrotów choroby
61
45
Liczba pacjentów, u których wystąpił co najmniej jeden nawrót choroby
30 (34,5%)
21 (50,0%)
Różnica w porównaniu z grupą terapii rzekomej 1
Różnica procentowa
15,5%
95% CI
(-2,6%; 33,6%)
Wartość p
0,092
Kortykosteroid podawany dogałkowo/okołogałkowo
Całkowita liczba nawrotów choroby
23
99
Liczba uczestników badania, u których wystąpił co najmniej jeden nawrót choroby
17 (19,5%)
29 (69,0%)
Różnica w porównaniu z grupą terapii rzekomej 1
Różnica procentowa
49,5%
95% CI
(33,2%; 65,8%)
Wartość p
<0,001
Kortykosteroid podawany miejscowo
Całkowita liczba nawrotów choroby
40
47
Liczba uczestników badania, u których wystąpił co najmniej jeden nawrót choroby
24 (27,6%)
24 (57,1%)
Różnica w porównaniu z grupą terapii rzekomej 1
Różnica procentowa
29,6%
95% CI
(11,9%; 47,2%)
Wartość p
0,001
1 Wartość p pochodzi z testu chi-kwadrat Cochrana-Mantela-Haenszela dla skojarzenia ogólnego, porównującego w grupach poddanych leczeniu liczbę uczestników badania, u których zastosowano bądź nie terapię wspomagającą.
Znacznie mniejsza liczba pacjentów leczonych produktem ILUVIEN w porównaniu do terapii rzekomej wymagała leczenia wspomagającego kortykosteroidami podawanymi dogałkowo/okołogałkowo (19,5% i 69,0% odpowiednio, p<0,001) lub kortykosteroidami miejscowymi (27,6% i 57,1% odpowiednio, p=0,001). Mniejsza liczba pacjentów wymagała leczenia wspomagającego ogólnoustrojowymi kortykosteroidami lub lekami immunosupresyjnymi (34,5%
i 50,0% odpowiednio, p=0,092).
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań dotyczących fluocynolonu acetonidu podawanego do ciałka szklistego we wszystkich podgrupach populacji dzieci i młodzieży
w leczeniu cukrzycowego obrzęku plamki żółtej. Stosowanie u dzieci i młodzieży, patrz punkt 4.2.
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
ILUVIEN, 190 mikrogramów, implant do ciałka szklistego w aplikatorze.
Każdy implant zawiera 190 mikrogramów fluocynolonu acetonidu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Implant do ciałka szklistego w aplikatorze.
Jasnobrązowy cylinder wielkości około 3,5 mm x 0,37 mm. Aplikator implantu z igłą o rozmiarze 25 G.
ILUVIEN jest wskazany do leczenia zaburzeń widzenia związanych z przewlekłym cukrzycowym obrzękiem plamki żółtej (ang. diabetic macular oedema, DMO), uznanym za niewystarczająco reagujący na dostępne terapie (patrz punkt 5.1).
ILUVIEN jest wskazany do zapobiegania nawrotom choroby w przebiegu nawracającego niezakaźnego zapalenia obejmującego tylny odcinek błony naczyniowej oka (patrz punkt 5.1)
Dawkowanie
Zalecaną dawką jest jeden implant ILUVIEN do chorego oka. Podawanie do obu oczu jednocześnie nie jest zalecane. (patrz punkt 4.4).
Każdy implant ILUVIEN uwalnia fluocynolonu acetonid przez okres do 36 miesięcy.
Cukrzycowy obrzęk plamki żółtej
Kolejny implant może być podany po 12 miesiącach, jeżeli u pacjenta występuje pogorszenie widzenia lub zwiększenie grubości siatkówki wtórne do nawrotu lub pogorszenie cukrzycowego obrzęku plamki żółtej (patrz punkt 5.1).
Nie należy stosować ponownego leczenia, o ile potencjalne korzyści nie przewyższają ryzyka.
Implantem ILUVIEN powinni być leczeni wyłącznie pacjenci, którzy niedostatecznie reagowali na wcześniejsze leczenie fotokoagulacją laserową lub innymi dostępnymi sposobami leczenia cukrzycowego obrzęku plamki żółtej.
Niezakaźne zapalenie obejmujące tylny odcinek błony naczyniowej oka
Brak jest dostępnych danych, aby uzasadnić ponowne leczenie pacjentów dodatkowym implantem w celu zapobiegania nawrotom choroby w przebiegu nawracającego niezakaźnego zapalenia obejmującego tylny odcinek błony naczyniowej oka.
Dzieci i młodzież
Podawanie fluocynolonu acetonidu do ciałka szklistego u dzieci i młodzieży nie jest właściwe we wskazaniu cukrzycowego obrzęku plamki żółtej (ang. DMO).
Nie ustalono bezpieczeństwa i skuteczności stosowania produktu w leczeniu zapalenia błony naczyniowej oka u dzieci i młodzieży.
Specjalne grupy pacjentów
U pacjentów w podeszłym wieku lub pacjentów z zaburzeniami czynności nerek lub wątroby nie jest konieczne dostosowanie dawki.
Sposób podawania
WYŁĄCZNIE PODANIE DO CIAŁKA SZKLISTEGO.
Implant ILUVIEN jest przeznaczony wyłącznie do podawania do ciałka szklistego i powinien być podawany przez okulistę doświadczonego w wykonywaniu wstrzyknięć do ciałka szklistego. Zabieg wstrzyknięcia do ciałka szklistego powinien być wykonywany w kontrolowanych warunkach aseptycznych, co obejmuje jałowe rękawiczki, jałową serwetę i jałowy wziernik powiekowy (lub równorzędny). Przed wstrzyknięciem należy zastosować właściwe znieczulenie oraz lek bakteriobójczy o szerokim spektrum działania.
Zabieg wstrzyknięcia implantu ILUVIEN należy przeprowadzić w następujący sposób:
Stosowanie implantu do ciałka szklistego ILUVIEN jest przeciwwskazane przy współistniejącej jaskrze lub czynnym czy podejrzewanym zakażeniu oczu lub okolic oczu, w tym z chorobami wirusowymi rogówki i spojówek, włącznie z czynnym nabłonkowym opryszczkowym zapaleniem rogówki (dendrytowe zapalenie rogówki), krowianką, ospą wietrzną, zakażeniami Mycobacterium i chorobami grzybiczymi.
ILUVIEN jest przeciwwskazany u pacjentów z:
Wstrzyknięcia do ciałka szklistego były związane z wewnętrznym zapaleniem oka, zwiększeniem lub zmniejszeniem ciśnienia wewnątrzgałkowego, odklejeniem siatkówki i krwawieniem lub odklejeniem ciałka szklistego. Pacjenci powinni być poinformowani o konieczności zgłaszania wszelkich objawów sugerujących wewnętrzne zapalenie oka. Monitorowanie pacjenta w ciągu dwóch do ośmiu dni po wstrzyknięciu może pozwolić na wczesną identyfikację i leczenie zakażenia oka, zwiększenia lub zmniejszenia ciśnienia wewnątrzgałkowego lub innych powikłań. Następnie zaleca się monitorowanie ciśnienia wewnątrzgałkowego co najmniej raz na kwartał.
Stosowanie kortykosteroidów do ciałka szklistego może spowodować zaćmę, zwiększenie ciśnienia wewnątrzgałkowego, jaskrę i może zwiększyć ryzyko wtórnych zakażeń.
Bezpieczeństwo stosowania i skuteczność implantu ILUVIEN podawanego do obu oczu równocześnie nie zostały zbadane. Nie zaleca się podawania implantu do obu oczu podczas tej samej wizyty.
Leczenie obu oczu nie jest wskazane do czasu poznania reakcji układowej i ocznej pacjenta na pierwszy implant (patrz punkt 4.2).
Badania III fazy w terapii cukrzycowego obrzęku plamki żółtej (FAME)
W badaniach FAME zabieg usunięcia zaćmy przeprowadzono u 80% pacjentów z naturalną soczewką leczonych fluocynolonu acetonidem (patrz punkt 4.8). Po leczeniu fluocynolonu acetonidem pacjentów z naturalną soczewką należy ściśle monitorować w kierunku objawów zaćmy.
38% pacjentów leczonych fluocynolonu acetonidem wymagało leczenia lekiem obniżającym ciśnienie wewnątrzgałkowe (patrz punkt 4.8). Fluocynolon acetonidu powinien być stosowany ostrożnie
u pacjentów z wysokim ciśnieniem wewnątrzgałkowym przed leczeniem, a ciśnienie wewnątrzgałkowe musi być ściśle monitorowane. W przypadku, gdy ciśnienie wewnątrzgałkowe wzrasta i nie reaguje na leki lub zabiegi obniżające ciśnienie wewnątrzgałkowe, implant ILUVIEN może być usunięty przez witrektomię.
24% osób w grupie rzekomo leczonej którym podawano w dowolnym czasie antykoagulant lub lek przeciwpłytkowy, w porównaniu z 27% w grupie leczonej implantem ILUVIEN. U osób leczonych implantem ILUVIEN jednocześnie lub w ciągu 30 dni od zakończenia leczenia przeciwzakrzepowego lub przeciwpłytkowego krwawienie spojówkowe występowało nieco częściej w porównaniu
z osobami rzekomo leczonymi (0,5% rzekomo leczonych i 2,7% leczonych implantem ILUVIEN). Jedynym innym działaniem zgłaszanym częściej w grupie leczonej implantem ILUVIEN były powikłania operacji oka (0% rzekomo leczonych i 0,3% leczonych implantem ILUVIEN).
Istnieje ograniczone doświadczenie działania fluocynolonu acetonidu w oczach po witrektomii. Możliwe jest, że klirens leku będzie przyspieszony po witrektomii, chociaż nie oczekuje się wpływu na stężenia w stanie stacjonarnym. Może to skrócić czas działania implantu.
Badania III fazy w terapii zapalenia błony naczyniowej oka
W badaniach terapii zapalenia błony naczyniowej oka u niektórych pacjentów leczonych fluocynolonu acetonidem podawanym w implancie do ciałka szklistego przeprowadzono zabiegi usunięcia zaćmy. Pacjentów z naturalną soczewką należy po leczeniu ściśle monitorować w kierunku objawów zaćmy.
Ponadto u niektórych pacjentów obserwowano zwiększone ciśnienie wewnątrzgałkowe wymagające leczenia środkami obniżającymi IOP.
U niektórych pacjentów leczonych w badaniach fluocynolonu acetonidem występowała hipotonia, która pojawiała się w ciągu kilku dni po zastosowaniu leczenia (wielokrotnie już pierwszego dnia) i zwykle ustępowała w ciągu tygodnia od pojawienia się pierwszych objawów. Zaleca się
monitorowanie pacjentów w kierunku zwiększenia lub zmniejszenia IOP bezpośrednio po oraz przez pierwsze osiem dni po wstrzyknięciu.
W leczeniu pacjentów z zapaleniem błony naczyniowej oka należy bezwzględnie wykluczyć możliwość zakaźnych przyczyn zapalenia przed rozpoczęciem terapii produktem ILUVIEN.
Występuje ryzyko przesunięcia się implantu do komory przedniej oka, szczególnie u pacjentów z brakiem tylnej torebki soczewki lub uszkodzeniem tylnej torebki lub jej przedarciem po
wewnątrzgałkowym zabiegu operacyjnym. Jeśli leczenie nie zostanie podjęte, przesunięty implant może wywołać obrzęk rogówki i w ciężkich przypadkach prowadzić do uszkodzenia rogówki
z koniecznością przeszczepienia rogówki. U pacjentów z zaburzeniami widzenia należy przeprowadzić ocenę umożliwiającą wczesne rozpoznanie migracji implantu i odpowiednie postępowanie w takim przypadku.
Nie przeprowadzono badań dotyczących interakcji.
Ciąża
Istnieją ograniczone dane dotyczące stosowania fluocynolonu acetonidu do ciałka szklistego u kobiet w okresie ciąży. Badania na zwierzętach dotyczące szkodliwego wpływu podawanego do ciałka szklistego fluocynolonu acetonidu na reprodukcję są niewystarczające (patrz punkt 5.3). Mimo że fluocynolonu acetonid jest nieoznaczalny w krążeniu ogólnoustrojowym po podaniu miejscowym do oka, fluocynolon to silny glikokortykosteroid i nawet bardzo niski poziom ekspozycji układowej może stanowić ryzyko dla rozwijającego się płodu. W celu zachowania ostrożności zaleca się unikanie stosowania implantu ILUVIEN w okresie ciąży.
Karmienie piersią
Po podaniu ogólnym fluocynolonu acetonid przenika do mleka ludzkiego. Mimo że oczekuje się, iż ekspozycja układowa na fluocynolonu acetonid stosowany do ciałka szklistego kobiet karmiących piersią jest bardzo niska, należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać podawanie implantu ILUVIEN, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki.
Płodność
Brak danych na temat wpływu na płodność. Wpływ na płodność u mężczyzn lub kobiet jest jednak mało prawdopodobny, gdyż ekspozycja układowa na fluocynolonu acetonid stosowany do ciałka szklistego jest bardzo niska.
ILUVIEN wywiera niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Po podaniu implantu ILUVIEN pacjenci mogą przejściowo doświadczać zaburzeń widzenia i powinni unikać prowadzenia pojazdów lub obsługiwania maszyn do czasu ich ustąpienia.
Podsumowanie profilu bezpieczeństwa
Cukrzycowy obrzęk plamki żółtej
Fluocynolonu acetonid stosowany do ciałka szklistego oceniano u 768 osób (375 osób w grupie stosującej ILUVIEN w dawce 0,2 µg/dzień; 393 osoby w grupie stosującej 0,5 µg/dzień)
z cukrzycowym obrzękiem plamki żółtej w badaniach klinicznych FAME. Najczęściej zgłaszane reakcje niepożądane obejmowały operację zaćmy, zaćmę i zwiększenie ciśnienia wewnątrzgałkowego.
W badaniach 3 fazy 38,4% osób leczonych implantem ILUVIEN wymagało zastosowania leku obniżającego ciśnienie wewnątrzgałkowe, a 4,8% wymagało zabiegów chirurgicznych obniżających ciśnienie wewnątrzgałkowe. Zastosowanie leku obniżającego ciśnienie wewnątrzgałkowe było podobne u osób, które otrzymały dwa lub więcej cykli leczenia implantem ILUVIEN.
Zgłoszono dwa przypadki zapalenia wewnętrznego oka u osób leczonych implantem ILUVIEN w czasie badań fazy 3. Odpowiada to częstości występowania 0,2% (2 przypadki podzielone na 1022 wstrzyknięć).
Chociaż większość osób w badaniach klinicznych FAME otrzymała tylko jeden implant (patrz punkt 5.1), długoterminowe bezpieczeństwo obecności niebiodegradowalnego implantu wewnątrz oka jest nieznane. W badaniach klinicznych FAME dane 3-letnie wykazują, że zdarzenia takie jak zaćma, zwiększenie ciśnienia wewnątrzgałkowego i męty ciałka szklistego występują tylko nieznacznie częściej u osób otrzymujących 2 lub więcej implantów. Uznaje się to raczej za skutek zwiększonej
ekspozycji na lek niż efekt samego implantu. Badania niekliniczne nie wskazywały na zwiększenie częstości zdarzeń dotyczących bezpieczeństwa stosowania innych niż zmiany soczewek w oczach królika z 2-4 implantami w czasie 24 miesięcy. Implant jest wykonany z poliimidu i jest zasadniczo podobny dotykowo do soczewek ocznych; dlatego oczekuje się, że pozostanie nieczynny wewnątrz oka.
Niezakaźne zapalenie obejmujące tylny odcinek błony naczyniowej oka
Profil bezpieczeństwa dla niezakaźnego zapalenia obejmującego tylny odcinek błony naczyniowej oka oparty jest na dwóch 36-miesięcznych głównych badaniach przedrejestracyjnych terapii zapalenia błony naczyniowej oka (PSV-FAI-001 i PSV-FAI-005). Obecnie dostępne dane obejmują okres
36 miesięcy dla badania PSV-FAI-001 i 12 miesięcy dla badania PSV-FAI-005. Do najczęściej zgłaszanych reakcji niepożądanych należały zwiększone ciśnienie wewnątrzgałkowe, zaćma
i krwawienie spojówkowe. Rzadziej zgłaszanymi, lecz poważniejszymi reakcjami niepożądanymi były krwawienie do tarczy nerwu wzrokowego oraz odwarstwienie siatkówki.
Tabelaryczne zestawienie działań niepożądanych
Na podstawie danych z badań klinicznych III fazy (terapii DMO i zapalenia błony naczyniowej oka) oraz zgłoszeń spontanicznych uznano, że następujące działania niepożądane były związane
z leczeniem i zostały sklasyfikowane według następującej konwencji: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do <1/1000); i bardzo rzadko (≤1/10 000). W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Zakażenia i zarażenia pasożytnicze | Niezbyt często: wewnętrzne zapalenie oka |
Zaburzenia układu nerwowego | Niezbyt często: ból głowy |
Zaburzenia oka | Bardzo często: zaćma1, zwiększenie ciśnienia wewnątrzgałkowego2 Często: jaskra3, odwarstwienie siatkówki, krwawienie do tarczy nerwu wzrokowego*, krwawienie do ciałka szklistego, zmniejszona ostrość widzenia, zmiany w polu widzenia*, zwłóknienie plamki żółtej*, krwawienie spojówkowe4, zamazane widzenie*5, zmniejszone ciśnienie wewnątrzgałkowe*6, męty ciałka szklistego7, wysięk komórek zapalnych w komorze przedniej oka*, zmętnienie ciałka szklistego oka*, uczucie ciała obcego w oku*, suche oko*, fotopsja*, ból oka8. Niezbyt często: zamknięcie naczyń siatkówki9, zaburzenia nerwu wzrokowego, makulopatia, atrofia nerwu wzrokowego, wrzód spojówki, neowaskularyzacja tęczówki, wysięki siatkówki, degeneracja ciałka szklistego, odklejenie ciałka szklistego, odwarstwienie naczyniówki*, erozja rogówki*, złogi na rogówce, utrata przezierności torebki tylnej, zrost tęczówki, skurcz powiek*, obrzęk oka*10, przekrwienie, ścieńczenie twardówki, wydzielina z oka, świąd oka |
Urazy, zatrucia i powikłania po zabiegach | Niezbyt często: wypchnięcie implantu, implant w linii wzroku, powikłania po zabiegach, ból po zabiegu |
Procedury medyczne i chirurgiczne | Bardzo często: operacja zaćmy Często: trabekulektomia, operacja jaskry, witrektomia, trabekuloplastyka Niezbyt często: usunięcie wypchniętego implantu z twardówki |
Zaburzenia ogólne i stany w miejscu podania | Niezbyt często: przesunięcie się implantu (migracja), mogące prowadzić do obrzęku rogówki |
*Obserwowane wyłącznie u pacjentów z zapaleniem błony naczyniowej oka
1 obejmuje terminy MedDRA dotyczące zaćmy (NOS), zaćmy podtorebkowej, zaćmy korowej, zaćmy jądrowej i zaćmy cukrzycowej.
2 obejmuje terminy MedDRA dotyczące zwiększonego ciśnienia wewnątrzgałkowego i nadciśnienia ocznego.
3 obejmuje terminy MedDRA dotyczące jaskry, jaskry z otwartym kątem przesączania, jaskry granicznej, wytwarzania zagłębienia nerwu wzrokowego i zwiększonego stosunku zagłębienie/tarczy. 4 obejmuje terminy MedDRA dotyczące krwawienia spojówkowego, przekrwienia spojówek
5 obejmuje terminy MedDRA dotyczące zamazanego widzenia i zaburzeń widzenia. 6 obejmuje terminy MedDRA dotyczące obniżonego ciśnienia wewnątrzgałkowego 7 obejmuje terminy MedDRA dotyczące mętów ciałka szklistego
8 obejmuje terminy MedDRA dotyczące bólu oka, podrażnienia oka i dyskomfortu oka.
9 obejmuje terminy MedDRA dotyczące zamknięcia żyły siatkówki, zamknięcia tętnicy siatkówki i zamknięcia naczyń siatkówki.
10 obejmuje terminy MedDRA dotyczące obrzęku oka, obrzęku spojówki, obrzęku rogówki
Opis wybranych działań niepożądanych
Długotrwałe stosowanie kortykosteroidów może spowodować zaćmę i zwiększone ciśnienie wewnątrzgałkowe. Częstości podane poniżej odzwierciedlają zdarzenia obserwowane u wszystkich pacjentów w badaniach FAME. Obserwowane częstości u pacjentów z przewlekłym DMO nie były znacząco różne od obserwowanych w ogólnej populacji.
Badania III fazy w terapii cukrzycowego obrzęku plamki żółtej
Częstość występowania zaćmy u pacjentów z naturalną soczewką oka wynosiła około 82% u osób leczonych implantem ILUVIEN i 50% u osób rzekomo leczonych w badaniach klinicznych fazy 3. U 80% pacjentów z naturalną soczewką oka leczonych implantem ILUVIEN istniała konieczność operacji zaćmy do Roku 3 w porównaniu z 27% osób rzekomo leczonych. Większość pacjentów
wymagała operacji przed upływem 21 miesięcy. Tylna podtorebkowa zaćma jest najczęstszym typem zaćmy związanej ze stosowaniem kortykosteroidów. Operacja tego typu zaćmy jest trudniejsza i może być związana z większym ryzykiem powikłań chirurgicznych.
W badaniach DMO osoby z ciśnieniem wewnątrzgałkowym > 21 mmHg przed leczeniem zostały wyłączone. Częstość występowania zwiększonego ciśnienia wewnątrzgałkowego wynosiła 37%,
a 38% osób wymagało zastosowania leku obniżającego ciśnienie wewnątrzgałkowe, z czego połowa wymagała co najmniej dwóch leków do kontroli ciśnienia wewnątrzgałkowego. Stosowanie leku obniżającego ciśnienie wewnątrzgałkowe było podobne u osób, które były leczone dodatkowym implantem w czasie badania. Dodatkowo 5,6% (21/375) osób, które otrzymało implant, wymagało zabiegu chirurgicznego lub laserowego do kontroli ciśnienia wewnątrzgałkowego (trabekuloplastyka 5 (1,3%), trabekulektomia 10 (2,7%), endocykloablacja 2 (0,5%) i innych zabiegów chirurgicznych
6 (1,6%)).
W podgrupie osób z większym od mediany ciśnieniem wewnątrzgałkowym przed leczeniem
(≥15 mmHg) 47% wymagało zastosowania leku obniżającego ciśnienie wewnątrzgałkowe, a liczba zabiegów chirurgicznych lub laserowych zwiększyła się do 7,1%. W tej podgrupie było 5 (2,2%) osób leczonych trabekuloplastyką, 7 (3,1%) trabekulektomią, 2 (0,9%) endocykloablacją i 4 (1,8%) za pomocą innych zabiegów chirurgicznych stosowanych w leczeniu jaskry.
Badania III fazy w terapii zapalenia błony naczyniowej oka
Tabela 1: Zdarzenia niepożądane dotyczące IOP, zaćmy i hipotonii w populacjach wyodrębnionych zgodnie z zaplanowanym leczeniem (ang. Intent-To-Treat, ITT) w badaniach PSV-FAI-001 i PSV-FAI-005.
Populacja ITT | ||||
PSV-FAI-001 ( 36 miesięcy) | PSV-FAI-005 (12 miesięcy) | |||
Implant FAI1 | Wstrzyknięcie placebo | Implant FAI | Wstrzyknięcie placebo | |
Liczba randomizowanych pacjentów | 87 | 42 | 101 | 52 |
Czas trwania ekspozycji (dni) średnia (SD) | 1055 (139,47) | 1029 (191,09) | 354 (37,56) | 354 (37,56) |
Leki obniżające IOP n (%) | 37 (42,5) | 14 (33,3) | 51 (50,5) | 27 (51,9) |
IOP > 25 mmHg, n (%) | 21 (24,1) | 10 (23,8) | 22 (21,8) | 2 (3,8) |
IOP > 30 mmHg, n (%) | 14 (16,1) | 5 (11,9) | 15 (14,9) | 1 (1,9) |
Zabieg chirurgiczny obniżający IOP, n (%) | 5 (5,7) | 5 (11,9) | 1 (1,0) | 0 |
Zdarzenia niepożądane dotyczące IOP, n (%) | 28 (32,2) | 13 (31,0) | 30 (29,7) | 1 (1,9) |
Zabieg chirurgiczny na zaćmę, n (%) na podstawie pacjentów z naturalną soczewką | 31 (73,8) | 5 (23,8) | 11 (18) | 4 (11,4) |
Zdarzenia niepożądane dotyczące zaćmy, n (%) | 37 (42,5) | 10 (23,8) | 29 (47,5) | 11 (31,4) |
Hipotonia, n (%) | 9 (10,3) | 5 (11,9) | 13 (12,9) | 0 (0,0) |
1 Implant z fluocynolonem acetonidu do ciałka szklistego
W badaniach III fazy nad zapaleniem błony naczyniowej oka nie stwierdzono przypadków zapalenia wnętrza gałki ocznej w grupie fluocynolonu acetonidu.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: +48 22 49 21 301
Faks: +48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie zgłoszono żadnego przypadku przedawkowania.
Grupa farmakoterapeutyczna: LEKI PRZECIWZAPALNE, kortykosteroidy, zwykłe Kod ATC: S01BA15
Kortykosteroidy hamują reakcję zapalną na różnorodne czynniki pobudzające. Hamują obrzęk, odkładanie fibryny, rozszerzenie naczyń włosowatych, migrację leukocytów, proliferację naczyń włosowatych, proliferację fibroblastów, odkładanie kolagenu i tworzenie blizn związane z procesem zapalnym.
Uważa się, że kortykosteroidy działają poprzez indukcję białek hamujących fosfolipazę A, wspólnie nazywanych lipokortynami. Postuluje się, że te białka kontrolują biosyntezę silnych mediatorów zapalenia, takich jak prostaglandyny i leukotrieny, przez hamowanie uwalniania wspólnego prekursora, kwasu arachidonowego. Kwas arachidonowy jest uwalniany z fosfolipidów błonowych komórkowych przez fosfolipazę A2. Wykazano również, że kortykosteroidy zmniejszają stężenie naczyniowego śródbłonkowego czynnika wzrostu, białka, które zwiększa przepuszczalność naczyń i wywołuje obrzęk.
Cukrzycowy obrzęk plamki:
Skuteczność implantu ILUVIEN oceniano w dwóch randomizowanych, wieloośrodkowych, prowadzonych metodą podwójnie ślepej próby, równoległych badaniach, rekrutujących pacjentów z cukrzycowym obrzękiem plamki żółtej, którzy wcześniej byli leczeni za pomocą fotokoagulacji laserowej co najmniej raz. W obu badaniach obserwacja trwała 3 lata. U 74,4% osób zastosowano
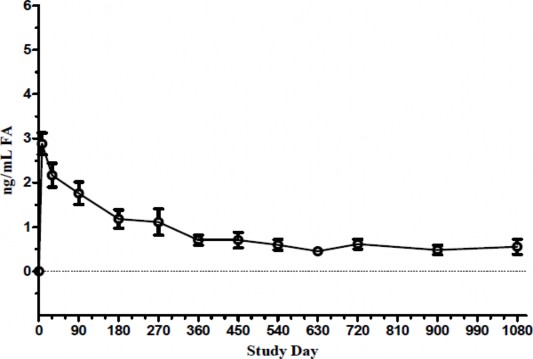
W badaniu farmakokinetycznym u ludzi (C-01-06-002, badanie FAMOUS) stężenie fluocynolonu acetonidu w osoczu było poniżej dolnej granicy oznaczalności testu (100 pg/ml) we wszystkich punktach czasowych od Dnia 1 do Miesiąca 36. U większości osób maksymalne stężenia w cieczy wodnistej fluocynolonu acetonidu obserwowano w Dniu 7. Stężenia fluocynolonu acetonidu w cieczy wodnistej zmniejszały się w czasie pierwszych 3-6 miesięcy, i pozostawały zasadniczo takie same
w Miesiącu 36 u osób, których nie leczono ponownie. U osób, które leczono ponownie, obserwowano
drugie maksymalne stężenie fluocynolonu acetonidu, podobne do stężenia po podaniu wstępnej dawki. Po ponownym leczeniu stężenie fluocynolonu acetonidu w cieczy wodnistej wracało do poziomu podobnego do obserwowanego w czasie pierwszego leczenia.
Wykres 6: Poziom fluocynolonu acetonidu (FA) w ludzkiej cieczy wodnistej u osób otrzymujących 1 implant ILUVIEN (badanie FAMOUS)
Dzień badania
Wykazano, że fluocynolonu acetonid działa teratogennie u myszy i królików po podaniu ogólnym. Brak danych na temat mutagenności fluocynolonu acetonidu podawanego do ciałka szklistego, jego rakotwórczości czy szkodliwego wpływu na rozwój. Fluocynolonu acetonid podawany do ciałka szklistego jest jednak nieoznaczalny w krążeniu ogólnoustrojowym, dlatego nie są spodziewane działania ogólne.
Obserwowano działania miejscowe (ogniska degeneracji włókien w tylnej biegunowej i tylnej korowej części soczewki) u królików przy zastosowaniu dawek fluocynolonu acetonidu podawanego do ciałka szklistego przekraczających dawki stosowane klinicznie. Obserwowano również działania miejscowe (ogniskowe blizny na siatkówce) u królików leczonych implantami zawierającymi zarówno placebo, jak i fluocynolonu acetonid. Blizn nie obserwowano klinicznie u ludzi i przyjmuje się, że były one wywołane różnicami w budowie anatomicznej oka królików i ludzi.
Substancje pomocnicze:
Alkohol poliwinylowy
Substancje pomocnicze wchodzące w skład implantu:
Tuba z poliimidu Warstwa silikonowa Alkohol poliwinylowy
Nie dotyczy.
Po pierwszym otwarciu opakowania bezpośredniego: zużyć natychmiast
Przechowywać w temperaturze poniżej 30°C. Nie przechowywać w lodówce ani nie zamrażać. Nie otwierać plastikowej tacy pokrytej folią do momentu zastosowania aplikatora.
1 opakowanie zawiera:
1 implant umieszczony w jałowym aplikatorze do jednorazowego użycia z igłą ze stali nierdzewnej. Aplikator jest umieszczony na plastikowej tacy pokrytej folią.
Opakowanie zewnętrzne: tekturowe pudełko
Usuwać aplikator w pojemniku do usuwania ostrych, niebezpiecznych biologicznie materiałów. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Alimera Sciences Europe Limited 77 Sir John Rogerson’s Quay Dublin 2
Irlandia
Pozwolenie nr 22358
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 23.03.2015 r.
09.08.2021 r.











