Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przymocować aplikator do pompki dozującej: należy mocno trzymać pompkę i wcisnąć górną część aplikatora.
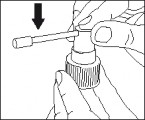
Odkręcić i zdjąć zakrętkę z butelki.
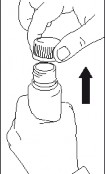
Pompkę dozującą umieścić w butelce i mocno zakręcić.
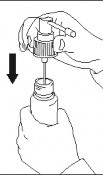
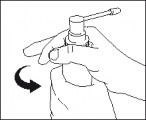
Zwolnić pompkę dozującą; dozownik jest gotowy do użycia.
Skierować aplikator w kierunku środka obszaru pozbawionego włosów, nacisnąć raz pompkę i rozprowadzić roztwór po całym obszarze koniuszkami palców (z lub bez masowania).
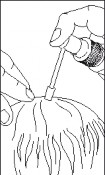
Dawkę wynoszącą 1 mL minoksydylu uzyskuje się po 10-krotnym naciśnięciu przycisku pompki.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Agrocia, 50 mg/mL, roztwór na skórę
Każdy mL roztworu zawiera 50 mg minoksydylu.
Jeden mL roztworu odpowiada 10 rozpyleniom (za pomocą pompki dozującej).
Substancje pomocnicze o znanym działaniu:
Każdy mL roztworu zawiera 520 mg glikolu propylenowego. Każdy mL roztworu zawiera 243 mg etanolu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór na skórę.
Przezroczysty, bezbarwny lub lekko żółtawy roztwór o zapachu alkoholu.
Leczenie łysienia androgenowego u mężczyzn.
Minoksydylu o mocy 50 mg/mL nie wolno stosować u kobiet, ze względu na możliwość wystąpienia niepożądanego owłosienia w innych częściach ciała (patrz punkt 4.4).
Wyłącznie do stosowania na skórę.
Dawkowanie
Zalecana dawka dobowa to 1 mL roztworu (10 rozpyleń aerozolu za pomocą pompki dozującej) dwa razy na dobę, nanoszonego na owłosioną skórę głowy, zaczynając od środka leczonej powierzchni. Należy zawsze stosować zalecaną dawkę dobową, niezależnie od wielkości powierzchni owłosionej skóry głowy objętej łysieniem.
Maksymalna dawka dobowa wynosi 2 mL.
Produkt leczniczy Agrocia stabilizuje proces łysienia typu męskiego (łysienie androgenowe)
w obrębie tonsury na przestrzeni o średnicy od 3 do 10 cm owłosionej skóry głowy u mężczyzn w wieku od 18 do 49 lat. Leczenie może więc przeciwdziałać postępowi łysienia androgenowego. Początek wystąpienia i stopień odpowiedzi na leczenie różni się u poszczególnych pacjentów,
jednakże nie można przewidzieć indywidualnej reakcji ze względu na brak dostępnych danych.
Odpowiedź na leczenie minoksydylem różni się u poszczególnych pacjentów, dlatego, do uzyskania zauważalnego wzrostu włosa, konieczne może być stosowanie produktu leczniczego przez okres
4 miesięcy. Podczas długotrwałego stosowania, efekty leczenia pozostają niezmienne w czasie. Jeśli po sześciu miesiącach nie obserwuje się poprawy wzrostu włosów, leczenie należy przerwać.
Przerwanie leczenia może spowodować zahamowanie wzrostu włosów i powrót do początkowego stanu łysienia przed rozpoczęciem leczenia w ciągu 3 do 4 miesięcy (patrz punkt 5.1).
Szczególne grupy pacjentów
Osoby w podeszłym wieku
Nie zaleca się stosowania minoksydylu w tej grupie wiekowej, ponieważ nie przeprowadzono badań u tych pacjentów.
Dzieci i młodzież
Nie zaleca się stosowania minoksydylu w tej grupie wiekowej, ponieważ nie przeprowadzono badań u tych pacjentów.
Sposób podawania
Zaleca się dokładne umycie rąk wodą po naniesieniu minoksydylu, ze względu na ryzyko wzrostu włosów w innych częściach ciała.
Nanosić na suchą owłosioną skórę głowy, rozpoczynając od środka leczonej powierzchni. Nie stosować na inną część ciała. Nie połykać.
Produkt leczniczy nanosi się za pomocą pompki dozującej, wyposażonej w przycisk do podania dawki oraz aplikator z wydłużoną końcówką. Przed zastosowaniem produktu leczniczego należy umieścić
aplikator, połączony z pompką dozującą, w butelce.
Instrukcja stosowania:
Nadwrażliwość na minoksydyl lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
U pacjentów z chorobami skóry lub zmianami skórnymi na skórze głowy, przezskórne wchłanianie produktu leczniczego może być większe, dlatego przed jego zastosowaniem należy upewnić się, że nie występują takie stany.
Minoksydyl nie jest wskazany u osób, u których w wywiadzie rodzinnym nie występuje wypadanie włosów, wypadanie włosów jest nagłe i (lub) częściowe lub przyczyna wypadania włosów nie jest znana, a także, gdy wypadanie włosów jest związane z niektórymi metodami leczenia, takimi, jak
chemioterapia lub niektóre choroby, takie jak niedobór żelaza, zaburzenia czynności tarczycy, toczeń
lub kiła wtórna, a także ciężkie zaburzenia odżywiania, pewne nawyki pielęgnacyjne (np. wiązanie włosów w ciasne warkocze lub kucyki).
Produkt leczniczy nie jest również wskazany w przypadku stosowania opatrunków okluzyjnych lub innych leków podawanych miejscowo na skórę głowy.
Minoksydyl należy stosować tylko na zdrową skórę głowy. Nie należy stosować minoksydylu, jeśli występuje stan zapalny, podrażnienie lub zakażenie skóry głowy, na miejsca objęte łuszczycą,
w przypadku silnego oparzenia słonecznego lub ciężkiego uszkodzenia skóry głowy oraz na ogoloną skórę głowy, ze względu na ryzyko zwiększonego wchłaniania.
Przed zastosowaniem produktu leczniczego należy przeprowadzić pełny wywiad lekarski i zbadać pacjenta. Należy wykluczyć zaburzenia endokrynologiczne, podstawowe choroby ogólnoustrojowe lub niedożywienie i, jeżeli jest to konieczne, należy włączyć specjalne leczenie.
Chociaż badania przeprowadzone z minoksydylem wykazały niewielkie wchłanianie ogólnoustrojowe, możliwe jest ograniczone miejscowe wchłanianie przez skórę głowy, dlatego zaleca się regularne monitorowanie ciśnienia krwi i tętna u pacjentów z chorobami serca lub układu krążenia, takimi jak:
choroba wieńcowa, zastoinowa niewydolność serca i (lub) choroby zastawek, oznaki możliwej retencji wody lub sodu, obrzęk miejscowy i uogólniony, wysięk osierdziowy, tamponada serca, tachykardia, dławica piersiowa. Pacjenci z rozpoznaną chorobą układu krążenia lub zaburzeniami rytmu serca powinni zasięgnąć porady lekarza przed zastosowaniem minoksydylu.
W razie wystąpienia ciężkich objawów ogólnoustrojowych lub dotyczących skóry, należy przerwać stosowanie minoksydylu i wprowadzić odpowiednie leczenie.
Produktu leczniczego Agrocia nie wolno stosować u kobiet, ze względu na ryzyko wzrostu włosów w innych częściach ciała.
Należy unikać kontaktu produktu leczniczego z oczami i błonami śluzowymi. W razie przypadkowego kontaktu z oczami, należy obficie przepłukać je wodą i, jeśli to konieczne, skonsultować się z okulistą. Należy unikać wdychania rozpylonej mgiełki roztworu powstałej podczas aplikacji produktu leczniczego.
Minoksydyl może zwiększać ryzyko niedociśnienia ortostatycznego u pacjentów leczonych
jednocześnie lekami rozszerzającymi naczynia obwodowe i lekami przeciwnadciśnieniowymi, takimi jak guanetydyna i jej pochodne (patrz punkt 4.5).
Należy przerwać stosowanie produktu leczniczego i skontaktować się z lekarzem, jeśli wystąpi niedociśnienie tętnicze lub ból w klatce piersiowej, szybka czynność serca, omdlenia lub zawroty
głowy, nagłe niewyjaśnione zwiększenie masy ciała, obrzęk rąk lub stóp albo trwałe zaczerwienienie lub podrażnienie skóry głowy.
Nie wolno narażać leczonego obszaru skóry na światło słoneczne (nawet podczas zachmurzenia) lub lampy emitujące promieniowanie ultrafioletowe (UVA). W razie potrzeby należy stosować
odpowiednią ochronę leczonego obszaru skóry.
Przypadkowe połknięcie produktu leczniczego może spowodować wystąpienie ciężkich działań
niepożądanych ze strony układu krążenia. Dlatego produkt leczniczy należy przechowywać w miejscu niedostępnym dla dzieci.
Niektórzy pacjenci na początku leczenia minoksydylem zgłaszali zwiększone wypadanie włosów. Przyczyną takiego stanu jest prawdopodobnie działanie minoksydylu, który powoduje skracanie spoczynkowej, telogenowej fazy cyklu włosa i przejście do fazy wzrostu, anagenu (stare włosy wypadają, pozostawiając miejsce dla rosnących włosów). Ten chwilowo nasilony proces utraty włosów występuje najczęściej w ciągu 2 do 6 tygodni po rozpoczęciu stosowania minoksydylu
i ustępuje samoistnie w ciągu kilku tygodni. W przypadku utrzymywania się tego stanu bez żadnej
poprawy (powyżej 2 tygodni), należy zaprzestać stosowania produktu leczniczego i skontaktować się z lekarzem.
Minoksydyl może zmienić kolor i (lub) strukturę włosów.
Substancje pomocnicze
Produkt leczniczy Agrocia zawiera etanol. Ze względu na zawartość etanolu produkt jest łatwopalny. Nie należy używać produktu w pobliżu otwartego płomienia, zapalonego papierosa lub niektórych urządzeń (np. suszarek do włosów).
Produkt leczniczy Agrocia zawiera 520 mg glikolu propylenowego w każdym mL roztworu na skórę.
Chociaż nie zostało to udowodnione klinicznie, minoksydyl może zwiększać ryzyko niedociśnienia ortostatycznego u pacjentów leczonych jednocześnie lekami rozszerzającymi naczynia obwodowe i lekami przeciwnadciśnieniowymi, takimi jak guanetydyna i jej pochodne.
Nie wolno stosować produktu leczniczego Agrocia jednocześnie z innymi lekami stosowanymi na skórę, takimi jak np. kortykosteroidy, retynoidy, np. miejscowo stosowane produkty zawierające tretynoinę, gdyż mogą one zwiększać wchłanianie minoksydylu.
Należy unikać jednoczesnego stosowania z produktami do włosów takimi, jak pomady o działaniu okluzyjnym, ponieważ mogą one zwiększać wchłanianie minoksydylu.
Wykazano, że betametazonu dipropionian zwiększa miejscowe stężenie minoksydylu w tkankach i zmniejsza jego wchłanianie ogólnoustrojowe. Jednakże, wpływ betametazonu dipropionianu na wchłanianie minoksydylu w przypadku zapalenia skóry głowy nie jest znany.
Podczas jednoczesnego stosowania minoksydylu stosowanego miejscowo z cyklosporyną podawaną ogólnoustrojowo istnieje zwiększone ryzyko nadmiernego wzrostu włosów.
Badania na zwierzętach nie wykazały szkodliwego wpływu na przebieg ciąży, rozwój zarodka/płodu, poród lub rozwój pourodzeniowy (patrz punkt 5.3).
Ze względu na brak danych klinicznych dotyczących stosowania u kobiet w ciąży, minoksydyl nie jest zalecany do stosowania w okresie ciąży.
Minoksydyl stosowany doustnie przenika do mleka kobiecego, dlatego nie zaleca się stosowania minoksydylu w okresie karmienia piersią.
Jest mało prawdopodobne, aby stosowanie produktu leczniczego wywierało wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
W obrębie każdej grupy o określonej częstości występowania, poniższe działania niepożądane wymieniono według malejącej ciężkości.
Najczęściej występujące działania niepożądane dotyczące skóry to: świąd, zapalenie skóry, suchość, podrażnienie skóry, wyprysk, nadmierne owłosienie. Działania te są zwykle łagodne do umiarkowanych i odwracalne po przerwaniu leczenia. Działania niepożądane mogą zależeć od dawki minoksydylu (świąd, zapalenie skóry, suchość, podrażnienie skóry, wyprysk) lub od sposobu stosowania (nadmierne owłosienie).
Działania niepożądane wymienione w tabeli zostały podzielone zgodnie z klasyfikacją układów
i narządów MedDRA oraz według częstości występowania. Bardzo często (≥1/10), często (≥ 1/100 do
< 1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10000 do <1/1000) i bardzo rzadko (< 1/10 000).
Zaburzenia układu nerwowego Bardzo często (≥ 1/10) Niezbyt często (1/1000 do <1/100) | Ból głowy Zawroty głowy |
Zaburzenia oka Niezbyt często (1/1000 do <1/100) | Podrażnienie oczu |
Zaburzenia serca Bardzo rzadko (<1/10 000) | Zmiany ciśnienia tętniczego krwi, zwiększenie częstości akcji serca |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Często (1/100 do <1/10) Bardzo rzadko (<1/10 000) | Duszność Ból w klatce piersiowej |
Zaburzenia skóry i tkanki podskórnej Często (1/100 do <1/10) Niezbyt często (1/1000 do <1/100) Bardzo rzadko (<1/10 000) | Miejscowe podrażnienie (złuszczanie, rumień, wysypka), świąd, kontaktowe zapalenie skóry, suchość skóry, obrzęk, wysypka przypominająca trądzik, pieczenie i nadmierne owłosienie. Wyprysk, zmiana struktury włosów, zmiana koloru włosów Przemijające wypadanie włosów, nierównomierny wzrost włosów |
Zaburzenia układu immunologicznego Nieznana (częstość nie może być określona na podstawie dostępnych danych). | Reakcje alergiczne, w tym obrzęk naczynioruchowy |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej Często (1/100 do <1/10) | Ból mięśniowo-szkieletowy |
Zaburzenia psychiczne Często (1/100 do <1/10) | Depresja |
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.
Al. Jerozolimskie 181 C, 02-222 Warszawa
Tel.: +48 22 49 21 301, Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przypadkowe lub zamierzone przedawkowanie minoksydylu lub zastosowanie większych niż zalecane dawek minoksydylu na skórę może powodować nasilenie działań niepożądanych dotyczących skóry, szczególnie takich, jak świąd, suchość, podrażnienie skóry i wyprysk. Ponadto, wchłanianie ogólnoustrojowe jest większe, co w konsekwencji zwiększa prawdopodobieństwo wystąpienia ogólnoustrojowych działań niepożądanych.
Objawy przedmiotowe i podmiotowe po przypadkowym lub zamierzonym przyjęciu doustnym tego produktu leczniczego wynikają z szybkiego i prawie całkowitego wchłaniania substancji czynnej
w przewodzie pokarmowym. Objawy te obejmują niedociśnienie, tachykardię, zatrzymanie wody i sodu i wynikające stąd obrzęki, wysięk opłucnowy lub zastoinową niewydolność serca.
Leczenie obrzęków wymaga podania leków moczopędnych, w przypadku tachykardii należy
zastosować leki blokujące receptory -adrenergiczne lub inne inhibitory współczulnego układu nerwowego, w razie niedociśnienia należy podać dożylnie roztwór soli fizjologicznej.
Należy unikać leków sympatykomimetycznych, takich jak adrenalina i noradrenalina, ze względu na ich działanie pobudzające czynność serca.
Grupa farmakoterapeutyczna: Inne leki dermatologiczne; produkty lecznicze zawierające minoksydyl kod ATC: D11AX 01.
Mechanizm działania
Minoksydyl (2,4-diamino-6-piperydynopirymidyno-3-tlenek) stosowany miejscowo wykazuje działanie hamujące wypadanie włosów. Mechanizm jego działania nie jest znany. Dane literaturowe wskazują, że minoksydyl pobudza wzrost włosów u pacjentów z łysieniem typu androgenowego.
Działanie to obserwuje się po co najmniej 4 miesiącach stosowania, a odpowiedź na leczenie różni się u każdego pacjenta.
Przerwanie leczenia minoksydylem może spowodować zatrzymanie wzrostu włosów i powrót do początkowego stanu łysienia w ciągu 3 do 4 miesięcy.
Skuteczność kliniczna i bezpieczeństwo stosowania
Nie przeprowadzono badań klinicznych z produktem leczniczym Agrocia.
Wchłanianie
Wchłanianie ogólnoustrojowe po podaniu na skórę wynosi około 1-2%. Wchłanianie minoksydylu po podaniu na skórę nie zmienia się w zależności od płci, po ekspozycji na promieniowanie UV, podczas jednoczesnego stosowania produktu nawilżającego, pod okluzją (np. noszenie peruki), po
odparowaniu rozpuszczalnika (suszarką do włosów) lub stanu powierzchni skóry, na którą jest nakładany. Jednakże, w przypadku zranienia warstwy rogowej skóry głowy na skutek oparzenia słonecznego, golenia lub przez inne czynniki, wchłanianie przezskórne może zwiększyć się, co może spowodować zwiększenie częstości występowania i nasilenia działań niepożądanych.
Po podaniu minoksydylu w postaci roztworu 2% u mężczyzn, AUC minoksydylu
wynosiło 7,5 ng*h/mL, a Cmax wynosiło 1,25 ng/mL. Po podaniu minoksydylu w postaci roztworu 5% u mężczyzn, AUC w surowicy wynosiło 18,7 ng*h/mL, a Cmax wynosiło 2,13 ng/mL. Czas do
osiągnięcia maksymalnego stężenia w osoczu (Tmax) wynosił 5,8 godzin.
Dystrybucja
Wiązanie z białkami osocza wynosi od 37 do 39%. Objętość dystrybucji po dożylnym podaniu minoksydylu wynosiła 70 L. Minoksydyl nie przenika przez barierę krew-mózg. Po zastosowaniu miejscowym minoksydyl przenika do mleka kobiecego.
Metabolizm
Około 60% wchłanianej dawki jest metabolizowane do glukuronidów, głównie w wątrobie.
Eliminacja
Minoksydyl jest wydalany głównie przez nerki (97%), tylko nieznaczna ilość jest wydalana z kałem (3%). Okres półtrwania miejscowo stosowanego minoksydylu wynosi 22 godziny. Po przerwaniu
leczenia, ok. 95% miejscowo stosowanego minoksydylu jest wydalane w ciągu 4 dni.
Szczególne grupy pacjentów
Zaburzenia czynności nerek i wątroby zazwyczaj nie wpływają na właściwości farmakokinetyczne minoksydylu stosowanego doustnie.
W badaniach toksyczności prowadzonych na zwierzętach, podawanie dużych dawek minoksydylu nie powodowało toksycznego działania na żaden z głównych narządów. Dawki powodujące działanie toksyczne są bardzo duże, w porównaniu z dawkami i stężeniami w osoczu osiąganymi po podaniu miejscowym na skórę. Minoksydyl nie wykazywał działania mutagennego i genotoksycznego ani potencjalnego działania rakotwórczego.
Badania na zwierzętach, dotyczące toksycznego wpływu na reprodukcję, rozwój zarodka/płodu i okres okołoporodowy nie wykazały żadnego działania toksycznego.
Etanol 96%
Glikol propylenowy Woda oczyszczona.
Nie dotyczy.
3 lata.
Po pierwszym otwarciu butelki: 30 dni.
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Butelka z HDPE z zakrętka z PP oraz pompką dozującą z PP, w tekturowym pudełku.
Wielkość opakowania: butelka zawierająca 60 mL, 120 mL (2 butelki po 60 mL) i 240 mL (4 butelki po 60 mL) roztworu na skórę.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Medical Valley Invest AB Brädgårdsvägen 28
236 32 Höllviken Szwecja
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











