Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Lapimyl, 2 mg, tabletki powlekane Lapimyl, 4 mg, tabletki powlekane Lapimyl, 6 mg, tabletki powlekane
Lapimyl, 2 mg, tabletki powlekane: Jedna tabletka powlekana zawiera 2 mg lacydypiny. Lapimyl, 4 mg, tabletki powlekane: Jedna tabletka powlekana zawiera 4 mg lacydypiny. Lapimyl, 6 mg, tabletki powlekane: Jedna tabletka powlekana zawiera 6 mg lacydypiny.
Substancja pomocnicza o znanym działaniu:
Lapimyl, 2 mg, tabletki powlekane: Jedna tabletka powlekana zawiera 124,25 mg laktozy jednowodnej.
Lapimyl, 4 mg, tabletki powlekane: Jedna tabletka powlekana zawiera 248,50 mg laktozy jednowodnej.
Lapimyl, 6 mg, tabletki powlekane: Jedna tabletka powlekana zawiera 372,75 mg laktozy jednowodnej.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka powlekana.
Lapimyl, 2 mg, tabletki powlekane:
Białe, okrągłe tabletki powlekane z wytłoczonym 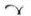 po jednej stronie oraz „225” po drugiej stronie, o średnicy około 7,2 mm.
po jednej stronie oraz „225” po drugiej stronie, o średnicy około 7,2 mm.
Lapimyl, 4 mg, tabletki powlekane:
Białe, owalne tabletki powlekane z wytłoczonym 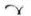 po jednej stronie oraz „2” i „24” przedzielonymi linią podziału po drugiej stronie, o wymiarach około 12,9 mm x 7,3 mm. Lapimyl, 6 mg, tabletki powlekane:
po jednej stronie oraz „2” i „24” przedzielonymi linią podziału po drugiej stronie, o wymiarach około 12,9 mm x 7,3 mm. Lapimyl, 6 mg, tabletki powlekane:
Białe, owalne tabletki powlekane z wytłoczonym 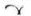 po jednej stronie i „226” po drugiej stronie,
po jednej stronie i „226” po drugiej stronie,
o wymiarach około 14,3 mm x 8 mm.
Produkt leczniczy Lapimyl jest wskazany do stosowania u dorosłych pacjentów w leczeniu nadciśnienia tętniczego, w monoterapii lub w skojarzeniu z innymi preparatami
przeciwnadciśnieniowymi, takimi jak beta-adrenolityki, leki moczopędne i inhibitory konwertazy angiotensyny (ACE).
Dawkowanie
Dorośli
Leczenie nadciśnienia należy dostosować do nasilenia choroby oraz indywidualnej reakcji pacjenta na leczenie.
Zalecana dawka początkowa wynosi 2 mg raz na dobę. Dawkę można zwiększyć do 4 mg (następnie, w razie konieczności, do 6 mg na dobę) po upływie czasu koniecznego do uzyskania pełnego działania farmakologicznego. W praktyce okres ten nie powinien być krótszy niż 3-4 tygodnie.
Nie stwierdzono, aby dawki dobowe większe niż 6 mg były znacząco bardziej skuteczne. Nie ma ograniczeń co do czasu stosowania lacypidyny.
Pacjenci z zaburzeniami czynności wątroby
Lacydypina jest metabolizowana głównie przez wątrobę, dlatego u pacjentów z zaburzeniami
czynności wątroby biodostępność lacydypiny moze być zwiększona, a działanie hipotensyjne nasilone. Pacjentów tych należy starannie monitorować, a w ciężkich przypadkach może być konieczne zmniejszenie dawki.
Pacjenci z chorobą nerek
Lacydypina nie jest wydalana przez nerki, dlatego nie jest konieczna modyfikacja dawkowania u pacjentów z chorobą nerek.
Dzieci i młodzież
Nie ustalono bezpieczeństwa i skuteczności stosowania lacydypiny u dzieci i młodzieży w wieku poniżej 18 lat. Brak dostępnych danych.
Sposób podawania
Podanie doustne.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Produkt leczniczy Lapimyl należy stosować bardzo ostrożnie u osób, u których wystąpiła wcześniej reakcja alergiczna na inną pochodną dihydropirydyny, ze względu na teoretyczne ryzyko
reakcji krzyżowej.
Podobnie jak w przypadku innych antagonistów wapnia, stosowanie lacydypiny należy przerwać u pacjentów u których wystąpi wstrząs kardiogenny lub niestabilna dławica piersiowa. Wykazano, że pochodne dihydropirydyny zmniejszają przepływ krwi w tętnicach wieńcowych u pacjentów ze zwężeniem aorty, dlatego stosowanie lacydypiny u tych pacjentów jest przeciwwskazane.
Nie należy stosować lacydypiny w trakcie zawału mięśnia sercowego lub w ciągu miesiąca od jego wystąpienia.
W przypadku rzadkich dziedzicznych zaburzeń, które mogą powodować nietolerancję substancji pomocniczej (patrz punkt 4.4), stosowanie produktu jest przeciwwskazane.
W badaniach specjalistycznych nie wykazano wpływu lacydypiny na automatyczną czynność węzła zatokowo-przedsionkowego ani na wydłużanie przewodzenia w węźle przedsionkowo-komorowym. Jednakże, podobnie jak w przypadku innych antagonistów wapnia istnieje teoretyczna możliwość wpływu na czynność węzła zatokowo-przedsionkowego i przedsionkowo-komorowego. Dlatego
należy zachować ostrożność stosując lacydypinę u pacjentów, u których wcześniej stwierdzono zaburzenia czynności węzła zatokowo-przedsionkowego i przedsionkowo-komorowego.
Podobnie jak w przypadku innych antagonistów wapnia z grupy pochodnych dihydropirydyny, należy zachować ostrożność stosując lacydypinę u pacjentów z wrodzonym lub nabytym wydłużeniem odstępu QT. Należy także zachować ostrożność stosując lacydypinę u pacjentów leczonych
jednocześnie lekami, które wydłużają odstęp QT, takimi jak leki przeciwarytmiczne klasy
I i III, trójpierścieniowe leki przeciwdepresyjne, niektóre leki przeciwpsychotyczne, antybiotyki (np. erytromycyna) i niektóre leki przeciwhistaminowe (np. terfenadyna).
Podobnie jak inne leki należące do grupy antagonistów wapnia, lacydypinę należy stosować ostrożnie u pacjentów z małą rezerwą sercową.
Nie ma dowodów, że lacydypina jest przydatna w prewencji wtórnej zawału mięśnia sercowego.
Nie ustalono skuteczności i bezpieczeństwa lacydypiny w leczeniu nadciśnienia tętniczego złośliwego.
Należy zachować ostrożność stosując lacydypinę u pacjentów z zaburzeniami czynności wątroby, ponieważ działanie przeciwnadciśnieniowe może być nasilone.
Nie stwierdzono, że lacydypina zaburza tolerancję glukozy lub pogarsza kontrolę cukrzycy.
Ten produkt leczniczy zawiera laktozę. Nie należy go stosować u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, niedoborem laktazy typu Lapp lub zespołem złego wchłaniania glukozy-galaktozy.
Jednoczesne stosowanie lacydypiny i innych leków o działaniu hipotensyjnym, w tym leków przeciwnadciśnieniowych (np. leki moczopędne, beta-adrenolityki lub inhibitory konwertazy angiotensyny) może powodować addytywne działanie hipotensyjne. Jednakże nie stwierdzono specyficznych interakcji z powszechnie stosowanymi lekami przeciwnadciśnieniowymi (np. beta- adrenolitykami, lekami moczopędnymi), digoksyną, tolbutamidem czy warfaryną.
Stężenie lacydypiny w osoczu może być zwiększone w przypadku jednoczesnego podawania cymetydyny.
Lacydypina silnie wiąże się z białkami (ponad 95%): z albuminą i alfa-1-glikoproteiną.
Podobnie jak w przypadku innych pochodnych dihydropirydyny, nie należy przyjmować lacydypiny z sokiem grejpfrutowym, gdyż może to wpływać na biodostępność lacydypiny.
W badaniach klinicznych przeprowadzonych z udziałem pacjentów po przeszczepieniu nerki, leczonych cyklosporyną, stwierdzono, że lacydypina normalizuje zmniejszone przesączanie kłębuszkowe i zmniejszony przepływ nerkowy, spowodowane podawaniem cyklosporyny.
Lacydypina jest metabolizowana przez CYP3A4 i dlatego leki będące silnymi inhibitorami
(np. itrakonazol) lub induktorami (np. ryfampicyna) CYP3A4 stosowane jednocześnie z lacydypiną mogą wywierać wpływ na jej metabolizm i wydalanie.
Jednoczesne stosowanie lacydypiny z kortykosteroidami lub tetrakozaktydem może osłabiać jej działanie przeciwnadciśnieniowe.
Ciąża
Pomimo że stwierdzono działanie teratogenne niektórych związków dihydropirydyny u zwierząt, dane dotyczące szczurów i królików nie dostarczyły dowodów na działanie teratogenne lacydypiny.
Stosowanie u zwierząt dawek lacydypiny znacznie większych niż zakres terapeutyczny powoduje toksyczny wpływ na matkę, skutkujący zwiększeniem ilości utraconych zarodków przed i po
implantacji oraz możliwym opóźnieniem kostnienia. Dane od zwierząt doświadczalnych wykazały, że stosowanie lacydypiny powoduje wydłużenie okresu ciąży oraz wydłużenie i utrudnienie porodu wskutek rozluźnienia mięśnia macicy.
Brak danych dotyczących bezpieczeństwa stosowania lacydypiny u kobiet w ciąży.
Lacydypinę możną stosować podczas ciąży tylko, jeśli korzyści dla matki przeważają nad możliwymi działaniami niepożądanymi u płodu lub noworodka.
Należy pamiętać, że lacydypina może powodować osłabienie czynności skurczowej mięśnia macicy w czasie porodu.
Karmienie piersią
W badaniach przeprowadzonych na zwierzętach wykazano, że lacydypina (lub jej metabolity) przenika do mleka matki.
Lacydypinę możną stosować w okresie karmienia piersią tylko, jeśli korzyści dla matki przeważają nad możliwymi działaniami niepożądanymi u noworodka.
Płodność
Brak dostępnych danych.
Lacydypina może powodować zawroty głowy. Należy uprzedzić pacjentów, aby nie prowadzili pojazdów ani nie obsługiwali maszyn, jeśli wystąpią zawroty głowy lub podobne objawy.
Lacydypina jest na ogół dobrze tolerowana. Niektórzy pacjenci mogą odczuwać łagodne objawy
niepożądane, związane ze znanym działaniem farmakologicznym, powodującym rozszerzenie naczyń obwodowych. Objawy te, oznaczone symbolem #, są zwykle przemijające i ustępują w czasie dalszego leczenia tą samą dawką lacydypiny.
Bardzo często (≥1/10) | Często (≥1/100 do <1/10) | Niezbyt często (≥1/1000 do <1/100) | Rzadko (≥1/10000 do <1/1000) | Bardzo rzadko (<1/10000) | Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) | |
Zaburzenia psychiczne | Depresja | |||||
Zaburzenia układu nerwowego | Zawroty głowy#, ból głowy# | Drżenie |
Zaburzenia serca | Kołatanie serca# , tachykardia | Omdlenie, dławica piersiowa | ||||
Zaburzenia naczyniowe | Nagłe zaczerwienie- nie# | Niedociśnie- nie | ||||
Zaburzenia żołądka i jelit | Objawy niestrawności, nudności | Rozrost dziąseł | ||||
Zaburzenia skóry i tkanki podskórnej | Wysypka, rumień, świąd | Obrzęk naczynioru- chowy, pokrzywka | ||||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Kurcze mięśni | |||||
Zaburzenia nerek i dróg moczowych | Wielomocz | |||||
Zaburzenia ogólne i stany w miejscu podaniu | Osłabienie, obrzęk# | |||||
Badania diagnostyczne | Zwiększenie aktywności fosfatazy alkalicznej |
Podobnie jak w przypadku innych pochodnych dihydropirydyny obserwowano w pojedynczych przypadkach nasilenie istniejącej dławicy piersiowej, szczególnie na początku leczenia. Większe prawdopodobieństwo pojawienia się takich działań występuje u pacjentów z objawową chorobą niedokrwienną serca.
Lacydypinę należy odstawić pod nadzorem lekarza, jeśli u pacjenta wystąpi niestabilna dławica piersiowa.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa,
tel.: + 48 22 49-21-301, fax: +48 22 49-21-309,
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy:
Dotychczas nie zanotowano przypadków przedawkowania lacydypiny. Najbardziej prawdopodobnym objawem przedawkowania jest przedłużone rozszerzenie naczyń obwodowych, z towarzyszącym
niedociśnieniem tętniczym i tachykardią. Może też wystąpić bradykardia lub wydłużenie przewodzenia przedsionkowo - komorowego.
Postępowanie:
Brak specyficznego leczenia. Należy zastosować standardowe postępowanie, w tym monitorowanie czynności serca i odpowiednie leczenie podtrzymujące i objawowe.
Grupa farmakoterapeutyczna: wybiórczy antagoniści wapnia o dominującym działaniu naczyniowym, pochodne dihydropirydyny, kod ATC: C08CA09
Lacydypina jest swoistym i silnie działającym antagonistą wapnia, o dominującym działaniu
wybiórczym na kanały wapniowe mięśni gładkich naczyń krwionośnych. Jej główne działanie polega na rozszerzaniu tętniczek obwodowych, co powoduje zmniejszenie obwodowego oporu naczyniowego i w rezultacie obniżenie ciśnienia tętniczego.
W badaniu klinicznym z udziałem dziesięciu pacjentów po przeszczepieniu nerki wykazano, że lacydypina zapobiegania nagłemu zmniejszeniu przepływu osocza przez nerki oraz przesączania kłębuszkowego przez około sześć godzin po podaniu doustnym cyklosporyny. Nie zaobserwowano
różnicy w przepływie osocza przez nerki oraz we współczynniku przesączania kłębuszkowego w fazie najmniejszego stężenia cyklosporyny we krwi u pacjentów przyjmujących i nie przyjmujących
lacydypinę.
Po podaniu doustnym 4 mg lacydypiny ochotnikom obserwowano nieznaczne wydłużenie odstępu QTc (średnie wydłużenie QTcF pomiędzy 3,44 i 9,60 ms u ochotników młodych i w
podeszłym wieku). Nie było to związane z jakimikolwiek niepożądanymi działaniami klinicznymi ani zaburzeniami rytmu serca w trakcie obserwacji.
Lacydypina jest związkiem wysoce lipofilnym; po podaniu doustnym wchłania się szybko z przewodu pokarmowego. Całkowita biodostępność wynosi około 10% na skutek znacznego metabolizmu podczas pierwszego przejścia przez wątrobę.
Największe stężenie w osoczu występuje po 30-150 minutach od podania leku. Lek jest usuwany głównie drogą metabolizmu wątrobowego (poprzez izoenzym CYP3A4 cytochromu P450). Nie stwierdzono, aby lacydypina indukowała lub hamowała aktywność enzymów wątrobowych.
Główne metabolity wykazują bardzo małą lub zerową aktywność farmakodynamiczną.
Około 70% dawki leku jest wydalane w postaci metabolitów z kałem, pozostała część wydalana jest w postaci metabolitów z moczem.
Średni końcowy okres półtrwania lacydypiny w stanie stacjonarnym wynosi od 13 do 19 godzin.
Badania toksyczności ostrej wykazały szeroki margines bezpieczeństwa lacydypiny.
W badaniach toksyczności po stosowaniu dawek wielokrotnych lacydypiny, wyniki u zwierząt związane z profilem bezpieczeństwa u ludzi, miały charakter odwracalny i odzwierciedlały farmakodynamiczne działanie lacydypiny.
W badaniach in vivo oraz in vitro dotyczących toksycznego wpływu na reprodukcję, genotoksyczności oraz rakotwórczości nie uzyskano danych o znaczeniu klinicznym.
Rdzeń tabletki:
Laktoza jednowodna Powidon (PVPK-30) Krospowidon (typ B) Magnezu stearynian
Otoczka tabletki:
Hypromeloza 5cP Tytanu dwutlenek (E171) Makrogol 400
Nie dotyczy.
3 lata
Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Blistry OPA/Alu/PVC/Alu.
Wielkości opakowań: 14 i 28 tabletek powlekanych. Opakowania kalendarzowe w wielkości: 28 tabletek powlekanych (dla dawek: 2 mg oraz 4 mg).
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań.
Mylan Ireland Limited Unit 35/36 Grange Parade
Baldoyle Industrial Estate, Dublin 13 Irlandia
Lapimyl, 2 mg: 23250
Lapimyl, 4 mg: 23251
Lapimyl, 6 mg: 23252











