Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Postępowanie w wypadku dłuższej przerwy w stosowaniu systemu terapeutycznego dopochwowego Contraseton
Pacjentka powinna jak najszybciej założyć nowy system terapeutyczny dopochwowy. Dodatkowo przez następne 7 dni powinna stosować mechaniczne metody antykoncepcji, takie jak prezerwatywa dla mężczyzn. Jeśli w czasie przerwy w stosowaniu systemu terapeutycznego dopochwowego Contraseton miał miejsce stosunek, należy upewnić się, że pacjentka nie jest w ciąży. Im przerwa
w stosowaniu systemu terapeutycznego dopochwowego Contraseton była dłuższa, tym większe ryzyko zajścia w ciążę.
Postępowanie w razie wypadnięcia systemu terapeutycznego dopochwowego Contraseton
System terapeutyczny dopochwowy Contraseton powinien się znajdować w pochwie nieprzerwanie przez okres 3 tygodni. W wypadku samoistnego wypadnięcia systemu terapeutycznego dopochwowego Contraseton, należy go umyć w zimnej lub letniej (nie gorącej) wodzie i jak najszybciej ponownie założyć.
Jeśli system terapeutyczny dopochwowy Contraseton znajdował się poza pochwą przez czas krótszy niż 3 godziny, nie wpłynęło to na skuteczność tej metody antykoncepcyjnej. Pacjentka powinna jak najszybciej ponownie założyć system terapeutyczny dopochwowy, nie później niż w ciągu 3 godzin od wypadnięcia.
Jeśli pacjentka podejrzewa lub jest pewna, że system terapeutyczny dopochwowy Contraseton znajdował się poza pochwą przez czas dłuższy niż 3 godziny w pierwszym lub drugim tygodniu stosowania, skuteczność antykoncepcyjna systemu terapeutycznego dopochwowego Contraseton mogła się zmniejszyć. Pacjentka powinna jak najszybciej ponownie założyć system terapeutyczny dopochwowy. Dodatkowo przez okres pierwszych 7 dni stosowania systemu terapeutycznego dopochwowego Contraseton po jego ponownym założeniu należy stosować mechaniczne metody antykoncepcji, takie jak prezerwatywa dla mężczyzn. Im dłużej system terapeutyczny dopochwowy Contraseton znajdował się poza pochwą i im bliżej planowanej przerwy w jego stosowaniu miało to
miejsce, tym większe ryzyko zajścia w ciążę.
Jeśli pacjentka podejrzewa lub jest pewna, że Contraseton znajdował się poza pochwą przez czas dłuższy niż 3 godziny w trzecim tygodniu stosowania, skuteczność antykoncepcyjna systemu terapeutycznego dopochwowego Contraseton mogła się zmniejszyć. Pacjentka powinna wyrzucić ten system terapeutyczny dopochwowy i wybrać jedno z dwóch poniższych rozwiązań:
Postępowanie w wypadku dłuższego stosowania systemu terapeutycznego dopochwowego Contraseton
Mimo, że nie jest to zalecany sposób postępowania, jeśli system terapeutyczny dopochwowy Contraseton był stosowany nie dłużej niż 4 tygodnie, skuteczność antykoncepcyjna jest zachowana. Pacjentka może zrobić jednotygodniową przerwę w jego stosowaniu, a następnie założyć nowy system terapeutyczny dopochwowy. Jeśli system terapeutyczny dopochwowy Contraseton stosowano dłużej niż 4 tygodnie, skuteczność antykoncepcyjna może być zmniejszona, a przed założeniem nowego systemu terapeutycznego dopochwowego należy upewnić się, że pacjentka nie jest w ciąży.
Jeśli pacjentka nie stosowała się do zaleconego sposobu użycia systemu terapeutycznego dopochwowego Contraseton i w kolejnej przerwie w jego stosowaniu krwawienie z odstawienia nie wystąpiło, przed założeniem nowego systemu terapeutycznego dopochwowego należy upewnić się, że pacjentka nie jest w ciąży.
JAK OPÓŹNIĆ WYSTĄPIENIE KRWAWIENIA LUB PRZESUNĄĆ JE W CZASIE
W wyjątkowych przypadkach, aby opóźnić wystąpienie krwawienia z odstawienia, pacjentka może założyć nowy system terapeutyczny dopochwowy, opuszczając tygodniową przerwę w jego stosowaniu. Nowy system terapeutyczny dopochwowy można używać przez następne 3 tygodnie.
W tym czasie może występować krwawienie śródcykliczne lub plamienie. Po tygodniowej przerwie w stosowaniu systemu terapeutycznego dopochwowego powraca się do normalnego stosowania systemu terapeutycznego dopochwowego Contraseton.
Aby przesunąć w czasie wystąpienie krwawienia z odstawienia na inny dzień tygodnia niż ten, do którego pacjentka jest przyzwyczajona, pacjentka może skrócić kolejną przerwę w stosowaniu systemu terapeutycznego dopochwowego Contraseton o dowolną liczbę dni. Im przerwa w stosowaniu systemu terapeutycznego dopochwowego Contraseton jest krótsza, tym większe jest prawdopodobieństwo braku krwawienia z odstawienia po jego usunięciu i wystąpienia krwawienia śródcyklicznego lub plamienia w czasie stosowania następnego
systemu terapeutycznego dopochwowego.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Ryzyko rozwoju żylnej choroby zakrzepowo-zatorowej
Stosowanie jakichkolwiek złożonych hormonalnych środków antykoncepcyjnych wiąże się ze zwiększonym ryzykiem rozwoju żylnej choroby zakrzepowo-zatorowej w porównaniu do sytuacji, gdy terapia nie jest stosowana. Stosowanie produktów zawierających lewonorgestrel, norgestimat lub noretisteron jest związane z najmniejszym ryzykiem rozwoju żylnej choroby zakrzepowo-zatorowej. Stosowanie innych produktów, takich jak system terapeutyczny dopochwowy Contraseton może być związane z dwukrotnie większym ryzykiem. Decyzja o zastosowaniu produktu spoza grupy najmniejszego ryzyka rozwoju żylnej choroby zakrzepowo-zatorowej powinna zostać podjęta wyłącznie po rozmowie
z pacjentką, w celu zapewnienia, że rozumie ona ryzyko żylnej choroby zakrzepowo-zatorowej związane z systemem terapeutycznym dopochwowym Contraseton, jak obecne czynniki ryzyka wpływają na to ryzyko oraz, że ryzyko rozwoju żylnej choroby zakrzepowo-zatorowej jest największe w pierwszym roku stosowania. Istnieją pewne dowody, świadczące, że ryzyko zwiększa się, gdy złożone hormonalne środki antykoncepcyjne są przyjmowane ponownie po przerwie w stosowaniu wynoszącej 4 tygodnie lub więcej.
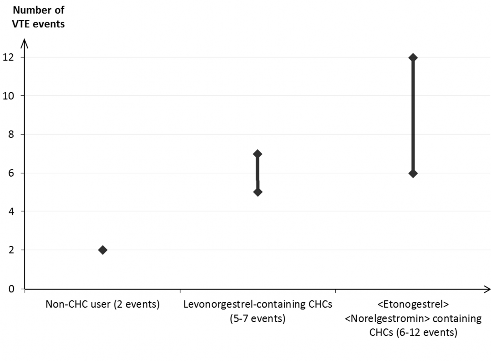
U około 2 na 10 000 kobiet, które nie stosują złożonych hormonalnych środków antykoncepcyjnych i nie są w ciąży, w okresie roku rozwinie się żylna choroba zakrzepowo- zatorowa. Jakkolwiek ryzyko to może być znacznie większe, w zależności od czynników ryzyka występujących u danej pacjentki (patrz poniżej).
Szacuje się, że spośród 10 000 kobiet, które stosują małe dawki złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel, u około 6 kobiet1, w okresie roku rozwinie się żylna choroba zakrzepowo-zatorowa. Uzyskano niejednoznaczne wyniki dotyczące ryzyka rozwoju żylnej choroby zakrzepowo-zatorowej związanego ze stosowaniem systemu terapeutycznego dopochwowego zawierającego etonogestrel + etynyloestradiol w porównaniu do złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel (relatywne ryzyko szacowane w zakresie od braku wzrostu, RR=0,96, do prawie dwukrotnego wzrostu ryzyka, RR=1,90). Przekłada się to na 6 do 12 przypadków żylnej choroby zakrzepowo-zatorowej w okresie roku na 10 000 kobiet stosujących system terapeutyczny dopochwowy zawierający etonogestrel + etynyloestradiol.
W obydwu sytuacjach, liczba przypadków żylnej choroby zakrzepowo-zatorowej przypadających na okres roku jest mniejsza niż oczekiwana liczba przypadków u kobiet w ciąży lub w okresie poporodowym.
Żylna choroba zakrzepowo-zatorowa może być śmiertelna w 1-2% przypadków.
1 Punkt środkowy z zakresu od 5 do 7 na 10 000 kobiet w okresie roku, w oparciu o relatywne ryzyko wynoszące około 2,3 do 3,6 dla złożonych hormonalnych środków antykoncepcyjnych zawierających lewonorgestrel w porównaniu do sytuacji, gdy terapia nie jest stosowana.
Liczba przypadków żylnej choroby zakrzepowo-zatorowej przypadających na 10 000 kobiet w okresie roku
Pacjentki niestosujące złożonych hormonalnych środków antykoncepcyjnych (2 przypadki)



Liczba przypadków żylnej choroby zakrzepowo- zatorowej
Złożone hormonalne środki antykoncepcyjne zawierające lewonorgestrel
(5-7 przypadków)
Złożone hormonalne środki antykoncepcyjne zawierające etonogestrel
(6-12 przypadków)
U pacjentek stosujących złożone hormonalne środki antykoncepcyjne niezwykle rzadko zgłaszano przypadki zakrzepicy w innych naczyniach krwionośnych, np. wątrobowych, krezkowych, nerkowych lub w żyłach i tętnicach siatkówki.
Czynniki ryzyka rozwoju żylnej choroby zakrzepowo-zatorowej
Ryzyko wystąpienia żylnych powikłań zakrzepowo-zatorowych u pacjentek stosujących złożone hormonalne środki antykoncepcyjne może znacząco wzrosnąć w przypadku występowania dodatkowych czynników ryzyka, szczególnie, jeśli występuje kilka czynników ryzyka jednocześnie (patrz tabela).
Stosowanie systemu terapeutycznego dopochwowego Contraseton jest przeciwwskazane, jeśli u pacjentki występuje jednocześnie kilka czynników ryzyka, zwiększających ryzyko wystąpienia zakrzepicy żylnej (patrz punkt 4.3). Jeśli u kobiety wstępuje więcej niż jeden czynnik ryzyka, możliwe jest, że zwiększenie ryzyka jest większe niż suma pojedynczych czynników – w tym przypadku należy ocenić całkowite ryzyko rozwoju żylnej choroby zakrzepowo-zatorowej. Jeśli ocena stosunku korzyści do ryzyka jest negatywna, nie należy przepisywać złożonych hormonalnych środków antykoncepcyjnych (patrz punkt 4.3).
Tabela: Czynniki ryzyka rozwoju żylnej choroby zakrzepowo-zatorowej
Czynnik ryzyka
Uwagi
Otyłość (wskaźnik masy ciała (BMI) powyżej 30 kg/m2)
Ryzyko istotnie zwiększa się ze wzrostem BMI.
Jest to szczególnie istotne do oceny, jeśli występują również inne czynniki ryzyka.
Długotrwałe unieruchomienie, rozległy zabieg operacyjny, jakikolwiek zabieg operacyjny w obrębie kończyn dolnych lub miednicy, zabieg neurochirurgiczny lub poważny uraz
Uwaga: tymczasowe unieruchomienie, w tym podróż samolotem >4 godzin może również stanowić czynnik ryzyka rozwoju żylnej choroby zakrzepowo- zatorowej, szczególnie u kobiet ze współistniejącymi innymi czynnikami ryzyka.
W powyższych sytuacjach zaleca się przerwanie stosowania plastrów/tabletek/systemu dopochwowego na co najmniej 4 tygodnie przed planowanym zabiegiem chirurgicznym i niewznawianie stosowania produktu przed upływem dwóch tygodni od czasu powrotu do sprawności ruchowej. Należy stosować inną metodę antykoncepcji, aby uniknąć niezamierzonego zajścia
w ciążę.
Należy rozważyć leczenie przeciwzakrzepowe, jeśli stosowania systemu terapeutycznego dopochwowego Contraseton nie przerwano odpowiednio wcześnie.
Dodatni wywiad rodzinny (występowanie żylnych zaburzeń zakrzepowo- zatorowych u rodzeństwa bądź rodziców, szczególnie w stosunkowo młodym wieku, tj. przed 50 rokiem życia)
Jeśli podejrzewa się predyspozycję genetyczną, przed podjęciem decyzji o stosowaniu złożonego hormonalnego środka antykoncepcyjnego kobieta powinna zostać skierowana na konsultację u specjalisty.
Inne schorzenia związane z żylną chorobą zakrzepowo- zatorową
Nowotwór, toczeń rumieniowaty układowy, zespół hemolityczno-mocznicowy, przewlekłe zapalne choroby jelit (np. choroba Leśniowskiego-Crohna lub wrzodziejące zapalenie jelita grubego) oraz niedokrwistość sierpowatokrwinkowa.
Wiek
Szczególnie w wieku powyżej 35 lat.
Nie osiągnięto konsensusu, co do możliwej roli żylaków oraz zakrzepowego zapalenia żył powierzchniowych na wystąpienie lub progresję żylnej choroby zakrzepowo- zatorowej.
Należy uwzględnić zwiększone ryzyko wystąpienia choroby zakrzepowo-zatorowej w ciąży oraz w szczególności w 6-tygodniowym okresie poporodowym („Ciąża i laktacja” patrz punkt 4.6).
Objawy żylnej choroby zakrzepowo-zatorowej (zakrzepicy żył głębokich oraz zatorowości płucnej)
Należy poinformować pacjentkę, że w razie wystąpienia następujących objawów należy natychmiast zgłosić się do lekarza i powiedzieć personelowi medycznemu, że stosuje się złożone hormonalne środki antykoncepcyjne.
Objawy zakrzepicy żył głębokich (ang. deep vein thrombosis, DVT) mogą obejmować:
obrzęk nogi i (lub) stopy lub obrzęk wzdłuż żyły w nodze
ból lub tkliwość w nodze, które mogą być odczuwane wyłącznie w czasie stania lub chodzenia
zwiększona temperatura w zmienionej chorobowo nodze; czerwona lub przebarwiona skóra
nogi
Objawy zatorowości płucnej (ang. pulmonary embolism, PE) mogą obejmować:
nagłe niewyjaśnione spłycenie oddechu lub przyspieszenie oddechu
nagły napad kaszlu, który może być połączony z krwiopluciem
ostry ból w klatce piersiowej
ciężkie zamroczenie lub zawroty głowy
przyspieszone lub nieregularne bicie serca
Niektóre z tych objawów (np. „spłycenie oddechu”, „kaszel”) są niespecyficzne i mogą być niepoprawnie zinterpretowane jako występujące częściej lub mniej poważne stany (np. zakażenia układu oddechowego).
Inne objawy zamknięcia naczyń mogą obejmować: nagły ból, obrzęk oraz lekko niebieskie przebarwienie kończyn.
Jeżeli zamknięcie naczynia wystąpi w oku, objawy mogą obejmować bezbolesne zaburzenia widzenia, które mogą przekształcić się w utratę widzenia. W niektórych przypadkach utrata widzenia może nastąpić niemal natychmiast.
Ryzyko rozwoju tętniczych zaburzeń zakrzepowo-zatorowych
Badania epidemiologiczne wykazały związek pomiędzy stosowaniem hormonalnych środków antykoncepcyjnych, a zwiększonym ryzykiem rozwoju tętniczych zaburzeń zakrzepowo- zatorowych (zawału mięśnia sercowego) lub incydentów naczyniowo-mózgowych (np. przemijającego napadu niedokrwiennego, udaru). Przypadki tętniczych zaburzeń zakrzepowo- zatorowych mogą być śmiertelne.
Czynniki ryzyka rozwoju tętniczych zaburzeń zakrzepowo-zatorowych
Ryzyko wystąpienia tętniczych powikłań zakrzepowo-zatorowych lub napadów naczyniowo- mózgowych u pacjentek stosujących złożone hormonalne środki antykoncepcyjne jest zwiększone
u kobiet, u których występują czynniki ryzyka (patrz tabela). Stosowanie systemu terapeutycznego dopochwowego Contraseton jest przeciwwskazane, jeżeli u pacjentki występuje jeden poważny lub jednocześnie kilka czynników ryzyka rozwoju tętniczych zaburzeń zakrzepowo-zatorowych, które stawiają pacjentkę w grupie wysokiego ryzyka rozwoju zakrzepicy tętniczej (patrz punkt 4.3). Jeśli
u kobiety wstępuje więcej niż jeden czynnik ryzyka, możliwe jest, że zwiększenie ryzyka jest większe niż suma pojedynczych czynników – w tym przypadku należy ocenić całkowite ryzyko. Jeśli ocena stosunku korzyści do ryzyka jest negatywna, nie należy przepisywać złożonych hormonalnych środków antykoncepcyjnych (patrz punkt 4.3).
Tabela: Czynniki ryzyka rozwoju tętniczych zaburzeń zakrzepowo-zatorowych
Czynnik ryzyka
Uwagi
Wiek
Szczególnie w wieku powyżej 35 lat.
Palenie tytoniu
Należy dokładnie pouczyć kobiety, aby nie paliły, jeśli zamierzają stosować złożone hormonalne środki antykoncepcyjne. Kobiety w wieku powyżej 35 lat, które nie zaprzestały palenia, należy dokładnie pouczyć, aby
stosowały inną metodę antykoncepcji.
Nadciśnienie tętnicze
Otyłość (wskaźnik masy ciała (BMI) powyżej 30 kg/m2)
Ryzyko istotnie wzrasta wraz ze wzrostem BMI.
Jest to szczególnie ważne dla kobiet, u których występują również inne czynniki ryzyka.
Dodatni wywiad rodzinny (występowanie tętniczych zaburzeń zakrzepowo- zatorowych u rodzeństwa bądź rodziców, szczególnie w stosunkowo młodym wieku, tj. przed 50. rokiem życia)
Jeśli podejrzewa się predyspozycję genetyczną, przed podjęciem decyzji o stosowaniu złożonego hormonalnego środka antykoncepcyjnego kobieta powinna zostać skierowana na konsultację u specjalisty.
Migrena
Zwiększenie częstości występowania lub nasilenia migreny w trakcie stosowania złożonych hormonalnych środków antykoncepcyjnych (która może zapowiadać wystąpienie incydentu naczyniowo- mózgowego) może być powodem do natychmiastowego przerwania stosowania.
Inne schorzenia związane ze zdarzeniami niepożądanymi w obrębie naczyń
Cukrzyca, hiperhomocysteinemia, wady zastawkowe serca, migotanie przedsionków, dyslipoproteinemia oraz toczeń rumieniowaty układowy.
Objawy tętniczych zaburzeń zakrzepowo-zatorowych
Należy poinformować pacjentkę, że w razie wystąpienia następujących objawów należy natychmiast zgłosić się do lekarza i powiedzieć personelowi medycznemu, że stosuje się złożone hormonalne środki antykoncepcyjne.
Objawy napadu naczyniowo-mózgowego mogą obejmować:
nagłe zdrętwienie lub osłabienie twarzy, rąk lub nóg, szczególnie po jednej stronie ciała;
nagłe trudności z chodzeniem, zawroty głowy, utratę równowagi lub koordynacji
nagła dezorientacja, trudności z mówieniem lub rozumieniem
nagłe trudności z widzeniem w jednym lub obydwu oczach
nagłe, ciężkie lub długotrwałe bóle głowy bez ustalonej przyczyny
utratę przytomności lub omdlenie z drgawkami lub bez drgawek
Przejściowe objawy sugerują, że zdarzenie jest przemijającym napadem niedokrwiennym (ang.
transient ischemic attack, TIA).
Objawy zawału serca (ang. myocardial infarction, MI) mogą być następujące:
ból, uczucie dyskomfortu, uczucie ucisku, ociężałość, uczucie ściskania lub pełności w klatce piersiowej, ramieniu lub poniżej mostka
uczucie dyskomfortu promieniujące do pleców, szczęki, gardła, ramienia, żołądka;
uczucie pełności, niestrawności lub zadławienia
nadmierne pocenie się, nudności, wymioty lub zawroty głowy
skrajne osłabienie, niepokój lub spłycenie oddechu
przyspieszone lub nieregularne bicie serca.
W razie podejrzenia lub potwierdzonych objawów żylnej choroby zakrzepowo-zatorowej
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne Etonogestrel
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Contraseton, (0,120 mg + 0,015 mg)/24 h, system terapeutyczny dopochwowy
Contraseton zawiera 11,0 mg etonogestrelu (Etonogestrelum) i 3,474 mg etynyloestradiolu (Ethinylestradiolum). System terapeutyczny dopochwowy uwalnia etonogestrel i etynyloestradiol w średniej ilości odpowiednio 0,120 mg i 0,015 mg w ciągu 24 godzin przez okres 3 tygodni.
Pełny wykaz substancji pomocniczych został podany w punkcie 6.1.
System terapeutyczny dopochwowy.
Contraseton jest elastycznym, przezroczystym, bezbarwnym lub prawie bezbarwnym pierścieniem o średnicy zewnętrznej 54 mm. Średnica systemu terapeutycznego dopochwowego w przekroju wynosi 4 mm.
Antykoncepcja
Contraseton jest przeznaczony dla kobiet w wieku rozrodczym. Bezpieczeństwo stosowania i skuteczność produktu leczniczego oceniono w grupie kobiet w wieku od 18 do 40 lat.
Decyzja o przepisaniu systemu terapeutycznego dopochwowego Contraseton powinna zostać podjęta na podstawie indywidualnej oceny czynników ryzyka u kobiety, zwłaszcza ryzyka rozwoju żylnej choroby zakrzepowo-zatorowej oraz ryzyka rozwoju żylnej choroby zakrzepowo-zatorowej związanego ze stosowaniem systemu terapeutycznego dopochwowego Contraseton, w odniesieniu do innych złożonych hormonalnych środków antykoncepcyjnych (patrz punkty 4.3 oraz 4.4).
Dawkowanie
Żeby działanie antykoncepcyjne było skuteczne, system terapeutyczny dopochwowy Contraseton musi być stosowany zgodnie z zaleceniami (patrz „Jak stosować system terapeutyczny dopochwowy Contraseton” i „Jak rozpocząć stosowanie systemu terapeutycznego dopochwowego Contraseton”).
Dzieci i młodzież
Nie badano bezpieczeństwa stosowania ani skuteczności systemu terapeutycznego dopochwowego Contraseton u młodzieży w wieku poniżej 18 lat.
Sposób podawania
JAK STOSOWAĆ SYSTEM TERAPEUTYCZNY DOPOCHWOWY CONTRASETON
Pacjentka umieszcza system terapeutyczny dopochwowy Contraseton w pochwie samodzielnie. Lekarz powinien poinstruować pacjentkę, w jaki sposób zakładać i usuwać system terapeutyczny dopochwowy Contraseton. W celu założenia systemu terapeutycznego dopochwowego pacjentka powinna przyjąć najwygodniejszą dla siebie pozycję, np. stojąc z jedną nogą uniesioną, siedząc w kucki lub leżąc. System terapeutyczny dopochwowy Contraseton należy ścisnąć i umieścić w pochwie tak, aby nie przeszkadzał. Umiejscowienie systemu terapeutycznego dopochwowego Contraseton w pochwie nie ma zasadniczego znaczenia dla jego działania antykoncepcyjnego (patrz Ryciny 1-4).
Po założeniu systemu terapeutycznego dopochwowego Contraseton (patrz punkt „Jak rozpocząć stosowanie systemu terapeutycznego dopochwowego Contraseton”), pozostaje on w pochwie nieprzerwanie przez 3 tygodnie. Zaleca się regularne sprawdzanie obecności systemu terapeutycznego dopochwowego w pochwie (na przykład przed i po stosunku). W razie przypadkowego wypadnięcia systemu terapeutycznego dopochwowego Contraseton należy postępować zgodnie z zaleceniami zawartymi w punkcie 4.2 „Postępowanie w razie wypadnięcia systemu terapeutycznego dopochwowego Contraseton” (więcej informacji: patrz również punkt 4.4 „Samoistne wypadnięcie”). System terapeutyczny dopochwowy Contraseton należy usunąć po 3 tygodniach stosowania, w tym samym dniu tygodnia, w którym był założony. Po przerwie w stosowaniu systemu terapeutycznego dopochwowego trwającej jeden tydzień, zakłada się nowy system terapeutyczny dopochwowy (np. jeśli system terapeutyczny dopochwowy Contraseton założono w środę około godz. 22, należy go usunąć również w środę, 3 tygodnie później, około godziny 22. W następną środę należy założyć nowy system terapeutyczny dopochwowy). System terapeutyczny dopochwowy Contraseton można usunąć, zaczepiając palcem wskazującym o brzeg systemu terapeutycznego dopochwowego lub chwytając system terapeutyczny dopochwowy palcem wskazującym i środkowym i pociągając go (Rycina 5). Zużyty system terapeutyczny dopochwowy należy włożyć do saszetki (przechowywać w miejscu niedostępnym dla dzieci i zwierząt) i zutylizować w sposób zgodny z zaleceniami podanymi w punkcie 6.6. Krwawienie z odstawienia występuje zwykle po upływie 2-3 dni po usunięciu systemu terapeutycznego dopochwowego Contraseton i może nie ustąpić całkowicie do czasu założenia nowego systemu terapeutycznego dopochwowego.
Stosowanie wraz z innymi metodami dopochwowej antykoncepcji mechanicznej przeznaczonej dla kobiet
System terapeutyczny dopochwowy Contraseton może utrudniać prawidłowe założenie i umieszczenie niektórych środków antykoncepcji mechanicznej dla kobiet, takich jak diafragma, kapturek naszyjkowy oraz prezerwatywa dla kobiet. Tych metod nie należy
stosować wraz z systemem terapeutycznym dopochwowym Contraseton jako dodatkowych metod antykoncepcji.
Jak założyć system terapeutyczny dopochwowy Contraseton
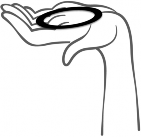
Rycina 1. Wyjąć system terapeutyczny dopochwowy Contraseton z saszetki
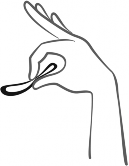
Rycina 2. Ścisnąć system terapeutyczny dopochwowy Contraseton
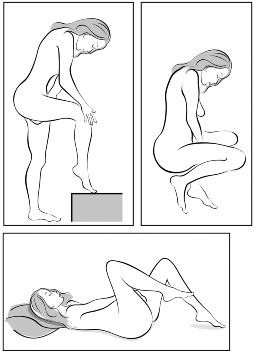
Rycina 3. Wybrać najwygodniejszą pozycję do założenia systemu terapeutycznego dopochwowego Contraseton
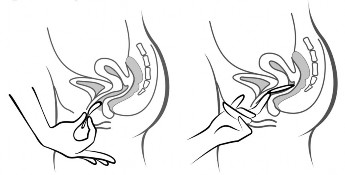
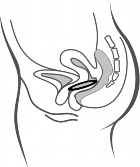
Rycina 4A Rycina 4B Rycina 4C
Włożyć system terapeutyczny dopochwowy Contraseton do pochwy jedną ręką (Rycina 4A), w razie potrzeby drugą ręką rozchylając wargi sromowe. Umieścić system terapeutyczny dopochwowy Contraseton wewnątrz pochwy tak, aby nie przeszkadzał (Rycina 4B). System terapeutyczny dopochwowy Contraseton pozostawia się w pochwie przez 3 tygodnie (Rycina 4C).
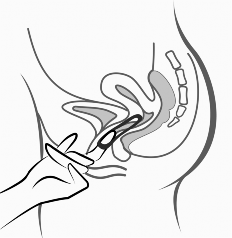
Rycina 5.
System terapeutyczny dopochwowy Contraseton można usunąć, zaczepiając palcem wskazującym o brzeg systemu terapeutycznego dopochwowego lub chwytając system terapeutyczny dopochwowy palcem wskazującym i środkowym i pociągając go.
JAK ROZPOCZĄĆ STOSOWANIE SYSTEMU TERAPEUTYCZNEGO DOPOCHWOWEGO CONTRASETON
W poprzednim cyklu nie stosowano hormonalnego środka antykoncepcyjnego
System terapeutyczny dopochwowy Contraseton należy założyć pierwszego dnia naturalnego cyklu (tj. pierwszego dnia miesiączki). Można również rozpocząć stosowanie systemu terapeutycznego dopochwowego Contraseton między 2. a 5. dniem cyklu, ale w takim wypadku w czasie pierwszego cyklu przez pierwsze 7 dni stosowania systemu terapeutycznego dopochwowego Contraseton zaleca się jednoczesne stosowanie mechanicznej metody antykoncepcji.
Dotychczas stosowano złożone hormonalne środki antykoncepcyjne
System terapeutyczny dopochwowy Contraseton należy założyć najpóźniej w dniu następującym po przerwie w stosowaniu tabletek lub systemu transdermalnego, stosowanego wcześniej złożonego hormonalnego środka antykoncepcyjnego, lub po okresie stosowania tabletek zawierających placebo.
Jeżeli pacjentka regularnie i prawidłowo stosowała poprzednią metodę antykoncepcji i jeżeli jest pewne, że nie jest w ciąży, może zmienić dotychczasową złożoną antykoncepcję hormonalną na system terapeutyczny dopochwowy Contraseton w dowolnym dniu cyklu.
Przerwa w stosowaniu dotychczasowego środka antykoncepcyjnego nigdy nie powinna przekraczać zaleconego czasu.
Dotychczas stosowano antykoncepcję zawierającą tylko progestagen (minitabletka, implant lub iniekcje) lub system terapeutyczny domaciczny uwalniający progestagen [IUS]
Stosowanie systemu terapeutycznego dopochwowego Contraseton zamiast minitabletki można rozpocząć w dowolnym dniu (w przypadku implantu i systemu - w dniu usunięcia implantu lub systemu, w przypadku iniekcji – w dniu następnego zaplanowanego wstrzyknięcia), ale we wszystkich tych przypadkach przez pierwsze 7 dni stosowania systemu terapeutycznego dopochwowego Contraseton należy dodatkowo stosować mechaniczne metody antykoncepcji.
Po poronieniu w pierwszym trymestrze ciąży
Stosowanie systemu terapeutycznego dopochwowego Contraseton można rozpocząć natychmiast. Nie ma potrzeby jednoczesnego stosowania dodatkowych metod antykoncepcji. Jeśli rozpoczęcie stosowania systemu terapeutycznego dopochwowego Contraseton
bezpośrednio po poronieniu wydaje się niewskazane, pacjentka powinna postępować według zaleceń podanych w punkcie: „W poprzednim cyklu nie stosowano hormonalnego środka antykoncepcyjnego”. W międzyczasie powinna stosować inną metodę antykoncepcji.
Po porodzie lub poronieniu w drugim trymestrze ciąży
Informacje dla kobiet karmiących piersią podano w punkcie 4.6.
Stosowanie systemu terapeutycznego dopochwowego Contraseton należy rozpocząć w czwartym tygodniu po porodzie lub po poronieniu w drugim trymestrze ciąży. W razie późniejszego rozpoczęcia stosowania systemu terapeutycznego dopochwowego Contraseton, należy zalecić jednoczesne stosowanie mechanicznej metody antykoncepcji przez pierwsze 7 dni stosowania systemu terapeutycznego dopochwowego Contraseton. Jeśli jednak w tym czasie miał miejsce stosunek, przed rozpoczęciem stosowania systemu terapeutycznego dopochwowego Contraseton należy wykluczyć ciążę lub pacjentka powinna poczekać do wystąpienia pierwszej miesiączki.
NIEWŁAŚCIWE STOSOWANIE SYSTEMU TERAPEUTYCZNEGO DOPOCHWOWEGO CONTRASETON
Stosowanie systemu terapeutycznego dopochwowego Contraseton w sposób inny niż opisany w zaleceniach może zmniejszyć jego skuteczność antykoncepcyjną i pogorszyć kontrolę cyklu.
Aby uniknąć utraty działania antykoncepcyjnego w wyniku niewłaściwego stosowania systemu terapeutycznego dopochwowego, należy przestrzegać poniższych zasad:
Złożonych hormonalnych środków antykoncepcyjnych nie należy stosować w następujących przypadkach. Jeżeli jakikolwiek z podanych objawów wystąpi po raz pierwszy w okresie stosowania systemu terapeutycznego dopochwowego Contraseton, należy jak najszybciej usunąć system terapeutyczny dopochwowy.
Występowanie lub ryzyko rozwoju żylnej choroby zakrzepowo-zatorowej (ang. venous thromboembolism, VTE)
o Żylna choroba zakrzepowo-zatorowa - czynna (leczona przeciwzakrzepowymi produktami leczniczymi) lub przebyta VTE, np. zakrzepica żył głębokich (ang. deep venous thrombosis, DVT), zatorowość płucna (ang. pulmonary embolism, PE)
o Znana dziedziczna lub nabyta predyspozycja do występowania żylnej choroby zakrzepowo-zatorowej np. oporność na aktywowane białko C (ang. activated protein C resistance, APC-R) (w tym czynnik V Leiden), niedobór antytrombiny III, niedobór białka C, niedobór białka S
o Rozległy zabieg operacyjny związany z długotrwałym unieruchomieniem (patrz punkt 4.4)
o Wysokie ryzyko rozwoju żylnej choroby zakrzepowo-zatorowej wskutek występowania wielu czynników ryzyka (patrz punkt 4.4)
Występowanie lub ryzyko rozwoju tętniczych zaburzeń zakrzepowo-zatorowych (ang.
arterial thromboembolism, ATE)
o Tętnicze zaburzenia zakrzepowo-zatorowe – czynne tętnicze zaburzenia zakrzepowo-zatorowe, tętnicze zaburzenia zakrzepowo-zatorowe w wywiadzie (np. zawał mięśnia sercowego) lub objawy prodromalne (np. dławica piersiowa)
o Choroby naczyń mózgowych - czynny udar, przebyty udar lub objawy prodromalne w wywiadzie (np. przemijający napad niedokrwienny, ang. transient ischemic attack, TIA)
o Stwierdzona dziedziczna lub nabyta skłonność do występowania tętniczych zaburzeń zakrzepowo-zatorowych np. hiperhomocysteinemia i obecność przeciwciał antyfosfolipidowych (przeciwciała antykardiolipinowe, antykoagulant toczniowy).
o Migrena z ogniskowymi objawami neurologicznymi w wywiadzie
o Wysokie ryzyko rozwoju zaburzeń zakrzepowo-zatorowych tętnic z powodu występowania wielu czynników ryzyka (patrz punkt 4.4) lub występowania jednego z poważnych czynników ryzyka, takich jak:
cukrzyca z powikłaniami naczyniowymi
ciężkie nadciśnienie tętnicze
ciężka dyslipoproteinemia
Zapalenie trzustki obecnie lub w przeszłości, jeśli współwystępuje z ciężką hipertriglicerydemią.
Ciężka choroba wątroby obecnie lub w przeszłości, tak długo jak parametry czynności wątroby nie powrócą do normy
Występowanie obecnie lub w przeszłości nowotworów wątroby (łagodnych lub złośliwych)
Obecność lub podejrzenie złośliwych nowotworów narządów płciowych lub piersi
zależnych od hormonów płciowych
Krwawienia z pochwy o nieznanej etiologii
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1
Jednoczesne stosowanie systemu terapeutycznego dopochwowego Contraseton z produkatami leczniczymi zawierającymi ombitaswir/parytaprewir/rytonawir i dazabuwir jest przeciwskazane (patrz punkty 4.4 oraz 4.5).
Ostrzeżenia
Jeżeli występuje którykolwiek z poniższych stanów lub czynniki ryzyka, należy omówić z pacjentką zasadność stosowania systemu terapeutycznego dopochwowego Contraseton.
W razie pogorszenia lub wystąpienia po raz pierwszy któregokolwiek z wymienionych stanów lub czynników ryzyka kobieta powinna zgłosić się do lekarza prowadzącego, który zadecyduje, czy konieczne jest przerwanie stosowania systemu terapeutycznego dopochwowego Contraseton.
lub tętniczych zaburzeń zakrzepowo-zatorowych należy przerwać stosowanie złożonych hormonalnych środków antykoncepcyjnych. Ze względu na teratogenne skutki leczenia przeciwzakrzepowego (leków przeciwzakrzepowych pochodnych kumaryny), należy rozpocząć stosowanie innej, skutecznej metody antykoncepcji.
INTERAKCJE Z INNYMI PRODUKTAMI LECZNICZYMI
Uwaga: W celu określenia potencjalnych interakcji, należy zapoznać się z informacjami dotyczącymi jednocześnie stosowanych produktów leczniczych.
Wpływ innych produktów leczniczych na system terapeutyczny dopochwowy Contraseton
Mogą występować interakcje z produktami leczniczymi lub produktami ziołowymi, które indukują enzymy mikrosomalne, co może skutkować zwiększeniem klirensu hormonów płciowych i może prowadzić do wystąpienia krwawienia śródcyklicznego i (lub) zmniejszenia skuteczności antykoncepcyjnej.
Postępowanie
Indukcja enzymów może być widoczna już po kilku dniach leczenia. Maksymalna indukcja enzymów jest na ogół widoczna w ciągu kilku tygodni. Po przerwaniu leczenia, indukcja enzymów może utrzymywać się przez około 4 tygodnie.
Krótkotrwałe leczenie
Kobiety podczas leczenia produktami leczniczymi lub preparatami ziołowymi indukującymi
enzymy wątrobowe, w trakcie stosowania systemu terapeutycznego dopochwowego Contraseton powinny czasowo stosować mechaniczne lub inne metody antykoncepcji. Uwaga: systemu terapeutycznego dopochwowego Contraseton nie należy stosować z diafragmą, kapturkiem naszyjkowym lub prezerwatywą dla kobiet. Antykoncepcja mechaniczna musi być stosowana przez cały okres jednoczesnego przyjmowania produktów leczniczych indukujących enzymy i przez 28 dni po ich odstawieniu. Jeśli jednocześnie stosowane produkty lecznicze indukujące aktywność enzymów przyjmowane są przez okres dłuższy niż 3 tygodnie stosowania systemu terapeutycznego dopochwowego, następny system terapeutyczny dopochwowy należy założyć natychmiast, bez przerwy w stosowaniu systemu terapeutycznego dopochwowego.
Długotrwałe leczenie
Kobietom długotrwale leczonym produktami leczniczymi indukującymi enzymy wątrobowe zaleca się stosowanie innej, skutecznej, niehormonalnej metody antykoncepcji.
W literaturze opisano następujące interakcje.
Substancje zwiększające klirens złożonych hormonalnych środków antykoncepcyjnych
Mogą występować interakcje z produktami leczniczymi lub produktami ziołowymi, które indukują aktywność enzymów cytochromu P450 (CYP), co może prowadzić do zwiększenia klirensu, powodującego zmniejszenie stężenia hormonów płciowych w osoczu i zmniejszenia skuteczności złożonych hormonalnych środków antykoncepcyjnych, w tym systemu terapeutycznego dopochwowego Contraseton. Do tych produktów należy fenytoina, fenobarbital, prymidon, bosentan, karbamazepina, ryfampicyna, a prawdopodobnie również okskarbazepina, topiramat, felbamat, gryzeofulwina, niektóre inhibitory proteazy HIV (np. rytonawir) i nienukleozydowe inhibitory odwrotnej transkryptazy (np. efawirenz) oraz produkty zawierające ziele dziurawca zwyczajnego (Hypericum perforatum).
Substancje wywierające różny wpływ na klirens złożonych hormonalnych środków antykoncepcyjnych Jednoczesne podawanie z hormonalnymi środkami antykoncepcyjnymi połączeń inhibitorów proteazy HIV (np. nelfinawir) i nienukleozydowych inhibitorów odwrotnej transkryptazy (np. newirapiny) i (lub) połączeń z produktami leczniczymi wirusa zapalenia wątroby typu C (HCV) (np. boceprewir, telaprewir), może zwiększać lub zmniejszać stężenia progestagenów, w tym etonogestrelu, lub estrogenów w osoczu. W niektórych przypadkach końcowy wpływ tych zmian może mieć znaczenie kliniczne.
Substancje zmniejszające klirens złożonych hormonalnych środków antykoncepcyjnych Kliniczne znaczenie potencjalnych interakcji z inhibitorami enzymów pozostaje nieznane. Jednoczesne podawanie silnych (np. ketokonazol, itrakonazol, klarytromycyna) lub umiarkowanych (np. flukonazol, diltiazem, erytromycyna) inhibitorów CYP3A4 może zwiększać stężenia estrogenów lub progestagenów, w tym etonogestrelu.
Zgłaszano przypadki uszkodzenia systemu terapeutycznego dopochwowego podczas jednoczesnego stosowania produktów dopochwowych, w tym przeciwgrzybiczych produktów leczniczych, antybiotyków oraz środków nawilżających (patrz punkt 4.4 „Uszkodzenie systemu terapeutycznego dopochwowego Contraseton”). Jak wynika z badań farmakokinetycznych, produkty lecznicze przeciwgrzybicze i środki plemnikobójcze stosowane dopochwowo nie powinny wpływać na skuteczność antykoncepcyjną i bezpieczeństwo stosowania systemu terapeutycznego dopochwowego Contraseton.
Hormonalne środki antykoncepcyjne mogą zaburzać metabolizm innych produktów leczniczych, zwiększając stężenie jednych (np. cyklosporyny), a zmniejszając innych (np. lamotryginy) w osoczu i tkankach.
Interakcje farmakodynamiczne
Jednoczesne stosowanie z produktami leczniczymi zawierającymi ombitaswir/parytaprewir/rytonawir i dazabuwir w monoterapii lub w skojarzeniu z rybawiryną może zwiększyć ryzyko zwiększonej aktywności aminotransferazy alaninowej (patrz punkty
4.3 i 4.4). Dlatego też pacjentki stosujące system terapeutyczny dopochwowy Contraseton muszą przestawić się na alternatywną metodę antykoncepcji (np. na środek antykoncepcyjny zawierający jedynie progestagen lub metody niehormonalne) przed rozpoczęciem takiej terapii skojarzonej. Pacjentka może ponownie rozpocząć stosowanie produktu leczniczego Contraseton 2 tygodnie po zakończeniu takiej terapii skojarzonej.
BADANIA LABORATORYJNE
Stosowanie hormonalnej terapii antykoncepcyjnej może wpływać na wyniki niektórych badań laboratoryjnych, w tym parametrów biochemicznych czynności wątroby, tarczycy, nadnerczy i nerek, stężenia białek nośnikowych w osoczu (np. globuliny wiążącej kortykosteroidy
i globuliny wiążącej hormony płciowe), poszczególnych frakcji lipidów i lipoprotein, parametrów metabolizmu węglowodanów, wskaźników układu krzepnięcia i fibrynolizy. Mimo tych odchyleń poszczególne parametry na ogół pozostają w granicach normy laboratoryjnej.
INTERAKCJE Z TAMPONAMI
Badania farmakokinetyczne wykazały, że stosowanie tamponów nie ma wpływu na wchłanianie hormonów uwalnianych z systemu terapeutycznego dopochwowego Contraseton. W rzadkich przypadkach system terapeutyczny dopochwowy Contraseton może wypaść w czasie usuwania tamponu (patrz punkt „Postępowanie w razie wypadnięcia systemu terapeutycznego dopochwowego Contraseton”).
Ciąża
Contraseton nie jest wskazany do stosowania w ciąży. Jeśli w czasie stosowania systemu terapeutycznego dopochwowego Contraseton pacjentka zajdzie w ciążę, powinna usunąć system terapeutyczny dopochwowy. Rozległe badania epidemiologiczne nie wykazały ani zwiększonego ryzyka rozwoju wad wrodzonych u dzieci, których matki przed zajściem w ciążę stosowały złożone hormonalne środki antykoncepcyjne, ani działania teratogennego tych produktów leczniczych stosowanych nieświadomie we wczesnej ciąży.
Badanie kliniczne prowadzone w małej grupie kobiet wykazało, że stężenie steroidów antykoncepcyjnych w jamie macicy u pacjentek stosujących Contraseton pomimo stosowania dopochwowego jest zbliżone do stężenia obserwowanego u pacjentek stosujących złożone doustne hormonalne środki antykoncepcyjne (patrz punkt 5.2). Jak dotąd nie ma danych na temat wyników zakończenia ciąż u pacjentek stosujących system terapeutyczny dopochwowy Contraseton.
Podejmując decyzję o ponownym rozpoczęciu stosowania systemu terapeutycznego dopochwowego Contraseton należy wziąć pod uwagę zwiększone ryzyko rozwoju żylnej choroby zakrzepowo-zatorowej u kobiet w okresie poporodowym (patrz punkty 4.2 i 4.4).
Karmienie piersią
Stosowanie estrogenów może wpływać na karmienie piersią, zmniejszając ilość pokarmu i zmieniając jego skład. Z tych względów system terapeutyczny dopochwowy Contraseton nie jest zalecany do czasu całkowitego zaprzestania karmienia piersią. Niewielka ilość steroidów antykoncepcyjnych i (lub) ich metabolitów może być wydzielana z mlekiem matki, jednak nie ma dowodów na to, aby mogło to mieć niekorzystny wpływ na zdrowie dziecka.
Płodność
System terapeutyczny dopochwowy Contraseton jest wskazany do stosowania w celu zapobiegania ciąży. Jeśli kobieta zechce zajść w ciążę i w związku z tym zaprzestać stosowania systemu terapeutycznego dopochwowego Contraseton, przed próbą zajścia w ciążę należy odczekać do wystąpienia naturalnego krwawienia miesiączkowego, ponieważ pomoże to ustalić termin porodu.
Na podstawie badań farmakodynamicznych stwierdzono, że system terapeutyczny dopochwowy Contraseton nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Do najczęstszych działań niepożądanych obserwowanych w badaniach klinicznych
z etonogestrelem i etynyloestradiolem należał ból głowy oraz zapalenie pochwy i upławy, zgłaszane przez 5-6% kobiet.
Opis wybranych działań niepożądanych
U kobiet stosujących złożone hormonalne środki antykoncepcyjne odnotowano zwiększone ryzyko wystąpienia żylnych i tętniczych incydentów zakrzepowych i zakrzepowo-zatorowych, w tym zawału serca, udaru, przemijającego napadu niedokrwiennego, zakrzepicy żylnej oraz zatorowości płucnej, które zostały szerzej omówione w punkcie 4.4.
Także inne działania niepożądane zgłaszane przez kobiety stosujące złożone hormonalne środki antykoncepcyjne zostały opisane szczegółowo w punkcie 4.4.
Działania niepożądane zgłoszone w badaniach klinicznych, badaniach obserwacyjnych lub w okresie po wprowadzeniu do obrotu systemu terapeutycznego dopochwowego
zawierającego etonogestrel i etynyloestradiol przedstawiono w poniższej tabeli. Do opisania poszczególnych działań niepożądanych użyto najbardziej odpowiednich terminów według MedDRA.
Wszystkie działania niepożądane zostały wymienione zgodnie z klasyfikacją układów i narządów oraz według częstości występowania; często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1000) oraz nieznana (częstość nie może być określona na podstawie dostępnych danych).
Klasyfikacja układów i narządów | Często | Niezbyt często | Rzadko | Nieznana1 |
Zakażenia i zarażenia pasożytnicze | zapalenie pochwy | zapalenie szyjki macicy, zapalenie pęcherza, zakażenie dróg moczowych | ||
Zaburzenia układu immunologicznego | nadwrażliwość | |||
Zaburzenia metabolizmu i odżywiania | zwiększenie apetytu | |||
Zaburzenia psychiczne | depresja, zmniejszenie popędu płciowego | zmieniony nastrój, chwiejność nastroju, nagłe zmiany nastroju | ||
Zaburzenia układu nerwowego | bóle głowy, migrena | zawroty głowy, niedoczulica |
Zaburzenia oka | zaburzenia widzenia | |||
Zaburzenia naczyniowe | uderzenia gorąca | żylna choroba zakrzepowo- zatorowa tętnicza zaburzenia zakrzepowo - zatorowe | ||
Zaburzenia żołądka i jelit | bóle brzucha, nudności | wzdęcia brzucha, biegunka, wymioty, zaparcia | ||
Zaburzenia skóry i tkanki podskórnej | trądzik | łysienie, egzema, świąd, wysypka | ostuda, pokrzywka | |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | ból pleców, skurcze mięśni, ból w kończynie | |||
Zaburzenia nerek i dróg moczowych | zaburzenia w oddawaniu moczu, parcie na mocz, częstomocz | |||
Zaburzenia układu rozrodczego i piersi | tkliwość piersi, świąd żeńskich narządów płciowych, bolesne miesiączkowanie, bóle w obrębie miednicy, upławy | brak miesiączki, bolesność piersi, powiększenie piersi, guzek w piersi, polip szyjki macicy, krwawienie w trakcie stosunku, dyspareunia, wywinięcie szyjki macicy, dysplazja włóknisto- torbielowata sutka, krwotoczne miesiączki, krwotok maciczny, dyskomfort w obrębie miednicy, zespół napięcia przedmiesiączkowego, skurcz macicy, uczucie palenia w pochwie, nieprzyjemny zapach z pochwy, ból w pochwie, dyskomfort sromu i pochwy, suchość sromu i pochwy | mlekotok | dolegliwości prącia |
Zaburzenia ogólne i stany w miejscu podania | uczucie zmęczenia, drażliwość, złe samopoczucie, obrzęk, uczucie obecności ciała obcego | Obrośnięcie systemu terapeutycznego dopochwowego przez tkankę pochwy. | ||
Badania diagnostyczne | zwiększenie masy ciała | zwiększenie ciśnienia krwi | ||
Urazy, zatrucia i powikłania po zabiegach | dyskomfort związany z użytkowaniem systemu terapeutycznego dopochwowego, wypadnięcie systemu terapeutycznego dopochwowego | powikłania związane ze stosowaniem systemu terapeutycznego dopochwowego, | uszkodzenie ściany pochwy związane z uszkodzeniem systemu terapeutycznego dopochwowego |
1) Lista działań niepożądanych oparta na zgłoszeniach spontanicznych.
Istnieją doniesienia na temat nowotworów zależnych od hormonów płciowych (np. nowotwory wątroby, piersi) u pacjentek przyjmujących złożone hormonalne środki antykoncepcyjne.
Więcej informacji patrz punkt 4.4.
Bardzo rzadko zgłaszano przypadki uszkodzenia systemu terapeutycznego dopochwowego Contraseton w czasie stosowania (patrz punkty 4.4 i 4.5).
Interakcje
Interakcje innych produktów leczniczych (induktorów enzymów) z hormonalnymi środkami antykoncepcyjnymi mogą prowadzić do wystąpienia krwawienia śródcyklicznego i (lub) nieskuteczności działania antykoncepcyjnego (patrz punkt 4.5)
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych,
Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, e-mail: ndl@urpl.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Jak dotąd nie ma doniesień o ciężkich szkodliwych działaniach związanych z przedawkowaniem hormonalnych środków antykoncepcyjnych. Objawy, jakie mogą wystąpić to: nudności, wymioty oraz niewielkie krwawienie z pochwy u młodych dziewcząt. Po przedawkowaniu nie stosuje się żadnego antidotum, w razie potrzeby należy stosować leczenie objawowe.
Grupa farmakoterapeutyczna: inne leki ginekologiczne, dopochwowe środki antykoncepcyjne, system terapeutyczny dopochwowy z progestagenem i estrogenem, kod ATC: G02BB01.
Mechanizm działania
System terapeutyczny dopochwowy Contraseton zawiera etonogestrel i etynyloestradiol. Etonogestrel jest progestagenem, pochodną 19-nortestosteronu i wykazuje wysokie powinowactwo do receptorów dla progesteronu w narządach docelowych. Etynyloestradiol jest estrogenem szeroko stosowanym w antykoncepcyjnych produktach leczniczych. Działanie antykoncepcyjne systemu terapeutycznego dopochwowego Contraseton zawierającego etonogestrel i etynyloestradiol opiera się na wielu mechanizmach, z których najważniejszy to hamowanie owulacji.
Skuteczność kliniczna i bezpieczeństwo stosowania
Badania kliniczne prowadzono wśród kobiet w wieku od 18 do 40 lat na całym świecie (USA, Europa i Brazylia). Skuteczność antykoncepcyjna była co najmniej porównywalna do skuteczności antykoncepcyjnej złożonych doustnych środków antykoncepcyjnych. Na podstawie badań klinicznych z użyciem systemu terapeutycznego dopochwowego Contraseton zawierającego etonogestrel i etynyloestradiol uzyskano przedstawione w poniższej tabeli współczynniki Pearla (liczba ciąż na 100 kobieto-lat stosowania).
Analiza Metoda | Współczynnik Pearla | 95% CI | Ilość cykli |
ITT (pacjentka + błąd metody) | 0,96 | 0,64 – 1,39 | 37 977 |
PP (błąd metody) | 0,64 | 0,35 – 1,07 | 28 723 |
W przypadku stosowania złożonych doustnych środków antykoncepcyjnych o większej dawce (0,05 mg etynyloestradiolu) ryzyko rozwoju raka endometrium i raka jajnika jest mniejsze.
Jak dotąd nie ustalono, czy odnosi się to również do środków antykoncepcyjnych o mniejszej dawce estrogenu, takich jak system terapeutyczny dopochwowy zawierający etonogestrel
i etynyloestradiol. PROFIL KRWAWIEŃ
Duże badanie porównawcze z zastosowaniem doustnego środka antykoncepcyjnego zawierającego lewonorgestrel + etynyloestradiol w dawkach odpowiednio 150/30 µg (n= 512 w porównaniu do n=518), oceniające profil krwawień w czasie 13 kolejnych cykli wykazało małą częstość występowania plamień i krwawień śródcyklicznych u kobiet stosujących system terapeutyczny dopochwowy zawierający etonogestrel i etynyloestradiol (2,0-6,4%). Ponadto u większości pacjentek krwawienia z dróg rodnych występowały jedynie w okresie przerwy w stosowaniu systemu terapeutycznego dopochwowego Contraseton (58,8-72,8%).
WPŁYW NA GĘSTOŚĆ MINERALNĄ KOŚCI
Wpływ stosowania systemu terapeutycznego dopochwowego zawierającego etonogestrel i etynyloestradiol (n=76) na gęstość mineralną kości (ang. bone mineral density, BMD) badano
w porównaniu z dopochwową wkładką antykoncepcyjną nie zawierającą hormonów (n=31) przez okres dwóch lat. Nie stwierdzono negatywnego wpływu na gęstość mineralną kości.
Dzieci i młodzież
Nie badano bezpieczeństwa stosowania ani skuteczności systemu terapeutycznego dopochwowego zawierającego etonogestrel i etynyloestradiol u młodzieży w wieku poniżej 18 lat.
Wchłanianie
Etonogestrel uwalniany z systemu terapeutycznego dopochwowego zawierający etonogestrel
i etynyloestradiol jest szybko wchłaniany przez błonę śluzową pochwy. Maksymalne stężenie w osoczu wynoszące około 1700 pg/ml etonogestrel osiąga po tygodniu od założenia systemu terapeutycznego dopochwowego. Stężenie w osoczu wykazuje nieznaczne wahania i powoli się zmniejsza do około 1600 pg/ml po upływie 1 tygodnia, 1500 pg/ml po upływie 2 tygodni i 1400 pg/ml po upływie 3 tygodni stosowania. Całkowita biodostępność wynosi niemal 100%, jest więc wyższa niż po podaniu doustnym.
U niewielkiej liczby kobiet stosujących system terapeutyczny dopochwowy zawierający etonogestrel i etynyloestradiol lub doustny środek antykoncepcyjny zawierający 0,150 mg dezogestrelu i 0,020 mg etynyloestradiolu zmierzono stężenie etonogestrelu w szyjce i jamie macicy. Obserwowane wartości były porównywalne.
Dystrybucja
Etonogestrel wiąże się z albuminami osocza i z globuliną wiążącą hormony płciowe (ang. sex hormone binding globulin, SHBG). Pozorna objętość dystrybucji etonogestrelu wynosi
2,3 l/kg mc.
Metabolizm
Etonogestrel podlega dobrze poznanym przemianom metabolicznym wspólnym dla związków steroidowych. Pozorny klirens osocza wynosi około 3,5 l/godz. Nie stwierdzono bezpośrednich interakcji z jednocześnie podawanym etynyloestradiolem.
Eliminacja
Stężenie etonogestrelu w osoczu zmniejsza się w dwóch fazach. W końcowej fazie eliminacji okres półtrwania wynosi około 29 godzin. Etonogestrel i jego metabolity są wydalane wraz
z moczem i żółcią w stosunku 1,7:1. Okres połowicznej eliminacji metabolitów wynosi około 6 dni.
Etynyloestradiol
Wchłanianie
Etynyloestradiol uwalniany z systemu terapeutycznego dopochwowego zawierającego etonogestrel i etynyloestradiol jest szybko wchłaniany przez błonę śluzową pochwy. Maksymalne stężenie w osoczu wynoszące około 35 pg/ml występuje po 3 dniach od założenia systemu terapeutycznego dopochwowego Contraseton i zmniejsza się do 19 pg/ml po upływie 1 tygodnia, 18 pg/ml po upływie 2 tygodni i 18 pg/ml po upływie 3 tygodni stosowania.
Ogólnoustrojowa miesięczna ekspozycja na etynyloestradiol (AUC0-ω) przy stosowaniu systemu terapeutycznego dopochwowego zawierającego etonogestrel i etynyloestradiol wynosi 10,9 ng/godz./ml. Całkowita biodostępność wynosi około 56%, co jest porównywalne z podaniem doustnym etynyloestradiolu. U niewielkiej liczby kobiet stosujących terapeutyczny dopochwowy system zawierający etonogestrel i etynyloestradiol lub doustny środek antykoncepcyjny zawierający 0,150 mg dezogestrelu i 0,020 mg etynyloestradiolu zmierzono stężenie etynyloestradiolu w szyjce i jamie macicy. Obserwowane wartości były porównywalne.
Dystrybucja
Etynyloestradiol wiąże się w znacznym stopniu, lecz niespecyficznie z albuminami osocza. Pozorna objętość dystrybucji wynosi około 15 l/kg mc.
Metabolizm
Etynyloestradiol jest metabolizowany głównie na drodze hydroksylacji aromatycznej, choć tworzy się również szereg innych pochodnych hydroksylowych i metylowych. Występują one jako wolne metabolity oraz w postaci sprzężonej z siarczanami i glukuronidami. Pozorny klirens wynosi około35 l/godz.
Eliminacja
Stężenie etynyloestradiolu w osoczu zmniejsza się w dwóch fazach. Końcowa faza eliminacji charakteryzuje się dużą zmiennością osobniczą wartości okresu półtrwania; średnio wynosi ona 34 godziny. Etynyloestradiol nie jest wydalany w postaci niezmienionej; jego metabolity są wydalane z moczem i żółcią w stosunku 1,3:1. Okres połowicznej eliminacji metabolitów wynosi około 1,5 doby.
Specjalne grupy pacjentów
Dzieci i młodzież
Nie badano farmakokinetyki systemu terapeutycznego dopochwowego zawierającego etonogestrel i etynyloestradiol u zdrowych dziewcząt w wieku poniżej 18 lat, po pierwszej miesiączce.
Pacjentki z zaburzeniami czynności nerek
Nie przeprowadzono badań oceniających wpływ choroby nerek na właściwości farmakokinetyczne systemu terapeutycznego dopochwowego zawierającego etonogestrel i etynyloestradiol.
Pacjentki z zaburzeniami czynności wątroby
Nie przeprowadzono badań oceniających wpływ choroby wątroby na właściwości farmakokinetyczne systemu terapeutycznego dopochwowego zawierającego etonogestrel i etynyloestradiol. Niemniej jednak u kobiet z zaburzeniami czynności wątroby hormony steroidowe mogą być słabo metabolizowane.
Grupy etniczne
Nie przeprowadzono badań oceniających właściwości farmakokinetyczne u pacjentek z różnych grup etnicznych.
Dane niekliniczne na temat etynyloestradiolu i etonogestrelu, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród nie ujawniają żadnego szczególnego zagrożenia dla człowieka, poza tym, które jest ogólnie znane.
Ocena ryzyka zagrożenia dla środowiska (ang. ERA, Environmental Risk Assessment)
Badania oceniające ryzyko zagrożenia dla środowiska wykazały, że 17α-etynyloestradiol
i etonogestrel mogą stanowić zagrożenie dla organizmów wód powierzchniowych (patrz punkt 6.6).
Etylenu i octanu winylu kopolimer (28% octanu winylu) Poliuretan
Nie dotyczy.
2 lata.
Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego Przechowywać w oryginalnym opakowaniu w celu w celu ochrony przed światłem.
Jedna saszetka zawiera jeden system terapeutyczny dopochwowy Contraseton.
Saszetka jest wykonana z folii PET/Aluminium/LDPE. Saszetka chroni zawartość przed światłem i wilgocią. Saszetki są umieszczane w tekturowym pudełku wraz z ulotką oraz naklejkami na kalendarz, pomagającymi zapamiętać kiedy należy wprowadzić i usunąć system terapeutyczny dopochwowy Contraseton.
Opakowanie zawiera 1, 3 lub 6 systemów.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Patrz punkt 4.2.
System terapeutyczny dopochwowy Contraseton należy założyć co najmniej jeden miesiąc przed upływem terminu ważności zamieszczonego na opakowaniu po EXP. Termin ważności oznacza ostatni dzień podanego miesiąca. Ten produkt leczniczy może stanowić zagrożenie dla środowiska. Po usunięciu systemu terapeutycznego dopochwowego Contraseton należy go umieścić w saszetce i dokładnie zamknąć. Zamkniętą saszetkę powinno się wyrzucić z innymi odpadkami domowymi lub odnieść z powrotem do apteki w celu właściwego zniszczenia zgodnie z lokalnymi przepisami. Nieużywane (przeterminowane) produkty lecznicze Contraseton należy usunąć zgodnie z lokalnymi przepisami. Nie należy wyrzucać systemu terapeutycznego dopochwowego Contraseton do toalety lub systemów usuwania ciekłych odpadów.
Mylan S.A.S.
117 Allée des Parcs 69800 Saint-Priest Francja
Pozwolenie nr: 24346
I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 2 listopad 2017
01/2019











