Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Leczenie inwazyjnej kandydozy u pacjentów dorosłych lub dzieci i młodzieży.
Leczenie inwazyjnej aspergilozy u pacjentów dorosłych lub dzieci i młodzieży, u których występuje oporność lub nietolerancja leczenia amfoterycyną B, preparatami lipidowymi amfoterycyny B i (lub) itrakonazolem. Brakiem odpowiedzi na terapię jest progresja zakażenia lub brak poprawy klinicznej po co najmniej 7 dniach właściwego leczenia przeciwgrzybiczego w dawkach terapeutycznych.
Leczenie empiryczne przy podejrzeniu zakażenia grzybiczego (takiego jak Candida lub
Dawkowanie i sposób podawania
Mosteller RD: Simplified Calculation of Body Surface Area. N Engl J Med 1987 Oct 22;317(17):1098 (letter)
stwierdzonym zakażeniem grzybiczym powinni być leczeni przez minimum 14 dni i leczenie należy kontynuować przez przynajmniej 7 dni po ustąpieniu zarówno neutropenii, jak i objawów klinicznych.
Czas trwania leczenia inwazyjnej kandydozy powinien opierać się na odpowiedzi klinicznej i mikrobiologicznej pacjenta. Po uzyskaniu poprawy w zakresie objawów podmiotowych i przedmiotowych w przebiegu inwazyjnej kandydozy oraz ujemnych wyników posiewów można rozważyć zmianę na doustne leczenie przeciwgrzybicze. Na ogół leczenie przeciwgrzybicze należy kontynuować przez co najmniej 14 dni po ostatnim dodatnim wyniku posiewu.
Czas trwania leczenia inwazyjnej aspergilozy należy ustalać indywidualnie w zależności od stopnia nasilenia choroby podstawowej pacjenta, szybkości ustępowania immunosupresji i odpowiedzi klinicznej. Na ogół leczenie należy kontynuować przez co najmniej 7 dni po ustąpieniu objawów.
Dane na temat bezpieczeństwa stosowania leku dłużej niż 4 tygodnie są ograniczone. Dostępne dane wskazują jednak, że kaspofungina stosowana przez dłuższy czas (do 162 dni u dorosłych oraz do 87 dni u dzieci i młodzieży) jest dobrze tolerowana.
Jednoczesne podawanie z induktorami enzymów metabolicznych
Ograniczone dane wskazują, że należy rozważyć zwiększenie dobowej dawki kaspofunginy do 70 mg, po podaniu dawki nasycającej 70 mg, podczas jednoczesnego podawania u dorosłych pacjentów kaspofunginy z niektórymi induktorami enzymów metabolizujących (patrz punkt 4.5). W przypadku stosowania u dzieci i młodzieży (w wieku od 12 miesięcy do 17 lat) kaspofunginy jednocześnie z tymi samymi induktorami enzymów metabolizujących (patrz punkt 4.5), należy rozważyć podawanie dawki 70 mg/m2 na dobę (nie przekraczać rzeczywistej dawki dobowej wynoszącej 70 mg).
Sposób podawania
Po rozpuszczeniu i rozcieńczeniu, roztwór powinien być podawany w powolnej infuzji dożylnej trwającej około 1 godziny. Wskazówki dotyczące sposobu rozpuszczenia i rozcieńczenia produktu leczniczego przed podaniem znajdują się w punkcie 6.6.
Produkt jest dostępny w fiolkach po 70 mg lub 50 mg. Kaspofunginę należy podawać we wlewie dożylnym raz na dobę.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Caspofungin Adamed, 70 mg, proszek do sporządzania koncentratu roztworu do infuzji
Każda fiolka zawiera 70 mg kaspofunginy (Caspofunginum) w postaci kaspofunginy octanu.
Po rozpuszczeniu w 10,5 ml wody do wstrzykiwań, 1 ml koncentratu zawiera 7,2 mg kaspofunginy.
Substancje pomocnicze:
Każda fiolka zawiera 0,018-0,053 mmol (0,425-1,219 mg) sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek do sporządzania koncentratu roztworu do infuzji. Biały lub prawie biały liofilizowany proszek.
Aspergillus) u pacjentów dorosłych lub dzieci i młodzieży z gorączką i neutropenią.
Leczenie z użyciem kaspofunginy powinien rozpocząć lekarz, który ma doświadczenie w postępowaniu w inwazyjnych zakażeniach grzybiczych.
Dawkowanie
Dorośli
Pierwszego dnia powinna być podana pojedyncza dawka nasycająca wynosząca 70 mg, a następnie stosuje się 50 mg na dobę. U pacjentów, których masa ciała wynosi więcej niż 80 kg, po dawce nasycającej wynoszącej 70 mg zalecane jest podawanie kaspofunginy w dawce 70 mg na dobę (patrz punkt 5.2). Nie jest konieczne dostosowywanie dawki w zależności od płci czy rasy (patrz punkt 5.2).
Dzieci i młodzież (od 12 miesięcy do 17 lat)
U dzieci i młodzieży (w wieku od 12 miesięcy do 17 lat) wielkość dawki należy wyliczyć na podstawie pola powierzchni ciała pacjenta (patrz Instrukcja stosowania u dzieci i młodzieży, wzór Mostellera1). We wszystkich wskazaniach do stosowania, 1 dnia powinna być podana pojedyncza dawka nasycająca wynosząca 70 mg/m2 (nie przekraczać rzeczywistej dawki wynoszącej 70 mg), a następnie 50 mg/m2 na dobę (nie przekraczać rzeczywistej dawki wynoszącej 70 mg na dobę). Jeżeli dawka wynosząca 50 mg/m2 na dobę jest dobrze tolerowana ale nie zapewnia odpowiedniej odpowiedzi klinicznej, dawka dobowa powinna zostać zwiększona do 70 mg/m2 na dobę (nie przekraczać rzeczywistej dawki dobowej wynoszącej 70 mg).
Bezpieczeństwo i skuteczność kaspofunginy nie zostały wystarczająco zbadane w badaniach klinicznych z udziałem noworodków i niemowląt w wieku poniżej 12 miesięcy. Zalecane jest zachowanie środków ostrożności podczas leczenia pacjentów z tej grupy wiekowej. Ograniczone dane wskazują, że może być brane pod uwagę podawanie kaspofunginy w dawce 25 mg/m2 na dobę noworodkom i niemowlętom (w wieku poniżej 3 miesięcy) oraz w dawce 50 mg/m2 małym dzieciom (w wieku od 3 do 11 miesięcy) (patrz punkt 5.2).
Specjalne grupy pacjentów
W podeszłym wieku
U pacjentów w podeszłym wieku (65 lat i powyżej) pole pod krzywą (AUC) jest zwiększone o około 30%. Nie jest jednak wymagane dostosowywanie dawki leku. Doświadczenie w leczeniu pacjentów w wieku 65 lat i powyżej jest ograniczone (patrz punkt 5.2).
Zaburzenia czynności nerek
Nie jest konieczne dostosowanie dawki w zależności od występujących zaburzeń czynności nerek (patrz punkt 5.2).
Zaburzenia czynności wątroby
U dorosłych pacjentów z łagodnymi zaburzeniami czynności wątroby (5 do 6 punktów w klasyfikacji Childa i Pugha) nie jest konieczne dostosowanie dawki. U dorosłych pacjentów z umiarkowanymi zaburzeniami czynności wątroby (7 do 9 punktów w klasyfikacji Childa i Pugha), na podstawie danych farmakokinetycznych, zalecane jest stosowanie kaspofunginy w dawce 35 mg na dobę. W pierwszej dobie leczenia należy podać wstępną dawkę nasycającą wynoszącą 70 mg. Nie ma doświadczenia klinicznego dotyczącego stosowania leku u pacjentów dorosłych z ciężkimi zaburzeniami czynności wątroby (więcej niż 9 punktów wg Childa i Pugha) oraz u dzieci i młodzieży z zaburzeniami czynności wątroby dowolnego stopnia (patrz punkt 4.4).
Czas trwania leczenia
Czas trwania leczenia empirycznego powinien opierać się na odpowiedzi klinicznej pacjenta. Leczenie należy kontynuować przez co najmniej 72 godziny po ustąpieniu neutropenii (ANC ≥500). Pacjenci ze
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
W trakcie podawania kaspofunginy odnotowano wystąpienie anafilaksji. W przypadku wystąpienia anafilaksji należy przerwać podawanie kaspofunginy i zastosować odpowiednie leczenie. Odnotowano działania niepożądane prawdopodobnie wywołane przez histaminę, takie jak wysypka, obrzęk twarzy, obrzęk naczynioruchowy, świąd, uczucie gorąca lub skurcz oskrzeli. W razie wystąpienia takich reakcji, może być konieczne przerwanie podawania kaspofunginy i (lub) zastosowanie odpowiedniego leczenia.
Ograniczone dane wskazują, że kaspofungina nie działa na mniej rozpowszechnione drożdżaki inne niż z rodzaju Candida oraz pleśnie inne niż z rodzaju Aspergillus. Skuteczność kaspofunginy przeciwko tym patogenom grzybiczym nie została określona.
Jednoczesne podawanie kaspofunginy i cyklosporyny oceniano u dorosłych zdrowych ochotników i u dorosłych pacjentów. U niektórych zdrowych ochotników, którzy otrzymali cyklosporynę w dwóch dawkach po 3 mg/kg razem z kaspofunginą wykazywano przejściowy wzrost aktywności aminotransferazy alaninowej (ALT) i aminotransferazy asparaginianowej (AST) mniejszy lub równy trzykrotności górnej granicy normy (GGN), który ustępował po przerwaniu leczenia. W badaniu retrospektywnym 40 pacjentów leczonych kaspofunginą po wprowadzeniu jej do obrotu i cyklosporyną przez 1–290 dni (mediana 17,5 dnia) nie odnotowano żadnych poważnych działań niepożądanych dotyczących wątroby. Te dane wskazują, że kaspofungina może być stosowana u pacjentów otrzymujących cyklosporynę, gdy potencjalne korzyści przewyższają potencjalne ryzyko. Podczas jednoczesnego stosowania kaspofunginy i cyklosporyny należy rozważyć ścisłe monitorowanie aktywności enzymów wątrobowych.
U dorosłych pacjentów z łagodnymi i umiarkowanymi zaburzeniami czynności wątroby stwierdzono zwiększenie AUC kaspofunginy odpowiednio o około 20% i 75%. Zalecane jest zmniejszenie dawki dobowej do 35 mg u dorosłych pacjentów z umiarkowanymi zaburzeniami czynności wątroby. Nie ma doświadczenia klinicznego u dorosłych z ciężkimi zaburzeniami czynności wątroby ani u dzieci i młodzieży z zaburzeniami czynności wątroby dowolnego stopnia. U pacjentów z ciężkimi zaburzeniami czynności wątroby można się spodziewać większej ekspozycji na lek niż przy umiarkowanym zaburzeniu czynności wątroby i dlatego należy zachować ostrożność stosując kaspofunginę w tej grupie chorych (patrz punkt 4.2 i 5.2).
U zdrowych ochotników oraz u pacjentów dorosłych, dzieci i młodzieży leczonych kaspofunginą obserwowano nieprawidłowości w wynikach laboratoryjnych badań czynności wątroby. U niektórych pacjentów dorosłych oraz u dzieci i młodzieży z ciężkimi chorobami podstawowymi, którzy otrzymywali wiele produktów leczniczych jednocześnie z kaspofunginą, zgłaszane były przypadki znaczących klinicznie zaburzeń czynności wątroby, zapalenia lub niewydolności wątroby. Nie określono związku przyczynowego ze stosowaniem kaspofunginy. Pacjentów z nieprawidłowymi wynikami prób czynnościowych wątroby odnotowanymi w trakcie leczenia kaspofunginą, należy monitorować czy nie występują u nich objawy pogorszenia czynności wątroby i ponownie ocenić stosunek ryzyka do korzyści dla dalszego leczenia kaspofunginą.
Po wprowadzeniu do obrotu kaspofunginy obserwowano przypadki zespołu Stevensa-Johnsona (ang. Stevens-Johnson Syndrome, SJS) oraz martwicy toksyczno-rozpływnej naskórka (ang. toxic epidermal necrolysis, TEN). Należy zachować ostrożność u pacjentów z alergiczną reakcją skórną w wywiadzie (patrz punkt 4.8).
Lek zawiera mniej niż 1 mmol (23 mg) sodu na fiolkę, to znaczy lek uznaje się za „wolny od sodu”.
W badaniach in vitro wykazano, że kaspofungina nie jest inhibitorem żadnego enzymu układu cytochromu P450 (CYP). W badaniach klinicznych kaspofungina nie indukowała metabolizmu innych substancji poprzez enzym CYP3A4. Kaspofungina nie jest substratem dla glikoproteiny P i wykazuje
słabe powinowactwo do enzymów cytochromu P450. W badaniach farmakologicznych i klinicznych wykazano jednak, że kaspofungina wchodzi w interakcje z innymi produktami leczniczymi (patrz poniżej).
W dwóch badaniach klinicznych przeprowadzonych u zdrowych dorosłych osób cyklosporyna A (w dawce 4 mg/kg mc. lub w dwóch dawkach po 3 mg/kg mc. w odstępie 12 godzin) zwiększała AUC kaspofunginy o około 35%. Ten wzrost AUC jest prawdopodobnie związany ze zmniejszonym wychwytem kaspofunginy przez wątrobę. Kaspofungina nie zwiększała stężenia cyklosporyny w osoczu. Podczas jednoczesnego podawania kaspofunginy i cyklosporyny obserwowano przejściowy wzrost aktywności ALT i AST w wątrobie mniejszy lub równy trzykrotności górnej granicy normy (GGN), który ustępował po przerwaniu podawania tych produktów leczniczych. Nie obserwowano poważnych zaburzeń czynności wątroby w retrospektywnym badaniu 40 pacjentów leczonych kaspofunginą po wprowadzeniu jej do obrotu i cyklosporyną przez okres 1 do 290 dni (mediana 17,5 dnia), (patrz punkt 4.4). Podczas jednoczesnego podawania tych dwóch produktów leczniczych należy rozważyć monitorowanie aktywności enzymów wątrobowych.
Kaspofungina zmniejszała minimalne stężenie takrolimusu o 26% u zdrowych dorosłych ochotników. U pacjentów przyjmujących oba leki konieczne jest standardowe monitorowanie stężeń takrolimusu we krwi oraz odpowiednie dostosowanie jego dawek.
W badaniach klinicznych z udziałem zdrowych dorosłych ochotników wykazano, że farmakokinetyka kaspofunginy nie zmieniała się w znaczący klinicznie sposób po zastosowaniu itrakonazolu, amfoterycyny B, mykofenolanu, nelfinawiru ani takrolimusu. Kaspofungina nie miała wpływu na farmakokinetykę amfoterycyny B, itrakonazolu, ryfampicyny ani mykofenolanu mofetylu. Chociaż dane dotyczące bezpieczeństwa są ograniczone, wydaje się, że nie są konieczne specjalne środki ostrożności podczas jednoczesnego stosowania kaspofunginy z amfoterycyną B, itrakonazolem, nelfinawirem czy mykofenolanem mofetylu.
Ryfampicyna powodowała zwiększenie AUC kaspofunginy o 60% oraz zwiększenie jej stężenia minimalnego o 170% u zdrowych dorosłych ochotników, w pierwszym dniu jednoczesnego podawania obu produktów leczniczych. Minimalne stężenia kaspofunginy stopniowo zmniejszały się po wielokrotnym podaniu. Po dwóch tygodniach podawania ryfampicyna wykazywała ograniczony wpływ na AUC kaspofunginy, której minimalne stężenia były jednak o 30% niższe niż u dorosłych pacjentów otrzymujących wyłącznie kaspofunginę. Mechanizm interakcji prawdopodobnie polega na początkowym hamowaniu, a następnie indukcji białek transportowych. Podobnego wpływu można spodziewać się podczas stosowania innych leków indukujących enzymy metabolizujące. Ograniczone dane z populacyjnych badań farmakokinetycznych wskazują, że jednoczesne podawanie kaspofunginy z takimi lekami jak efawirenz, newirapina, ryfampicyna, deksametazon, fenytoina lub karbamazepina może skutkować zmniejszeniem AUC kaspofunginy. Podczas jednoczesnego stosowania induktorów enzymów metabolizujących u dorosłych pacjentów po zastosowaniu 70 mg w dawce nasycającej należy rozważyć zwiększenie dobowej dawki kaspofunginy do 70 mg (patrz punkt 4.2).
Wszystkie opisane powyżej badania interakcji z innymi produktami leczniczymi u dorosłych pacjentów były przeprowadzone z użyciem dawek kaspofunginy wynoszących 50 lub 70 mg na dobę. Interakcje większych dawek kaspofunginy z innymi produktami leczniczymi nie zostały formalnie zbadane.
Wyniki analiz regresji danych farmakokinetycznych wskazują, że u dzieci i młodzieży jednoczesne podawanie deksametazonu z kaspofunginą może spowodować znaczące klinicznie zmniejszenie wartości minimalnego stężenia kaspofunginy. Może to oznaczać, że zastosowanie induktorów u
dzieci i młodzieży wiązać się będzie z podobnym jak u osób dorosłych zmniejszeniem stężeń. W przypadku stosowania kaspofunginy u dzieci i młodzieży (w wieku od 12 miesięcy do 17 lat) jednocześnie z induktorami klirensu substancji czynnych, takimi jak ryfampicyna, efawirenz, newirapina, fenytoina, deksametazon lub karbamazepina, należy rozważyć podawanie kaspofunginy w dawce wynoszącej 70 mg/m2 na dobę (nie przekraczać rzeczywistej dawki dobowej wynoszącej 70 mg).
Ciąża
Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania kaspofunginy u kobiet w ciąży. Kaspofunginy nie należy podawać kobietom w ciąży, chyba że jest to bezwzględnie konieczne.
Badania na zwierzętach wykazały toksyczny wpływ na rozwój potomstwa (patrz punkt 5.3). W badaniach na zwierzętach wykazano, że kaspofungina przenika przez barierę łożyskową.
Karmienie piersią
Nie wiadomo, czy kaspofungina przenika do mleka kobiecego. Na podstawie dostępnych danych farmakodynamicznych/toksykologicznych dotyczących zwierząt stwierdzono przenikanie kaspofunginy do mleka. Kobiety przyjmujące kaspofunginę nie powinny karmić piersią.
Płodność
W badaniach prowadzonych u samców i samic szczurów nie stwierdzono wpływu kaspofunginy na płodność (patrz punkt 5.3). Brak danych klinicznych umożliwiających ocenę wpływu kaspofunginy na płodność.
Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Zgłaszano reakcje nadwrażliwości (anafilaksja i działania niepożądane prawdopodobnie powodowane przez histaminę) (patrz punkt 4.4).
U pacjentów z inwazyjną postacią aspergilozy zgłaszano także występowanie obrzęku płuc, zespołu ostrej niewydolności oddechowej dorosłych (ARDS) oraz nacieków widocznych w badaniach radiologicznych.
Dorośli
W badaniach klinicznych 1865 osób dorosłych otrzymywało kaspofunginę w pojedynczej dawce lub w wielokrotnych dawkach: 564 pacjentów z gorączką i neutropenią (badania dotyczące leczenia empirycznego), 382 pacjentów z inwazyjną kandydozą, 228 pacjentów z inwazyjną aspergilozą, 297 pacjentów ze zlokalizowanymi zakażeniami wywołanymi przez Candida oraz 394 pacjentów włączonych do badań klinicznych fazy I. Pacjenci uczestniczący w badaniach dotyczących leczenia empirycznego otrzymywali chemioterapię w celu leczenia nowotworu złośliwego lub zostali poddani przeszczepowi komórek macierzystych układu krwiotwórczego (w tym 39 przeszczepom allogenicznym). W badaniach obejmujących pacjentów z potwierdzonym zakażeniem grzybami Candida, u większości pacjentów z inwazyjnym zakażeniem Candida występowały ciężkie choroby podstawowe (np. nowotwór hematologiczny lub inny nowotwór złośliwy, niedawno przebyty duży
zabieg chirurgiczny, HIV) wymagające jednoczesnego stosowania wielu produktów leczniczych. U pacjentów uczestniczących w nieporównawczym badaniu dotyczącym zakażenia grzybami Aspergillus często występowały poważne sytuacje medyczne, predysponujące do takiego zakażenia (np. przeszczepy szpiku kostnego lub przeszczepy obwodowych komórek macierzystych, nowotwór krwi, guzy lite lub przeszczepy narządu), wymagające jednoczesnego stosowania wielu produktów leczniczych.
We wszystkich grupach pacjentów często obserwowaną reakcją niepożądaną było zapalenie żyły w miejscu podania leku. Do innych reakcji miejscowych należały: rumień, ból lub wrażliwość na dotyk, świąd, wydzielina i uczucie pieczenia.
Zgłaszane zaburzenia kliniczne i laboratoryjne u wszystkich pacjentów leczonych kaspofunginą (łącznie 1780) były zazwyczaj łagodne i rzadko prowadziły do przerwania leczenia.
Tabelaryczne zestawienie działań niepożądanych
Podczas badań klinicznych i (lub) po wprowadzeniu produktu leczniczego z kaspofunginą do obrotu zgłaszano występowanie następujących działań niepożądanych:
Klasyfikacja układów i narządów | Często (≥ 1/100 do < 1/10) | Niezbyt często (≥ 1/1 000 do < 1/100) | Częstość nieznana (nie może być określona na podstawie dostępnych danych) |
Zaburzenia krwi i układu chłonnego | zmniejszenie stężenia hemoglobiny, zmniejszenie hematokrytu, zmniejszenie liczby białych krwinek | niedokrwistość, małopłytkowość, koagulopatia, leukopenia, zwiększenie liczby eozynofilów, zmniejszenie liczby płytek krwi, zwiększenie liczby płytek krwi, zmniejszenie liczby limfocytów, zwiększenie liczby białych krwinek, zmniejszenie liczby granulocytów obojętnochłonnych | |
Zaburzenia metabolizmu i odżywiania | hipokaliemia | przeciążenie płynami, hipomagnezemia, jadłowstręt, zaburzenie równowagi elektrolitowej, hiperglikemia, hipokalcemia, kwasica metaboliczna | |
Zaburzenia psychiczne | niepokój, dezorientacja, bezsenność | ||
Zaburzenia układu nerwowego | ból głowy | zawroty głowy, zaburzenie smaku, parestezje, senność, drżenie, niedoczulica | |
Zaburzenia oka | zażółcenie oczu, niewyraźne widzenie, obrzęk powiek, nadmierne łzawienie | ||
Zaburzenia serca | kołatanie serca, tachykardia, arytmia, migotanie przedsionków, zastoinowa niewydolność serca |
Zaburzenia naczyniowe | zapalenie żył | zakrzepowe zapalenie żył, zaczerwienienie twarzy, uderzenia gorąca, nadciśnienie tętnicze, niedociśnienie tętnicze | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | duszności | nieżyt nosa, ból gardła i krtani, szybkie oddychanie, skurcz oskrzeli, kaszel, nocna duszność napadowa, niedotlenienie narządów i tkanek, szmery oddechowe, świszczący oddech | |
Zaburzenia żołądka i jelit | nudności, biegunka, wymioty | ból brzucha, ból w górnej części brzucha, suchość w jamie ustnej, niestrawność, dyskomfort w żołądku, rozdęcie brzucha, puchlina brzuszna, zaparcie, utrudnienie połykania, wzdęcia | |
Zaburzenia wątroby i dróg żółciowych | zwiększenie aktywności enzymów wątrobowych (aminotransferazy alaninowej, aminotransferazy asparaginianowej, fosfatazy zasadowej we krwi, bilirubiny związanej, bilirubiny we krwi) | zastój żółci, powiększenie wątroby, hiperbilirubinemia, żółtaczka, zaburzenie czynności wątroby, toksyczne działanie na wątrobę, zaburzenie dotyczące wątroby, zwiększenie aktywności gamma glutamylotransferazy | |
Zaburzenia skóry i tkanki podskórnej | wysypka, świąd, rumień, nadmierne pocenie się | rumień wielopostaciowy, wysypka plamkowa, wysypka plamisto- grudkowa, wysypka świądowa, pokrzywka, alergiczne zapalenie skóry, świąd uogólniony, wysypka rumieniowata, wysypka uogólniona, wysypka odropodobna, zmiana skórna | Martwica toksyczno rozpływna naskórka i zespół Stevensa- Johnsona (patrz punkt 4.4) |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | ból stawów | ból pleców, ból kończyn, ból kości, osłabienie mięśni, ból mięśni | |
Zaburzenia nerek i dróg moczowych | niewydolność nerek, ostra niewydolność nerek |
Zaburzenia ogólne i stany w miejscu podania | gorączka, dreszcze, świąd w miejscu wlewu | ból, ból w miejscu cewnikowania, zmęczenie, uczucie zimna, uczucie gorąca, rumień w miejscu wlewu, stwardnienie w miejscu wlewu, ból w miejscu wlewu, obrzmienie w miejscu wlewu, zapalenie żył w miejscu wstrzyknięcia, obrzęk obwodowy, tkliwość, dyskomfort w klatce piersiowej, ból w klatce piersiowej, obrzęk twarzy, uczucie zmiany temperatury ciała, stwardnienie, wynaczynienie w miejscu wlewu, podrażnienie w miejscu wlewu, zapalenie żył w miejscu wlewu, wysypka w miejscu wlewu, pokrzywka w miejscu wlewu, rumień w miejscu wstrzyknięcia, obrzęk w miejscu wstrzyknięcia, ból w miejscu wstrzyknięcia, obrzmienie w miejscu wstrzyknięcia, złe samopoczucie, obrzęk | |
Badania diagnostyczne | zmniejszenie stężenia potasu we krwi, zmniejszenie stężenia albumin | zwiększenie stężenia kreatyniny we krwi, obecność krwinek czerwonych w moczu, zmniejszenie stężenia całkowitego białka, obecność białka w moczu, wydłużenie czasu protrombinowego, skrócenie czasu protrombinowego, zmniejszenie stężenia sodu we krwi, zwiększenie stężenia sodu we krwi, zmniejszenie stężenia wapnia we krwi, zwiększenie stężenia wapnia we krwi, zmniejszenie stężenia chlorków we krwi, zwiększenie stężenia glukozy we krwi, zmniejszenie stężenia magnezu we krwi, zmniejszenie stężenia fosforu we krwi, zwiększenie stężenia fosforu we krwi, zwiększenie stężenia mocznika we krwi, wydłużenie czasu częściowej tromboplastyny po aktywacji, zmniejszenie stężenia wodorowęglanów we krwi, zwiększenie stężenia chlorków we krwi, zwiększenie stężenia potasu we krwi, zwiększenie ciśnienia krwi, zmniejszenie stężenia kwasu moczowego we krwi, obecność krwi |
w moczu, nieprawidłowe odgłosy oddechowe, zmniejszenie stężenia dwutlenku węgla, zwiększenie stężenia immunosupresyjnych produktów leczniczych, zwiększenie Międzynarodowego Współczynnika Znormalizowanego, wałeczki moczowe, obecność białych krwinek w moczu oraz zwiększenie pH moczu. |
Kaspofungina była także oceniana w dawce 150 mg na dobę (przez maksymalnie 51 dni) u 100 dorosłych pacjentów (patrz punkt 5.1). W badaniu porównywano kaspofunginę w dawce 50 mg na dobę (po podaniu 1. dnia dawki nasycającej 70 mg) z dawką 150 mg na dobę w leczeniu inwazyjnej kandydozy. W tej grupie pacjentów bezpieczeństwo kaspofunginy przy większej dawce okazało się podobne do bezpieczeństwa u pacjentów otrzymujących kaspofunginę w dawce 50 mg na dobę.
Stosunek pacjentów z poważnymi działaniami niepożądanymi związanymi ze stosowaniem produktu leczniczego lub działaniami niepożądanymi związanymi ze stosowaniem produktu leczniczego prowadzącymi do przerwania stosowania kaspofunginy był porównywalny w obu badanych grupach.
Dzieci i młodzież
Dane z 5 badań klinicznych przeprowadzonych z udziałem 171 dzieci i młodzieży wskazują, że występowanie klinicznych zdarzeń niepożądanych u dzieci i młodzieży (26,3%; 95% CI od 19,9 do 33,6) nie jest odnotowywane częściej niż u dorosłych przyjmujących kaspofunginę (43,1%; 95% CI od 40,0 do 46,2). Prawdopodobnie jednak u dzieci i młodzieży profil działań niepożądanych jest inny niż u dorosłych. Najczęściej zgłaszanymi klinicznymi zdarzeniami niepożądanymi związanymi z przyjmowaniem kaspofunginy u dzieci i młodzieży były: gorączka (11,7%), wysypka (4,7%) oraz ból głowy (2,9%).
Tabelaryczne zestawienie działań niepożądanych
Zgłaszano występowanie następujących działań niepożądanych:
Klasyfikacja układów i narządów | Bardzo często (≥ 1/10) | Często (≥ 1/100 do < 1/10) |
Zaburzenia krwi i układu chłonnego | zwiększenie liczby eozynofilów | |
Zaburzenia układu nerwowego | bóle głowy | |
Zaburzenia serca | tachykardia | |
Zaburzenia naczyniowe | uderzenia gorąca, niedociśnienie tętnicze | |
Zaburzenia wątroby i dróg żółciowych | zwiększenie aktywności enzymów wątrobowych (AST, ALT) | |
Zaburzenia skóry i tkanki podskórnej | wysypka, świąd |
Zaburzenia ogólne i stany w miejscu podania | gorączka | dreszcze, ból w miejscu cewnikowania |
Badania diagnostyczne | zmniejszenie stężenia potasu, hipomagnezemia, zwiększenie stężenia glukozy, zmniejszenie stężenia fosforu lub zwiększenie stężenia fosforu. |
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem:
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu
Odnotowano niezamierzone podanie kaspofunginy w dawce dobowej do 400 mg. Przypadki te nie skutkowały klinicznie istotnymi działaniami niepożądanymi. Kaspofungina nie ulega dializie.
Grupa farmakoterapeutyczna: inne leki przeciwgrzybicze do stosowania ogólnego, kod ATC: J02AX04
Mechanizm działania
Octan kaspofunginy jest półsyntetycznym lipopeptydem (echinokandyna) syntetyzowanym z produktu fermentacji Glarea lozoyensis. Octan kaspofunginy hamuje syntezę beta-(1,3)-D-glukanu, istotnego składnika ściany komórkowej wielu grzybów strzępkowych i drożdżaków. Beta-(1,3)-D-glukan nie występuje w komórkach ssaków.
Wykazano działanie grzybobójcze kaspofunginy na drożdżaki z rodzaju Candida. Badania in vitro oraz in vivo wykazały, że ekspozycja grzybów z rodzaju Aspergillus na kaspofunginę prowadzi do rozpadu i śmierci części szczytowej grzybni i miejsc jej rozgałęziania, gdzie następuje wzrost komórek i ich podział.
Działanie farmakodynamiczne
Kaspofungina in vitro wykazuje działanie przeciw gatunkom z rodzaju Aspergillus (Aspergillus fumigatus [N = 75], Aspergillus flavus [N = 111], Aspergillus niger [N = 31], Aspergillus nidulans [N
= 8], Aspergillus terreus [N = 52] oraz Aspergillus candidus [N = 3]). Kaspofungina in vitro
wykazuje również działanie przeciw gatunkom z rodzaju Candida (Candida albicans [N = 1032], Candida dubliniensis [N = 100], Candida glabrata [N = 151], Candida guilliermondii [N = 67], Candida kefyr [N = 62], Candida krusei [N = 147], Candida lipolytica [N = 20], Candida lusitaniae [N = 80], Candida parapsilosis [N = 215], Candida rugosa [N = 1] oraz Candida tropicalis [N = 258]), w tym izolatom grzybów z wieloma mutacjami transportowymi (powodującymi oporność na wiele leków), a także izolatom grzybów z nabytą lub naturalną opornością na flukonazol, amfoterycynę B i na 5-flucytozynę. Przeprowadzono badanie wrażliwości zgodnie ze zmodyfikowanymi metodami Clinical and Laboratory Standards Institute (CLSI, znanym wcześniej jako National Committee for Clinical Laboratory Standards [NCCLS]) M38-A2 (dla gatunków z rodzaju Aspergillus) i M27-A3 (dla gatunków z rodzaju Candida).
Standaryzowane techniki badania wrażliwości drożdżaków zostały ustalone przez EUCAST. Wartości graniczne EUCAST nie zostały jeszcze ustalone dla kaspofunginy ze względu na znaczne różnice międzylaboratoryjne w zakresach MIC dla kaspofunginy. Zamiast wartości granicznych należy przyjąć, że izolaty Candida, które są wrażliwe zarówno na anidulafunginę, jak i na mykafunginę, będą wrażliwe na kaspofunginę. Podobnie można uznać, że izolaty C. parapsilosis wykazujące pośrednią wrażliwość na anidulafunginę i mykafunginę są pośrednio wrażliwe na kaspofunginę.
Mechanizm powstawania oporności
U niewielkiej liczby pacjentów zidentyfikowano w trakcie leczenia izolaty drożdżaków z rodzaju Candida o zmniejszonej wrażliwości na kaspofunginę (zgłaszano wartości MIC kaspofunginy > 2 mg/l (zwiększenie wartości MIC czterokrotne do trzydziestokrotnego) przy zastosowaniu standaryzowanej techniki oznaczania wartości MIC, zatwierdzonej przez CLSI). Zidentyfikowany mechanizm powstawania oporności to mutacje w genach FKS1 i (lub) FKS2 (dla C. glabrata).
Przypadki te wiązały się ze złymi wynikami klinicznymi.
Stwierdzono powstawanie oporności na kaspofunginę u gatunków z rodzaju Aspergillus w warunkach in vitro. Podczas ograniczonego stosowania klinicznego obserwowano powstawanie oporności na kaspofunginę u pacjentów z inwazyjną aspergilozą. Nie ustalono mechanizmu powstawania oporności. Przypadki oporności na kaspofunginę różnych klinicznych izolatów Aspergillus występują rzadko.
Zaobserwowano oporność na kaspofunginę w przypadku Candida, ale częstość występowania może różnić się w zależności od gatunku lub obszaru.
Skuteczność kliniczna i bezpieczeństwo stosowania
Inwazyjna kandydoza u dorosłych pacjentów: Do badania początkowego porównującego kaspofunginę i amfoterycynę B w leczeniu inwazyjnej kandydozy włączono dwustu trzydziestu dziewięciu pacjentów. U dwudziestu czterech pacjentów występowała neutropenia. Najczęściej rozpoznane były: zakażenie krwi (kandydemia) (77%, N = 186) i Candida peritonitis (8%, N = 19); z badania wykluczono pacjentów z wywołanym przez Candida zapaleniem wsierdzia, zapaleniem szpiku kostnego lub zapaleniem opon mózgowo-rdzeniowych. Kaspofunginę stosowano w dawce 50 mg raz na dobę, po podaniu dawki nasycającej 70 mg, podczas gdy amfoterycyna B stosowana była w dawce od 0,6 mg/kg mc. do 0,7 mg/kg mc. na dobę u pacjentów bez neutropenii lub w dawce od 0,7 mg/kg mc. do 1,0 mg/kg mc. na dobę u pacjentów z neutropenią. Średni czas trwania terapii dożylnej wynosił 11,9 dni, w zakresie od 1 do 28 dni. Odpowiedź uznawano za korzystną w razie jednoczesnego ustąpienia objawów i wyeliminowania zakażenia Candida w badaniach mikrobiologicznych. W podstawowej analizie skuteczności (analiza MITT) po zakończeniu leczenia dożylnego uwzględniono 224 pacjentów; wskaźniki korzystnej odpowiedzi na leczenie inwazyjnej kandydozy były porównywalne dla kaspofunginy (73% [80/109]) i amfoterycyny B (62% [71/115]) (% różnicy 12,7 [95,6% CI, od -0,7 do 26,0]). Wśród pacjentów z kandydemią, wskaźniki korzystnej odpowiedzi po
zakończeniu leczenia dożylnego były porównywalne dla kaspofunginy (72% [66/92]) i amfoterycyny B (63% [59/94]) w podstawowej analizie skuteczności (analiza MITT) (% różnicy 10,0 [95% CI od - 4,5 do 24,5]). Dane dotyczące pacjentów z innymi zakażeniami niż zakażenie krwi były bardziej ograniczone. Wskaźniki korzystnej odpowiedzi na leczenie u pacjentów z neutropenią wynosiły: 7/14 (50%) w grupie pacjentów otrzymujących kaspofunginę oraz 4/10 (40%) w grupie pacjentów otrzymujących amfoterycynę B. Te ograniczone dane zostały poparte wynikami badań dotyczących leczenia empirycznego.
W drugim badaniu pacjenci z inwazyjną kandydozą otrzymali kaspofunginę w dawce 50 mg/dobę (po podaniu nasycającej dawki 70 mg w dniu 1) lub kaspofunginę w dawce 150 mg/dobę (patrz punkt 4.8). W tym badaniu dawka kaspofunginy była podawana w ciągu 2 godzin (zamiast rutynowo stosowanego wlewu 1-godzinnego). Z udziału w badaniu wykluczono pacjentów z podejrzeniem wywołanego przez Candida zapalenia wsierdzia, zapalenia opon mózgowo-rdzeniowych lub zapalenia szpiku kostnego. Ponieważ było to badanie dotyczące oceny leczenia pierwszego rzutu, wykluczono również pacjentów opornych na wcześniej stosowane leki przeciwgrzybicze. Liczba włączonych do badania pacjentów z neutropenią była także ograniczona (8%). Drugorzędowym punktem końcowym badania była ocena skuteczności leczenia. Pacjenci, którzy spełnili kryteria włączenia do badania i otrzymali jedną lub dwie dawki kaspofunginy, zostali włączeni do analizy skuteczności. Na koniec okresu leczenia kaspofunginą stwierdzono ogólnie korzystne wyniki odpowiedzi, które były podobne w 2 grupach leczenia: 72% (73/102) i 78% (74/95), odpowiednio dla grupy leczonej kaspofunginą w dawce 50 mg i dla grupy stosującej lek w dawce 150 mg (różnica 6,3% [95% CI -5,9, 18,4]).
Inwazyjna aspergiloza u dorosłych pacjentów: Sześćdziesięciu dziewięciu dorosłych pacjentów (w wieku 18–80 lat) z inwazyjną aspergilozą włączono do otwartego nieporównawczego badania mającego na celu ocenę bezpieczeństwa, tolerancji i skuteczności kaspofunginy. Warunkiem udziału w badaniu była oporność (postęp choroby bądź brak poprawy przy zastosowaniu innych terapii przeciwgrzybiczych przez co najmniej 7 dni) (84% zakwalifikowanych pacjentów) lub brak tolerancji (16% zakwalifikowanych pacjentów) na inne standardowe terapie przeciwgrzybicze. U większości pacjentów występowały choroby podstawowe (nowotwory złośliwe układu krwiotwórczego [N = 24], stan po przeszczepie allogenicznym szpiku kostnego lub po przeszczepie komórek macierzystych [N = 18], po przeszczepie narządu [N = 8], lity guz [N = 3] lub inne stany [N
= 10]). Do rozpoznania inwazyjnej aspergilozy oraz określenia odpowiedzi na leczenie (odpowiedź klasyfikowano jako korzystną w przypadku znamiennej klinicznie poprawy w badaniu radiologicznym oraz ustępowania objawów podmiotowych i przedmiotowych) zastosowano ścisłe kryteria opracowane według Mycoses Study Group Criteria. Średni czas trwania terapii wyniósł 33,7 dnia, w zakresie od 1 do 162 dni.
Niezależny zespół ekspertów ocenił, że u 41% (26/63) pacjentów, którzy otrzymali co najmniej jedną dawkę kaspofunginy, wystąpiła odpowiedź pozytywna. W grupie pacjentów, którzy przyjmowali kaspofunginę przez ponad 7 dni korzystną odpowiedź na leczenie stwierdzono w 50% przypadków (26/52). Wskaźnik pozytywnych odpowiedzi u pacjentów wykazujących oporność lub nietolerancję na wcześniejsze terapie wyniósł odpowiednio 36% (19/53) i 70% (7/10). U 5 pacjentów włączonych do badania w związku z opornością na stosowane dotychczasowe leczenie przeciwgrzybicze, dawki stosowanych pierwotnie leków przeciwgrzybiczych były niższe od dawek zazwyczaj stosowanych w leczeniu inwazyjnej aspergilozy. Pomimo to, wskaźnik korzystnej odpowiedzi podczas leczenia kaspofunginą był zbliżony do wskaźników obserwowanych u pozostałych pacjentów opornych na leczenie (odpowiednio 2/5 vs. 17/48). U pacjentów z chorobą płucną i pozapłucną wskaźniki odpowiedzi wyniosły odpowiednio 47% (21/45) i 28% (5/18). Korzystną odpowiedź na leczenie uzyskano u 2 z 8 pacjentów z infekcją pozapłucną, u których występowała również potwierdzona, prawdopodobna lub przypuszczalna infekcja ośrodkowego układu nerwowego.
Leczenie empiryczne u dorosłych pacjentów z gorączką i neutropenią: Do badania klinicznego zakwalifikowano łącznie 1111 pacjentów z utrzymującą się gorączką i neutropenią, którym raz na dobę podawano albo 50 mg kaspofunginy, poprzedzone dawką nasycającą 70 mg, albo liposomalną amfoterycynę B w dawce 3,0 mg/kg/dzień. Pacjenci spełniający kryteria kwalifikacyjne zostali poddani chemioterapii w celu leczenia nowotworu lub przeszczepu komórek macierzystych hematopoezy oraz zgłosili się z neutropenią (<500 komórek/mm3 przez 96 godzin) i gorączką (>38,0°C) bez odpowiedzi na pozajelitową terapię przeciwbakteryjną trwającą ≥96 godzin.
Zaplanowano leczenie pacjentów maksymalnie do chwili upływu 72 godzin od ustąpienia neutropenii, ale nie dłużej niż przez 28 dni. Natomiast pacjenci, u których stwierdzono udokumentowane zakażenie grzybicze, mogli być leczeni dłużej. Jeśli produkt leczniczy był dobrze tolerowany, ale gorączka u pacjenta nie ustępowała a stan kliniczny pogarszał się po 5 dniach leczenia, dawka badanego produktu leczniczego mogła zostać zwiększona do 70 mg kaspofunginy /dobę (13,3% leczonych pacjentów) lub do 5,0 mg liposomalnej amfoterycyny B /kg/dobę (14,3% leczonych pacjentów). Zmodyfikowaną analizą skuteczności zgodną z intencją leczenia (MITT) pod względem ogólnej pozytywnej odpowiedzi objęto 1095 pacjentów. Skuteczność kaspofunginy (33,9%) była taka sama jak liposomalnej amfoterycyny B (33,7%) [różnica odsetka 0,2 (95,2% CI, od -5,6 do 6,0)]. Uznanie wystąpienia ogólnie pozytywnej odpowiedzi wymagało spełnienia wszystkich 5 kryteriów: (1) zakończone powodzeniem leczenie dowolnego zakażenia grzybiczego stwierdzonego podczas wizyty wyjściowej, (kaspofungina 51,9% [14/27], liposomalna amfoterycyna B 25,9% [7/27]), (2) brak przełomowych zakażeń grzybiczych w czasie podawania badanego produktu leczniczego lub w ciągu 7 dni po zakończeniu leczenia (kaspofungina 94,8% [527/556], liposomalna amfoterycyna B 95,5% [515/539]), (3) przeżycie przez 7 dni po zakończeniu leczenia objętego badaniem (kaspofungina 92,6% [515/556], liposomalna amfoterycyna B 89,2% [481/539]), (4) brak przerwania leczenia badanym produktem leczniczym z powodu jego toksyczności lub braku skuteczności (kaspofungina 89,7% [499/556], liposomalna amfoterycyna B 85,5% [461/539]) i (5) ustąpienie gorączki w czasie trwania neutropenii (kaspofungina 41,2% [229/556], liposomalna amfoterycyna B 41,4% [223/539]). Wskaźniki odpowiedzi na kaspofunginę i liposomalną amfoterycynę B w odniesieniu do zakażeń występujących w momencie włączania do badania, wywołanych przez grzyby z rodzaju Aspergillus wyniosły odpowiednio 41,7% (5/12) i 8,3% (1/12), natomiast wywołanych przez grzyby z rodzaju Candida — 66,7% (8/12) i 41,7% (5/12). U pacjentów należący do grupy przyjmującej kaspofunginę wystąpiły zakażenia przełomowe wywołane przez następujące, rzadko spotykane drożdżaki i pleśnie: Trichosporon species (1), Fusarium species (1), Mucor species (1), Rhizopus species (1)..
Dzieci i młodzież
Bezpieczeństwo i skuteczność stosowania kaspofunginy oceniano u dzieci i młodzieży w wieku od 3 miesięcy do 17 lat w dwóch wieloośrodkowych badaniach prospektywnych. Projekt badania, kryteria diagnostyczne oraz kryteria oceny skuteczności były podobne jak w odpowiednich badaniach prowadzonych z udziałem pacjentów dorosłych (patrz punkt 5.1).
Pierwsze badanie, do którego włączono 82 pacjentów w wieku od 2 do 17 lat, było randomizowanym badaniem z podwójnie ślepą próbą, polegającym na porównaniu kaspofunginy (50 mg/m2, podawana dożylnie raz na dobę po podaniu 1. dnia dawki nasycającej 70 mg/m2 [nie przekraczać 70 mg na dobę]) z liposomalną amfoterycyną B (3 mg/kg, podawana dożylnie raz na dobę) w układzie leczenia 2:1 (56 pacjentów przyjmowało kaspofunginę, a 26 liposomalną amfoterycynę B) w leczeniu empirycznym u dzieci i młodzieży z utrzymującą się gorączką i neutropenią. Ogólne wskaźniki powodzenia określone na podstawie analizy MITT, z uwzględnieniem warstw ryzyka, były następujące: 46,6% (26/56) w przypadku kaspofunginy i 32,2% (8/25) w przypadku liposomalnej amfoterycyny B.
Drugie badanie było prospektywnym otwartym badaniem nieporównawczym mającym na celu ocenę bezpieczeństwa i skuteczności stosowania kaspofunginy u dzieci i młodzieży (w wieku od 6 miesięcy do 17 lat) z inwazyjną kandydozą, kandydozą przełyku i inwazyjną aspergilozą (jako terapia ratunkowa). Do badania włączono czterdziestu dziewięciu pacjentów, którzy otrzymywali kaspofunginę w dawce 50 mg/m2 w infuzji dożylnej raz na dobę po podaniu 1. dnia dawki nasycającej 70 mg/m2 (nie przekraczać 70 mg na dobę), z których 48 ujęto w analizie MITT. U 37 spośród tych osób występowała inwazyjna kandydoza, u 10 inwazyjna aspergiloza, a u 1 osoby kandydoza przełyku. Wskaźnik korzystnych odpowiedzi (według objawów) wyniósł na koniec okresu leczenia kaspofunginą na podstawie analizy MITT: 81% (30/37) w przypadku inwazyjnej kandydozy, 50% (5/10) w przypadku inwazyjnej aspergilozy i 100% (1/1) w przypadku kandydozy przełyku.
W podwójnie zaślepionym, randomizowanym (2:1), kontrolowanym lekiem porównawczym badaniu oceniano bezpieczeństwo stosowania, tolerancję i skuteczność kaspofunginy (2 mg/kg mc. na dobę w 2-godzinnym wlewie dożylnym) w porównaniu z deoksycholanem amfoterycyny B (1 mg/kg mc. na dobę) u noworodków i niemowląt w wieku poniżej 3 miesięcy z inwazyjną kandydozą (potwierdzoną posiewem). Ze względu na niedostateczny nabór pacjentów do badania, zostało ono zakończone przedterminowo, a randomizacji poddano zaledwie 51 pacjentów. Odsetek pacjentów z przeżyciem wolnym od grzybicy (ang. fungal-free survival, FFS) po upływie 2 tygodni od leczenia w grupie przyjmującej kaspofunginę (71,0%) był zbliżony do obserwowanego w grupie otrzymującej deoksycholan amfoterycyny B (68,8%). Ustalenie zaleceń dotyczących dawkowania u noworodków i niemowląt na podstawie tego badania jest niemożliwe.
Dystrybucja
Kaspofungina w znacznym stopniu wiąże się z albuminami. Frakcja niezwiązana kaspofunginy w osoczu wynosi od 3,5% u zdrowych ochotników do 7,6% u pacjentów z inwazyjną kandydozą.
Dystrybucja odgrywa istotną rolę w farmakokinetyce kaspofunginy w osoczu i decyduje o przebiegu fazy alfa i beta. Najwyższe wartości dystrybucja osiąga po 1,5 do 2 dni od podania, gdy 92% dawki dociera do tkanek. Prawdopodobnie tylko niewielka frakcja kaspofunginy, która dotarła do tkanek, wraca później do osocza jako związek macierzysty. Dlatego eliminacja następuje przy braku równowagi dystrybucji, a oszacowanie faktycznej objętości dystrybucji kaspofunginy jest aktualnie niemożliwe.
Metabolizm
Kaspofungina ulega samoistnemu rozpadowi do związku z otwartym pierścieniem. Dalszy metabolizm obejmuje hydrolizę peptydu oraz N-acetylację. Dwa pośrednie produkty, utworzone podczas rozpadu kaspofunginy do takiego związku z otwartym pierścieniem, tworzą kowalencyjne addukty z białkami osocza. W wyniku tego powstaje niewielka ilość nieodwracalnych połączeń z białkami osocza.
W badaniach in vitro wykazano, że kaspofungina nie jest inhibitorem enzymów 1A2, 2A6, 2C9, 2C19, 2D6 ani 3A4 cytochromu P450 (CYP). W badaniach klinicznych kaspofungina nie indukowała ani nie hamowała metabolizmu innych produktów leczniczych poprzez enzym CYP3A4. Kaspofungina nie jest substratem dla glikoproteiny P i wykazuje słabe powinowactwo do enzymów cytochromu P450.
Eliminacja
Eliminacja kaspofunginy z osocza przebiega wolno przy klirensie na poziomie 10–12 ml/min. Stężenie kaspofunginy w osoczu spada w sposób wielofazowy po jednorazowej, 1-godzinnej infuzji
dożylnej. Bezpośrednio po infuzji występuje krótka faza alfa poprzedzająca fazę beta z okresem półtrwania na poziomie od 9 do 11 godzin. Pojawia się również dodatkowa faza gamma z okresem półtrwania na poziomie 45 godzin. Decydującym mechanizmem wpływającym na klirens osoczowy leku jest dystrybucja, a nie wydalanie lub biotransformacja.
Około 75% podanej dawki radioaktywnej odzyskiwano w ciągu 27 dni: 41% w moczu i 34% w kale. W pierwszych 30 godzinach po podaniu wydalanie lub biotransformacja kaspofunginy są nieznaczne. Wydalanie jest powolne, a okres półtrwania radioaktywności w końcowej fazie eliminacji wynosił od 12 do 15 dni. Niewielka ilość kaspofunginy jest wydalana w moczu w postaci niezmienionej (około 1,4% dawki).
Farmakokinetyka kaspofunginy jest umiarkowanie nieliniowa. Kumulacja leku zwiększa się w miarę zwiększania dawki. Czas osiągnięcia stanu równowagi po podaniu wielokrotnym zależy od dawki.
Specjalne grupy pacjentów
U dorosłych pacjentów z zaburzeniem czynności nerek i łagodnym zaburzeniem czynności wątroby, u kobiet oraz u osób starszych odnotowano wzrost ekspozycji na kaspofunginę. Na ogół wzrost ten był niewielki i jego wartość nie powodowała konieczności dostosowania dawki. U dorosłych pacjentów z umiarkowanym zaburzeniem czynności wątroby oraz pacjentów o większej masie ciała może być konieczne dostosowanie dawki (patrz niżej).
Masa ciała:
Analiza farmakokinetyczna przeprowadzona u dorosłych pacjentów z kandydozą wykazała wpływ masy ciała na farmakokinetykę kaspofunginy. Stężenie w osoczu spada wraz ze wzrostem masy ciała. U dorosłych pacjentów o masie ciała wynoszącej 80 kg przewidywany średni poziom ekspozycji był o około 23% niższy niż u dorosłych pacjentów o masie ciała wynoszącej 60 kg (patrz punkt 4.2).
Zaburzenia czynności wątroby:
U dorosłych pacjentów z łagodnym i umiarkowanym zaburzeniem czynności wątroby AUC jest zwiększone odpowiednio o około 20 i 75%. Nie ma doświadczenia klinicznego u dorosłych pacjentów z ciężkimi zaburzeniami czynności wątroby ani u dzieci i młodzieży z zaburzeniami czynności wątroby dowolnego stopnia. W badaniu obejmującym podanie kilku dawek wykazano, że po obniżeniu dawki dobowej do 35 mg u dorosłych pacjentów z umiarkowanym zaburzeniem czynności wątroby AUC miało podobną wielkość co u dorosłych pacjentów z prawidłową czynnością wątroby, u których stosowano standardowy schemat leczenia (patrz punkt 4.2).
Zaburzenia czynności nerek:
W badaniu klinicznym obejmującym podanie pojedynczych dawek 70 mg farmakokinetyka kaspofunginy była podobna u dorosłych ochotników z łagodnym zaburzeniem czynności nerek (klirens kreatyniny od 50 do 80 ml/min) oraz u osób z grupy kontrolnej. Umiarkowane (klirens kreatyniny od 31 do 49 ml/min), zaawansowane (klirens kreatyniny od 5 do 30 ml/min) oraz schyłkowe (klirens kreatyniny <10 ml/min i konieczność stosowania dializy) zaburzenia czynności nerek powodowały umiarkowany wzrost stężenia kaspofunginy w osoczu po podaniu pojedynczej dawki (rozpiętość: od 30% do 49% dla AUC). Jednakże u dorosłych pacjentów z inwazyjną kandydozą, kandydozą przełyku lub inwazyjną aspergilozą, którym wielokrotnie podano dawki dobowe kaspofunginy po 50 mg, nie stwierdzono istotnego wpływu zaburzenia czynności nerek na poziomie od łagodnego do zaawansowanego na stężenie kaspofunginy. Nie ma konieczności dostosowywania dawki u pacjentów z zaburzeniami czynności nerek. Kaspofungina nie ulega dializie, dlatego nie ma potrzeby podawania dodatkowej dawki po hemodializie.
Płeć:
Stężenie kaspofunginy w osoczu było średnio o 17–38% wyższe u kobiet niż u mężczyzn.
Osoby w podeszłym wieku:
U mężczyzn w podeszłym wieku obserwowano niewielki wzrost AUC (28%) oraz C24h (32%) w porównaniu z młodymi mężczyznami. W przypadku pacjentów poddanych leczeniu empirycznemu lub chorych na inwazyjną kandydozę obserwowano podobny niewielki wpływ wieku u pacjentów starszych w porównaniu z młodszymi.
Rasa:
Dane farmakokinetyczne pacjentów wskazują na brak klinicznie istotnych różnic pod względem farmakokinetyki kaspofunginy u osób rasy białej, czarnej, Latynosów i Metysów.
Dzieci i młodzież:
U nastolatków (w wieku od 12 do 17 lat) otrzymujących kaspofunginę w dawce 50 mg/m2 na dobę (maksymalnie 70 mg na dobę) wartość AUC0-24hr dla kaspofunginy w osoczu była na ogół porównywalna z obserwowaną u osób dorosłych otrzymujących kaspofunginę w dawce 50 mg na dobę. Wszystkim nastolatkom podawano dawki >50 mg na dobę, a 6 na 8 otrzymywało w rzeczywistości maksymalną dawkę 70 mg/dobę. Stężenie kaspofunginy w osoczu u tych nastolatków było niższe w porównaniu z dorosłymi otrzymującymi 70 mg, czyli dawkę która była najczęściej stosowaną u nastolatków.
U dzieci (w wieku od 2 do 11 lat) otrzymujących kaspofunginę w dawce 50 mg/m2 na dobę (maksymalnie 70 mg na dobę) wartość AUC0-24hr dla kaspofunginy w osoczu była po podaniu kilku dawek porównywalna z obserwowaną u dorosłych otrzymujących kaspofunginę w dawce 50 mg/dzień.
U małych dzieci (w wieku od 12 do 23 miesięcy) otrzymujących kaspofunginę w dawce 50 mg/m2 na dobę (maksymalnie 70 mg na dobę) wartość AUC0-24hr dla kaspofunginy w osoczu po podaniu kilku dawek była porównywalna z obserwowaną u dorosłych otrzymujących kaspofunginę w dawce 50 mg na dobę oraz u starszych dzieci (w wieku od 2 do 11 lat) otrzymujących dobową dawkę 50 mg/m2.
Ogólnie, dane na temat farmakokinetyki, skuteczności i bezpieczeństwa u pacjentów w wieku od 3 do 10 miesięcy są ograniczone. Dane na temat farmakokinetyki uzyskane u jednego 10-miesięcznego dziecka otrzymującego dzienną dawkę 50 mg/m2 wskazują, że wartość AUC0–24hr była w tym samym zakresie co odnotowana u starszych dzieci i dorosłych odpowiednio przy dawce 50 mg/m2 i 50 mg, natomiast u 6-miesięcznego dziecka otrzymującego dawkę 50 mg/m2 wartość AUC0–24hr była nieco wyższa.
U noworodków i niemowląt (w wieku <3 miesięcy) otrzymujących kaspofunginę w dawce 25 mg/m2 na dobę (co odpowiada średniej dobowej dawce na poziomie 2,1 mg/kg) szczytowe stężenie (C1hr) i minimalne stężenie kaspofunginy (C24hr) było po podaniu kilku dawek porównywalne z obserwowanym u dorosłych otrzymujących kaspofunginę w dawce 50 mg na dobę. W 1. dniu wartość C1hr była u tych noworodków i niemowląt porównywalna z obserwowaną u dorosłych, a wartość C24hr lekko zwiększona (36%). Zaobserwowano jednak zmienność pod względem zarówno wartości C1hr (średnia geometryczna w 4. dniu 11,73 µg/ml, zakres od 2,63 do 22,05 µg/ml), jak i C24hr (średnia geometryczna w 4. dniu 3,55 µg/ml, zakres od 0,13 do 7,17 µg/ml). W tym badaniu nie zmierzono wartości AUC0–24hr ze względu na niewystarczającą liczbę próbek osocza. Należy zwrócić uwagę, że skuteczność i bezpieczeństwo kaspofunginy nie zostały odpowiednio zbadane w prospektywnych badaniach klinicznych z udziałem noworodków i niemowląt w wieku poniżej 3 miesięcy.
W przeprowadzonych na szczurach i małpach badaniach toksyczności po wielokrotnym podaniu dożylnym dawek do 7–8 mg/kg mc. obserwowano reakcje w miejscu wstrzyknięcia, objawy reakcji uwolnienia histaminy u szczurów oraz objawy niepożądanego działania na wątrobę u małp. Badania toksycznego wpływ na rozwój potomstwa u szczurów wykazały, że kaspofungina powoduje spadek masy ciała płodu oraz wzrost przypadków niepełnego skostnienia kręgów, mostka i kości czaszki przy dawkach 5 mg/kg, które były powiązane z działaniami niepożądanymi wpływającymi na ciąże, takimi jak oznaki wydzielania histaminy u ciężarnych samic szczurów. Stwierdzano także zwiększenie częstości występowania żeber szyjnych. Wyniki badań potencjalnej genotoksyczności kaspofunginy były ujemne zarówno w testach in vitro , jak i w badaniu chromosomalnym szpiku kostnego u myszy in vivo. Nie prowadzono długookresowych badań na zwierzętach w celu oceny potencjalnego działania rakotwórczego. W badaniach prowadzonych u samców i samic szczurów nie stwierdzono wpływu kaspofunginy na płodność przy dawkach do 5 mg/kg/dobę.
Sacharoza Mannitol
Kwas octowy lodowaty
Sodu wodorotlenek (do ustalenia pH)
Nie mieszać z roztworami zawierającymi glukozę, ponieważ produkt leczniczy Caspofungin Adamed nie jest stabilny w roztworach zawierających glukozę. Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności.
Wykazano, że chemiczna i fizyczna trwałość rozpuszczonego koncentratu do sporządzania roztworu do infuzji, przechowywanego w temperaturze 25°C lub niższej, albo w temperaturze 5°C ± 3°C wynosi 24 h, jeśli do rozpuszczenia użyto wody do wstrzykiwań.
Produkt leczniczy Caspofungin Adamed nie zawiera substancji konserwujących.
Z mikrobiologicznego punktu widzenia, jeśli sposób otwierania/rozpuszczania/rozcieńczania nie wyklucza ryzyka zanieczyszczenia mikrobiologicznego, wówczas produkt powinien być użyty natychmiast. Jeśli nie został użyty natychmiast, za czas i warunki przechowywania przed użyciem odpowiedzialny jest użytkownik.
Wykazano, że chemiczna i fizyczna trwałość rozcieńczonego roztworu do infuzji dla pacjenta przechowywanego w temperaturze 2°C – 8°C lub w 25°C wynosi 48 godzin, jeśli był rozcieńczony roztworem chlorku sodu do wstrzykiwań o stężeniu 9 mg/ml (0,9%), 4,5 mg/ml (0,45%) lub 2,25 mg/ml (0,225%) albo roztworem Ringera z dodatkiem mleczanu.
Ze względów mikrobiologicznych produkt należy zużyć natychmiast. Jeśli nie zostanie zużyty natychmiast, za czas i warunki przechowywania przed użyciem odpowiada użytkownik.
Przechowywanie w normalnej sytuacji nie powinno przekraczać 24 godzin w temperaturze 2°C – 8°C, chyba że rozpuszczanie i rozcieńczenie wykonano w kontrolowanych oraz zwalidowanych warunkach aseptycznych.
Nieotwarte fiolki: przechowywać w lodówce (2°C – 8°C).
Warunki przechowywania produktu leczniczego po rozpuszczeniu i rozcieńczeniu, patrz punkt 6.3.
Fiolka o pojemności 10 ml z bezbarwnego szkła typu I, z korkiem z gumy bromobutylowej i aluminiowym uszczelnieniem oraz wieczkiem z PP typu flip-off.
Opakowanie zawiera 1 fiolkę.
Rozpuszczanie produktu leczniczego Caspofungin Adamed
NIE STOSOWAĆ ROZPUSZCZALNIKÓW ZAWIERAJĄCYCH GLUKOZĘ, ponieważ produkt
Caspofungin Adamed nie jest stabilny w roztworach zawierających glukozę. NIE MIESZAĆ ANI NIE PODAWAĆ W TYM SAMYM WLEWIE PRODUKTU Caspofungin Adamed WRAZ Z INNYMI
PRODUKTAMI LECZNICZYMI, ponieważ brak jest dostępnych danych dotyczących zgodności produktu leczniczego Caspofungin Adamed z innymi substancjami, dodatkami lub produktami leczniczymi podawanymi dożylnie. Roztwór do infuzji należy obejrzeć, czy nie zawiera cząstek stałych oraz czy nie jest zabarwiony.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Caspofungin Adamed 70 mg, proszek do sporządzania koncentratu roztworu do infuzji
INSTRUKCJA STOSOWANIA LEKU U PACJENTÓW DOROSŁYCH
Etap 1 Rozpuszczenie zawartości fiolki
Aby rozpuścić proszek należy nieotwartą fiolkę doprowadzić do temperatury pokojowej, a następnie w sposób jałowy dodać 10,5 ml wody do wstrzykiwań. Stężenie otrzymanego koncentratu będzie wynosiło 7,2 mg/ml.
Biały lub prawie biały, liofilizowany proszek rozpuści się całkowicie. Delikatnie mieszać do uzyskania klarownego roztworu. Przygotowany roztwór należy obejrzeć, czy nie zawiera cząstek stałych oraz czy nie jest zabarwiony. Przygotowany roztwór może być przechowywany przez 24 godziny w temperaturze 25°C lub niższej, albo w temperaturze 5°C ± 3°C.
Etap 2 Dodanie rozpuszczonego produktu Caspofungin Adamed do roztworu do infuzji dla pacjenta
Do sporządzenia finalnego roztworu do infuzji można używać następujących roztworów: roztwór chlorku sodu do wstrzykiwań lub roztwór Ringera z mleczanami. Roztwór do infuzji należy sporządzić poprzez dodanie w sposób jałowy odpowiedniej objętości przygotowanego koncentratu (tak jak pokazano w tabeli poniżej) do worka lub butelki infuzyjnej o objętości 250 ml. Dawkę dobową 50 mg lub 35 mg, jeśli jest to wskazane, można podać we wlewie o zmniejszonej objętości do 100 mlTen roztwór do infuzji musi zostać zużyty w ciągu 48 godzin, jeśli jest przechowywany w temperaturze 2-8 °C lub 25 °C. Nie stosować roztworu, jeśli występuje zmętnienie lub osad.
SPORZĄDZANIE ROZTWORU DO INFUZJI DLA OSÓB DOROSŁYCH
Dawka* | Objętość rozpuszczonego produktu Caspofungin Adamed, jaką należy przenieść do worka lub butelki do infuzji | Preparat standardowy (rozpuszczony produkt Caspofungin Adamed dodany do 250 ml), stężenie końcowe | Zmniejszona objętość infuzji (rozpuszczony produkt Caspofungin Adamed dodany do 100 ml), stężenie końcowe |
70 mg | 10 ml | 0,28 mg/ml | Nie jest zalecane |
70 mg (z dwóch fiolek po 50 mg)** | 14 ml | 0,28 mg/ml | Nie jest zalecane |
35 mg w umiarkowanych zaburzeniach czynności wątroby (z jednej fiolki 70 mg) | 5 ml | 0,14 mg/ml | 0,34 mg/ml |
* Do rozpuszczenia zawartości każdej fiolki należy użyć 10,5 ml płynu.
** Jeśli nie jest dostępna fiolka zawierająca 70 mg, dawkę 70 mg można uzyskać z dwóch fiolek po 50 mg.
INSTRUKCJA UŻYCIA U DZIECI I MŁODZIEŻY
Obliczanie pola powierzchni ciała (Body Surface Area, BSA) w celu ustalenia dawki DLA dzieci i młodzieży
Przed przygotowaniem wlewu należy obliczyć pole powierzchni ciała pacjenta używając następującego wzoru: (wzór Mostellera)
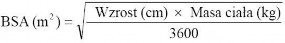
Przygotowanie wlewu dożylnego zawierającego dawkę 70 mg/m2 pc. dla dzieci i młodzieży w wieku > 3 miesięcy (z użyciem fiolki zawierającej 70 mg produktu)
c. Produkt Caspofungin Adamed przygotowywany jest tak, by umożliwić uzyskanie pełnej dawki podanej na etykiecie fiolki (70 mg) po pobraniu z fiolki 10 ml roztworu.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Adamed Pharma S.A.
Pieńków, ul. M. Adamkiewicza 6A 05-152 Czosnów
Pozwolenie nr 23688
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 2017-01-30
13.08.2020











