Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY Predasol 5 mg tabletki
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY Predasol 5 mg tabletki
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
niewydolność kory nadnerczy o dowolnej przyczynie (np. choroba Addisona, zespół nadnerczowo- płciowy, stan po usunięciu operacyjnym nadnerczy, niedobór ACTH) po zakończeniu wzrostu (lekami z wyboru są hydrokortyzon i kortyzon),
stany stresowe po długotrwałym leczeniu kortykosteroidami.
Reumatologia:
aktywna faza układowego zapalenia naczyń:
guzkowe zapalenie tętnic (SD: a, b, u pacjentów z dodatnim wynikiem testu serologicznego w kierunku zapalenia wątroby typu B należy ograniczyć czas trwania leczenia do dwóch tygodni),
olbrzymiokomórkowe zapalenie tętnic, polimialgia reumatyczna (SD: c),
zapalenie tętnicy skroniowej (SD:a, w przypadku nagłej utraty wzroku początkowo dożylna terapia glikokortykosteroidami w pulsach, a następnie leczenie podtrzymujące z monitorowaniem OB),
ziarniniakowatość Wegenera:
leczenie początkowe (SD: a-b) w skojarzeniu z metotreksatem (łagodne postacie nieobejmujące nerek) lub według schematu Fauci (ciężkie postacie obejmujące nerki i (lub) płuca), podtrzymywanie remisji: (SD: d, stopniowo zmniejszając dawki) w skojarzeniu z lekami immunosupresyjnymi,
zespół Churga i Strauss: leczenie początkowe (SD: a-b) z manifestacją narządową i ciężkie postacie w skojarzeniu z lekami immunosupresyjnymi, podtrzymywanie remisji (SD: d),
aktywne fazy układowych chorób reumatycznych (SD: a, b):
toczeń rumieniowaty układowy,
zapalenie wielomięśniowe, przewlekłe zanikowe zapalenie wielochrząstkowe,
mieszana choroba tkanki łącznej,
aktywne reumatoidalne zapalenie stawów (SD: a do d) w ciężkiej, postępującej postaci, np. z szybkim zniszczeniem stawów (SD: a) i (lub) z objawami pozastawowymi (SD: b),
inne postacie reumatoidalnego zapalenia stawów, które ze względu na nasilenie objawów wymagają podawania glikokortykosteroidów, a niesteroidowe leki przeciwzapalne (NLPZ) nie mogą być stosowane:
zapalenie stawów kręgosłupa, zesztywniające zapalenie stawów kręgosłupa z zajęciem stawów obwodowych (SD: b, c), łuszczycowe zapalenie stawów (SD: c, d), enteropatyczne zapalenie stawów ze znaczną aktywnością procesu zapalnego (SD: a),
reaktywne postacie zapalenia stawów (SD: c),
zapalenie stawów w przebiegu sarkoidozy (SD: b początkowo),
zapalenie serca w przebiegu gorączki reumatycznej, ponad 2-3 miesiące w ciężkich przypadkach (SD: a)
młodzieńcze idiopatyczne zapalenie stawów w ciężkiej postaci układowej (choroba Stilla) lub z zapaleniem tęczówki i ciała rzęskowego, które nie ustępuje po leczeniu miejscowym (SD: a).
Pulmonologia:
astma oskrzelowa (SD: c do a), jednocześnie zaleca się podawanie leków rozszerzających oskrzela,
zaostrzenie przewlekłej obturacyjnej choroby płuc (POChP) (SD: b) – zalecany czas leczenia: do 10 dni,
śródmiąższowe choroby płuc, takie jak ostre zapalenie pęcherzyków płucnych (SD: b), zwłóknienie płuc (SD: b), zarostowe zapalenie oskrzelików z organizującym się zapaleniem płuc (BOOP) (SD: b stopniowo zmniejszając dawki), w razie potrzeby w skojarzeniu z lekami immunosupresyjnymi, przewlekłe eozynofilowe zapalenie płuc (SD: b stopniowo zmniejszając dawki), długotrwałe leczenie przewlekłych postaci sarkoidozy w stadium II i III (z dusznością, kaszlem i pogorszeniem parametrów czynnościowych płuc) (SD: b),
profilaktyka zespołu zaburzeń oddychania u wcześniaków (SD: b, dwie dawki pojedyncze).
Choroby górnych dróg oddechowych:
ciężkie postacie pyłkowicy i alergicznego nieżytu nosa po niepowodzeniu leczenia glikokortykosteroidami podawanymi donosowo (SD: c),
nagłe zwężenie krtani i dróg oddechowych: obrzęk naczynioruchowy, podgłośniowe zapalenie krtani (pseudokrup) (SD: b do a).
Dermatologia:
Choroby skóry i błon śluzowych, które ze względu na stopień nasilenia i (lub) zajmowaną powierzchnię albo zajęcie narządów wewnętrznych nie mogą być odpowiednio leczone glikokortykosteroidami stosowanymi miejscowo (lub nie odpowiadają na takie leczenie). Należą do nich:
choroby alergiczne, pseudoalergiczne i choroby alergiczne związane z zakażeniami: np. ostra pokrzywka, reakcje anafilaktoidalne, wysypka polekowa, wielopostaciowy rumień wysiękowy, toksyczna rozpływna martwica naskórka (zespół Lyella), ostra uogólniona osutka krostkowa, rumień guzowaty, ciężka gorączkowa dermatoza neutrofilowa (zespół Sweeta), alergiczny wyprysk kontaktowy (SD: b do a),
wyprysk: np. wyprysk atopowy, wyprysk kontaktowy, wyprysk bakteryjny (pieniążkowaty) (SD: b do a),
choroby ziarniniakowe: np. sarkoidoza, ziarniniakowe zapalenie warg (skąpoobjawowa postać zespołu Melkerssona-Rosenthala) (SD: b do a),
dermatozy pęcherzowe: np. pęcherzyca zwykła, pemfigoid pęcherzowy, łagodny pemfigoid błon śluzowych, linijna IgA dermatoza (SD: b do a),
zapalenia naczyń: np. alergiczne zapalenie naczyń, guzkowe zapalenie tętnic (SD: b do a),
choroby autoimmunologiczne: np. zapalenie skórno-mięśniowe, twardzina układowa (faza stwardnieniowa), przewlekły toczeń rumieniowaty krążkowy i podostra postać skórna tocznia rumieniowatego (SD: b do a),
dermatozy ciążowe (patrz też punkt 4.6): np. opryszczka ciążowa, liszajec opryszczkowaty (SD: d do a),
dermatozy rumieniowo-złuszczające: np. łuszczyca krostkowa, łupież czerwony mieszkowy, grupa przyłuszczyc (SD: c do a),
erytrodermia, w tym przypadki zespołu Sézary'ego (SD: c do a),
inne choroby: np. reakcja Jarischa-Herxheimera na penicylinę zastosowaną w leczeniu kiły, naczyniak krwionośny jamisty z szybko postępującym wytrzeszczem, choroba Behçeta, piodermia zgorzelinowa, eozynofilowe zapalenie powięzi, liszaj czerwony rumieniowaty, dziedziczne pęcherzowe oddzielanie się naskórka (SD: c do a).
Hematologia/onkologia:
autoimmunologiczna niedokrwistość hemolityczna (SD: c do a), samoistna plamica małopłytkowa (choroba Werlhofa) (SD: a), ostra małopłytkowość przemijająca (SD: a),
ostra białaczka limfoblastyczna, ziarnica złośliwa, chłoniak nieziarniczy, przewlekła białaczka limfatyczna, makroglobulinemia Waldenströma, szpiczak mnogi (SD: e),
hiperkalcemia w przebiegu podstawowej choroby nowotworowej (SD: c do a),
profilaktyka i leczenie wymiotów wywołanych cytostatykami (SD: b do a), stosowanie w ramach leczenia przeciwwymiotnego,
terapia paliatywna chorób nowotworowych.
Uwaga: prednizolon może być stosowany w celu łagodzenia objawów, np. w przypadku braku apetytu, jadłowstrętu i ogólnego osłabienia w przebiegu zaawansowanych chorób nowotworowych po wyczerpaniu możliwości specyficznych terapii. Szczegółowe informacje można znaleźć w aktualnej literaturze specjalistycznej.
Neurologia (SD: a):
miastenia (lekiem pierwszego wyboru jest azatiopryna),
przewlekły zespół Guillaina-Barrégo,
zespół Tolosa-Hunta,
polineuropatia w przebiegu gammapatii monoklonalnej,
stwardnienie rozsiane (przy doustnym stopniowym zmniejszaniu dawek po wcześniejszym pozajelitowym podawaniu dużych dawek glikokortykosteroidów w przebiegu ostrego rzutu choroby),
napady zgięciowe (zespół Westa).
Choroby zakaźne:
stany toksyczne w przebiegu ciężkich chorób zakaźnych (w skojarzeniu z antybiotykami lub chemioterapeutykami), np. gruźlicze zapalenie opon mózgowo-rdzeniowych (SD: b), ciężkie postacie gruźlicy płuc (SD: b).
Choroby oczu (SD: b do a):
w chorobach układowych obejmujących oczy i w procesach immunologicznych w obrębie oczodołu i oka: neuropatia nerwu wzrokowego (np. olbrzymiokomórkowe zapalenie tętnic, przednia niedokrwienna neuropatia nerwu wzrokowego (AION), urazowa neuropatia nerwu wzrokowego), choroba Behçeta, sarkoidoza, orbitopatia tarczycowa, rzekomy guz oczodołu, odrzucenie przeszczepu i w niektórych zapaleniach błony naczyniowej, takich jak zespół Harady i współczulne zapalenie naczyniówki.
w następujących chorobach ogólnoustrojowe podawanie glikokortykosteroidów wskazane jest tylko w przypadku nieskutecznego terapii lekami stosowanymi miejscowo: zapalenie twardówki, zapalenie nadtwardówki, zapalenie rogówki, przewlekłe zapalenie ciała rzęskowego, zapalenie błony naczyniowej, alergiczne zapalenie spojówek, oparzenia związkami zasadowymi, w skojarzeniu z leczeniem przeciwbakteryjnym w przypadku autoimmunologicznego lub związanego z kiłą śródmiąższowego zapalenia rogówki, w zapaleniu zrębu rogówki wywołanym wirusem opryszczki pospolitej, tylko jeśli nabłonek rogówki jest nieuszkodzony i zapewniona jest regularna kontrola okulistyczna.
Gastroenterologia/Hepatologia:
wrzodziejące zapalenie jelita grubego (SD: b do c),
choroba Leśniowskiego-Crohna (SD: b),
autoimmunologiczne zapalenie wątroby (SD: b),
oparzenia przełyku substancjami żrącymi (SD: a).
Nefrologia:
submikroskopowe kłębuszkowe zapalenie nerek (SD: a),
rozplemowe zewnątrzwłośniczkowe kłębuszkowe zapalenie nerek (gwałtownie postępujące kłębuszkowe zapalenie nerek) (SD: leczenie dużymi dawkami w pulsach, na ogół w skojarzeniu z cytostatykami), zmniejszanie dawki i zakończenie leczenia w zespole Goodpasture’a, we wszystkich innych postaciach długotrwałe leczenie (SD: d),
idiopatyczne zwłóknienie pozaotrzewnowe (SD: b).
Dawkowanie i sposób podawania
chłoniak nieziarniczy:
schemat CHOP, prednizolon 100 mg/m2 dzień 1-5; schemat COP, prednizolon 100 mg/m2 dzień 1-5
przewlekła białaczka limfatyczna:
schemat Knospe, prednizolon 75/50/25 mg dzień 1 -3
ziarnica złośliwa: schemat COPP-ABVD, prednizolon 40 mg/m2 dzień 1-14
szpiczak mnogi: schemat Alexanian, prednizolon 2 mg/kg masy ciała dzień 1 -4
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
ostre zakażenia wirusowe (wirusowe zapalenie wątroby typu B, półpasiec, opryszczka, ospa wietrzna, opryszczkowe zapalenie rogówki ),
przewlekłe czynne wirusowe zapalenie wątroby z dodatnim wynikiem testu na obecność HBsAg,
w okresie od około 8 tygodni przed do 2 tygodni po szczepieniach ochronnych z użyciem żywych szczepionek,
układowe grzybice i zakażenia pasożytnicze (np. wywołane przez nicienie),
u pacjentów z podejrzeniem lub potwierdzeniem strongyloidozy (zakażenie węgorkiem jelitowym) glikokortykosteroidy mogą prowadzić do masywnego namnażania się pasożytów,
choroba Heinego-Medina
zapalenie węzłów chłonnych po szczepieniu przeciw gruźlicy,
ostre i przewlekłe zakażenia bakteryjne,
w przypadku gruźlicy w wywiadzie stosować tylko z profilaktyką przeciwgruźliczą.
Ponadto leczenie produktem Predasol powinno być prowadzone tylko w przypadku bezwzględnych wskazań medycznych i, jeśli konieczne, z zastosowaniem dodatkowego swoistego leczenia w przypadku:
wrzodów żołądka i jelit,
osteoporozy,
trudnego do wyrównania nadciśnienia tętniczego,
trudnej do wyrównania cukrzycy,
chorób psychicznych (również w wywiadzie), w tym myśli samobójcze – zalecany jest nadzór neurologiczny lub psychiatryczny,
jaskry z wąskim i szerokim kątem przesączania – zalecany jest nadzór okulistyczny i leczenie towarzyszące,
owrzodzeń i uszkodzeń rogówki – zalecany jest nadzór okulistyczny i leczenie towarzyszące.
Ze względu na ryzyko perforacji jelita Predasol można stosować tylko w przypadku bezwzględnych wskazań medycznych i pod odpowiednim nadzorem w przypadku:
ciężkiego wrzodziejącego zapalenia jelita grubego z ryzykiem perforacji (nawet bez objawów podrażnienia otrzewnej,
zapalenia uchyłków jelita,
zespoleń jelitowych (bezpośrednio w okresie pooperacyjnym)
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Glikozydy nasercowe: Działanie glikozydów może zostać nasilone na skutek niedoboru potasu.
Leki moczopędne nasilające wydalanie sodu oraz leki przeczyszczające: Może dojść do zwiększenia wydalania potasu.
Leki przeciwcukrzycowe: Działanie obniżające stężenie glukozy we krwi może być zmniejszone.
Pochodne kumaryny (doustne leki przeciwzakrzepowe): Działanie antykoagulantów może być osłabione lub nasilone. Podczas jednoczesnego stosowania może być konieczne dostosowanie dawki antykoagulantu.
Niesteroidowe leki przeciwzapalne i przeciwreumatyczne (NLPZ), salicylany i indometacyna: Ryzyko owrzodzeń żołądka i jelit oraz krwawień z przewodu pokarmowego może być zwiększone.
Niedepolaryzujące leki zwiotczające mięśnie prążkowane: Zwiotczenie mięśni może być wydłużone.
Atropina, inne leki antycholinergiczne: Podczas jednoczesnego stosowania możliwe jest dodatkowe zwiększenie ciśnienia wewnątrzgałkowego.
Prazykwantel: Kortykosteroidy mogą zmniejszać stężenia prazykwantelu we krwi.
Chlorochina, hydroksychlorochina, meflochina: Istnieje zwiększone ryzyko miopatii i kardiomiopatii.
Somatotropina: Działanie somatotropiny może zostać zmniejszone.
Protyrelina: Zwiększenie aktywności TSH po podaniu protyreliny może być obniżone.
Estrogeny (np. hamujące owulację): Okres półtrwania glikokortykosteroidów może być wydłużony. Z tego powodu działanie kortykosteroidów może być nasilone.
Leki zobojętniające: Podczas jednoczesnego stosowania magnezu i wodorotlenku glinu
możliwe jest zmniejszenie wchłaniania prednizolonu. Przyjmowanie tych leków powinno odbywać się w odstępach czasu (2 godziny).
Produkt lecznicze pobudzające CYP3A4, takie jak ryfampicyna, fenytoina, karbamazepina, barbiturany i prymidon mogą zmniejszać działanie kortykosteroidów.
Efedryna: Może nastąpić przyśpieszenie metabolizmu glikokortykosteroidów, co może zmniejszyć ich skuteczność.
Produkty lecznicze hamujące CYP3A4, np. ketokonazol i itrakonazol mogą zwiększać działanie kortykosteroidów.
Leki immunosupresyjne: Zwiększenie podatności na zakażenia oraz możliwe zaostrzenie lub pojawienie się objawów zakażeń utajonych. Dodatkowo dla cyklosporyny: Stężenie cyklosporyny we krwi może być zwiększone; istnieje zwiększone ryzyko drgawek mózgowych.
Inhibitory konwertazy angiotensyny: Zwiększone ryzyko zmian morfologii krwi.
Fluorochinolony mogą zwiększać ryzyko uszkodzeń ścięgien.
Spodziewane jest, że jednoczesne podawanie inhibitorów CYP3A, w tym produktów zawierających kobicystat, zwiększy ryzyko ogólnoustrojowych działań niepożądanych. Należy unikać łączenia leków, chyba że korzyść przewyższa zwiększone ryzyko ogólnoustrojowych działań niepożądanych związanych ze stosowaniem glikokortykosteroidów; w takim przypadku pacjenta należy obserwować w celu wykrycia ogólnoustrojowych działań glikokortykosteroidów.
Wpływ na wyniki badań laboratoryjnych:
Reakcje skórne w testach alergicznych mogą być zahamowane.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługę maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych Predasol, 5 mg, tabletki
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Predasol, 5 mg, tabletki Predasol, 10 mg, tabletki Predasol, 20 mg, tabletki
1 tabletka zawiera 5 mg prednizolonu (Prednisolonum).
Substancja pomocnicza o znanym działaniu:
1 tabletka zawiera 70 mg laktozy jednowodnej (patrz punkt 4.4.)
Predasol 10 mg tabletki
1 tabletka zawiera 10 mg prednizolonu (Prednisolonum).
Substancja pomocnicza o znanym działaniu:
1 tabletka zawiera 70 mg laktozy jednowodnej (patrz punkt 4.4.)
Predasol 20 mg tabletki
1 tabletka zawiera 20 mg prednizolonu (Prednisolonum).
Substancja pomocnicza o znanym działaniu:
1 tabletka zawiera 67,6 mg laktozy jednowodnej (patrz punkt 4.4.) Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka
Predasol 5 mg tabletki:
Białe, okrągłe tabletki o średnicy ok. 7 mm z linią podziału w kształcie krzyża po jednej stronie oraz wytłoczeniem „5” po drugiej stronie.
Predasol 10 mg tabletki
Białe, okrągłe tabletki o średnicy ok. 7 mm z linią podziału w kształcie krzyża po jednej stronie oraz wytłoczeniem „10” po drugiej stronie.
Predasol 20 mg tabletki
Białe, okrągłe tabletki o średnicy ok. 9 mm z linią podziału w kształcie krzyża po jednej stronie oraz wytłoczeniem „20” po drugiej stronie.
Tabletki można podzielić na dwie lub cztery równe dawki.
Predasol jest wskazany do leczenia chorób, które wymagają ogólnoustrojowego podawania glikokortykosteroidów. Do tych chorób, w zależności od ich objawów i stopnia ciężkości, należą [schematy dawkowania (SD): od a do d, patrz punkt 4.2. „Dawkowanie”]:
Predasol stosowany jest u dorosłych, dzieci w każdej grupie wiekowej oraz młodzieży.
Leczenie substytucyjne:
Dawkowanie
Dawkowanie zależy od rodzaju i nasilenia choroby oraz od indywidualnej reakcji pacjenta. Na ogół stosuje się względnie duże dawki początkowe, które muszą być wyraźnie większe w ostrych i ciężkich postaciach choroby niż w przypadku chorób przewlekłych.
W zależności od objawów klinicznych i odpowiedzi pacjenta na leczenie, dawkowanie można szybko zmniejszyć w indywidualny sposób do możliwie małej dawki podtrzymującej (zwykle między 5 a 15 mg prednizolonu na dobę). Szczególnie w przypadku chorób przewlekłych, często wymagane jest długotrwałe leczenie małymi dawkami podtrzymującymi.
O ile nie przepisano inaczej, obowiązują następujące wytyczne dawkowania:
Leczenie substytucyjne (poza okresem wzrostu)
5 do 7,5 mg prednizolonu na dobę, podzielone na dwie dawki pojedyncze (rano i w południe, w zespole nadnerczowo-płciowym: rano i wieczorem). W zespole nadnerczowo-płciowym dawka wieczorna ma na celu zmniejszenie nocnego zwiększenia ACTH, a tym samym zapobieganie rozrostowi kory nadnerczy. W razie potrzeby, należy dodatkowo przyjmować mineralokortykoid (fludrokortyzon). W przypadku szczególnego obciążenia fizycznego (np. uraz, operacja) lub występujących jednocześnie zakażeń itp., konieczne może być 2-3-krotne zwiększenie dawki, a przy skrajnym obciążeniu (np. poród) – 10-krotne zwiększenie dawki.
Stany stresowe po długotrwałym leczeniu glikokortykosteroidami: do 50 mg prednizolonu na dobę, podawane w odpowiednim czasie. Dawkę należy zmniejszać przez okres kilku dni.
Farmakoterapia
Poniższe tabele przedstawiają przegląd ogólnych wytycznych dawkowania, w odniesieniu do aktualnej literatury specjalistycznej:
Dorośli
Dawki | Dawka (mg na dobę) | Dawka (mg/kg masy ciała na dobę) |
a) duże | 80 – 100 (250) | 1,0 – 3,0 |
b) średnie | 40 – 80 | 0,5 – 1,0 |
c) małe | 10 – 40 | 0,25 – 0,5 |
d) bardzo małe | 1,5 – 7,5 (10) | ./. |
e) chemioterapia skojarzona, patrz schemat dawkowania „e” (SD: e) | ||
Na ogół całkowita dawka dobowa przyjmowana jest wcześnie rano między godz. 6.00 a 8.00 (leczenie zgodne z rytmem dobowym). W zależności od choroby duże dawki dobowe można podzielić na 2-4 dawki pojedyncze, a średnie dawki dobowe – na 2-3 dawki pojedyncze.
Dzieci
Dawki | Dawka (mg/kg masy ciała na dobę) |
duże | 2 – 3 |
średnie | 1 – 2 |
podtrzymujące | 0,25 |
U dzieci (w okresie wzrostu) leczenie, jeśli to możliwe, powinno być prowadzone w schemacie naprzemiennym lub przerywanym. W szczególnych przypadkach (np. w napadach zgięciowych – zespole Westa), można odstąpić od tego zalecenia.
Redukcja dawki
Po uzyskaniu zamierzonego działania klinicznego, w zależności od choroby podstawowej, należy zacząć zmniejszanie dawki. Jeśli dawka dobowa jest podzielona na kilka dawek pojedynczych, należy w pierwszej kolejności zmniejszyć dawkę wieczorną, następnie dawkę południową, jeśli dotyczy. Redukcja dawki powinna być prowadzona początkowo nieco szybciej, a następnie wolniej od dawki około 25 mg na dobę. Sytuacja kliniczna jest czynnikiem decydującym o tym, czy należy zakończyć podawanie leku, czy należy stosować dawki podtrzymujące.
Następujące etapy wraz z monitorowaniem nasilenia choroby mogą służyć jako wytyczne zmniejszania dawkowania:
ponad 30 mg na dobę | redukcja o 10 mg | co 2-5 dni, |
od 30 do 15 mg na dobę | redukcja o 5 mg | co tydzień, |
od 15 do 10 mg na dobę | redukcja o 2,5 mg | co 1-2 tygodnie, |
od 10 do 6 mg na dobę | redukcja o 1 mg | co 2-4 tygodnie, |
poniżej 6 mg na dobę | redukcja o 0,5 mg | co 4-8 tygodni. |
Leczenie dużymi i największymi dawkami trwające przez kilka dni, w zależności od choroby podstawowej i klinicznej odpowiedzi pacjenta, może zostać odstawione bez konieczności stopniowego zmniejszania dawek.
Schemat dawkowania „e” (SD: e)
Leczenie w ramach chemioterapii skojarzonej, we wskazaniach onkologicznych, powinno być oparte na aktualnie obowiązujących protokołach. Na ogół w takich przypadkach prednizolon jest podawany w dawce pojedynczej bez konieczności stopniowego zmniejszania dawki na zakończenie leczenia. W odniesieniu do aktualnej literatury specjalistycznej, poniżej wymieniono w formie przykładów dawkowanie prednizolonu w ustalonych protokołach chemioterapii:
Sposób podawania i czas trwania leczenia
Tabletki należy przyjmować w trakcie lub po posiłku, najlepiej po śniadaniu, bez rozgryzania, popijając dostateczną ilością płynu.
Podczas leczenia produktem Predasol należy sprawdzić, czy możliwe jest podawanie tego leku w schemacie naprzemiennym. Zależnie od choroby podstawowej, zaraz po uzyskaniu zadowalającego wyniku leczenia, dawkę leku zmniejsza się do wymaganej dawki podtrzymującej lub leczenie zostaje zakończone, przy jednoczesnej kontroli działania nadnerczy.
W przypadku niedoczynności tarczycy lub marskości wątroby mogą być wystarczające względnie małe dawki lub może być konieczne zmniejszenie dawki.
Aby umożliwić stosowanie różnych schematów dawkowania, Predasol dostępny jest jako tabletki po 5 mg, 10 mg i 20 mg prednizolonu. Linie podziału w kształcie krzyża na tabletkach umożliwiają stosowanie odpowiednich dawek pojedynczych w poszczególnych sytuacjach.
W przypadku nadwrażliwości na prednizolon lub którąkolwiek substancję pomocniczą (wymienioną w punkcie 6) nie stosować produktu Predasol.
W przypadku krótkotrwałego leczenia stanów zagrożenia życia nie ma przeciwskazań.
Ze względu na działanie immunosupresyjne leczenie produktem Predasol może prowadzić do zwiększonego ryzyka zakażeń bakteryjnych, wirusowych, pasożytniczych, oportunistycznych oraz grzybiczych. Objawy występującego lub rozwijającego się zakażenia mogą być maskowane, przez co postawienie diagnozy może być utrudnione. Może też dojść do aktywowania utajonego zakażenia, np. gruźlicy lub wirusowego zapalenia wątroby typu B.
Leczenie produktem Predasol powinno być prowadzone tylko w przypadku bezwzględnych wskazań medycznych i, jeśli konieczne, z zastosowaniem dodatkowego celowanego leczenia przeciwdrobnoustrojowego w przypadku następujących chorób:
U pacjentów, którzy otrzymują duże dawki glikokortykosteroidów, mogą nie występować objawy zapalenia otrzewnej po perforacji przewodu pokarmowego.
Ryzyko zaburzeń w obrębie ścięgien, zapalenia ścięgna i zerwania ścięgna jest zwiększone w przypadku jednoczesnego podawania fluorochinolonów i glikokortykosteroidów.
Podczas stosowania produktu Predasol u chorych na cukrzycę należy wziąć pod uwagę możliwość zwiększenia zapotrzebowania na insulinę lub doustne leki przeciwcukrzycowe.
Podczas leczenia produktem Predasol wymagane są regularne kontrole ciśnienia tętniczego, szczególnie podczas stosowania dużych dawek oraz u pacjentów z trudnym do wyrównania nadciśnieniem tętniczym.
Pacjentów z ciężką niewydolnością serca należy uważnie monitorować, ponieważ istnieje ryzyko pogorszenia stanu klinicznego.
Podczas leczenia miastenii może na początku dojść do nasilenia objawów. Dlatego kortykosteroid należy początkowo podawać w szpitalu. W szczególności w razie wystąpienia ciężkich zaburzeń w obrębie twarzy i gardła albo zmniejszenia objętości oddechowej należy stopniowo wprowadzać Predasol.
Długotrwałe stosowanie nawet małych dawek prednizolonu prowadzi do zwiększonego ryzyka zakażeń takimi drobnoustrojami, które na ogół rzadko powodują zakażenia (tzw. zakażenia oportunistyczne).
Zasadniczo możliwe jest szczepienie z użyciem szczepionek inaktywowanych. Należy jednak pamiętać o tym, że przy podawaniu większych dawkach kortykosteroidu może dojść do zmniejszenia odpowiedzi immunologicznej, a przez to – skuteczności szczepienia.
Bradykardia
Podczas stosowania dużych dawek prednizolonu może wystąpić bradykardia. Wystąpienie bradykardii nie musi być związane z czasem trwania leczenia.
Podczas długotrwałego podawania produktu Predasol konieczne są regularne kontrole lekarskie (w tym kontrola okulistyczna co 3 miesiące). Podczas długotrwałego leczenia względnie dużymi dawkami produktu Predasol, należy zwrócić uwagę na wystarczające przyjmowanie potasu i ograniczenie spożycia sodu.
Należy kontrolować stężenie potasu w surowicy krwi.
W przypadku gdy podczas leczenia produktem Predsol dojdzie do szczególnego obciążenia fizycznego (choroba przebiegająca z gorączką, wypadek, operacja, poród itp.), konieczne może być przejściowe zwiększenie dawki. Ze względu na potencjalne zagrożenie w sytuacjach szczególnego obciążenia, pacjenci w trakcie długotrwałego leczenia powinni otrzymać kartę informacyjną w razie nagłych wypadków.
Mogą wystąpić ciężkie reakcje anafilaktyczne.
W zależności od czasu trwania leczenia i stosowanych dawek należy liczyć się z negatywnym wpływem produktu na metabolizm wapnia. Dlatego zaleca się profilaktykę osteoporozy. Dotyczy to przede wszystkim osób z istniejącymi równocześnie czynnikami ryzyka, takimi jak predyspozycje rodzinne, podeszły wiek, okres pomenopauzalny, niedostateczna podaż białka i wapnia, palenie dużej liczby papierosów, nadmierne spożycie alkoholu oraz brak aktywności fizycznej. Profilaktyka polega na dostatecznej podaży wapnia i
witaminy D oraz na aktywności fizycznej. W przypadku już istniejącej osteoporozy, należy rozważyć dodatkowe leczenie farmakologiczne.
W trakcie odstawiania lub po ewentualnym przerwaniu długotrwałego leczenia glikokortykosteroidami należy rozważyć ryzyko: zaostrzenia lub nawrotu choroby podstawowej, ostrej niewydolności kory nadnerczy (szczególnie w sytuacjach stresu, np. podczas zakażenia, po urazach, przy zwiększonym obciążeniu organizmu), zespołu odstawienia kortyzonu.
U pacjentów leczonych glikokortykosteroidami niektóre choroby wirusowe (ospa wietrzna, odra) mogą mieć szczególnie ciężki przebieg. Najbardziej zagrożeni są pacjenci o osłabionej odporności (poddani immunosupresji), którzy dotychczas nie chorowali na odrę lub ospę wietrzną. W przypadku kontaktu tych pacjentów z osobami chorymi na odrę lub ospę wietrzną, podczas leczenia produktem Predasol, w razie konieczności, należy zastosować leczenie profilaktyczne.
Przełom w przebiegu guza chromochłonnego
Po podaniu glikokortykosteroidów zgłaszano przypadki wystąpienia przełomu w przebiegu guza chromochłonnego nadnerczy (Pheochromocytoma crisis), który może prowadzić do śmierci. W przypadku pacjentów z podejrzeniem lub zdiagnozowanym guzem chromochłonnym nadnerczy glikokortykosteroidy należy podawać wyłącznie po odpowiedniej ocenie stosunku korzyści do ryzyka.
Twardzinowy przełom nerkowy
U pacjentów z twardziną układową wymagane jest zachowanie ostrożności ze względu na zwiększoną częstość występowania twardzinowego przełomu nerkowego (o możliwym śmiertelnym przebiegu) z nadciśnieniem i zmniejszeniem wytwarzania moczu obserwowanym po podaniu prednizolonu w dawce wynoszącej co najmniej 15 mg na dobę. Dlatego należy rutynowo sprawdzać ciśnienie krwi i czynność nerek (stężenie kreatyniny w surowicy). Jeśli podejrzewa się wystąpienie przełomu nerkowego, należy starannie kontrolować ciśnienie krwi.
Zaburzenia widzenia
Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
Dzieci i młodzież
W okresie wzrostu dzieci powinno się dokładnie rozważyć stosunek korzyści do ryzyka związanego z leczeniem produktem Predasol. Ponieważ prednizolon może powodować zahamowanie wzrostu, w trakcie długotrwałego leczenia należy regularnie kontrolować wzrost dziecka.
Leczenie powinno być ograniczone czasowo, a w przypadku długotrwałego leczenia powinno być prowadzone w schemacie naprzemiennym.
Osoby w podeszłym wieku
Ponieważ pacjenci w podeszłym wieku narażeni są na większe ryzyko osteoporozy, należy dokładnie rozważyć stosunek korzyści do ryzyka związanego z leczeniem produktem Predasol.
Stosowanie produktu Predasol może prowadzić do dodatnich wyników w kontrolach antydopingowych.
Produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
W przypadku niektórych zagadnień przeprowadzano badanie interakcji u dorosłych. Inne interakcje oparte są na doświadczeniu klinicznym.
Ciąża
Podczas ciąży produkt leczniczy może być stosowany wyłącznie po dokładnej ocenie stosunku korzyści do ryzyka. Nie można wykluczyć wystąpienia zaburzeń wzrostu płodu podczas długotrwałego stosowania glikokortykosteroidów w trakcie ciąży. Podawanie kortykosteroidów ciężarnym zwierzętom może powodować nieprawidłowości w rozwoju płodu, w tym rozszczep podniebienia, wewnątrzmaciczne opóźnienie wzrostu oraz wpływa na rozwój mózgu (patrz punkt 5.3). Rozważana jest możliwość zwiększenia ryzyka rozwoju rozszczepienia ust u płodów ludzkich, spowodowanego podawaniem glikokortykosteroidów podczas pierwszego trymestru ciąży. Jeśli glikokortykosteroidy podawane są pod koniec ciąży, istnieje ryzyko wystąpienia niewydolności kory nadnerczy u płodów, co z kolei może wymagać leczenia substytucyjnego ze stopniowym zmniejszaniem dawki u noworodków.
Karmienie piersią
Prednizolon przenika do mleka kobiet karmiących piersią. Do tej pory nie są znane uszkodzenia u niemowląt. Niemniej jednak produkt może być stosowany podczas karmienia piersią, wyłącznie jeśli jest to bezwzględnie wskazane. Jeśli wymagane jest stosowanie większych dawek ze względu na chorobę, karmienie piersią powinno zostać przerwane.
Płodność
Kortykosteroidy mogą wpływać na ruchliwość i liczbę plemników u niektórych pacjentów.
Dotychczas brak danych wskazujących na to, że Predasol upośledza zdolność prowadzenia pojazdów i obsługiwania maszyn. To samo odnosi się do pracy bez zabiezpieczeń.
Leczenie substytucyjne
Podczas stosowania zalecanych dawek ryzyko działań niepożądanych jest małe.
Farmakoterapia
W trakcie leczenia mogą wystąpić następujące działania niepożądane, które w dużym stopniu zależą od dawki i czasu trwania leczenia oraz dla których w związku z tym nie jest możliwe określenie częstości występowania:
Zakażenia i zarażenia pasożytnicze
Maskowanie zakażeń, wystąpienie, pogorszenie lub reaktywacja zakażeń wirusowych, grzybiczych, bakteryjnych, pasożytniczych oraz zakażeń patogenami oportunistycznymi, aktywacja strongyloidozy (patrz punkt 4.4).
Zaburzenia krwi i układu chłonnego
Umiarkowana leukocytoza, limfopenia, eozynopenia, policytemia.
Zaburzenia układu immunologicznego
Reakcje alergiczne (np. wysypka polekowa), ciężkie reakcje anafilaktyczne, takie jak arytmie, skurcz oskrzeli, obniżenie lub podwyższenie ciśnienia tętniczego krwi, zapaść krążeniowa, zatrzymanie pracy serca, osłabienie systemu odpornościowego.
Zaburzenia endokrynologiczne
Zahamowanie czynności nadnerczy i wywołanie zespołu Cushinga (typowe objawy: twarz księżycowata, otyłość tułowia i hiperwolemia).
Zaburzenia metabolizmu i odżywiania
Zatrzymanie sodu, któremu towarzyszy powstawanie obrzęków, zwiększenie wydalania potasu (uwaga: ryzyko arytmii), zwiększenie masy ciała, obniżenie tolerancji glukozy, cukrzyca, hipercholesterolemia i hipertriglicerydemia, zwiększenie apetytu.
Zaburzenia psychiczne
Depresja, drażliwość, euforia, zwiększenie napędu, psychoza, mania, halucynacje, chwiejność emocjonalna, lęk, zaburzenia snu, myśli samobójcze.
Zaburzenia układu nerwowego
Rzekomy guz mózgu, pojawienie się objawów utajonej padaczki, zwiększenie skłonności do drgawek w padaczce.
Zaburzenia oka
Zaćma, szczególnie zaćma tylna podtorebkowa, jaskra, pogorszenie objawów owrzodzenia rogówki, zwiększenie ryzyka wirusowych, grzybiczych i bakteryjnych zapaleń oka, nieostre widzenie (patrz także punkt 4.4.).
Zaburzenia serca
Bradykardia (po dużych dawkach)
Zaburzenia naczyniowe
Nadciśnienie tętnicze, zwiększone ryzyko miażdżycy i zakrzepicy, zapalenie naczyń (także jako zespół odstawienia po długotrwałym leczeniu), zwiększona łamliwość naczyń włosowatych.
Zaburzenia żołądka i jelit
Wrzody żołądka i jelit, krwawienie z żołądka lub jelit, zapalenie trzustki.
Zaburzenia skóry i tkanki podskórnej
Rozstępy, zanik skóry, teleangiektazje, wybroczyny, wylewy krwi, nadmierne owłosienie, trądzik steroidowy, zapalenie skóry (wokół ust) podobne do trądziku różowatego, zmiany pigmentacji skóry.
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Zanik i osłabienie mięśni, miopatia, osteoporoza (zależne od dawki, możliwe także podczas krótkotrwałego stosowania), jałowa martwica kości, zaburzenia w obrębie ścięgien, zapalenie ścięgna, zerwanie ścięgna, tłuszczakowatość nadtwardówkowa, zahamowanie wzrostu u dzieci.
Uwaga: W przypadku zbyt szybkiego zmniejszania dawki po długotrwałym leczeniu mogą wystąpić objawy, takie jak bóle mięśni i stawów.
Zaburzenia nerek i dróg moczowych
Twardzinowy przełom nerkowy: Występowanie twardzinowego przełomu nerkowego różni się w poszczególnych podgrupach pacjentów. Największe ryzyko występuje u pacjentów z uogólnioną postacią twardziny układowej. Ryzyko jest najmniejsze u pacjentów z ograniczoną postacią twardziny układowej (2%) i z młodzieńczą postacią twardziny układowej (1%).
Zaburzenia układu rozrodczego i piersi
Zaburzenia wydzielania hormonów płciowych (skutkujące brakiem krwawień miesiączkowych, hirsutyzmem, impotencją).
Zaburzenia ogólne i stany w miejscu podania
Opóźnienie gojenia się ran.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można również zgłaszać podmiotowi odpowiedzialnemu.
Objawy:
Nie są znane przypadki ostrego zatrucia prednizolonem. W przypadku przedawkowania można spodziewać się nasilenia się działań niepożądanych (patrz punkt 4.8), szczególnie tych dotyczących układu endokrynologicznego, metabolizmu i równowagi elektrolitowej.
Leczenie:
Antidotum na prednizolon nie jest znane.
Grupa farmakoterapeutyczna: glikokortykosteroidy do stosowania układowego, kod ATC: H02AB06
Prednizolon jest niefluorowanym glikokortykosteroidem do leczenia układowego. Prednizolon, w zależności od dawki, wpływa na metabolizm prawie wszystkich tkanek. W zakresie fizjologicznym działanie to jest niezbędne do utrzymania homeostazy organizmu zarówno w spoczynku, jak i podczas wysiłku oraz regulowaniu czynności układu immunologicznego.
W przypadku braku czynności lub niewydolności kory nadnerczy prednizolon może zastąpić endogenny hydrokortyzon. Wpływa on wówczas w stanie równowagi metabolicznej na przemianę węglowodanów, białek i tłuszczów. Pod względem zależności działania od dawki, 5 mg prednizolonu odpowiada 20 mg hydrokortyzonu. Ze względu jednak na bardzo niewielkie działanie mineralokortykosteroidowe prednizolonu, w trakcie leczenia substytucyjnego u pacjentów z niewydolnością kory nadnerczy należy dodatkowo stosować mineralokortykosteroid.
W zespole nadnerczowo-płciowym prednizolon zastępuje kortyzol, którego brak wynika z defektu enzymatycznego i hamuje nadmierne wytwarzanie kortykotropiny w przysadce oraz androgenów w korze nadnerczy. Jeśli wspomniany defekt enzymatyczny dotyczy także syntezy mineralokortykosteroidów, należy dodatkowo stosować mineralokortykoid.
Prednizolon w dawkach większych niż wymagane do leczenia substytucyjnego wykazuje szybkie działanie przeciwzapalne (przeciwwysiękowe i antyproliferacyjne) oraz opóźnione działanie immunosupresyjne.
Hamuje przy tym chemotaksję i aktywność komórek układu immunologicznego oraz uwalnianie i działanie mediatorów reakcji zapalnych oraz odpowiedzi immunologicznej, np. enzymów lizosomalnych,
prostaglandyn i leukotrienów. W obturacji oskrzeli zwiększa działanie beta-adrenomimetyków rozszerzających oskrzela (tzw. efekt permisywny).
Długotrwałe leczenie dużymi dawkami prednizolonu prowadzi do zaniku układu odpornościowego i kory nadnerczy.
Efekt mineralotropowy, wyraźnie obecny przy hydrokortyzonie i wciąż wykrywalny przy prednizolonie, może wymagać kontrolowania stężenia elektrolitów w surowicy.
Działanie prednizolonu w obturacji dróg oddechowych polega zasadniczo na hamowaniu procesów zapalnych, zmniejszaniu lub zapobieganiu obrzękowi błony śluzowej, hamowaniu skurczu oskrzeli, hamowaniu względnie ograniczaniu wytwarzania śluzu oraz zmniejszaniu lepkości śluzu. Działania te wynikają z następujących mechanizmów: uszczelnienie naczyń i stabilizacja błon, normalizacja wrażliwości mięśni oskrzeli na beta-2-adrenomimetyki, obniżonej wskutek długotrwałego stosowania, osłabienie reakcji typu I począwszy od drugiego tygodnia terapii.
Prednizolon po podaniu doustnym jest szybko i prawie całkowicie wchłaniany, największe stężenie leku w surowicy występuje w ciągu 1-2 godzin. Prednizolon wiąże się odwracalnie z transkortyną oraz z albuminami osocza.
Prednizolon jest głównie metabolizowany w wątrobie, poprzez glukuronidację (około 70%) i sulfatację (około 30%). Częściowo ulega również przekształceniu do 11β, 17β-dihydroksyandrosta-1,4-dien-3-onu i 1,4- pregnadien-20-olu. Metabolity nie wykazują aktywności hormonalnej i usuwane są głównie przez nerki. Tylko bardzo niewielka ilość prednizolonu pojawia się w postaci niezmienionej w moczu. Okres półtrwania prednizolonu w osoczu wynosi około 3 godzin. Jest on wydłużony u pacjentów z ciężką niewydolnością wątroby. Czas biologicznej aktywności prednizolonu jest dłuższy od czasu obecności leku w surowicy, np. 18 do 36 godzin w zakresie średnich dawek.
Biodostępność
Biodostępność bezwzględna
Prednizolon po podaniu doustnym jest szybko i prawie całkowicie wchłaniany, największe stężenie leku w surowicy występuje w ciągu 1 do 2 godzin.
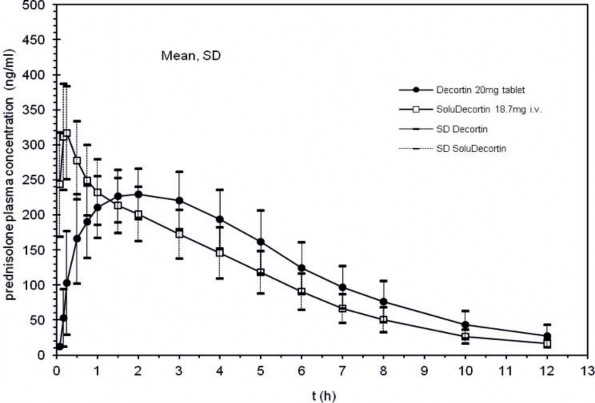
W przeprowadzonym w 1993 roku na grupie 12 zdrowych mężczyzn randomizowanym podwójnie krzyżowym badaniu biodostępności bezwzględnej prednizolonu porównywano jedną tabletkę 20 mg produktu referencyjnego podawanego doustnie względem 25 mg prednizolonu bursztynianu w postaci soli sodowej (=18.7 mg prednizolonu) jako 1 ampułka produktu referencyjnego podawanego dożylnie (produkt - odniesienie), przy czym tabletka przyjmowana była rano po standardowym śniadaniu.
Uzyskano następujące wyniki:
Parametr | produkt referencyjny podawany doustnie | produkt referencyjny podawany dożylnie (produkt - odniesienie) |
Maksymalne stężenie w osoczu (Cmax) [ng/ml] | 253,9 (28,5) | 323,6 (70,0)* |
Czas do wystąpienia maksymalnego stężenia w osoczu tmax [h] | 1,83 (1,10) | 0,24 (0,09) |
Pole powierzchni pod krzywą zależności stężenia od czasu (AUC) [h x ng/ml] | 1593 (326) | 1439 (386) |
biodostępność bezwzględna Fabs [%] | 106 (0,17) |
*5 minut po iniekcji
(wartości podawane jako wartości średnie i odchylenia standardowe)
Opierając się na porównaniu pól powierzchni AUC po/AUC iv. średnia biodostępność bezwzględna
skorygowana względem dawki wynosi 106% z zakresem 86%-134%.
Metoda statystyczna | Parametr | Estymator punktowy | 90% przedział ufności |
ANOVAln | AUC | 104,73 | 95,90 – 114,38 |
CV- ANOVA do oszacowania zmienności wewnątrzosobniczej dla prednizolonu wynosi dla AUC 13,08%.
Biodostępność względna
Biodostępność względna/biorównoważność 1 mg vs. 5 mg
W przeprowadzonym w 1990 roku na grupie 12 zdrowych mężczyzn randomizowanym, krzyżowym badaniu biodostępności względnej/biorównoważności porównywano pięć tabletek produktu referencyjnego po 1 mg względem jednej tabletki produktu referencyjnego 5 mg jako odniesienie, przy czym tabletki były przyjmowane rano ze standardowym śniadaniem.
Uzyskano następujące wyniki dla prednizolonu:
Parametr | pięć tabletek produktu referencyjnego po 1 mg | jedna tabletka produktu referencyjnego 5 mg |
Maksymalne stężenie w osoczu (Cmax) [ng/ml] | 133 (19) | 146 (23) |
Czas do wystąpienia maksymalnego stężenia w osoczu tmax [h] | 1,23 (1,28) | 1,23 (1,16) |
Pole powierzchni pod krzywą zależności stężenia od czasu (AUC) [h x ng/ml] | 791 (138) | 913 (300) |
(wartości podawane jako wartości średnie i odchylenia standardowe)
Opierając się na porównaniu AUC średnia biodostępność względna wynosi dla prednizolonu 85%.
Metoda statystyczna | Parametr | Estymator punktowy | 90% przedział ufności |
ANOVAln | AUC | 86,97 | 77,03 – 98,19 |
ANOVAln | Cmax | 91,08 | 81,09 – 102,29 |
CV- ANOVA do oszacowania zmienności wewnątrzosobniczej dla prednizolonu wynosi dla AUC 17,31%, dla Cmax – 15,70%.
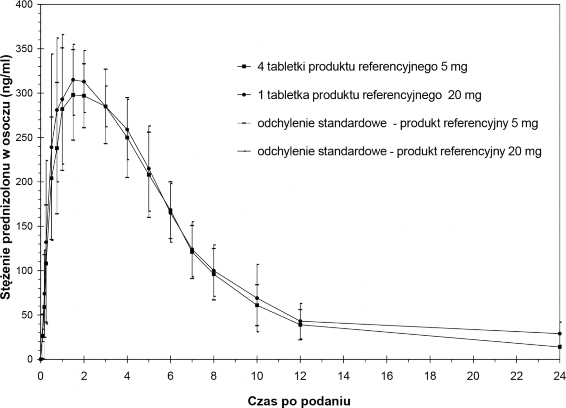
Biodostępność względna/biorównoważność 5 mg vs. 20 mg
W przeprowadzonym w 1992 roku na grupie 12 zdrowych mężczyzn randomizowanym podwójnie krzyżowym badaniu nad biodostępnością względną/biorównoważnością porównywano jedną tabletkę produktu referencyjnego 20 mg względem czterech tabletek produktu referencyjnego po 5 mg jako odniesienie, przy czym tabletki były przyjmowane rano ze standardowym śniadaniem.
Uzyskano następujące wyniki dla prednizolonu:
Parametr | tabletka produktu referencyjnego 20 mg | cztery tabletki produktu referencyjnego 5 mg |
Maksymalne stężenie w osoczu (Cmax) [ng/ml] | 339 (64) | 326 (36) |
Czas do wystąpienia maksymalnego stężenia w osoczu tmax [h] | 1,9 (0,9) | 1,9 (0,6) |
Pole powierzchni pod krzywą zależności stężenia od czasu (AUC) [h x ng/ml] | 2329 (490) | 2148,2 (358) |
(wartości podawane jako wartości średnie i odchylenia standardowe)
Opierając się na porównaniu AUC średnia biodostępność względna wynosi dla prednizolonu 108%.
Metoda statystyczna | Parametr | Estymator punktowy | 90% przedział ufności |
ANOVAln | AUC | 107,65 | 98,43 – 117,75 |
ANOVAln | Cmax | 103,01 | 95,40 – 111,21 |
CV- ANOVA do oszacowania zmienności wewnątrzosobniczej dla prednizolonu wynosi dla AUC 12,38%, dla Cmax – 11.88%.
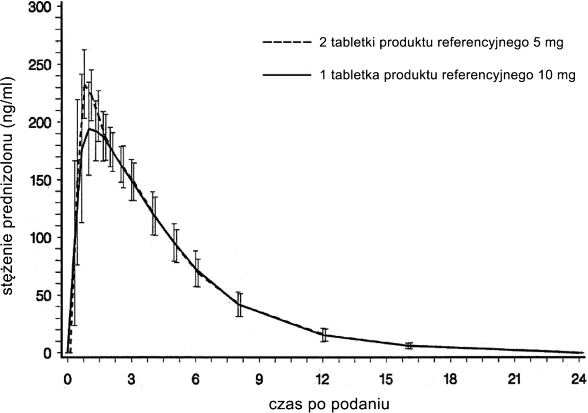
Biodostępność względna/biorównoważność 5 mg vs. 10 mg
W przeprowadzonym w 1999 roku na grupie 16 ochotników badaniu biodostępności względną/biorównoważności porównywano jedną tabletkę produktu referencyjnego 10 mg względem dwóch tabletek produktu referencyjnego 5 mg jako odniesienie uzyskując następujące wyniki:
Parametr | jedna tabletka produktu referencyjnego 10 mg | dwie tabletki produktu referencyjnego po 5 mg |
Maksymalne stężenie w osoczu (Cmax) [ng/ml] | 224,4 ± 29,4 | 242,1 ± 25,3 |
Czas do wystąpienia maksymalnego stężenia w osoczu tmax [h] | 1,132 ± 0,5 | 0,77 ± 0,23 |
Pole powierzchni pod krzywą zależności stężenia od czasu (AUC) [h x ng/ml] | 1101,4 ± 131,8 | 1132,8 ± 139,7 |
(wartości podawane jako wartość średnia i zakres rozpiętości)
Średnie stężenie w osoczu po przyjęciu tabletek produktu referencyjnego po 5 mg lub po 10 mg
Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, potencjalnego działania rakotwórczego oraz toksycznego wpływu na rozród nie ujawniają żadnego szczególnego zagrożenia dla człowieka.
Toksyczność ostra
W badaniach dotyczących toksyczności ostrej prednizolonu u szczurów wyznaczono wartość LD50 (zgon w przeciągu 7 dni) po jednokrotnym podaniu dawki 240 mg prednizolonu/kg masy ciała.
Toksyczność subchroniczna i po podaniu wielokrotnym
U szczurów, po dootrzewnowym podawaniu leku w dawce dobowej 33 mg/kg masy ciała przez 7 – 14 dni zaobserwowano zmiany widoczne w mikroskopie świetlnym i elektronowym w obrębie komórek wysp Langerhansa. U królików wywołano eksperymentalne uszkodzenie wątroby po podawaniu dawki dobowej
2 – 3 mg/kg masy ciała przez dwa do czterech tygodni. Odnotowano toksyczne działanie na tkanki w postaci martwicy mięśni po kilkutygodniowym stosowaniu dawki 0,5 – 5 mg/kg masy ciała u świnek morskich i
4 mg/kg masy ciała u psów.
Genotoksyczność i kancerogenność
Dostępne wyniki badań glikokortykosteroidów nie wskazują na jakiekolwiek klinicznie znaczące właściwości genotoksyczne.
Toksyczny wpływ na reprodukcję
W badaniach na zwierzętach prednizolon powodował rozszczep podniebienia u myszy, chomików i królików. Podczas pozajelitowego podawania, u szczurów pojawiały się nieznaczne nieprawidłowiści w obrębie czaszki, szczęki i języka. Obserwowano wewnątrzmaciczne zaburzenia wzrostu(patrz punkt 4.6).
Podczas stosowania dużych dawek prednizolonu przez dłuższy okres (30 mg na dobę przez co najmniej 4 tygodnie) obserwowano odwracalne zaburzenia spermatogenezy, które utrzymywały się jeszcze przez kilka miesięcy po odstawieniu leku.
Predasol, 10 mg, tabletki Skrobia ziemniaczana Laktoza jednowodna
Krzemionka koloidalna bezwodna Karboksymetyloskrobia sodowa typ A Magnezu stearynian
Predasol, 20 mg, tabletki
Laktoza jednowodna
Skrobia żelowana kukurydziana Celuloza mikrokrystaliczna Hypromeloza 2910 Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Talk
Magnezu stearynian
Nie dotyczy.
Predasol, 5 mg, tabletki: 18 miesięcy
Predasol, 10 mg, tabletki: 18 miesięcy
Predasol, 20 mg, tabletki: 5 lat
Nie przechowywać w temperaturze powyżej 25°C.
Blistry z folii PVC/PVDC/Aluminium w tekturowym pudełku.
Predasol, 5 mg, tabletki
Wielkości opakowań:
20, 60, 100 tabletek
Predasol, 10 mg, tabletki
Wielkości opakowań:
20, 30, 100 tabletek
Predasol, 20 mg, tabletki
Wielkości opakowań:
20, 30, 100 tabletek
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Brak szczególnych wymagań.
SUN-FARM Sp. z o.o.
ul. Dolna 21
05-092 Łomianki
Pozwolenie nr 24450 – Predasol, 5 mg, tabletki Pozwolenie nr 24451 – Predasol, 10 mg, tabletki Pozwolenie nr 24452 – Predasol, 20 mg, tabletki
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 13.12.2017











