Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Ciąża (patrz punkt 4.6)
Kobiety planujące zajście w ciążę (patrz punkt 4.6)
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Badania kliniczne:
Innymi działaniami niepożądanymi, które opisywano w badaniach klinicznych z użyciem produktu Epiduo, żel (adapalen 0,1% + benzoilu nadtlenek 2,5%), są podrażnieniowe kontaktowe zapalenie skóry (występujące często) i oparzenia słoneczne (występujące niezbyt często).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwi to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: +48 22 49 21 301
Faks: +48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Adapalen: adapalen jest stabilną chemicznie pochodną kwasu naftalenokarboksylowego o aktywności podobnej do retynoidów. Badania nad profilem biochemicznym i farmakologicznym adapalenu wykazały, że adapalen działa w patofizjologii trądziku pospolitego: jest silnym modulatorem różnicowania i keratynizacji komórek oraz wykazuje właściwości przeciwzapalne. Z mechanistycznego punktu widzenia adapalen wiąże się ze swoistymi receptorami jądrowymi kwasu retynowego. Aktualne dane wskazują, że miejscowe stosowanie adapalenu doprowadza do prawidłowego różnicowania komórek mieszkowych nabłonka, co prowadzi do zmniejszenia ilości mikrozaskómików. Adapalen hamuje chemotaktyczną (kierunkową) i chemokinetyczną (przypadkową) odpowiedź ludzkich leukocytów wielojądrzastych w modelach in vitro; hamuje również przemianę kwasu arachidonowego do mediatorów stanu zapalnego. Badania in vitro wykazały zahamowanie czynników AP-1 oraz ekspresji receptorów Toll-podobnych 2. Profil ten sugeruje, że adapalen osłabia komórkową komponentę zapalną w trądziku.
- Benzoilu nadtlenek: wykazano działanie przeciwdrobnoustrojowe benzoilu nadtlenku, szczególnie na bakterie Cutibacterium acnes, które występują w stanach patologicznych w mieszku łojowo-włosowym dotkniętym trądzikiem. Mechanizm działania benzoilu nadtlenku wyjaśniano jego dużą lipofilnością, która umożliwia jego przenikanie przez naskórek do błon komórkowych bakterii i keratynocytów w mieszku łojowo-włosowym. Benzoilu nadtlenek uważa się za bardzo skuteczny lek przeciwbakteryjny o szerokim spektrum w leczeniu trądziku pospolitego. Wykazano, że wywiera działanie bakteriobójcze poprzez wytwarzanie wolnych rodników, które utleniają białka i inne niezbędne składniki komórkowe w ścianie bakterii.
Minimalne stężenie hamujące benzoilu nadtlenku jest bakteriobójcze i wykazano jego działanie na antybiotykowrażliwe i antybiotykooporne szczepy C. acnes. Ponadto wykazano, iż benzoilu nadtlenek ma działanie złuszczające i keratolityczne.
Skuteczność kliniczna i bezpieczeństwo stosowania
Ocenę bezpieczeństwa i skuteczności produktu leczniczego Epiduo Forte stosowanego raz na dobę w leczeniu trądziku pospolitego przeprowadzono w trwającym 12 tygodni, wieloośrodkowym, randomizowanym, prowadzonym metodą podwójnie ślepej próby, kontrolowanym badaniu klinicznym porównującym działanie produktu leczniczego Epiduo Forte z działaniem podłoża żelu, z udziałem 503 pacjentów z trądzikiem. W tym badaniu 217 pacjentów leczono produktem Epiduo Forte, żel, 217 pacjentów leczono żelem zawierającym adapalen w stężeniu 0,1% + benzoilu nadtlenek w stężeniu 2,5% i 69 pacjentów – podłożem żelu.
Kryteria skuteczności były następujące:
odsetek powodzeń zdefiniowany jako udział procentowy pacjentów zakwalifikowanych jako
„wolny od trądziku” lub „prawie wolny od trądziku” po 12 tygodniach leczenia, z poprawą o co najmniej dwa stopnie wskaźnika ogólnej oceny przez lekarza (ang. Investigator’s Global Assessment, IGA). Wskaźnik IGA „wolny od trądziku” odpowiadał czystej skórze, bez zmian zapalnych czy niezapalnych. Wskaźnik IGA „prawie wolny od trądziku” odpowiadał obecności niewielkiej liczby rozproszonych zaskórników i niewielkiej liczby małych grudek.
Bezwzględna zmiana po 12 tygodniach leczenia w stosunku do stanu wyjściowego liczby zmian zapalnych i niezapalnych.
Podczas oceny początkowej u 50% pacjentów włączonych do badania nasilenie trądziku oceniano jako
„umiarkowane” (IGA=3), a u 50% jako „ciężkie” (IGA=4). W całej badanej populacji dozwolona była obecność maksymalnie dwóch guzków. Jeśli chodzi o liczbę zmian, u pacjentów było średnio obecnych po 98 zmian łącznie (zakres: 51–226), przy czym średnia liczba zmian zapalnych wynosiła 38 (zakres: 20–99), a średnia liczba zmian niezapalnych wynosiła 60 (zakres: 30–149). Pacjenci byli w wieku od 12 do 57 lat (średni wiek: 19,6 roku), przy czym 273 (54,3%) pacjentów było w wieku od 12 do 17 lat. Do badania włączono podobną liczbę mężczyzn (47,7%) i kobiet (52,3%).
W tym kluczowym badaniu u 55,2% pacjentów w grupie z chorobą o ciężkim nasileniu trądzik występował na tułowiu. Pacjenci stosowali produkt leczniczy na skórę twarzy i innych okolic ciała dotkniętych trądzikiem w miarę potrzeb, raz na dobę, wieczorem.
Przeprowadzono analizy statystyczne w celu porównania i zinterpretowania wyników badania w sposób stopniowany:
porównanie żelu Epiduo Forte z podłożem żelu w ogólnej populacji pacjentów z trądzikiem o nasileniu umiarkowanym i ciężkim (IGA=3 i IGA=4)
porównanie żelu Epiduo Forte z podłożem żelu w podgrupie pacjentów z trądzikiem o nasileniu ciężkim (IGA=4)
Badanie nie zostało zaplanowane i nie dawało możliwości do oficjalnego porównania skuteczności Epiduo Forte do niższej mocy adapalenu 0,1% + benzoilu nadtlenku 2,5%, ani do porównania mniejszej mocy adapalenu 0,1% + benzoilu nadtlenku 2,5% do podłoża żelu
p<0,001 w porównaniu do podłoża
p=0,029 w porównaniu do podłoża
p<0,001 w porównaniu do podłoża
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Epiduo Forte, 0,3% + 2,5%, żel
1 g żelu zawiera:
3 mg (0,3% w/w) adapalenu (Adapalenum) oraz benzoilu nadtlenek uwodniony, w ilości odpowiadającej 25 mg (2,5% w/w) benzoilu nadtlenku bezwodnego (Benzoylis peroxidum).
Substancja pomocnicza o znanym działaniu: glikol propylenowy (E1520) 40 mg/g (4,0%) Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Żel.
Biały lub bardzo bladożółty, nieprzejrzysty żel.
Produkt leczniczy Epiduo Forte jest wskazany do stosowania w miejscowym leczeniu trądziku pospolitego (Acne vulgaris) z zaskórnikami, licznymi grudkami i krostkami (patrz punkty 4.2 i 5.1).
Produkt leczniczy Epiduo Forte jest wskazany do stosowania u dorosłych i młodzieży od 12. roku życia.
Dawkowanie
Produkt leczniczy Epiduo Forte należy nanosić na cały obszar skóry twarzy i tułowia zajęty przez trądzik raz na dobę, wieczorem, na czystą i suchą skórę.
Czas trwania leczenia powinien być określony przez lekarza na podstawie stanu klinicznego pacjenta oraz odpowiedzi terapeutycznej na leczenie. Pierwsze objawy poprawy stanu klinicznego pojawiają się zazwyczaj między 1. a 4. tygodniem leczenia. Jeśli nie zostanie zaobserwowana poprawa po
4-8 tygodniach leczenia, należy ponownie rozważyć korzyści z kontynuacji.
Dostępny jest również produkt leczniczy Epiduo o mniejszej mocy dawki (Epiduo, 0,1% + 2,5%, żel), którego użycie rozważyć należy u pacjentów z trądzikiem o umiarkowanym nasileniu (patrz
punkt 5.1).
W przypadku pokrycia całej twarzy licznymi grudkami i krostkami, obserwowano zwiększone korzyści kliniczne u pacjentów leczonych produktem leczniczym Epiduo Forte (0,3% + 2,5%) w porównaniu z terapią referencyjną (Epiduo, 0,1% + 2,5%). Lekarz może dokonać wyboru pomiędzy dwoma stężeniami opierając się na aktualnym stanie klinicznym pacjenta oraz nasileniu objawów.
Specjalne grupy pacjentów Osoby w podeszłym wieku
Nie określono bezpieczeństwa stosowania i skuteczności produktu leczniczego Epiduo Forte u pacjentów w podeszłym wieku (65 lat i starszych).
Zaburzenia czynności nerek i wątroby
Nie badano stosowania produktu Epiduo Forte u pacjentów z zaburzeniami czynności nerek i wątroby.
Dzieci i młodzież
Nie badano bezpieczeństwa stosowania i skuteczności produktu leczniczego Epiduo Forte u dzieci w wieku poniżej 12 lat.
Sposób podawania
Tylko do stosowania na skórę.
Nanosić cienką warstwę żelu Epiduo Forte na zajęte obszary skóry na twarzy i (lub) tułowiu raz na dobę, po myciu. Nanieść ilość wielkości ziarna groszku na każdą okolicę twarzy (np. na czoło, brodę, każdy policzek), unikając oczu i warg (patrz punkt 4.4).
Pacjentom należy zalecić, aby myli ręce po nałożeniu produktu leczniczego. Kosmetyki można nakładać po wyschnięciu produktu leczniczego.
Jeśli wystąpi podrażnienie, pacjentowi należy zalecić stosowanie, odpowiednio do potrzeb, niekomedogennych produktów nawilżających, stosowanie produktu leczniczego z mniejszą częstością (np. co drugi dzień), tymczasowe przerwanie jego stosowania lub całkowite odstawienie go.
Produktu leczniczego Epiduo Forte nie należy nanosić na uszkodzoną skórę, skaleczenia lub otarcia, oparzenia słoneczne ani na skórę z wypryskiem.
Unikać kontaktu z oczami, wargami, ustami, nozdrzami czy błonami śluzowymi. Jeśli produkt leczniczy dostanie się do oka, należy je natychmiast przemyć ciepłą wodą.
W razie pojawienia się reakcji wskazującej na uczulenie na którykolwiek składnik produktu leczniczego Epiduo Forte należy przerwać jego stosowanie.
Unikać nadmiernego narażenia na promieniowanie słoneczne i promieniowanie UV.
Należy unikać kontaktu żelu Epiduo Forte z wszelkimi powierzchniami farbowanymi, np. z włosami lub tkaninami, ponieważ może on spowodować ich odbarwienie lub zmianę koloru.
Produkt leczniczy zawiera 40 mg glikolu propylenowego (E1520) w każdym gramie co odpowiada 4% w/w.
Nie określono bezpieczeństwa i skuteczności stosowania produktu leczniczego Epiduo Forte
u pacjentów z ciężkim trądzikiem guzkowym lub głębokim trądzikiem guzkowo-torbielowatym. Ponieważ u pacjentów z ciężkim trądzikiem guzkowym lub guzkowo-torbielowatym istnieje zwiększone ryzyko wystąpienia trwałych blizn wtórnie do zmian trądzikowych, nie zaleca się stosowania leku Epiduo Forte u takich pacjentów w związku z ryzykiem uzyskania niezadowalającej reakcji na leczenie.
Nie przeprowadzono badań dotyczących interakcji produktu leczniczego Epiduo Forte.
Na podstawie wcześniejszych doświadczeń z adapalenem i benzoilu nadtlenkiem można stwierdzić, że nie ma znanych interakcji z innymi produktami leczniczymi, które mogłyby być stosowane na skórę jednocześnie z produktem leczniczym Epiduo Forte. Nie należy jednak stosować produktu leczniczego Epiduo Forte jednocześnie z innymi retynoidami, benzoilu nadtlenkiem lub lekami o podobnym mechanizmie działania. Ostrożnie stosować kosmetyki złuszczające, podrażniające i wysuszające, ponieważ mogą działać podrażniająco podczas jednoczesnego stosowania z tym produktem leczniczym.
Wchłanianie adapalenu przez skórę ludzką jest niewielkie (patrz punkt 5.2), dlatego też wystąpienie interakcji z produktami leczniczymi o działaniu ogólnoustrojowym jest mało prawdopodobne.
Przenikanie benzoilu nadtlenku przez skórę jest niewielkie i jest on całkowicie metabolizowany do kwasu benzoesowego, który jest szybko eliminowany. Dlatego też zaistnienie potencjalnych interakcji kwasu benzoesowego z produktami leczniczymi o działaniu ogólnoustrojowym jest mało prawdopodobne.
Retynoidy stosowane doustnie mają związek z występowaniem wad wrodzonych. Retynoidy do stosowania miejscowego, jeśli są stosowane zgodnie z zaleceniami, ogólnie są uznawane za wywołujące małą ekspozycję układową, ze względu na minimalne wchłanianie przezskórne. Mogą jednak wystąpić indywidualne okoliczności (jak np. uszkodzona skóra, przedawkowanie), które przyczynią się do zwiększonej ekspozycji ogólnoustrojowej.
Ciąża
Epiduo Forte jest przeciwwskazany (patrz punkt 4.3) do stosowania u kobiet w ciąży oraz u kobiet planujących zajście w ciążę.
Brak danych lub istnieją tylko ograniczone dane dotyczące miejscowego stosowania adapalenu u kobiet w ciąży.
Badania na zwierzętach, w których podawano adapalen doustnie, wykazały szkodliwy wpływ na reprodukcję w przypadku stosowania dużych dawek o działaniu ogólnoustrojowym (patrz punkt 5.3).
Doświadczenia kliniczne ze stosowanym miejscowo adapalenem i nadtlenkiem benzoilu u kobiet w ciąży są ograniczone.
Jeśli produkt jest stosowany w trakcie ciąży, lub gdy pacjentka zajdzie w ciążę w trakcie przyjmowania leku, leczenie musi zostać przerwane.
Karmienie piersią
Nie przeprowadzono badań dotyczących przenikania produktu leczniczego Epiduo Forte do mleka zwierząt oraz ludzi po naniesieniu na skórę.
Na podstawie dostępnych danych farmakokinetycznych dotyczących szczurów stwierdzono przenikanie adapalenu do mleka po doustnym lub dożylnym podaniu adapalenu.
Nie można wykluczyć, że istnieje ryzyko dla dzieci karmionych piersią.
Decyzję o zaprzestaniu karmienia piersią lub o zaprzestaniu lub czasowym wstrzymaniu leczenia żelem Epiduo Forte należy podjąć po uwzględnieniu korzyści z karmienia piersią dla dziecka oraz korzyści z leczenia dla matki.
W okresie karmienia piersią, aby uniknąć narażenia dziecka na kontakt z produktem leczniczym Epiduo Forte, nie należy go nanosić na klatkę piersiową.
Płodność
Nie przeprowadzono badań z udziałem ludzi, dotyczących wpływu produktu leczniczego Epiduo Forte na płodność.
Nie stwierdzono jednak wpływu adapalenu czy benzoilu nadtlenku na płodność w badaniach dotyczących ich wpływu na reprodukcję u szczurów (patrz punkt 5.3).
Epiduo Forte nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Podsumowanie danych dotyczących bezpieczeństwa stosowania leku
Można się spodziewać wystąpienia działań niepożądanych na skórze u około 10% pacjentów. Do związanych z leczeniem działań niepożądanych, które były na ogół uznane za powiązane ze stosowaniem produktu Epiduo Forte, należą reakcje w miejscu aplikacji o nasileniu łagodnym lub umiarkowanym, takie jak podrażnienie skóry charakteryzujące się głównie łuszczeniem, suchością, rumieniem i paleniem/pieczeniem. Zaleca się zastosowanie kremu nawilżającego, tymczasowe zmniejszenie częstości aplikacji do nakładania produktu co drugi dzień lub tymczasowe przerwanie jego stosowania, aż będzie można powrócić do stosowania raz na dobę.
Reakcje te występują na ogół wcześnie w trakcie leczenia i zazwyczaj z czasem stopniowo ustępują.
Tabelaryczny wykaz działań niepożądanych
Działania niepożądane zostały sklasyfikowane według układów i narządów i częstości występowania, zgodnie z następująca konwencją: bardzo często: (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych) i zostały opisane po zastosowaniu produktu Epiduo Forte w badaniu klinicznym fazy 3., w którym jako produkt kontrolny zastosowano podłoże produktu (patrz tabela 1).
Tabela 1: Działania niepożądane
Klasyfikacja układów i narządów | Częstość występowania | Działania niepożądane |
Zaburzenia oka | Niezbyt często | Rumień powieki |
Nieznana* | Obrzęk powieki | |
Zaburzenia układu immunologicznego | Nieznana* | Reakcja anafilaktyczna |
Zaburzenia układu nerwowego | Niezbyt często | Parestezje (mrowienie w miejscu aplikacji) |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Nieznana* | Uczucie ucisku w gardle, duszność |
Zaburzenia skóry i tkanki podskórnej | Często | Atopowe zapalenie skóry, wyprysk, uczucie pieczenia skóry, podrażnienie skóry |
Niezbyt często | Suchość skóry, świąd, wysypka | |
Nieznana* | Alergiczne kontaktowe zapalenie skóry, obrzęk twarzy, ból skóry (piekący ból), pęcherzyki, przebarwienie skóry (nadmierne zabarwienie lub odbarwienie), pokrzywka, oparzenie w miejscu aplikacji** |
* Dane z obserwacji po dopuszczeniu do obrotu odnotowane w okresie począwszy od pierwszego na świecie wprowadzenia do obrotu produktu leczniczego Epiduo, 0,1% + 2,5%, żel, pochodzące z populacji o nieznanej wielkości.
**W większości przypadków „oparzenie w miejscu aplikacji” było powierzchowne, jednak notowano przypadki oparzenia drugiego stopnia lub ciężkiego oparzenia.
Działania niepożądane dotyczące skóry były częstsze przy stosowaniu Epiduo Forte (adapalen 0,3% + benzoilu nadtlenek 2,5%) niż przy Epiduo (adapalen 0,1% + benzoilu nadtlenek 2,5%) w porównaniu do podłoża. W głównych badaniach (patrz punkt 5.1) działania niepożądane związane ze skórą
wystąpiły u 9,2% badanych w mieszanej populacji, leczonych Epiduo Forte oraz u 3,7% w populacji leczonej Epiduo, w porównaniu z grupą u której zastosowano podłoże żelu – 2,9%.
Poza niektórymi z działań niepożądanych wymienionych powyżej opisywano również występowanie innych działań niepożądanych po zastosowaniu produktu leczniczego Epiduo, żel
(adapalen 0,1% + benzoilu nadtlenek 2,5%), wcześniej dopuszczonego do obrotu produktu złożonego zawierającego adapalen i benzoilu nadtlenek:
Produkt leczniczy Epiduo Forte przeznaczony jest wyłącznie do stosowania raz na dobę na skórę. Nałożenie nadmiernej ilości produktu Epiduo Forte może spowodować nasilone podrażnienie.
W takim wypadku należy przerwać stosowanie produktu leczniczego i poczekać, aż zmiany na skórze ustąpią. W razie przypadkowego połknięcia produktu leczniczego należy zastosować odpowiednie leczenie objawowe.
Grupa farmakoterapeutyczna: leki przeciwtrądzikowe stosowane miejscowo, kod ATC: D10AD53 Mechanizm działania i właściwości farmakodynamiczne
Produkt Epiduo Forte zawiera dwie substancje czynne, których mechanizmy działania są różne, ale
wzajemnie dopełniające się.
Wyniki dotyczące skuteczności produktu leczniczego Epiduo Forte w połączonych populacjach pacjentów z trądzikiem o umiarkowanym i ciężkim nasileniu przedstawiono w tabeli 2.
Tabela 2: Skuteczność kliniczna w całej populacji: pacjenci z trądzikiem pospolitym
o umiarkowanym i ciężkim nasileniu po 12 tygodniach (połączone wskaźniki IGA = 3 i 4, MI, populacja ITT)
Parametry skuteczności | Epiduo Forte, 0,3% + 2,5%, żel (N=217) | Adapalen 0,1% + benzoilu nadtlenek 2,5%, żel (N=217)a | Podłoże żelu (N=69) |
Odsetek powodzeń (poprawa o minimum 2 stopnie i wskaźnik IGA „wolny od trądziku” lub „prawie wolny od trądziku”) | 33,7%b | 27,3%c | 11,0% |
Zmiana liczby zmian zapalnych, średnie zmniejszenie bezwzględne (procentowe) | 27,8b (68,7%) | 26,5% (69,3%) | 13,2 (39,2%) |
Zmiana liczby zmian niezapalnych, średnie zmniejszenie bezwzględne (procentowe) | 40,5b (68,3%) | 40% (68,0%) | 19,7 (37,4%) |
MI= imputacja wielokrotna; ITT= populacja wyodrębniona zgodnie z zaplanowanym leczeniem (intent-to-treat)
W tabeli 3 przedstawiono wyniki podstawowych analiz skuteczności w populacji pacjentów z trądzikiem o ciężkim nasileniu.
Tabela 3: Skuteczność kliniczna u pacjentów z trądzikiem pospolitym o ciężkim nasileniu (wskaźnik IGA = 4, MI, populacja ITT)
Parametry skuteczności | Epiduo Forte, 0,3% + 2,5%, żel (N=106) | Adapalen 0,1% + benzoilu nadtlenek 2,5%, żel (N=112) | Podłoże żelu (N=34) |
Odsetek powodzeń (poprawa o minimum 2 stopnie i wskaźnik IGA „wolny od trądziku” lub „prawie wolny od trądziku”) | 31,9% a | 20,5% | 11,8% |
Zmiana liczby zmian zapalnych, średnie zmniejszenie bezwzględne (procentowe) | 37,3b (74,4%) | 30,2% (68%) | 14,3 (33,0%) |
Zmiana liczby zmian niezapalnych, średnie zmniejszenie bezwzględne (procentowe) | 46,3b (72,1%) | 43,9% (68,4%) | 17,8 (30,8%) |
MI= imputacja wielokrotna; ITT= populacja wyodrębniona zgodnie z zaplanowanym leczeniem (intent-to-treat)
Żel zawierający adapalen w stężeniu 0,1% oraz benzoilu nadtlenek w stężeniu 2,5% był uwzględniony w tym badaniu jako lek referencyjny. U pacjentów, u których trądzik oceniono jako mający
„umiarkowane” nasilenie (wskaźnik IGA 3), Epiduo Forte nie wykazało przewagi w skuteczności
w porównaniu do leczenia referencyjnego. W analizie obejmującej pacjentów z trądzikiem ocenionym jako mający „ciężkie” nasilenie (wskaźnik IGA 4) osiągnięto wyższą skuteczność w porównaniu do podłoża żelu z różnicą w leczeniu 20,1% (31,9% w porównaniu do 11,8%; 95% CI: [6,0%, 34,2%], p=0,029), czego nie osiągnięto podczas leczenia produktem referencyjnym (różnica w leczeniu w porównaniu do podłoża – 8,8%).
Działanie produktu leczniczego Epiduo Forte na blizny trądzikowe oceniono w badaniu OSCAR. Było to wieloośrodkowe, randomizowane, zaślepione dla badacza, kontrolowane podłożem badanie,
z zastosowaniem porównania wewnątrzosobniczego (prawa połowa twarzy vs. lewa połowa twarzy), w którym uczestniczyli mężczyźni i kobiety w wieku od 16 do 35 lat (n = 67), z trądzikiem pospolitym twarzy o nasileniu umiarkowanym do ciężkiego, z wynoszącą 40 średnią liczbą zmian trądzikowych (18 zmian zapalnych, 22 zmiany niezapalne) po obu stronach twarzy. U zdecydowanej większości pacjentów (93%), występował trądzik o ogólnie umiarkowanym nasileniu. Zmiany trądzikowe były równomiernie rozłożone po obu stronach twarzy, nasilenie występowania blizn trądzikowych obejmowało po 12 blizn po każdej stronie twarzy, z przewagą blizn o wymiarach od 2 do 4 mm.
U większości pacjentów (63%) występowały blizny o ogólnie łagodnym nasileniu, a u około 30% pacjentów występowały blizny o nasileniu umiarkowanym.
Do badania włączono mężczyzn i kobiety w wieku od 16 do 35 lat włącznie, z fototypem skóry typu od I do IV według skali Fitzpatricka.
Populacja włączona do badania składała się głównie z kobiet (65,7%), większość pacjentów stanowiły osoby rasy białej (86,6%), pozostałą część stanowili Azjaci (13,4%), pochodzenie etniczne nie zostało uwzględnione. Najczęściej występującymi fototypami skóry był typ II (47,8%) i typ III (34,3%),
a pozostałą część stanowił typ IV (13,4%) i typ I (4,5%).
Pacjenci włączeni do badania byli randomizowani do grupy stosującej produkt leczniczy Epiduo Forte na jednej połowie twarzy i podłoże żelu na drugiej połowie twarzy, raz na dobę, wieczorem, przez okres 24 tygodni. Pierwszorzędowym punktem końcowym oceny skuteczności była liczba zanikowych blizn trądzikowych, występujących na jednej połowie twarzy w 24 tygodniu badania.
Analiza pierwszorzędowego punktu końcowego wykazała, że stosowanie produktu leczniczego Epiduo Forte wiązało się ze zmniejszeniem całkowitej liczby blizn trądzikowych (patrz Tabela 4).
Tabela 4: Całkowita liczba blizn trądzikowych (ITT/LOCF)
Całkowita liczba blizn trądzikowych (ITT/LOCF) | Epiduo Forte | Podłoże żelu | Różnica w leczeniu | Wynik statystyczny |
Średnia ± SD Mediana (Q1, Q3) (Min, Max) | 9,5 ± 5,5 8,0 (6,0; 12,0) (0, 27) | 13,3 ± 7,4 13,0 (8,0; 19,0) (0, 36) | -3,7 ± 4,4 -3,0 (-7,0; 0,0) (-16, 3) | p<0,0001 |
Produkt leczniczy Epiduo Forte powodował przede wszystkim redukcję blizn o wielkości od 2 do 4 mm (średnia dla Epiduo Forte 9,0 ± 5,4; średnia dla podłoża żelu 12,1 ± 7,0; średnia różnica w leczeniu względem podłoża żelu -3,1 ± 4,1), podczas gdy redukcja blizn o wielkości > 4 mm była mniejsza (średnia dla Epiduo Forte 0,6 ± 0,8; średnia dla podłoża żelu 1,2 ± 1,9; średnia różnica w leczeniu względem podłoża żelu -0,6 ± 1,5).
Wykres 1 przedstawia zmianę procentową całkowitej liczby blizn zanikowych obserwowaną podczas oceny połówek twarzy na których stosowano produkt leczniczy Epiduo Forte i połówek twarzy na których stosowano podłoże żelu.
Wykres 1
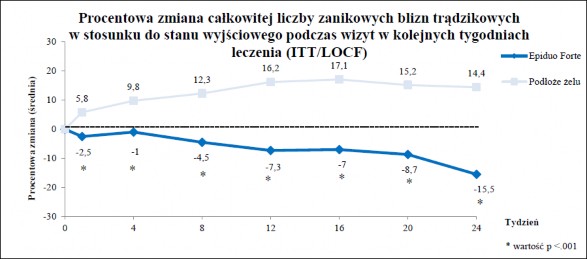
* nominalna wartość p, nieskorygowana dla wielokrotnych testów
Wchłanianie
Przeprowadzono badanie farmakokinetyki obejmujące podawanie produktu Epiduo Forte, żel
26 pacjentom w wieku dorosłym i młodzieńczym (od 12 do 33 lat) z ciężkim trądzikiem pospolitym. U pacjentów zastosowano leczenie polegające na aplikacji produktu leczniczego na wszystkie potencjalnie zajęte okolice w okresie 4 tygodni, w średniej dawce 2,3 grama/dobę (zakres:
1,6-3,1 grama/dobę) żelu Epiduo Forte nakładanego w postaci cienkiej warstwy na twarz, barki, górną część klatki piersiowej i górną część pleców. Po 4 tygodniach leczenia u 16 pacjentów (62%) stwierdzono mierzalne stężenie adapalenu w osoczu powyżej granicy oznaczalności (wartość LOQ 0,1 ng/ml), ze średnią wartością Cmax 0,16 ± 0,08 ng/ml i średnią wartością AUC0-24 h
2,49 ± 1,21 ng.h/ml. U pacjentów z największą ekspozycją wartości Cmax i AUC0-24 h adapalenu wynosiły odpowiednio 0,35 ng/ml i 6,41 ng.h/ml.
W badaniach farmakokinetycznych przeprowadzonych z żelami Epiduo i Epiduo Forte wykazano, że benzoilu nadtlenek nie wpływa na przezskórne wchłanianie adapalenu.
Przenikanie benzoilu nadtlenku przez skórę jest niewielkie; po nałożeniu na skórę jest on całkowicie przekształcany w kwas benzoesowy, który jest szybko eliminowany.
Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, fototoksyczności i działania rakotwórczego nie ujawniają żadnego szczególnego zagrożenia dla człowieka.
Przeprowadzono badania toksycznego działania adapalenu, podawanego doustnie i na skórę, na reprodukcję na szczurach i królikach. Wykazano działanie teratogenne przy wysokiej ekspozycji ogólnoustrojowej (dawki doustne od 25 mg/kg mc./dobę). W przypadku mniejszej ekspozycji na produkt leczniczy (podanie na skórę dawki 6 mg/kg mc./dobę) obserwowane były zmiany liczby żeber lub kręgów.
Badania produktu Epiduo lub Epiduo Forte przeprowadzone na zwierzętach obejmują badania tolerancji miejscowej oraz badania toksyczności dawki wielokrotnej podawanej na skórę u szczurów, psów i (lub) świń miniaturowych, trwające do 13 tygodni. Wykazano w nich miejscowe podrażnienie
i możliwość uczulenia, co jest zgodne z oczekiwaniami dotyczącymi złożonych produktów leczniczych zawierających benzoilu nadtlenek. Ekspozycja ogólnoustrojowa na adapalen po wielokrotnym nanoszeniu na skórę zwierząt produktu leczniczego złożonego zawierającego adapalen jest bardzo mała, co jest zgodne z klinicznymi danymi farmakokinetycznymi. W skórze benzoilu nadtlenek jest szybko i całkowicie metabolizowany do kwasu benzoesowego, który po wchłonięciu do organizmu jest wydalany z moczem, przy ograniczonej ekspozycji ogólnoustrojowej.
Toksyczność reprodukcyjna adapalenu była badana po podaniu doustnym u szczurów pod kątem wpływu na płodność.
Nie stwierdzono niekorzystnego wpływu na rozrodczość i płodność, przeżywalność miotu F1, wzrost i rozwój do odstawienia, a następnie wydajność reprodukcyjną po podaniu doustnym adapalenu w dawkach do 20 mg/kg mc./dobę.
Badanie toksyczności reprodukcyjnej i rozwojowej przeprowadzone na szczurach z zastosowaniem dawek doustnych nadtlenku benzoilu w wysokości do 1000 mg/kg/dobę (5 ml/kg), wykazało, że nadtlenek benzoilu nie wywołał teratogenności ani wpływu na funkcje rozrodcze w dawkach do 500 mg/kg mc./dobę.
Ocena ryzyka dla środowiska (ERA)
Badania oceniające ryzyko dla środowiska wykazały, że adapalen ma potencjalnie bardzo trwały i toksyczny wpływ na środowisko (patrz punkt 6.6).
Badania oceniające ryzyko dla środowiska wykazały, że adapalen może stwarzać ryzyko dla środowiska wodnego.
Disodu edetynian Sodu dokuzynian Glicerol Poloksamer 124
Glikol propylenowy (E1520)
Simulgel 600 PHA (kopolimer akryloamidu i sodu akryloilodimetylotaurynianu dyspersja 40% w izoheksadekanie, polisorbat 80, sorbitanu oleinian)
Woda oczyszczona
Nie dotyczy.
2 lata.
Po pierwszym otwarciu: 3 miesiące.
Nie przechowywać w temperaturze powyżej 25°C.
Produkt leczniczy Epiduo Forte jest dostarczany w dwóch rodzajach opakowań:
Tuba:
plastikowe tuby z korpusem z polietylenu wysokiej gęstości i z szyjką z polietylenu wysokiej gęstości, zamykane nakrętką z polipropylenu, o pojemności 2 g i 5 g.
Pojemnik hermetyczny wielodawkowy z pompką:
pojemnik hermetyczny wielodawkowy z pompką i zatrzaskiwanym wieczkiem o pojemności 15 g, 30 g, 45 g i 60 g, wykonany z polipropylenu i polietylenu wysokiej gęstości,.
lub
polipropylenu, polietylenu wysokiej gęstości i polietylenu bardzo niskiej gęstości. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Ten produkt leczniczy może stwarzać ryzyko dla środowiska (patrz punkt 5.3).
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Galderma Polska Sp. z o.o. ul. Puławska 145
02-715 Warszawa Polska
23639
22.12.2016 r. / 28.04.2021 r.
Maj 2023











