Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- Przeciwwskazania
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Nie dotykać końcówką dozownika żadnych powierzchni, aby uniknąć zakażenia roztworu.
Przeciwwskazania
nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1;
jaskra z wąskim kątem przesączania;
ciężka choroba układu krążenia (np. choroba tętnic wieńcowych serca lub nadciśnienie tętnicze);
guz chromochłonny nadnerczy;
rozrost gruczołu krokowego;
zaburzenia przemiany materii (np. nadczynność tarczycy, cukrzyca, porfiria);
stosowanie inhibitorów monoaminooksydazy (IMAO), trójpierścieniowych leków przeciwdepresyjnych lub innych leków, które mogą podwyższać ciśnienie tętnicze (patrz punkt 4.5);
u dzieci w wieku poniżej 2 lat.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Szczególne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Starazolin Free, 0,5 mg/ml, krople do oczu, roztwór
1 ml kropli do oczu zawiera 0,5 mg tetryzoliny chlorowodorku (Tetryzolini hydrochloridum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Krople do oczu, roztwór.
Przejrzysty, bezbarwny roztwór (pH 6,2 - 6,5; osmolalność 0,265 - 0,306 osmol/kg).
Zmniejszanie przekrwienia spojówek u pacjentów z niezakaźnym podrażnieniem oka, wywołanym np. przez dym, kurz, wiatr, chlorowaną wodę, światło lub reakcję alergiczną (np. katar sienny).
Starazolin Free krople do oczu, roztwór jest sterylnym roztworem, który nie zawiera środków konserwujących.
Dawkowanie
Dorośli i młodzież w wieku powyżej 12 lat
Jeśli nie przepisano inaczej, zalecaną dawką jest jedna kropla do każdego podrażnionego oka 2 do 3 razy na dobę.
Dzieci w wieku od 2 do 12 lat
Nie zaleca się stosowania tego produktu u dzieci w wieku od 2 do 12 lat bez wcześniejszej konsultacji z lekarzem.
Stosowanie produktu Starazolin Free jest przeciwwskazane u dzieci w wieku poniżej 2 lat (patrz punkt 4.3).
Osoby w podeszłym wieku
Brak danych na temat potrzeby zmniejszenia dawki u osób w podeszłym wieku.
Zaburzenia czynności nerek
Brak danych na temat potrzeby zmniejszenia dawki u pacjentów z zaburzeniami czynności nerek.
Zaburzenia czynności wątroby
Brak danych na temat potrzeby zmniejszenia dawki u pacjentów z zaburzeniami czynności wątroby.
Sposób podawania Podanie do oka.
Stosowanie tego produktu dłużej niż 72 godziny jest dozwolone wyłącznie pod nadzorem lekarza.
Informacje dla użytkowników soczewek kontaktowych
Nie należy stosować soczewek kontaktowych w przypadku choroby oczu.
W szczególnych przypadkach, gdy dozwolone jest noszenie soczewek kontaktowych, należy zdejmować je przed zastosowaniem tego produktu. Po zakropleniu produktu należy odczekać 15 minut przed ponownym włożeniem soczewek kontaktowych.
Instrukcja stosowania:
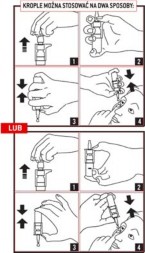
Nie wolno stosować produktu Starazolin Free krople do oczu, roztwór 0,5 mg/ml w następujących przypadkach:
Stosowanie u dzieci, jak również stosowanie w większych dawkach jest dozwolone wyłącznie pod nadzorem lekarza.
Oprócz jaskry z wąskim kątem przesączania, która stanowi ścisłe przeciwwskazanie do stosowania, u pacjentów z jaskrą innych typów stosowanie produktu jest dozwolone wyłącznie pod nadzorem lekarza i wymaga zachowania szczególnej ostrożności.
Nie zaleca się stosowania tego produktu w przypadku suchego zapalenia błony śluzowej nosa lub suchego zapalenia rogówki i spojówek.
Pacjenci z nadwrażliwością kontaktową na srebro w wywiadzie nie powinni stosować tego produktu, ponieważ krople mogą zawierać śladowe ilości srebra.
Pacjenci, którzy stosują Starazolin Free, muszą mieć świadomość, że podrażnienie lub zaczerwienienie oka jest często objawem poważnego schorzenia oka i powinni w związku z tym skonsultować się z okulistą.
Produkt Starazolin Free należy stosować wyłącznie w przypadku niewielkiego podrażnienia oczu. Jeśli w ciągu 48 godzin nie nastąpi poprawa lub podrażnienie i zaczerwienienie oczu utrzymują się, lub nasilają, należy natychmiast odstawić krople i skonsultować się z lekarzem.
Podrażnienie lub zaczerwienienie wynikające z ciężkiej choroby oka, np. zakażenia, obecności ciała obcego lub chemicznego uszkodzenia rogówki, również wymaga pilnej wizyty u lekarza.
W przypadku silnego bólu oka, bólu głowy, utraty wzroku, pojawienia się plam w polu widzenia, silnego, ostrego lub jednostronnego zaczerwienienia oka, bólu przy narażeniu na światło lub podwójnego widzenia należy natychmiast zgłosić się do lekarza.
Przedłużające się i nieprawidłowe podawanie większych niż zalecane dawek tego produktu (lub nadużywanie produktu) może prowadzić do przekrwienia reaktywnego (zaczerwienienia) spojówki i błony śluzowej nosa (polekowego zapalenia błony śluzowej nosa).
Należy unikać długotrwałego stosowania, szczególnie u dzieci.
Stosowanie produktu Starazolin Free może powodować przemijające rozszerzenie źrenic.
W szczególnych przypadkach, gdy dozwolone jest noszenie soczewek kontaktowych, należy zdejmować je przed zastosowaniem tego produktu. Po zakropleniu produktu należy odczekać 15 minut przed ponownym włożeniem soczewek kontaktowych (patrz punkt 4.2).
Jednoczesne stosowanie tego leku z inhibitorami MAO, np. tranylcyprominą lub trójpierścieniowymi lekami przeciwdepresyjnymi, a także z innymi lekami, które podwyższają ciśnienie tętnicze, może nasilać działanie zwężające naczynia krwionośne i podwyższać ciśnienie tętnicze. Należy więc unikać jednoczesnego stosowania tych leków.
Płodność
Brak danych dotyczących wpływu tego leku na płodność.
Ciąża
Nie ma danych dotyczących przenikania leku przez łożysko.
Należy unikać stosowania produktu podczas ciąży z powodu możliwych ogólnoustrojowych działań niepożądanych.
Karmienie piersią
Nie ma danych dotyczących przenikania leku do mleka kobiecego.
Należy unikać stosowania produktu w okresie karmienia piersią z powodu możliwych ogólnoustrojowych działań niepożądanych.
Po podaniu produktu zdolność prowadzenia pojazdów i obsługiwania maszyn może być zmniejszona z powodu niewyraźnego widzenia lub oślepiania przez światło (wynikającego z rozszerzenia źrenic).
Działania niepożądane w tabeli zaklasyfikowano według następującej konwencji: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do
<1/1000), bardzo rzadko (<1/10 000) oraz częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia oka | rzadko: rozszerzenie źrenic |
bardzo rzadko: keratynizacja (rogowacenie) nabłonka spojówki, prowadzące do zamknięcia kanalików łzowych i łzawienia spowodowanego zaburzeniami w odpływie łez po przedłużającym się stosowaniu tetryzoliny | |
częstość nieznana: podrażnienie spojówki, niewyraźne widzenie | |
Zaburzenia ogólne i stany w miejscu podania | często: nasilony obrzęk błony śluzowej oka (przekrwienie reaktywne), pieczenie błony śluzowej oka, suchość błony śluzowej oka, działania ogólnoustrojowe (np. kołatanie serca, |
ból głowy, drżenie, osłabienie, potliwość, podwyższone ciśnienie tętnicze, szybkie tętno) | |
częstość nieznana: pieczenie oczu i okolic oczu, rumień, podrażnienie, obrzęk, ból, świąd |
Dzieci i młodzież
Ryzyko wystąpienia objawów przedawkowania jest szczególnie duże u niemowląt i małych dzieci z powodu wchłaniania produktu wynikającego z jego połknięcia. Do głównych objawów należą: zaburzenia ośrodkowego układu nerwowego, takie jak podwyższone ciśnienie tętnicze, zaburzenia rytmu serca, tachykardia, tachyarytmia i reaktywna bradykardia.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nadmierne ogólnoustrojowe wchłanianie alfa-sympatykomimetycznych pochodnych imidazolu może prowadzić do depresji ośrodkowego układu nerwowego. Należy to szczególnie brać pod uwagę
w odniesieniu do dzieci.
Do objawów przedawkowania należą: rozszerzenie źrenic, sinica, gorączka, drgawki, tachykardia, zaburzenia rytmu serca, zatrzymanie czynności serca, nadciśnienie tętnicze, obrzęk płuc, zaburzenia oddychania i zaburzenia psychiczne.
Ponadto, w niektórych przypadkach, przedawkowanie może doprowadzić do zahamowania czynności ośrodkowego układu nerwowego, a w rezultacie do senności, obniżenia temperatury ciała, bradykardii, znacznego niedociśnienia tętniczego przypominającego stan wstrząsu, bezdechu i śpiączki.
Ryzyko wystąpienia objawów przedawkowania jest szczególnie duże w przypadku wchłaniania produktu po jego połknięciu. Może wtedy dojść do zaburzeń ośrodkowego układu nerwowego, depresji oddechowej lub zapaści krążeniowej.
Nawet 0,01 mg tetryzoliny na kilogram masy ciała należy uznać za dawkę toksyczną.
Postępowanie lecznicze w przypadku przedawkowania
Podać węgiel leczniczy, wykonać płukanie żołądka, podawać tlen, obniżyć temperaturę ciała i prowadzić terapię przeciwdrgawkową.
Stosowanie leków zwężających naczynia krwionośne jest przeciwwskazane u pacjentów z niedociśnieniem tętniczym.
W przypadku objawów antycholinergicznych należy podać odtrutkę, np. fizostygminę.
Grupa farmakoterapeutyczna: leki oftalmologiczne, sympatykomimetyki stosowane jako leki zmniejszające przekrwienie,
kod ATC: S01GA02.
Mechanizm działania:
Tetryzolina jest sympatykomimetykiem, który bezpośrednio stymuluje receptory alfa-adrenergiczne współczulnego układu nerwowego. Nie oddziałuje z receptorami beta-adrenergicznymi lub oddziaływanie to jest minimalne.
Jako sympatykomimetyk ma działanie zwężające naczynia krwionośne i zmniejszające przekrwienie.
Działanie zwężające naczynia krwionośne i zmniejszające przekrwienie tetryzoliny rozpoczyna się w ciągu kilku minut od podania miejscowego i utrzymuje się przez 4 do 8 godzin.
Nie da się wykluczyć wchłaniania ogólnoustrojowego po podaniu miejscowym u pacjentów z naruszoną błoną śluzową lub nabłonkiem.
Podczas badania klinicznego przeprowadzonego u 10 zdrowych ochotników stwierdzano mierzalne stężenia tetryzoliny w surowicy i w moczu po podaniu do oka dawek terapeutycznych.
Średni okres półtrwania tetryzoliny w surowicy wynosi około 6 godzin. Wchłanianie ogólnoustrojowe było zmienne wśród uczestników badania, a maksymalne stężenie w surowicy mieściło się w zakresie od 0,068 do 0,380 ng/ml. W 24. godzinie po podaniu u wszystkich uczestników badania stwierdzano mierzalne stężenia tetryzoliny w moczu.
Toksyczność miejscowa
Podawanie zbuforowanego (pH 5,5) roztworu tetryzoliny (0,25% i 0,5%) dwa razy na dobę przez pięć kolejnych dni nie spowodowało podrażnień oka u królików.
Toksyczność ostra
Wartość LD50 tetryzoliny po podaniu doustnym u myszy wynosi 420 mg/kg, a u szczura - 785 mg/kg masy ciała.
Toksyczność po podaniu wielokrotnym
U szczurów nie stwierdzano działań niepożądanych związanych z substancją czynną po kilku tygodniach doustnego podawania tetryzoliny w dawkach od 10 do 30 mg/kg masy ciała.
U małp rezus po podawaniu dożylnym tetryzoliny w dawkach od 5 do 10 mg/kg masy ciała przez 120 dni oraz po podawaniu doustnym w dawkach od 5 do 10 mg/kg masy ciała przez 32 tygodnie stwierdzono długotrwałe działanie uspokajające i senność.
Genotoksyczność i działanie rakotwórcze
Brak dostępnych wyników badań mutagenności i rakotwórczości.
Szkodliwy wpływ na reprodukcję
Nie badano tetryzoliny pod kątem szkodliwego wpływu na reprodukcję.
Sodu chlorek Kwas borowy Boraks
Woda oczyszczona
Nie dotyczy.
30 miesięcy.
Okres ważności po pierwszym otwarciu wynosi 28 dni. Przechowywać po pierwszym otwarciu w temperaturze poniżej 30C.
Przechowywać w temperaturze poniżej 30C.
Warunki przechowywania produktu leczniczego po pierwszym otwarciu, patrz punkt 6.3.
10 ml roztworu w białej plastikowej (HDPE) butelce (pojemność 10 ml) z pompką dozującą 3K (PP, HDPE, LDPE), nasadką ochronną (HDPE) i czerwonym aplikatorem (PP).
Jedna butelka w tekturowym pudełku.
Bez specjalnych wymagań.
Zakłady Farmaceutyczne POLPHARMA SA ul. Pelplińska 19
83-200 Starogard Gdański
Pozwolenie nr
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











