Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na substancję czynną, glikol propylenowy lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Rak piersi lub gruczołu krokowego, lub podejrzenie raka piersi lub gruczołu krokowego.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
używać do nakładania żelu aplikatora a nie rąk, aby zmniejszyć ryzyko wtórnej ekspozycji na testosteron,
w razie dotknięcia żelu rękami w trakcie jego nakładania, należy dokładnie umyć ręce wodą z mydłem po nałożeniu żelu,
zakryć miejsca aplikacji ubraniem po wyschnięciu nałożonego żelu,
wziąć prysznic przed wystąpieniem sytuacji, w której przewiduje się kontakt cielesny z inną osobą.
Dla osób, które nie są leczone produktem leczniczym Testavan:
w razie kontaktu z miejscem aplikacji żelu, które nie zostało umyte lub zakryte ubraniem, jak najszybciej umyć skórę wodą z mydłem w miejscach, na które testosteron mógł być przeniesiony.
zgłosić wystąpienie objawów nadmiernego wpływu androgenu na organizm, takich jak trądzik lub zmiany w owłosieniu.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Podsumowanie profilu bezpieczeństwa
Najczęściej zgłaszanymi działaniami niepożądanymi w badaniach klinicznych 2 fazy i 3 fazy trwających do 9 miesięcy były reakcje w miejscu podania (4%), w tym wysypka, rumień, świąd, zapalenie skóry, suchość skóry i podrażnienie skóry. Większość tych reakcji miała nasilenie od łagodnego do umiarkowanego.
Tabelaryczne podsumowanie działań niepożądanych
Działania niepożądane zgłaszane w badaniach klinicznych produktu leczniczego Testavan 2 fazy i 3 fazy wymienione są w tabeli poniżej. Wszystkie zgłoszone działania niepożądane
o prawdopodobnym związku z leczeniem wymienione są według klasyfikacji układów i narządów oraz zgodnie z następującą częstością: często (≥ 1/100 do < 1/10); niezbyt często ((≥ 1/1000
do < 1/100).
Działania niepożądane związane ze stosowaniem produktu leczniczego Testavan zgłoszone podczas badań klinicznych w więcej niż jednym przypadku (N=379)
Klasyfikacja układów i narządów MedDRA
Często
(≥ 1/100 do < 1/10)
Niezbyt często
(≥ 1/1000 do < 1/100)
Zaburzenia ogólne i stany w miejscu podania
Reakcje w miejscu aplikacji leku (w tym wysypka, rumień, świąd, zapalenie skóry, suchość skóry i podrażnienie skóry)
Badania diagnostyczne
Zwiększone stężenie trójglicerydów/
/hipertriglicerydemia, zwiększone stężenie PSA, zwiększony hematokryt
Zwiększone stężenie hemoglobiny
Zaburzenia naczyniowe
Nadciśnienie
Zaburzenia układu nerwowego
Ból głowy
Zgodnie z danymi z piśmiennictwa i spontanicznych doniesień dotyczących testosteronu w postaci żelu, inne znane działania niepożądane wymienione są w tabeli poniżej:
Klasyfikacja układów i narządów MedDRA
Działania niepożądane – Preferowany termin
Zaburzenia krwi i układu chłonnego
Policytemia, niedokrwistość
Zaburzenia psychiczne
Bezsenność, depresja, niepokój, agresja, nerwowość, wrogość
Zaburzenia układu nerwowego
Ból głowy, zawroty głowy, parestezje
Zaburzenia naczyniowe
Uderzenia gorąca (rozszerzenie naczyń krwionośnych), zakrzepica żył głębokich
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Duszność, bezdech we śnie
Zaburzenia żołądka i jelit
Nudności
Zaburzenia skóry i tkanki podskórnej
Różne reakcje skórne, w tym trądzik, łojotok, łysienie, pocenie się, nadmierne owłosienie
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Ból mięśniowo-szkieletowy, skurcze mięśni
Zaburzenia nerek i dróg moczowych
Problemy z oddawaniem moczu, niedrożność dróg moczowych
Zaburzenia układu rozrodczego i piersi
Ginekomastia, nasilona erekcja, zaburzenia jąder, oligospermia, łagodny rozrost gruczołu krokowego, zmiany popędu płciowego (leczenie dużymi dawkami testosteronu
często odwracalnie przerywa lub zmniejsza spermatogenezę, zmniejszając w ten sposób wielkość jąder; testosteronowa
terapia zastępcza hipogonadyzmu może w rzadkich przypadkach powodować trwałe, bolesne erekcje (priapizm), zaburzenia gruczołu krokowego, raka gruczołu krokowego*)
Zaburzenia ogólne i stany w miejscu podania
Osłabienie, złe samopoczucie, reakcje w miejscu podania
Wysokie dawki lub długotrwałe podawanie testosteronu zwiększa czasem występowanie zatrzymywania wody w organizmie i obrzęków; mogą wystąpić reakcje nadwrażliwości.
Badania diagnostyczne
Zwiększenie masy ciała, zwiększone stężenie PSA, zwiększony hematokryt, zwiększona liczba krwinek czerwonych, zwiększone stężenie hemoglobiny
Zaburzenia metabolizmu i odżywiania
Zmiany stężeń elektrolitów (retencja sodu, chlorków, potasu, wapnia, nieorganicznych fosforanów i wody) podczas
leczenia dużymi dawkami i (lub) długotrwałego leczenia.
Zaburzenia wątroby i dróg żółciowych
Żółtaczka i nieprawidłowe wyniki testów czynności wątroby
*) Dane dotyczące ryzyka raka gruczołu krokowego w związku z terapią testosteronem są niejednoznaczne.
Z uwagi na zawartość alkoholu, częste nakładanie produktu leczniczego na skórę może powodować podrażnienie i suchość skóry.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych: Aleje Jerozolimskie 181C, 02-222 Warszawa, Tel: +48 22 49 21 301, Fax: +48 22 49 21 309, e-mail:ndl@urpl.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Testavan, 20 mg/g, żel przezskórny
Jeden gram żelu zawiera 20 mg testosteronu. Jedno uruchomienie pompki dozującej uwalnia 1,15 g (1,25 ml) żelu, co odpowiada 23 mg testosteronu.
Substancja pomocnicza o znanym działaniu: 1 g żelu zawiera 0,2 g glikolu propylenowego. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Żel przezskórny.
Jednorodny, półprzezroczysty, lekko opalizujący żel.
Testosteronowa terapia zastępcza w hipogonadyzmie dorosłych mężczyzn, gdy niedobór testosteronu jest potwierdzony objawami klinicznymi i badaniami biochemicznymi.
Dawkowanie
Dorośli mężczyźni
Zalecana dawka początkowa produktu leczniczego Testavan wynosi 23 mg testosteronu
(1 uruchomienie pompki dozującej) jeden raz na dobę. Aby zapewnić prawidłowe dawkowanie, należy okresowo oznaczać stężenie testosteronu w surowicy krwi i dostosowywać dawkę w celu utrzymania stężenia testosteronu w surowicy krwi na poziomie eugonadalnym (patrz punkt 4.4).
Pomiaru stężenia testosteronu w surowicy krwi należy dokonywać 2 - 4 godziny po zastosowaniu produktu, około 14. i 35. dnia po rozpoczęciu leczenia lub po dostosowaniu dawki. Jeśli stężenie testosteronu w surowicy krwi jest mniejsze niż 17,3 nmol/l (500 ng/dl), dawkę dobową produktu leczniczego Testavan można zwiększyć o 1 uruchomienie pompki dozującej. Jeśli stężenie testosteronu w surowicy krwi jest większe niż 36,4 nmol/l (1050 ng/dl), dawkę dobową produktu leczniczego Testavan można zmniejszyć o 1 uruchomienie pompki dozującej.
Dostosowywanie dawki powinno opierać się na stężeniu testosteronu w surowicy krwi oraz obecności podmiotowych i przedmiotowych objawów związanych z niedoborem testosteronu.
Osoby w podeszłym wieku
Taka sama dawka jak dla dorosłych. Jednak należy brać pod uwagę, że fizjologicznie stężenia testosteronu ulegają zmniejszeniu wraz z wiekiem (patrz punkt 4.4).
Maksymalna zalecana dawka
Maksymalna zalecana dawka wynosi 69 mg testosteronu na dobę, co odpowiada 3 uruchomieniom pompki dozującej.
Pacjenci z zaburzeniami czynności nerek i wątroby
Nie podejmowano specjalnych badań w celu wykazania skuteczności i bezpieczeństwa stosowania
tego produktu leczniczego u pacjentów z zaburzeniami czynności nerek lub wątroby. Z tego względu testosteronową terapię zastępczą należy stosować w tej grupie pacjentów z zachowaniem ostrożności (patrz punkt 4.4). Po leczeniu produktem leczniczym Testavan stężenia testosteronu są podobne
u pacjentów z łagodną lub umiarkowaną niewydolnością nerek w porównaniu do pacjentów z normalną czynnością nerek (patrz punkt 5.2).
Kobiety
Testavan nie jest wskazany do stosowania u kobiet.
Dzieci i młodzież
Testavan nie jest wskazany do stosowania u dzieci i nie był poddawany ocenie klinicznej u mężczyzn w wieku poniżej 18 lat.
Sposób podawania Podanie przezskórne
Testavan jest żelem, który należy nakładać na górną część ramienia i bark za pomocą aplikatora. Należy pouczyć pacjentów, aby nie nakładali produktu leczniczego Testavan palcami ani rękami.
Przygotowanie (napełnienie) nowej pompki dozującej
W celu zapewnienia prawidłowego dawkowania należy pouczyć pacjenta, aby przed pierwszym użyciem każdej nowej pompki dozującej napełnił ją poprzez wciskanie do końca głowicy pompki
dozującej nad papierową chusteczką do czasu, aż pojawi się żel. Pierwszą porcję żelu oraz 2 następne porcje żelu należy odrzucić, a papierową chusteczkę wyrzucić z zachowaniem zasad bezpieczeństwa.
Podawanie
Testavan należy nakładać za pomocą aplikatora raz na dobę mniej więcej w tym samym czasie, najlepiej rano, na czystą, suchą, nienaruszoną skórę górnej części ramienia i barku. Jeśli Testavan nakładany jest na skórę brzucha lub uda, ilość wchłanianego testosteronu jest mniejsza i dlatego nie zaleca się zmiany miejsca nakładania żelu (patrz punkt 5.2).
W celu nałożenia żelu należy zdjąć osłonkę aplikatora i wcisnąć jeden raz do końca głowicę pompki dozującej nad główką aplikatora. Należy pouczyć pacjenta, żeby za jednym razem podawał na główkę aplikatora tylko jedną dawkę żelu (jedno uruchomienie pompki dozującej). Żel należy rozprowadzić aplikatorem równomiernie na możliwie największej powierzchni górnej części ramienia i barku,
uważając, aby nie dostał się na skórę rąk. Jeśli do uzyskania dawki dobowej potrzeba więcej niż jednego uruchomienia pompki dozującej, należy powtórzyć procedurę dla drugiego ramienia i barku.
Dawka | Metoda podawania |
23 mg (1 wciśnięcie pompki dozującej) | Zastosować jedną dawkę na górną część ramienia i bark. |
46 mg (2 wciśnięcia pompki dozującej) | Zastosować jedną dawkę na górną część ramienia i bark. Powtórzyć procedurę, aby zastosować jedną dawkę na górną część drugiego ramienia i barku. |
Dawka | Metoda podawania |
69 mg (3 wciśnięcia pompki dozującej) | Zastosować jedną dawkę na górną część ramienia i bark. Powtórzyć procedurę, aby zastosować jedną dawkę na górną część drugiego ramienia i barku. Powtórzyć ponownie procedurę, aby zastosować jedną dawkę na górną część pierwszego ramienia i barku. |
Czyszczenie aplikatora
Po użyciu, aplikator należy oczyścić papierową chusteczką i z powrotem nałożyć osłonkę
zabezpieczającą na główkę aplikatora. Użytą papierową chusteczkę należy wyrzucić z zachowaniem zasad bezpieczeństwa, a produkt przechowywać w bezpiecznym miejscu niedostępnym dla dzieci.
Po podaniu
Należy pouczyć pacjenta, aby w przypadku dotknięcia żelu rękami podczas jego nakładania dokładnie umył ręce wodą z mydłem natychmiast po nałożeniu produktu leczniczego Testavan.
Należy pouczyć pacjenta, aby przed nałożeniem odzieży odczekał, aż miejsca nałożenia żelu całkowicie wyschną.
Pacjentowi należy zalecić odczekanie co najmniej 2 godziny przed prysznicem, kąpielą lub pływaniem, aby zapobiec zmniejszeniu wchłaniania testosteronu (patrz punkt 4.4).
Cały czas należy nosić ubrania zakrywające miejsca nałożenia żelu, aby zapobiec przypadkowemu przeniesieniu żelu na inne osoby.
Testavan należy stosować tylko wówczas, gdy rozpoznano hipogonadyzm i jeśli przed rozpoczęciem leczenia wykluczono inną etiologię odpowiedzialną za występujące objawy. Przed rozpoczęciem
jakiejkolwiek testosteronowej terapii zastępczej, w tym leczenia produktem Testavan, niedobór
testosteronu powinien przejawiać się wyraźnymi objawami klinicznymi (regresją drugorzędowych cech płciowych, zmianą w składzie ciała, osłabieniem, obniżeniem libido, zaburzeniami erekcji itd.) i powinien być potwierdzony dwoma oddzielnymi oznaczeniami testosteronu we krwi.
Przed rozpoczęciem testosteronowej terapii zastępczej wszyscy pacjenci muszą zostać poddani dokładnym badaniom, aby wykluczyć ryzyko istniejącego raka gruczołu krokowego.
U pacjentów poddawanych leczeniu testosteronem konieczne jest staranne i regularne kontrolowanie stanu gruczołu krokowego i piersi przy użyciu zalecanych metod [badanie palpacyjne przez odbyt oraz oznaczanie stężenia antygenu swoistego dla gruczołu krokowego (ang. Prostatic Specific Antigen
- PSA) w surowicy], co najmniej raz w roku. U pacjentów w podeszłym wieku i pacjentów z grupy podwyższonego ryzyka (z czynnikami klinicznymi lub rodzinnymi) kontrolę taką należy
przeprowadzać co najmniej dwa razy w roku.
Należy monitorować stężenie testosteronu w punkcie początkowym i regularnie podczas leczenia.
Lekarze powinni dostosowywać dawkowanie indywidualnie, aby zapewnić utrzymanie stężenia testosteronu na poziomie eugonadalnym. Niektóre objawy kliniczne, takie jak drażliwość, nerwowość, zwiększenie masy ciała i długotrwałe lub częste erekcje, mogą wskazywać na nadmierny wpływ
androgenu na organizm i wymagać dostosowania dawkowania.
Androgeny mogą przyspieszać rozwój bezobjawowego raka gruczołu krokowego i łagodnego rozrostu gruczołu krokowego.
Testavan należy stosować ostrożnie u pacjentów z rakiem obarczonych ryzykiem wystąpienia hiperkalcemii i związanej z nią hiperkalciurii, ze względu na przerzuty do kości. U pacjentów tych zaleca się regularne kontrolowanie stężenia wapnia w surowicy.
Testavan nie jest przeznaczony do leczenia niepłodności lub impotencji u mężczyzn.
Doświadczenie dotyczące bezpieczeństwa i skuteczności stosowania produktu leczniczego Testavan u pacjentów w wieku powyżej 65 lat jest ograniczone. Aktualnie nie ma konsensusu co do
specyficznych dla wieku wartości referencyjnych dla testosteronu. Należy jednak wziąć pod uwagę, że fizjologiczne stężenie testosteronu w surowicy zmniejsza się wraz z wiekiem.
Testosteron może powodować zwiększenie ciśnienia tętniczego krwi i dlatego produkt leczniczy Testavan należy stosować z zachowaniem ostrożności u mężczyzn z nadciśnieniem.
U pacjentów z ciężką niewydolnością serca, wątroby lub nerek lub chorobą niedokrwienną serca,
leczenie testosteronem może spowodować poważne powikłania w postaci obrzęków, przebiegających z zastoinową niewydolnością serca lub bez niej. W takim przypadku należy natychmiast przerwać leczenie.
Zaburzenia krzepnięcia:
Należy zachować ostrożność podczas stosowania testosteronu u pacjentów z trombofilią lub czynnikami ryzyka żylnej choroby zakrzepowo-zatorowej (VTE), ponieważ wyniki badań po
dopuszczeniu do obrotu i publikowane dane wykazały występowanie u tych pacjentów podczas
leczenia testosteronem incydentów zakrzepowych (np. zakrzepicy żył głębokich, zatorowości płucnej, zakrzepicy w oku). U pacjentów z trombofilią notowano przypadki VTE nawet podczas leczenia
przeciwzakrzepowego, dlatego po wystąpieniu pierwszego zdarzenia zakrzepowego należy dokładnie ocenić zasadność kontynuacji leczenia testosteronem. Jeśli leczenie to będzie kontynuowane, należy podjąć dalsze środki w celu zminimalizowania indywidualnego ryzyka VTE.
Testosteron należy stosować ostrożnie u pacjentów z chorobą niedokrwienną serca, padaczką i migreną, ponieważ choroby te mogą ulec nasileniu.
Publikowane są doniesienia o zwiększonym ryzyku bezdechu sennego u mężczyzn
z hipogonadyzmem leczonych estrami testosteronu, szczególnie u osób z czynnikami ryzyka, takimi jak otyłość lub przewlekła choroba układu oddechowego.
Jeśli u pacjenta wystąpi ciężka reakcja w miejscu podania leku, należy dokonać oceny leczenia i w razie potrzeby przerwać stosowanie leku.
U pacjentów otrzymujących długoterminowe leczenie androgenami należy również regularnie monitorować następujące parametry laboratoryjne: hemoglobinę i hematokryt, testy czynnościowe wątroby i profil lipidowy.
Produktu leczniczego Testavan nie należy stosować u kobiet ze względu na możliwe działania wirylizujące.
Ponieważ mycie po nałożeniu produktu leczniczego Testavan zmniejsza stężenie testosteronu, należy pouczyć pacjentów, aby nie myli się ani nie brali prysznica przez co najmniej 2 godziny po nałożeniu produktu leczniczego Testavan. Gdy mycie następuje w okresie do 2 godzin po nałożeniu żelu,
wchłanianie testosteronu może być zmniejszone.
Testavan zawiera glikol propylenowy, który może podrażniać skórę.
Produkty na bazie alkoholu, w tym Testavan, są łatwopalne; dlatego należy unikać ognia, płomienia i palenia papierosów do czasu, aż żel wyschnie.
Możliwość przeniesienia
Jeśli nie zostaną zachowane środki ostrożności, żel z testosteronem może zostać przeniesiony na inne osoby poprzez bezpośredni kontakt cielesny, powodując zwiększenie stężenia testosteronu w surowicy i możliwość wystąpienia działań niepożądanych [np. wzrost włosów na twarzy i (lub) ciele, trądzik, pogłębienie barwy głosu, zaburzenia cyklu miesiączkowego] w przypadku powtarzanego kontaktu (nieumyślna androgenizacja).
Lekarz powinien dokładnie poinformować pacjenta o ryzyku przeniesienia testosteronu oraz przekazać instrukcje dotyczące bezpieczeństwa (patrz poniżej). Produktu leczniczego Testavan nie należy
przepisywać pacjentom z dużym ryzykiem nieprzestrzegania zaleceń dotyczących zasad
bezpieczeństwa (np. z ciężkim alkoholizmem, uzależnieniem od narkotyków, ciężkimi zaburzeniami psychicznymi).
Przeniesienia unika się, nosząc ubranie zakrywające miejsca aplikacji leku lub biorąc prysznic przed kontaktem z inną osobą.
W związku z tym zaleca się następujące środki ostrożności:
Dla pacjenta:
W celu poprawienia bezpieczeństwa partnerki należy pouczyć pacjenta, aby nosił podczas kontaktu płciowego podkoszulek zakrywający miejsce nałożenia leku, lub aby wziął prysznic przed stosunkiem płciowym.
Ponadto, zaleca się noszenie podkoszulka zakrywającego miejsce nałożenia leku podczas kontaktów z dziećmi, aby uniknąć skażenia skóry dziecka.
Kobiety w ciąży muszą unikać jakiegokolwiek kontaktu z miejscami nałożenia produktu leczniczego Testavan. W przypadku, gdy partnerka jest w ciąży, pacjent musi ze wzmożoną uwagą przestrzegać środków ostrożności dotyczących stosowania leku (patrz punkt 4.6).
Należy ostrzec pacjentów, aby zminimalizowali stosowanie balsamów do ciała i produktów ochrony przeciwsłonecznej w miejscu aplikacji, w trakcie i zaraz po zastosowaniu żelu Testavan.
Wpływ na wyniki badań laboratoryjnych: Androgeny mogą zmniejszać stężenie globulin wiążących tyroksynę, powodując zmniejszenie stężenia tyroksyny całkowitej (T4) w surowicy i zwiększenie wychwytu żywicowego trójjodotyroniny (T3) i T4. Stężenie wolnych hormonów tarczycy pozostaje niezmienione i nie stwierdza się klinicznych oznak zaburzeń czynności tarczycy.
Gdy androgeny stosuje się jednocześnie z lekami przeciwzakrzepowymi, działanie przeciwzakrzepowe może się nasilać. Pacjenci otrzymujący doustne leki przeciwzakrzepowe wymagają ścisłego monitorowania ich wystandaryzowanego współczynnika czasu protrombinowego
(ang. International Normalized Ratio – INR), szczególnie w okresie rozpoczynania i kończenia terapii androgenem.
Jednoczesne podawanie testosteronu z hormonem adrenokortykotropowym (ACTH) lub kortykosteroidami może zwiększać prawdopodobieństwo wystąpienia obrzęków; dlatego leki te należy podawać ostrożnie, szczególnie u pacjentów z chorobami serca, nerek lub wątroby.
U pacjentów leczonych androgenami, u których po terapii zastępczej dochodzi do normalizacji stężenia testosteronu w osoczu, może nastąpić poprawa wrażliwości na insulinę.
Nie przeprowadzono badań dotyczących interakcji z balsamem do ciała i produktami ochrony przeciwsłonecznej.
Testavan jest wskazany do stosowania wyłącznie u mężczyzn.
Nie przeprowadzono badań klinicznych produktu leczniczego Testavan w celu oceny płodności u mężczyzn. Testavan może powodować odwracalną supresję spermatogenezy (patrz punkt 5.3).
Kobiety w ciąży powinny unikać kontaktu skóry z miejscami nałożenia produktu leczniczego Testavan (patrz punkt 4.4).
W przypadku, gdy nieumyta lub niezakryta ubraniem skóra, na którą nałożono produkt leczniczy Testavan, wejdzie w bezpośredni kontakt ze skórą kobiety w ciąży, całą okolicę kontaktu na skórze kobiety należy natychmiast umyć wodą z mydłem.
Testosteron może powodować wirylizację płodu.
Testavan nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
W badaniach klinicznych nie zgłoszono żadnego przypadku przedawkowania produktu leczniczego Testavan.
Objawy
Objawy kliniczne, takie jak drażliwość, nerwowość, zwiększenie masy ciała, wydłużone lub częste
erekcje, mogą wskazywać na nadmierną ekspozycję na androgen i dlatego należy dokonywać pomiaru stężenia testosteronu w surowicy krwi.
Leczenie
Leczenie przedawkowania obejmuje odstawienie produktu leczniczego Testavan i odpowiednie leczenie objawowe i podtrzymujące.
Grupa farmakoterapeutyczna: Androgeny, kod ATC: G03B A03
Testosteron i dihydrotestosteron (DHT), endogenne androgeny, odpowiadają za prawidłowy wzrost i rozwój męskich narządów płciowych oraz za zachowanie drugorzędowych cech płciowych.
W efekcie następuje wzrost i dojrzewanie gruczołu krokowego, pęcherzyków nasiennych, penisa
i moszny; rozwój męskiego typu owłosienia na twarzy, klatce piersiowej, okolicy pachowej i łonowej; powiększenie krtani, pogrubienie strun głosowych, zmiany w umięśnieniu i rozmieszczeniu tkanki tłuszczowej.
Niewystarczające wydzielanie testosteronu wynikające z niewydolności jąder, patologii w obrębie przysadki mózgowej, niedoboru gonadotropin lub hormonu uwalniającego hormon luteinizujący, powoduje hipogonadyzm oraz małe stężenie testosteronu w surowicy. Objawy związane z małą ilością testosteronu obejmują zmniejszony popęd seksualny z impotencją lub bez impotencji, uczucie
zmęczenia, utratę masy mięśniowej, nastrój depresyjny oraz regresję drugorzędowych cech płciowych.
Przywrócenie stężenia testosteronu do prawidłowych wartości może doprowadzić w miarę upływu czasu do poprawy masy mięśniowej, nastroju, pożądania seksualnego, libido i funkcji seksualnych, w tym sprawności seksualnej i liczby spontanicznych erekcji.
Podczas podawania egzogennego testosteronu zdrowym mężczyznom uwalnianie endogennego testosteronu może ulec zmniejszeniu poprzez hamowanie zwrotne przysadkowego hormonu
luteinizującego (LH). Przy dużych dawkach egzogennych androgenów osłabieniu może ulegać także spermatogeneza przez hamowanie wydzielania hormonu folikulotropowego (FSH).
Podawanie androgenów powoduje retencję sodu, azotu, potasu, fosforu oraz zmniejszenie wydalania wapnia z moczem. Istnieją doniesienia, że androgeny zwiększają anabolizm białek oraz zmniejszają katabolizm białek. Bilans azotowy poprawia się tylko przy wystarczającym spożyciu kalorii i białka. Istnieją doniesienia, że androgeny pobudzają wytwarzanie krwinek czerwonych poprzez zwiększenie produkcji erytropoetyny.
Testavan dostarcza fizjologiczne ilości testosteronu, które zapewniają stężenie krążącego testosteronu podobne do prawidłowego stężenia u zdrowych mężczyzn (tj. 300 - 1050 ng/dl). Testavan oceniano w wieloośrodkowym, otwartym, 120-dniowym badaniu klinicznym III fazy (badanie 000127), obejmującym 159 mężczyzn z hipogonadyzmem w wieku od 18 do 75 lat (średni wiek 54,1 lat),
w tym 77% mężczyzn rasy białej, 20% rasy czarnej, 2% rasy azjatyckiej i 1% rasy mieszanej. W badaniu III fazy, na końcu 90-dniowego okresu leczenia, podczas którego dawkę produktu leczniczego Testavan można było zwiększać w oparciu o całkowite stężenie testosteronu,
76,1% mężczyzn miało średnie stężenie testosteronu obserwowane przez okres 24 godzin (Cavg) na poziomie eugonadalnym (300 - 1050 ng/dl).
Profil średniego stężenia testosteronu w 90. dniu przedstawiony jest na Wykresie 1, natomiast parametry farmakokinetyczne testosteronu całkowitego w 90. dniu podsumowane są dla każdej dawki produktu leczniczego Testavan w Tabeli 1.
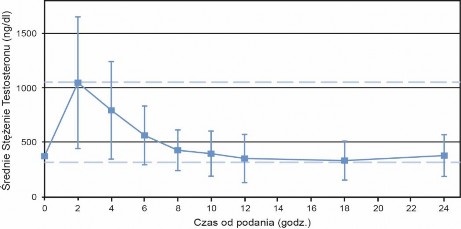
Wykres 1. Średnie (±SD) stężenie testosteronu w surowicy w 90. dniu po dostosowaniu dawki produktu leczniczego Testavan
Tabela 1. Parametry farmakokinetyczne testosteronu całkowitego w 90. dniu badania po dostosowaniu dawki, badanie 000127 pełna analiza
Testavan Dawka w 90. dniu | N | Cmin (ng/dl) Średnie ±SD | Cavg (ng/dl) Średnie ±SD | Cmax (ng/dl) Średnie ±SD | Tmax (h) Mediana |
23 mg | 5 | 191 ± 49 | 368 ± 121 | 721 ± 254 | 4,02 |
Testavan Dawka w 90. dniu | N | Cmin (ng/dl) Średnie ±SD | Cavg (ng/dl) Średnie ±SD | Cmax (ng/dl) Średnie ±SD | Tmax (h) Mediana |
46 mg | 45 | 277 ± 140 | 506 ± 207 | 1228 ± 640 | 2,02 |
69 mg | 89 | 229 ± 82 | 438 ± 164 | 1099 ± 595 | 2,08 |
Cmin: minimalne stężenie; Cavg: średnie stężenie w ciągu 24 godzin; Cmax: maksymalne stężenie; Tmax: czas do osiągnięcia maksymalnego stężenia; SD: odchylenie standardowe
Wchłanianie
Testavan zapewnia przezskórne dostarczanie testosteronu, z medianą Tmax wynoszącą około
2-4 godziny po podaniu. Stężenia całkowitego testosteronu powracają do wartości sprzed podania dawki po około 12 godzinach po podaniu, i nie dochodzi do akumulacji po codziennym podawaniu przez 10 dni. Aplikacja żelu na skórę górnej części ramienia i barku prowadzi do uzyskania większego stężenia testosteronu w surowicy w porównaniu do aplikacji na skórę brzucha lub wewnętrznej strony uda. Średnie Cmax wynosiło odpowiednio 926, 451 i 519 ng/dL, a średnie Cavg odpowiednio 557, 372
i 395 ng/dL.
Wyniki badania 2 fazy pokazują, że stężenie całkowitego testosteronu zwiększało się wraz ze zwiększaniem dawki po codziennym stosowaniu 23, 46 i 69 mg produktu leczniczego Testavan.
Dystrybucja
Krążący testosteron występuje w surowicy przeważnie w postaci związanej z globuliną wiążącą hormony płciowe (ang. sex hormone-binding globulin, SHBG) i albuminami. Związana z albuminą frakcja testosteronu łatwo dysocjuje z kompleksu z albuminą i jest uważana za frakcję aktywną
biologicznie. Frakcja testosteronu związana z SHBG nie jest uważana za frakcję aktywną biologicznie. Około 40% testosteronu w osoczu jest związane z SHBG, 2% pozostaje w postaci niezwiązanej (wolnej), a pozostała część jest związana z albuminami i innymi białkami.
Metabolizm
W piśmiennictwie podawane są bardzo zróżnicowane wartości okresu półtrwania testosteronu, w zakresie od 10 do 100 minut.
Testosteron jest metabolizowany do różnych 17-ketosteroidów dwiema różnymi drogami. Głównymi aktywnymi metabolitami testosteronu są estradiol i dihydrotestosteron (DHT).
Eliminacja
Około 90% testosteronu podanego domięśniowo jest wydalane z moczem w postaci koniugatów
testosteronu i jego metabolitów z kwasem glukuronowym i siarkowym; około 6% dawki jest wydalane z kałem, głównie w postaci niesprzężonej.
Wpływ kąpieli pod prysznicem
Kąpiel pod prysznicem 1 i 2 godziny po zastosowaniu produktu leczniczego Testavan, zmniejszała Cavg odpowiednio o 19,2% i 14,3% w porównaniu z pacjentami, którzy nie brali prysznica po zastosowaniu produktu leczniczego Testavan. Kąpiel pod prysznicem 6 godzin po zastosowaniu produktu leczniczego Testavan nie powodowała zmniejszenia Cavg.
Czynność nerek
Cavg i Cmax testosteronu było podobne u pacjentów z prawidłową czynnością nerek i u pacjentów
z łagodnymi i umiarkowanymi zaburzeniami czynności nerek. Brak danych dotyczących pacjentów z ciężką niewydolnością nerek.
Badania toksykologiczne nie ujawniły innych działań niż te, które można wyjaśnić na podstawie profilu hormonalnego produktu leczniczego Testavan.
Badania płodności u gryzoni i naczelnych wykazały, że leczenie testosteronem może upośledzać płodność samców poprzez hamowanie spermatogenezy w sposób zależny od dawki.
W badaniach in vitro z zastosowaniem modelu mutacji powrotnych (test Amesa) lub linii komórek jajnika chomika chińskiego stwierdzono, że testosteron nie ma działania mutagennego. U zwierząt laboratoryjnych zaobserwowano związek między leczeniem androgenami i niektórymi postaciami raka. Dane z badań na szczurach wykazały zwiększoną częstość występowania raka gruczołu krokowego po leczeniu testosteronem.
Wiadomo, że hormony płciowe ułatwiają rozwój pewnych typów nowotworów wywoływanych przez znane czynniki rakotwórcze. Nie stwierdzono powiązania pomiędzy tymi ustaleniami a rzeczywistym ryzykiem u ludzi.
Etanol (96%) Glikol propylenowy
Glikolu dietylenowego monoetylowy eter Karbomer 980
Trolamina Disodu edetynian
Woda oczyszczona
Nie dotyczy.
3 lata
Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego.
Testavan dostarczany jest w pojemniku wielokrotnego dawkowania składającym się z pompki dozującej z laminowanym woreczkiem foliowym w butelce i jest wyposażony w aplikator
z higienicznym wieczkiem. Pompka zbudowana jest z polipropylenu, monomeru etylenowo-propylenowo-dienowego i stali nierdzewnej, a woreczek jest laminatem
polietylenu/tereftalanu polietylenu/aluminium/polietylenu umieszczonym w sztywnej butelce z polipropylenu.
Produkt dostępny jest w opakowaniu z jednym pojemnikiem lub trzema (3x1) pojemnikami wielokrotnego dawkowania.
Jedna pompka dozująca zawiera 85,5 g żelu Testavan i umożliwia podanie 56 odmierzonych dawek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
The Simple Pharma Company Limited Ground Floor, 71 Lower Baggot St Dublin D02 P593
Irlandia
24670
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 12 kwietnia 2018











