Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMER(Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
nadwrażliwość na glimepiryd, inne pochodne sulfonylomocznika lub sulfonamidy lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1,
cukrzyca typu I,
śpiączka cukrzycowa,
kwasica ketonowa,
ciężkie zaburzenia czynności nerek lub wątroby. W przypadku ciężkich zaburzeń czynności nerek lub wątroby, wymagana jest zamiana leczenia na insulinę.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
niechęć lub (częściej u pacjentów w podeszłym wieku) niezdolność do współpracy z lekarzem,
niedożywienie, nieregularne przyjmowanie posiłków, pomijanie posiłków, poszczenie,
brak równowagi pomiędzy wysiłkiem fizycznym a ilością spożywanych węglowodanów,
zmiana diety,
spożywanie alkoholu, szczególnie z jednoczesnym pomijaniem posiłków,
zaburzenia czynności nerek,
ciężkie zaburzenia czynności wątroby,
przedawkowanie produktu leczniczego Glimepiride Aurovitas,
niektóre niekontrolowane schorzenia endokrynologiczne prowadzące do zaburzenia przemiany węglowodanów lub rozregulowania cukrzycy (np. niektóre zaburzenia czynności tarczycy oraz przedniego płata przysadki lub niewydolność kory nadnerczy),
jednoczesne przyjmowanie niektórych leków (patrz punkt 4.5).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
fenylobutazon, azapropazon oraz oksyfenbutazon,
insulina oraz doustne leki przeciwcukrzycowe, jak metformina,
salicylany oraz kwas p-aminosalicylowy,
steroidy anaboliczne i męskie hormony płciowe,
chloramfenikol, niektóre sulfonamidy o długotrwałym działaniu, tetracykliny, antybiotyki z
grupy chinolonów i klarytromycyna,
leki przeciwzakrzepowe z grupy pochodnych kumaryny,
fenfluramina,
dizopiramid,
fibraty,
inhibitory konwertazy angiotensyny,
fluoksetyna, inhibitory monoaminooksydazy,
allopurynol, probenecyd, sulfinpirazon,
sympatykolityki,
cyklo-, tro- i ifosfamid,
mikonazol, flukonazol,
pentoksyfilina (duże dawki podawane pozajelitowo),
trytokwalina.
Wskutek stosowania jednego z następujących produktów leczniczych może wystąpić osłabienie działania zmniejszającego stężenie cukru we krwi, prowadzące w niektórych przypadkach do zwiększenia stężenia cukru we krwi, na przykład:
estrogeny i progestageny,
saluretyki, diuretyki tiazydowe,
leki stymulujące tarczycę, glikokortykosteroidy,
pochodne fenotiazyny, chloropromazyna,
adrenalina i sympatykomimetyki,
kwas nikotynowy (w dużych dawkach) oraz pochodne kwasu nikotynowego,
leki przeczyszczające (długotrwałe stosowanie),
fenytoina, diazoksyd,
glukagon, barbiturany oraz ryfampicyna,
acetazolamid.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Szczególne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER(Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Glimepiride Aurovitas, 2 mg, tabletki Glimepiride Aurovitas, 3 mg, tabletki Glimepiride Aurovitas, 4 mg, tabletki
Jedna tabletka zawiera 2 mg glimepirydu. Jedna tabletka zawiera 3 mg glimepirydu. Jedna tabletka zawiera 4 mg glimepirydu.
Substancja pomocnicza o znanym działaniu:
Każda tabletka zawiera 157,50 mg laktozy jednowodnej. Każda tabletka zawiera 156,45 mg laktozy jednowodnej. Każda tabletka zawiera 155,35 mg laktozy jednowodnej.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka.
Glimepiride Aurovitas, 2 mg, tabletki:
Tabletki białe lub prawie białe, płaskie, podłużne, niepowlekane, z rowkiem dzielącym. Po jednej stronie, z obu stron rowka wytłoczone oznakowanie “Y” i “32”, druga strona gładka. Wymiary: 10 mm x 5 mm. Tabletkę można podzielić na równe dawki.
Glimepiride Aurovitas, 3 mg, tabletki:
Tabletki jasnożółte, płaskie, podłużne, niepowlekane, z rowkiem dzielącym. Po jednej stronie, z obu stron rowka wytłoczone oznakowanie “Y” i “33”, druga strona gładka. Wymiary: 10 mm x 5 mm.
Tabletkę można podzielić na równe dawki.
Glimepiride Aurovitas, 4 mg, tabletki:
Tabletki jasnoniebieskie lub prawie niebieskie, płaskie, podłużne, niepowlekane, z rowkiem dzielącym. Po jednej stronie, z obu stron rowka wytłoczone oznakowanie “Y” i “34”, druga strona gładka. Wymiary: 10 mm x 5 mm. Tabletkę można podzielić na równe dawki.
Produkt leczniczy Glimepiride Aurovitas jest wskazany do stosowania w leczeniu cukrzycy typu 2,
gdy dieta, ćwiczenia fizyczne oraz zmniejszenie masy ciała nie są wystarczająco skuteczne.
Podanie doustne.
Podstawą skutecznego leczenia cukrzycy jest właściwa dieta, regularne ćwiczenia fizyczne, jak również regularne badania krwi i moczu. Tabletki lub insulina nie są skuteczne, jeśli pacjent nie przestrzega zaleconej diety.
Dawkowanie
Dawkowanie zależy od wyników stężenia glukozy we krwi i moczu.
Początkowa dawka glimepirydu wynosi 1 mg na dobę. Jeśli taka dawka zapewnia dobrą kontrolę glikemii, należy ją przyjąć jako dawkę podtrzymującą.
Dla innego schematu dawkowania są dostępne produkty o innych mocach.
W przypadku braku zadowalającej kontroli, dawkę należy stopniowo zwiększać, na podstawie wyników kontroli glikemii, w odstępach 1-2 tygodniowych między kolejnymi wielkościami dawek, do osiągnięcia dawki dobowej 2, 3 lub 4 mg glimepirydu.
Tylko w wyjątkowych przypadkach dawka glimepirydu większa niż 4 mg na dobę daje lepsze wyniki terapeutyczne. Maksymalna zalecana dawka dobowa wynosi 6 mg glimepirydu.
U pacjentów, u których po podawaniu maksymalnej dawki dobowej metforminy nie uzyskano
zadowalającej skuteczności, można zastosować leczenie skojarzone z glimepirydem.
Utrzymując dawkę metforminy, należy rozpocząć podawanie glimepirydu od małych dawek, które w zależności od pożądanej kontroli stężenia glukozy zwiększa się, aż do maksymalnej dawki dobowej. Leczenie skojarzone powinno odbywać się pod ścisłą kontrolą lekarza.
U pacjentów, u których po zastosowaniu maksymalnej dawki dobowej produktu leczniczego Glimepiride Aurovitas nie uzyskano zadowalającej skuteczności, można w razie konieczności, rozpocząć jednoczesne leczenie insuliną. Utrzymując dawkę glimepirydu, należy rozpocząć podawanie insuliny od małych dawek, które stopniowo zwiększa się w zależności od pożądanej kontroli stężenia glukozy. Leczenie skojarzone powinno odbywać się pod ścisłą kontrolą lekarza.
Wystąpienie u pacjenta hipoglikemii po przyjęciu 1 mg produktu leczniczego Glimepiride Aurovitas
na dobę, oznacza możliwość kontrolowania glikemii wyłącznie za pomocą samej diety.
W czasie leczenia, gdy na skutek poprawy kontroli cukrzycy wzrasta wrażliwość na insulinę, zapotrzebowanie na glimepiryd może się zmniejszyć. Z tego względu, w celu uniknięcia hipoglikemii, należy rozważyć okresowe zmniejszenie dawki lub całkowite odstawienie produktu. Zmianę dawkowania należy także rozważyć w przypadku wystąpienia zmiany masy ciała lub trybu życia pacjenta oraz wystąpienia innych czynników zwiększających ryzyko hipo- lub hiperglikemii.
Zastąpienie innych doustnych leków przeciwcukrzycowych produktem leczniczym Glimepiride Aurovitas.
Możliwe jest dokonanie zmiany sposobu leczenia zastępując inne doustne leki przeciwcukrzycowe produktem leczniczym Glimepiride Aurovitas. W razie zmiany leku na produkt leczniczy Glimepiride Aurovitas należy wziąć pod uwagę dawkę oraz okres półtrwania poprzednio stosowanego leku. W przypadku niektórych leków, szczególnie leków przeciwcukrzycowych o długim okresie półtrwania (np. chlorpropamid), zaleca się zachowanie kilkudniowego okresu na wydalenie produktu, w celu zminimalizowania ryzyka hipoglikemii spowodowanego łącznym działaniem.
Zalecana dawka początkowa produktu leczniczego Glimepiride Aurovitas wynosi 1 mg/dobę. W zależności od reakcji na leczenie, dawka glimepirydu może być stopniowo zwiększana zgodnie z powyższymi zaleceniami.
Zastąpienie insuliny produktem leczniczym Glimepiride Aurovitas.
W wyjątkowych przypadkach, u pacjentów z cukrzycą typu 2 leczonych insuliną, wskazana może być zmiana leczenia na produkt leczniczy Glimepiride Aurovitas. Zmiana sposobu leczenia powinna odbywać się pod ścisłą kontrolą lekarza.
Szczególne grupy pacjentów
Pacjenci z zaburzeniami czynności nerek lub wątroby:
Patrz punkt 4.3.
Dzieci i młodzież:
Brak danych dotyczących stosowania glimepirydu u pacjentów w wieku poniżej 8 lat. Dane dotyczące bezpieczeństwa i skuteczności stosowania glimepirydu w monoterapii u dzieci od 8 lat i młodzieży są ograniczone (patrz punkt 5.1 i 5.2).
Ponieważ dostępne dane dotyczące bezpieczeństwa i skuteczności stosowania u dzieci i młodzieży są niewystarczające, nie zaleca się stosowania.
Sposób podawania
Zazwyczaj pojedyncza dawka dobowa glimepirydu jest wystarczająca. Zaleca się przyjmowanie leku na krótko przed lub w trakcie śniadania, lub gdy pominięto śniadanie na krótko przed pierwszym głównym posiłkiem.
W przypadku pominięcia dawki, nie należy jej korygować zwiększając następną dawkę. Tabletki należy połknąć popijając płynem, bez żucia.
Produkt leczniczy Glimepiride Aurovitas jest przeciwwskazany w następujących przypadkach:
Produkt leczniczy Glimepiride Aurovitas należy przyjmować na krótko przed lub w trakcie posiłku.
W przypadku nieregularnego spożywania posiłków lub pomijania posiłków, leczenie produktem leczniczym Glimepiride Aurovitas może prowadzić do hipoglikemii. Objawami hipoglikemii mogą być: bóle głowy, napady głodu, nudności, wymioty, znużenie, senność, zaburzenia snu, niepokój ruchowy, agresywność, osłabienie koncentracji, czujności i czasu reakcji, depresja, dezorientacja, zaburzenia mowy i widzenia, afazja, drżenie, niedowład, zaburzenia czucia, zawroty głowy, uczucie bezradności, utrata samokontroli, delirium, drgawki pochodzenia mózgowego, senność i utrata przytomności aż do stanu śpiączki włącznie, płytki oddech oraz bradykardia. Ponadto mogą wystąpić objawy zaburzenia regulacji układu adrenergicznego, takie jak: potliwość, wilgotna skóra, niepokój, częstoskurcz, nadciśnienie, palpitacje, dławica piersiowa oraz arytmie serca.
Obraz kliniczny wstrząsu hipoglikemicznego może przypominać udar.
Powyższe objawy można zazwyczaj kontrolować poprzez natychmiastowe podanie węglowodanów (cukru). Sztuczne środki słodzące nie są skuteczne.
Na przykładzie innych pochodnych sulfonylomocznika wiadomo, że pomimo początkowego osiągnięcia zamierzonej skuteczności, może wystąpić nawrót hipoglikemii.
Ciężka lub długotrwała hipoglikemia, kontrolowana tylko częściowo za pomocą zwykle stosowanych ilości cukru, wymaga natychmiastowej interwencji lekarza lub czasami hospitalizacji.
Czynniki mogące wpłynąć na rozwój hipoglikemii:
Leczenie produktem leczniczym Glimepiride Aurovitas wymaga regularnego kontrolowania stężenia
cukru we krwi i w moczu. Ponadto zaleca się oznaczanie wskaźnika glikozylowanej hemoglobiny.
W czasie leczenia produktem leczniczym Glimepiride Aurovitas wymagane jest regularne kontrolowanie czynności wątroby oraz obrazu krwi (szczególnie oznaczanie liczby leukocytów i płytek krwi).
W sytuacjach stresowych (np. wypadek, poważna operacja, infekcje ze stanem gorączkowym itp.) może być wskazana czasowa zmiana leku na insulinę.
Brak danych dotyczących stosowania produktu leczniczego Glimepiride Aurovitas u pacjentów z ciężkim zaburzeniem czynności wątroby oraz u pacjentów dializowanych. U pacjentów z ciężkim zaburzeniem czynności nerek lub wątroby wskazana jest zmiana leczenia na insulinę.
Leczenie pochodnymi sulfonylomocznika pacjentów z niedoborem G6PD może prowadzić do niedokrwistości hemolitycznej. Ponieważ glimepiryd należy do grupy pochodnych sulfonylomocznika, należy zachować ostrożność w przypadku pacjentów z niedoborem G6PD lub rozważyć zastosowanie alternatywnego produktu, który nie należy do tej grupy.
Produkt leczniczy Glimepiride Aurovitas zawiera laktozę.
Pacjenci z rzadko występującą dziedziczną nietolerancją galaktozy, całkowitym niedoborem laktazy
lub zespołem złego wchłaniania glukozy-galaktozy, nie powinni przyjmować tego produktu.
Produkt leczniczy Glimepiride Aurovitas zawiera sód
Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, co oznacza, że jest
zasadniczo „wolny od sodu”.
Jednoczesne przyjmowanie produktu leczniczego Glimepiride Aurovitas z niektórymi produktami leczniczymi może powodować zarówno nasilenie jak i osłabienie działania hipoglikemizującego glimepirydu. Dlatego też inne leki można przyjmować tylko za zgodą lub z przepisu lekarza.
Glimepiryd jest metabolizowany przez enzym cytochromu P450 2C9 (CYP2C9). Metabolizm glimepirydu może być zmieniony pod wpływem indukcji (np. ryfampicyny) lub zahamowania (np. flukonazolu) CYP2C9.
Wyniki z interakcji badanej in vivo opisane w literaturze wskazują, że podanie flukonazolu, jednego z najsilniejszych inhibitorów CYP2C9, powoduje około 2-krotne zwiększenie pola pod krzywą (AUC) glimepirydu.
Interakcje opisuje się na podstawie doświadczeń ze stosowaniem glimepirydu oraz innych pochodnych sulfonylomocznika.
Wskutek stosowania jednego z następujących produktów leczniczych może wystąpić nasilenie działania zmniejszającego stężenie cukru we krwi, prowadzące w niektórych przypadkach do hipoglikemii, na przykład:
Antagoniści receptora H2, leki blokujące receptory β-adrenergiczne, klonidyna oraz rezerpina mogą
powodować zarówno nasilenie jak i osłabienie działania hipoglikemizującego.
Pod wpływem działania leków sympatykolitycznych, takich jak leki blokujące receptory β-adrenergiczne, klonidyna, guanetydyna oraz rezerpina, osłabieniu lub zniesieniu może ulec kompensacyjna regulacja pochodzenia adrenergicznego.
Alkohol może nasilać lub osłabiać hipoglikemizujące działanie glimepirydu w sposób
nieprzewidywalny.
Glimepiryd może zarówno nasilać, jak i osłabiać działanie pochodnych kumaryny.
Kolesewelam wiąże się z glimepirydem i zmniejsza jego wchłanianie z układu pokarmowego. Nie zaobserwowano tej interakcji, gdy glimepiryd podawano co najmniej 4 godziny przed zastosowaniem kolesewelamu. Dlatego też, glimepiryd należy podawać co najmniej 4 godziny przed zastosowaniem kolesewelamu.
Ciąża
Ryzyko związane z cukrzycą
Nieprawidłowe stężenia glukozy we krwi w czasie ciąży wiążą się z większą częstością występowania wad wrodzonych i umieralności okołoporodowej. Dlatego należy monitorować stężenie glukozy we krwi przez cały okres ciąży, aby zmniejszyć ryzyko teratogenności. W takich przypadkach zaleca się stosowanie insuliny. Pacjentki, która planują ciążę, powinny poinformować o tym lekarza.
Ryzyko związane ze stosowaniem glimepirydu
Brak jest wystarczających danych dotyczących stosowania glimepirydu u kobiet w ciąży. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję, związany prawdopodobnie z działaniem farmakologicznym (hipoglikemia) glimepirydu (patrz punkt 5.3).
W związku z tym, nie zaleca się stosowania glimepirydu przez cały okres ciąży.
Jeżeli pacjentka leczona glimepirydem planuje ciążę lub zajdzie w ciążę, należy zastąpić jak
najszybciej ten sposób leczenia terapięą insuliną.
Karmienie piersią
Nie wiadomo, czy glimepiryd przenika do mleka ludzkiego. Glimepiryd przenika do mleka u szczurów. Ponieważ inne pochodne sulfonylomocznika przenikają do mleka matek karmiących oraz ze względu na ryzyko hipoglikemii u noworodków, nie zaleca się karmienia piersią podczas leczenia glimepirydem.
Płodność
Brak dostępnych danych dotyczących wpływu na płodność.
Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów i
obsługiwania maszyn.
Zdolność koncentracji i szybkość reakcji chorych na cukrzycę może ulec osłabieniu na skutek hipoglikemii lub hiperglikemii lub np. z powodu zaburzeń widzenia. Może to stwarzać zagrożenie w sytuacjach wymagających szczególnej koncentracji (np. prowadzenie pojazdu lub obsługiwanie maszyny).
Pacjenta należy poinformować, że w czasie prowadzenia pojazdów powinien unikać sytuacji mogących prowadzić do wystąpienia hipoglikemii. Ma to szczególnie znaczenie u pacjentów z niską świadomością lub brakiem świadomości o objawach ostrzegawczych hipoglikemii lub u których hipoglikemia występuje często. W takich przypadkach należy rozważyć, czy prowadzenie pojazdów lub obsługiwanie maszyn jest wskazane.
Następujące działania niepożądane stwierdzone w badaniach klinicznych w oparciu o doświadczenia ze stosowaniem glimepirydu i innych pochodnych sulfonylomocznika, zostały wymienione poniżej według klasyfikacji układów i narządów i według częstości występowania (bardzo często: 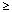 1/10, często:
1/10, często: 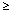 1/100 do < 1/10, niezbyt często:
1/100 do < 1/10, niezbyt często: 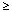 1/1 000 do < 1/100, rzadko:
1/1 000 do < 1/100, rzadko: 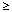 1/10 000 do < 1/1 000, bardzo rzadko: < 1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
1/10 000 do < 1/1 000, bardzo rzadko: < 1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia krwi i układu chłonnego
Rzadko: małopłytkowość, leukopenia, erytrocytopenia, granulocytopenia, agranulocytoza, niedokrwistość hemolityczna, pancytopenia, zazwyczaj ustępujące po przerwaniu leczenia
Częstość nieznana: ciężka trombocytopenia z liczbą płytek krwi poniżej 10 000/μl oraz plamica
małopłytkowa
Zaburzenia układu immunologicznego
Bardzo rzadko: leukoklastyczne zapalenie naczyń, łagodne reakcje nadwrażliwości, które mogą przybrać postać ciężką, z dusznością, spadkiem ciśnienia tętniczego krwi i czasem wstrząsem.
Częstość nieznana: nadwrażliwość krzyżowa na pochodne sulfonylomocznika, sulfonamidy lub
pokrewne substancje.
Zaburzenia metabolizmu i odżywiania Rzadko: hipoglikemia.
Reakcje hipoglikemiczne występują zazwyczaj natychmiast, mogą być ciężkie i nie zawsze są łatwe do wyrównania. Częstość występowania tych reakcji zależy, tak jak w przypadku innego leczenia hipoglikemizującego, od indywidualnych czynników, jak zwyczaje żywieniowe i dawkowanie (patrz dalsze informacje w punkcie 4.4).
Zaburzenia oka
Częstość nieznana: zaburzenia widzenia, które są przemijające i występują zwykle po rozpoczęciu leczenia, na skutek zmian stężenia glukozy we krwi.
Zaburzenia żołądka i jelit
Bardzo rzadko: nudności, wymioty, biegunka, ucisk lub uczucie pełności żołądka, ból brzucha, które rzadko powodują przerwanie leczenia.
Rzadko: zaburzenia smaku.
Zaburzenia wątroby i dróg żółciowych
Częstość nieznana: zwiększenie aktywności enzymów wątrobowych.
Bardzo rzadko: nieprawidłowa czynność wątroby (np. z cholestazą lub żółtaczką), zapalenie wątroby i niewydolność wątroby.
Zaburzenia skóry i tkanki podskórnej
Częstość nieznana: mogą wystąpić reakcje nadwrażliwości skórnej takie, jak świąd, wysypka oraz pokrzywka i nadwrażliwość na światło.
Rzadko: łysienie.
Badania diagnostyczne
Bardzo rzadko: zmniejszenie stężenia sodu w surowicy. Rzadko: zwiększenie masy ciała.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa,
tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy
W przypadku przedawkowania może wystąpić hipoglikemia trwająca od 12 do 72 godzin, która może nawrócić po początkowej poprawie. Objawy mogą nie uwidaczniać się w ciągu pierwszych 24 godzin od przyjęcia produktu. Zaleca się obserwację w szpitalu. Mogą wystąpić nudności, wymioty oraz ból nadbrzusza. Hipoglikemii zazwyczaj towarzyszą objawy neurologiczne, takie jak: niepokój ruchowy, drżenia, zaburzenia widzenia, zaburzenia koordynacji, senność, śpiączka oraz drgawki.
Postępowanie
Początkowo leczenie polega na ograniczeniu wchłaniania przez wywołanie wymiotów, a następnie podaniu wody lub lemoniady z węglem aktywowanym (adsorbent) oraz siarczanu sodu (środek przeczyszczający). W przypadku przyjęcia dużej dawki leku zaleca się płukanie żołądka, a następnie podanie aktywowanego węgla i siarczanu sodu. W przypadku przedawkowania o szczególnie ciężkim przebiegu zaleca się hospitalizację na oddziale intensywnej opieki medycznej. Należy rozpocząć, możliwie jak najszybciej, podawanie glukozy, w razie konieczności podaje się dożylnie (bolus) 50 ml 50% roztworu, a następnie 10% roztwór w postaci wlewu dożylnego, monitorując stężenie glukozy we krwi. Dalsze leczenie jest objawowe.
W szczególnych przypadkach leczenia hipoglikemii spowodowanej przypadkowym przyjęciem produktu leczniczego Glimepiride Aurovitas przez niemowlęta lub małe dzieci, dawka podawanej glukozy musi być starannie kontrolowana w celu uniknięcia niebezpieczeństwa hiperglikemii. Należy uważnie monitorować stężenie glukozy we krwi.
Grupa farmakoterapeutyczna: Doustne leki hipoglikemizujące, pochodne sulfonylomocznika, kod ATC: A10BB12.
Glimepiryd jest doustnym lekiem hipoglikemizującym, należącym do grupy pochodnych sulfonylomocznika. Może być stosowany w leczeniu cukrzycy insulinoniezależnej.
Działanie glimepirydu polega głównie na stymulowaniu wydzielania insuliny przez komórki beta trzustki.
Podobnie jak w przypadku innych pochodnych sulfonylomocznika, działanie to polega na zwiększeniu wrażliwości komórek beta trzustki na fizjologiczny bodziec, jakim jest glukoza. Ponadto glimepiryd działa pozatrzustkowo, co prawdopodobnie dotyczy również innych pochodnych sulfonylomocznika.
Leki z grupy pochodnych sulfonylomocznika wpływają na wydzielanie insuliny poprzez zamykanie kanałów potasowych wrażliwych na ATP w błonie komórek beta trzustki. Zamykanie kanałów potasowych powoduje depolaryzację w komórkach beta i prowadzi – poprzez otwarcie kanałów wapniowych – do zwiększonego napływu jonów wapnia do wnętrza komórki.
Prowadzi to do uwalniania insuliny w wyniku egzocytozy.
Glimepiryd wiąże się odwracalnie z białkiem błonowym komórek beta, związanym z zależnym
od ATP kanałem potasowym, ale miejsce wiązania różni się od tego jakie zwykle zajmują pochodne sulfonylomocznika.
Działanie pozatrzustkowe
Do działania pozatrzustkowego należy np. zwiększenie wrażliwości tkanek obwodowych na insulinę oraz zmniejszenie wychwytu insuliny przez wątrobę.
Wychwyt glukozy z krwi przez obwodowe tkanki mięśniowe i tłuszczowe odbywa się poprzez specjalne białka transportujące, znajdujące się w błonie komórkowej. Transport glukozy w tych tkankach stanowi etap ograniczający zużytkowanie glukozy. Glimepiryd bardzo szybko zwiększa liczbę aktywnych cząsteczek transportujących glukozę w błonie komórkowej mięśni i tkanki tłuszczowej, co powoduje zwiększony wychwyt glukozy.
Glimepiryd zwiększa aktywność fosfolipazy C specyficznej dla glikozylofosfatydyloinozytolu, która może być skorelowana z lipogenezą i glikogenezą wywoływaną przez leki w izolowanych komórkach mięśniowych i tłuszczowych.
Glimepiryd hamuje wytwarzanie glukozy w wątrobie poprzez zwiększanie wewnątrzkomórkowego stężenia fruktozo-2,6-bifosforanu, który z kolei hamuje glukoneogenezę.
Działanie ogólne
U osób zdrowych minimalna skuteczna doustna dawka terapeutyczna glimepirydu wynosi około
0,6 mg. Działanie glimepirydu zależy od dawki i jest powtarzalne. Reakcja fizjologiczna na ćwiczenia fizyczne, zmniejszone wydzielanie insuliny, występuje również w trakcie przyjmowania glimepirydu.
Nie stwierdzono istotnych różnic w działaniu leku podanego na 30 minut lub bezpośrednio przed posiłkiem. U pacjentów z cukrzycą, zadowalająca kontrola metaboliczna utrzymuje się przez całą dobę po podaniu pojedynczej dawki dobowej.
Pomimo że hydroksymetabolit glimepirydu powodował niewielkie, lecz znaczące zmniejszenie stężenia glukozy w surowicy zdrowych osób, jest w niewielkim stopniu odpowiedzialny za ogólne działanie produktu.
Leczenie skojarzone z metforminą
W jednym badaniu wykazano poprawę kontroli metabolicznej w leczeniu skojarzonym
z glimepirydem w porównaniu do leczenia tylko metforminą u pacjentów, u których kontrola maksymalną dawką dobową metforminy była niezadowalająca.
Leczenie skojarzone z insuliną
Dane dotyczące leczenia skojarzonego z insuliną są ograniczone. U pacjentów, u których nie można uzyskać kontroli maksymalną dawką glimepirydu, można rozpocząć leczenie skojarzone z insuliną.
W dwóch badaniach leczenie skojarzone przyniosło taką samą poprawę kontroli metabolicznej, jak insulina w monoterapii; jednakże w leczeniu skojarzonym potrzebne były mniejsze średnie dawki insuliny.
Szczególne grupy pacjentów
Dzieci i młodzież
Przeprowadzono badanie kliniczne kontrolowane aktywnym leczeniem (glimepiryd do 8 mg na dobę lub metformina do 2000 mg na dobę) trwające 24 tygodnie, do którego włączono 285 dzieci (wiek od 8 do 17 lat) z cukrzycą typu 2.
Zarówno w przypadku glimepirydu, jak i metforminy wykazano znaczące zmniejszenie wyjściowych wartości HbA1c (w przypadku glimepirydu zmniejszenie o 0,95 (SE 0,41); w przypadku metforminy
– o 1,39 (SE 0,40)). Jednakże, w przypadku glimepirydu nie osiągnięto kryteriów równoważności w stosunku do metforminy w aspekcie średniej zmiany w stosunku do wartości wyjściowej HbA14c. Różnica pomiędzy dwoma sposobami leczenia wynosiła 44% na korzyść metforminy. Górny zakres (1,05) 95% przedziału ufności dla tej różnicy nie zawierał się w zakresie równoważności, wynoszącej 0,3%.
Podczas leczenia glimepirydem nie było wątpliwości dotyczących bezpieczeństwa stosowania produktu u dzieci, w porównaniu do dorosłych pacjentów z cukrzycą typu 2. Brak danych dotyczących długoterminowego bezpieczeństwa i skuteczności stosowania u dzieci i młodzieży.
Wchłanianie
Biodostępność podanego doustnie glimepirydu jest całkowita. Przyjmowanie pokarmu nie ma istotnego wpływu na wchłanianie, może jedynie zmniejszyć się szybkość wchłaniania. Maksymalne stężenie leku w surowicy krwi (Cmax) jest osiągane w ciągu ok. 2,5 godziny po podaniu doustnym (średnie stężenie 0,3 µg/ml po wielokrotnym podawaniu 4 mg na dobę). Istnieje liniowa zależność pomiędzy dawką a Cmax oraz AUC (pole powierzchni pod krzywą zależności stężenia do czasu).
Dystrybucja
Glimepiryd ma bardzo małą objętość dystrybucji (około 8,8 litra), w przybliżeniu równą objętości dystrybucji albuminy, wysoki stopień wiązania z białkiem (> 99%), oraz niski klirens (około 48 ml/min).
U zwierząt glimepiryd jest wydzielany z mlekiem. Przenika przez łożysko. Przenikanie przez barierę
krew–mózg jest niewielkie.
Metabolizm i eliminacja
Średni okres półtrwania w surowicy, mający wpływ na stężenie leku w surowicy po podaniu wielokrotnym, wynosi około 5 do 8 godzin. Po podaniu dużych dawek, obserwowano nieznaczne wydłużenie okresu półtrwania.
Po podaniu pojedynczej dawki radioaktywnie znakowanego glimepirydu, 58% radioaktywności oznaczono w moczu, zaś 35% w kale. W moczu nie wykryto niezmienionej substancji. Zarówno w moczu, jak i w kale zidentyfikowano dwa metabolity, najprawdopodobniej pochodzące z przemian w wątrobie (głównym enzymem jest CYP2C9): pochodna hydroksylowa i pochodna karboksylowa. Po doustnym podaniu glimepirydu, końcowy okres półtrwania metabolitów wynosił odpowiednio 3 do 6 i 5 do 6 godzin.
Nie stwierdzono istotnych różnic w farmakokinetyce glimepirydu po podaniu jednorazowym i wielokrotnym, a różnice osobnicze były również niewielkie. Nie stwierdzono istotnej kumulacji produktu.
Szczególne grupy pacjentów
Farmakokinetyka była podobna u kobiet i mężczyzn oraz w grupie pacjentów młodych i w podeszłym wieku (powyżej 65 lat). U pacjentów z niskim klirensem kreatyniny obserwowano tendencję do zwiększania się klirensu glimepirydu oraz zmniejszania się średniego stężenia w surowicy krwi, prawdopodobnie na skutek szybszej eliminacji ze względu na mniejsze wiązanie z białkami. Wydalanie obu metabolitów przez nerki było zmniejszone. Nie należy przewidywać zwiększonego ryzyka kumulacji w tej grupie pacjentów.
Farmakokinetyka produktu u pięciu pacjentów po zabiegach chirurgicznych na drogach żółciowych, nie chorujących na cukrzycę, była podobna jak u osób zdrowych.
Dzieci i młodzież
Badanie po podaniu na czczo, które miało na celu określenie farmakokinetyki, bezpieczeństwa i tolerancji dawki 1 mg glimepirydu u 30 pacjentów pediatrycznych (4 dzieci w wieku od 10 do 12 lat i 26 dzieci w wieku od 12 do 17 lat) z cukrzycą typu 2 wykazało, że średnie AUC(0-last), Cmax i t ½ były podobne do wartości opisywanych u dorosłych.
Wyniki badań przedklinicznych zaobserwowane podczas stosowania dawek przewyższających maksymalne dawki stosowane u ludzi mają niewielkie zastosowanie w praktyce klinicznej lub wynikały z działania farmakodynamicznego (hipoglikemia) substancji czynnej. Wyniki te dotyczą typowych badań farmakologicznych bezpieczeństwa stosowania leku, badań toksyczności po podaniu wielokrotnej dawki, genotoksyczności, kancerogenności oraz wpływu na reprodukcję. Działania niepożądane (embriotoksyczność, teratogenność i wpływ na rozwój płodu) uważane były za wynik działania hipoglikemizującego substancji czynnej u samic i potomstwa.
Celuloza mikrokrystaliczna (PH-101)
Laktoza jednowodna
Powidon (K 25) Karboksymetyloskrobia sodowa (typ A) Magnezu stearynian
Żelaza tlenek żółty (E 172) [tylko dla 3 mg]
Indygotyna, lak aluminiowy (E 132) [tylko dla 4 mg]
Nie dotyczy.
3 lata.
Brak szczególnych środków ostrożności dotyczących przechowywania produktu leczniczego
Tabletki pakowane są w:
Blistry z PVC/PE/PVDC/Aluminium po: 15, 30, 50, 60, 90 i 120 tabletek, w tekturowym pudełku.
Butelka z HDPE z zamknieciem z PP: 500 tabletek, w tekturowym pudełku. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
DOPUSZCZENIE DO OBROTU
Aurovitas Pharma Polska Sp. z o.o. ul. Sokratesa 13D lokal 27
01-909 Warszawa
2 mg: 24609
3 mg: 24610
4 mg: 24611
Data wydania pierwszego Pozwolenia na dopuszczenie do obrotu: 2018-03-12
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
2021-05-17











