Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Przedstawiono wartości dla produktu gefitynib vs karboplatyna z paklitaksel.
„m” oznacza medianę w miesiącach. Liczby w nawiasach kwadratowych to 95% przedział ufności dla współczynnika ryzyka.
Przedstawiono wartości dla porównania gefitynib vs docetaksel
„m” oznacza medianę w miesiącach. Liczby w nawiasach kwadratowych to 96% przedział ufności dla przeżycia całkowitego
HR w całej populacji, w pozostałych przypadkach 95% przedziały ufności dla HR
przedział ufności w całości poniżej marginesu co najmniej równoważności (non-inferiority) wynoszącego 1,154 N liczba pacjentów zrandomizowanych
Przedstawiono wartości dla gefitynibu w porównaniu z placebo.
„m” oznacza medianę w miesiącach. Liczby w nawiasach kwadratowych to przedział ufności 95 %dla współczynnika ryzyka. c Stratyfikowany test log-rank dla całej populacji; w pozostałych przypadkach model proporcjonalnego ryzyka Coxa.
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
zanik nabłonka rogówki i ścieńczenie rogówki,
martwica brodawek nerkowych,
martwica komórek wątroby i nacieki eozynofilowe makrofagów w zatokach wątrobowych.
Dane z badań nieklinicznych (in vitro) wskazują, że gefitynib ma potencjalne działanie hamujące repolaryzację mięśnia serca (np. odcinek QT). Doświadczenie kliniczne nie wykazuje związku przyczynowego między wydłużeniem odstępu QT a gefitynibem.
U szczurów po dawce 20 mg/kg/dobę obserwowano zmniejszenie płodności samic.
Wyniki opublikowanych badań wskazują, że genetycznie modyfikowane myszy, u których brak jest ekspresji EGFR wykazują zaburzenia rozwojowe związane z niedojrzałością nabłonka w wielu narządach, w tym skórze, przewodzie pokarmowym i płucach. Gefitynib podawany szczurom w okresie organogenezy w największej dawce (30 mg/kg/dobę) nie wpływał na rozwój płodów, jednak u królików otrzymujących dawki 20 mg/kg na dobę i większe stwierdzono zmniejszoną masę ciała płodów. U żadnego z tych gatunków nie obserwowano występowania wad rozwojowych wywołanych przez podawany lek. Stosowany u szczurów w dawce 20 mg/kg na dobę w okresie ciąży i podczas porodu zmniejsza przeżycie nowo narodzonych szczurów.
Po doustnym podaniu, 14 dni po porodzie, karmiącym samicom szczura, znakowanego C-14 gefitynibu stwierdzano, że radioaktywność mleka była 11-19 razy większa niż krwi.
Gefitynib nie wykazuje działania genotoksycznego.
W trwającym 2-lata badaniu nad potencjalnym działaniem rakotwórczym przeprowadzonym na szczurach obserwowano małe, ale statystycznie znamienne zwiększenie częstości występowania gruczolaka wątroby u szczurów obu płci oraz naczyniakomięsaka krwionośnego węzłów krezki u samic szczura tylko po największej zastosowanej dawce (10 mg/kg/dobę). Występowanie gruczolaka wątroby obserwowano także u myszy w trwającym 2 lata badaniu, gdzie stwierdzono niewielkie zwiększenie częstości jego występowania u samców myszy po zastosowaniu średniej dawki, u myszy obu płci po zastosowaniu największej dawki. Działanie to osiągnęło poziom istotności statystycznej w grupie samic myszy, natomiast w grupie samców nie osiągnęło znamienności statystycznej. Dawki nie wywołujące zmian u szczurów ani myszy były poza zakresem ekspozycji klinicznej. Nie jest znane kliniczne znaczenie tych wyników.
Wyniki przeprowadzonego in vitro badania nad fototoksycznością wskazują, że gefitynib może mieć działanie fototoksyczne.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Gefitinib Stada, 250 mg, tabletki powlekane
Jedna tabletka zawiera 250 mg gefitynibu. Substancja pomocnicza o znanym działaniu:
Każda tabletka zawiera 163,5 mg laktozy (w postaci jednowodnej).
Każda tabletka zawiera 1,9 mg sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka powlekana.
Brązowe, okrągłe, dwuwypukłe tabletki powlekane (średnicy około 11 mm), z wytłoczonym na jednej stronie napisem G9FB 250.
Produkt Gefitinib Stada jest wskazany w monoterapii do leczenia dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP), miejscowo zaawansowanym lub z przerzutami, z uaktywnioną mutacją EGFR-TK (patrz punkt 4.4).
Leczenie produktem leczniczym Gefitinib Stada powinno być rozpoczęte i nadzorowane przez lekarza doświadczonego w stosowaniu leków przeciwnowotworowych.
Dawkowanie
Zalecana dawka produktu leczniczegoGefitinib Stada to 250 mg (jedna tabletka) raz na dobę. W przypadku pominięcia dawki leku, powinna ona zostać zażyta tak szybko jak pacjent sobie o tym przypomni. Jeśli czas do zastosowania następnej dawki jest krótszy niż 12 godzin, pacjent nie powinien zażywać pominiętej dawki.
Pacjent nie powinien zażywać podwójnej dawki (w tym samym czasie) w celu uzupełnienia pominiętej dawki.
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczegoGefitinib Stada u dzieci i młodzieży w wieku poniżej 18 lat. Gefitynib nie ma zastosowania u dzieci i młodzieży we wskazaniu do leczenia NDRP.
Zaburzenia czynności wątroby
U pacjentów z umiarkowaną do ciężkiej niewydolnością wątroby (stopień B lub C w skali Child-Pugh) z powodu marskości wątroby występuje zwiększone stężenie gefitynibu w osoczu. Należy dokładnie monitorować tych pacjentów ze względu na możliwość wystąpienia działań niepożądanych. Stężenie w osoczu
nie było zwiększone u pacjentów ze zwiększoną aktywnością aminotransferazy asparaginowej (AspAT), fosfatazy alkalicznej lub bilirubiny z powodu przerzutów w wątrobie (patrz punkt 5.2).
Zaburzenia czynności nerek
Nie ma konieczności zmiany dawki u pacjentów z zaburzeniami czynności nerek, jeśli wartość klirensu kreatyniny wynosi >20 ml/min. Dane dotyczące pacjentów z klirensem kreatyniny 20 ml/min są ograniczone, dlatego zaleca się zachowanie ostrożności w tej grupie pacjentów (patrz punkt 5.2).
Pacjenci w podeszłym wieku
Nie ma konieczności modyfikacji dawki w zależności od wieku pacjenta (patrz punkt 5.2).
Pacjenci o wolnym metabolizmie leku w mechanizmie angażującym cytochrom CYP2D6
Nie ma konieczności modyfikacji dawki produktu leczniczego u osób z genotypem CYP2D6 odpowiedzialnym za wolny metabolizm, jednak należy ściśle monitorować działania niepożądane u tych pacjentów (patrz punkt 5.2).
Modyfikacja dawki w zależności od toksyczności
U pacjentów źle tolerujących działania niepożądane produktu leczniczego, takie jak biegunka lub reakcje skórne, zaleca się krótką przerwę w leczeniu (do 14 dni) i ponowne rozpoczęcie leczenia produktem Gefitinib Stada w dawce 250 mg (patrz punkt 4.8). U pacjentów, którzy nie tolerują leczenia po przerwie w terapii, należy zaprzestać stosowania produktu i rozważyć inny sposób leczenia.
Sposób podawania
Tabletka może być zażywana niezależnie od posiłku, codziennie, mniej więcej o tej samej porze dnia. Tabletkę można połknąć w całości popijając wodą lub jeśli podawanie całej tabletki nie jest możliwe tabletka może być podana po rozpuszczeniu w wodzie (niegazowanej). Nie należy używać innych płynów. Tabletkę należy wrzucić do szklanki w połowie wypełnionej wodą, przy czym nie należy kruszyć tabletki. Można raz na jakiś czas zamieszać, aż tabletka się rozpuści (może to trwać do 20 minut). Zawiesinę należy wypić niezwłocznie po przygotowaniu (tj. w ciągu 60 minut). Szklankę należy ponownie napełnić do połowy wodą i wypić. Roztwór można podawać także przez sondę nosowo-żołądkową lub gastrostomię.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1. Karmienie piersią (patrz punkt 4.6).
Rozważając zastosowanie produktu leczniczego Gefitinib Stada w leczeniu NDRP zaawansowanego miejscowo lub z przerzutami, należy podjąć próbę oceny mutacji EGFR w tkance nowotworowej u wszystkich pacjentów. Jeżeli próbka guza nie nadaje się do oceny, wówczas można wykorzystać krążący DNA guza (ctDNA) uzyskany z próbki krwi (osocza).
W celu uniknięcia fałszywie ujemnych lub fałszywie dodatnich oznaczeń, należy korzystać tylko z pewnych, wiarygodnych i czułych testów o udowodnionej przydatności do ustalenia statusu mutacji EGFR w tkance guza lub ctDNA (patrz punkt 5.1).
Choroba śródmiąższowa płuc (ChŚP)
U 1,3% pacjentów otrzymujących gefitynib zaobserwowano wystąpienie śródmiąższowej choroby płuc (ChŚP). Początek choroby może być nagły, w niektórych przypadkach wystąpił zgon pacjenta (patrz punkt 4.8). W razie nasilenia się u pacjenta takich objawów, jak duszność, kaszel i gorączka, należy przerwać leczenie produktem Gefitinib Stada i natychmiast rozpocząć postępowanie diagnostyczne. Jeśli rozpoznano śródmiąższową chorobę płuc należy przerwać stosowanie produktu Gefitinib Stada i zastosować odpowiednie leczenie.
W badaniu farmakoepidemiologicznym przeprowadzonym w Japonii u 3159 pacjentów z niedrobnokomórkowym rakiem płuca otrzymujących gefitynib lub chemioterapię, obserwowanych przez 12 tygodni, stwierdzono następujące czynniki ryzyka wystąpienia choroby śródmiąższowej płuc niezależnie od tego czy pacjent otrzymywał gefitynib czy chemioterapię: palenie tytoniu, zły stan ogólny (PS>2), potwierdzone w tomografii komputerowej (CT) zmniejszenie ilości prawidłowego miąższu płucnego (≤ 50%), niedługi czas od rozpoznania NDRP (< 6 miesięcy), istniejąca wcześniej choroba śródmiąższowa płuc, starszy wiek (≥ 55 lat) i współistniejąca choroba serca. Zwiększone ryzyko wystąpienia ChŚP po zastosowaniu gefitynibu w porównaniu z chemioterapią występowało głównie podczas pierwszych 4 tygodni leczenia (skorygowana wartość OR 3,8; 95% CI 1,9 do 7,7), w późniejszym okresie względne ryzyko było mniejsze (skorygowana wartość OR 2,5; 95% CI 1,1 do 5,8). Ryzyko zgonu u pacjentów, leczonych gefitynibem lub chemioterapią, u których wystąpiła ChŚP było większe w grupie z następującymi czynnikami ryzyka: palenie tytoniu, potwierdzone w tomografii komputerowej (CT) zmniejszenie ilości prawidłowego miąższu płucnego (≤ 50%), istniejąca wcześniej choroba śródmiąższowa płuc, starszy wiek (≥ 65 lat), znaczne obszary w przyleganiu do opłucnej (≥ 50%).
Hepatotoksyczność i zaburzenia czynności wątroby
Często obserwowano nieprawidłowe wyniki badań diagnostycznych oceniających czynność wątroby (w tym zwiększenie aktywności aminotransferazy alaninowej, aminotransferazy asparaginowej, stężenia bilirubiny), rzadko obserwowaną patologią było zapalenie wątroby (patrz punkt 4.8). Istnieją pojedyncze doniesienia o niewydolności wątroby, w niektórych przypadkach zakończone zgonem.
Dlatego zaleca się okresową kontrolę czynności wątroby. Gefitynib należy stosować ostrożnie u pacjentów ze stwierdzonymi zmianami czynności wątroby o niewielkim lub umiarkowanym nasileniu. W przypadku poważnych zmian należy rozważyć przerwanie leczenia.
Wykazano, że zaburzenia czynności wątroby z powodu marskości wątroby prowadzą do zwiększenia stężenia gefitynibu w osoczu (patrz punkt 5.2).
Interakcje z innymi produktami leczniczymi
Substancje, które działają pobudzająco na aktywność izoenzymu CYP3A4, mogą zwiększać metabolizm gefitynibu i zmniejszać jego stężenie w osoczu. Dlatego, jednoczesne stosowanie substancji pobudzających CYP3A4 (np. fenytoiny, karbamazepiny, ryfampicyny, barbituranów i produktów ziołowych zawierających ziele dziurawca Hypericumperforatum) może zmniejszać skuteczność leczenia i należy go unikać (patrz punkt 4.5).
U niektórych pacjentów o genotypie CYP2D6 powodującym wolny metabolizm, leczenie silnym inhibitorem enzymu CYP3A4 może spowodować zwiększenia stężenia gefitynibu w osoczu. Podczas rozpoczynania leczenia inhibitorem enzymu CYP3A4, pacjenta należy ściśle monitorować pod kątem wystąpienia działań niepożądanych związanych z gefitynibem (patrz punkt 4.5).
U niektórych pacjentów przyjmujących jednocześnie warfarynę oraz gefitynib stwierdzano krwawienia i (lub) zwiększone wartości międzynarodowego współczynnika znormalizowanego (INR) (patrz punkt 4.5).
U pacjentów, którzy otrzymują jednocześnie warfarynę i gefitynib, należy systematycznie kontrolować wartości INR lub czasu protrombinowego (PT).
Produkty lecznicze, które powodują znaczne, trwałe zwiększenie pH soku żołądkowego, takie jak inhibitory pompy protonowej i antagoniści receptora H2 mogą zmniejszać biodostępność i stężenie gefitynibu w osoczu, a tym samym zmniejszać jego skuteczność. Leki zobojętniające podawane regularnie o tej samej porze dnia co gefitynib mogą mieć podobne działanie (patrz punkty 4.5 i 5.2).
Wyniki badania klinicznego fazy II z jednoczesnym zastosowaniem gefitynibu i winorelbiny wskazują, że gefitynib może nasilać neutropenię występującą po zastosowaniu winorelbiny.
Laktoza
Produkt leczniczyGefitinib Stada zawiera laktozę. Nie należy stosować tego leku u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, całkowitym niedoborem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
Dalsze środki ostrożności
Należy poinformować pacjenta o konieczności niezwłocznego skontaktowania się z lekarzem w razie wystąpienia ciężkiej lub utrzymującej się biegunki, nudności, wymiotów lub anoreksji, ponieważ mogą one pośrednio prowadzić do odwodnienia. W razie wystąpienia powyższych objawów należy zastosować właściwe leczenie (patrz punkt 4.8).
Pacjentów zgłaszających objawy przedmiotowe i podmiotowe sugerujące zapalenie rogówki, takie jak ostry epizod lub nasilenie: zmian zapalnych w obrębie oka, łzawienia, nadwrażliwości na światło, nieostrego widzenia, bólu i (lub) zaczerwienienia oka należy niezwłocznie kierować do okulisty.
W przypadku potwierdzenia wrzodziejącego zapalenia rogówki leczenie gefitynibem należy przerwać, a jeżeli objawy nie ustąpią lub powrócą po ponownym rozpoczęciu leczenia gefitynibem, należy rozważyć trwałe odstawienie gefitynibu.
W badaniu fazy I/II z zastosowaniem gefitynibu i leczenia napromienianiem u dzieci z noworozpoznanym glejakiem pnia mózgu lub po niecałkowitym usunięciu złośliwego glejaka nadnamiotowego, w grupie 45 pacjentów włączonych do badania stwierdzono 4 przypadki krwawienia do ośrodkowego układu nerwowego (w jednym przypadku wystąpił zgon). Kolejny przypadek krwawienia do ośrodkowego układu nerwowego stwierdzono u dziecka z wyściółczakiem, które brało udział w badaniu z zastosowaniem samego gefitynibu. Nie stwierdzono, aby u dorosłych pacjentów z NDRP otrzymujących gefitynib istniało zwiększone ryzyko krwawienia do ośrodkowego układu nerwowego.
U pacjentów przyjmujących gefitynib zgłaszano przypadki perforacji przewodu pokarmowego. W większości przypadków jest to skojarzone z innymi znanymi czynnikami ryzyka, w tym produktami towarzyszącymi, takimi jak steroidy lub produkty z grupy NLPZ, owrzodzeniem przewodu pokarmowego w wywiadzie, wiekiem, paleniem tytoniu lub przerzutami do jelita w miejscu perforacji.
Gefitynib jest metabolizowany przez izoenzym CYP3A4 (głównie) i izoenzym CYP2D6 układu cytochromu P450.
Substancje czynne, które mogą zwiększać stężenie gefitynibu w osoczu
Wyniki badań in vitro wykazują, że gefitynib jest substratem dla glikoproteiny-p (Pgp). Dostępne dane nie wskazują, aby obserwacje in vitro miały znaczenie kliniczne.
Substancje, które hamują cytochrom CYP3A4 mogą zmniejszać klirens gefitynibu. Jednoczesne stosowanie z silnymi inhibitorami aktywności CYP3A4 (np. ketokonazolem, pozakonazolem, worykonazolem, inhibitorami proteaz, klarytromycyną, telitromycyną) może zwiększać stężenie gefitynibu. Wzrost ten może mieć znaczenie kliniczne, ponieważ działania niepożądane są zależne od dawki i ekspozycji. Wzrost ten może być jeszcze większy u osób z genotypem odpowiedzialnym za wolny metabolizm przez izoenzym CYP2D6. Wcześniejsze leczenie itrakonazolem (silnym inhibitorem CYP3A4) powodowało u zdrowych ochotników zwiększenie średniej powierzchni pola pod krzywą (AUC) o 80%. W sytuacji jednoczesnego leczenia silnymi inhibitorami CYP3A4 należy ściśle obserwować pacjentów ze względu na możliwość wystąpienia działań niepożądanych po gefitynibie.
Brak danych klinicznych dotyczących jednoczesnego stosowania z inhibitorami CYP2D6, jednak silne inhibitory tego izoenzymu mogą powodować około 2-krotne zwiększenie stężenia gefitynibu u osób z szybkim metabolizmem przez cytochrom CYP2D6 (patrz punkt 5.2). Jeśli rozpoczyna się jednoczesne leczenie silnym
inhibitorem CYP2D6, należy ściśle obserwować pacjenta pod kątem możliwości wystąpienia działań niepożądanych.
Substancje czynne, które mogą zmniejszać stężenie gefitynibu w osoczu
Substancje, które indukują aktywność CYP3A4 mogą zwiększać metabolizm i zmniejszać stężenie gefitynibu w osoczu i w ten sposób zmniejszyć skuteczność gefitynibu. Należy unikać jednoczesnego stosowania produktów leczniczych indukujących CYP3A4 (np. fenytoiny, karbamazepiny, ryfampicyny, barbituranów lub ziela dziurawca (Hypericum perforatum)). Wcześniejsze leczenie ryfampicyną (silnie indukującą CYP3A4) powodowało u zdrowych ochotników zmniejszenie średniej powierzchni pola pod krzywą (AUC) o 83% (patrz punkt 4.4).
Produkty lecznicze, które powodują znaczne, trwałe zwiększenie pH soku żołądkowego mogą zmniejszać stężenie gefitynibu i tym samym zmniejszać skuteczność gefitynibu. Duże dawki krótko działających leków zobojętniających mogą mieć podobne działanie, jeśli są stosowane regularnie w porze zbliżonej do czasu zażywania gefitynibu. Jednoczesne stosowanie gefitynibu i ranitydyny w dawkach powodujących trwałe zwiększenie pH soku żołądkowego ≥ 5, u zdrowych ochotników powodowało zmniejszenie średniej powierzchni pola pod krzywą (AUC) dla gefitynibu o 47% (patrz punkty 4.4 i 5.2).
Substancje czynne, których stężenie w osoczu może być zmienione przez gefitynib
Badania in vitro wykazały, że gefitynib ma ograniczony wpływ hamujący na izoenzym CYP2D6. W badaniu klinicznym pacjentom podawano jednocześnie gefitynib i metoprolol (lek metabolizowany przez izoenzym CYP2D6). Zaobserwowano niewielkie zwiększenie ekspozycji na metoprolol (35%). Takie zwiększenie może mieć znaczenie w przypadku substancji o wąskim indeksie terapeutycznym, będących substratem izoenzymu CYP2D6. Kiedy rozważa się zastosowanie substratów dla izoenzymu CYP2D6 jednocześnie z gefitynibem, należy wziąć pod uwagę dostosowanie dawki substratu dla CYP2D6 zwłaszcza dla produktów o wąskim indeksem terapeutycznym.
Gefitynib in vitro hamuje białko transportujące BCRP, jednak znaczenie kliniczne tego działania jest nieznane.
Inne potencjalne interakcje
U niektórych pacjentów przyjmujących jednocześnie warfarynę stwierdzano krwawienia i (lub) zwiększone wartości międzynarodowego współczynnika znormalizowanego (INR) (patrz punkt 4.4).
Kobiety w wieku rozrodczym
Kobietom w wieku rozrodczym należy zalecić unikanie zajścia w ciążę w trakcie leczenia.
Ciąża
Brak danych dotyczących stosowania gefitynibu u kobiet w ciąży. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Potencjalne zagrożenie dla ludzi nie jest znane.
Produktu leczniczegoGefitinib Stada nie należy stosować u kobiet w ciąży, o ile nie jest to bezwzględnie konieczne.
Karmienie piersią
Nie wiadomo czy gefitynib przenika do mleka karmiących kobiet. Gefitynib i jego metabolity kumulowały się w mleku karmiących samic szczura (patrz punkt 5.3). Gefitynib jest przeciwwskazany w okresie
karmienia piersią i dlatego karmienie powinno być przerwane podczas leczenia gefitynibem (patrz punkt 4.3)
Podczas stosowania gefitynibu obserwowano występowanie osłabienia. Pacjenci, u których występuje ten objaw, powinni zachować ostrożność podczas prowadzenia pojazdów mechanicznych lub obsługiwania urządzeń mechanicznych.
Podsumowanie profilu bezpieczeństwa
Z łącznych danych pochodzących z badań klinicznych III fazy ISEL, INTEREST i IPASS (2462 pacjentów leczonych gefitynibem) wynika, że najczęściej zgłaszanymi działaniami niepożądanymi, stwierdzanymi u ponad 20% pacjentów, są biegunka i objawy skórne (w tym wysypka, trądzik, suchość skóry i świąd). Działania niepożądane występują zazwyczaj podczas pierwszego miesiąca leczenia i najczęściej są odwracalne. U około 8% pacjentów wystąpiły ciężkie działania niepożądane (3. lub 4. stopnia według Wspólnej Skali Toksyczności - Common Toxicity Criteria, CTC).
U około 3% pacjentów przerwano leczenie z powodu działań niepożądanych.
U 1,3% pacjentów wystąpiła choroba śródmiąższowa płuc, często ciężka (3. do 4. stopnia CTC). Stwierdzano przypadki zgonów.
Tabelaryczne zestawienie działań niepożądanych
Profil bezpieczeństwa przedstawiony w tabeli 1 opiera się na danych z zastosowania gefitynibu w badaniach klinicznych i po dopuszczeniu go do obrotu. Działania niepożądane przedstawione w tabeli 1 zostały podzielone według częstości występowania na podstawie łącznej analizy zgłoszeń porównywalnych działań niepożądanych z badań ISEL, INTEREST i IPASS (badania III fazy, 2462 pacjentów leczonych gefitynibem).
Częstość występowania działań niepożądanych została określona następująco: bardzo często (≥ 1/10), często (≥ 1/100, < 1/10), niezbyt często (≥ 1/1000, < 1/100), rzadko (≥ 1/10 000, < 1/1000),
bardzo rzadko (< 1/10000), nieznana (częstości nie można określić na podstawie dostępnych danych).
W obrębie każdej grupy o określonej częstości występowania działań niepożądanych są one wymienione od najcięższych do najlżejszych.
Tabela 1 Działania niepożądane
Działania niepożądane podzielone według układów narządów oraz częstości występowania | ||
Zaburzenia metabolizmu i odżywiania | Bardzo częste | Anoreksja, łagodna do umiarkowanej (1. lub 2. stopnia CTC). |
Zaburzenia oka | Częste | Zapalenie spojówek, zapalenie powiek, suchość oka*, zwykle łagodna (1. stopnia CTC). |
Niezbyt częste | Nadżerka rogówki, odwracalna i czasami współistniejąca z nieprawidłowym wzrostem rzęs. | |
Zapalenie rogówki (0,12%). | ||
Zaburzenia naczyniowe | Częste | Krwawienia, takie jak krwawienie z nosa i krwiomocz. |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Częste | Śródmiąższowa choroba płuc (1,3%), często ciężka (3.-4. stopnia według CTC). Stwierdzano przypadki zgonów. |
Zaburzenia żołądka i jelit | Bardzo częste | Biegunka, głównie łagodna i umiarkowana (1. lub 2. stopnia według CTC). |
Wymioty, głównie łagodne i umiarkowane (1. lub 2. stopnia według CTC). | ||
Nudności, głównie łagodne (1. stopnia według CTC). | ||
Zapalenie jamy ustnej, głównie łagodne (1. stopnia według CTC). | ||
Częste | Odwodnienie w związku z biegunką, nudnościami, wymiotami lub brakiem łaknienia. | |
Suchość w jamie ustnej*, przeważnie łagodna (1. stopnia według CTC). | ||
Niezbyt częste | Zapalenie trzustki; Perforacja przewodu | |
pokarmowego. | ||
Zaburzenia wątroby i dróg żółciowych | Bardzo częste | Zwiększenie aktywności aminotransferazy alaninowej, głównie łagodne i umiarkowane. |
Częste | Zwiększenie aktywności aminotransferazy asparaginowej, głównie łagodne do umiarkowanego. | |
Zwiększenie stężenia bilirubiny całkowitej, głównie łagodne do umiarkowanego. | ||
Niezbyt częste | Zapalenie wątroby**. | |
Zaburzenia ze strony skóry i tkanki podskórnej | Bardzo częste | Reakcje skórne, głównie łagodne lub umiarkowane (1. lub 2. stopnia), wysypka krostkowa, czasami swędząca, z suchością skóry, w tym pęknięcia skóry, na podłożu rumienia. |
Częste | Zaburzenia płytki paznokciowej. | |
Łysienie. | ||
Reakcje uczuleniowe (1,1%), w tym obrzęk naczynioruchowy i pokrzywka. | ||
Rzadkie | Zaburzenia pęcherzowe skóry, w tym martwica toksyczno-rozpływna naskórka, zespół Stevensa- Johnsona i rumień wielopostaciowy. | |
Zapalenie naczyń skóry. | ||
Zaburzenia czynności nerek i układu moczowego | Częste | Bezobjawowe zwiększenie stężenia kreatyniny w badaniach laboratoryjnych. |
Białkomocz. | ||
Zapalenie pęcherza moczowego. | ||
Rzadkie | Krwotoczne zapalenie pęcherza moczowego. | |
Zaburzenia ogólnoustrojowe i zaburzenia w miejscu podania leku | Bardzo częste | Osłabienie, przeważnie łagodne (1. stopnia według CTC). |
Częste | Gorączka. |
Częstość działań niepożądanych, które dotyczą nieprawidłowych wyników badań laboratoryjnych odnosi się do pacjentów ze zmianą o 2 lub więcej stopni w skali CTC dla poszczególnych badań.
* To działanie niepożądane może występować łącznie z suchością w innych lokalizacjach (głównie skóry) po zastosowaniu gefitynibu.
**W tym pojedyncze doniesienia o niewydolności wątroby, w niektórych przypadkach zakończone zgonem.
Choroba śródmiąższowa płuc (ChŚP)
W badaniu INTEREST częstość występowania zdarzeń niepożądanych zaliczanych do ChŚP wynosiła 1,4% (10 pacjentów) w grupie gefitynibu; w grupie docetakselu 8 pacjentów [1,1%]. W jednym przypadku działania niepożądanego zaliczanego do ChŚP u pacjenta otrzymującego gefitynib, wystąpił zgon.
W całej populacji badania ISEL częstość występowania zdarzeń niepożądanych zaliczanych do ChŚP wynosiła około 1%. Większość zdarzeń zgłaszanych jako ChŚP wystąpiło u pacjentów pochodzących z Azji.
Częstość występowania ChŚP u pacjentów pochodzących z Azji otrzymujących gefitynib i placebo wynosiła odpowiednio 3% i 4%. W jednym przypadku działania niepożądanego zaliczanego do ChŚP, u pacjenta otrzymującego placebo, nastąpił zgon.
W badaniu oceniającym bezpieczeństwo, wykonanym po wprowadzeniu produktu do obrotu w Japonii częstość występowania ChŚP w grupie 3350 pacjentów leczonych gefitynibem wynosiła 5,8%. Odsetek przypadków działań niepożądanych zaliczonych do ChŚP, w których wystąpił zgon wynosił 38,6%.
W otwartym badanu klinicznym III fazy (IPASS) z udziałem 1217 pacjentów pochodzenia azjatyckiego,
w którym porównywano gefitynib i chemioterapię skojarzoną karboplatyna z paklitaksel w leczeniu pierwszego
rzutu u wybranych pacjentów z zaawansowanym NDRP, częstość występowania zdarzeń zaliczonych do ChŚP wynosiła 2,6% w grupie leczonej gefitynibem i 1,4% w grupie leczonej karboplatyną z paklitakselem.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego.
Osoby należące do personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie ma specjalnego leczenia w przypadku przedawkowania gefitynibu. Jednak w badaniach klinicznych I fazy ograniczona liczba pacjentów otrzymywała produkt w dawce dobowej do 1000 mg. Obserwowano zwiększenie częstości i ciężkości nasilenia niektórych działań niepożądanych, głównie biegunki i wysypek skórnych.
Działania niepożądane występujące w związku z przedawkowaniem produktu powinny być leczone objawowo, szczególnie w przypadku ciężkiej biegunki należy zapewnić leczenie zgodne ze wskazaniami klinicznymi. W jednym z badań ograniczona liczba pacjentów co tydzień otrzymywała lek w dawkach od 1500 mg do 3500 mg. W tym badaniu ekspozycja na gefitynib nie rosła wraz ze wzrostem dawki, zdarzenia niepożądane w większości przypadków miały nasilenie łagodne do umiarkowanego i mieściły się w znanym profilu bezpieczeństwa gefitynibu.
Grupa farmakoterapeutyczna: inhibitory kinazy proteinowej; kod ATC: L01XE02 Mechanizm działania i wynik działania farmakodynamicznego
Naskórkowy czynnik wzrostu (ang. Epidermal Growth Factor EGF) i jego receptor (ang. Epidermał Growth
Factor Receptor EGFR [HER1; ErbB1]) zostały zidentyfikowane jako główne czynniki odpowiedzialne za proces wzrostu i podziału w komórkach prawidłowych i nowotworowych. Mutacja aktywująca EGFR w komórce nowotworowej jest ważnym czynnikiem pobudzającym wzrost komórki, blokującym apoptozę, zwiększającym produkcję czynników angiogenezy i ułatwiającym proces powstawania przerzutów.
Gefitynib jest wybiórczym, małocząsteczkowym inhibitorem kinazy tyrozynowej receptora dla naskórkowego czynnika wzrostu i jest skutecznym sposobem leczenia u pacjentów z nowotworem z obecnością mutacji aktywującej domenę kinazy tyrozynowej EGFR niezależnie od rzutu leczenia. Nie stwierdzono istotnego klinicznie działania u pacjentów z potwierdzonym brakiem mutacji EGFR w guzie.
Dla częstych mutacji aktywujących EGFR (delecje egzonu 19; L858R) istnieją mocne dane dotyczące odpowiedzi na leczenie, potwierdzające wrażliwość na gefitynib; na przykład wartość wskaźnika HR dla przeżycia wolnego od progresji choroby, dla porównania gefitynibu z dwuskładnikowym schematem chemioterapii, wyniosła 0,489 (95% CI: 0,336, 0,710) [WJTOG3405]. Dane dotyczące odpowiedzi na gefitynib są bardziej skąpe w przypadku pacjentów, których nowotwory zawierają rzadsze mutacje;
dostępne dane wskazują, że mutacje G719X, L861Q i S7681 są mutacjami uwrażliwiającymi natomiast samodzielna mutacja T790M lub samodzielne insercje w egzonie 20 leżą u podłoża mechanizmów oporności guza.
Oporność
W przypadku większości guzów NDRP z uwrażliwiającymi mutacjami kinazy EGFR ostatecznie rozwija się oporność na leczenie gefitynibem, przy czym mediana czasu do progresji choroby wynosi 1 rok. W około 60% przypadków oporność wiąże się z wtórną mutacją T790M i wówczas jako opcję terapeutyczną kolejnego rzutu można brać pod uwagę leki z grupy TKI ukierunkowane na mutację T790M EGFR. Inne potencjalne mechanizmy powstawania oporności opisywane po leczeniu lekami blokującymi sygnalizację EGFR obejmują sygnalizację oboczną, np. amplifikację genów HER2 i MET oraz mutacje genu PIK3CA. W 5-10% przypadków opisywano także zmianę fenotypu nowotworu na drobnokomórkowego raka płuca.
Krążący DNA nowotworu (circulating tumour DNA; ctDNA)
W badaniu IFUM status mutacji oceniano w próbkach guza i w próbkach ctDNA uzyskanych z osocza za pomocą zestawu Therascreen EGFR RGQ PCR kit (Qiagen). U 652 pacjentów spośród 1060 poddanych ocenie przesiewowej zarówno próbki ctDNA, jak i próbki guza kwalifikowały się do oceny. Odsetek odpowiedzi obiektywnych (ORR) u pacjentów z dodatnim wynikiem oznaczenia mutacji w próbkach guza i ctDNA wyniósł 77% (95% CI: 66% do 86%) a u pacjentów, u których dodatni wynik uzyskano tylko w próbkach guza - 60% (95% CI: 44% do 74%).
Tabela 2 Podsumowanie wyjściowego statusu mutacji w próbkach guza i ctDNA u wszystkich pacjentów poddanych ocenie przesiewowej, u których obie próbki kwalifikowały się do oceny.
Miara | Definicja | Badanie IFUM; odsetek % (CI) | Bada nie |
Czułość | Odsetek guzów M+ z jednoczesnym wynikiem M+ dla | 65,7 (55,8, 74,7) | 105 |
Swoistość | Odsetek guzów M- z jednoczesnym wynikiem M- dla ctDNA | 99,8 (99,0, 100,0) | 547 |
Te dane są zgodne z zaplanowaną z góry analizą eksploracyjną podgrupy japońskiej w badaniu IPASS (Goto 2012). W tym badaniu do analizymutacji EGFR z użyciem zestawu EGFR Mutation Test Kit (DxS) wykorzystano ctDNA uzyskany z surowicy, a nie z osocza (N= 86). W tym badaniu czułość wyniosła 43,1%, swoistość - 100%.
Skuteczność kliniczna i bezpieczeństwo stosowania
Leczenie pierwszego rzutu
Randomizowane badanie kliniczne III fazy, w leczeniu pierwszego rzutu, IPASS, przeprowadzono z udziałem pacjentów pochodzących z Azji1 z zaawansowanym (stadium IIIB lub IV) NDRP o utkaniu gruczołowym, którzy w przeszłości palili papierosy w niewielkiej ilości (rzucili palenie ≥ 15 lat temu i palili ≤ 10 paczko-lat) lub nigdy nie palili (patrz tabela 3).
1 Chiny, Hong Kong, Indonezja, Japonia, Malezja, Filipiny, Singapur, Tajwan i Tajlandia.
Tabela 3 Ocena skuteczności gefitynibu w porównaniu do leczenia karboplatyną z paklitakselem w badaniu IPASS
Populacja | N | Odsetek odpowiedzi obiektywnych i 95% przedział ufności dla różnicy pomiędzy sposobami leczeniaa | Pierwszorzędowy punkt końcowy: Przeżycie wolne od progresji (PFS),a,b | Przeżycie całkowiteab |
Wszyscy pacjenci | 1217 | 43,0% vs 32,2% [5,3%, 16,1%] | HR 0,74 [0,65, 0,85] 5,7 m vs 5,8 m p< 0,0001 | HR 0,90 [0,79, 1,02] 18,8 m vs 17,4m p = 0,1087 |
Z mutacją EGFR | 261 | 71,2 % vs 47,3% [12,0%; 34,9%] | HR 0,48 [0,36, 0,64] 9,5 m vs 6,3 m p< 0,0001 | HR 1,00 [0,76, 1,33] 21,6 m vs 21,9 m |
Bez mutacji EGFR | 176 | 1,1% vs 23,5% [-32,5%; -13,3%] | HR 2,85 [2,05, 3,98] 1,5 m vs 5,5 m p< 0,0001 | HR 1,18 [0,86, 1,63] 11,2 m vs 12,7 m |
Nieznany status mutacji EGFR | 780 | 43,3% vs 29,2% [7,3%; 20,6%] | HR 0,68 [0,58 do 0,81] 6,6 m vs 5,8 m p< 0,0001 | HR 0,82 [0,70 do 0,96] 18,9 m vs 17,2 m |
N - liczba pacjentów zrandomizowanych.
HR - współczynnik ryzyka (współczynnik ryzyka < 1 oznacza przewagę gefitynibu)
Wyniki oceny jakości życia różniły się w zależności od statusu mutacji EGFR. W grupie pacjentów z mutacją EGFR, leczonych gefitynibem, u znacząco większej grupy pacjentów poprawiła się jakość życia i objawy raka płuca w porównaniu do grupy leczonej karboplatyną z paklitakselem (patrz tabela 4).
Tabela 4 Wyniki badania jakości życia dla gefitynibu w porównaniu do leczenia karboksyplatyną z paklitakselem w badaniu IPASS
Populacja | N | Odsetek przypadków poprawy w skali FACT-L QoLa % | Odsetek przypadków poprawy objawów w skali LCSa % |
Wszyscy pacjenci | 1151 | (48,0% vs 40,8%) p = 0,0148 | (51,5% vs 48,5%) p = 0,3037 |
Z mutacją EGFR | 259 | (70,2% vs 44,5%) p< 0,0001 | (75,6% vs 53,9%) p = 0,0003 |
Bez mutacji EGFR | 169 | (14,6% vs 36,3%) p = 0,0021 | (20,2% vs 47,5%) p = 0,0002 |
Indeks wyników badania (Trial Outcome Index; TOI) potwierdzał wyniki FACT-L i LCS a Przedstawiono wartości dla gefitynibu vs karboplatyna z paklitaksel.
N liczba pacjentów, u których możliwe było przeprowadzenie analizy jakości życia. QoL jakość życia.
FACT-L czynnościowa ocena leczenia przeciwnowotworowego - płuca (ang. Functional Assessment of Cancer Therapy - Lung)
LCS podskala oceny raka płuca (ang. Lung Cancer Subscale)
W badaniu IPASS wykazano przewagę gefitynibu w odniesieniu do PFS, ORR, QoL i złagodzenia objawów przy braku istotnej różnicy przeżycia całkowitego w porównaniu do schematu karboplatyna z paklitakselem u nieleczonych uprzednio pacjentów z NDRP zaawansowanym miejscowo lub z przerzutami, z aktywującymi mutacjami kinazy tyrozynowej EGFR w komórkach guza.
Pacjenci uprzednio leczeni
Przeprowadzono randomizowane badanie kliniczne III fazy INTEREST, u pacjentów z miejscowo zaawansowanym lub z przerzutami NDRP, którzy otrzymywali wcześniej leczenie związkami platyny.
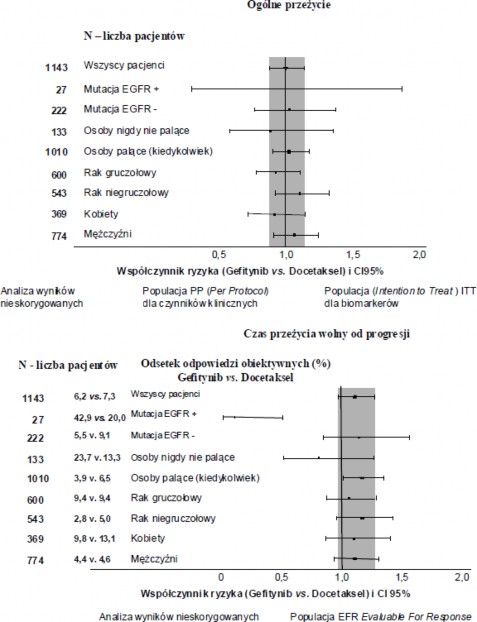
W ogólnej populacji nie stwierdzono znamiennej statystycznie różnicy pomiędzy gefitynibem i docetakselem (75 mg/m2)w odniesieniu do przeżycia całkowitego, czasu przeżycia wolnego od progresji i odsetka odpowiedzi obiektywnych (patrz Tabela 5).
Tabela 5 Wyniki badania skuteczności gefitynibu w porównaniu do leczenia docetakselem w badaniu
INTEREST Populacja | N | Odsetek odpowiedzi obiektywnych i przedział ufności 95% dla różnicy pomiędzy sposobami leczeniaa | Czas przeżycia wolny od progresjia,b | Pierwszorzędowy punkt końcowy: przeżycie całkowitea,b |
Wszyscy | 1466 | 9,1% vs 7,6% | HR 1,04 | HR 1,020 |
pacjenci | [-1,5%; 4,5%] | [0,93, 1,18] | [0,905, 1,150]c | |
2,2 m vs 2,7 m | 7,6 m vs 8,0 m | |||
p = 0,4658 | p = 0,7332 | |||
mutacja EGFR - | 44 | 42,1% vs 21,1% | HR 0,16 | HR 0,83 |
wynik dodatni | [-8,2%; 46,0%] | [0,05, 0,49] | [0,41, 1,67] | |
7,0 m vs 4,1 m | 14,2 m vs 16,6 m | |||
p = 0,0012 | p = 0,6043 | |||
mutacja EGFR - | 253 | 6,6% vs 9,8% | HR 1,24 | HR 1,02 |
wynik ujemny | [-10,5%; 4,4%] | [0,94, 1,64] | [0,78, 1,33] | |
1,7 m vs 2,6 m | 6,4 m vs 6,0 m | |||
p = 0,1353 | p = 0,9131 | |||
Populacja | 323 | 19,7% vs 8,7% | HR 0,83 | HR 1,04 |
azjatyckac | [3,1%; 19,2%] | [0,64, 1,08] | [0,80, 1,35] | |
2,9 m vs 2,8 m | 10,4 m vs 12,2 m | |||
p = 0,1746 | p = 0,7711 | |||
Populacja | 1143 | 6,2% vs 7,3% | HR 1,12 | HR 1,01 |
nieazjatycka | [-4,3%; 2,0%] | [0,98, 1,28] | [0,89, 1,14] | |
2,0 m vs 2,7 m | 6,9 m vs 6,9 m | |||
p = 0,1041 | p = 0,9259 |
HR współczynnik ryzyka (współczynnik ryzyka < 1 oznacza przewagę gefitynibu)
Ryciny 1 i 2 Wyniki w zakresie skuteczności leczenia w podgrupach populacji pacjentów nieazjatyckich badania INTEREST (N pacjentów = liczba pacjentów zrandomizowanych)
Randomizowane badanie kliniczne III fazy ISEL było przeprowadzone u pacjentów z zaawansowanym NDRP, którzy otrzymywali wcześniej 1 lub 2 cykle chemioterapii i nie tolerowali lub nie zareagowali na ostatni cykl leczenia. Schemat „gefitynib + najlepsza opieka podtrzymująca” porównano ze schematem „placebo + najlepsza opieka podtrzymująca”. Gefitynib nie przedłużał przeżycia w całej populacji. Wyniki przeżycia były różne w zależności od palenia tytoniu i rasy (patrz tabela 6).
Tabela 6 Wyniki skuteczności leczenia gefitynibem w porównaniu z placebo w badaniu ISEL
Populacja | N | Odsetek odpowiedzi obiektywnych i 95% przedział ufności dla różnicy pomiędzy sposobami leczeniaa | Czas do stwierdzenia niepowodzenia leczeniaa,b | Pierwszorzędowy punkt końcowy: przeżycie całkowitea,b,c |
Wszyscy pacjenci | 1692 | 8,0% vs 1,3% [4,7%; 8,8%] | HR 0,82 [0,73, 0,92] 3,0 m vs 2,6 m p = 0,0006 | HR 0,89 [0,77; 1,02] 5,6 m vs 5,1 m p = 0,0871 |
Mutacja EGFR wynik dodatni | 26 | 37,5% vs 0% [-15,1%; 61,4%] | HR 0,79 [0,20, 3,12] 10,8 m vs 3,8m p = 0,7382 | HR NC NR vs 4,3 m |
Mutacja EGFR wynik ujemny | 189 | 2,6% vs 0% [-5,6%; 7,3%] | HR 1,10 [0,78, 1,56] 2,0 m vs 2,6 m p=0,5771 | HR 1,16 [0,79, 1,72] 3,7 m vs 5,9 m p=0,4449 |
Osoby nigdy nie palące | 375 | 18,1% vs 0% [12,3 %; 24,0 %] | HR 0,55 [0,42, 0,72] 5,6 m vs 2,8 m p< 0,0001 | HR 0,67 [0,49, 0,92] 8,9 m vs 6,1 m p=0,0124 |
Osoby palące (kiedykolwiek) | 1317 | 5,3% vs 1,6% [1,4%; 5,7%] | HR 0,89 [0,78, 1,01] 2,7 m vs 2,6 m p=0,0707 | HR 0,92 [0,79, 1,06] 5,0 m vs 4,9 m p = 0,2420 |
Populacja azjatyckad | 342 | 12,4% vs 2,1% [4,0 %; 15,8 %] | HR 0,69 [0,52, 0,91] 4,4 m vs 2,2 m p = 0,0084 | HR 0,66 [0,48, 0,91] 9,5 m vs 5,5 m p = 0,0100 |
Populacja nieazjatycka | 1350 | 6,8% vs 1,0% [3,5%; 7,9%] | HR 0,86 [0,76, 0,98] 2,9 m vs 2,7 m p = 0,0197 | HR 0,92 [0,80, 1,07] 5,2 m vs 5,1 m p = 0,2942 |
d W grupie pacjentów pochodzenia azjatyckiego nie uwzględniono pacjentów pochodzących z Indii i odnoszono się do rasy a nie do miejsca urodzenia.
N Liczba pacjentów zrandomizowanych
NC Współczynnik ryzyka dla przeżycia całkowitego nieliczony z powodu zbyt małej liczby zdarzeń. NR Nie osiągnięto.
HR Współczynnik ryzyka (współczynnik ryzyka < 1 oznacza przewagę gefitynibu).
Badanie IFUM to jednoramienne, wieloośrodkowe badanie przeprowadzone w grupie pacjentów rasy kaukaskiej (n=106) chorujących na NDRP z dodatnim wynikiem oznaczenia aktywującej, uwrażliwiającej mutacji EGFR mające na celu potwierdzenie, że aktywność gefitynibu jest podobna w populacjach kaukaskiej i azjatyckiej. Według oceny badacza wartość ORR wyniosła 70%, a mediana PFS - 9,7 miesiąca. Te dane są podobne do danych podanych w badaniu IPASS.
Status mutacji EGFR i charakterystyka kliniczna
W analizie badań klinicznych nad gefitynibem*, obejmującej 786 pacjentów rasy kaukaskiej, uwzględniającej różne czynniki, niezależnym czynnikiem klinicznym wskazującym na obecność mutacji EGFR okazał się być
brak palenia tytoniu w wywiadzie, rak gruczołowy i płeć żeńska (patrz tabela 7). Guzy z mutacją EGFR częściej występują u pacjentów pochodzenia azjatyckiego.
Tabela 7 Podsumowanie wieloczynnikowej analizy regresji logistycznej w celu identyfikacji niezależnych czynników klinicznych wskazujących na obecność mutacji EGFR u 786 pacjentów rasy kaukaskiej*.
Czynniki wskazujące na obecność mutacji EGFR | Wartość p | Prawdopodobieństwo występowania mutacji EGFR | Wartość pozytywnie predestynująca (u 9,5 % ogólnej populacji występuje mutacja EGFR (M+)) |
Osoby palące tytoń | < 0,0001 | 6,5 raza większa u osób, które nigdy nie paliły niż u osób, które kiedykolwiek paliły | mutacja (M+) występuje u 28/70 (40%) osób nigdy nie palących i u 47/716 (7%) osób kiedykolwiek palących |
Histologia | < 0,0001 | prawdopodobieństwo 4,4 raza większe u osób z rakiem gruczołowym niż niegruczołowym | mutacja (M+) występuje u 63/396 (16%) pacjentów z rakiem gruczołowym i u 12/390 (3%) pacjentów z rakiem niegruczołowym |
Płeć | 0,0397 | prawdopodobieństwo 1,7 raza większe u kobiet niż u mężczyzn | mutacja (M+) występuje u 40/235 (17%) kobiet i u 35/551 (6%) mężczyzn |
*na podstawie następujących badań klinicznych: INTEREST, ISEL, INTACT 1&2, IDEAL 1&2, INVITE
Wchłanianie
Po podaniu doustnym gefitynib jest umiarkowanie wolno wchłaniany, a maksymalne stężenie gefitynibu w osoczu występuje zazwyczaj po 3 do 7 godzinach od zażycia. Średnia bezwzględna biodostępność u pacjentów chorujących na nowotwór wynosi 59%. Posiłki nie wpływają istotnie na ekspozycję na gefitynib. W badaniu przeprowadzonym z udziałem zdrowych ochotników, gdy utrzymywano pH soku żołądkowego powyżej 5, ekspozycja na gefitynib zmniejszyła się o 47%, prawdopodobnie ze względu na zaburzoną rozpuszczalność gefitynibu w żołądku (patrz punkt 4.4 i 4.5).
Dystrybucja
Średnia objętość dystrybucji gefitynibu w stanie stacjonarnym wynosi 1400 l, co wskazuje na znaczną dystrybucję do tkanek. Wiązanie z białkami osocza wynosi około 90%. Gefitynib wiąże się z albuminami osocza i kwaśną alfa 1-glikoproteiną.
Dane z badań in vitro wskazują, że gefitynib jest substratem dla białka Pgp odpowiedzialnego za transport przezbłonowy.
Metabolizm
Dane z badań in vitro wskazują, że izoenzymy CYP3A4 i CYP2D6 są głównymi izoenzymami układu cytochromu P450 biorącymi udział w metabolizmie tlenowym gefitynibu.
Badania in vitro wykazały, że gefitynib ma ograniczony wpływ hamujący na izoenzym CYP2D6. W badaniach na zwierzętach gefitynib nie wykazuje działania pobudzającego enzymy ani istotnego działania hamującego (badania in vitro) na jakikolwiek inny enzym układu cytochromu P450.
U ludzi gefitynib jest intensywnie metabolizowany. W pełni określono pięć metabolitów znajdujących się w wydzielinach i 8 występujących w osoczu. Głównym zidentyfikowanym metabolitem jest O-demetylowany gefitynib, który ma 14-krotnie słabsze działanie hamujące wzrost komórki powodowany przez pobudzenie EGFR, jak również nie wykazuje działania hamującego wzrost komórek guza u myszy. Dlatego wydaje się, że nie bierze on udziału w działaniu klinicznym gefitynibu.
W badaniach in vitro wykazano, że O-demetylowany gefitynib powstaje z udziałem CYP2D6. Rola CYP2D6 w przemianach metabolicznych gefitynibu była określona w badaniu klinicznym z udziałem zdrowych ochotników z określonym genotypem enzymu CYP2D6. U osób wolno metabolizujących nie stwierdzono wykrywalnych
stężeń O-demetylowanego gefitynibu. Zakresy ekspozycji stwierdzane u osób wolno i szybko metabolizujących były szerokie i częściowo pokrywały się, jednak średnia ekspozycja na gefitynib była 2-krotnie większa u osób wolno metabolizujących. Większa średnia ekspozycja u osób z nieaktywnym CYP2D6 może mieć znaczenie kliniczne, ponieważ działania niepożądane są zależne od dawki i ekspozycji.
Eliminacja
Gefitynib jest wydalany głównie w postaci zmetabolizowanej z kałem, mniej niż 4% podanej dawki jest wydalane przez nerki w postaci gefitynibu i jego metabolitów.
Całkowity klirens osoczowy gefitynibu wynosi mniej więcej 500 ml/min, a średni okres półtrwania u pacjentów z nowotworem wynosi 41 godzin. Podawanie gefitynibu raz na dobę powodowało 2- do 8-krotną kumulację,
a typowa dla stanu stacjonarnego ekspozycja została osiągnięta po podaniu 7 do 10 dawek. W stanie stacjonarnym, stężenie w osoczu jest 2- do 3-krotnie większe, przez cały okres 24 godzin między kolejnymi dawkami.
Szczególne grupy pacjentów
W analizach uwzględniających dane farmakokinetyczne populacji pacjentów z nowotworem nie stwierdzono zależności między przewidywanym minimalnym stężeniem leku w stanie stacjonarnym a wiekiem, masą ciała, płcią, rasą lub wartością klirensu kreatyniny (powyżej 20 ml/min).
Zaburzenia czynności wątroby
W otwartym badaniu I fazy przeprowadzonym z udziałem pacjentów z łagodną, umiarkowaną i ciężką niewydolnością wątroby z powodu marskości (zgodnie z klasyfikacją Child-Pugh), po podaniu pojedynczej dawki gefitynibu 250 mg obserwowano zwiększenie ekspozycji we wszystkich grupach w porównaniu z ekspozycją u osób zdrowych. U osób z umiarkowaną i ciężką niewydolnością wątroby obserwowano średnio 3,1-krotne zwiększenie ekspozycji na gefitynib. U żadnego z pacjentów nie występował nowotwór,
u wszystkich stwierdzano marskość, a u niektórych zapalenie wątroby. Zwiększenie ekspozycji może mieć znaczenie kliniczne, ponieważ działania niepożądane są zależne od dawki i ekspozycji na gefitynib.
Gefitynib był badany w grupie 41 pacjentów z litymi guzami nowotworowymi, którzy mieli prawidłową czynność wątroby albo umiarkowane lub ciężkie zaburzenia czynności wątroby (sklasyfikowane zgodnie z Common Toxicity Criteria, w oparciu o stwierdzone na początku badania wartości AST, fosfatazy alkalicznej i bilirubiny) z powodu przerzutów do wątroby. Wykazano, że gdy podawano gefitynib w dawce 250 mg na dobę, czas do osiągnięcia stanu stacjonarnego, całkowity klirens osoczowy (CmaxSS), ekspozycja na lek w stanie stacjonarnym (AUC24SS), były porównywalne w przypadku pacjentów z prawidłową czynnością wątroby i umiarkowanymi zaburzeniami czynności wątroby. Dane od 4 pacjentów z ciężkimi zaburzeniami czynności wątroby z powodu przerzutów sugerują, że ekspozycja w stanie stacjonarnym u tych pacjentów jest zbliżona do ekspozycji u osób z prawidłową czynnością wątroby.
Działania niepożądane, które nie występowały w badaniach klinicznych, natomiast były obserwowane u zwierząt po ekspozycji porównywalnej do ekspozycji klinicznej i które mogą mieć znaczenie w praktyce klinicznej:
Rdzeń tabletki
Sodu laurylosiarczan Laktoza jednowodna Celuloza mikrokrystaliczna Powidon K-29/32 Kroskarmeloza sodowa Magnezu stearynian
Otoczka tabletki Alkohol poliwinylowy Makrogol 4000
Talk
Żelaza tlenek czerwony (E172) Żelaza tlenek żółty (E172) Żelaza tlenek czarny (E172)
Nie dotyczy.
3 lata
Brak specjalnych zaleceń dotyczących warunków przechowywania produktu leczniczego.
Blister OPA/Aluminium/PVC-Aluminium, perforowany lub nieperforowany.
Opakowania zawierające 30 lub 30 x 1 tabletka. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
STADA Arzneimittel AG Stadastrasse 2-18
61118 Bad Vilbel Niemcy
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











