Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Ezetimibe Genoptim, 10 mg, tabletki
Każda tabletka zawiera 10 mg ezetymibu (Ezetimibum). Substancja pomocnicza o znanym działaniu
Każda tabletka zawiera 64 mg laktozy jednowodnej.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka
Białe lub prawie białe, okrągłe, wypukłe tabletki o średnicy około 6 mm
Hipercholesterolemia pierwotna
Ezetimibe Genoptim podawany w skojarzeniu z inhibitorem reduktazy HMG-CoA (statyną) jest wskazany do stosowania jako produkt leczniczy wspomagający wraz z dietą u pacjentów z pierwotną hipercholesterolemią (heterozygotyczną rodzinną lub nierodzinną), u których nie jest możliwe odpowiednie zmniejszenie stężenia lipidów przy zastosowaniu samej statyny.
Ezetimibe Genoptim w monoterapii jest wskazany do stosowania jako produkt leczniczy wspomagający wraz z dietą u pacjentów z pierwotną hipercholesterolemią (heterozygotyczną rodzinną lub nierodzinną), u których stosowanie statyny jest niewskazane lub lek ten nie jest tolerowany.
Zapobieganie wystąpieniu incydentów sercowo-naczyniowych
Ezetimibe Genoptim podawany dodatkowo u pacjentów wcześniej leczonych statyną lub włączany do leczenia jednocześnie ze statyną jest wskazany do stosowania, w celu zmniejszenia ryzyka wystąpienia incydentów sercowo-naczyniowych (patrz punkt 5.1) u pacjentów z chorobą wieńcową (ang. CHD, Coronary Heart Disease) i ostrym zespołem wieńcowym w wywiadzie (ang. ACS, Acute Coronary Syndrome).
Homozygotyczna hipercholesterolemia rodzinna (HoFH)
Ezetimibe Genoptim w skojarzeniu ze statyną jest wskazany do stosowania jako produkt leczniczy wspomagający wraz z dietą u pacjentów z homozygotyczną hipercholesterolemią rodzinną.
U pacjentów mogą być również stosowane dodatkowe metody leczenia (np. afereza LDL).
Homozygotyczna sitosterolemia (Phytosterolemia)
Ezetimibe Genoptim jest wskazany do stosowania jako produkt leczniczy wspomagający wraz z dietą u pacjentów z homozygotyczną sitosterolemią rodzinną.
Dawkowanie
Pacjent powinien stosować odpowiednią dietę zmniejszającą stężenie lipidów we krwi. Powinien ją kontynuować w okresie stosowania produktu leczniczego Ezetimibe Genoptim.
Ezetimibe Genoptim przyjmuje się doustnie. Zalecana dawka to jedna tabletka 10 mg raz na dobę. Produkt leczniczy Ezetimibe Genoptim można przyjmować o dowolnej porze dnia, niezależnie od posiłków.
W przypadku stosowania produktu leczniczego Ezetimibe Genoptim w skojarzeniu ze statyną należy stosować wskazaną dawkę początkową lub już ustaloną wyższą dawkę danej statyny. Należy zapoznać się z zaleceniami dotyczącymi stosowania danej statyny.
Stosowanie u pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie Udowodniono korzystny wpływ produktu leczniczego Ezetimibe Genoptim 10 mg stosowanego ze statyną o udokumentowanych korzyściach sercowo-naczyniowych na dodatkowe zmniejszenie incydentów sercowo-naczyniowych u pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie.
Jednoczesne stosowanie z lekami wiążącymi kwasy żółciowe
Ezetimibe Genoptim należy przyjmować co najmniej 2 godziny przed lub 4 godziny po przyjęciu leku wiążącego kwasy żółciowe.
Osoby w podeszłym wieku
Nie jest wymagane dostosowanie dawki produktu leczniczego dla osób w wieku podeszłym (patrz punkt 5.2).
Dzieci i młodzież
Leczenie należy rozpocząć pod nadzorem lekarza specjalisty.
Dzieci i młodzież w wieku 6 lat i powyżej: Nie określono bezpieczeństwa stosowania ani skuteczności ezetymibu u dzieci w wieku od 6 do 17 lat. Aktualne dane przedstawiono w punktach 4.4, 4.8, 5.1 i 5.2, ale brak zaleceń dotyczących dawkowania.
Jeśli produkt leczniczy Ezetimibe Genoptim jest podawany w skojarzeniu ze statyną, dawkowanie statyny u dzieci należy omówić z lekarzem.
Dzieci w wieku poniżej 6 lat: Nie określono bezpieczeństwa stosowania ani skuteczności ezetymibu u dzieci w wieku poniżej 6 lat. Dane nie są dostępne.
Zaburzenia czynności wątroby
U pacjentów z łagodnymi zaburzeniami czynności wątroby (5-6 punktów wg skali Child-Pugh) nie jest wymagane dostosowanie dawki produktu leczniczego. U pacjentów z umiarkowanymi zaburzeniami czynności wątroby (7-9 punktów wg skali Child-Pugh) lub ciężkimi zaburzeniami czynności wątroby (> 9 punktów wg Child-Pugh) nie zaleca się stosowania produktu leczniczego Ezetimibe Genoptim (patrz punkty 4.4 i 5.2).
Zaburzenia czynności nerek
Nie jest wymagane dostosowanie dawki produktu leczniczego u pacjentów z zaburzeniami czynności nerek (patrz punkt 5.2).
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
W przypadku stosowania produktu leczniczego Ezetimibe Genoptim w skojarzeniu ze statyną należy zapoznać się z Charakterystyką Produktu Leczniczego (ChPL) danego produktu leczniczego.
Przeciwwskazane jest jednoczesne stosowanie produktu leczniczego Ezetimibe Genoptim i statyny w okresie ciąży i laktacji.
Ezetimibe Genoptim w skojarzeniu ze statyną jest przeciwwskazany u pacjentów z czynną chorobą wątroby lub niewyjaśnionym, utrzymującym się zwiększeniem aktywności aminotransferaz w surowicy krwi.
W przypadku jednoczesnego stosowania ze statyną, należy zapoznać się z ChPL danego produktu leczniczego.
Enzymy wątrobowe
W badaniach z grupą kontrolną, w których pacjenci przyjmowali ezetymib i statynę, obserwowano zwiększenie aktywności aminotransferaz (≥ 3x powyżej górnej granicy wartości prawidłowych [GGN]). W przypadku jednoczesnego stosowania produktu leczniczego Ezetimibe Genoptim i statyny należy przeprowadzać testy czynnościowe wątroby przed rozpoczęciem leczenia oraz zgodnie z zaleceniami ChPL dotyczącymi danej statyny (patrz punkt 4.8).
W badaniu IMPROVE-IT (ang. IMProved Reduction of Outcomes: Vytorin Efficacy International Trial) 18 144 pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie przydzielano w sposób losowy do grupy otrzymującej ezetymib z symwastatyną w dawce 10 mg + 40 mg na dobę (n=9067) lub symwastatynę w dawce 40 mg na dobę (n=9077). Podczas okresu obserwacji, którego mediana wynosiła 6,0 lat, częstość występowania kolejnych wzrostów poziomu transaminaz (≥ 3x GGN) w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 2,5% i 2,3%. (Patrz punkt 4.8).
W kontrolowanym badaniu klinicznym, w którym ponad 9000 pacjentów z przewlekłą chorobą nerek randomizowano do grupy leczonej ezetymibem 10 mg z symwastatyną w dawce 20 mg na dobę (n=4650) lub do grupy przyjmującej placebo (n=4620) (mediana okresu obserwacji 4,9 roku), częstość występowania kolejnego zwiększenia aktywności aminotransferaz (> 3x GGN) wynosiła 0,7% wśród osób przyjmujących ezetymib z symwastatyną i 0,6% w grupie placebo (patrz punkt 4.8).
Mięśnie szkieletowe
Po wprowadzeniu produktu leczniczego do obrotu zgłaszano przypadki wystąpienia miopatii i rabdomiolizy podczas stosowania ezetymibu. Większość pacjentów, u których doszło do rabdomiolizy przyjmowała statynę jednocześnie z ezetymibem. Jednak bardzo rzadko zgłaszano również występowanie rabdomiolizy w przypadku monoterapii oraz w przypadku jednoczesnego stosowania ezetymibu z innymi produktami, których związek ze zwiększeniem ryzyka rabdomiolizy jest znany.
Jeśli podejrzewany jest rozwój miopatii na podstawie objawów ze strony mięśni lub zostanie ona potwierdzona zwiększeniem aktywności kinazy kreatynowej (CK) przekraczającym 10 razy górną granicę wartości prawidłowych, należy niezwłocznie zaprzestać stosowania produktu leczniczego Ezetimibe Genoptim, statyn i wszelkich innych środków równocześnie przyjmowanych przez pacjenta. Wszyscy pacjenci rozpoczynający leczenie produktem leczniczym Ezetimibe Genoptim powinni być poinformowani o ryzyku wystąpienia miopatii i o konieczności natychmiastowego zgłoszenia wszelkich niewyjaśnionych bólów mięśni, ich tkliwości lub osłabienia (patrz punkt 4.8).
W badaniu IMPROVE-IT 18 144 pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie przydzielano w sposób losowy do grupy otrzymującej ezetymib z symwastatyną w dawce
10 mg + 40 mg na dobę (n=9067) lub symwastatynę w dawce 40 mg na dobę (n=9077). Podczas okresu obserwacji, którego mediana wynosiła 6,0 lat, częstość występowania miopatii w grupie otrzymującej ezetymib z symwastatyną oraz w grupie przyjmującej symwastatynę wynosiła odpowiednio 0,2% i 0,1%. Miopatię zdefiniowano jako niewyjaśnione osłabienie mięśni lub ból ze zwiększoną aktywnością kinazy kreatynowej (CK) w surowicy wynoszącą ≥ 10x GGN lub dwa kolejne epizody zwiększenia aktywności CK wynoszące ≥ 5 i < 10x GGN. Częstość występowania rabdomiolizy w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 0,1% i 0,2%. Rabdomiolizę zdefiniowano jako niewyjaśnione osłabienie mięśni lub ból ze zwiększoną aktywnością CK w surowicy wynoszącą ≥ 10x GGN i objawami uszkodzenia nerek, dwa kolejne epizody zwiększenia aktywności CK wynoszącej ≥ 5 i < 10x GGN z objawami uszkodzenia nerek lub CK ≥ 10 000 j.m./l bez objawów uszkodzenia nerek. (Patrz punkt 4.8.).
W badaniu klinicznym, w którym ponad 9000 pacjentów z przewlekłą chorobą nerek randomizowano do grupy leczonej ezetymibem 10 mg z symwastatyną 20 mg na dobę (n=4650) lub placebo (n=4620) (mediana okresu obserwacji 4,9 roku), częstość występowania miopatii/rabdomiolizy wynosiła 0,2% wśród osób przyjmujących ezetymib z symwastatyną i 0,1% w grupie placebo (patrz punkt 4.8).
Zaburzenia czynności wątroby
Ze względu na to, że nie są znane skutki długotrwałego stosowania ezetymibu u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności wątroby, nie zaleca się stosowania produktu leczniczego Ezetimibe Genoptim u tych pacjentów (patrz punkt 5.2).
Dzieci i młodzież
Skuteczność i bezpieczeństwo stosowania ezetymibu u pacjentów w wieku od 6 do 10 lat z heterozygotyczną postacią hipercholesterolemii rodzinnej lub z hipercholesterolemią nierodzinną oceniano w trwającym 12 tygodni badaniu klinicznym kontrolowanym placebo. Nie badano jednak wpływu ezetymibu stosowanego w okresie dłuższym niż 12 tygodni w tej grupie wiekowej (patrz punkty 4.2, 4.8, 5.1 i 5.2).
Nie przeprowadzono badań ezetymibu u pacjentów w wieku poniżej 6 lat (patrz punkty 4.2 i 4.8).
Skuteczność i bezpieczeństwo stosowania ezetymibu w skojarzeniu z symwastatyną u pacjentów w wieku 10 do 17 lat z heterozygotyczną hipercholesterolemią rodzinną oceniono w badaniu klinicznym z grupą kontrolną z udziałem dorastających chłopców (w skali Tannera, w fazie II i powyżej) oraz dziewcząt, u których pierwsza miesiączka wystąpiła co najmniej 1 rok wcześniej.
W tym ograniczonym badaniu z grupą kontrolną, ogólnie nie stwierdzono wykrywalnego wpływu na wzrost lub dojrzewanie płciowe u dorastających chłopców lub dziewcząt, ani na długość cyklu miesiączkowego u dziewcząt. Nie przeprowadzono jednak badań dotyczących wpływu stosowania ezetymibu przez okres > 33 tygodni na wzrost i proces dojrzewania płciowego (patrz punkty 4.2 i 4.8).
Nie przeprowadzono oceny bezpieczeństwa stosowania i skuteczności ezetymibu w skojarzeniu z symwastatyną w dawkach przekraczających 40 mg na dobę u dzieci i młodzieży w wieku 10 do 17 lat.
Nie przeprowadzono badań dotyczących bezpieczeństwa stosowania i skuteczności ezetymibu stosowanego w skojarzeniu z symwastatyną u dzieci i młodzieży w wieku poniżej 10 lat (patrz punkty 4.2 i 4.8).
Nie przeprowadzono oceny długotrwałej skuteczności stosowania ezetymibu u pacjentów w wieku poniżej 17 lat w zakresie zmniejszenia zachorowalności i śmiertelności w wieku dojrzałym.
Fibraty
Nie określono bezpieczeństwa stosowania i skuteczności ezetymibu w skojarzeniu z fibratami.
Jeśli u pacjentów przyjmujących Ezetimibe Genoptim i fenofibrat podejrzewa się wystąpienie kamicy żółciowej, wskazane są badania pęcherzyka żółciowego, a leczenie to należy przerwać (patrz punkty 4.5 i 4.8).
Cyklosporyna
Należy zachować ostrożność na początku stosowania produktu leczniczego Ezetimibe Genoptim u pacjentów przyjmujących cyklosporynę. Należy monitorować stężenia cyklosporyny u pacjentów przyjmujących Ezetimibe Genoptim i cyklosporynę (patrz punkt 4.5).
Substancje przeciwzakrzepowe
W przypadku stosowania produktu leczniczego Ezetimibe Genoptim jednocześnie z warfaryną, inną substancją przeciwzakrzepową z grupy pochodnych kumaryny lub fluindionem, należy odpowiednio monitorować wartości INR (międzynarodowy wskaźnik znormalizowany) (patrz punkt 4.5).
Substancja pomocnicza
Produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub z zespołem złego wchłaniania glukozy-galaktozy.
Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy, że uznaje się za
„wolny od sodu”.
W badaniach przedklinicznych wykazano, że ezetymib nie indukuje metabolizujących leki enzymów z grupy cytochromu P450. Nie obserwowano istotnych klinicznie interakcji farmakokinetycznych pomiędzy ezetymibem a lekami, o których wiadomo, że są metabolizowane przez cytochromy P450 1A2, 2D6, 2C8, 2C9 i 3A4 lub przez N-acetylotransferazę.
W badaniach dotyczących interakcji klinicznych stwierdzono, że ezetymib nie ma wpływu na parametry farmakokinetyczne dapsonu, dekstrometorfanu, digoksyny, doustnych środków antykoncepcyjnych (zawierających etynyloestradiol i lewonorgestrel), glipizydu, tolbutamidu lub midazolamu, podczas jednoczesnego stosowania tych leków. Cymetydyna podawana jednocześnie z ezetymibem nie miała wpływu na jego biodostępność.
Leki zobojętniające
Jednoczesne przyjmowanie leków zobojętniających zmniejsza szybkość wchłaniania ezetymibu, ale nie ma wpływu na jego biodostępność. Zmniejszenie szybkości wchłaniania nie jest uważane za klinicznie istotne.
Kolestyramina
Jednoczesne podawanie kolestyraminy zmniejsza średnią wartość pola pod krzywą (AUC) ezetymibu całkowitego (ezetymib + glukuronian ezetymibu) o około 55%. Efekt zwiększonej redukcji stężenia cholesterolu LDL po dołączeniu leczenia produktem leczniczym Ezetimibe Genoptim do leczenia kolestyraminą może ulec osłabieniu w wyniku tej interakcji (patrz punkt 4.2).
Fibraty
Lekarze powinni wziąć pod uwagę możliwe ryzyko wystąpienia kamicy żółciowej i schorzenia pęcherzyka żółciowego u pacjentów przyjmujących fenofibrat i Ezetimibe Genoptim (patrz punkty 4.4 i 4.8).
Jeśli u pacjentów przyjmujących Ezetimibe Genoptim i fenofibrat podejrzewa się wystąpienie kamicy żółciowej, wskazane są badania pęcherzyka żółciowego, a leczenie to należy przerwać (patrz punkt 4.8).
Podczas jednoczesnego przyjmowania fenofibratu lub gemfibrozylu następuje nieznaczne zwiększenie całkowitego stężenia ezetymibu (odpowiednio: 1,5- i 1,7-krotnie).
Nie przeprowadzono badań dotyczących jednoczesnego stosowania ezetymibu w skojarzeniu z innymi fibratami.
Fibraty mogą zwiększać wydalanie cholesterolu do żółci, co prowadzi do kamicy żółciowej. W badaniu na zwierzętach, ezetymib czasem zwiększał stężenie cholesterolu w żółci zawartej w pęcherzyku żółciowym, ale nie u wszystkich gatunków (patrz punkt 5.3). Ryzyko powstawania kamieni w pęcherzyku żółciowym związane z leczeniem produktem Ezetimibe Genoptim nie może być wykluczone.
Statyny
Nie stwierdzono istotnych klinicznie interakcji farmakokinetycznych podczas jednoczesnego stosowania ezetymibu z atorwastatyną, symwastatyną, prawastatyną, lowastatyną, fluwastatyną lub rozuwastatyną.
Cyklosporyna
W badaniu z udziałem 8 pacjentów po przeszczepieniu nerki (klirens kreatyniny > 50 ml/min.), którzy przyjmowali stałą dawkę cyklosporyny, po podaniu pojedynczej dawki 10 mg ezetymibu stwierdzono 3,4-krotne zwiększenie średniej wartości AUC całkowitego ezetymibu (zakres od 2,3 do 7,9-krotnie) w porównaniu z grupą osób zdrowych, otrzymujących ezetymib w monoterapii w ramach innego badania (n=17). W innym badaniu u pacjenta po zabiegu przeszczepienia nerki z ciężkim zaburzeniem czynności nerek, który przyjmował cyklosporynę i wiele innych leków, wykazano 12-krotne zwiększenie stężenia całkowitego ezetymibu, w porównaniu z osobami z grupy kontrolnej otrzymującymi ezetymib w monoterapii. W badaniu skrzyżowanym złożonym z dwóch okresów, w którym uczestniczyło dwunastu zdrowych ochotników stosowanie 20 mg ezetymibu na dobę przez 8 dni z podaniem pojedynczej dawki cyklosporyny wielkości 100 mg w dniu 7. badania spowodowało średnie zwiększenie AUC cyklosporyny o 15% (zakres wynosił od 10% zmniejszenia do 51% zwiększenia) w porównaniu z podaniem wyłącznie pojedynczej dawki cyklosporyny wielkości 100 mg. Nie przeprowadzono badania kontrolowanego dotyczącego wpływu jednoczesnego stosowania ezetymibu na narażenie na cyklosporynę u pacjentów po przeszczepieniu nerki. Należy zachować ostrożność rozpoczynając leczenie produktem leczniczym Ezetimibe Genoptim m w trakcie stosowania cyklosporyny. Należy monitorować stężenie cyklosporyny u pacjentów przyjmujących jednocześnie Ezetimibe Genoptim i cyklosporynę (patrz punkt 4.4).
Substancje przeciwzakrzepowe
Jednoczesne stosowanie ezetymibu (10 mg raz na dobę) nie miało istotnego wpływu na biodostępność warfaryny i czas protrombinowy w badaniu przeprowadzonym z udziałem dwunastu zdrowych dorosłych mężczyzn. Jednakże istnieją doniesienia z okresu po wprowadzeniu do obrotu dotyczące zwiększenia wartości INR u pacjentów stosujących warfarynę lub fluindion, u których dołączono leczenie ezetymibem. W przypadku dołączenia produktu leczniczego Ezetimibe Genoptim do terapii z warfaryną, inną substancją przeciwzakrzepową z grupy pochodnych kumaryny lub fluindionem, należy odpowiednio monitorować INR (patrz punkt 4.4).
Dzieci i młodzież
Badania dotyczące interakcji przeprowadzono wyłącznie u dorosłych.
Stosowanie produktu leczniczego Ezetimibe Genoptim w skojarzeniu ze statyną jest przeciwwskazane w okresie ciąży i laktacji (patrz punkt 4.3). Należy zapoznać się z ChPL dotyczącą określonej statyny.
Ciąża
Ezetimibe Genoptim wolno podawać kobietom w ciąży jedynie wówczas, gdy jest to bezwzględnie konieczne. Brak danych klinicznych na temat stosowania ezetymibu w okresie ciąży. Badania na zwierzętach dotyczące stosowania ezetymibu w monoterapii nie wykazały żadnego bezpośredniego lub pośredniego szkodliwego oddziaływania na przebieg ciąży, rozwój zarodka i płodu, przebieg porodu lub rozwój noworodka (patrz punkt 5.3).
Karmienie piersią
Produktu leczniczego Ezetimibe Genoptim nie należy stosować w okresie laktacji. Badania na szczurach wykazały, że ezetymib jest wydzielany do mleka tych zwierząt. Nie wiadomo, czy ezetymib jest wydzielany do mleka ludzkiego.
Płodność
Brak dostępnych danych z badań klinicznych dotyczących wpływu ezetymibu na płodność u ludzi. Ezetymib nie miał wpływu na płodność samców i samic szczurów (patrz punkt 5.3).
Nie przeprowadzono badań dotyczących wpływu leku na zdolność prowadzenia pojazdów i obsługiwania maszyn. Niemniej jednak, podczas prowadzenia pojazdów i obsługiwania maszyn należy wziąć pod uwagę, że zgłaszano występowanie zawrotów głowy.
Tabelaryczny wykaz działań niepożądanych (obserwowanych podczas badań klinicznych i po wprowadzeniu produktu leczniczego do obrotu)
W przeprowadzonych badaniach klinicznych trwających do 112 tygodni 2396 pacjentom podawano ezetymib w dawce 10 mg na dobę w monoterapii, 11 308 pacjentom w skojarzeniu ze statyną oraz 185 pacjentom w skojarzeniu z fenofibratem. Działania niepożądane były zwykle łagodne i przemijające. Ogólna częstość występowania działań niepożądanych w badaniach była podobna do częstości ich występowania podczas stosowania placebo. Stwierdzono również, że liczba pacjentów, którzy przerwali leczenie z powodu działań niepożądanych była porównywalna w grupie przyjmującej ezetymib i placebo.
Ezetymib w monoterapii lub w skojarzeniu ze statyną:
Poniżej przedstawiono działania niepożądane obserwowane u pacjentów leczonych ezetymibem w monoterapii (n=2396), które pojawiły się z większą częstością niż u pacjentów przyjmujących placebo (n=1159) lub u pacjentów leczonych ezetymibem w skojarzeniu ze statyną (n=11308), które pojawiły się z większą częstością niż u pacjentów przyjmujących jedynie statynę (n=9361). Działania niepożądane obserwowane po wprowadzeniu do obrotu pochodzą ze zgłoszeń dotyczących ezetymibu stosowanego w monoterapii lub w skojarzeniu ze statyną.
Działania niepożądane obserwowane w badaniach klinicznych ezetynibu (w monoterapii lub w skojarzeniu ze statyną) lub zgłoszone po wprowadzeniu ezetynibu do obrotu, w monoterapii lub w skojarzeniu ze statyną, wymieniono w Tabeli 1. Objawy te przedstawiono według klasyfikacji układów i narządów oraz częstości występowania.
Częstości występowania określono jako występujące: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1000), bardzo rzadko (< 1/10 000) oraz częstość nieznana (nie może być określona na podstawie dostępnych danych).
Tabela 1 Działania niepożądane
Klasyfikacja układów i narządów Częstość występowania | Działanie niepożądane |
Zaburzenia krwi i układu chłonnego | |
Częstość nieznana | małopłytkowość |
Zaburzenia układu immunologicznego | |
Częstość nieznana | reakcje nadwrażliwości, w tym wysypka; pokrzywka; wstrząs anafilaktyczny i obrzęk naczynioruchowy |
Zaburzenia metabolizmu i odżywiania | |
Niezbyt często | zmniejszenie apetytu |
Zaburzenia psychiczne | |
Częstość nieznana | depresja |
Zaburzenia układu nerwowego | |
Często | ból głowy |
Niezbyt często | parestezje |
Częstość nieznana | zawroty głowy |
Zaburzenia naczyniowe | |
Niezbyt często | uderzenia gorąca; nadciśnienie |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | |
Niezbyt często | kaszel |
Czestość nieznana | duszność |
Zaburzenia żołądka i jelit | |
Często | ból brzucha; biegunka; wzdęcia |
Niezbyt często | niestrawność; refluks żołądkowo-przełykowy; nudności; suchość w jamie ustnej; zapalenie błony śluzowej żołądka |
Częstość nieznana | zapalenie trzustki; zaparcie |
Zaburzenia wątroby i dróg żółciowych | |
Częstość nieznana | zapalenie wątroby; kamica żółciowa; zapalenie pęcherzyka żółciowego |
Zaburzenia skóry i tkanki podskórnej | |
Niezbyt często | świąd; wysypka; pokrzywka |
Częstość nieznana | rumień wielopostaciowy |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | |
Często | ból mięśni |
Niezbyt często | ból stawów; skurcze mięśni; ból szyi; ból pleców, osłabienie mięśni; ból kończyn |
Częstość nieznana | miopatia/rabdomioliza (patrz punkt 4.4) |
Zaburzenia ogólne i stany w miejscu podania | |
Często | zmęczenie |
Niezbyt często | ból w klatce piersiowej; ból; osłabienie; obrzęk obwodowy |
Badania diagnostyczne | |
Często | zwiększenie aktywności AlAT i (lub) AspAT |
Niezbyt często | zwiększenie aktywności fosfokinazy kreatynowej (CPK) we krwi; zwiększenie aktywności gamma- glutamylotransferazy; nieprawidłowe wyniki badań czynnościowych wątroby |
Ezetimibe Genoptim w skojarzeniu z fenofibratem Zaburzenia żołądka i jelit: ból brzucha (często)
W kontrolowanym placebo klinicznym badaniu wieloośrodkowym, z podwójnie ślepą próbą, uczestniczyli pacjenci z mieszaną hiperlipidemią. 625 pacjentów leczonych było przez 12 tygodni, a 576 pacjentów przez 1 rok. W badaniu tym, 172 pacjentów przyjmujących ezetymib i fenofibrat ukończyło 12-tygodniowe leczenie, a 230 pacjentów przyjmujących ezetymib i fenofibrat (w tym 109 przyjmujących ezetymib w monoterapii przez pierwszych 12 tygodni) ukończyło leczenie trwające 1 rok. Celem badania nie było porównanie leczonych grup pacjentów pod względem występowania rzadkich działań niepożądanych. Wskaźnik występowania (przedział ufności 95%) istotnego klinicznie zwiększenia aktywności aminotransferaz (> 3x GGN w kolejnych oznaczeniach) w surowicy wynosił odpowiednio 4,5% (1,9; 8,8) dla fenofibratu stosowanego w monoterapii i 2,7% (1,2; 5,4) dla ezetymibu podawanego w skojarzeniu z fenofibratem, po dostosowaniu ekspozycji na
leczenie. Natomiast wskaźnik cholecystektomii wynosił odpowiednio, dla fenofibratu stosowanego w monoterapii 0,6% (0,0; 3,1) i dla ezetymibu podawanego w skojarzeniu z fenofibratem 1,7% (0,6; 4,0)
(patrz punkty 4.4 i 4.5).
Dzieci i młodzież (w wieku od 6 do 17 lat)
W badaniu prowadzonym z udziałem dzieci i młodzieży (w wieku od 6 do 10 lat) z heterozygotyczną postacią hipercholesterolemii rodzinnej lub hipercholesterolemią nierodzinną (n=138) obserwowano zwiększenie aktywności AlAT i (lub) AspAT (≥ 3x GGN w kolejnych oznaczeniach) u 1,1% pacjentów (1 pacjent) leczonych ezetymibem w porównaniu z 0% osób z grupy placebo. Nie stwierdzono żadnego przypadku zwiększenia aktywności kinazy kreatynowej (CK) (≥ 10x GGN). Nie zgłoszono żadnego przypadku miopatii.
W oddzielnym badaniu z udziałem dzieci i młodzieży (w wieku 10–17 lat) z heterozygotyczną hipercholesterolemią rodzinną (n=248), u 3% pacjentów (4 pacjentów) leczonych ezetymibem w skojarzeniu z symwastatyną obserwowano zwiększenie aktywności AlAT i (lub) AspAT (≥ 3x GGN w kolejnych oznaczeniach) w porównaniu z 2% osób (2 pacjentami) z grupy stosującej symwastatynę w monoterapii; podwyższenie stężenia CK (≥ 10x GGN) stwierdzono odpowiednio u 2% (2 pacjentów) i 0% uczestników badania. Nie zaobserwowano przypadków miopatii.
Te badania nie były dostosowane do oceny porównawczej rzadko występujących działań niepożądanych produktu leczniczego.
Pacjenci z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie
W badaniu IMPROVE-IT (patrz punkt 5.1) z udziałem 18 144 pacjentów leczonych ezetymibem z symwastatyną w dawce 10 mg + 40 mg (n=9067, przy czym u 6% pacjentów dawkę ezetymibu i symwastatyny zwiększono do 10 mg + 80 mg) lub symwastatyną w dawce 40 mg (n=9077, przy czym u 27% pacjentów dawkę symwastatyny zwiększono do 80 mg) w okresie obserwacji, którego mediana wynosiła 6,0 lat, obserwowano zbliżone profile bezpieczeństwa. Wskaźnik przerwania leczenia z powodu działań niepożądanych wynosił 10,6% u pacjentów leczonych ezetymibem z symwastatyną oraz 10,1% u pacjentów leczonych symwastatyną. Częstość występowania miopatii w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 0,2% i 0,1%. Miopatię zdefiniowano, jako niewyjaśnione osłabienie mięśni lub ból ze zwiększoną aktywnością CK w surowicy wynoszącą ≥ 10x GGN lub dwa kolejne epizody zwiększenia aktywności CK wynoszące ≥ 5 i < 10x GGN. Częstość występowania rabdomiolizy w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 0,1% i 0,2%. Rabdomiolizę zdefiniowano jako niewyjaśnione osłabienie mięśni lub ból ze zwiększoną aktywnością CK w surowicy wynoszącą ≥ 10x GGN i objawami uszkodzenia nerek, dwa kolejne epizody zwiększenia aktywności CK wynoszącej ≥ 5 i < 10x GGN z objawami uszkodzenia nerek lub CK ≥ 10 000 j.m./l bez objawów uszkodzenia nerek. Częstość występowania kolejnych wzrostów poziomu transaminaz (≥ 3x GGN) w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 2,5% i 2,3%. (Patrz punkt 4.4.). Działania niepożądane ze strony pęcherzyka żółciowego zgłoszono u 3,1% pacjentów z grupy otrzymującej ezetymib z symwastatyną oraz u 3,5% pacjentów z grupy leczonej symwastatyną. Częstość hospitalizacji z powodu cholecystektomii w obu leczonych grupach wynosiła 1,5%.
Nowotwór (zdefiniowany jako dowolny nowotwór) zdiagnozowano podczas badania u odpowiednio 9,4% i 9,5% pacjentów.
Pacjenci z przewlekłą chorobą nerek
W badaniu dotyczącym ochrony serca i nerek (ang. SHARP, Study of Heart and Renal Protection) (patrz punkt 5.1) z udziałem ponad 9000 pacjentów przyjmujących skojarzone leczenie ezetymibem 10 mg z symwastatyną 20 mg na dobę (n=4650) lub placebo (n=4620) profile bezpieczeństwa były porównywalne w okresie obserwacji wynoszącym średnio 4,9 roku. W tym badaniu rejestrowano tylko ciężkie działania niepożądane i przypadki rezygnacji z leczenia z powodu działań niepożądanych. Częstość przerywania leczenia z powodu wystąpienia działań niepożądanych była porównywalna (10,4% wśród pacjentów leczonych ezetymibem z symwastatyną, 9,8% wśród
pacjentów przyjmujących placebo). Częstość występowania miopatii/rabdomiolizy wynosiła 0,2% w przypadku pacjentów leczonych ezetymibem w skojarzeniu z symwastatyną i 0,1% wśród pacjentów przyjmujących placebo. Przypadki zwiększenia aktywności aminotransferaz (> 3x GGN) stwierdzono u 0,7% pacjentów leczonych ezetymibem w skojarzeniu z symwastatyną w porównaniu z 0,6% pacjentów przyjmujących placebo. (Patrz punkt 4.4). W tym badaniu nie odnotowano statystycznie istotnego wzrostu częstości występowania określonych wcześniej działań niepożądanych, w tym nowotworów (9,4% w grupie leczonej ezetymibem z symwastatyną, 9,5% w grupie przyjmującej placebo), zapalenia wątroby, operacji usunięcia pęcherzyka żółciowego lub powikłań kamicy żółciowej, lub zapalenia trzustki.
Wpływ leku na parametry laboratoryjne
W badaniach z grupą kontrolną, w których ezetymib był stosowany w monoterapii, częstość występowania istotnego klinicznie zwiększenia aktywności aminotransferaz w surowicy (zwiększenie aktywności aminotransferazy alaninowej (AlAT) i (lub) asparaginianowej (AspAT)
≥ 3x GGN w kolejnych oznaczeniach) była podobna w grupie przyjmujących ezetymib (0,5%) oraz placebo (0,3%).W badaniach, w których ezetymib stosowano w skojarzeniu częstość występowania wspomnianego uprzednio zwiększenia aktywności aminotransferaz w surowicy wynosiła 1,3% w grupie pacjentów przyjmujących ezetymib w skojarzeniu ze statyną oraz 0,4% w grupie pacjentów przyjmujących wyłącznie statynę. Zwiększenie aktywności enzymów przebiegało na ogół bez objawów; nie stwierdzano cech zastoju żółci. Aktywność aminotransferaz powracała do wartości początkowych po zaprzestaniu przyjmowania leków albo podczas dalszego ich stosowania (patrz punkt 4.4).
W badaniach klinicznych zgłaszano zwiększenie aktywności CK przekraczające 10 razy górną granicę wartości prawidłowych u 4 spośród 1674 (0,2%) pacjentów stosujących wyłącznie ezetymib w porównaniu z 1 spośród 786 (0,1%) pacjentów stosujących placebo oraz u 1 spośród 917 (0,1%) pacjentów stosujących jednocześnie ezetymib i statyny w porównaniu z 4 spośród 929 (0,4%) pacjentów stosujących wyłącznie statyny. Nie stwierdzono większej liczby przypadków miopatii lub rabdomiolizy związanych ze stosowaniem ezetymibu w porównaniu z odpowiednią grupą kontrolną (placebo lub statyna w monoterapii) (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa
tel.: + 48 22 49-21-301
fax: + 48 22 49-21-309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Ezetymib był dobrze tolerowany w badaniach klinicznych, w których, dawkę 50 mg na dobę podawano 15 zdrowym ochotnikom przez 14 dni, a dawkę 40 mg na dobę podawano 18 pacjentom z hipercholesterolemią pierwotną przez okres 56 dni. W badaniach na zwierzętach nie obserwowano działania toksycznego po przyjęciu pojedynczej dawki doustnej 5000 mg/kg ezetymibu u szczurów i myszy oraz 3000 mg/kg u psów.
Informowano o kilku przypadkach przedawkowania ezetymibu; większość tych przypadków nie była związana z występowaniem działań niepożądanych. Raportowane działania niepożądane nie były poważne.
W przypadku wystąpienia przedawkowania należy zastosować leczenie objawowe i wspomagające.
Grupa farmakoterapeutyczna: inne leki modyfikujące stężenie lipidów, kod ATC: C10A X09 Mechanizm działania
Ezetymib należy do nowej grupy leków zmniejszających stężenie lipidów, które wybiórczo hamują
wchłanianie cholesterolu i pochodnych steroli roślinnych w jelitach. Ezetymib działa po podaniu doustnym. Jego mechanizm działania różni się od mechanizmów działania innych grup leków zmniejszających stężenie cholesterolu (np. statyn, żywic wiążących kwasy żółciowe, pochodnych kwasu fibrynowego i stanoli pochodzenia roślinnego). Celem działania ezetymibu na poziomie molekularnym jest nośnik steroli, białko Niemann-Pick C1-Like 1 (NPC1L1), które odgrywa rolę w wychwytywaniu cholesterolu i fitosteroli w jelicie.
Ezetymib wiąże się z rąbkiem szczoteczkowym jelita cienkiego i hamuje wchłanianie cholesterolu. Prowadzi to do zmniejszenia ilości cholesterolu transportowanego do wątroby. Statyny zmniejszają syntezę cholesterolu w wątrobie. Ze względu na różne mechanizmy działania obu leków możliwe jest uzupełniające się zmniejszenie stężenia cholesterolu. W trwającym 2 tygodnie badaniu z udziałem 18 pacjentów z hipercholesterolemią ezetymib hamował wchłanianie cholesterolu z jelit o 54% w porównaniu z placebo.
Działanie farmakodynamiczne
Przeprowadzono szereg badań przedklinicznych, aby określić czy działanie ezetymibu hamujące absorpcję cholesterolu jest wybiórcze. Ezetymib hamował wchłanianie cholesterolu znakowanego izotopem węgla C14, nie miał zaś wpływu na wchłanianie triglicerydów, kwasów tłuszczowych, kwasów żółciowych, progesteronu, etynyloestradiolu lub witamin rozpuszczalnych w tłuszczach, takich jak witaminy A i D.
Badania epidemiologiczne wykazały, że zachorowalność i śmiertelność z powodu chorób układu krążenia są związane proporcjonalnie ze stężeniem cholesterolu całkowitego i cholesterolu LDL, natomiast odwrotnie proporcjonalnie ze stężeniem cholesterolu HDL.
Podawanie ezetymibu ze statyną skutecznie zmniejsza ryzyko wystąpienia incydentów sercowo- naczyniowych u pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie.
Skuteczność kliniczna i bezpieczeństwo stosowania
W badaniach klinicznych z grupą kontrolną stosowano ezetymib w monoterapii albo w skojarzeniu ze statyną. U pacjentów z hipercholesterolemią zastosowanie ezetymibu powodowało istotne zmniejszenie stężenia cholesterolu całkowitego, stężenia cholesterolu LDL, apolipoproteiny B (Apo B) oraz triglicerydów, jak również zwiększenie stężenia cholesterolu HDL.
Hipercholesterolemia pierwotna
W trwającym 8 tygodni badaniu z podwójnie ślepą próbą, kontrolowanym placebo uczestniczyło 769 pacjentów z hipercholesterolemią, którzy już przyjmowali statynę w monoterapii i u których nie uzyskano docelowego stężenia cholesterolu LDL (2,6 do 4,1 mmol/l [100 do 160 mg/dl], w zależności od stężenia początkowego) według amerykańskiego National Cholesterol Education Program (NCEP). Pacjentów tych przydzielono losowo do grupy otrzymującej ezetymib w dawce 10 mg lub placebo, w skojarzeniu z aktualnie stosowaną statyną.
Wśród pacjentów leczonych statyną, u których nie uzyskano docelowego stężenia cholesterolu LDL (około 82%) istotnie więcej pacjentów przyjmujących ezetymib uzyskało docelowe stężenie cholesterolu LDL na zakończenie okresu obserwacji niż pacjentów przydzielonych losowo do grupy placebo (odpowiednio 72% w porównaniu z 19%). Również odpowiednie zmniejszenie stężenia cholesterolu LDL było istotnie różne (25% w grupie przyjmujących ezetymib w porównaniu z 4% w grupie placebo). Ponadto dołączenie leczenia ezetymibem do aktualnie przyjmowanej statyny istotnie zmniejszyło stężenie cholesterolu całkowitego, stężenie ApoB, stężenie triglicerydów i zwiększyło stężenie cholesterolu HDL w porównaniu z placebo. Ezetymib lub placebo dodane do aktualnie przyjmowanej statyny powodowały zmniejszenie mediany stężenia białka C-reaktywnego odpowiednio o 10% lub 0% w porównaniu z wartościami początkowymi.
Przeprowadzono 2 badania z podwójnie ślepą próbą, z randomizacją, grupą kontrolną placebo i okresem obserwacji wynoszącym 12 tygodni, w których wzięło udział 1719 pacjentów z pierwotną hipercholesterolemią. W grupie przyjmującej ezetymib w dawce 10 mg stwierdzono istotnie większą redukcję stężenia cholesterolu całkowitego (o 13%), stężenia cholesterolu LDL (o 19%), stężenia ApoB (14%) i triglicerydów (o 8%) oraz zwiększenie stężenia cholesterolu HDL (o 3%) w porównaniu z grupą placebo. Ponadto ezetymib nie miał wpływu na osoczowe stężenia witamin rozpuszczalnych w tłuszczach (witaminy A, D, E), a także nie miał wpływu na czas protrombinowy. Podobnie jak inne produkty lecznicze zmniejszające stężenie lipidów, ezetymib nie zaburzał wytwarzania hormonów steroidowych kory nadnerczy.
W wieloośrodkowym badaniu klinicznym z grupą kontrolną prowadzonym metodą podwójnie ślepej próby (ENHANCE) 720 pacjentów z heterozygotyczną hipercholesterolemią rodzinną randomizowano do grup leczonych przez 2 lata ezetymibem w dawce wynoszącej 10 mg w skojarzeniu z symwastatyną w dawce wynoszącej 80 mg (n=357) lub symwastatyną w dawce wynoszącej 80 mg (n=363). Głównym celem tego badania było sprawdzenie wpływu stosowania leczenia skojarzonego ezetymibem i symwastatyną na grubość błony wewnętrznej i środkowej (ang. IMT, intima-media).
Wciąż nie wykazano wpływu tego zastępczego markera na zachorowalność i śmiertelność z przyczyn sercowo-naczyniowych.
Pierwszorzędowy punkt końcowy badania, zmiana średniej wartości IMT we wszystkich sześciu odcinkach tętnicy szyjnej mierzonej metodą ultrasonografii w projekcji B, nie różnił się istotnie (p=0,29) w obu grupach leczonych. Po upływie 2 lat badania z zastosowaniem 10 mg ezetymibu w skojarzeniu z 80 mg symwastatyny lub samej symwastatyny w dawce 80 mg grubość błony wewnętrznej i środkowej zwiększyła się odpowiednio o 0,0111 mm i 0,0058 mm (wyjściowa średnia wartość IMT tętnicy szyjnej wynosiła odpowiednio 0,68 mm i 0,69 mm).
Leczenie ezetymibem w dawce 10 mg w skojarzeniu z symwastatyną w dawce 80 mg wiązało się z istotnie większym obniżeniem stężenia frakcji cholesterolu LDL, cholesterolu całkowitego, ApoB, oraz triglicerydów w porównaniu z leczeniem samą symwastatyną w dawce 80 mg. Procentowy wzrost stężenia cholesterolu HDL był podobny w obu grupach leczonych. Działania niepożądane zgłaszane w grupie leczonej ezetymibem w dawce 10 mg w skojarzeniu z symwastatyną w dawce 80 mg były zgodne ze znanym profilem bezpieczeństwa takiej terapii.
Dzieci i młodzież
W wieloośrodkowym badaniu z podwójnie ślepą próbą i grupą kontrolną, 138 pacjentów (59 chłopców oraz 79 dziewcząt) w wieku od 6 do 10 lat (średni wiek 8,3 roku) z heterozygotyczną postacią hipercholesterolemii rodzinnej lub z hipercholesterolemią nierodzinną, u których wyjściowe stężenie cholesterolu LDL wynosiło od 3,74 do 9,92 mmol/l, randomizowano do leczenia ezetymibem w dawce 10 mg lub placebo przez 12 tygodni.
W 12 tygodniu ezetymib spowodował istotne obniżenie stężenia cholesterolu całkowitego (-21% w porównaniu z 0%), cholesterolu LDL (-28% w porównaniu z -1%), ApoB (-22% w porównaniu z - 1%) i cholesterolu nie-HDL (-26% w porównaniu z 0%) w porównaniu z placebo. Wyniki uzyskane
we wspomnianych dwóch grupach leczonych były zbliżone w odniesieniu do stężeń triglicerydów i cholesterolu HDL (odpowiednio -6% w porównaniu z +8% oraz +2% w porównaniu z +1%).
W wieloośrodkowym badaniu z podwójnie ślepą próbą i grupą kontrolną, 142 chłopców (w skali Tannera w fazie II i powyżej) oraz 106 dziewcząt, u których wystąpiła już pierwsza miesiączka, w wieku 10 do 17 lat (średnia wieku 14,2 roku) z heterozygotyczną hipercholesterolemią rodzinną (HeFH) i stężeniem wyjściowym cholesterolu LDL pomiędzy 4,1 a 10,4 mmol/l przydzielono losowo albo do grupy przyjmującej ezetymib w dawce 10 mg w skojarzeniu z symwastatyną (10, 20 lub 40 mg), albo do grupy otrzymującej wyłącznie symwastatynę (10, 20 lub 40 mg) przez okres 6 tygodni, ezetymib podawany w skojarzeniu z symwastatyną w dawce 40 mg lub symwastatynę w monoterapii w dawce 40 mg przez okres kolejnych 27 tygodni, a następnie metodą terapii otwartej ezetymib w skojarzeniu z symwastatyną (10, 20 lub 40 mg) przez kolejne 20 tygodni.
W tygodniu 6. wykazano, że ezetymib stosowany w skojarzeniu z symwastatyną (we wszystkich dawkach) znacząco obniżał stężenie cholesterolu całkowitego (38% w porównaniu z 26%), cholesterolu LDL (49% w porównaniu z 34%), ApoB (39% w porównaniu z 27%) i cholesterolu nie- HDL (47% w porównaniu z 33%) w porównaniu z symwastatyną w monoterapii (we wszystkich dawkach). W odniesieniu do stężenia triglicerydów i cholesterolu HDL wyniki otrzymane w obu grupach leczonych były zbliżone (odpowiednio -17% w porównaniu z -12% oraz +7% w porównaniu z +6%). W tygodniu 33. uzyskane wyniki były zgodne z otrzymanymi w tygodniu 6. i znacząco większa liczba pacjentów otrzymujących ezetymib w skojarzeniu z symwastatyną w dawce 40 mg (62%), osiągnęła idealną docelową wartość stężenia cholesterolu LDL według kryteriów NCEP AAP (< 2,8 mmol/l [110 mg/dl]) w porównaniu z pacjentami przyjmującymi wyłącznie symwastatynę w dawce 40 mg (25%). W tygodniu 53, pod koniec fazy przedłużenia badania prowadzonego metodą terapii otwartej, utrzymywały się wyniki leczenia w zakresie parametrów lipidowych.
Nie przeprowadzono oceny bezpieczeństwa stosowania i skuteczności leczenia skojarzonego ezetymibem i symwastatyną w dawkach przekraczających 40 mg na dobę u dzieci w wieku 10 do 17 lat. Nie przeprowadzono badań dotyczących bezpieczeństwa stosowania i skuteczności ezetymibu stosowanego w skojarzeniu z symwastatyną u dzieci i młodzieży w wieku poniżej 10 lat. Nie przeprowadzono oceny długoterminowej skuteczności leczenia ezetymibem u pacjentów poniżej 17 lat w zakresie zmniejszenia zachorowalności i śmiertelności w wieku dojrzałym.
Zapobieganie wystąpieniu incydentów sercowo-naczyniowych
Badanie IMPROVE-IT było wieloośrodkowym, randomizowanym badaniem klinicznym, z podwójnie ślepą próbą i grupą kontrolną przyjmującą aktywny lek, przeprowadzonym z udziałem 18 144 pacjentów włączonych do badania w ciągu 10 dni od hospitalizacji z powodu wystąpienia ostrego zespołu wieńcowego (OZW, tj. ostrego zawału mięśnia sercowego lub niestabilnej dławicy piersiowej). W czasie przyjęcia do szpitala z powodu OZW u pacjentów, którzy nie przyjmowali leczenia obniżającego poziom lipidów, stężenie cholesterolu LDL wynosiło ≤ 125 mg/dl (≤ 3,2 mmol/l), a u pacjentów, którzy przyjmowali leczenie obniżające poziom lipidów, wynosiło ≤ 100 mg/dl (≤ 2,6 mmol/l). Wszystkich pacjentów przydzielano w sposób losowy w stosunku 1:1 do grupy otrzymującej ezetymib z symwastatyną w dawce 10 mg+ 40 mg (n=9067) lub symwastatynę w dawce 40 mg (n=9077). Mediana okresu obserwacji wynosiła 6,0 lat.
Średnia wieku pacjentów wynosiła 63,6 lat. 76% pacjentów stanowili mężczyźni, 84% pacjentów było rasy białej, a 27% pacjentów chorowało na cukrzycę. Średnie stężenie cholesterolu LDL w czasie wystąpienia incydentu kwalifikującego do badania u pacjentów przyjmujących leczenie obniżające poziom lipidów (n=6390) i u tych, którzy nie przyjmowali leczenia obniżającego poziom lipidów (n=11594) wynosiło odpowiednio 80 mg/dl (2,1 mmol/l) i 101 mg/dl (2,6 mmol/l). Przed hospitalizacją z powodu wystąpienia OZW kwalifikującego do badania 34% pacjentów przyjmowało statynę. Po upływie jednego roku średnie stężenie cholesterolu LDL u pacjentów kontynuujących leczenie wynosiło 53,2 mg/dl (1,4 mmol/l) w grupie otrzymującej ezetymib z symwastatyną i 69,9 mg/dl (1,8 mmol/l) w grupie przyjmującej symwastatynę w monoterapii. Poziom lipidów badano na ogół u pacjentów, którzy w dalszym ciągu przyjmowali badane leczenie.
Na pierwszorzędowy punkt końcowy składał się zgon z przyczyn naczyniowo-sercowych, poważne incydenty wieńcowe (zdefiniowane jako zawał mięśnia sercowego niezakończony zgonem, udokumentowana niestabilna dławica piersiowa wymagająca hospitalizacji lub jakakolwiek procedura rewaskularyzacji wieńcowej przeprowadzona przynajmniej 30 dni po losowym przydzieleniu leczenia) oraz udar mózgu niezakończony zgonem. Badanie wykazało, że leczenie ezetymibem w skojarzeniu z symwastatyną pozwalało uzyskać dodatkowe korzyści w zmniejszeniu pierwszorzędowego złożonego punktu końcowego, tj. zgonu z przyczyn sercowo-naczyniowych, poważnego incydentu wieńcowego i udaru mózgu niezakończonego zgonem, w porównaniu z samą symwastatyną (zmniejszenie ryzyka względnego o 6,4%, p=0,016). Pierwszorzędowy punkt końcowy wystąpił u 2572 z 9067 pacjentów
(7-letni wskaźnik Kaplana-Meiera [KM] wynosił 32,72%) w grupie przyjmującej ezetymib z symwastatyną oraz u 2742 z 9077 pacjentów (7-letni wskaźnik KM wynosił 34,67%) w grupie otrzymującej samą symwastatynę (patrz Rycina 1 i Tabela 2.). Oczekuje się, że w przypadku jednoczesnego podawania innych statyn o udowodnionej skuteczności w zmniejszeniu ryzyka incydentów sercowo-naczyniowych korzyści te będą zbliżone. Całkowita liczba zgonów w tej grupie podwyższonego ryzyka nie uległa zmianie (patrz Tabela 2).
Stwierdzono ogólną korzyść w przypadku wszystkich udarów mózgu; jakkolwiek odnotowano niewielkie, nieistotne zwiększenie liczby udarów krwotocznych w grupie ezetymib-symwastatyna w porównaniu do grupy pacjentów otrzymujących samą symwastatynę (patrz Tabela 2). Ryzyko udaru krwotocznego w przypadku jednoczesnego podawania ezetymibu w skojarzeniu ze statyną o silniejszym działaniu nie zostało ocenione w długoterminowych badaniach.
Efekt leczenia ezetymibem z symwastatyną był na ogół spójny z efektami uzyskiwanymi w szeregu podgrup, tj. zależnie od płci, wieku, rasy, cukrzycy w wywiadzie, wyjściowego poziomu lipidów, wcześniejszego leczenia statyną, przebytego udaru mózgu i nadciśnienia.
Rycina 1: Wpływ leczenia skojarzonego ezetymibem z symwastatyną na pierwszorzędowy złożony punkt końcowy, tj. zgon z przyczyn sercowo-naczyniowych, poważny incydent wieńcowy lub udar mózgu niezakończony zgonem
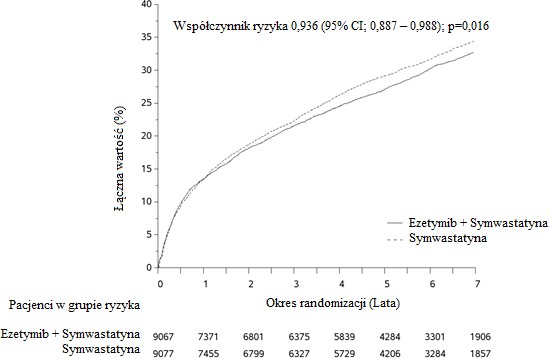
Tabela 2
Poważne incydenty sercowo-naczyniowe u wszystkich przydzielanych w sposób losowy pacjentów w badaniu IMPROVE-IT z podziałem na grupy leczenia
Wynik | Ezetimib+Symwastatyna 10+40 mga (N=9067) | Symwastatyna 40 mgb (N=9077) | Współczynnik ryzyka (95% CI) | Wartość p | ||
n | K-M % c | n | K-M % c | |||
Pierwszorzędowy złożony punkt końcowy skuteczności | ||||||
(zgon z przyczyn sercowo- naczyniowych, poważny incydent wieńcowy i udar mózgu niezakończony zgonem) | 2572 | 32,72% | 2742 | 34,67% | 0,936 (0,887; 0,988) | 0,016 |
Drugorzędowe złożone punkty końcowe skuteczności | ||||||
Zgon związany z chorobą wieńcową, zawał mięśnia sercowego niezakończony zgonem, rewaskularyzacja wieńcowa w trybie pilnym po 30 dniach | 1322 | 17,52% | 1448 | 18,88% | 0,912 (0,847; 0,983) | 0,016 |
Poważny incydent wieńcowy, udar mózgu niezakończony zgonem, zgon (z dowolnej przyczyny) | 3089 | 38,65% | 3246 | 40,25% | 0,948 (0,903; 0,996) | 0,035 |
Zgon z przyczyn sercowo- naczyniowych, zawał mięśnia sercowego niezakończony zgonem, niestabilna dławica piersiowa wymagająca hospitalizacji, jakakolwiek procedura rewaskularyzacji, udar mózgu niezakończony zgonem | 2716 | 34,49% | 2869 | 36,20% | 0,945 (0,897; 0,996) | 0,035 |
Składowe pierwszorzędowego złożonego punktu końcowego skuteczności i wybrane punkty końcowe skuteczności (pierwsze wystąpienie określonego zdarzenia w dowolnym momencie) | ||||||
Zgon z przyczyn sercowo- naczyniowych | 537 | 6,89% | 538 | 6,84% | 1,000 (0,887; 1,127) | 0,997 |
Poważny incydent wieńcowy: | ||||||
- zawał mięśnia sercowego niezakończony zgonem | 945 | 12.77% | 1083 | 14,41% | 0,871 (0,798; 0,950) | 0,002 |
- niestabilna dławica piersiowa wymagająca hospitalizacji | 156 | 2,06% | 148 | 1,92% | 1,059 (0,846; 1,326) | 0,618 |
- rewaskularyzacja wieńcowa po 30 dniach | 1690 | 21,84% | 1793 | 2,.36% | 0,947 (0,886; 1,012) | 0,107 |
Udar mózgu niezakończony zgonem | 245 | 3,49% | 305 | 4,24% | 0,802 (0,678; 0,949) | 0,010 |
Wszystkie przypadki zawału mięśnia sercowego (zakończone i niezakończone zgonem) | 977 | 13,13% | 1118 | 14,82% | 0,872 (0,800; 0,950) | 0,002 |
Wszystkie przypadki udaru (zakończone i niezakończone zgonem) | 296 | 4,16% | 345 | 4,77% | 0,857 (0,734; 1,001) | 0,052 |
- Udar niekrwotocznyd | 242 | 3,48% | 305 | 4,23% | 0,793 (0,670; 0,939) | 0,007 |
- Udar krwotoczny | 59 | 0,77% | 43 | 0,59% | 1,377 (0,930; 2,040) | 0,110 |
Zgon z dowolnej przyczyny | 1215 | 15,36% | 1231 | 15,28% | 0,989 (0,914; 1,070) | 0,782 |
a u 6% pacjentów dawkę ezetymibu + symwastatyny zwiększono do 10 + 80 mg
b u 27% pacjentów dawkę symwastatyny zwiększono do 80 mg.
c estymator Kaplana-Meiera po 7 latach.
d w tym udar niedokrwienny mózgu lub udar niekreślonego rodzaju.
Zapobieganie poważnym zdarzeniom naczyniowym w przewlekłej chorobie nerek
Badanie SHARP było wielonarodowym, randomizowanym badaniem, z grupą kontrolną placebo
i podwójnie ślepą próbą, przeprowadzonym z udziałem 9438 pacjentów z przewlekłą chorobą nerek, z których w chwili rozpoczęcia badania 1/3 była poddawana hemodializie. 4650 pacjentów przydzielono do grupy stosującej kombinację ezetymibu i symwastatyny w stałej dawce 10/20 mg,
a 4620 do grupy placebo. Mediana czasu obserwacji wynosiła 4,9 roku. Średnia wieku pacjentów wynosiła 62 lata, 63% uczestników stanowili mężczyźni, 72% osób było rasy białej, u 23% stwierdzono cukrzycę, a w przypadku pacjentów niedializowanych średnia szacunkowa szybkość przesączania kłębuszkowego (ang. eGFR, estimated glomerular filtration rate) wynosiła 26,5 ml/min/1,73 m2. W kryteriach przystąpienia do badania nie uwzględniono parametrów lipidowych. Średnie wyjściowe stężenie frakcji cholesterolu LDL wynosiło 108 mg/dl. Po upływie jednego roku, w tym u pacjentów nie przyjmujących już badanego produktu leczniczego, stężenie cholesterolu LDL zmniejszyło się względem placebo o 26% w grupie leczonej symwastatyną w monoterapii w dawce 20 mg i o 38% w grupie stosującej ezetymib 10 mg w skojarzeniu z symwastatyną w dawce 20 mg.
Porównaniem pierwotnym określonym w protokole badania SHARP była analiza wyodrębniona zgodnie z zaplanowanym leczeniem „poważnych zdarzeń naczyniowych” (zdefiniowanych jako zawał mięśnia sercowego niezakończony zgonem lub zgon z przyczyn sercowych, udar mózgu lub jakakolwiek procedura rewaskularyzacji) wyłącznie u tych pacjentów przydzielanych w sposób losowy na początku do grupy leczonej ezetymibem w skojarzeniu z symwastatyną (n=4193) lub do grupy placebo (n=4191). W analizach wtórnych uwzględniono tę samą kombinację zdarzeń, którą analizowano w całej kohorcie pacjentów przydzielanych w sposób losowy (w chwili rozpoczęcia badania lub po upływie 1 roku) do grupy leczonej ezetymibem w skojarzeniu z symwastatyną (n=4650) lub do grupy placebo (n=4620), a także poszczególne składowe tej kombinacji.
Analiza pierwszorzędowego punktu końcowego wykazała, że stosowanie ezetymibu w skojarzeniu z symwastatyną wiązało się z istotnym zmniejszeniem ryzyka wystąpienia poważnych zdarzeń naczyniowych (749 pacjentów ze stwierdzonymi zdarzeniami w grupie placebo w porównaniu z 639 przypadkami w grupie leczonej ezetymibem w skojarzeniu z symwastatyną), przy czym ryzyko względne zmniejszyło się o 16% (p=0,001).
Jednakże plan tego badania nie pozwala na odrębną ocenę wkładu ezetymibu w skuteczność w zakresie istotnego zmniejszenia ryzyka występowania poważnych zdarzeń naczyniowych u pacjentów z przewlekłą chorobą nerek.
W Tabeli 3 przedstawiono poszczególne zdarzenia opisywane jako poważne incydenty naczyniowe, stwierdzone u pacjentów przydzielanych w sposób losowy. Stosowanie ezetymibu w skojarzeniu z symwastatyną wiązało się z istotnym zmniejszeniem ryzyka wystąpienia udaru mózgu oraz wykonania jakiejkolwiek procedury rewaskularyzacji, przy nieistotnych różnicach liczbowych na korzyść ezetymibu w skojarzeniu z symwastatyną w odniesieniu do zdarzeń w postaci zawału mięśnia sercowego niezakończonego zgonem i zgonu z przyczyn sercowych.
Tabela 3
Poważne zdarzenia naczyniowe stwierdzone u wszystkich przydzielanych w sposób losowy pacjentów w badaniu SHARP a z podziałem na grupy leczenia
Wynik | Ezetimib 10 mg w skojarzeniu z symwastatyną 20 mg (N=4650) | Placebo (N=4620) | Współczynnik ryzyka (95% CI) | Wartość p |
Poważne zdarzenia naczyniowe | 701 (15,1%) | 814 (17,6%) | 0,85 (0,77-0,94) | 0,001 |
Zawał mięśnia sercowego niezakończony zgonem | 134 (2,9%) | 159 (3,4%) | 0,84 (0,66-1,05) | 0,12 |
Zgon z przyczyn sercowych | 253 (5,4%) | 272 (5,9%) | 0,93 (0,78-1,10) | 0,38 |
Jakikolwiek udar | 171 (3,7%) | 210 (4,5%) | 0,81 (0,66-0,99) | 0,038 |
Niekrwotoczny udar mózgu | 131 (2,8%) | 174 (3,8%) | 0,75 (0,60-0,94) | 0,011 |
Krwotoczny udar mózgu | 45 (1,0%) | 37 (0,8%) | 1,21 (0,78-1,86) | 0,40 |
Jakakolwiek procedura rewaskularyzacji | 284 (6,1%) | 352 (7,6%) | 0,79 (0,68-0,93) | 0,004 |
Duże zdarzenia miażdżycowe (ang. MAE, major atherosclerotic events)b | 526 (11,3%) | 619 (13,4%) | 0,83 (0,74-0,94) | 0,002 |
a Analiza wyodrębniona zgodnie z zaplanowanym leczeniem z uwzględnieniem wszystkich uczestników badania SHARP przydzielanych w sposób losowy do grupy leczonej ezetymibem w skojarzeniu z symwastatyną lub do grupy placebo w chwili rozpoczęcia badania lub po upływie 1 roku.
b MAE: zdefiniowane jako kombinacja zawału mięśnia sercowego niezakończonego zgonem, zgonu z przyczyn wieńcowych, niekrwotocznego udaru mózgu lub jakiejkolwiek procedury rewaskularyzacji
W przypadku pacjentów, u których wyjściowe stężenie cholesterolu LDL było mniejsze (< 2,5 mmol/l) oraz pacjentów, którzy w chwili rozpoczęcia badania poddawani byli dializie, całkowite zmniejszenie stężenia frakcji cholesterolu LDL uzyskane za pomocą ezetymibu w skojarzeniu z symwastatyną było mniejsze niż w przypadku pozostałych pacjentów i, analogicznie, zmniejszenie ryzyka w obu tych grupach było relatywnie osłabione.
Homozygotyczna hipercholesterolemia rodzinna
W badaniu z randomizacją, podwójnie ślepą próbą i z okresem obserwacji wynoszącym 12 tygodni wzięło udział 50 pacjentów z rozpoznaniem homozygotycznej hipercholesterolemii rodzinnej na podstawie danych klinicznych i (lub) genetycznych. Pacjenci przyjmowali atorwastatynę lub symwastatynę (40 mg), stosując lub nie stosując aferezy LDL. Ezetymib przyjmowany w skojarzeniu z atorwastatyną (40 lub 80 mg) lub symwastatyną (40 lub 80 mg) istotnie zmniejszał stężenie cholesterolu LDL (o 15%) w porównaniu ze zwiększeniem dawek symwastatyny lub atorwastatyny, stosowanych w monoterapii z 40 do 80 mg.
Sitosterolemia homozygotyczna (phytosterolemia)
W kontrolowanym placebo badaniu, z podwójnie ślepą próbą i randomizacją oraz trwającym 8 tygodni wzięło udział 37 pacjentów z sitosterolemią homozygotyczną. Przydzielono ich losowo do grup przyjmujących ezetymib w dawce 10 mg (n=30) lub placebo (n=7). Niektórzy pacjenci przyjmowali także inne leki (np. statyny, żywice). Ezetymib istotnie zmniejszał stężenia dwóch najważniejszych steroli roślinnych, sitosterolu i kampesterolu, odpowiednio o 21% i o 24% od wartości wyjściowych. Nie jest znany wpływ zmniejszenia stężenia sitosterolu na zachorowalność i śmiertelność w tej populacji.
Stenoza aortalna
Badanie dotyczące stosowania symwastatyny i ezetymibu w leczeniu stenozy aortalnej (ang. SEAS, Simvastatin and Ezetimibe for the Treatment of Aortic Stenosis) było to wieloośrodkowe badanie z podwójnie ślepą próbą i grupą kontrolną placebo (mediana czasu trwania 4,4 lata) prowadzone z udziałem 1873 pacjentów z bezobjawową stenozą aortalną (ang. AS, aortic stenosis), udokumentowaną na podstawie mierzonej metodą Dopplera wartości szczytowej prędkości przepływu przez zastawkę aortalną mieszczącej się w zakresie od 2,5 do 4,0 m/s. Do badania włączono jedynie pacjentów, w przypadku których stwierdzono brak konieczności stosowania statyn w celu zmniejszenia ryzyka rozwoju miażdżycy układu sercowo-naczyniowego. Pacjentów randomizowano w stosunku liczbowym 1 : 1 do grupy przyjmującej placebo lub do grupy leczonej ezetymibem w dawce 10 mg w skojarzeniu z symwastatyną w dawce 40 mg na dobę.
Pierwszorzędowym punktem końcowym badania był punkt złożony w postaci poważnych incydentów sercowo-naczyniowych (ang. MCE, major cardiovascular events), czyli zgonu z przyczyn sercowo- naczyniowych, operacji wymiany zastawki aortalnej (ang. AVR, aortic valve replacement), zastoinowej niewydolności serca (ang. CHF, congestive heart failure) w następstwie progresji stenozy aortalnej, zawału mięśnia sercowego bez skutku śmiertelnego, operacji wszczepienia pomostów aortalno-wieńcowych (ang. CABG, coronary artery bypass grafting), przezskórnej interwencji wieńcowej (ang. PCI, percutaneous coronary intervention), hospitalizacji z powodu niestabilnej dławicy piersiowej oraz niekrwotocznego udaru mózgu. Najważniejsze drugoplanowe punkty końcowe stanowiły zestawienia podzbiorów określonych kategorii zdarzeń z pierwszorzędowego punktu końcowego.
W porównaniu z placebo leczenie skojarzone ezetymibem z symwastatyną w dawce 10/40 mg nie wiązało się z istotnym zmniejszeniem ryzyka wystąpienia poważnych incydentów sercowo- naczyniowych.
Pierwszorzędowy punkt końcowy stwierdzono u 333 pacjentów (35,3%) z grupy leczonej ezetymibem w skojarzeniu z symwastatyną oraz u 355 pacjentów (38,2%) z grupy placebo (współczynnik ryzyka - HR w grupie leczonej ezetymibem w skojarzeniu z symwastatyną wynosił 0,96; 95% przedział ufności, 0,83 do 1,12; p=0,59). Operację wymiany zastawki aortalnej przeprowadzono u 267 pacjentów (28,3%) z grupy leczonej ezetymibem w skojarzeniu z symwastatyną i u 278 pacjentów (29,9%) z grupy placebo (HR, 1,00; 95% przedział ufności, 0,84 do 1,18; p=0,97). Wystąpienie niedokrwiennych incydentów sercowo-naczyniowych odnotowano u mniejszej liczby pacjentów z grupy leczonej ezetymibem w skojarzeniu z symwastatyną (n=148) niż z grupy placebo (n=187) (HR, 0,78; 95% przedział ufności, 0,63 do 0,97; p=0,02), głównie ze względu na mniejszą liczbę osób poddanych operacji wszczepienia pomostów aortalno-wieńcowych.
Nowotwory stwierdzono częściej w grupie leczonej ezetymibem z symwastatyną (105 w porównaniu z 70, p=0,01). Kliniczne znaczenie tej obserwacji jest niepewne, ponieważ w większym badaniu SHARP całkowita liczba pacjentów, u których wystąpiły nowotwory (438 w grupie leczonej ezetymibem w skojarzeniu z symwastatyną w porównaniu z 439 w grupie otrzymującej placebo) nie różniła się. Ponadto w badaniu IMPROVE-IT całkowita liczba pacjentów z nowo zdiagnozowanym nowotworem złośliwym (853 w grupie ezetymib/symwastatyna w stosunku do 863 w grupie otrzymującej tylko symwastatynę) nie różniła się znacząco, a zatem wyniki uzyskane w badaniu SEAS nie zostały potwierdzone przez badanie SHARP lub IMPROVE-IT.
Wchłanianie
Po przyjęciu doustnym ezetymib jest szybko wchłaniany i w znacznym stopniu sprzęgany do postaci czynnego farmakologicznie glukuronianu fenolowego (glukuronian ezetymibu). Średnie maksymalne
stężenia leku (Cmax) występują w ciągu 1 - 2 godzin w przypadku glukuronianu ezetymibu i w ciągu 4 do 12 godzin w przypadku ezetymibu. Nie można określić bezwzględnej biodostępności ezetymibu, ponieważ substancja ta jest prawie całkowicie nierozpuszczalna w wodnych roztworach, które mogą być stosowane do wstrzykiwań.
Jednoczesne przyjmowanie pokarmów (z dużą lub małą zawartością tłuszczu) nie ma wpływu na biodostępność ezetymibu podczas jego stosowania w postaci tabletek 10 mg. Ezetymib można przyjmować z jedzeniem lub bez.
Dystrybucja
Ezetymib i glukuronian ezetymibu wiążą się z białkami ludzkiego osocza odpowiednio w 99,7% i 88% do 92%.
Metabolizm
Ezetymib jest metabolizowany głównie w jelicie cienkim i w wątrobie poprzez sprzęganie z kwasem glukuronowym (reakcja II fazy), a następnie wydalany z żółcią. U wszystkich badanych gatunków zwierząt obserwowano również minimalny metabolizm oksydacyjny (reakcja I fazy). Ezetymib i glukuronian ezetymibu są dwiema głównymi pochodnymi leku wykrywanymi w osoczu krwi.
Stanowią one odpowiednio 10% do 20% oraz 80% do 90% całkowitego stężenia leku w osoczu krwi. Zarówno ezetymib, jak i glukuronian ezetymibu są powoli usuwane z osocza. Stwierdzono znaczne krążenie jelitowo-wątrobowe tych substancji. Okres półtrwania ezetymibu i glukuronianu ezetymibu wynosi około 22 godzin.
Eliminacja
Po podaniu doustnym ezetymibu znakowanego C14 w dawce 20 mg ludziom, całkowity ezetymib w osoczu krwi stanowił około 93% całkowitej aktywności promieniotwórczej. W stolcu i w moczu odzyskano odpowiednio około 78% i 11% całkowitej dawki izotopu promieniotwórczego w okresie 10-dniowej zbiórki. Po 48 godzinach od podania nie stwierdzono wykrywalnego poziomu aktywności promieniotwórczej w osoczu krwi.
Szczególne grupy pacjentów
Dzieci i młodzież
Parametry farmakokinetyczne ezetymibu są podobne u dzieci w wieku powyżej 6 lat oraz u dorosłych. Brak danych o właściwościach farmakokinetycznych w populacji dzieci w wieku poniżej 6 lat.
Doświadczenie kliniczne u dzieci i młodzieży obejmuje pacjentów z homozygotyczną hipercholesterolemią rodzinną, heterozygotyczną hipercholesterolemią rodzinną lub sitosterolemią.
Osoby w podeszłym wieku
Stężenie ezetymibu całkowitego w osoczu krwi u osób w wieku podeszłym (65 lat lub starszych) jest około 2 razy większe niż u osób młodszych (18 – 45 lat). Zmniejszenie stężenia cholesterolu LDL oraz profil działań niepożądanych są porównywalne przy stosowaniu ezetymibu u osób w wieku podeszłym i u osób młodszych. Dlatego nie ma konieczności dostosowywania dawkowania ezetymibu u osób starszych.
Zaburzenia czynności wątroby
Po podaniu ezetymibu w pojedynczej dawce 10 mg średnie AUC stężenia całkowitego ezetymibu było zwiększone około 1,7-krotnie u pacjentów z łagodnymi zaburzeniami czynności wątroby (5-6 punktów wg skali Child-Pugh) w porównaniu z osobami zdrowymi. W 14 dniowym badaniu, w którym podawano dawki wielokrotne leku (10 mg raz na dobę) pacjentom z umiarkowanymi zaburzeniami czynności wątroby (7-9 punktów wg skali Child-Pugh), stwierdzono około 4-krotne zwiększenie średniego AUC całkowitego ezetymibu pomiędzy dobą pierwszą i czternastą w porównaniu z osobami zdrowymi. Nie jest konieczne dostosowanie dawki produktu leczniczego u pacjentów z łagodnymi zaburzeniami czynności wątroby. Ze względu na to, że nie jest znany wpływ wzrastającej ekspozycji na ezetymib u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności wątroby (> 9 punktów wg skali Child-Pugh) nie zaleca się stosowania ezetymibu w tej grupie pacjentów (patrz punkt 4.4).
Zaburzenia czynności nerek
Po podaniu ezetymibu w pojedynczej dawce 10 mg pacjentom z ciężką chorobą nerek (n=8, średni klirens kreatyniny ≤ 30 ml/min/1,73 m2), średnie AUC całkowitego ezetymibu zwiększyło się około 1,5-krotnie w porównaniu z osobami zdrowymi (n=9). Wynik ten nie jest uważany za klinicznie istotny. Nie jest konieczne dostosowanie dawki produktu leczniczego u pacjentów z zaburzeniami czynności nerek.
U dodatkowego pacjenta uczestniczącego w powyższym badaniu (stan po przeszczepieniu nerki, otrzymującego wiele leków, w tym cyklosporynę) stężenie ezetymibu całkowitego wzrosło 12-krotnie.
Płeć
U kobiet stwierdzono nieco większe (około 20%) stężenia całkowitego ezetymibu w osoczu niż u mężczyzn. Nie stwierdzono różnic pod względem zmniejszenia stężenia cholesterolu LDL i profilu bezpieczeństwa u mężczyzn i kobiet leczonych ezetymibem, dlatego nie jest wymagane dostosowanie dawki w zależności od płci pacjenta.
Badania na zwierzętach dotyczące przewlekłego działania toksycznego nie wykazały istnienia narządów szczególnie zagrożonych takim działaniem. U psów, którym podawano ezetymib przez okres czterech tygodni (≥ 0,03 mg/kg mc. na dobę) stwierdzono zwiększenie stężenia cholesterolu w żółci znajdującej się w pęcherzyku żółciowym o 2,5 do 3,5 razy. Niemniej jednak w badaniu, w którym psom podawano lek w dawkach do 300 mg/kg mc. na dobę przez okres jednego roku, nie stwierdzono zwiększenia zapadalności na kamicę żółciową, ani innego oddziaływania na wątrobę i drogi żółciowe. Nie wiadomo, czy wyniki tych badań mają jakieś odniesienie do ludzi. Nie można wykluczyć ryzyka powstawania kamieni żółciowych w przypadku stosowania ezetymibu w dawkach terapeutycznych.
W badaniach nad jednoczesnym stosowaniem ezetymibu i statyn stwierdzono, że działania toksyczne były zasadniczo takie, jakie są związane ze stosowaniem statyn. Niektóre z tych działań były bardziej widoczne podczas jednoczesnego stosowania produktów leczniczych niż obserwowane podczas stosowania statyn w monoterapii. Można to przypisać interakcjom farmakokinetycznym i farmakodynamicznym podczas stosowania skojarzonego. W badaniach klinicznych nie obserwowano takich interakcji. Miopatia występowała u szczurów dopiero po dawkach wielokrotnie większych od dawek leczniczych u ludzi (około 20 razy większe AUC w odniesieniu do statyn oraz 500 – 2000 razy większe AUC w odniesieniu do aktywnych metabolitów ezetymibu).
W szeregu testów dotyczących działania ezetymibu przeprowadzonych in vivo i in vitro nie stwierdzono działania genotoksycznego podczas podawania leku osobno lub w skojarzeniu ze statyną. Wyniki długotrwałych badań dotyczących działania rakotwórczego ezetymibu były również ujemne.
Ezetymib nie miał wpływu na płodność samic i samców szczurów. Nie miał działania teratogennego w badaniach na szczurach lub królikach, nie miał także wpływu na rozwój przedurodzeniowy i pourodzeniowy. Ezetymib przenikał barierę łożyskową u ciężarnych samic szczura i królika podczas podawania go w wielokrotnych dawkach po 1000 mg/kg mc. na dobę. W przypadku jednoczesnego podawania ezetymibu i statyn nie stwierdzono działania teratogennego u szczurów. Zaobserwowano niewielką liczbę zaburzeń rozwoju kośćca (połączenia trzonów kręgów piersiowych i ogonowych, zmniejszenie liczby kręgów ogonowych) u ciężarnych samic szczura. W przypadku jednoczesnego stosowania ezetymibu i lowastatyny stwierdzono działanie letalne na zarodki.
Laktoza jednowodna
Celuloza mikrokrystaliczna Kopowidon K28 Krospowidon (typ B)
Sodu laurylosiarczan Magnezu stearynian
Nie dotyczy.
24 miesiące
Nie przechowywać w temperaturze powyżej 25℃. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią.
Blistry z przezroczystej folii typu Triplex (PVC/PE/PVDC)/Aluminium w opakowaniach po 7, 10, 14, 20, 28, 30, 50, 84, 90, 98, 100 lub 300 tabletek.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań.
Synoptis Pharma Sp. z o.o. ul. Krakowiaków 65
02-255 Warszawa
Pozwolenie nr: 25542
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 11.09.2019 r.
18.02.2021











