Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane Dane z badań klinicznych
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
z 1 igłą: opakowania po 1 i 10 sztuk;
z 2 igłami: opakowanie z 1 sztuką;
bez igieł: opakowanie po 1 i 10 sztuk.
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Fluarix Tetra, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw grypie (rozszczepiony wirion, inaktywowana)
Rozszczepiony, inaktywowany wirus grypy pochodzący z następujących szczepów*:
A/Victoria/2570/2019 (H1N1)pdm09 – podobny szczep (A/Victoria/2570/2019, IVR-215)
15 mikrogramów HA**
A/Darwin/9/2021 (H3N2) – podobny szczep (A/Darwin/6/2021, IVR-227)
15 mikrogramów HA**
B/Austria/1359417/2021 – podobny szczep (B/Austria/1359417/2021, BVR-26)
15 mikrogramów HA**
B/Phuket/3073/2013 – podobny szczep (B/Phuket/3073/2013, szczep dziki)
15 mikrogramów HA**
w dawce 0,5 ml
* namnażane w zarodkach kurzych pochodzących ze zdrowych stad
** hemaglutynina
Szczepionka odpowiada zaleceniom Światowej Organizacji Zdrowia (WHO) (dla Półkuli Północnej) i Unii
Europejskiej na sezon 2022/2023.
Szczepionka Fluarix Tetra może zawierać śladowe ilości jaj kurzych (takie jak albumina jaja kurzego, białko kurze), formaldehydu, gentamycyny siarczanu oraz dezoksycholanu sodu, które są używane podczas procesu wytwarzania (patrz punkt 4.3).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Zawiesina do wstrzykiwań w ampułko-strzykawce. Zawiesina jest bezbarwna lub lekko opalizująca.
Fluarix Tetra jest zalecany do czynnego uodparniania osób dorosłych i dzieci od ukończenia 6. miesiąca życia w celu zapobiegania zachorowaniu na grypę wywołaną przez dwa podtypy wirusa grypy A oraz dwie linie wirusa grypy B, które zawarte są w szczepionce (patrz punkt 5.1).
Stosowanie szczepionki Fluarix Tetra powinno być zgodne z oficjalnymi zaleceniami.
Coroczne szczepienie aktualną szczepionką jest rekomendowane ze względu na spadek odporności powstałej po podaniu szczepionki w poprzednim sezonie oraz ze względu na to, że krążące szczepy grypy mogą się zmieniać z roku na rok.
Dawkowanie
Dorośli: 0,5 ml
Dzieci i młodzież
Dzieci od ukończenia 6. miesiąca życia: 0,5 ml
Dzieciom w wieku poniżej 9 lat, które nie były uprzednio szczepione przeciw grypie, należy podać drugą dawkę po upływie co najmniej 4 tygodni od podania pierwszej dawki.
Dzieci w wieku poniżej 6 miesięcy: bezpieczeństwo i skuteczność szczepionki Fluarix Tetra u dzieci w wieku poniżej 6 miesięcy nie zostały ustalone. Brak dostępnych danych.
Sposób podawania
Szczepionkę podaje się domięśniowo.
Środki ostrożności, które należy podjąć przed użyciem lub podaniem produktu leczniczego
Instrukcja dotycząca przygotowania produktu leczniczego przed podaniem, patrz punkt 6.6.
Nadwrażliwość na substancje czynne lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1 lub na którykolwiek składnik, który może być obecny w śladowych ilościach, taki jak: pozostałości jaja (albumina jaja kurzego, białko kurze), formaldehyd, gentamycyny siarczan, dezoksycholan sodu.
Szczepienie powinno być odroczone u pacjentów z chorobą przebiegającą z gorączką lub infekcją o ostrym
przebiegu.
Identyfikowalność
W celu poprawienia identyfikowalności biologicznych produktów leczniczych należy czytelnie zapisać nazwę
i numer serii podawanego produktu.
Do elementów dobrej praktyki lekarskiej należy przegląd historii medycznej pacjenta przed szczepieniem
(szczególnie pod względem szczepień przyjętych w przeszłości oraz możliwego wystąpienia działań niepożądanych) oraz wykonanie badania lekarskiego.
Tak jak w przypadku wszystkich szczepionek podawanych we wstrzyknięciach, konieczne jest zapewnienie pacjentom możliwości odpowiedniego natychmiastowego leczenia i nadzoru medycznego na wypadek wystąpienia reakcji anafilaktycznej po szczepieniu.
U pacjentów poddawanych leczeniu immunosupresyjnemu lub u osób z wrodzonymi zaburzeniami
odporności odpowiedź immunologiczna na szczepienie może być niewystarczająca.
Fluarix Tetra nie jest skuteczny w uodpornianiu przeciw wszystkim szczepom wirusa grypy. Fluarix Tetra ma zapewnić ochronę przeciw tym szczepom wirusa na bazie których został przygotowany (oraz przeciw szczepom pokrewnym).
Tak jak inne szczepionki, Fluarix Tetra może nie wywołać odpowiedzi immunologicznej u wszystkich
zaszczepionych osób.
Szczepionki Fluarix Tetra w żadnym przypadku nie wolno podawać donaczyniowo.
Tak jak w przypadku innych szczepionek podawanych domięśniowo, Fluarix Tetra powinien być podawany ostrożnie osobom z trombocytopenią lub zaburzeniami krzepnięcia, ponieważ może u nich wystąpić krwawienie po podaniu domięśniowym.
Utrata przytomności (omdlenie) może wystąpić po podaniu lub nawet przed podaniem każdej szczepionki, szczególnie u nastolatków, jako reakcja psychogenna na ukłucie igłą. Mogą temu towarzyszyć objawy neurologiczne, takie jak przemijające zaburzenia widzenia, parestezje oraz toniczno-kloniczne ruchy kończyn podczas odzyskiwania przytomności. Ważne jest zachowanie odpowiednich procedur, aby uniknąć urazów podczas omdleń.
Wpływ na wynik testów serologicznych
Patrz punkt 4.5.
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na dawkę, więc może być uznany za wolny od
sodu.
Ten produkt leczniczy zawiera mniej niż 1 mmol potasu (39 mg) na dawkę, więc może być uznany za wolny
od potasu.
Fluarix Tetra może być podawany jednocześnie ze szczepionką zawierającą polisacharyd pneumokokowy pacjentom w wieku 50 lat i starszym (patrz punkt 5.1).
Fluarix Tetra może być podawany jednocześnie ze szczepionką przeciw półpaścowi z adiuwantem (Shingrix) (patrz punkt 5.1).
Jeśli Fluarix Tetra jest podawany jednocześnie z innymi szczepionkami, szczepienie powinno być wykonane w różne miejsca ciała.
Częstość występowania bólu w miejscu podania szczepionki zgłaszana u osób szczepionych jednocześnie szczepionką czterowalentną przeciw grypie (Fluarix Tetra) oraz 23-walentną szczepionką zawierającą polisacharydy pneumokokowe (PPV23) jest zbliżona do częstości raportowanej w przypadku szczepienia jedynie szczepionką PPV23, a wyższa w porównaniu do częstości raportowanej przy szczepieniu jedynie szczepionką Fluarix Tetra.
Częstość występowania zmęczenia, bólu głowy, bólu mięśni, dreszczy u osób zaszczepionych jednocześnie szczepionkami Fluarix Tetra i Shingrix, jest zbliżona do częstości raportowanej w przypadku szczepienia jedynie szczepionką Shingrix, a wyższa w porównaniu do częstości raportowanej przy szczepieniu jedynie szczepionką Fluarix Tetra.
Po szczepieniu przeciwko grypie zaobserwowano występowanie fałszywie dodatnich wyników testów serologicznych wykonywanych przy użyciu metody ELISA, przeprowadzanych w celu wykrycia przeciwciał przeciwko HIV1, wirusowemu zapaleniu wątroby typu C, a szczególnie HTLV1. Badanie techniką Western Blot eliminuje fałszywie dodatnie wyniki uzyskane w badaniu metodą ELISA. Przejściowe fałszywie dodatnie wyniki mogą być wywołane obecnością przeciwciał klasy IgM, które powstały w odpowiedzi na szczepionkę.
Ciąża
Inaktywowane szczepionki przeciw grypie mogą być stosowane na wszystkich etapach ciąży. W porównaniu do pierwszego trymestru ciąży, więcej danych dotyczących bezpieczeństwa jest dostępnych dla drugiego i trzeciego trymestru. Jednakże dane uzyskane podczas stosowania inaktywowanych szczepionek przeciw grypie na całym świecie nie wskazują na jakikolwiek niepożądany wpływ na płód i matkę związany z zastosowaniem szczepionki.
Karmienie piersią
Fluarix Tetra może być stosowany podczas karmienia piersią. Płodność
Brak danych dotyczących płodności.
Szczepionka Fluarix Tetra nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów
i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Najczęściej zgłaszanym miejscowym działaniem niepożądanym we wszystkich grupach wiekowych występującym po szczepieniu był ból w miejscu podania (15,6% do 40,9%).
U dorosłych w wieku 18 lat i starszych, najczęściej zgłaszanymi ogólnymi działaniami niepożądanymi występującymi po szczepieniu były: zmęczenie (11,1%), ból głowy (9,2%) oraz ból mięśni (11,8%).
U pacjentów w wieku od 6 do 17 lat, najczęściej zgłaszanymi ogólnymi działaniami niepożądanymi występującymi po szczepieniu były: zmęczenie (12,6%), ból mięśni (10,9%) oraz ból głowy (8,0%).
U pacjentów w wieku od 3 do 5 lat, najczęściej zgłaszanymi ogólnymi działaniami niepożądanymi występującymi po szczepieniu były: senność (9,8%) oraz drażliwość (11,3%).
U pacjentów w wieku od 6 miesięcy do 3 lat, najczęściej zgłaszanymi ogólnymi działaniami niepożądanymi występującymi po szczepieniu były drażliwość/marudność (14,9%) oraz utrata apetytu (12,9%).
Tabelaryczne zestawienie działań niepożądanych
Działania niepożądane zgłaszane dla szczepionki Fluarix Tetra we wszystkich grupach wiekowych są przedstawione z uwzględnieniem liczby podanych dawek szczepionki i zgodnie z poniższymi kategoriami częstości:
Bardzo często (≥ 1/10) Często (≥ 1/100 do < 1/10)
Niezbyt często (≥ 1/1000 do < 1/100) Rzadko (≥ 1/10 000 do < 1/1000) Bardzo rzadko (< 1/10 000)
Dorośli
Badanie kliniczne dotyczące stosowania szczepionki Fluarix Tetra u osób dorosłych oceniło częstość występowania działań niepożądanych u pacjentów w wieku 18 lat i starszych, którzy otrzymali jedną dawkę szczepionki Fluarix Tetra (N=3 036) lub szczepionki Fluarix (trzywalentnej szczepionki przeciw grypie) (N=1 010).
Zgłaszano następujące działania niepożądane po podaniu jednej dawki:
Klasyfikacja układów i narządów | Częstość | Działania niepożądane |
Zaburzenia układu nerwowego | Często | Ból głowy |
Niezbyt często | Zawroty głowy1 | |
Zaburzenia metabolizmu i odżywiania | Często | Objawy ze strony żołądka i jelit (w tym nudności, wymioty, biegunka i/lub ból brzucha) |
Zaburzenia skóry i tkanki podskórnej | Często | Potliwość2 |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Bardzo często | Ból mięśni |
Często | Ból stawów | |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | Ból w miejscu podania, zmęczenie |
Często | Zaczerwienienie w miejscu podania, obrzęk w miejscu podania, dreszcze, gorączka, stwardnienie w miejscu podania2 | |
Niezbyt często | Krwiak w miejscu podania1, świąd w miejscu podania1 |
1 Zgłoszone jako niespodziewane działanie niepożądane
2 Zgłaszane we wcześniejszych badaniach prowadzonych dla szczepionki Fluarix
Dzieci w wieku od 6 miesięcy do < 18 lat
Dwa badania kliniczne dotyczące stosowania szczepionki Fluarix Tetra u dzieci oszacowały reaktogenność oraz bezpieczeństwo szczepionki Fluarix Tetra po podaniu jednej dawki Fluarixu Tetra lub szczepionki kontrolnej.
W pierwszym badaniu brały udział dzieci w wieku od 3 lat do < 18 lat, którym podano odpowiednio Fluarix Tetra (N=915) lub Fluarix (N=912). W drugim badaniu brały udział dzieci w wieku 6 miesięcy do < 36 miesięcy, którym podawano odpowiednio Fluarix Tetra (N=6 006) lub szczepionkę kontrolną niebędącą szczepionką przeciw grypie (N=6 012) (patrz punkt 5.1).
Zgłaszano następujące działania niepożądane po podaniu jednej dawki:
Częstość |
Klasyfikacja układów i narządów | Działania niepożądane | 6 do < 36 (miesięcy) | 3 do < 6 (lat) | 6 do < 18 (lat) |
Zaburzenia metabolizmu i odżywiania | Utrata apetytu | Bardzo często | Często | N/A |
Zaburzenia psychiczne | Drażliwość/marudność | Bardzo często | Bardzo często | N/A |
Zaburzenia układu nerwowego | Senność | Bardzo często | Często | N/A |
Ból głowy | N/A | N/A | Często | |
Zaburzenia żołądka i jelit | Objawy ze strony żołądka i jelit (w tym nudności, biegunka, wymioty i/lub ból brzucha) | N/A | N/A | Często |
Zaburzenia skóry i tkanki podskórnej | Wysypka1 | N/Z | Niezbyt często | Niezbyt często |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Ból mięśni | N/A | N/A | Bardzo często |
Ból stawów | N/A | N/A | Często | |
Zaburzenia ogólne i stany w miejscu podania | Gorączka (≥ 38oC) | Często | Często | Często |
Zmęczenie | N/A | N/A | Bardzo często | |
Ból w miejscu podania | Bardzo często | Bardzo często | Bardzo często | |
Zaczerwienienie w miejscu podania | Bardzo często | Bardzo często | Bardzo często | |
Obrzęk w miejscu podania | Często | Bardzo często | Bardzo często | |
Dreszcze | N/A | N/A | Często | |
Świąd w miejscu podania1 | N/Z | Niezbyt często | Niezbyt często | |
Stwardnienie w miejscu podania2 | N/A | Często | Często |
N/A – niespodziewane w tej grupie wiekowej N/Z – nie zgłaszane
1 Zgłoszone jako niespodziewane działanie niepożądane
2 Zgłaszane we wcześniejszych badaniach prowadzonych dla szczepionki Fluarix
Dane uzyskane po wprowadzeniu do obrotu
Po wprowadzeniu do obrotu szczepionek Fluarix i/lub Fluarix Tetra odnotowano następujące zgłoszenia działań niepożądanych1:
Klasyfikacja układów i narządów | Częstość | Działania niepożądane |
Zaburzenia krwi i układu chłonnego | Rzadko | Przejściowa limfadenopatia |
Zaburzenia układu immunologicznego | Rzadko | Reakcje alergiczne (w tym reakcje anafilaktyczne) |
Zaburzenia układu nerwowego | Rzadko | Zapalenie nerwu, ostre rozsiane zapalenie mózgu i rdzenia kręgowego, zespół Guillain- Barré2 |
Zaburzenia skóry i tkanki podskórnej | Rzadko | Pokrzywka, świąd, rumień, obrzęk naczynioruchowy |
Zaburzenia ogólne i stany w miejscu podania | Rzadko | Choroba grypopodobna, złe samopoczucie |
1 Trzy ze szczepów zawartych w szczepionce Fluarix są również obecne w szczepionce Fluarix Tetra.
2 Po szczepieniach wykonywanych szczepionkami Fluarix i Fluarix Tetra zanotowano spontaniczne zgłoszenia dotyczące wystąpienia zespołu Guillain-Barré, jednakże nie określono związku przyczynowo-skutkowego pomiędzy szczepieniem a wystąpieniem tego zespołu.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309,
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie przypuszcza się, aby przedawkowanie spowodowało jakiekolwiek niekorzystne działania.
Grupa farmakoterapeutyczna: szczepionka przeciwko grypie, kod ATC: J07 BB 02.
Mechanizm działania
Fluarix Tetra zapewnia czynne uodpornienie przeciw czterem szczepom wirusa grypy (dwóm podtypom wirusa A i dwóm liniom wirusa B), wchodzącym w skład tej szczepionki.
Szczepionka Fluarix Tetra powoduje wytworzenie przeciwciał przeciwko hemaglutyninom. Przeciwciała te neutralizują wirusy grypy.
Swoiste poziomy mian przeciwciał przeciw hemaglutyninie stwierdzone w teście hamowania hemaglutynacji (ang. hemagglutination-inhibition, HI) po podaniu inaktywowanych szczepionek przeciw grypie nie korelują z poziomem ochrony przed zachorowaniem na grypę, ale miana przeciwciał anty-HA są wykorzystywane jako wskaźnik aktywności szczepionki. W niektórych badaniach prowokacyjnych z udziałem ludzi (challenge study), poziomy mian przeciwciał anty-HA ≥1:40 były związane z występowaniem ochrony przed grypą nawet u 50% osób badanych.
Działanie farmakodynamiczne
Skuteczność u dzieci w wieku 6-35 miesięcy życia:
Skuteczność szczepionki Fluarix Tetra była oceniana w randomizowanym, zaślepionym dla obserwatora badaniu klinicznym D-QIV-004 z wykorzystaniem szczepionki kontrolnej nie będącej szczepionką przeciw wirusowi grypy, które było przeprowadzane w trakcie sezonów zwiększonej zachorowalności na grypę w latach 2011-2014. Zdrowi uczestnicy badania w wieku od 6 do 35 miesięcy, zostali podzieleni na dwie grupy (1:1), z których jedna otrzymała szczepionkę Fluarix Tetra (N=6 006) a druga szczepionkę kontrolną nie będącą szczepionką przeciw wirusowi grypy (N=6 012). Uczestnikom podano jedną dawkę (w przypadku wcześniejszego szczepienia przeciw grypie w wywiadzie) lub dwie dawki szczepionki (z odstępem ok. 28 dni między dawkami).
Oceniono skuteczność szczepionki Fluarix Tetra w profilaktyce grypy typu A i/lub B o nasileniu umiarkowanym do poważnego lub o dowolnym nasileniu, wywoływanej przez dowolny szczep sezonowego wirusa grypy potwierdzonej metodą reakcji łańcuchowej polimerazy z odwrotną transkryptazą (RT-PCR).
Począwszy od 2 tygodni po szczepieniu, aż do zakończenia okresu zwiększonej zachorowalności na grypę (czyli do około 6 miesięcy później), od osób, u których wystąpiły objawy grypopodobne pobierano wymaz z nosa, a pobrany materiał badano na obecność wirusa grypy A i/lub B metodą RT-PCR. Wyniki pozytywne uzyskane w teście RT-PCR potwierdzano dalej badaniem w hodowli komórkowej w celu określenia, czy szczep wirusa w pobranej próbce był zgodny ze szczepem zawartym w szczepionce.
Szczepionka Fluarix Tetra osiągnęła wcześniej zdefiniowane kryteria dla pierwszorzędowych i drugorzędowych celów stosowanych do oceny skuteczności, przedstawionych w Tabeli 1.
Tabela 1: Fluarix Tetra: Współczynnik zapadalności oraz skuteczność szczepionki u dzieci w wieku 6- 35 miesięcy (ATP (z ang. according to protocol – zgodna z protokołem kohorta do oceny skuteczności – czas do wystąpienia zdarzenia))
Fluarix Tetra | Szczepionka kontrolna1 | Skuteczność szczepionki | ||||||
N2 | n3 | Współczynnik zapadalności (n/N) (%) | N2 | n3 | Współczynnik zapadalności (n/N) (%) | % | CI | |
Grypa o dowolnym nasileniu6 | ||||||||
Potwierdzona testem RT- PCR | 5707 | 344 | 6,03 | 5697 | 662 | 11,62 | 49,8 | 41,8; 56,84 |
Potwierdzona w hodowli komórkowej | 5707 | 303 | 5,31 | 5697 | 602 | 10,57 | 51,2 | 44,1; 57,65 |
Potwierdzone w hodowli komórkowej szczepy zgodne z użytymi w szczepionce | 5707 | 88 | 1,54 | 5697 | 216 | 3,79 | 60,1 | 49,1; 69,05 |
Grypa o nasileniu umiarkowanym do ciężkiego7 | ||||||||
Potwierdzona testem RT- PCR | 5707 | 90 | 1,58 | 5697 | 242 | 4,25 | 63,2 | 51,8; 72,34 |
Potwierdzona w hodowli komórkowej | 5707 | 79 | 1,38 | 5697 | 216 | 3,79 | 63,8 | 53,4; 72,25 |
Potwierdzone w hodowli komórkowej szczepy zgodne z użytymi w szczepionce | 5707 | 20 | 0,35 | 5697 | 88 | 1,54 | 77,6 | 64,3; 86,65 |
Choroba dolnych dróg oddechowych potwierdzona testem RT- PCR | 5707 | 28 | 0,49 | 5697 | 61 | 1,07 | 54,0 | 28,9; 71,05 |
Ostre zapalenie ucha środkowego potwierdzone testem RT- PCR | 5707 | 12 | 0,21 | 5697 | 28 | 0,49 | 56,6 | 16,7; 78,85 |
CI: przedział ufności
1 Dzieci otrzymywały odpowiednią do wieku szczepionkę kontrolną nie będącą szczepionką przeciw grypie
2 Liczba badanych włączonych w kohortę ATP dla potrzeb oznaczenia skuteczności – czas do wydarzenia. Ta kohorta zawierała badanych którzy spełnili kryteria doboru, byli monitorowani pod względem skuteczności i spełniali wymogi protokołu do momentu wystąpienia zachorowania
3 Liczba badanych dla których zgłoszono przynajmniej jeden przypadek zachorowania w okresie objętym badaniem
4 Dwustronny 97,5% przedział ufności
5 Dwustronny 95% przedział ufności
6 Grypa o dowolnym nasileniu była zdefiniowana jako epizod choroby grypopodobnej (infekcja grypopodobna np. gorączka ≥ 38oC z którymkolwiek objawem towarzyszącym: kaszel, katar, wyciek z nosa lub problemy z oddychaniem) lub następstwo infekcji wirusem grypy (ostre zapalenie ucha środkowego, choroba dolnych dróg oddechowych)
7 Grypa o nasileniu umiarkowanym do poważnego rozumiana była jako wystąpienie jakiegokolwiek rodzaju grypy z towarzyszącymi: gorączką > 39oC, zdiagnozowanym przez lekarza ostrym zapaleniem ucha środkowego, zdiagnozowaną przez lekarza infekcją dolnych dróg oddechowych, zdiagnozowanymi przez lekarza pozapłucnymi komplikacjami, hospitalizacją na oddziale intensywnej terapii lub wystąpieniem potrzeby suplementacji tlenem przez czas dłuższy niż 8 godzin.
Przeprowadzono analizę dotyczącą całej zaszczepionej kohorty, w skład której wchodziło 12018 osób (N=6006 dla szczepionki Fluarix Tetra, N=6012 dla szczepionki kontrolnej). Fluarix Tetra wykazał skuteczność w zapobieganiu umiarkowanej do poważnej postaci grypy wywoływanej przez każdy z 4 szczepów (Tabela 2.), nawet wtedy, gdy miała miejsce znacząca niezgodność antygenowa 2 szczepów zawartych w szczepionce (A/H3N2 oraz B/Victoria).
Tabela 2: Fluarix Tetra: Współczynnik zapadalności oraz skuteczność szczepionki w zapobieganiu grypie o nasileniu umiarkowanym do poważnego u dzieci w wieku od 6-35 miesięcy, wywołanej przez wirusy podtypu A i linii B, potwierdzonej metodą RT-PCR (cała zaszczepiona kohorta)
Fluarix Tetra | Szczepionka kontrolna1 | Skuteczność szczepionki | ||||||
Szczep | N2 | n3 | Współczynnik zapadalności (n/N) (%) | N2 | n3 | Współczynnik zapadalności (n/N) (%) | % | 95% CI |
A | ||||||||
H1N14 | 6 006 | 13 | 0,22 | 6 012 | 46 | 0,77 | 72,1 | 49,9; 85,5 |
H3N25 | 6 006 | 53 | 0,88 | 6 012 | 112 | 1,86 | 52,7 | 34,8; 66,1 |
B | ||||||||
Victoria6 | 6 006 | 3 | 0,05 | 6 012 | 15 | 0,25 | 80,1 | 39,7; 95,4 |
Yamagata7 | 6 006 | 22 | 0,37 | 6 012 | 73 | 1,21 | 70,1 | 52,7; 81,9 |
1 Dzieci otrzymywały odpowiednią dla wieku szczepionkę kontrolną nie będącą szczepionką przeciw grypie
2 Liczba badanych włączonych do całej zaszczepionej kohorty (TVC-Total Vaccinated Cohort)
3 Liczba badanych, dla których zgłoszono przynajmniej jeden przypadek zachorowania w okresie objętym badaniem
4 do 7 Wskaźnik zgodności antygenowej szczepów wynosił 84,8%, 2,6%, 14,3% oraz 66,6% odpowiednio dla A/H1N1,
A/H1N2, B/Victoria oraz B/Yamagata.
Dodatkowo, dla przypadków zachorowań o dowolnym nasileniu potwierdzonych testem RT-PCR, Fluarix Tetra zmniejszał ryzyko wizyty u lekarza rodzinnego o 47% (relatywne ryzyko (RR): 0,53 [95% CI:0,46; 0,61], tzn. 310 w porównaniu do 583 wizyt) oraz ryzyko wizyty na ostrym dyżurze o 79% (RR: 0,21 [95% CI:0,09;0,47], tzn. 7 w stosunku do 33 wizyt). Użycie antybiotyków zostało zredukowane o 50% (RR:0,50 [95% CI: 0,42; 0,60], tzn. 172 w porównaniu do 341 osób badanych].
Skuteczność u dorosłych w wieku 18-64 lata
W badaniu klinicznym przeprowadzonym z udziałem ponad 7600 osób w Czechach oraz Finlandii oceniano skuteczność szczepionki Fluarix w zapobieganiu zachorowaniom na grypę typu A i/lub B, potwierdzoną badaniem w hodowli komórkowej i wywoływaną przez szczepy antygenowo zgodne ze szczepami szczepionkowymi.
Badani byli monitorowani pod kątem wystąpienia choroby grypopodobnej, którą potwierdzano badaniem w hodowli komórkowej (wyniki – patrz Tabela 3). Choroba grypopodobna była definiowana jako wystąpienie przynajmniej jednego ogólnego objawu (gorączka ≥ 37,8oC i/lub ból mięśni) oraz jednego objawu dotyczącego układu oddechowego (kaszel i/lub ból gardła).
Tabela 3: Współczynnik zapadalności oraz skuteczność szczepionki w profilaktyce chorób związanych z udokumentowaną infekcją wirusem grypy A lub B u osób dorosłych w wieku 18-64 lat (cała zaszczepiona kohorta).
Współczynnik zapadalności (n/N)1 | Skuteczność szczepionki (95% CI2) | ||||||
N | n | % | % | LL3 | UL | ||
Grypa wywołana przez szczepy wirusa antygenowo zgodne ze szczepionkowymi i potwierdzone badaniem w hodowli komórkowej4 | |||||||
Fluarix | 5103 | 49 | 1,0 | 66,9 | 51,9 | 77,4 | |
Placebo | 2549 | 74 | 2,9 | - | - | - | |
Wszystkie przypadki grypy potwierdzone badaniem w hodowli komórkowej (antygenowo zgodne, niezgodne i nieokreślone) 5 | |||||||
Fluarix | 5103 | 63 | 1,2 | 61,6 | 46,0 | 72,8 | |
Placebo | 2549 | 82 | 3,2 | - | - | - | |
1 n/N liczba przypadków/całkowita liczba badanych
2 CI: przedział ufności
3 LL: dolna granica przedziału ufności
4 W grupie zaszczepionych szczepionką Fluarix ani w grupie placebo nie było przypadków zachorowań wywołanych wirusem A/New Caledonia/20/1999 czy B/Malaysia/2506/2004, antygenowo zgodnym ze szczepionką i potwierdzonym w badaniu w hodowli komórkowej .
5 Z dodatkowych 22 przypadków, 18 było niezgodnych a 4 nieokreślone; 15 z 22 przypadków zachorowań dotyczyło szczepu A/H3N2 (11 przypadków w grupie zaszczepionej szczepionką Fluarix i 4 w grupie otrzymującej placebo).
W tym badaniu oceniano również immunogenność szczepionki.
Tabela 4: Średnie geometryczne mian przeciwciał (z ang. geometric mean titre – GMT) oraz stopień
serokonwersji po szczepieniu
Osoby dorosłe w wieku 18-64 lat | Fluarix1 N=291 |
GMT (95% CI) | |
A/H1N1 | 541,0 (451,0; 649,0) |
A/H3N2 | 133,2 (114,6; 154,7) |
B (Victoria) | 242,8 (210,7; 279,7) |
Stopień serokonwersji (95% CI) | |
A/H1N1 | 76,3% (71,0; 81,1) |
A/H3N1 | 73,9% (68,4; 78,8) |
B (Victoria) | 85,2% (80,6; 89,1) |
1Zawierający szczepy A/H1N1, A/H3N2 oraz B (linia Victoria)
Poziom seroprotekcji uzyskany po szczepieniu wynosił 97,6% wobec A/H1N1, 86,9% wobec A/H3N2 oraz 96,2% wobec B (Victoria).
Immunogenność u dzieci i osób dorosłych:
Immunogenność szczepionki Fluarix Tetra była oceniana w teście zahamowania hemaglutynacji (z ang. hemagglutination inhibition test – HI), określającym średnią geometryczną mian przeciwciał (GMT) 28 dni po podaniu ostatniej dawki (u dzieci) oraz w dniu 21. (u dorosłych) oraz poziom serokonwersji określanej również za pomocą testu HI (4-krotny wzrost wykrywalnych mian przeciwciał oraz zmiana z niewykrywalnego [<10] na wykrywalny poziom mian przeciwciał ≥ 40).
W badaniu D-QIV-004 (dzieci w wieku od 6-35 miesięcy) ocena ta została przeprowadzona na subkohorcie 1332 badanych (753 w grupie szczepionki Fluarix Tetra oraz 579 w grupie kontrolnej). Wyniki przedstawione zostały w Tabeli 5.
Efekt dwudawkowego szczepienia pierwotnego przeprowadzonego w trakcie badania D-QIV-004 był oceniany w badaniu D-QIV-009 poprzez ocenę odpowiedzi immunologicznej po ponownym podaniu po upływie jednego roku pojedynczej dawki szczepionki Fluarix Tetra. To badanie wykazało, że 7 dni po szczepieniu, pamięć immunologiczna u dzieci w wieku 6-35 miesięcy została aktywowana dla wszystkich 4 szczepów wirusa.
Równoważność (non-inferiority) szczepionki Fluarix Tetra ze szczepionką Fluarix w zakresie immunogenności oceniono u dzieci w badaniu klinicznym QIV-003 (u około 900 dzieci w wieku 3 do <18 lat w każdej z badanych grup, z których każde otrzymało jedną lub dwie dawki jednej ze szczepionek) oraz u dorosłych w badaniu D-QIV-008 (u około 1800 badanych w wieku 18 lat oraz starszych otrzymało jedną dawkę szczepionki Fluarix Tetra, a około 600 badanych otrzymało jedną dawkę szczepionki Fluarix). W obu badaniach, Fluarix Tetra wywołał równoważną odpowiedź immunologiczną przeciwko trzem szczepom wspólnym dla obu szczepionek oraz lepszą odpowiedź immunologiczną w stosunku do dodatkowego szczepu B, wchodzącego w skład szczepionki Fluarix Tetra. Wyniki są przedstawione w Tabeli 5.
Tabela 5: Fluarix Tetra: Średnia geometryczna mian przeciwciał (z ang. geometric mean titre – GMT) oraz stopień serokonwersji (z ang. seroconversion rate – SCR) po szczepieniu u dzieci (w wieku 6-35 miesięcy; w wieku 3 do <18 lat) oraz u dorosłych w wieku 18 lat i starszych (kohorta ATP).
Dzieci w wieku 6 do 35 miesięcy (D-QIV-004) | ||||
Fluarix Tetra | Szczepionka kontrolna1 | |||
N=750-753 | N’ = 742-746 | N=578-579 | N’=566-568 | |
GMT2 (95% CI) | Stopień serokonwersji2 (95% CI) | GMT2 (95% CI) | Stopień serokonwersji2 (95% CI) | |
A/H1N1 | 165,3 (148,6; 183,8) | 80,2% (77,2; 83,0) | 12,6 (11,1; 14,3) | 3,5% (2,2; 5,4) |
A/H3N2 | 132,1 (119,1; 146,5) | 68,8% (65,3; 72,1) | 14,7 (12,9; 16,7) | 4,2% (2,7; 6,2) |
B (Victoria) | 92,6 (82,3; 104,1) | 69,3% (65,8; 72,6) | 9,2 (8,4; 10,1) | 0,9% (0,3; 2,0) |
B (Yamagata) | 121,4 (110,1; 133,8) | 81,2% (78,2; 84,0) | 7,6 (7,0; 8,3) | 2,3% (1,2; 3,9) |
Dzieci w wieku od 3 do <18 lat (D-QIV-003) | ||||
Fluarix Tetra | Fluarix3 | |||
N=791 | N’=790 | N=818 | N’=818 | |
GMT (95% CI) | Stopień serokonwersji (95% CI) | GMT2 (95% CI) | Stopień serokonwersji (95% CI) | |
A/H1N1 | 386,2 (357,3; 417,4) | 91,4% (89,2; 93,3) | 433,2 (401,0; 468,0) | 89,9% (87,6; 91,8) |
A/H3N2 | 228,8 (215,0; 243,4) | 72,3% (69,0; 75,4) | 227,3 (213,3; 242,3) | 70,7% (67,4; 73,8) |
B (Victoria) | 244, (227,5; 262,1)_ | 70,0% (66,7; 73,2) | 245,6 (229,2; 263,2) | 68,5% (65,2; 71,6) |
B (Yamagata) | 569,6 (533,6; 608,1) | 72,5% (69,3; 75,6) | 224,7 (207,9; 242,9) | 37,0% (33,7;40,5) |
Dorośli w wieku 18 lat i starsi (D-QIV-008) | ||||
Fluarix Tetra | Fluarix3 | |||
N=1809 | N’=1801 | N=608 | N’=605 | |
GMT (95% CI) | Stopień serokonwersji (95% CI) | GMT2 (95% CI) | Stopień serokonwersji (95% CI) | |
A/H1N1 | 201,1 (188,1; 215,1) | 77,5% (75,5; 79,4) | 218,4 (194,2; 245,6) | 77,2% (73,6; 80,5) |
A/H3N2 | 314,7 (296,8; 333,6) | 71,5% (69,3; 73,5) | 298,2 (268,4; 331,3) | 65,8% (61,9; 69,6) |
B (Victoria) | 404,6 (386,6; 423,4) | 58,1% (55,8; 60,4) | 393,8 (362,7; 427,6) | 55,4% (51,3; 59,4) |
B (Yamagata) | 601,8 (573,3; 631,6) | 61,7% (59,5; 64,0) | 386,6 (351,5; 425,3) | 45,6% (41,6; 49,7) |
N = Liczba badanych z dostępnymi danymi po szczepieniu (dla GMT)
N’ = Liczba badanych z dostępnymi danymi zarówno przed jak i po szczepieniu (dla serokonwersji)
1 szczepionka kontrolna nie będąca szczepionką przeciw grypie
2 wyniki z badań immunogenności subkohorty
3 Szczep B (Yamagata) nie wchodzi w skład szczepionki Fluarix
Jednoczesne podanie z polisacharydową szczepionką pneumokokową:
W badaniu klinicznym D-QIV-010 z udziałem 356 dorosłych w wieku ≥50 lat z ryzykiem powikłań grypy i chorób pneumokokowych, badani otrzymywali Fluarix Tetra i 23-walentną pneumokokową szczepionkę polisacharydową (PPV23) jednocześnie lub oddzielnie. Dla wszystkich czterech szczepów wirusa grypy zawartych w szczepionce Fluarix Tetra oraz sześciu serotypów pneumokokowych (1, 3, 4, 7F, 14 oraz 19A) zawartych w szczepionce PPV23, ocenianych na podstawie predefiniowanej analizy pierwotnej, odpowiedź immunologiczna była porównywalna (non-inferior) pomiędzy obiema badanymi grupami. Na podstawie analizy opisowej dla sześciu dodatkowych serotypów pneumokoków zawartych w szczepionce PPV23 (5, 6B, 9V, 18C, 19F oraz 23F), odpowiedź immunologiczna w obu grupach była porównywalna, z 91,7% do 100% oraz 90,7% do 100% badanych osiągających poziomy przeciwciał zapewniających seroprotekcję dla wspomnianych serotypów, odpowiednio: w grupie otrzymującej obie szczepionki równocześnie oraz w grupie otrzymującej szczepionki oddzielnie.
Jednoczesne podanie ze szczepionką przeciw półpaścowi z adiuwantem (Shingrix):
W badaniu klinicznym Zoster-004, 828 osób w wieku ≥ 50 lat w sposób zrandomizowany przydzielono do dwóch grup, którym podano dwie dawki szczepionki Shingrix w odstępie 2 miesięcy albo z równoczesnym podaniem szczepionki Fluarix Tetra (N=413) z pierwszą dawką szczepionki Shingrix, albo z nierównoczesnym podaniem tej szczepionki (N=415). Odpowiedź immunologiczna na każdą ze szczepionek była podobna bez względu na to, czy szczepionki podano równocześnie, czy też nie. Ponadto, na podstawie analizy średnich geometrycznych mian przeciwciał (GMT) w teście zahamowania hemaglutynacji (HI), immunologiczna równoważność (non-inferiority) pomiędzy równoczesnym i nierównoczesnym podaniem obu szczepionek, została wykazana dla wszystkich czterech szczepów wirusa grypy, zawartych w szczepionce Fluarix Tetra.
Nie dotyczy.
Dane niekliniczne uzyskane na podstawie konwencjonalnych badań dotyczących ostrej toksyczności, tolerancji miejscowej, toksyczności po podaniu wielokrotnym, toksycznego wpływu na rozrodczość i rozwój nie ujawniają występowania szczególnego zagrożenia dla ludzi.
Sodu chlorek
Disodu fosforan dwunastowodny Potasu diwodorofosforan
Potasu chlorek
Magnezu chlorek sześciowodny
-tokoferylu wodorobursztynian Polisorbat 80
Oktoksynol 10
Woda do wstrzykiwań
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności.
1 rok
Przechowywać w lodówce (2˚C – 8˚C). Nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
0,5 ml zawiesiny w ampułko-strzykawce (ze szkła typu I) z zatyczką tłoka (szara guma butylowa) i nasadką na ampułko-strzykawkę (bromobutyl i guma z syntetycznego poliizoprenu typu I), z dołączonymi igłami albo bez igieł, w następujących opakowaniach:
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Szczepionka przed podaniem powinna osiągnąć temperaturę pokojową.
Należy wstrząsnąć przed użyciem. Przed podaniem szczepionkę należy obejrzeć. Instrukcja podania szczepionki w ampułko-strzykawce
W celu dołączenia igły do strzykawki należy postępować zgodnie z poniższym
rysunkiem.
Osłonka igły

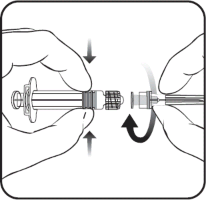
Igła
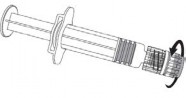
Ampułko-strzykawka
Tłok strzykawki
Korpus strzykawki
Nasadka
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI
OBROTU
GlaxoSmithKline Biologicals S.A. Rue de l’Institut 89
1330 Rixensart Belgia
Pozwolenie: 24888
DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 29/08/2018
PRODUKTU LECZNICZEGO
08/2022
Szczegółowe informacje o tym produkcie są dostępne na stronie internetowej Urzędu Rejestracji Produktów
Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.











